硫酸软骨素AC外切酶的重组大肠杆菌及其构建方法和应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物技术领域,具体涉及一种硫酸软骨素AC外切酶的重组大肠杆菌及其构建方法和应用。
背景技术
硫酸软骨素(CS)作为一种典型的酸性糖胺聚糖,主要以蛋白聚糖的形式存在于动物软骨、韧带、喉骨、气管和血管等组织中,具有多种药理学活性,目前广泛应用在食品、化妆品及保健品等领域。硫酸软骨素降解酶(Chondroitinase,ChSase)作为其制备过程的关键酶,国内外主要通过微生物发酵来提取ChSase并获得高纯度的酶制剂,并且已经从多种微生物中分离得到ChSase。我国对ChSase有很高的市场需求,然而目前我国没有独立的ChSase供应,只能以相当昂贵的价格通过进口来获取。根据其底物作用形式,ChSase可分为四种,其中硫酸软骨素AC降解酶ChSase AC II显示出一种外切作用模式,从多糖链的非还原端剪切二糖单位。日本的Seikagaku公司曾经是ChSase AC II的唯一供应商,但于2011年停止生产,因此对该酶深入研究的相关信息十分有限。
随着基因组学和蛋白组学的发展,重组蛋白技术的应用范围越来越广泛。大肠杆菌(Escherichia coli)具有分子操作简单、培养成本低和发酵周期短等优势,是表达异源蛋白质的最佳宿主之一。目前,已有关于ChSase AC II在大肠杆菌中重组表达的研究报道,但仍存在一定局限性,如表达的外源蛋白往往以不溶性的无功能包涵体形式存在,会导致可溶性表达效果不好、酶活力低等诸多问题的发生。
发明内容
本发明要解决的技术问题是,提供一种硫酸软骨素AC外切酶的重组大肠杆菌及其构建方法和应用。本发明的重组菌解决了硫酸软骨素AC外切酶重组过程中可溶性表达效果不好和酶活力低的技术问题。
本发明采用如下技术方案:
本发明提供一种硫酸软骨素AC外切酶的重组大肠杆菌,所述重组大肠杆菌包含表达硫酸软骨素AC外切酶的重组表达载体、表达分子伴侣GroES-GroEL的载体和大肠杆菌宿主。
进一步,所述硫酸软骨素AC外切酶来源于Arthrobacter sp.CS01,其核苷酸序列如SEQ ID NO.1所示。
其中,SEQ ID NO.1:
ATGACGCACGAAGTATCCCGACGCCATATTCTGCAGGGCACCGCAGCACTGACCTTCGCCGGCCTGCTGACCGCCGGTTTCGCCCCTCTGGCCCAGGCAGCAGAAGCCGCAACCCCCGCAAACCTGGACGCCCTGCGCGAGCGTTGGGTCGATCAGATCACCGGCCGCCTGCTGATCGACCCGGCCGATCCTGACTTCAAGGCCGCCATCGCCTCCCAGGACCGCGCAGTTGACAAGAGCGTGAGCCTGCTGGCCCCGCGCCCTGGTAAAATGGGCGTGTTCACCGACGCCCCCTTCTCCAGCGAAGCCCAGATGGTGACCTCCTACAAGCGCCTGGCCCAGATGGCCGCCGCCTGGGCAACACCTGGCAGCAAGCACCAGGGCTCCCCGGTCCTGCTGGACCAGATCCTGGGCGCCCTGGAAGACGGCAACACCTACATCTACAACGACGGCCAGGCCGAGTACGGCAACTGGTGGTCCTGGGAAATCGGCACCTCCAAGGCCGCCACCGACACCCTGGCCATCCTGGGTAGCAACGTCAGCCCGGACCTGATCCTGCCGTCCGAAGCCGCCATCGACCACTTCATCCCGGACCCCACCAAGCAGTTCCCGGACTCCCGCGGCAAGATCCTGTCCGAAGGCGCCAACCGCGTCGATATCTGCCAGGCCATCATCGTCCGCAGCATCGTCGGCGGCGACACCGCACGTCTGGCCGCAGCAATCAGCGCCCTGTCCGCCCTGTGGAACTACCCGACCAGCGGCAACGGCTTCTACGCCGACGGCAGCTTCGTCCAGCACACCACCATCCCGTACACCGGCACCTACGGCGTGGTCCTGCTGGGCGGTCTGGCCAAGCTGTTCTCCCTGCTGGGCGGCTCCGACCACGCCGTTAGCGACCCTAGCCGCACCATCCTGTTCAACACCGTGGAAGACAGCTTCGCCCCCTTCCTGCACGACGGCCTGATGATGGACAGCGTCCGCGGCCGCGCCATCTCCCGTACACAGGAACGCGGCTTCGACGACGGCACCATCACCATCGAAGCCATCCTGTGGCTGGCCCGCGCCGTGGATGCCACAACCGGTAACCGCTGGCGCGCCCTGTGCAAGACGATGGATGGCCGCAACCAGTACTCCAACCCCCTGGCCGGCGCCTCCATCCCTCGTACAGCCCTGCTGAAGGAACTGGCCGCCTCCGCCACCTACTGGCGCTCAGTGACAGCCGGTCACTCCTTCTTCCCCGGCATGGACCGCTCCGTCTACCGCGGTAAAGGCTGGGCCGCCGCCCTGGGTCTGAGCTCCCGTCGTACCACCTGGTACGAATGCGGCAACGGCGAAAACAACCTGGGCGCCCAGACCGGCTCCGGCATGACATACCTGTACGCCGGCAACCAGGGCCACTTCGACGACGACTTCTGGCCGACCGCCAACCTGAGCCGCCTGCCTGGTATCACCGTCGATACCACCCCCCTGCCGCCGAAGGTGGAGGGTGAATGGGGCGCCGCCACCCCTCACAACGAGTGGACCGGCGGCGTGACCCTGAACGGCACCGGTGCAGTCGGCATGCACCTGGTGGGCCCGGGTGGTACCGGCCTGCAAGCACGTAAGGCCTGGTTCCACGTGGCCGAAATGGTGGTCGCCCTGGGCGCCGACATCCACACCGCATCCGGCGCAGCCGTGGAGAGCATCATGGAACACCGCAACCTGGGCGCGGACGGCGGTCAAGCAATGACCGTCGATGGCCGCCCCCACACCGCCGCAGCAGGTACCCCTGTCAGCTACGGCCACCCGCGCTGGGCACACCTGGAGGGTACCGGTGGCAGCGCCGTCGATCGCGAGGGTGACCTGACCGTGCTGCGCGAGCAGCGCACCGGTGCATGGGGTACCCTGTACGAGGCCCGCACCCCGGCCGTCGTGTCACGTCAATACGCCACCCTGCTGTTCGAACACGGCACCGACCCGGCCTACCCGTCAGGTATGATCCTGCCGGGCGCCAGCGCAATGGACACCGCAAAGGCCGCCGGCAAGTCCGCCCCTCGTGTGCTGCGTAACGACAAGACCGGCCAGGGCCTGGAGCTGGACAAGAAGACCACCGCCGCCCTGTTCTGGGCCCCGGGTACAGTGGGCAACCTGACCGCCGACGGCCCGGCATGTGTGCTGTTCAACGGCAACCCGGGCCACGGCGTGCTGGCAGTTAGCGACCCGACCCAGACCGCCACCTCCGTGACCGTGACCATCCGCGACGCCCGCTACCGCCGTATCAGCTCCACCGTGGGCGCCACCCTGAGCGTCGATCGCGACGGTAACGTGACCATCACCATTCCCACCGCCGGCCTGCTCGGCCGCACCGTGGAGGTCACGCTGCACCGC
对ChSase AC II(ORF,orf00115_1)基因和蛋白序列分析,对其一、二、三级结构,保守序列,活性位点,信号肽等做出预测。ChSase AC II完整的开放阅读框长度为2367bp,编码789个氨基酸,其中N端36个氨基酸为信号肽序列,蛋白质分子量为83.4kDa,理论等电点(pI)为6.11,属于硫酸软骨素AC外切酶。
进一步,所述表达硫酸软骨素AC外切酶的重组表达载体为质粒pET-12a(+),所述表达分子伴侣的载体为含有分子伴侣GroES-GroEL的质粒pGro7,所述大肠杆菌宿主为BL21(DE3)。
本发明还提供所述重组大肠杆菌的构建方法,包括以下步骤:
(1)将硫酸软骨素AC外切酶编码基因ChSase AC II进行EcoR I和Hind III双酶切,与同样进行双酶切的表达载体pET-12a(+)连接,构建重组质粒pET-12a(+)-ChSase ACII;
(2)将含有GroES-GroEL伴侣蛋白的质粒pGro7导入至大肠杆菌BL21(DE3)中,构建含有GroES-GroEL分子伴侣质粒pGro7的宿主菌;
(3)将上述构建的重组质粒pET-12a(+)-ChSase AC II转化至含有GroES-GroEL分子伴侣质粒pGro7的大肠杆菌宿主BL21/pGro7中,获得所述重组大肠杆菌BL21/pET-12a(+)-ChSase AC II。
本发明还提供所述重组大肠杆菌用于生产硫酸软骨素AC外切酶的方法,将所述的重组大肠杆菌接种于含有抗生素的LB培养基,在37℃,170rpm振荡培养至OD
本发明还提供一种硫酸软骨素AC外切酶的重组大肠杆菌在降解硫酸软骨素A和硫酸软骨素C中的应用,利用所述重组大肠杆菌将硫酸软骨素A和硫酸软骨素C降解为二糖。
本发明与现有技术相比的有益效果
本发明提供一种硫酸软骨素AC外切酶(ChSase AC II)的大肠杆菌重组菌,并通过与分子伴侣GroES-GroEL共表达提高其在大肠杆菌中的可溶性表达水平,克服了当前ChSase AC II在大肠杆菌中可溶性表达效果不好、酶活力低的现状,极大提升了其胞内外酶活力,使胞内、外酶活力分别提升至10.52U/mL、7.63U/mL,本发明所述的ChSase AC II能够将硫酸软骨素降解为二糖,为发酵法制备ChSase AC II以及酶解制备低分子量硫酸软骨素提供一定的实验依据和理论基础。
附图说明
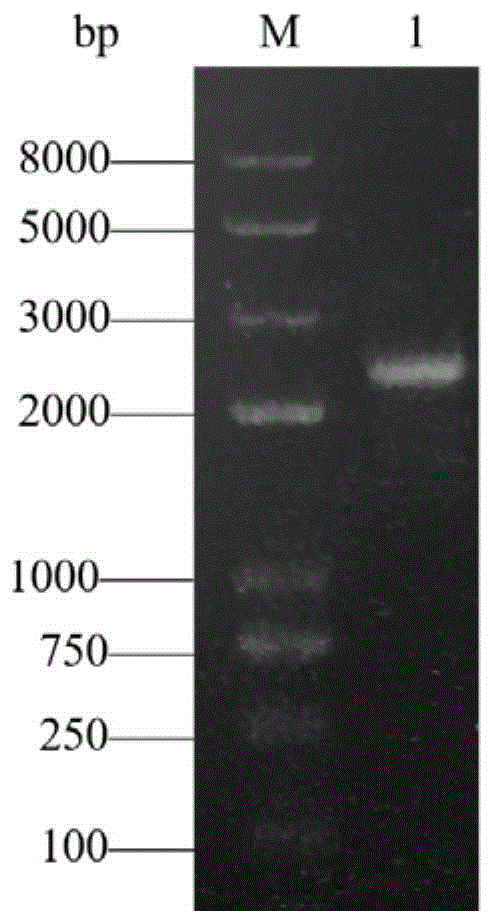
图1为ChSase AC II基因的PCR电泳验证图;
图2为重组表达载体pET-12a(+)-ChSase AC II使用Fast Digest EcoR I/HindIII的双酶切电泳验证图;
图3为ChSase AC II与分子伴侣共表达的蛋白电泳验证图。其中,泳道M:170kDa蛋白marker;泳道1、2分别为ChSase AC II在BL21(DE3)和BL21/pGro7诱导表达的粗酶液;
图4为ChSase AC II在BL21(DE3)和BL21/pGro7中的酶活力情况对比图;
图5为ChSase AC II酶解产物的质谱图。其中,图A:ChSase AC II对CS-A酶解的质谱图;图B:ChSase AC II对CS-C酶解的质谱图;
图6为ChSase AC II酶解产物的TLC图。其中,0-4分别为ChSase AC II对CS-A(图A)和CS-C(图B)酶解0、1、2、3、4h的样品。
具体实施方式
下面将结合本发明实施例中的附图,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明下述实施例公开了一种硫酸软骨素AC外切酶的重组大肠杆菌及其构建方法和应用。
实验材料和试剂:
1.菌株和载体:
由本实验室保存大肠杆菌DH5α、大肠杆菌BL21(DE3)和质粒pGro7;Arthrobactersp.CS01由实验室分离筛选得到;质粒pET-12a(+)购自Invitrogen公司。
2.酶与其他试剂及试剂盒:
PCR酶及连接酶购买自Takara公司,AMP、CM和IPTG均购自Invitrogen公司;细菌基因组提取试剂盒、质粒提取试剂盒及胶回收试剂盒购自Omega公司。
3.培养基
CS菌株生长培养基:0.5%硫酸软骨素(Chondroitin sulfate,CS),0.5%酵母浸粉,0.5%NaCl,0.2%MgSO
LB培养基的成分及质量百分比:1%胰蛋白胨、0.5%酵母提取物、1%NaCl,其余为水;
LB固体培养基的成分及质量百分比:1%胰蛋白胨、0.5%酵母提取物、1%NaCl,2%琼脂,其余为水;
下述实施例中涉及的检测方法如下:
1.SDS-PAGE电泳分析:
取20μL的样品和5μL的样品缓冲液混合,沸水加热7min,3000rpm离心1min;安装好制胶板,将其放入装有电泳缓冲液的电泳槽中,各样品上样量为15μL,Marker上样量为10μL;首先设置电源电压为80V,待电泳示踪剂到达浓缩胶和分离胶界限时,升高电压为100V,直至电泳示踪剂至凝胶底部;电泳结束后,取出凝胶,用考马斯亮蓝R-250染色30min;倒掉染色液,将凝胶置于脱色液中,水平摇床过夜脱色,直至背景变为透明;将脱色后的蛋白胶放至凝胶成像仪中观察蛋白电泳条带。
2.酶活力测定方法:
采用紫外吸收法对本发明的硫酸软骨素外切酶ChSase AC II进行酶活测定。取3.9mL0.2%的硫酸软骨素溶液(Tris-HCl缓冲液配制,20mM,pH 7.5),4mL Tris-HCl缓冲液(20mM,pH 7.5)和100μL的ChSase AC II在37℃水浴中反应5min,反应结束后沸水浴处理5min,测定OD
酶活计算单位公式:
式中:ε指毫摩尔消光系数,5.1;
d指石英比色皿的厚度,1cm;
t指反应时间,min;
A指不饱和二糖产物在232nm的吸光值;
V
V
酶活力定义为:在37℃条件下,每min降解硫酸软骨素产生1μmol不饱和二糖所需的酶量定义为1个酶活力单位(U)。
说明:以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》第三版J.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
实施例1硫酸软骨素AC外切酶编码基因ChSase AC II的扩增
Arthrobacter sp.CS01基因组DNA的提取
用接种环挑取甘油保藏管中Arthrobacter sp.CS01的菌液(所述菌株已被方洋涛于2018年发表的文章“产硫酸软骨素酶菌株发酵条件优化及酶学性质”公开,该菌株目前保藏在中国海洋大学应用微生物研究室)。
在CS菌株生长培养基平板上进行划线,于28℃恒温培养3d。挑取单菌落至CS菌株生长液体培养基,于28℃,160rpm振荡培养48h后,使用细菌基因组DNA提取试剂盒提取。
利用DNAMAN软件分析ChSase AC II基因序列的限制性内切酶位点,再结合pET-12a(+)质粒的多克隆位点,设计带有合适限制性内切酶酶切位点的引物F1和R1:
F1:5’-CCG
R1:5’-CC
以提取的Arthrobacter sp.CS01的基因组为模版,使用引物F1和R1进行PCR扩增,PCR反应条件为:95℃预变性2min,然后进行95℃30s,56℃20s,72℃3min共35个循环,最后再进行72℃延伸10min。反应结束后将该PCR产物回收并进行1%琼脂糖凝胶电泳,电泳结果显示只有一条特异性条带,且长度与ChSase AC II的基因长度2367bp一致,在后续的测序结果也显示扩增正确(参见图1)。
实施例2硫酸软骨素AC外切酶重组大肠杆菌的构建
(1)pET-12a(+)-ChSase AC II表达载体的构建
将扩增的硫酸软骨素AC外切酶编码基因ChSase AC II进行双酶切(EcoR I和HindIII),与同样进行双酶切的表达载体pET-12a(+)连接,然后将连接产物转化至大肠杆菌DH5α感受态细胞,挑选阳性克隆进行DNA测序,测序结果序列正确的转化子用于大量制备重组质粒,将构建成功的表达载体命名为pET-12a(+)-ChSase AC II。
(2)重组菌株的构建
将重组表达质粒pET-12a(+)-ChSase AC II转化至大肠杆菌BL21(DE3)感受态细胞,将转化后的感受态涂布含有100μg/mL氨苄青霉素抗性(AMP)的LB固体培养基上,于37℃培养过夜并进行阳性克隆的筛选(大肠杆菌感受态细胞制备及转化参照分子克隆实验室手册)。
将构建成功的重组菌进行质粒提取,使用Fast Digest EcoR I/Hind III进行双酶切验证,若构建成功,通过核酸电泳验证,会在分子量大约为4500bp和2500bp位置处出现特异性条带(参见图2),将构建成功的重组菌命名为BL21/pET-12a(+)-ChSase AC II。
实施例3分子伴侣共表达重组菌的构建
将含有GroES-GroEL伴侣蛋白的质粒pGro7导入至感受态细胞E.coli BL21(DE3)中,构建含有GroES-GroEL分子伴侣质粒pGro7的宿主菌,命名为BL21/pGro7。按照大肠杆菌感受态细胞制备的方法将其制备成感受态细胞;将上述构建的重组质粒pET-12a(+)-ChSase AC II转化至含有含有GroES-GroEL分子伴侣质粒pGro7的大肠杆菌宿主BL21/pGro7中并进行阳性克隆的筛选。其中,与分子伴侣共表达的组别LB培养基中添加100μg/mL的氯霉素(CM),构建成功的重组菌命名为BL21/pGro7/pET-12a(+)-ChSase AC II。
实施例4重组菌的诱导表达
分别将构建成功的重组菌BL21/pET-12a(+)-ChSase AC II和BL21/pGro7/pET-12a(+)-ChSase AC II接种至含有20mL的LB液体培养基(分别含100μg/mLAMP和CM),于37℃,170rpm,振荡培养12h后,吸取1mL菌液转接至装有50mL LB的液体培养基(分别含100μg/mL AMP和CM),于37℃,170rpm振荡培养至OD
发酵液在4℃,10000rpm离心10min,分别收集上清液和菌体,取上清液检测胞外酶活并将粗酶液采用SDS-PAGE进行表达产物分子量条带验证,根据SDS-PAGE结果,ChSase ACII中的分子伴侣GroES-GroEL在诱导后成功实现在BL21/pET-12a(+)-ChSase AC II中的表达(参见图3)。用Tris-HCl缓冲液(20mM,pH 7.5)重悬菌体,菌悬液采用超声破碎20min(工作1.5s,间歇1.5s,功率60%)。破碎结束后,于4℃,10000rpm离心10min,取上清液检测胞内酶活。酶活测定结果如图4所示,与对照组相比,共表达分子伴侣GroES-GroEL后,ChSase ACII在BL21/pGro7表达的胞内酶活力由3.17U/mL上升至10.52U/mL,胞外酶活力由2.38U/mL上升至7.63U/mL。
实施例5ChSase AC II降解硫酸软骨素的产物分析
ChSase AC II酶解产物的制备,所用的酶来源于BL21/pET-12a(+)-ChSase AC II获得ChSase AC II。
按照酶活力(U):CS质量=1:10的比例,于37℃水浴中搅拌酶解9h,底物分别为1.5%的CS-A和CS-C。酶解结束后,将酶解液5000rpm,离心10min,将上清液进行旋转蒸发后,加入2倍体积预冷的乙醇,4℃静置过夜,5000rpm离心10min;继续将上清液进行旋转蒸发,加入4倍体积预冷的乙醇,4℃静置过夜,5000rpm离心10min;继续将上清液进行旋转蒸发,加入6倍体积预冷的乙醇,4℃静置过夜,5000rpm离心10min,将醇沉上清液进行冻干。
(1)酶解产物质谱分析
将制备的醇沉上清液冻干产物进行质谱分析,将产物溶解于乙腈溶液(乙腈:水=1:1)中,通过负离子模式下的电喷雾电离质(ESI-MS)分析(Agilent 1290 Infinity II-6460,Frag=175.0V,m/z 100-2000amu),并进一步对两种产物的分子结构分析。
质谱结果参见图5,ChSase AC II酶解CS-A主要产生CS-A二糖(458.1,(ΔDi4S-H)
(2)酶解产物TLC分析
将两种产物(CS-A和CS-C)酶解不同时间的样品点样至薄层层析的硅胶板(Silicagel 60 F
结果参见图6,随着酶解时间的延长,ChSase AC II对CS-A和CS-C的酶解产物分布是相同的,在不同时间结点均只有一种终产物,无其他中间产物生成。由此可以推断,ChSase AC II是一种外切酶。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 一种布鲁氏菌三种基因重组质粒、构建方法及其在大肠杆菌中的表达和应用
- 一种重组大肠杆菌及其构建方法与应用
- 一种外切型硫酸软骨素酶AC及其制备方法与应用
- 一种共表达菊粉外切酶和内切酶的重组毕赤酵母菌株及其构建方法与应用
