钙交联载药脂质体凝胶及其制备方法
文献发布时间:2024-01-17 01:26:37
技术领域
本发明属于生物医学技术领域,特别涉及一种钙交联载药脂质体凝胶及其制备方法。
背景技术
在纳米医学领域中,将脂质体作为药物传递载体,由于脂质体具有低毒性和免疫原性,组成部分(如磷脂等)的高度生物相容性和生物可降解性,可增大体内药物浓度及保护药物不被降解,且脂质体容易与各种配体和功能分子进行修饰,可用于靶向递送药物和基因药物。但是据某些研究表明,将脂质体作为药物传递载体仍然有些缺点,比如物理和化学稳定性差,难以承受较大的机械应力等。
发明内容
为了克服上述现有技术中的问题,本发明提供了一种钙交联载药脂质体凝胶及其制备方法,在脂质体内部的钙离子的作用下,谷胱甘肽修饰的低酰基结冷胶在脂质体的外部交联成胶,实现脂质体膜的稳定性及对药物释放的有效控制。
为了实现本发明目的,所采用的的技术方案为:一种钙交联载药脂质体凝胶,包括包封在脂质体内部的药物和包裹在脂质体外部的谷胱甘肽修饰的低酰基结冷胶。
优选的,所述包封在脂质体内部的药物为能够通过口服、注射、眼科或鼻腔给药的药物(例如盐酸阿霉素、氢溴酸加兰他敏等)。
优选的,所述谷胱甘肽修饰的低酰基结冷胶的分子量为12-14kDa。
优选的,所述谷胱甘肽修饰的低酰基结冷胶是由谷胱甘肽接枝改性羧基活化后的低酰基结冷胶获得。
上述钙交联载药脂质体凝胶的制备方法,包括以下步骤:
(1)将处方量的药物溶解于5%葡萄糖溶液中,随后加入一定量的氯化钙,并控制氯化钙的浓度在1-10mM之间,优选为5mM;然后加入脂质薄膜,并在摇床中震荡30±10min,使脂质薄膜复溶;再水浴超声10±5min使溶液透明;随后使用超声波细胞粉碎机将获得的透明溶液超声6s,间歇6s,如此重复6min,以形成所述载药脂质体的分散液;
(2)将步骤(1)制备的载药脂质体的分散液通过固液分离的方式除去外部的氯化钙溶液,随后使用5%葡萄糖溶液将其复溶;
(3)利用谷胱甘肽修饰的低酰基结冷胶与步骤(2)中的载药脂质体溶液孵育30min±10min,在脂质体内部的钙离子的作用下,使得谷胱甘肽修饰的低酰基结冷胶在脂质体的外部交联成胶,并将脂质体包裹其中;再用固液分离方式除去脂质体凝胶分散液中多余的谷胱甘肽修饰的低酰基结冷胶溶液,最后利用5%的葡萄糖溶液将上述离心后的沉淀重新分散在溶液中,获得外部包裹谷胱甘肽修饰的低酰基结冷胶溶液的钙交联载药脂质体凝胶。
优选的,步骤(1)中所述的脂质薄膜由如下方法制得:分别称取磷脂材料与胆固醇,并配置磷脂与胆固醇的三氯甲烷混合溶液,磷脂与胆固醇的摩尔比为1:1-2,然后使用旋转蒸发仪室温下旋蒸至形成所述脂质薄膜;其中磷脂材料为大豆卵磷脂或DOTAP磷脂中的任一种。
优选的,步骤(1)在摇床中震荡时间为30min,水浴超声时间为10min。
优选的,步骤(2)中的固液分离方法为离心分离,所用离心机的转速为13000r/min,离心时间为30min,离心次数为至少1次。
优选的,步骤(3)中谷胱甘肽修饰的低酰基结冷胶溶液的配置方法为:将谷胱甘肽修饰的低酰基结冷胶加入溶剂中后,加热至80±10℃,调节pH至6以上使其完全溶解。其中谷胱甘肽修饰的低酰基结冷胶具有pH响应性,pH小于6使无法溶解在溶剂中。完全溶解后可再根据实际所需调节pH至相应的值。pH不宜调至强酸性或强碱性,否则会影响成胶性能。
优选的,谷胱甘肽修饰的低酰基结冷胶的配制方法所用溶剂为纯化水或5%的葡萄糖溶液。
优选的,步骤(3)中的固液分离方法为离心分离,所用离心机的转速为13000r/min,离心时间为30min,离心次数为至少2次。
与现有技术相比,本发明取得了如下有益技术效果:在脂质体内部钙离子的作用下,谷胱甘肽修饰的低酰基结冷胶在脂质体的外部交联形成保护膜,进而形成了钙交联载药脂质体凝胶,与未修饰的载药脂质体相比,具有更好的稳定性,药物释放具有更加明显的缓释效果。
附图说明:
图1为氯化钙溶液的浓度对载药脂质体凝胶粒径的影响;
图2为谷胱甘肽修饰的低酰基结冷胶与载药脂质体的孵育时间对载药脂质体凝胶粒径的影响;
图3为载药脂质体与载药脂质体凝胶的电位表征;
图4为载药脂质体、载药脂质体凝胶的低温储藏稳定性之粒径考察;
图5为载药脂质体、载药脂质体凝胶的低温储藏稳定性之包封率考察;
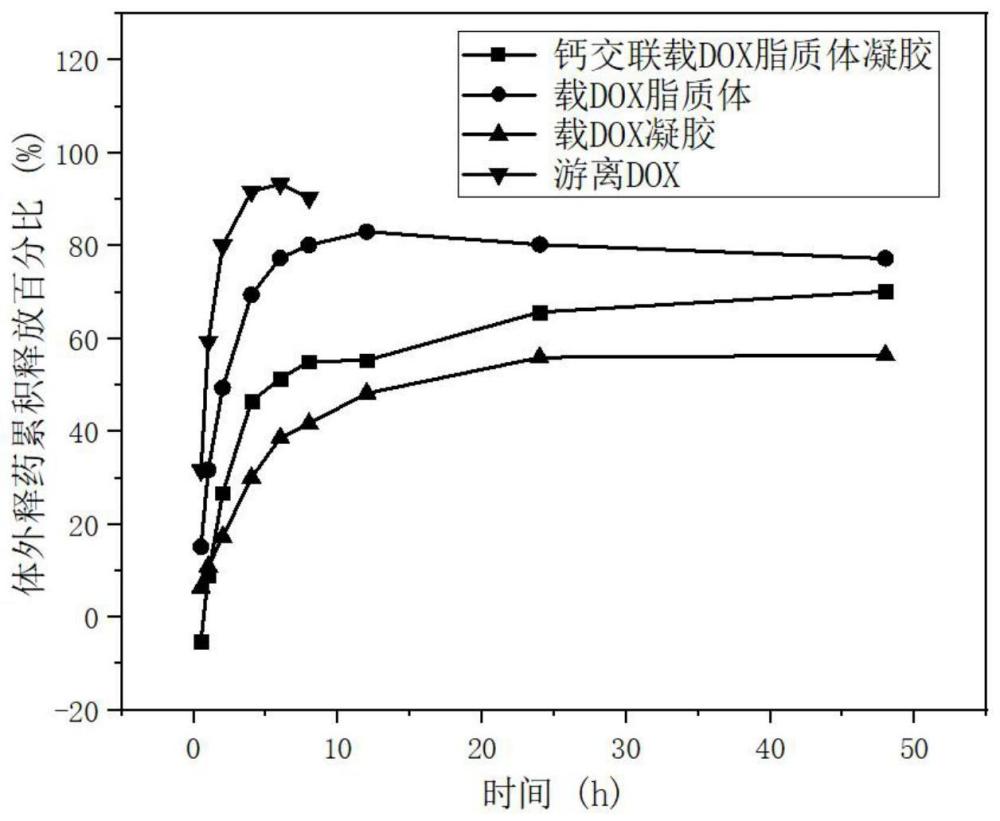
图6为钙交联脂质体凝胶、载DOX脂质体、载DOX凝胶以及游离的DOX的体外药物释放;
图7为载药脂质体、载药脂质体凝胶的细胞毒性研究。
具体实施方式
本发明不局限于下列具体实施方式,本领域一般技术人员根据本发明公开的内容,可以采用其他多种具体实施方式实施本发明的,或者凡是采用本发明的设计结构和思路,做简单变化或更改的,都落入本发明的保护范围。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
本发明下面结合实施例作进一步详述:
一种钙交联载药脂质体凝胶,包括包封在脂质体内的药物和包裹在脂质体外部的谷胱甘肽修饰的低酰基结冷胶。脂质体所载药物一般为能够通过口服、眼科或鼻腔给药的药物(以下实施例以盐酸阿霉素为例)。
以下实施例中所用的谷胱甘肽修饰的低酰基结冷胶溶液通过如下方法制得:
步骤一:制备谷胱甘肽修饰的低酰基结冷胶(GSH-GG)
在20-30℃下,将低酰基结冷胶的羧基活化,具体的,将羧基活化剂1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC)加入到低酰基结冷胶水溶液中,活化低酰基结冷胶中的羧基,活化结束后再加入谷胱甘肽并调节pH在5.0-6.0之间,持续反应3h左右。反应结束后,在N
其中关于低酰基结冷胶,是由天然结冷胶(也即高酰基结冷胶)通过碱处理除去O-酰基,再经过滤纯化而得,也即商品结冷胶,一般食品及医学领域应用的均为低酰基结冷胶。
步骤二:配置制备谷胱甘肽修饰的低酰基结冷胶水溶液(分别配置质量浓度为0.1%、0.2%、0.5%、1%的谷胱甘肽修饰的低酰基结冷胶水溶液)
根据所需浓度,将所需的谷胱甘肽修饰的低酰基结冷胶加入纯化水中,加热至80℃左右,调节pH至6以上使其完全溶解。谷胱甘肽修饰的低酰基结冷胶具有pH响应性,pH小于6使无法溶解在溶剂中。完全溶解后可再根据实际所需调节pH至相应的值。pH不宜调至强酸性或强碱性,否则会影响成胶性能。
实施例1
钙交联载药脂质体凝胶及其制备方法,包括如下步骤:
(1)将处方量的盐酸阿霉素(DOX)溶解在5%葡萄糖溶液中,随后加入一定量的氯化钙,并控制氯化钙的浓度在5mM;然后将其加入脂质薄膜,并在摇床中震荡30±10min使其复溶,然后对其进行水浴超声10±5min使溶液透明,随后利用超声波细胞粉碎机将获得的透明溶液超声6s,间歇6s,如此重复6min,以形成载DOX脂质体的分散液。
(2)将上述载DOX脂质体的分散液通过固液分离的方式去除脂质体外部的氯化钙溶液,所用固液分离的方式为离心分离,且所用离心机的转速为13000r/min,离心时间为30min,离心次数为至少1次,随后利用5%葡萄糖溶液将脂质沉淀复溶。
(3)将上述载DOX脂质体溶液缓慢均匀地加入到已经配制好质量浓度的谷胱甘肽修饰的低酰基结冷胶溶液中,并孵育30min±10min。再将已经孵育好的脂质体凝胶溶液经固液分离去除多余的谷胱甘肽修饰的低酰基结冷胶,所用固液分离的方式为离心分离,且所用离心机的转速为13000r/min,离心时间为30min,离心次数为至少2次。最后利用5%的葡萄糖溶液将沉淀重新分散在溶液中,便得到了载DOX脂质体外部包裹谷胱甘肽修饰的低酰基结冷胶溶液。
步骤(1)中所述的脂质薄膜由如下方法制得:分别称取一定量的摩尔比为1:1的大豆卵磷脂与胆固醇,或摩尔比为1:2的DOTAP磷脂与胆固醇,再分别将磷脂材料与胆固醇溶解在三氯甲烷中,进而制得磷脂三氯甲烷溶液和胆固醇三氯甲烷溶液,然后将该两种溶液均匀混合,最后使用旋转蒸发仪室温下旋蒸至形成脂质薄膜。
研究了氯化钙溶液浓度对载药脂质体凝胶粒径的影响,分别配制浓度为1mM、2mM、4mM、8mM、10mM、20mM的氯化钙溶液,其他步骤与实施例1相同。如图1所示,氯化钙溶液浓度在1-10mM之间时,钙交联载药脂质体凝胶的粒径基本相同,但是当氯化钙溶液浓度为20mM时,载药脂质体凝胶的粒径会大幅度增大。
包封率的测量方法为:首先做盐酸阿霉素的标准曲线,然后将制备好的载盐酸阿霉素脂质体凝胶在Ex为480nm,Em为590nm的波长下测量荧光强度,此时测量的为游离的盐酸阿霉素的荧光强度,最后利用1%的Triton对脂质体进行破乳,在Ex为480nm,Em为590nm的波长下测量荧光强度,此时测量的为总的盐酸阿霉素的荧光强度。包封率=(总的盐酸阿霉素的浓度-游离的盐酸阿霉素的浓度)/总的盐酸阿霉素的浓度×100%。结果如表1所示,钙交联载药脂质体凝胶相比较脂质体而言,包封率并无显著的变化,证明载药量与谷胱甘肽修饰的低酰基结冷胶对包封率无太大的影响。同时,由图4和图5可知,相比于空白脂质体,钙交联载药脂质体凝胶的稳定性得到了明显提升。
表1:钙交联脂质体凝胶与脂质体的包封率的差异
使用马尔文激光粒度仪进行了电位表征测试,如图3所示,结果表明,与未包裹谷胱甘肽结冷胶的脂质体相比,以大豆卵磷脂与胆固醇为原料的脂质薄膜制备的包裹谷胱甘肽结冷胶的载药脂质体凝胶的平均电位变得更低,而以DOTAP磷脂与胆固醇为原料的脂质薄膜制备的包裹谷胱甘肽结冷胶的载药脂质体凝胶的平均电位由正变负,均说明修饰成功。
同时,分别测试了钙交联脂质体凝胶、载DOX脂质体、载DOX凝胶以及游离的DOX连续50h内的体外药物释放。具体方法为:取钙交联载DOX脂质体凝胶2ml置于预先处理好的透析袋(Mw=14000Da)内,两端扎紧,投入30ml已恒温至37℃的释放介质中,恒温37℃水浴振摇,恒速100r/min,分别于规定的时间点(0,0.5,1,2,4,6,8,12,24,36,48h)收集5mL释放介质,同时补加等温等量的释放介质,采用荧光分光光度仪法测定,测定样品中DOX的浓度。另取游离的DOX溶液,载DOX凝胶,载DOX脂质体溶液,同上述实验步骤进行体外药物释放的测定。结果如图6所示,钙交联载药脂质体凝胶外部包裹的谷胱甘肽结冷胶并未对脂质体的药物释放能力造成明显影响,可在50h内释放70%以上的药物。
其中,游离的DOX溶液的配制过程为:称取适量DOX加入蒸馏水中,并水浴超声溶解,得到游离的DOX溶液。
载DOX凝胶的配制过程为:称取适量DOX加入质量浓度为0.5%的谷胱甘肽结冷胶中,并水浴超声溶解,得到载DOX凝胶。
使用传统的薄膜水合法制备载DOX脂质体。
由图7可知,与载药脂质体相比,外部包裹谷胱甘肽结冷胶的钙交联载药脂质体凝胶的细胞存活率保持在90%以上。
谷胱甘肽修饰的低酰基结冷胶包裹未载药脂质体的制备:
(1)将一定量的氯化钙溶解在5%葡萄糖溶液中,并控制氯化钙的浓度在5mM;然后将其加入脂质薄膜,并在摇床中震荡30±10min使其复溶,然后对其进行水浴超声10±5min使溶液透明,随后利用超声波细胞粉碎机将获得的透明溶液超声6s,间歇6s,如此重复6min,以形成载盐酸阿霉素脂质体的分散液。
(2)将上述脂质体溶液通过固液分离的方式去除脂质体外部的氯化钙溶液,所用固液分离的方式为离心分离,且所用离心机的转速为13000r/min,离心时间为30min,离心次数为至少1次,随后利用5%葡萄糖溶液将脂质沉淀复溶。
(3)将上述已重溶的脂质体缓慢均匀地加入到已经配制好质量浓度的谷胱甘肽修饰的低酰基结冷胶溶液中,并孵育30min±10min。随后将已经孵育好的脂质体凝胶溶液经固液分离去除多余的谷胱甘肽修饰的低酰基结冷胶,所用固液分离的方式为离心分离,且所用离心机的转速为13000r/min,离心时间为30min,离心次数为至少2次。最后利用5%的葡萄糖溶液将沉淀重新分散在溶液中,便得到了载药脂质体外部包裹谷胱甘肽修饰的低酰基结冷胶溶液。
此外,还研究了基于不同质量浓度的谷胱甘肽修饰的低酰基结冷胶包裹未载药脂质体和不包裹谷胱甘肽修饰的低酰基结冷胶的脂质体的粒径,可以发现随着载药量的增大,粒径随之增大,并且钙交联载药脂质体凝胶相比于外部无钙交联的低酰基结冷胶的脂质体,粒径有所增大。
表2:不同载药量与不同质量浓度的钙交联谷胱甘肽修饰的低酰基结冷胶的粒径对比
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 一种交联透明质酸凝胶的制备方法及所制备的交联透明质酸凝胶
- 海藻酸钙-氧化石墨烯纳米纤维及制备方法和载药海藻酸钙-氧化石墨烯纳米纤维
- 温度响应型载药脂质体凝胶及其制备方法
- 基于水凝胶和脂质体的复合载药递送材料的制备方法
