用于治疗皮肤病的含维生素D类似物的JAK抑制剂
文献发布时间:2024-04-18 19:58:26
相关申请的交叉引用
本申请要求2020年12月4日提交的美国临时申请号63/121,531和2021年1月29日提交的美国临时申请号63/199,876的优先权,所述申请各自特此以引用的方式整体并入。
技术领域
本公开涉及使用(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐来局部治疗皮肤病。
背景技术
由Janus激酶(JAK)–信号转导因子介导的炎症是自身免疫性皮肤病的重要特征之一。Janus激酶(JAK)抑制剂已被开发为用于治疗炎性皮肤病,包括特应性皮炎、斑秃、银屑病和白癜风的剂。然而,就任何治疗而言,JAK抑制剂可能不会对所有患有炎性皮肤病的受试者都同样有效。需要开发更有效的包含JAK抑制剂的制剂来治疗更广泛数量的患有各种炎性皮肤病的受试者。
考虑到这些局限性,医疗上需要新的治疗选项。本公开针对该需要和其他需要。
发明内容
本公开提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)鲁索替尼(ruxolitinib)或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)鲁索替尼或其药学上可接受的盐和(b)卡泊三醇(calcipotriol)或其药学上可接受的盐。
本公开还提供了一种JAK抑制剂或其药学上可接受的盐,用于与维生素D3、维生素D3类似物或其药学上可接受的盐组合来局部治疗本文所述的皮肤病。
本公开还提供了鲁索替尼或其药学上可接受的盐,用于与维生素D3、维生素D3类似物或其药学上可接受的盐组合来局部治疗本文所述的皮肤病。
本公开还提供了鲁索替尼或其药学上可接受的盐,用于与卡泊三醇或其药学上可接受的盐组合来局部治疗本文所述的皮肤病。
本公开还提供了一种JAK抑制剂或其药学上可接受的盐与维生素D3、维生素D3类似物或其药学上可接受的盐组合用于制造用于局部治疗本文所述的皮肤病的药剂的用途。
本公开还提供了一种鲁索替尼或其药学上可接受的盐与维生素D3、维生素D3类似物或其药学上可接受的盐组合用于制造用于局部治疗本文所述的皮肤病的药剂的用途。
本公开还提供了一种鲁索替尼或其药学上可接受的盐与卡泊三醇或其药学上可接受的盐组合用于制造用于局部治疗本文所述的皮肤病的药剂的用途。
在前述每一者的一些实施方案中,患者是人患者。
本公开进一步提供了一种用于局部治疗本文所述的皮肤病症的局部制剂,其包含(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开进一步提供了一种用于局部治疗本文所述的皮肤病症的局部制剂,其包含(a)鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开进一步提供了用于局部治疗本文所述的皮肤病症的局部制剂,其包含(a)鲁索替尼或其药学上可接受的盐和(b)卡泊三醇或其药学上可接受的盐。
本公开还提供了一种局部制剂用于制造用于局部治疗本文所述的皮肤病症的药剂的用途,所述局部制剂包含(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了一种局部制剂用于制造用于局部治疗本文所述的皮肤病症的药剂的用途,所述局部制剂包含(a)鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了一种局部制剂用于制造用于局部治疗本文所述的皮肤病症的药剂的用途,所述局部制剂包含(a)鲁索替尼或其药学上可接受的盐和(b)卡泊三醇或其药学上可接受的盐。
本公开进一步提供了用于局部治疗皮肤病的药物制剂,其包含(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了用于局部治疗皮肤病的药物制剂,其包含(a)鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开进一步提供了用于局部治疗皮肤病的药物制剂,其包含(a)磷酸鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
以下描述中阐述了本公开的一个或多个实施方案的详情。从说明书和附图以及从权利要求中,本公开的其他特征、目的以及优点将会显而易见。
附图说明
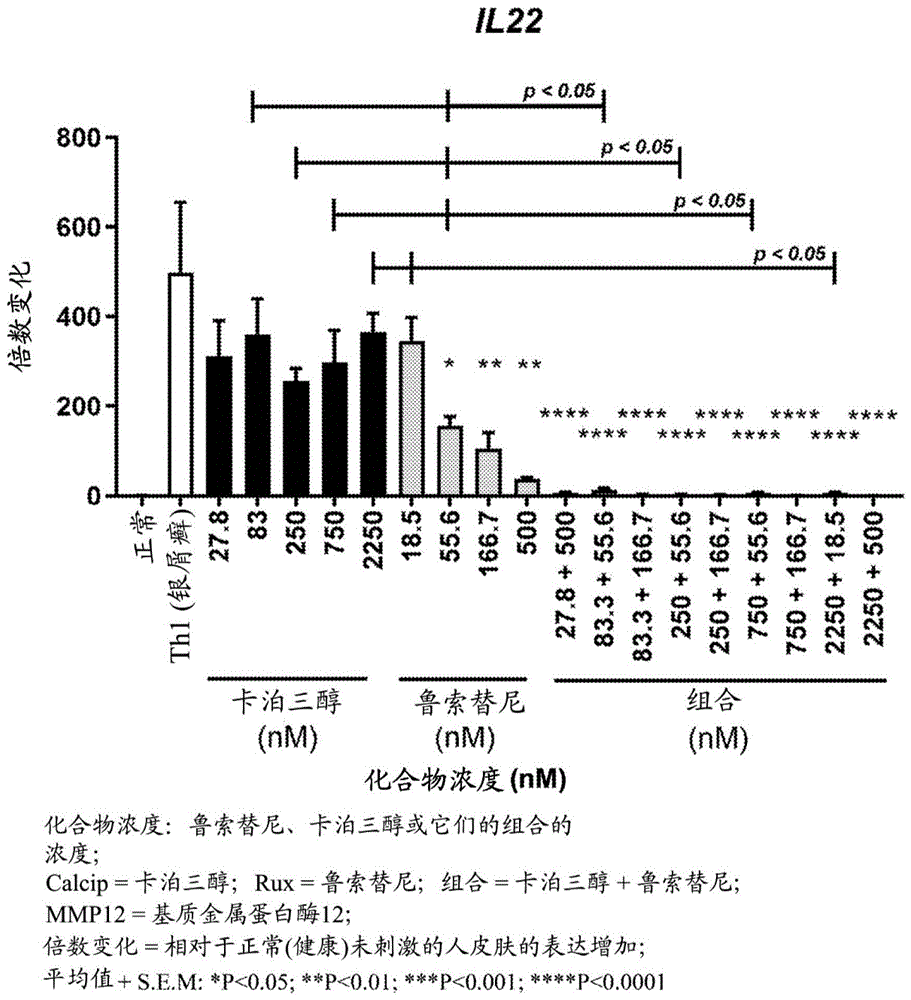
图1描绘了在刺激后24小时用不同浓度的鲁索替尼、卡泊三醇和其组合进行基底外侧处理的皮肤相对于正常(健康)未刺激和刺激的人皮肤的IL-22水平的倍数变化和p值。
图2描绘了在刺激后24小时用不同浓度的鲁索替尼、卡泊三醇和其组合进行基底外侧处理的皮肤相对于正常(健康)未刺激和刺激的人皮肤的CXCL10水平的倍数变化和p值。
图3描绘了在刺激后24小时用不同浓度的鲁索替尼、卡泊三醇和其组合进行基底外侧处理的皮肤相对于正常(健康)未刺激和刺激的人皮肤的MMP12水平的倍数变化和p值。
图4描绘了
图5描绘了乳膏制剂#1至#6的照片。
图6A至图6B分别描绘了在Th1或Th17刺激后与未处理的对照相比,用卡泊三醇和鲁索替尼的组合处理后某些基因表达的绝对倍数变化(白色表示<2绝对倍数变化,灰色表示>2绝对倍数变化,并且黑色表示>4绝对倍数变化)。
图7A至图7B分别描绘了在刺激后24小用不同浓度的鲁索替尼、马沙骨化醇和其组合进行基底外侧处理的皮肤相对于正常(健康)未刺激和刺激的人皮肤的IL-22水平和CXCL10的倍数变化(平均值+SEM)(JAKi是鲁索替尼;Vit D是马沙骨化醇;并且Combo是鲁索替尼和马沙骨化醇的组合)。
图8A至图8C分别描绘了在刺激后24小用不同浓度的鲁索替尼、卡泊三醇和其组合局部处理的皮肤相对于正常(健康)未刺激和刺激的人皮肤的S100a12、Defb4和Serpinb4的倍数变化(平均值+SEM)(JAKi是鲁索替尼;Vit D是卡泊三醇;并且Combo是鲁索替尼和卡泊三醇的组合)。
图9A至图9C分别描绘了在刺激后24小用不同浓度的鲁索替尼、卡泊三醇和其组合局部处理的皮肤相对于正常(健康)未刺激和刺激的人皮肤的MMP12、IL-22和CXCL10的倍数变化(平均值+SEM)(JAKi是鲁索替尼;Vit D是卡泊三醇;并且Combo是鲁索替尼和卡泊三醇的组合)。
图10描绘了在用媒介物或鲁索替尼和卡泊三醇的组合乳膏治疗的IL-23诱导的银屑病样体内小鼠模型中耳朵厚度的变化(***表示p<0.001)(JAKi是鲁索替尼;Vit D是卡泊三醇;并且Combo是鲁索替尼和卡泊三醇的组合)。
具体实施方式
本公开提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D衍生物或其药学上可接受的盐。
本公开提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3类似物或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)鲁索替尼或其药学上可接受的盐和(b)维生素D3或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)鲁索替尼或其药学上可接受的盐和(b)维生素D3类似物或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)磷酸鲁索替尼和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)磷酸鲁索替尼和(b)维生素D3或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)磷酸鲁索替尼和(b)维生素D3类似物或其药学上可接受的盐。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)磷酸鲁索替尼和(b)卡泊三醇或其药学上可接受的盐。在一些实施方案中,皮肤病是自身免疫性皮肤病。
本公开还提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)JAK抑制剂或其药学上可接受的盐和(b)卡泊三醇或其药学上可接受的盐。在一些实施方案中,皮肤病是自身免疫性皮肤病。
在一些实施方案中,皮肤病是炎性皮肤病。
在一些实施方案中,皮肤病与Th1或Th2相关。T辅助(Th)1细胞和/或T辅助(Th)17细胞参与许多炎性皮肤病和自身免疫性皮肤病。例如,以下疾病主要是Th17偏向性:(i)银屑病(Fletcher等人,Clin Exp Immunol,201(2):121-134(2020),PMID:32379344;Liu等人,Front Immunol,11:594735(2020),PMID:33281823);(ii)鱼鳞癣(Czarnowicki等人,JInvest Dermatol,138(10):2157-2167(2018),PMID:29660300;Paller等人,J AllergyClin Immunol,139(1):152-165(2017),PMID:27554821);和(iii)毛发红糠疹(Liu,同上,PMID:33281823)。此外,以下疾病主要是Th1偏向性:(i)斑秃(
在一些实施方案中,皮肤病由白细胞介素22(IL-22)、C-X-C基序趋化因子10(CXCL10)、基质金属肽酶12(MMP12)或其组合介导。在一些实施方案中,皮肤病由IL-22介导。在一些实施方案中,皮肤病由MMP12介导。在一些实施方案中,皮肤病由CXCL10介导。
在一些实施方案中,皮肤病由Defb4、S100a12或Serpinb4介导。S100a12是银屑病疾病活动的重要标志物(Wilsmann-Theis,D等人,J Eur Acad Dermatol Venereol,30(7):1165-70(2016);doi:10.1111/jdv.13269,所述文献以引用的方式整体并入本文)。Defb4编码人β-防御素2(hBD2),其为一种抗微生物肽,在皮肤炎性过程中起着重要作用,并且在银屑病的发病机制中起着重要作用(Johansen C等人,J Invest Derm,136(8):1608-1616(2016);doi:10.1016/j.jid.2016.04.012,所述文献以引用的方式整体并入本文)。Serpinb4导致患有慢性皮肤病的患者的炎症,包括特应性皮炎(Sivaprasad,U等人,JInvest Derm 135(1):160-169(2015);DOI:10.1038/jid.2014.353,其以引用的方式整体并入本文)。
在一些实施方案中,皮肤病选自银屑病、特应性皮炎、秃头、白癜风、赖特氏综合征(Reiter's syndrome)、毛发红糠疹、单纯性大疱性表皮松解症、掌跖角化病、先天性厚甲、多发性皮脂囊肿、皮肤扁平苔藓、皮肤T细胞淋巴瘤、化脓性汗腺炎、接触性皮炎、鱼鳞癣和角质化病症。
在一些实施方案中,皮肤病选自银屑病、特应性皮炎、秃头、白癜风、赖特氏综合征、毛发红糠疹、单纯性大疱性表皮松解症、掌跖角化病、先天性厚甲、多发性皮脂囊肿、皮肤扁平苔藓、皮肤T细胞淋巴瘤、化脓性汗腺炎、接触性皮炎和鱼鳞癣。
在一些实施方案中,皮肤病是银屑病。在一些实施方案中,银屑病由白细胞介素22(IL-22)、C-X-C基序趋化因子10(CXCL10)、基质金属肽酶12(MMP12)或其组合介导。银屑病与IL-22、CXCL10和/或MMP12之间的关系可在例如IL-22、CXCL10和/或MMP12处找到,参见He等人“Tape strips detect distinct immune and barrier profiles in atopicdermatitis and psoriasis”J Allergy Clin Immunol.2020年7月9日;S0091-6749(20)30824-1,PMID:32709423,所述文献以引用的方式整体并入本文。在一些实施方案中,银屑病由白细胞介素22(IL-22)介导。在一些实施方案中,银屑病由C-X-C基序趋化因子10(CXCL10)介导。在一些实施方案中,银屑病由基质金属肽酶12(MMP12)介导。在一些实施方案中,银屑病选自斑块型银屑病、指甲银屑病、擦烂性银屑病、掌跖银屑病和脓疱性银屑病。在一些实施方案中,银屑病是斑块型银屑病。在一些实施方案中,斑块型银屑病由白细胞介素22(IL-22)介导。在一些实施方案中,斑块型银屑病由C-X-C基序趋化因子10(CXCL10)介导。在一些实施方案中,斑块型银屑病由基质金属肽酶12(MMP12)介导。
在一些实施方案中,皮肤病是特应性皮炎。在一些实施方案中,特应性皮炎由白细胞介素22(IL-22)、C-X-C基序趋化因子10(CXCL10)、基质金属肽酶12(MMP12)或其组合介导。特应性皮炎与IL-22和/或MMP12之间的关系可在例如He等人“Tape strips detectdistinct immune and barrier profiles in atopic dermatitis and psoriasis”JAllergy Clin Immunol.2020年7月9日;S0091-6749(20)30824-1,PMID:32709423处找到。特应性皮炎与CXCL10之间的关系可以在例如Brunner等人“Nonlesional atopicdermatitis skin shares similar T-cell clones with lesional tissues”Allergy.2017年12月;72(12):2017-2025,PMID:28599078处找到。本文所引用的每篇参考文献均以引用的方式整体并入本文。在一些实施方案中,特应性皮炎由白细胞介素22(IL-22)介导。在一些实施方案中,特应性皮炎由C-X-C基序趋化因子10(CXCL10)介导。在一些实施方案中,特应性皮炎由基质金属肽酶12(MMP12)介导。
在一些实施方案中,皮肤病是秃头。在一些实施方案中,皮肤病是斑秃。斑秃与IL-22之间的关系可在例如Loh等人“Role of T helper17cells and T regulatory cells inalopecia areata:comparison of lesion and serum cytokine between controls andpatients”J Eur Acad Dermatol Venereol.2018年6月;32(6):1028-1033.,PMID:29283462处找到。斑秃与CXCL10之间的关系可在例如Duca等人“Frontal fibrosingalopecia shows robust T helper 1and Janus kinase 3skewing”Br J Dermatol.2020年3月25日,PMID:32215911处找到。本文所引用的每篇参考文献均以引用的方式整体并入本文。在一些实施方案中,秃头由白细胞介素22(IL-22)介导。在一些实施方案中,秃头由C-X-C基序趋化因子10(CXCL10)介导。
在一些实施方案中,皮肤病是白癜风。白癜风与IL-22之间的关系可在例如Czarnowicki等人“Blood endotyping distinguishes the profile of vitiligo fromthat of other inflammatory and autoimmune skin diseases”J Allergy ClinImmunol.2019年6月;143(6):2095-2107.PMID:30576756处找到。白癜风与CXCL10之间的关系可在例如Abdallah等人“CXCL-10and Interleukin-6are reliable serum markers forvitiligo activity:A multicenter cross-sectional study”Pigment Cell MelanomaRes.2018年3月;31(2):330-336.PMID:29094481处找到。本文所引用的每篇参考文献均以引用的方式整体并入本文。在一些实施方案中,白癜风由白细胞介素22(IL-22)介导。在一些实施方案中,白癜风由C-X-C基序趋化因子10(CXCL10)介导。
在一些实施方案中,皮肤病是赖特氏综合征。赖特氏综合征与IL-22之间的关系可在例如Zhao等人“IL-22+CD4+T cells in patients with rheumatoid arthritis”Int JRheum Dis.2013年10月;16(5):518-26,PMID:24164838处找到。赖特氏综合征与CXCL10之间的关系可在例如Pandya等人“Blood chemokine profile in untreated earlyrheumatoid arthritis:CXCL10 as a disease activity marker”Arthritis ResTher.2017年2月2日;19(1):20,PMID:28148302中找到。本文所引用的每篇参考文献均以引用的方式整体并入本文。在一些实施方案中,赖特氏综合征由白细胞介素22(IL-22)介导。在一些实施方案中,赖特氏综合征由C-X-C基序趋化因子10(CXCL10)介导。
在一些实施方案中,皮肤病是毛发红糠疹。毛发红糠疹与IL-22之间的关系可在例如Feldmeyer等人“Interleukin 23-Helper T Cell 17Axis as a Treatment Target forPityriasis Rubra Pilaris”JAMA Dermatol.2017年4月1日;153(4):304-308,PMID:28122069处找到。毛发红糠疹与CXCL10之间的关系可在例如Adnot-Desanlis等人“Effectiveness of infliximab in pityriasis rubra pilaris is associated withpro-inflammatory cytokine inhibition”Dermatology 2013;226(1):41-6,PMID:23548788处找到。本文所引用的每篇参考文献均以引用的方式整体并入本文。在一些实施方案中,毛发红糠疹由白细胞介素22(IL-22)介导。在一些实施方案中,毛发红糠疹由C-X-C基序趋化因子10(CXCL10)介导。
在一些实施方案中,皮肤病是单纯性大疱性表皮松解症。单纯性大疱性表皮松解症与IL-22和/或CXCL10之间的关系可在例如Castela等人“Epidermolysis bullosasimplex generalized severe induces a T helper 17response and is improved byapremilast treatment”Br J Dermatol.2019年2月;180(2):357-364,PMID:29932457处找到,所述文献以引用的方式整体并入本文。在一些实施方案中,单纯性大疱性表皮松解症由白细胞介素22(IL-22)介导。在一些实施方案中,单纯性大疱性表皮松解症由C-X-C基序趋化因子10(CXCL10)介导。
在一些实施方案中,皮肤病是掌跖角化病。掌跖角化病与IL-22之间的关系可在例如Druetz等人“Association of Transient Palmoplantar Keratoderma With Clinicaland Immunologic Characteristics of Bullous Pemphigoid”JAMA Dermatol.2019年2月1日;155(2):216-220,PMID:30484821处找到,所述文献以引用的方式整体并入本文。在一些实施方案中,掌跖角化病由白细胞介素22(IL-22)介导。
在一些实施方案中,皮肤病是先天性厚甲。先天性厚甲与IL-22之间的关系可在例如Yang等人“Keratin 17in disease pathogenesis:from cancer to dermatoses”JPathol.2019年2月;247(2):158-165,PMID:30306595处找到,所述文献以引用的方式整体并入本文。在一些实施方案中,先天性厚甲由白细胞介素22(IL-22)介导。
在一些实施方案中,皮肤病是多发性皮脂囊肿。多发性皮脂囊肿与IL-22之间的关系可在例如Yang等人“Keratin 17in disease pathogenesis:from cancer todermatoses”J Pathol.2019年2月;247(2):158-165,PMID:30306595处找到,所述文献以引用的方式整体并入本文。在一些实施方案中,多发性皮脂囊肿由白细胞介素22(IL-22)介导。
在一些实施方案中,皮肤病是皮肤扁平苔藓。皮肤扁平苔藓与IL-22之间的关系可在例如Chen等人“Immunoexpression of interleukin-22and interleukin-23in oraland cutaneous lichen planus lesions:a preliminary study”MediatorsInflamm.2013;2013:801974,PMID:24376306处找到。皮肤扁平苔藓与CXCL10之间的关系可在例如Domingues等人“The dysfunctional innate immune response triggered byToll-like receptor activation is restored by TLR7/TLR8 and TLR9 ligands incutaneous lichen planus”Br J Dermatol.2015年1月;172(1):48-55,PMID:24976336和Wenzel等人“CXCR3<->ligand-mediated skin inflammation in cutaneous lichenoidgraft-versus-host disease”J Am Acad Dermatol.2008年3月;58(3):437-42,PMID:18280341处找到,所述文献各自以引用的方式整体并入本文。在一些实施方案中,皮肤扁平苔藓由白细胞介素22(IL-22)介导。在一些实施方案中,皮肤扁平苔藓由C-X-C基序趋化因子10(CXCL10)介导。
在一些实施方案中,皮肤病是皮肤T细胞淋巴瘤。在一些实施方案中,皮肤T细胞淋巴瘤由白细胞介素22(IL-22)、C-X-C基序趋化因子10(CXCL10)、基质金属肽酶12(MMP12)或其组合介导。皮肤T细胞淋巴瘤与IL-22和/或MMP12之间的关系可在例如Litvinov等人“TheUse of Transcriptional Profiling to Improve Personalized Diagnosis andManagement of Cutaneous T-cell Lymphoma(CTCL)”Clin Cancer Res.2015年6月15日;21(12):2820-9,PMID:25779945处找到。皮肤T细胞淋巴瘤与CXCL10之间的关系可在例如Mehul等人“Proteomic analysis of stratum corneumin Cutaneous T-Cell Lymphomasand psoriasis”Exp Dermatol.2019年3月;28(3):317-321,PMID:30637808处找到。本文所引用的每篇参考文献均以引用的方式整体并入本文。在一些实施方案中,皮肤T细胞淋巴瘤由白细胞介素22(IL-22)介导。在一些实施方案中,皮肤T细胞淋巴瘤由C-X-C基序趋化因子10(CXCL10)介导。在一些实施方案中,皮肤T细胞淋巴瘤由基质金属肽酶12(MMP12)介导。
在一些实施方案中,皮肤病是化脓性汗腺炎。化脓性汗腺炎与IL-22之间的关系可在例如Rumberger等人“Transcriptomic analysis of hidradenitis suppurativa skinsuggests roles for multiple inflammatory pathways in disease pathogenesis”Inflamm Res.2020年10月;69(10):967-973,PMID:32661800处找到,所述文献以引用的方式整体并入本文。在一些实施方案中,化脓性汗腺炎由白细胞介素22(IL-22)介导。
在一些实施方案中,皮肤病是接触性皮炎。在一些实施方案中,接触性皮炎由白细胞介素22(IL-22)、C-X-C基序趋化因子10(CXCL10)、基质金属肽酶12(MMP12)或其组合介导。接触性皮炎与IL-22之间的关系可在例如Robb等人“Prostaglandin E 2stimulatesadaptive IL-22production and promotes allergic contact dermatitis”J AllergyClin Immunol.2018年1月;141(1):152-162,PMID:28583370处找到。接触性皮炎与CXCL10之间的关系可在例如Brans等人“Stratum corneum levels of inflammatory mediatorsand natural moisturizing factor in patch test reactions to thiurams andfragrances and their possible role in discrimination between irritant andallergic reactions to hapten mixtures”Contact Dermatitis.2020年11月21日,PMID:33222241处找到。接触性皮炎与MMP12之间的关系可在例如Meguro等人“SOCS3Expressedin M2 Macrophages Attenuates Contact Hypersensitivity by Suppressing MMP-12Production”J Invest Dermatol.2016年3月;136(3):649-657,PMID:27015453处找到。本文所引用的每篇参考文献均以引用的方式整体并入本文。在一些实施方案中,接触性皮炎由白细胞介素22(IL-22)介导。在一些实施方案中,接触性皮炎由C-X-C基序趋化因子10(CXCL10)介导。在一些实施方案中,接触性皮炎由基质金属肽酶12(MMP12)介导。
在一些实施方案中,皮肤病是鱼鳞癣。鱼鳞癣与IL-22之间的关系可在例如Czarnowicki等人“The Major Orphan Forms of Ichthyosis Are Characterized bySystemic T-Cell Activation and Th-17/Tc-17/Th-22/Tc-22 Polarization in Blood”J Invest Dermatol.2018年10月;138(10):2157-2167,PMID:29660300处找到,所述文献以引用的方式整体并入本文。在一些实施方案中,鱼鳞癣由白细胞介素22(IL-22)介导。在一些实施方案中,鱼鳞癣是寻常性鱼鳞癣、X连锁鱼鳞癣、大疱性先天性鱼鳞癣样红皮病(BCIE)、非大疱性先天性鱼鳞癣样红皮病(NBCIE)、板层状鱼鳞癣、丑角样鱼鳞癣、鱼鳞癣综合征或获得性鱼鳞癣。
通常,角质化病症是一组角化病症。角质化病症与IL-22之间的关系可在例如Yang等人“Keratin 17in disease pathogenesis:from cancer to dermatoses”JPathol.2019年2月;247(2):158-165,PMID:30306595处找到,所述文献以引用的方式整体并入本文。在一些实施方案中,角质化病症由IL-22介导。在一些实施方案中,角质化病症选自鱼鳞癣、掌跖角化病、毛囊角化症和棘层松解性皮肤病。
在一些实施方案中,皮肤病是红斑痤疮、银屑病关节炎、真皮纤维化、硬斑病、斯皮茨痣(spitz nevi)、皮肤癣菌病或寻常痤疮。在一些实施方案中,皮肤病是红斑痤疮。在一些实施方案中,红斑痤疮由白细胞介素22(IL-22)或C-X-C基序趋化因子10(CXCL10)或其组合介导。可找到红斑痤疮与IL-22和CXCL10之间的关系,例如参见Buhl等人,J.Invest.Derm.,135(9),P2198-2208(2015),PMID:25848978,所述文献以引用的方式整体并入本文。在一些实施方案中,红斑痤疮由白细胞介素22(IL-22)介导。在一些实施方案中,银屑病由C-X-C基序趋化因子10(CXCL10)介导。在一些实施方案中,皮肤病是由S100a12介导的银屑病。在一些实施方案中,皮肤病是由S100a12介导的银屑病关节炎。在一些实施方案中,皮肤病是由S100a12介导的真皮纤维化。在一些实施方案中,皮肤病是由S100a12介导的硬斑病。在一些实施方案中,皮肤病是由S100a12介导的特应性皮炎。在一些实施方案中,皮肤病是由S100a12介导的斯皮茨痣。
在一些实施方案中,皮肤病是由Defb4介导的银屑病。在一些实施方案中,皮肤病是由Defb4介导的银屑病关节炎。在一些实施方案中,皮肤病是由Defb4介导的皮肤真菌病。在一些实施方案中,皮肤病是由Defb4介导的寻常痤疮。在一些实施方案中,皮肤病是由Defb4介导的化脓性汗腺炎。
在一些实施方案中,皮肤病是由Serpinb4介导的银屑病。在一些实施方案中,皮肤病是由Serpinb4介导的银屑病关节炎。
在一些实施方案中,(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐依序施用。
在一些实施方案中,(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐依序施用。
在一些实施方案中,(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐每天施用至少一次。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐每天施用一次。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐每天施用两次。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐每天施用一次。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐每天施用两次。
在一些实施方案中,(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐作为单独的制剂施用。
在一些实施方案中,(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐作为单一制剂施用。
在一些实施方案中,(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐每天施用一次。
在一些实施方案中,(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐每天施用两次。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐以协同量施用。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐与维生素D3、维生素D3类似物或其药学上可接受的盐之间存在协同作用。
本公开提供了治疗有需要的患者的皮肤病的方法,其包括向患者的受影响区域局部施用(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐,还包括施用额外治疗剂。在一些实施方案中,额外治疗剂是皮质类固醇。
在一些实施方案中,(b)是维生素D3或其药学上可接受的盐。
在一些实施方案中,提供了如本文所述的方法,其中(a)JAK抑制剂或其药学上可接受的盐以治疗有效量施用。
在一些实施方案中,提供了如本文所述的方法,其中(b)维生素D3、维生素D3类似物或其药学上可接受的盐以治疗有效量施用。
在前述每一者的一些实施方案中,患者是人患者。
在一些实施方案中,(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3类似物或其药学上可接受的盐每天施用一次。
在一些实施方案中,(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3类似物或其药学上可接受的盐每天施用至少两次。
在一些实施方案中,(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3类似物或其药学上可接受的盐每天施用至少两次。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐和维生素D3类似物或其药学上可接受的盐各自以局部制剂施用。在一些实施方案中,每种局部制剂是软膏、乳膏或洗剂。在一些实施方案中,JAK抑制剂或其药学上可接受的盐和维生素D3类似物或其药学上可接受的盐处于单一制剂中。在一些实施方案中,单一制剂是乳膏或洗剂。在一些实施方案中,制剂具有约6.0至约8.0、约6.5至约7.5或约6.5至约7.0的pH。
用于方法和局部制剂中的维生素D3和维生素D3类似物
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是具有式(I)的化合物:
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,L是-CH
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是具有式(II)的化合物:
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,L是-CH
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,(b)是维生素D3类似物或其药学上可接受的盐。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是维生素1α-(OH)D3类似物或其药学上可接受的盐。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是维生素1α,25(OH)
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是维生素1α,25(OH)
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是维生素1α,24(OH)
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是维生素1α,26(OH)
如本文所用,“维生素D3”(骨化醇(calcitol);胆钙化醇)具有式(i)的式,编号如下所示。如本文所用,“维生素D衍生物”是指维生素D3(胆钙化醇)、维生素D2(麦角钙化醇)和式(i)的结构类似物,共享由碳1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、20和21形成的支架,其中碳20处的立体化学可以是(R)或(S)。
在一些实施方案中,短语“维生素D3类似物”是指式(i)的结构类似物,共享由碳1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、20和21形成的支架,其中碳20处的立体化学可以是(R)或(S),其中化合物在碳24处不含甲基取代基,并且其中碳3、6、7、8、9、11、12、13、14、15、16、17、20和21处的取代和键合保持不变。在一些实施方案中,碳19处的双键不存在。在一些实施方案中,碳19处的双键存在。在一些实施方案中,碳1可具有与碳3处的羟基的α位的羟基。
如本文所用,短语“维生素1α-(OH)D3类似物”是指式(ii)的结构类似物,共享由碳1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、20和21形成的支架,其中每条点线可以是适当价态限制内的单键、双键或三键,其中化合物在碳24处不含甲基取代基,并且其中在碳3、6、7、8、9、11、12、13、14、15、16、17、20和21处的取代保持不变。在一些实施方案中,碳19处的双键不存在。在一些实施方案中,碳19处的双键存在。
如本文所用,短语“维生素1α,25-(OH)
如本文所用,短语“维生素1α,24-(OH)
如本文所用,短语“维生素1α,26-(OH)
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是具有式(III)的化合物:
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,L是-CH
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐选自骨化二醇、骨化三醇、卡泊三醇、阿法骨化醇、他卡西醇(tacalcitol)、马沙骨化醇(maxacalcitol)、氟骨三醇(falecalcitriol)、艾地骨化醇(eldecalcitol)、依奈骨化醇(inecalcitol)、西奥骨化醇(seocalcitol)、来克骨化醇(lexicalcitol)、20-表-1α,25(OH)
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐选自骨化二醇、骨化三醇、卡泊三醇、阿法骨化醇、他卡西醇、马沙骨化醇、氟骨三醇、艾地骨化醇、依奈骨化醇、西奥骨化醇和来克骨化醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐选自卡泊三醇、他卡西醇、马沙骨化醇和西奥骨化醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是卡泊三醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是马沙骨化醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是他卡西醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是西奥骨化醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是骨化二醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是骨化三醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是阿法骨化醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是氟骨三醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是艾地骨化醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是依奈骨化醇。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是来克骨化醇。
用于方法中的维生素D3或维生素D3类似物的制剂
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐以局部制剂施用。在一些实施方案中,局部制剂是泡沫、软膏、洗剂或乳膏。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐作为局部制剂施用,所述局部制剂包含基于游离碱的制剂的约0.0001重量%至约0.1重量%的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐作为局部制剂施用,所述局部制剂包含基于游离碱的制剂的约0.0001重量%至约0.02重量%的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐作为局部制剂施用,所述局部制剂包含基于游离碱的制剂的约0.0001重量%至约0.005重量%的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐作为局部制剂施用,所述局部制剂包含基于游离碱的制剂的约0.0004重量%至约0.005重量%的维生素D3、维生素D3类似物或其药学上可接受的盐。
在一些实施方案中,维生素D3、维生素D3类似物或其药学上可接受的盐是卡泊三醇,其作为局部制剂施用,所述局部制剂包含约50μg卡泊三醇/克制剂。
在一些实施方案中,局部制剂是泡沫、软膏、洗剂或乳膏。在一些实施方案中,局部制剂还包含二丙酸倍他米松。在一些实施方案中,二丙酸倍他米松以约0.5mg/克制剂的量存在。
在一些实施方案中,维生素D3类似物是他卡西醇,其作为局部制剂施用,所述局部制剂包含约4μg他卡西醇/克制剂。在一些实施方案中,局部制剂是软膏、乳膏或洗剂。
在一些实施方案中,维生素D3类似物是马沙骨化醇,其作为局部制剂施用,所述局部制剂包含约6μg、约12.5μg/g、约25μg或约50μg/克制剂。在一些实施方案中,局部制剂是软膏。
用于方法和局部制剂中的JAK抑制剂
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是抑制JAK1、JAK2、JAK3和/或TYK2的化合物。在一些实施方案中,JAK抑制剂或其药学上可接受的盐选自JAK1抑制剂、JAK2抑制剂、JAK3抑制剂、TYK2抑制剂、JAK1/JAK2抑制剂、泛JAK抑制剂、JAK1/TYK2抑制剂和JAK1/JAK3抑制剂或前述任一者的药学上可接受的盐。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐选自鲁索替尼、巴瑞替尼(baricitinib)、奥拉替尼(oclacitinib)、莫洛替尼(momelotinib)、CTP-543、AH057、甘多替尼(gandotinib)、菲卓替尼(fedratinib)、来他替尼(lestaurtinib)、帕克替尼(pacritinib)、CHZ868、乌帕替尼(upadacitinib)、托法替尼(tofacitinib)、非戈替尼(filgocitinib),阿布昔替尼(abrocitinib)、伊他替尼(itacitinib)、布雷西替尼(brepocitinib)、ATI-501、ATI-1777、ATI-502、迪高替尼(delgocitinib)、培非替尼(peficitinib)、古沙替尼(gusacitinib)、葫芦素I、赛度替尼(cerdulatinib)、迪西替尼(decernotinib)、BMS-986165和利特昔替尼(ritlecitinib)或其药学上可接受的盐。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是JAK1抑制剂或其药学上可接受的盐。
在一些实施方案中,JAK1抑制剂是选择性JAK1抑制剂或其药学上可接受的盐。JAK1在许多细胞因子和生长因子信号传导通路中起着核心作用,所述信号传导通路失调时会引起或导致疾病状态。例如,在类风湿性关节炎中IL-6水平升高,在所述疾病中它已被证明具有有害作用(参见例如Fonesca等人,Autoimmunity Reviews,8:538-42,2009)。因为IL-6至少部分地通过JAK1发出信号,所以IL-6可间接通过JAK1抑制而产生潜在的临床益处(参见例如Guschin等人Embo J 14:1421,1995;和Smolen等人Lancet 371:987,2008)。在其他自身免疫性疾病和癌症中,激活JAK1的炎性细胞因子的全身水平升高也可能导致疾病和/或相关症状。因此,患有此类疾病的患者可能会受益于JAK1抑制。JAK1的选择性抑制剂可能是有效的,同时避免了抑制其他JAK激酶的不必要的和潜在的不良影响,如本文所述。在一些实施方案中,JAK1抑制剂对JAK1的选择性优先于JAK2(例如,具有>1的JAK2/JAK1IC
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是JAK2抑制剂或其药学上可接受的盐。
在一些实施方案中,JAK2抑制剂是选择性JAK2抑制剂或其药学上可接受的盐。在一些实施方案中,如通过在1mM ATP下测量IC
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是JAK3抑制剂或其药学上可接受的盐。
在一些实施方案中,JAK3抑制剂是选择性JAK3抑制剂或其药学上可接受的盐。在一些实施方案中,如通过在1mM ATP下测量IC
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是TYK2抑制剂或其药学上可接受的盐。
在一些实施方案中,TYK2抑制剂是选择性TYK2抑制剂或其药学上可接受的盐。在一些实施方案中,如通过在1mM ATP下测量IC
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是JAK1/JAK2抑制剂或其药学上可接受的盐。
在一些实施方案中,JAK1/JAK2抑制剂或其药学上可接受的盐对JAK1和JAK2的选择性超过对JAK3和TYK2的选择性。在一些实施方案中,JAK1/JAK2抑制剂或其药学上可接受的盐对JAK1和JAK2的选择性超过对JAK3的选择性。在一些实施方案中,化合物或盐对JAK1和JAK2的选择性是对JAK3的选择性的约10倍。在一些实施方案中,如通过在1mM ATP下测量IC
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是泛JAK抑制剂或其药学上可接受的盐。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是JAK1/TYK2抑制剂或其药学上可接受的盐。
在一些实施方案中,如通过在1mM ATP下测量IC
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是JAK1/JAK3抑制剂或其药学上可接受的盐。
在一些实施方案中,如通过在1mM ATP下测量IC
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是鲁索替尼或其药学上可接受的盐。鲁索替尼是一种JAK1/JAK2抑制剂。鲁索替尼在1mM ATP下对JAK1和JAK2的IC
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是磷酸鲁索替尼。在一些实施方案中,JAK抑制剂或其药学上可接受的盐是1:1鲁索替尼磷酸盐。磷酸盐可如美国专利8,722,693中所述制备,所述专利以引用的方式整体并入本文。
在一些实施方案中,鲁索替尼或其盐作为局部制剂施用。在一些实施方案中,局部制剂包含基于游离碱的制剂的约0.05重量%至约3.0重量%、约0.05重量%至约1.5重量%、约0.05重量%至约1重量%、约0.05重量%至约0.5重量%、约0.1重量%至约3.0重量%、约0.1重量%至约2.0重量%、约0.1重量%至约1.5重量%、约0.1重量%至约1.0重量%、约0.1重量%至约0.5重量%、约0.5重量%至约2.0重量%、约0.5重量%至约1.5重量%或约0.5重量%至约1.0重量%的鲁索替尼或其药学上可接受的盐。在一些实施方案中,局部制剂包含基于游离碱的制剂的约0.5重量%至约1.5重量%的鲁索替尼或其药学上可接受的盐。在一些实施方案中,局部制剂包含基于游离碱的制剂的约0.05重量%、约0.06重量%、约0.07重量%、约0.08重量%、约0.09重量%、约0.1重量%、约0.15重量%、约0.2重量%、约0.25重量%、约0.3重量%、约0.35重量%、约0.4重量%、约0.45重量%、约0.5重量%、约0.55重量%、约0.6重量%、约0.65重量%、约0.7重量%、约0.75重量%、约0.8重量%、约0.85重量%、约0.9重量%、约0.95重量%、约1.0重量%、约1.05重量%、约1.1重量%、约1.15重量%、约1.2重量%、约1.25重量%、约1.3重量%、约1.35重量%、约1.4重量%、约1.45重量%、约1.5重量%、约1.55重量%、约1.6重量%、约1.65重量%、约1.7重量%、约1.75重量%、约1.8重量%、约1.85重量%、约1.9重量%、约1.95重量%、约2.0重量%、约2.5重量%或约3.0重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是鲁索替尼或其药学上可接受的盐,其中一个或多个氢原子被氘原子替换。在一些实施方案中,JAK抑制剂或其药学上可接受的盐是美国专利9,249,149中的任何化合物或其药学上可接受的盐,所述专利以引用的方式整体并入本文。在一些实施方案中,JAK抑制剂或其药学上可接受的盐是CTP-543(具有以下结构)或其药学上可接受的盐。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是式IV化合物:
或其药学上可接受的盐,其中:
R
每个R
每个R
R
每个R
R
CTP-543是式IV化合物,其是JAK1/JAK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是选自下表中的以下化合物100-130的式IV化合物(其中R
/>
/>
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是巴瑞替尼或其药学上可接受的盐。巴瑞替尼是一种JAK1/JAK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是巴瑞替尼或其药学上可接受的盐,其中一个或多个氢原子被氘原子替换。在一些实施方案中,JAK抑制剂或其药学上可接受的盐是美国专利9,540,367(所述专利以引用的方式整体并入本文)中的任何化合物或其药学上可接受的盐。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是奥拉替尼或其药学上可接受的盐。奥拉替尼是一种JAK1/JAK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是莫洛替尼或其药学上可接受的盐。莫洛替尼是一种JAK1/JAK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是AH057或其药学上可接受的盐。AH057是一种JAK1/JAK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是甘多替尼或其药学上可接受的盐。甘多替尼是一种JAK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是菲卓替尼或其药学上可接受的盐。菲卓替尼是一种JAK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是来他替尼或其药学上可接受的盐。来他替尼是一种JAK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是帕克替尼或其药学上可接受的盐。帕克替尼是一种JAK2抑制剂,其还抑制fms样酪氨酸激酶3(FLT3)。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是CHZ868或其药学上可接受的盐。CHZ868是一种JAK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是乌帕替尼或其药学上可接受的盐。乌帕替尼是一种JAK1抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是非戈替尼或其药学上可接受的盐。非戈替尼是一种JAK1抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是阿布昔替尼或其药学上可接受的盐。阿布昔替尼是一种JAK1抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是伊他替尼或其药学上可接受的盐。伊他替尼是一种JAK1抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是JAK1抑制剂(其是表1的化合物)或其药学上可接受的盐。表1中的化合物是JAK1选择性抑制剂(例如,选择性超过JAK2、JAK3和TYK2)。表1中示出了通过实施例1的方法在1mM ATP下获得的IC
表1.
/>
/>
/>
/>
/>
/>
/>
/>
+意指<10nM(测定条件参见实施例1)
++意指≤100nM(测定条件参见实施例1)
+++意指≤300nM(测定条件参见实施例1)
a
b
在一些实施方案中,JAK1抑制剂或其药学上可接受的盐是{1-{1-[3-氟-2-(三氟甲基)异烟碱酰基]哌啶-4-基}-3[4-(7H-吡咯并[2,3-d]嘧啶-4-基)-1H-吡唑-1-基]氮杂环丁烷-3-基}乙腈或其药学上可接受的盐。在一些实施方案中,JAK1抑制剂或其药学上可接受的盐是一种JAK1抑制剂,其是{1-{1-[3-氟-2-(三氟甲基)异烟碱酰基]哌啶-4-基}-3[4-(7H-吡咯并[2,3-d]嘧啶-4-基)-1H-吡唑-1-基]氮杂环丁烷-3-基}乙腈己二酸盐。{1-{1-[3-氟-2-(三氟甲基)异烟碱酰基]哌啶-4-基}-3[4-(7H-吡咯并[2,3-d]嘧啶-4-基)-1H-吡唑-1-基]氮杂环丁烷-3-基}乙腈及其己二酸盐的合成和制备可在例如2011年3月9日提交的美国专利公布号2011/0224190、2012年9月6日提交的美国专利公布号2013/0060026和2014年3月5日提交的美国专利公布号2014/0256941中找到,所述专利各自以引用的方式整体并入本文。
在一些实施方案中,JAK1抑制剂或其药学上可接受的盐是一种JAK1抑制剂,其是4-[3-(氰基甲基)-3-(3',5'-二甲基-1H,1'H-4,4'-二吡唑-1-基)氮杂环丁烷-1-基]-2,5-二氟-N-[(1S)-2,2,2-三氟-1-甲基乙基]苯甲酰胺或其药学上可接受的盐。在一些实施方案中,JAK1抑制剂或其药学上可接受的盐是一种JAK1抑制剂,其是4-[3-(氰基甲基)-3-(3',5'-二甲基-1H,1'H-4,4'-二吡唑-1-基)氮杂环丁烷-1-基]-2,5-二氟-N-[(1S)-2,2,2-三氟-1-甲基乙基]苯甲酰胺磷酸盐。在一些实施方案中,JAK1抑制剂或其药学上可接受的盐是4-[3-(氰基甲基)-3-(3',5'-二甲基-1H,1'H-4,4'-二吡唑-1-基)氮杂环丁烷-1-基]-2,5-二氟-N-[(1S)-2,2,2-三氟-1-甲基乙基]苯甲酰胺盐酸盐。在一些实施方案中,JAK1抑制剂或其药学上可接受的盐是4-[3-(氰基甲基)-3-(3',5'-二甲基-1H,1'H-4,4'-二吡唑-1-基)氮杂环丁烷-1-基]-2,5-二氟-N-[(1S)-2,2,2-三氟-1-甲基乙基]苯甲酰胺氢溴酸盐。在一些实施方案中,JAK1抑制剂或其药学上可接受的盐是4-[3-(氰基甲基)-3-(3',5'-二甲基-1H,1'H-4,4'-二吡唑-1-基)氮杂环丁烷-1-基]-2,5-二氟-N-[(1S)-2,2,2-三氟-1-甲基乙基]苯甲酰胺硫酸盐。4-[3-(氰基甲基)-3-(3',5'-二甲基-1H,1'H-4,4'-二吡唑-1-基)氮杂环丁烷-1-基]-2,5-二氟-N-[(1S)-2,2,2-三氟-1-甲基乙基]苯甲酰胺及其磷酸盐的合成与制备可在例如2014年5月16日提交的美国专利公布号US2014/0343030中找到,所述专利以引用的方式整体并入本文。
在一些实施方案中,JAK1抑制剂或其药学上可接受的盐是((2R,5S)-5-{2-[(1R)-1-羟乙基]-1H-咪唑并[4,5-d]噻吩并[3,2-b]吡啶-1-基}四氢-2H-吡喃-2-基)乙腈或其药学上可接受的盐。
在一些实施方案中,JAK1抑制剂或其药学上可接受的盐是((2R,5S)-5-{2-[(1R)-1-羟乙基]-1H-咪唑并[4,5-d]噻吩并[3,2-b]吡啶-1-基}四氢-2H-吡喃-2-基)乙腈一水合物或其药学上可接受的盐。((2R,5S)-5-{2-[(1R)-1-羟乙基]-1H-咪唑并[4,5-d]噻吩并[3,2-b]吡啶-1-基}四氢-2H-吡喃-2-基)乙腈的合成及其无水和一水合物形式的表征描述于2013年10月31日提交的美国专利公布号2014/0121198和2015年4月29日提交的美国专利公布号2015/0344497,所述专利各自以引用方式整体并入本文。
在一些实施方案中,表1的化合物是通过描述于以下专利中的合成程序制备的:2011年3月9日提交的美国专利公布号2011/0224190、2014年5月16日提交的美国专利公布号2014/0343030、2013年10月31日提交的美国专利公布号2014/0121198、2010年5月21日提交的美国专利公布号2010/0298334、2010年8月31日提交的美国专利公布号2011/0059951、2011年11月18日提交的美国专利公布号2012/0149681、2011年11月18日提交的美国专利公布号2012/0149682、2012年6月19日提交的美国专利公布2013/0018034、2012年8月17日提交的美国专利公布号2013/0045963和2013年5月17日提交的美国专利号2014/0005166,所述专利各自以引用的方式整体并入本文。
在一些实施方案中,JAK1抑制剂或其药学上可接受的盐选自以下专利的化合物或其药学上可接受的盐:2011年3月9日提交的美国专利公布号2011/0224190、2014年5月16日提交的美国专利公布号2014/0343030、2013年10月31日提交的美国专利公布号2014/0121198、2010年5月21日提交的美国专利公布号2010/0298334、2010年8月31日提交的美国专利公布号2011/0059951、2011年11月18日提交的美国专利公布号2012/0149681、2011年11月18日提交的美国专利公布号2012/0149682、2012年6月19日提交的美国专利公布2013/0018034、2012年8月17日提交的美国专利公布号2013/0045963和2013年5月17日提交的美国专利号2014/0005166,所述专利各自以引用的方式整体并入本文。
在一些实施方案中,JAK抑制剂是布雷西替尼或其药学上可接受的盐。布雷西替尼是一种JAK1/JAK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是ATI-501或其药学上可接受的盐。ATI-501(Aclaris)是一种JAK1/JAK3抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是ATI-1777或其药学上可接受的盐。ATI-1777(Aclaris)是一种JAK1/JAK3抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是ATI-502或其药学上可接受的盐。ATI-502(Aclaris)是一种JAK1/JAK3抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是托法替尼或其药学上可接受的盐。托法替尼抑制JAK1和JAK3。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是迪高替尼或其药学上可接受的盐。迪高替尼是一种泛JAK抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是培非替尼或其药学上可接受的盐。培非替尼是一种泛JAK抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是古沙替尼或其药学上可接受的盐。古沙替尼是一种泛JAK抑制剂,还可抑制SYK。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是葫芦素I或其药学上可接受的盐。葫芦素I是一种泛JAK抑制剂,还抑制STAT3。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是赛度替尼或其药学上可接受的盐。赛度替尼是一种泛JAK抑制剂,还抑制脾酪氨酸激酶(SYK)。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是迪西替尼或其药学上可接受的盐。迪西替尼是一种JAK3抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是具有以下结构的BMS-986165:
或其药学上可接受的盐。BMS-986165是一种TYK2抑制剂。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐是利特昔替尼或其药学上可接受的盐。利特昔替尼(Pfizer)是一种JAK3抑制剂,其还抑制TEC。
在一些实施方案中,提供了如本文所述的方法,其中JAK抑制剂或其药学上可接受的盐选自鲁索替尼、奥拉替尼、巴瑞替尼、莫洛替尼和CTP-543或其药学上可接受的盐。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐选自鲁索替尼、奥拉替尼、巴瑞替尼、莫洛替尼、CTP-543、甘多替尼、菲卓替尼、来他替尼、帕克替尼、乌帕替尼、托法替尼、非戈替尼,阿布昔替尼、伊他替尼、布雷西替尼、ATI-501、ATI-1777、ATI-502、迪高替尼、培非替尼、古沙替尼、葫芦素I和赛度替尼或其药学上可接受的盐。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐选自鲁索替尼、奥拉替尼、巴瑞替尼、莫洛替尼、CTP-543、甘多替尼、菲卓替尼、来他替尼、帕克替尼、乌帕替尼、托法替尼、非戈替尼,阿布昔替尼、伊他替尼、布雷西替尼、迪高替尼、培非替尼、古沙替尼、葫芦素I和赛度替尼或其药学上可接受的盐。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐可以是同位素标记的化合物或其药学上可接受的盐。“同位素标记的”或“放射性标记的”化合物是一种化合物,其中一个或多个原子被原子质量或质量数不同于自然界中通常发现的(即天然存在的)原子质量或质量数的原子替换或取代。可掺入本公开的化合物中的合适的放射性核素包括但不限于
因此,在一些实施方案中,JAK抑制剂或其药学上可接受的盐是一种化合物或其药学上可接受的盐,其中所述化合物中的一个或多个氢原子被氘原子替换。
在一些实施方案中,提供了如本文所述的方法,其中JAK抑制剂或其药学上可接受的盐与如本文所述的任何JAK抑制剂或其药学上可接受的盐组合。
在一些实施方案中,提供了如本文所述的方法,其中(a)JAK抑制剂或其药学上可接受的盐以治疗有效量施用。
在一些实施方案中,JAK抑制剂或其药学上可接受的盐作为局部制剂施用。在一些实施方案中,局部制剂包含基于游离碱的制剂的约0.1重量%至约3.0重量%、约0.1重量%至约2.0重量%、约0.1重量%至约1.5重量%、约0.1重量%至约1.0重量%、约0.1重量%至约0.5重量%、约0.5重量%至约2.0重量%、约0.5重量%至约1.5重量%或约0.5重量%至约1.0重量%的JAK抑制剂或其药学上可接受的盐。在一些实施方案中,局部制剂包含基于游离碱的制剂的约0.5重量%至约1.5重量%的JAK抑制剂或其药学上可接受的盐。在一些实施方案中,局部制剂包含基于游离碱的制剂的约0.05重量%、约0.1重量%、约0.15重量%、约0.2重量%、约0.25重量%、约0.3重量%、约0.35重量%、约0.4重量%、约0.45重量%、约0.5重量%、约0.55重量%、约0.6重量%、约0.65重量%、约0.7重量%、约0.75重量%、约0.8重量%、约0.85重量%、约0.9重量%、约0.95重量%、约1.0重量%、约1.05重量%、约1.1重量%、约1.15重量%、约1.2重量%、约1.25重量%、约1.3重量%、约1.35重量%、约1.4重量%、约1.45重量%、约1.5重量%、约1.55重量%、约1.6重量%、约1.65重量%、约1.7重量%、约1.75重量%、约1.8重量%、约1.85重量%、约1.9重量%、约1.95重量%、约2.0重量%、约2.5重量%或约3.0重量%的JAK抑制剂或其药学上可接受的盐。
鲁索替尼的乳膏配方
在一些实施方案中,鲁索替尼或其药学上可接受的盐作为包含鲁索替尼或其药学上可接受的盐的乳膏制剂施用。
在一些实施方案中,鲁索替尼或其药学上可接受的盐作为包含磷酸鲁索替尼的乳膏制剂施用。
在一些实施方案中,鲁索替尼或其药学上可接受的盐呈乳膏制剂的形式。在一些实施方案中,乳膏制剂是水包油乳液。在一些实施方案中,乳膏制剂描述于美国专利10,758,543中,所述专利以引用的方式整体并入。具体地说,美国专利10,758,543的实施例3-6(并且特别是表3-5和随附文本)以引用的方式并入本文。在一些实施方案中,乳膏包含基于游离碱的乳液的约0.1重量%至约3.0重量%、约0.1重量%至约3.0重量%、约0.1重量%至约1.5重量%、约0.1重量%至约1.0重量%、约0.1重量%至约0.5重量%、约0.5重量%至约2.0%重量%、约0.5重量%至约1.5重量%、约0.5重量%至约1.4重量%、约0.5重量%至约1.3重量%、约0.5重量%至约1.2重量%、约0.5重量%至约1.1重量%、约0.6重量%至约2.0%重量%、约0.6重量%至约1.5重量%、约0.6重量%至约1.4重量%、约0.6重量%至约1.3重量%、约0.6重量%至约1.2重量%、约0.6重量%至约1.1重量%、约0.7重量%至约2.0%重量%、约0.7重量%至约1.5重量%、约0.7重量%至约1.4重量%、约0.7重量%至约1.3重量%、约0.7重量%至约1.2重量%、约0.7重量%至约1.1重量%、约0.8重量%至约2.0%重量%、约0.8重量%至约1.5重量%、约0.8重量%至约1.4重量%、约0.8重量%至约1.3重量%、约0.8重量%至约1.2重量%、约0.8重量%至约1.1重量%、约0.9重量%至约2.0%重量%、约0.9重量%至约1.5重量%、约0.9重量%至约1.4重量%、约0.9重量%至约1.3重量%、约0.9重量%至约1.2重量%、约0.9重量%至约1.1重量%、约1.0重量%至约2.0%重量%、约1.0重量%至约1.5重量%、约1.0重量%至约1.4重量%、约1.0重量%至约1.3重量%、约1.0重量%至约1.2重量%、约1.0重量%至约1.1重量%或约0.5重量%至约1.0%的鲁索替尼或其药学上可接受的盐。在一些实施方案中,水包油乳液包含基于游离碱的乳液的约0.5重量%至约1.5重量%的鲁索替尼或其药学上可接受的盐。在一些实施方案中,水包油乳液包含基于游离碱的乳液的约0.05重量%、约0.1重量%、约0.15重量%、约0.2重量%、约0.25重量%、约0.3重量%、约0.35重量%、约0.4重量%、约0.45重量%、约0.5重量%、约0.55重量%、约0.6重量%、约0.65重量%、约0.7重量%、约0.75重量%、约0.8重量%、约0.85重量%、约0.9重量%、约0.95重量%、约1.0重量%、约1.05重量%、约1.1重量%、约1.15重量%、约1.2重量%、约1.25重量%、约1.3重量%、约1.35重量%、约1.4重量%、约1.45重量%、约1.5重量%、约1.55重量%、约1.6重量%、约1.65重量%、约1.7重量%、约1.75重量%、约1.8重量%、约1.85重量%、约1.9重量%、约1.95重量%或约2.0重量%的鲁索替尼或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
在一些实施方案中,乳膏制剂具有约6.5至约7.0的pH。
在一些实施方案中,乳膏制剂具有约2.8至约3.9的pH。
在一些实施方案中,乳膏制剂具有约2.8至约3.6的pH。
在一些实施方案中,乳膏包括包含鲁索替尼的水包油乳液。
在一些实施方案中,乳膏包括包含磷酸鲁索替尼的水包油乳液。在一些实施方案中,乳膏是如US2015/0250790中所述的水包油乳液,所述专利以引用的方式整体并入本文。具体地说,US2015/0250790的实施例3-6(并且特别是表3-5和随附文本)以引用的方式并入本文。
在一些实施方案中,油组分以乳液的约10重量%至约40重量%的量存在。
在一些实施方案中,油组分以乳液的约10重量%至约24重量%的量存在。
在一些实施方案中,油组分以乳液的约15重量%至约24重量%的量存在。
在一些实施方案中,油组分以乳液的约18重量%至约24重量%的量存在。
在一些实施方案中,油组分包含一种或多种独立地选自以下的物质:凡士林、脂肪醇、矿物油、甘油三酯和硅油。
在一些实施方案中,油组分包含一种或多种独立地选自以下的物质:白凡士林、鲸蜡醇、硬脂醇、轻质矿物油、中链甘油三酯和聚二甲基硅氧烷。
在一些实施方案中,油组分包含封闭剂组分。
在一些实施方案中,封闭剂组分以乳液的约2重量%至约15重量%的量存在。
在一些实施方案中,封闭剂组分以乳液的约5重量%至约10重量%的量存在。
在一些实施方案中,封闭剂组分包含一种或多种选自以下的物质:脂肪酸(例如,羊毛脂酸)、脂肪醇(例如,羊毛脂醇)、烃油和蜡(例如,凡士林)、多元醇(例如,丙二醇)、聚硅氧烷(例如,聚二甲基硅氧烷)、甾醇(例如,胆固醇)、植物或动物脂肪(例如,可可脂)、植物蜡(例如,巴西棕榈蜡)和蜡酯(例如,蜂蜡)。
在一些实施方案中,封闭剂组分包含一种或多种选自以下的物质:羊毛脂酸脂肪醇、羊毛脂醇、凡士林、丙二醇、聚二甲基硅氧烷、胆固醇、可可脂、巴西棕榈蜡和蜂蜡。
在一些实施方案中,封闭剂组分包含凡士林。
在一些实施方案中,封闭剂组分包含白凡士林。
在一些实施方案中,白凡士林以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,白凡士林以乳液的约7重量%的量存在。
在一些实施方案中,油组分包含硬化剂组分。
在一些实施方案中,硬化剂组分以乳液的约2重量%至约8重量%的量存在。
在一些实施方案中,硬化剂组分以乳液的约3重量%至约6重量%的量存在。
在一些实施方案中,硬化剂组分以乳液的约4重量%至约7重量%的量存在。
在一些实施方案中,硬化剂组分包含一种或多种独立地选自脂肪醇的物质。
在一些实施方案中,硬化剂组分包含一种或多种独立地选自C
在一些实施方案中,硬化剂组分包含一种或多种独立地选自C
在一些实施方案中,硬化剂组分包含一种或多种独立地选自鲸蜡醇和硬脂醇的物质。
在一些实施方案中,鲸蜡醇以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,鲸蜡醇的量为乳液的约3重量%。
在一些实施方案中,硬脂醇以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,硬脂醇以乳液的约1.75重量%的量存在。
在一些实施方案中,硬化剂组分包含一种或多种独立地选自以下的物质:鲸蜡醇、硬脂醇、油醇和鲸蜡硬脂醇。
在一些实施方案中,鲸蜡硬脂醇以乳液的约0.1重量%至约30重量%的量存在。
在一些实施方案中,鲸蜡硬脂醇以乳液的约1重量%至约20重量%的量存在。
在一些实施方案中,油组分包含润肤剂组分。
在一些实施方案中,润肤剂组分以乳液的约5重量%至约15重量%的量存在。
在一些实施方案中,润肤剂组分以乳液的约7重量%至约13重量%的量存在。
在一些实施方案中,润肤剂组分包含一种或多种独立地选自矿物油和甘油三酯的物质。
在一些实施方案中,润肤剂组分包含一种或多种独立地选自轻质矿物油和中链甘油三酯的物质。
在一些实施方案中,轻质矿物油以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,轻质矿物油以乳液的约4重量%的量存在。
在一些实施方案中,润肤剂组分包含一种或多种独立地选自轻质矿物油、中链甘油三酯和聚二甲基硅氧烷的物质。
在一些实施方案中,聚二甲基硅氧烷以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,聚二甲基硅氧烷以乳液的约1重量%的量存在。
在一些实施方案中,中链甘油三酯的量为乳液的约0.1重量%至约15重量%。
在一些实施方案中,中链甘油三酯的量为乳液的约7.0重量%。
在一些实施方案中,水以乳液的约35重量%至约65重量%的量存在。
在一些实施方案中,水以乳液的约40重量%至约60重量%的量存在。
在一些实施方案中,水以乳液的约45重量%至约55重量%的量存在。
在一些实施方案中,乳化剂组分以乳液的约1重量%至约9重量%的量存在。
在一些实施方案中,乳化剂组分以乳液的约2重量%至约6重量%的量存在。
在一些实施方案中,乳化剂组分以乳液的约3重量%至约5重量%的量存在。
在一些实施方案中,乳化剂组分以乳液的约4重量%至约7重量%的量存在。
在一些实施方案中,乳液包含乳化剂组分和硬化剂组分,其中乳化剂组分和硬化剂组分的组合量为乳液的至少约8重量%。
在一些实施方案中,乳化剂组分包含一种或多种独立地选自甘油脂肪酸酯和脱水山梨糖醇脂肪酸酯的物质。
在一些实施方案中,乳化剂组分包含一种或多种独立地选自硬脂酸甘油酯和聚山梨醇酯20的物质。
在一些实施方案中,硬脂酸甘油酯以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,硬脂酸甘油酯以乳液的约3重量%的量存在。
在一些实施方案中,聚山梨醇酯20以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,聚山梨醇酯20以乳液的约1.25重量%的量存在。
在一些实施方案中,乳化剂组分包含非离子表面活性剂。
在一些实施方案中,非离子表面活性剂是聚西托醇1000或泊洛沙姆407。
在一些实施方案中,聚西托醇1000以乳液的约0.01重量%至约15重量%的量存在。
在一些实施方案中,聚西托醇1000以乳液的约0.1重量%至约10重量%的量存在。
在一些实施方案中,泊洛沙姆是泊洛沙姆407。
在一些实施方案中,泊洛沙姆407以乳液的约0.01重量%至约15重量%的量存在。
在一些实施方案中,乳化剂组分还包含硬脂酸甘油酯和PEG-100硬脂酸酯,诸如Arlacel
在一些实施方案中,硬脂酸甘油酯和PEG-100硬脂酸酯以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,乳液还包含稳定剂组分。
在一些实施方案中,稳定剂组分以乳液的约0.05重量%至约5重量%的量存在。
在一些实施方案中,稳定剂组分以乳液的约0.1重量%至约2重量%的量存在。
在一些实施方案中,稳定剂组分以乳液的约0.3重量%至约0.5重量%的量存在。
在一些实施方案中,稳定剂组分包含一种或多种独立地选自多糖的物质。
在一些实施方案中,稳定剂组分包含黄原胶。
在一些实施方案中,黄原胶以乳液的约0.001重量%至约5重量%的量存在。
在一些实施方案中,黄原胶以乳液的约0.2重量%至约0.6重量%的量存在。
在一些实施方案中,黄原胶以乳液的约0.4重量%的量存在。
在一些实施方案中,乳液还包含溶剂组分。
在一些实施方案中,溶剂组分以乳液的约10重量%至约35重量%的量存在。
在一些实施方案中,溶剂组分以乳液的约15重量%至约30重量%的量存在。
在一些实施方案中,溶剂组分以乳液的约20重量%至约25重量%的量存在。
在一些实施方案中,溶剂组分包含一种或多种独立地选自亚烷基二醇和聚亚烷基二醇的物质。
在一些实施方案中,溶剂组分包含一种或多种独立地选自丙二醇和聚乙二醇的物质。
在一些实施方案中,溶剂组分包含一种或多种独立地选自PEG200、PEG300、PEG400、丙二醇的物质。
在一些实施方案中,溶剂组分包含PEG300和丙二醇。
在一些实施方案中,PEG300以乳液的约7重量%w/w的量存在。
在一些实施方案中,溶剂是PEG400和丙二醇的组合。
在一些实施方案中,PEG400以乳液的约7重量%的量存在。
在一些实施方案中,丙二醇以乳液的约6.5重量%的量存在。在一些实施方案中,溶剂组分包含二乙二醇单乙醚,诸如
在一些实施方案中,乳液还包含:
乳液的约35重量%至约65重量%的水;
乳液的约10重量%至约40重量%的油组分;
乳液的约1重量%至约9重量%的乳化剂组分;
乳液的约10重量%至约35重量%的溶剂组分;以及
乳液的约0.05重量%至约5重量%的稳定剂组分。
在一些实施方案中,乳液包含:
乳液的约35重量%至约65重量%的水;
乳液的约10重量%至约40重量%的油组分;
乳液的约1重量%至约9重量%的乳化剂组分;
乳液的约10重量%至约35重量%的溶剂组分;
乳液的约0.05重量%至约5重量%的稳定剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液还包含:
乳液的约35重量%至约65重量%的水;
乳液的约10重量%至约24重量%的油组分;
乳液的约1重量%至约9重量%的乳化剂组分;
乳液的约10重量%至约35重量%的溶剂组分;以及
乳液的约0.05重量%至约5重量%的稳定剂组分。
在一些实施方案中,乳液包含:
乳液的约35重量%至约65重量%的水;
乳液的约10重量%至约24重量%的油组分;
乳液的约1重量%至约9重量%的乳化剂组分;
乳液的约10重量%至约35重量%的溶剂组分;
乳液的约0.05重量%至约5重量%的稳定剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液还包含:
乳液的约40重量%至约60重量%的水;
乳液的约15重量%至约30重量%的油组分;
乳液的约2重量%至约6重量%的乳化剂组分;
乳液的约15重量%至约30重量%的溶剂组分;以及
乳液的约0.1重量%至约2重量%的稳定剂组分。
在一些实施方案中,乳液包含:
乳液的约40重量%至约60重量%的水;
乳液的约15重量%至约30重量%的油组分;
乳液的约2重量%至约6重量%的乳化剂组分;
乳液的约15重量%至约30重量%的溶剂组分;
乳液的约0.1重量%至约2重量%的稳定剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液还包含:
乳液的约40重量%至约60重量%的水;
乳液的约15重量%至约30重量%的油组分;
乳液的约2重量%至约6重量%的乳化剂组分;
乳液的约15重量%至约24重量%的溶剂组分;以及
乳液的约0.1重量%至约2重量%的稳定剂组分。
在一些实施方案中,乳液包含:
乳液的约40重量%至约60重量%的水;
乳液的约15重量%至约30重量%的油组分;
乳液的约2重量%至约6重量%的乳化剂组分;
乳液的约15重量%至约24重量%的溶剂组分;
乳液的约0.1重量%至约2重量%的稳定剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液还包含:
乳液的约45重量%至约55重量%的水;
乳液的约15重量%至约24重量%的油组分;
乳液的约3重量%至约5重量%的乳化剂组分;乳液的约20重量%至约25重量%的溶剂组分;以及
乳液的约0.3重量%至约0.5重量%的稳定剂组分。
在一些实施方案中,乳液包含:
乳液的约45重量%至约55重量%的水;
乳液的约15重量%至约24重量%的油组分;
乳液的约3重量%至约5重量%的乳化剂组分;乳液的约20重量%至约25重量%的溶剂组分;
乳液的约0.3重量%至约0.5重量%的稳定剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液还包含:
乳液的约45重量%至约55重量%的水;
乳液的约15重量%至约24重量%的油组分;
乳液的约4重量%至约7重量%的乳化剂组分;乳液的约20重量%至约25重量%的溶剂组分;以及
乳液的约0.3重量%至约0.5重量%的稳定剂组分。
在一些实施方案中,乳液包含:
乳液的约45重量%至约55重量%的水;
乳液的约15重量%至约24重量%的油组分;
乳液的约4重量%至约7重量%的乳化剂组分;乳液的约20重量%至约25重量%的溶剂组分;
乳液的约0.3重量%至约0.5重量%的稳定剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中:
油组分包含一种或多种独立地选自以下的物质:凡士林、脂肪醇、矿物油、甘油三酯和聚二甲基硅氧烷;
乳化剂组分包含一种或多种独立地选自甘油脂肪酸酯和脱水山梨糖醇脂肪酸酯的物质;
溶剂组分包含一种或多种独立地选自亚烷基二醇和聚亚烷基二醇的物质;并且
稳定剂组分包含一种或多种独立地选自多糖的物质。
在一些实施方案中:
油组分包含一种或多种独立地选自以下的物质:白凡士林、鲸蜡醇、硬脂醇、轻质矿物油、中链甘油三酯和聚二甲基硅氧烷;
乳化剂组分包含一种或多种独立地选自硬脂酸甘油酯和聚山梨醇酯20的物质;
溶剂组分包含一种或多种独立地选自丙二醇和聚乙二醇的物质;并且
稳定剂组分包含黄原胶。
在一些实施方案中,乳液还包含:
乳液的约35重量%至约65重量%的水;
乳液的约2重量%至约15重量%的封闭剂组分;
乳液的约2重量%至约8重量%的硬化剂组分;
乳液的约5重量%至约15重量%的润肤剂组分;
乳液的约1重量%至约9重量%的乳化剂组分;以及
乳液的约0.05重量%至约5重量%的稳定剂组分。
乳液的约10重量%至约35重量%的溶剂组分;在一些实施方案中,乳液包含:
乳液的约35重量%至约65重量%的水;
乳液的约2重量%至约15重量%的封闭剂组分;
乳液的约2重量%至约8重量%的硬化剂组分;
乳液的约5重量%至约15重量%的润肤剂组分;
乳液的约1重量%至约9重量%的乳化剂组分;
乳液的约0.05重量%至约5重量%的稳定剂组分;
乳液的约10重量%至约35重量%的溶剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液还包含:
乳液的约40重量%至约60重量%的水;
乳液的约5重量%至约10重量%的封闭剂组分;
乳液的约2重量%至约8重量%的硬化剂组分;
乳液的约7重量%至约12重量%的润肤剂组分;
乳液的约2重量%至约6重量%的乳化剂组分;
乳液的约0.1重量%至约2重量%的稳定剂;以及
乳液的约15重量%至约30重量%的溶剂组分。
在一些实施方案中,乳液包含:
乳液的约40重量%至约60重量%的水;
乳液的约5重量%至约10重量%的封闭剂组分;
乳液的约2重量%至约8重量%的硬化剂组分;
乳液的约7重量%至约12重量%的润肤剂组分;
乳液的约2重量%至约6重量%的乳化剂组分;
乳液的约0.1重量%至约2重量%的稳定剂;
乳液的约15重量%至约30重量%的溶剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液还包含:
乳液的约45重量%至约55重量%的水;
乳液的约5重量%至约10重量%的封闭剂组分;
乳液的约3重量%至约6重量%的硬化剂组分;
乳液的约7重量%至约13重量%的润肤剂组分;
乳液的约3重量%至约5重量%的乳化剂组分;
乳液的约0.3重量%至约0.5重量%的稳定剂组分;以及
乳液的约20重量%至约25重量%的溶剂组分。
在一些实施方案中,乳液包含:
乳液的约45重量%至约55重量%的水;
乳液的约5重量%至约10重量%的封闭剂组分;
乳液的约3重量%至约6重量%的硬化剂组分;
乳液的约7重量%至约13重量%的润肤剂组分;
乳液的约3重量%至约5重量%的乳化剂组分;
乳液的约0.3重量%至约0.5重量%的稳定剂组分;
乳液的约20重量%至约25重量%的溶剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液还包含:
乳液的约45重量%至约55重量%的水;
乳液的约5重量%至约10重量%的封闭剂组分;
乳液的约4重量%至约7重量%的硬化剂组分;
乳液的约7重量%至约13重量%的润肤剂组分;
乳液的约4重量%至约7重量%的乳化剂组分;
乳液的约0.3重量%至约0.5重量%的稳定剂组分;以及
乳液的约20重量%至约25重量%的溶剂组分。
在一些实施方案中,乳液包含:
乳液的约45重量%至约55重量%的水;
乳液的约5重量%至约10重量%的封闭剂组分;
乳液的约4重量%至约7重量%的硬化剂组分;
乳液的约7重量%至约13重量%的润肤剂组分;
乳液的约4重量%至约7重量%的乳化剂组分;
乳液的约0.3重量%至约0.5重量%的稳定剂组分;
乳液的约20重量%至约25重量%的溶剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液还包含:
乳液的约45重量%至约55重量%的水;
乳液的约7重量%的封闭剂组分;
乳液的约4.5重量%至约5重量%的硬化剂组分;
乳液的约10重量%的润肤剂组分;
乳液的约4重量%至约4.5重量%的乳化剂组分;
乳液的约0.4重量%的稳定剂组分;以及
乳液的约22重量%的溶剂组分。
在一些实施方案中,乳液包含:
乳液的约45重量%至约55重量%的水;
乳液的约7重量%的封闭剂组分;
乳液的约4.5重量%至约5重量%的硬化剂组分;
乳液的约10重量%的润肤剂组分;
乳液的约4重量%至约4.5重量%的乳化剂组分;
乳液的约0.4重量%的稳定剂组分;
乳液的约22重量%的溶剂组分;以及
基于游离碱的乳液的0.5重量%至1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,鲁索替尼或其药学上可接受的盐作为磷酸鲁索替尼存在。
在一些实施方案中,乳液包含乳液的1.5重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液包含乳液的1.5重量%的磷酸鲁索替尼。
在一些实施方案中,乳液包含乳液的1.1重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液包含乳液的1.1重量%的磷酸鲁索替尼。
在一些实施方案中,乳液包含乳液的0.75重量%的鲁索替尼或其药学上可接受的盐。
在一些实施方案中,乳液包含乳液的0.75重量%的磷酸鲁索替尼。
在一些实施方案中,硬化剂组分和乳化剂组分的组合量为乳液的至少约8重量%。
在一些实施方案中:
封闭剂组分包含凡士林;
硬化剂组分包含一种或多种独立地选自一种或多种脂肪醇的物质;
润肤剂组分包含一种或多种独立地选自矿物油和甘油三酯的物质;
乳化剂组分包含一种或多种独立地选自甘油脂肪酸酯和脱水山梨糖醇脂肪酸酯的物质;
稳定剂组分包含一种或多种独立地选自多糖的物质;并且
溶剂组分包含一种或多种独立地选自亚烷基二醇和聚亚烷基二醇的物质。
在一些实施方案中:
封闭剂组分包含白凡士林;
硬化剂组分包含一种或多种独立地选自鲸蜡醇和硬脂醇的物质;
润肤剂组分包含一种或多种独立地选自轻质矿物油、中链甘油三酯和聚二甲基硅氧烷的物质;
乳化剂组分包含一种或多种独立地选自硬脂酸甘油酯和聚山梨醇酯20的物质;
稳定剂组分包含黄原胶;并且
溶剂组分包含一种或多种独立地选自丙二醇和聚乙二醇的物质。
在一些实施方案中,乳液还包含抗微生物防腐剂组分。
在一些实施方案中,抗微生物防腐剂组分以乳液的约0.05重量%至约3重量%的量存在。
在一些实施方案中,抗微生物防腐剂组分以乳液重量的约0.1重量%至约1重量%的量存在。
在一些实施方案中,抗微生物防腐剂组分包含一种或多种独立地选自对羟基苯甲酸烷基酯和苯氧乙醇的物质。
在一些实施方案中,抗微生物防腐剂组分包含一种或多种独立地选自对羟基苯甲酸甲酯、对羟基苯甲酸丙酯和苯氧乙醇的物质。
在一些实施方案中,抗微生物防腐剂组分包含对羟基苯甲酸甲酯和对羟基苯甲酸丙酯。
在一些实施方案中,对羟基苯甲酸甲酯以乳液的约0.001重量%至约5重量%的量存在。
在一些实施方案中,对羟基苯甲酸甲酯以乳液的约0.1重量%的量存在。
在一些实施方案中,对羟基苯甲酸丙酯以乳液的约0.001重量%至约5重量%的量存在。
在一些实施方案中,对羟基苯甲酸丙酯以乳液的约0.05重量%的量存在。
在一些实施方案中,苯氧乙醇以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,苯氧乙醇以乳液的约0.5重量%的量存在。
在一些实施方案中,苯氧乙醇以乳液的约0.1重量%至约10重量%的量存在。
在一些实施方案中,将乳膏的pH调节至约4.0、约5.5或约7.0。
在一些实施方案中,将乳膏的pH调节至约4.0、约5.5、约6.5或约7.0。
在一些实施方案中,将乳膏的pH调节至约6.5至约7.0的范围。
在一些实施方案中,将乳膏的pH用三乙醇胺和/或磷酸调节。在一些实施方案中,将乳膏的pH用三乙醇胺调节。在一些实施方案中,将乳膏的pH用磷酸调节。在一些实施方案中,将乳膏的pH用三乙醇胺和磷酸调节。
在一些实施方案中,乳液还包含抗氧化剂。
在一些实施方案中,抗氧化剂是丁基化羟基甲苯(BHT)、丁基化羟基茴香醚(BHA)或生育酚或其组合。
在一些实施方案中,乳液还包含螯合剂组分。
在一些实施方案中,螯合剂组分包含乙二胺四乙酸二钠。
在一些实施方案中,乙二胺四乙酸二钠以乳液的约0.001重量%至约5重量%的量存在。
在一些实施方案中,乙二胺四乙酸二钠以乳液的约0.001重量%至约1重量%的量存在。
在一些实施方案中,乳液还包含卡泊三醇稳定剂。
在一些实施方案中,卡泊三醇稳定剂是抗坏血酸棕榈酸酯、抗坏血酸或柠檬酸或其组合。
在一些实施方案中,乳液还包含保湿剂。
在一些实施方案中,保湿剂是甘油。
在一些实施方案中,甘油以乳液的约0.01重量%至约20重量%的量存在。
在一些实施方案中,甘油以乳液的约0.1重量%至约20重量%的量存在。
在一些实施方案中,乳液还包含表面活性剂。
在一些实施方案中,表面活性剂是聚山梨醇酯80。在一些实施方案中,聚山梨醇酯80以乳液的约0.01重量%至约15重量%的量存在。在一些实施方案中,聚山梨醇酯80以乳液的约0.1重量%至约15重量%的量存在。
鲁索替尼可如美国专利7,598,257和美国专利公布号2009/0181959中所述制备,所述专利各自以引用的方式整体并入本文。鲁索替尼的1:1磷酸盐可如美国专利号2008/0312259中所述制备,所述专利以引用的方式整体并入本文。
应当理解,本文所述的乳膏(乳液)的一些组分可具有多种功能。例如,给定的物质可同时充当乳化剂组分和稳定剂。在一些此类情况下,给定组分的功能可被认为是单一的,即使其特性可能允许多种功能。在一些实施方案中,制剂的每个组分包含不同的物质或物质的混合物。
药物制剂(固定剂量组合)
本文所提供和描述的药物制剂可用于本公开中描述的方法。
上文所述的JAK抑制剂、维生素D3或维生素D3类似物或前述任一者的药学上可接受的盐的浓度也可用于如下所述的固定剂量组合制剂中。如本文所用,“用于局部治疗皮肤病的药物制剂”和“局部制剂”可互换使用。
本公开进一步提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D衍生物或其药学上可接受的盐。
本公开还提供了用于局部治疗皮肤病的药物制剂,其包含(a)鲁索替尼或其药学上可接受的盐和(b)维生素D衍生物或其药学上可接受的盐。
本公开进一步提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)磷酸鲁索替尼或其药学上可接受的盐和(b)维生素D衍生物或其药学上可接受的盐。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开进一步提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐以基于游离碱的制剂的约0.05重量%、约0.06重量%、约0.07重量%、约0.08重量%、约0.09重量%、约0.1重量%、约0.15重量%、约0.2重量%、约0.25重量%、约0.3重量%、约0.35重量%、约0.4重量%、约0.45重量%、约0.5重量%、约0.55重量%、约0.6重量%、约0.65重量%、约0.7重量%、约0.75重量%、约0.8重量%、约0.85重量%、约0.9重量%、约0.95重量%、约1.0重量%、约1.05重量%、约1.1重量%、约1.15重量%、约1.2重量%、约1.25重量%、约1.3重量%、约1.35重量%、约1.4重量%、约1.45重量%、约1.5重量%、约1.55重量%、约1.6重量%、约1.65重量%、约1.7重量%、约1.75重量%、约1.8重量%、约1.85重量%、约1.9重量%、约1.95重量%、约2.0重量%、约2.5重量%或约3.0重量%的量存在。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)磷酸鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.1%w/w的鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL至约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL至约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL至约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.1%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL至约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约10μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约10μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.1%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约10μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.1%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约10μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.0001%w/w至约0.01%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.0001%w/w至约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.0001%w/w至约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.1%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.0001%w/w至约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.0001%w/w至约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.1%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
前述段落中描述的制剂,其中维生素D3、维生素D3类似物或其药学上可接受的盐是维生素D3类似物或其药学上可接受的盐。在一些实施方案中,维生素D3类似物或其药学上可接受的盐选自骨化二醇、骨化三醇、卡泊三醇、阿法骨化醇、他卡西醇、马沙骨化醇、氟骨三醇、艾地骨化醇、依奈骨化醇、西奥骨化醇、来克骨化醇、20-表-1α,25(OH)
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)约0.005%w/w的卡泊三醇。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)约0.005%w/w的卡泊三醇。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)约0.005%w/w的卡泊三醇。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
本公开还提供了一种用于局部治疗皮肤病的药物制剂,其包含(a)基于游离碱约1.1%w/w的鲁索替尼或其药学上可接受的盐和(b)约0.005%w/w的卡泊三醇。在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
在一些实施方案中,本文所述的药物制剂是乳膏。在一些实施方案中,上文所述的鲁索替尼的乳膏制剂也可用于如下所述的固定剂量组合制剂中。
在一些实施方案中,本文所述的药物制剂是洗剂。
在一些实施方案中,本文所述的药物制剂还包含水。在一些实施方案中,水占药物制剂的约5重量%至约90重量%。在一些实施方案中,水占药物制剂的约10重量%至约80重量%。在一些实施方案中,水占药物制剂的约10重量%至约70重量%。在一些实施方案中,水占药物制剂的约10重量%至约60重量%。在一些实施方案中,水占药物制剂的约20重量%至约70重量%。在一些实施方案中,水占药物制剂的约20重量%至约60重量%。在一些实施方案中,水占药物制剂的约20重量%至约50重量%。在一些实施方案中,水占药物制剂的约5重量%至约90重量%、约10重量%至约80重量%、约10重量%至约70重量%、约10重量%至约60重量%、约20重量%至约70重量%、约20重量%至约60重量%或约20重量%至约50重量%。
在一些实施方案中,本文所述的药物制剂具有不超过约3.6的pH。在一些实施方案中,本文所述的药物制剂具有约2.7至约3.9的pH。在一些实施方案中,本文所述的药物制剂具有约2.7至约3.6的pH。在一些实施方案中,本文所述的药物制剂具有约4至约8的pH。在一些实施方案中,本文所述的药物制剂具有约6.0至约7.0的pH。在一些实施方案中,本文所述的药物制剂具有约6.5至约7.0的pH。在一些实施方案中,本文所述的药物制剂具有约6.5至约7.5的pH。
在一些实施方案中,本文所述的药物制剂是水包油乳液。
在一些实施方案中,水包油乳液包含水、油组分和乳化剂或稳定剂组分。在一些实施方案中,水包油乳液包含水、油组分和乳化剂组分。
在一些实施方案中,水占药物制剂的约5重量%至约90重量%。在一些实施方案中,水占药物制剂的约10重量%至约80重量%。在一些实施方案中,水占药物制剂的约10重量%至约70重量%。在一些实施方案中,水占药物制剂的约10重量%至约60重量%。在一些实施方案中,水占药物制剂的约20重量%至约70重量%。在一些实施方案中,水占药物制剂的约20重量%至约60重量%。在一些实施方案中,水占药物制剂的约20重量%至约50重量%。在一些实施方案中,水占药物制剂的约5重量%至约90重量%、约10重量%至约80重量%、约10重量%至约70重量%、约10重量%至约60重量%、约20重量%至约70重量%、约20重量%至约60重量%或约20重量%至约50重量%。
在一些实施方案中,油组分占药物制剂的约5重量%至约90重量%。在一些实施方案中,油组分占药物制剂的约5重量%至约80重量%。在一些实施方案中,油组分占药物制剂的约5重量%至约70重量%。在一些实施方案中,油组分占药物制剂的约5重量%至约60重量%。在一些实施方案中,油组分占药物制剂的约5重量%至约50重量%。在一些实施方案中,油组分占药物制剂的约5重量%至约40重量%。在一些实施方案中,油组分占药物制剂的约5重量%至约30重量%。在一些实施方案中,油组分占药物制剂的约5重量%至约20重量%。在一些实施方案中,油组分占药物制剂的约5重量%至约90重量%、约5重量%至约80重量%、约5重量%至约70重量%、约5重量%至约60重量%、约5重量%至50重量%或约5重量%至约40重量%。在一些实施方案中,油组分包含脂肪醇、坚果油和/或矿物油。在一些实施方案中,油组分包含本文所述的油组分之一,包括润肤剂、硬化剂或其他油组分。
在一些实施方案中,乳化剂或稳定剂组分占药物制剂的约1重量%至约30重量%。在一些实施方案中,乳化剂或稳定剂组分占药物制剂的约5重量%至约25重量%。在一些实施方案中,乳化剂或稳定剂组分占药物制剂的约1重量%至约30重量%。在一些实施方案中,乳化剂或稳定剂组分占药物制剂的约1重量%至约30重量%或约5重量%至约25重量%。在一些实施方案中,乳化剂组分包含非离子表面活性剂。在一些实施方案中,乳化剂或稳定剂组分包含聚山梨醇酯、泊洛沙姆、脂肪醇、聚乙二醇脂肪醚、甘油脂肪酸酯和/或聚乙二醇脂肪酸酯。在一些实施方案中,乳化剂或稳定剂组分包含本文所述的乳化剂、稳定剂或表面活性剂中的一种。
在一些实施方案中,乳化剂或稳定剂组分包含非离子表面活性剂。在一些实施方案中,非离子表面活性剂是聚西托醇1000或泊洛沙姆407。
在一些实施方案中,药物制剂还包含用于溶解鲁索替尼或其药学上可接受的盐的溶剂组分。在一些实施方案中,溶剂组分占药物制剂的约1重量%至约40重量%。在一些实施方案中,溶剂组分占药物制剂的约2重量%至约30重量%。在一些实施方案中,溶剂组分占药物制剂的约5重量%至约30重量%。在一些实施方案中,溶剂组分占药物制剂的约5重量%至约25重量%。在一些实施方案中,溶剂组分占药物制剂的约5重量%至约20重量%。在一些实施方案中,溶剂组分占药物制剂的约10重量%至约20重量%。在一些实施方案中,溶剂组分占药物制剂的约5重量%至约20重量%、约2重量%至约30重量%、约5重量%至约30重量%、约5重量%至约25重量%、约5重量%至约20重量%或约10重量%至约20重量%。在一些实施方案中,溶剂组分包含二乙二醇单乙醚,诸如
在一些实施方案中,药物制剂还包含抗氧化剂。在一些实施方案中,抗氧化剂是丁基化羟基甲苯(BHT)、丁基化羟基茴香醚(BHA)或生育酚或其组合。在一些实施方案中,抗氧化剂占药物制剂的约0.01重量%至约10重量%、约0.01重量%至约5重量%、约0.01重量%至约2重量%、约0.01重量%至约1重量%或约0.1重量%至约10重量%。
在一些实施方案中,将pH调节至约6.0至约7.0、约6.5至约7.0。在一些实施方案中,将pH用三乙醇胺调节。
在一些实施方案中,油组分以乳液的约10重量%至约40重量%的量存在。
在一些实施方案中,油组分以乳液的约15重量%至约30重量%的量存在。
在一些实施方案中,油组分以乳液的约20重量%至约28重量%的量存在。
在一些实施方案中,油组分包含一种或多种独立地选自以下的物质:凡士林、脂肪醇、矿物油、甘油三酯和硅油。
在一些实施方案中,油组分包含一种或多种独立地选自以下的物质:白凡士林、鲸蜡醇、硬脂醇、轻质矿物油、中链甘油三酯和聚二甲基硅氧烷。
在一些实施方案中,油组分包含封闭剂组分。
在一些实施方案中,封闭剂以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,封闭剂组分以乳液的约2重量%至约15重量%的量存在。
在一些实施方案中,封闭剂组分以乳液的约5重量%至约10重量%的量存在。
在一些实施方案中,封闭剂组分包含一种或多种选自以下的物质:脂肪酸(例如,羊毛脂酸)、脂肪醇(例如,羊毛脂醇)、烃油和蜡(例如,凡士林)、多元醇(例如,丙二醇)、聚硅氧烷(例如,聚二甲基硅氧烷)、甾醇(例如,胆固醇)、植物或动物脂肪(例如,可可脂)、植物蜡(例如,巴西棕榈蜡)和蜡酯(例如,蜂蜡)。
在一些实施方案中,封闭剂组分包含一种或多种选自以下的物质:羊毛脂酸脂肪醇、羊毛脂醇、凡士林、丙二醇、聚二甲基硅氧烷、胆固醇、可可脂、巴西棕榈蜡和蜂蜡。
在一些实施方案中,封闭剂组分包含凡士林。
在一些实施方案中,封闭剂组分包含白凡士林。
在一些实施方案中,白凡士林以乳液的约7重量%的量存在。
在一些实施方案中,油组分包含硬化剂组分。
在一些实施方案中,硬化剂组分以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,硬化剂组分以乳液的约2重量%至约8重量%的量存在。
在一些实施方案中,硬化剂组分以乳液的约3重量%至约6重量%的量存在。
在一些实施方案中,硬化剂组分包含一种或多种独立地选自脂肪醇的物质。
在一些实施方案中,硬化剂组分包含一种或多种独立地选自C12-20脂肪醇的物质。
在一些实施方案中,硬化剂组分包含一种或多种独立地选自C16-18脂肪醇的物质。
在一些实施方案中,硬化剂组分包含一种或多种独立地选自鲸蜡醇和硬脂醇的物质。
在一些实施方案中,鲸蜡醇以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,鲸蜡醇的量为乳液的约3重量%。
在一些实施方案中,硬脂醇以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,硬脂醇以乳液的约1.75重量%的量存在。
在一些实施方案中,油组分包含润肤剂组分。
在一些实施方案中,润肤剂组分以乳液的约0.1重量%至约20重量%的量存在。
在一些实施方案中,润肤剂组分以乳液的约5重量%至约20重量%的量存在。
在一些实施方案中,润肤剂组分以乳液的约10重量%至约15重量%的量存在。
在一些实施方案中,润肤剂组分包含一种或多种独立地选自矿物油、甘油三酯和硅油的物质。
在一些实施方案中,润肤剂组分包含一种或多种独立地选自轻质矿物油、中链甘油三酯和聚二甲基硅氧烷的物质。
在一些实施方案中,轻质矿物油以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,轻质矿物油以乳液的约4重量%的量存在。
在一些实施方案中,聚二甲基硅氧烷以乳液的约1重量%的量存在。
在一些实施方案中,中链甘油三酯的量为乳液的约7重量%。
在一些实施方案中,中链甘油三酯的量为乳液的约10重量%。
在一些实施方案中,润肤剂组分包含一种或多种独立地选自矿物油、甘油三酯、硅油和坚果油的物质。
在一些实施方案中,坚果油是杏仁油。在一些实施方案中,杏仁油是甜杏仁油。在一些实施方案中,甜杏仁油以乳液的约0.1重量%至约15重量%的量存在。在一些实施方案中,甜杏仁油以乳液的约0.1重量%至约10重量%的量存在。
在一些实施方案中,水以乳液的约20重量%至约80重量%的量存在。
在一些实施方案中,水以乳液的约35重量%至约65重量%的量存在。
在一些实施方案中,水以乳液的约45重量%至约65重量%的量存在。
在一些实施方案中,乳化剂组分以乳液的约0.5重量%至约15重量%的量存在。
在一些实施方案中,乳化剂组分以乳液的约1重量%至约10重量%的量存在。
在一些实施方案中,乳化剂组分以乳液的约2重量%至约6重量%的量存在。
在一些实施方案中,乳化剂组分以乳液的约3重量%至约5重量%的量存在。
在一些实施方案中,乳液包含乳化剂组分和硬化剂组分,其中乳化剂组分和硬化剂组分的组合量为乳液的至少约8重量%。
在一些实施方案中,乳化剂组分包含一种或多种非离子乳化剂。
在一些实施方案中,乳化剂组分包含一种或多种独立地选自甘油脂肪酸酯和脱水山梨糖醇脂肪酸酯的物质。
在一些实施方案中,乳化剂组分包含一种或多种独立地选自硬脂酸甘油酯和聚山梨醇酯20的物质。
在一些实施方案中,硬脂酸甘油酯以乳液的约3重量%的量存在。
在一些实施方案中,聚山梨醇酯20以乳液的约1.25重量%的量存在。
在一些实施方案中,乳液还包含稳定剂组分。
在一些实施方案中,稳定剂组分以乳液的约0.05重量%至约5重量%的量存在。
在一些实施方案中,稳定剂组分以乳液的约0.1重量%至约2重量%的量存在。
在一些实施方案中,稳定剂组分以乳液的约0.3重量%至约0.5重量%的量存在。
在一些实施方案中,稳定剂组分包含一种或多种独立地选自多糖的物质。
在一些实施方案中,稳定剂组分包含黄原胶。
在一些实施方案中,乳液还包含溶剂组分。在一些实施方案中,溶剂组分是用于JAK抑制剂(例如,鲁索替尼)或其药学上可接受的盐的溶剂。
在一些实施方案中,溶剂组分以乳液的约1重量%至约35重量%的量存在。
在一些实施方案中,溶剂组分以乳液的约5重量%至约25重量%的量存在。
在一些实施方案中,溶剂组分以乳液的约10重量%至约20重量%的量存在。
在一些实施方案中,溶剂组分包含一种或多种独立地选自亚烷基二醇和聚亚烷基二醇的物质。
在一些实施方案中,溶剂组分包含一种或多种独立地选自丙二醇和聚乙二醇的物质。
在一些实施方案中,溶剂组分包含一种或多种独立地选自PEG200、PEG300、PEG400和丙二醇的物质。
在一些实施方案中,溶剂组分包含PEG300和丙二醇。
在一些实施方案中,PEG300以乳液的约7重量%的量存在。
在一些实施方案中,溶剂是PEG400和丙二醇的组合。
在一些实施方案中,PEG400以乳液的约7重量%的量存在。
在一些实施方案中,丙二醇以乳液的约6.5重量%的量存在。
在一些实施方案中,水包油乳液还包含:
乳液的约20重量%至约80重量%的水;
乳液的约10重量%至约40重量%的油组分;
乳液的约1重量%至约10重量%的乳化剂组分;
乳液的约1重量%至约35重量%的溶剂组分;以及
乳液的约0.05重量%至约5重量%的稳定剂组分。
在一些实施方案中,水包油乳液还包含:
乳液的约35重量%至约65重量%的水;
乳液的约15重量%至约35重量%的油组分;
乳液的约2重量%至约6重量%的乳化剂组分;
乳液的约5重量%至约25重量%的溶剂组分;以及
乳液的约0.05重量%至约5重量%的稳定剂组分。
在一些实施方案中,水包油乳液还包含:
乳液的约40重量%至约65重量%的水;
乳液的约20重量%至约28重量%的油组分;
乳液的约3重量%至约5重量%的乳化剂组分;
乳液的约10重量%至约20重量%的溶剂组分;以及
乳液的约0.1重量%至约2重量%的稳定剂组分。
在一些实施方案中,水包油乳液还包含:
乳液的约40重量%至约65重量%的水;
乳液的约20重量%至约28重量%的油组分;
乳液的约3重量%至约5重量%的乳化剂组分;
乳液的约10重量%至约20重量%的溶剂组分;以及
乳液的约0.3重量%至约0.5重量%的稳定剂组分。
在一些实施方案中,本文所述的药物制剂是包括包含水、油组分和乳化剂组分的水包油乳液的水包油乳液,其中:
油组分包含一种或多种独立地选自以下的物质:凡士林、脂肪醇、矿物油、甘油三酯和聚二甲基硅氧烷;
乳化剂组分包含一种或多种独立地选自甘油脂肪酸酯和脱水山梨糖醇脂肪酸酯的物质;
溶剂组分包含一种或多种独立地选自亚烷基二醇和聚亚烷基二醇的物质;并且
稳定剂组分包含一种或多种独立地选自多糖的物质。
在一些实施方案中,本文所述的药物制剂是包括包含水、油组分和乳化剂组分的水包油乳液的水包油乳液,其中:
油组分包含一种或多种独立地选自以下的物质:白凡士林、鲸蜡醇、硬脂醇、轻质矿物油、中链甘油三酯和聚二甲基硅氧烷;
乳化剂组分包含一种或多种独立地选自硬脂酸甘油酯和聚山梨醇酯20的物质;
溶剂组分包含一种或多种独立地选自丙二醇和聚乙二醇的物质;并且
稳定剂组分包括黄原胶。
在一些实施方案中,乳液还包含抗微生物防腐剂组分。
在一些实施方案中,抗微生物防腐剂组分以乳液的约0.05重量%至约3重量%的量存在。
在一些实施方案中,抗微生物防腐剂组分以乳液重量的约0.1重量%至约1重量%的量存在。
在一些实施方案中,抗微生物防腐剂组分包含一种或多种独立地选自对羟基苯甲酸烷基酯和苯氧乙醇的物质。
在一些实施方案中,抗微生物防腐剂组分包含一种或多种独立地选自对羟基苯甲酸甲酯、对羟基苯甲酸丙酯和苯氧乙醇的物质。
在一些实施方案中,抗微生物防腐剂组分包含对羟基苯甲酸甲酯和对羟基苯甲酸丙酯。
在一些实施方案中,对羟基苯甲酸甲酯以乳液的约0.001重量%至约5重量%的量存在。
在一些实施方案中,对羟基苯甲酸甲酯以乳液的约0.1重量%的量存在。
在一些实施方案中,对羟基苯甲酸丙酯以乳液的约0.001重量%至约5重量%的量存在。
在一些实施方案中,对羟基苯甲酸丙酯以乳液的约0.05重量%的量存在。
在一些实施方案中,苯氧乙醇以乳液的约0.1重量%至约15重量%的量存在。
在一些实施方案中,苯氧乙醇以乳液的约0.5重量%的量存在。
在一些实施方案中,乳膏的pH为约4至约8。
在一些实施方案中,乳膏的pH为约6.5至约7.0。
在一些实施方案中,乳液还包含抗氧化剂。
在一些实施方案中,抗氧化剂是丁基化羟基甲苯(BHT)、丁基化羟基茴香醚(BHA)或生育酚或其组合。
在一些实施方案中,丁基化羟基甲苯以乳液的约0.01重量%至约15重量%w/w的量存在。在一些实施方案中,丁基化羟基甲苯以乳液的约0.1重量%至约10重量%的量存在。在一些实施方案中,丁基化羟基甲苯以乳液的约0.1重量%至约5重量%的量存在。
在一些实施方案中,丁基羟基茴香醚以乳液的约0.001重量%至约5重量%w/w的量存在。在一些实施方案中,丁基羟基茴香醚以乳液的约0.01重量%至约1重量%w/w的量存在。
在一些实施方案中,乳液还包含卡泊三醇稳定剂。
在一些实施方案中,卡泊三醇稳定剂是抗坏血酸棕榈酸酯、抗坏血酸、富马酸或柠檬酸或其组合。
在一些实施方案中,本公开还提供了一种用于局部治疗皮肤病的药物制剂(或者可替代地,如实施方案1-75中任一项所述的方法),其中所述制剂是一种水包油乳液,其包含基于游离碱约1.5%w/w磷酸鲁索替尼、约0.005%w/w卡泊三醇、约55%w/w纯化水、约0.05%w/w EDTA二钠、约7%w/w PEG300、约6.5%w/w丙二醇、约0.1%w/w对羟基苯甲酸甲酯、约0.05%w/w对羟基苯甲酸丙酯、约0.4%w/w黄原胶、约7%w/w白凡士林、约4%w/w轻质矿物油、约3%w/w硬脂酸甘油酯SE、约3%w/w鲸蜡醇、约1.75%w/w硬脂醇、约1%w/w聚二甲基硅氧烷、约7%w/w中链甘油三酯、约1.25%w/w聚山梨酯20和约0.5%w/w苯氧乙醇。
在一些实施方案中,本公开还提供了用于局部治疗皮肤病的药物制剂(或者可替代地,如实施方案1-75中任一项所述的方法),其中所述制剂是一种水包油乳液,其包含基于游离碱约1.5%w/w磷酸鲁索替尼、约0.005%w/w卡泊三醇、约55%w/w纯化水、约0.05%w/w EDTA二钠、约7%w/w PEG400、约6.5%w/w丙二醇、约0.1%w/w对羟基苯甲酸甲酯、约0.05%w/w对羟基苯甲酸丙酯、约0.4%w/w黄原胶、约7%w/w白凡士林、约4%w/w轻质矿物油、约3%w/w硬脂酸甘油酯SE、约3%w/w鲸蜡醇、约1.75%w/w硬脂醇、约1%w/w聚二甲基硅氧烷、约7%w/w中链甘油三酯、约1.25%w/w聚山梨酯20和约0.5%w/w苯氧乙醇。
在一些实施方案中,将本文所述的药物制剂的pH用三乙醇胺(trolamine/triethanolamine)调节。在一些实施方案中,将本文所述的药物制剂的pH用磷酸调节。
在一些实施方案中,上文所述的鲁索替尼的乳液制剂也可用于如下所述的固定剂量组合制剂中。上述局部制剂可以任何合适的组合使用上述任何维生素D衍生物、维生素D3类似物和JAK抑制剂。
如在“局部治疗皮肤病”的上下文中使用的,“局部”意指向皮肤施用。
用于向皮肤施用的局部施用的药物制剂可包括溶液、混悬液、泡沫、软膏、洗剂、乳膏、凝胶、喷雾剂、液体和粉剂。常规药物载剂、水性、粉状或油性基质、增稠剂等可能是必需的或期望的。在一些实施方案中,组合物被配制成用于通过溶液、混悬液、凝胶、乳膏、软膏、洗剂、喷雾剂、泡沫、液体和粉末进行局部施用。
对于本文所述的皮肤病的治疗,能够穿透皮肤屏障并提供有限的全身作用的局部药物是特别重要的。
局部(真皮/真皮内)制剂通常是溶液、混悬液、凝胶、乳膏、软膏、洗剂、喷雾剂和泡沫。优选的局部制剂应为物理和化学稳定的,不会引起皮肤刺激,并且在适当的皮肤层处以会引起治疗反应的浓度递送活性剂,而全身暴露有限。
在一些实施方案中,施用是局部的并且包括具有一种或多种药学上(例如,皮肤病学上)可接受的赋形剂的制剂。皮肤病学上可接受的赋形剂的实例包括但不限于pH调节剂、螯合剂、防腐剂、共溶剂、渗透促进剂、保湿剂、增稠剂、胶凝剂、增粘剂、表面活性剂、推进剂、芳香剂、着色剂或其任何组合或混合物。在一些实施方案中,将局部制剂局部施用于患者(例如,在损伤部位处施用)。
在一些实施方案中,pH调节剂选自酸、酸盐、碱、碱盐和缓冲剂或其任何混合物。示例性酸包括但不限于乳酸、乙酸、柠檬酸和苯甲酸及其盐。示例性缓冲剂包括但不限于柠檬酸盐/柠檬酸、乙酸盐/乙酸、依地酸盐/依地酸、乳酸盐/乳酸等。
在一些实施方案中,螯合剂是单一赋形剂。在一些实施方案中,螯合剂是两种或更多种螯合剂的混合物。示例性螯合剂包括但不限于乙二胺四乙酸(EDTA)或其盐。在一些实施方案中,螯合剂包含螯合剂和抗氧化剂的混合物,其中螯合剂和抗氧化剂防止组合物中的氧化降解反应、使其最小化或减少所述反应。示例性抗氧化剂包括但不限于丁基化羟基甲苯(BHT)、丁基化羟基茴香醚(BHA)、生育酚和没食子酸丙酯。
在一些实施方案中,组合物包含一种或多种防腐剂。在一些实施方案中,组合物包含两种或更多种防腐剂的混合物。在一些实施方案中,组合物包含一至五种防腐剂。示例性防腐剂包括但不限于苯甲醇、苯氧乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯和咪唑烷基脲。
在一些实施方案中,组合物包含一种或多种共溶剂。在一些实施方案中,组合物包含两种或更多种共溶剂的混合物。在一些实施方案中,组合物包含一至五种共溶剂。示例性溶剂包括但不限于水、丙二醇(propylene glycol)、二乙二醇单乙醚、异山梨醇二甲醚、乙醇、异丙醇、苯甲醇、丙二醇(propanediol)、丙二醇(propylene glycol)、聚乙二醇(例如,聚乙二醇200、聚乙二醇300、聚乙二醇400等)。在一些实施方案中,溶剂是非水溶性剂。示例性非水溶性剂包括但不限于癸二酸二乙酯、己二酸二异丙酯、肉豆蔻酸异丙酯、棕榈酸异丙酯和中链甘油三酯。
在一些实施方案中,组合物包含一种或多种渗透促进剂。在一些实施方案中,组合物包含两种或更多种渗透促进剂的混合物。在一些实施方案中,组合物包含一至五种渗透促进剂。渗透促进剂可充当溶剂和渗透促进剂两者。示例性渗透促进剂包括但不限于脂肪酸、脂肪酸酯、脂肪醇、吡咯烷酮、亚砜、醇、二醇和多元醇或其任何混合物。在一些实施方案中,本文所提供的共溶剂是渗透促进剂。
在一些实施方案中,组合物包含一种或多种增稠剂、胶凝剂或增粘剂。在一些实施方案中,组合物包含两种或更多种增稠剂、胶凝剂或增粘剂的混合物。在一些实施方案中,组合物包含一至五种增稠剂、胶凝剂或增粘剂。示例性增稠剂、胶凝剂或增粘剂包括但不限于纤维素衍生物(例如,羟乙基纤维素(HEC)、羧甲基纤维素、羟丙基纤维素(HPC)和羟丙基甲基纤维素(HPMC)和聚乙烯吡咯烷酮(PVP)。
表面活性剂是降低两种液体之间或液体与固体之间的表面张力的化合物。表面活性剂可以是两种或更多种表面活性剂的混合物。示例性表面活性剂包括但不限于乙氧基化脂肪醇醚(例如,硬脂醇聚醚-2、硬脂醇聚醚-10、硬脂醇聚醚-20、鲸蜡硬脂醇聚醚-2、鲸蜡硬脂醇聚醚-10等)、PEG酯(例如,PEG-4二月桂酸酯、PEG-20硬脂酸酯等)、甘油酯或其衍生物(例如,二油酸甘油酯、硬脂酸甘油酯等)、聚合醚(例如,泊洛沙姆124、泊洛沙姆181、泊洛沙姆182、泊洛沙姆407等)、脱水山梨糖醇衍生物(例如,聚山梨醇酯80、脱水山梨糖醇单硬脂酸酯等)、脂肪醇(例如,鲸蜡醇、硬脂醇、鲸蜡硬脂醇等)和乳化蜡(例如,乳化蜡NF、鲸蜡硬脂醇混合物和聚山梨酯60的混合物等)。
局部(例如,真皮内)施用提供了局部治疗如本文所述的皮肤病和/或皮肤病症的优点,使与全身暴露相关的潜在不良事件最小化,并且允许在需要时更容易地中断治疗。另外,一些局部剂型(诸如乳膏、软膏和凝胶)具有可充当润肤剂或封闭剂的赋形剂的优点,可提高患者在治疗期间的健康状况和依从性。其他剂量途径(诸如口服、胃肠外和吸入)可能会导致全身药物水平超过治疗范围、不良事件发生的可能性增加、药物间相互作用以及活性/毒性代谢物的产生,这可能导致治疗中断和患者依从性不足。
旨在用于真皮递送的局部制剂通常是溶液、混悬液、凝胶、乳膏、软膏、洗剂、喷雾剂和泡沫,并且可含有一种或多种如本文所述的常规载剂。制剂组合物的制备应以将活性成分递送至适当的皮肤层、使全身暴露最小化和防止皮肤刺激为目标。另外,药物组合物应为物理和化学稳定的。根据所选择的剂型,可能需要一种或多种如本文所述的额外赋形剂,例如pH调节剂、螯合剂、防腐剂、共溶剂、渗透促进剂、保湿剂、增稠剂、胶凝剂、增粘剂、表面活性剂、推进剂、芳香剂、着色剂或其任何组合或混合物。
在一些实施方案中,局部制剂可含有一种或多种如本文所述的常规载剂。在一些实施方案中,软膏可含有水和一种或多种选自例如液体石蜡、聚氧乙烯烷基醚、丙二醇、白凡士林等的疏水性载剂。乳膏的载剂组合物可以基于水与甘油和一种或多种其他组分例如甘油单硬脂酸酯、PEG-甘油单硬脂酸酯和鲸蜡硬脂醇的组合。凝胶可使用异丙醇和水配制,适当地与其他组分诸如例如甘油、羟乙基纤维素等组合。
向患者施用的组合物可呈上述药物组合物的形式。这些组合物可通过常规灭菌技术灭菌,或者可无菌过滤。水溶液可按原样包装使用或冻干,冻干制剂在施用之前与无菌水性载剂组合。
本发明要求保护的主题的组合物还可包含一种或多种额外药剂,其实例在上文中列出。
组合疗法
本文所述的方法还可包括施用一种或多种额外治疗剂。可同时或依序向患者施用一种或多种额外治疗剂。
在一些实施方案中,额外治疗剂是抗生素。在一些实施方案中,抗生素是克林霉素、多西环素、米诺环素、甲氧苄氨嘧啶-磺胺甲噁唑、红霉素、甲硝唑、利福平、莫西沙星、氨苯砜或其组合。在一些实施方案中,抗生素是克林霉素、多西环素、米诺环素、甲氧苄氨嘧啶-磺胺甲噁唑或红霉素与甲硝唑的组合。在一些实施方案中,抗生素是利福平、莫西沙星和甲硝唑的组合。在一些实施方案中,抗生素是莫西沙星和利福平的组合。
在一些实施方案中,额外治疗剂是类视黄醇。在一些实施方案中,类视黄醇是阿达帕林、依曲替酯、阿维A或异维甲酸。
在一些实施方案中,额外治疗剂是类固醇。在一些实施方案中,额外治疗剂是皮质类固醇。在一些实施方案中,类固醇是诸如去炎松、地塞米松、氟轻松、可的松、泼尼松、泼尼松龙或氟米龙。
在一些实施方案中,额外治疗剂是免疫抑制剂。在一些实施方案中,免疫抑制剂是甲氨蝶呤或环孢菌素A。在一些实施方案中,免疫抑制剂是霉酚酸酯或霉酚酸钠。
在一些实施方案中,额外治疗剂是壬二酸。
在一些实施方案中,额外治疗剂用于局部治疗。在一些实施方案中,额外治疗剂用于治疗银屑病、特应性皮炎、秃头、白癜风、赖特氏综合征、毛发红糠疹、单纯性大疱性表皮松解症、掌跖角化病、先天性厚甲、多发性皮脂囊肿、皮肤扁平苔藓、皮肤T细胞淋巴瘤、化脓性汗腺炎、接触性皮炎和鱼鳞癣。在一些实施方案中,额外治疗剂用于治疗特应性皮炎。在一些实施方案中,额外治疗剂是吡美莫司。在一些实施方案中,额外治疗剂用于治疗银屑病。在一些实施方案中,额外治疗剂用于治疗秃头。在一些实施方案中,额外治疗剂用于治疗白癜风。在一些实施方案中,额外治疗剂用于治疗赖特氏综合征。在一些实施方案中,额外治疗剂用于治疗毛发红糠疹。在一些实施方案中,额外治疗剂用于治疗单纯性大疱性表皮松解症。在一些实施方案中,额外治疗剂用于治疗掌跖角化病。在一些实施方案中,额外治疗剂用于治疗先天性厚甲。在一些实施方案中,额外治疗剂用于治疗多发性皮脂囊肿。在一些实施方案中,额外治疗剂用于治疗皮肤扁平苔藓。在一些实施方案中,额外治疗剂用于治疗皮肤T细胞淋巴瘤。在一些实施方案中,额外治疗剂用于治疗化脓性汗腺炎。在一些实施方案中,额外治疗剂用于治疗接触性皮炎。在一些实施方案中,额外治疗剂用于治疗鱼鳞癣。
在一些实施方案中,额外治疗剂是克立硼罗。
在一些实施方案中,额外治疗剂是他克莫司。
在一些实施方案中,额外治疗剂是吡美莫司。
药盒
本公开还包括可用于例如治疗和/或预防如本文所述的皮肤病诸如银屑病、秃头和白癜风的药物药盒,其包括一个或多个含有药物组合物的容器,所述药物组合物包含治疗有效量的如本文所述的鲁索替尼或其药学上可接受的盐。如对于本领域技术人员而言是显而易见的,此类药盒还可根据需要包括一种或多种各种常规药物药盒组件,例如具有一种或多种药学上可接受的载剂的容器、额外容器等。药盒中还可包括指示待施用的组分的量、施用指南和/或用于混合组分的指南的说明书(呈插页形式或呈标签形式)。
还应当理解,为了清楚起见而在单独的实施方案的上下文中描述的本发明要求保护的主题的某些特征还可与单个实施方案组合提供。相反,为了简明起见而在单个实施方案的上下文中描述的本发明要求保护的主题的各种特征还可分开提供或以任何适合的子组合形式提供。
定义
如本文所用,“受影响的皮肤区域”是指患有如本文所述的皮肤病的患者皮肤区域。
如本文所用,“磷酸鲁索替尼”意指鲁索替尼的磷酸盐,其中鲁索替尼和磷酸的比率为1:1。
如本文所用,“乳膏”意指应用于皮肤的乳液状半固体剂型。
如本文所用,单独或与其他术语组合使用的术语“C
如本文所用,术语“协同效应”或“协同作用”当与剂或化合物组合的功效的描述结合使用时,意指所述组合的任何测量的作用,其大于根据个别剂或化合物的作用总和预测的作用。例如,如本文所述,(a)JAK抑制剂或其药学上可接受的盐与(b)维生素D3、维生素D3类似物或其药学上可接受的盐之间存在分别抑制IL-22、MMP12和CXCL10的协同作用,这意指(a)和(b)的组合的总抑制作用大于(a)和(b)单独的抑制作用的总和。
如本文所用,“统计学显著”意指p值<0.05(优选<0.001,并且最优选<0.0001)。
如本文所用,短语“药学上可接受的”意指那些化合物、材料、组合物和/或剂型在合理的医学判断范围内,适用于与人和动物的组织接触。在一些实施方案中,“药学上可接受的”意指由联邦监管机构或州政府批准的或者在美国药典或其他通常认可的药典上列出,以用于动物并且更具体地为用于人。
本发明要求保护的主题还包括本文所述的化合物的药学上可接受的盐。如本文所用,“药学上可接受的盐”是指所公开化合物的衍生物,其中母体化合物通过将现有的酸或碱部分转化为其盐形式而被修饰。药学上可接受的盐的实例包括但不限于碱性残基诸如胺的无机或有机酸盐;酸性残基诸如羧酸的碱金属或有机盐;等等。本发明要求保护的主题的药学上可接受的盐包括例如由无毒无机酸或有机酸形成的母体化合物的常规无毒盐。本发明要求保护的主题的药学上可接受的盐可由含有碱或酸部分的母体化合物通过常规化学方法合成。通常,此类盐可通过将这些化合物的游离酸或碱形式与水中或有机溶剂中或者二者的混合物中化学计算量的适当碱或酸反应来制备;通常优选非水介质诸如醚、乙酸乙酯、乙醇、异丙醇或乙腈(MeCN)。合适的盐的列表可在Remington's PharmaceuticalSciences,第17版,Mack Publishing Company,Easton,Pa.,1985,第1418页和Journal ofPharmaceutical Science,66,2(1977)中找到,所述文献各自以引用的方式整体并入本文。在一些实施方案中,药学上可接受的盐是磷酸盐、硫酸盐或马来酸盐。
如本文所用,术语“乳化剂组分”在一个方面是指一种物质或物质的混合物,其使元素或颗粒保持悬浮在流体介质中。在一些实施方案中,乳化剂组分允许油相在与水合并时形成乳液。在一些实施方案中,乳化剂组分是指一种或多种非离子表面活性剂。
如本文所用,术语“封闭剂组分”是指一种疏水剂或疏水剂的混合物,其在皮肤上形成封闭膜,从而通过防止水从角质层蒸发来减少经表皮水分流失(TEWL)。
如本文所用,术语“硬化剂组分”是指一种物质或物质的混合物,其增加乳膏的粘度和/或稠度或改善乳膏的流变学。
如本文所用,术语“润肤剂组分”是指使皮肤软化或舒缓或使受刺激的内表面舒缓的剂。
如本文所用,术语“稳定剂组分”是指一种物质或物质的混合物,其改善乳膏的稳定性和/或乳膏中组分的相容性。在一些实施方案中,稳定剂组分防止乳液结块并稳定水包油乳液中的液滴。
如本文所用,术语“溶剂组分”是一种液体物质或液体物质的混合物,其能够溶解如本文所述的JAK抑制剂诸如鲁索替尼或其药学上可接受的盐或乳膏中的其他物质。在一些实施方案中,溶剂组分是一种液体物质或液体物质的混合物,鲁索替尼或其药学上可接受的盐在其中具有合理的溶解度。例如,鲁索替尼(游离碱)或其磷酸盐(1:1盐)的溶解度报告于表1中。在一些实施方案中,溶剂是一种物质或其混合物,鲁索替尼或其药学上可接受的盐(无论使用哪个)在其中具有至少约10mg/mL或更大、至少约15mg/mL或更大或至少约20mg/mL或更大的溶解度。
如本文所用,短语“抗微生物防腐剂组分”是一种物质或物质的混合物,其抑制乳膏中的微生物生长。
如本文所用,短语“螯合剂组分”是指一种化合物或化合物的混合物,其具有与金属离子强烈结合的能力。
如本文所用,“乳液的重量%”意指乳液中组分的百分比浓度以w/w为基础。例如,1%w/w的组分A=[(组分A的质量)/(乳液的总质量)]x 100。
如本文所用,如本文所述的JAK抑制剂诸如鲁索替尼或其药学上可接受的盐的“基于游离碱的乳液的重量%”意指%w/w是基于总乳液中鲁索替尼的重量来计算的。例如,磷酸鲁索替尼的“基于游离碱1.5%w/w”意指对于100克总制剂,乳液剂中存在1.98克磷酸鲁索替尼(相当于1.5克游离碱鲁索替尼)。
如本文所用,如本文所述的JAK抑制剂诸如鲁索替尼或其药学上可接受的盐的“基于游离碱的制剂的重量%”意指%w/w是基于总制剂中鲁索替尼的重量来计算的。例如,磷酸鲁索替尼的“基于游离碱1.5%w/w”意指对于100克总制剂,制剂中存在1.98克磷酸鲁索替尼(相当于1.5克游离碱鲁索替尼)。
如本文所用,术语“组分”可意指一种物质或物质的混合物。
如本文所用,术语“脂肪酸”是指饱和或不饱和的脂肪酸。在一些实施方案中,脂肪酸是不同脂肪酸的混合物。在一些实施方案中,脂肪酸具有平均约八个至约三十个碳。在一些实施方案中,脂肪酸具有平均约12至20、14-20或16-18个碳。合适的脂肪酸包括但不限于鲸蜡酸、硬脂酸、月桂酸、肉豆蔻酸、芥酸、棕榈酸、棕榈油酸、癸酸、辛酸、油酸、亚油酸、亚麻酸、羟基硬脂酸、12-羟基硬脂酸、鲸蜡硬脂酸、异硬脂酸、倍半油酸、倍半-9-十八烷酸、倍半异十八烷酸、山萮酸、异山萮酸和花生四烯酸或其混合物。
如本文所用,术语“脂肪醇”是指饱和或不饱和的脂肪醇。在一些实施方案中,脂肪醇是不同脂肪醇的混合物。在一些实施方案中,脂肪醇具有平均约12至约20、约14至约20或约16至约18个碳。合适的脂肪醇包括但不限于硬脂醇、月桂醇、棕榈醇、鲸蜡醇、辛醇、辛酰基醇(caprylyl alcohol)、油醇、亚麻醇、花生四烯醇、山萮醇、异山萮醇、鲨油醇、鲨烯醇和亚油醇或其混合物。
如本文所用,单独或与其他术语组合使用的术语“聚亚烷基二醇”是指含有氧化烯单体单元的聚合物或不同氧化烯单体单元的共聚物,其中亚烷基具有2至6、2至4或2至3个碳原子。如本文所用,单独或与其他术语组合使用的术语“氧化烯”是指式-O-亚烷基-的基团。在一些实施方案中,聚亚烷基二醇是聚乙二醇。
如本文所用,术语“脱水山梨糖醇脂肪酸酯”包括衍生自脱水山梨糖醇或山梨糖醇和脂肪酸以及任选的聚(乙二醇)单元的产物,包括脱水山梨糖醇酯和聚乙氧基化脱水山梨糖醇酯。在一些实施方案中,脱水山梨糖醇脂肪酸酯是聚乙氧基化脱水山梨糖醇酯。
如本文所用,术语“脱水山梨糖醇酯”是指一种化合物或化合物的混合物,其衍生自山梨糖醇和至少一种脂肪酸的酯化。可用于衍生脱水山梨糖醇酯的脂肪酸包括但不限于本文所述的那些。合适的脱水山梨糖醇酯包括但不限于Span
如本文所用,术语“聚乙氧基化脱水山梨糖醇酯”是指衍生自脱水山梨糖醇酯的乙氧基化的化合物或其混合物。化合物的聚氧乙烯部分可在脂肪酸酯与脱水山梨糖醇部分之间。如本文所用,术语“脱水山梨糖醇酯”是指一种化合物或化合物的混合物,其衍生自山梨糖醇和至少一种脂肪酸的酯化。可用于衍生聚乙氧基化生脱水山梨糖醇酯的脂肪酸包括但不限于本文所述的那些。在一些实施方案中,化合物或混合物的聚氧乙烯部分具有约2至约200个氧乙烯单元。在一些实施方案中,化合物或混合物的聚氧乙烯部分具有约2至约100个氧乙烯单元。在一些实施方案中,化合物或混合物的聚氧乙烯部分具有约4至约80个氧乙烯单元。在一些实施方案中,化合物或混合物的聚氧乙烯部分具有约4至约40个氧乙烯单元。在一些实施方案中,化合物或混合物的聚氧乙烯部分具有约4至约20个氧乙烯单元。合适的聚乙氧基化脱水山梨糖醇酯包括但不限于Tween
如本文所用,术语“甘油脂肪酸酯”是指脂肪酸的甘油单酯、甘油二酯或甘油三酯。甘油脂肪酸酯可任选地被磺酸基团或其药学上可接受的盐取代。用于衍生脂肪酸甘油酯的合适脂肪酸包括但不限于本文所述的那些。在一些实施方案中,甘油脂肪酸酯是具有12至18个碳原子的脂肪酸的甘油单酯。在一些实施方案中,甘油脂肪酸酯是硬脂酸甘油酯。
如本文所用,术语“甘油三酯”是指脂肪酸的甘油三酯。在一些实施方案中,甘油三酯是中链甘油三酯。
如本文所用,术语“亚烷基二醇”是指式-O-亚烷基-的基团,其中亚烷基具有2至6、2至4或2至3个碳原子。在一些实施方案中,亚烷基二醇是丙二醇(1,2-丙二醇)。
如本文所用,术语“聚乙二醇”是指含有式-O-CH
如本文所用,“含有”等同于“包含”。
如本文所用,可互换使用的术语“受试者”、“个体”或“患者”是指人。在一些实施方案中,“受试者”、“个体”或“患者”需要所述治疗。
在一些实施方案中,如本文所述的化合物或其药学上可接受的盐或其药物制剂、其局部制剂以治疗有效量施用。如本文所用,短语“治疗有效量”是指引起研究人员、兽医、医学博士或其他临床医师在组织、系统、动物、个体或人中寻求的生物或医学反应的活性化合物或药剂的量。
如本文所用,术语“治疗(treating/treatment)”是指以下中的一种或多种:(1)抑制疾病;例如,抑制正在经历或表现出疾病、病状或病症的病理或症状的个体的疾病、病状或病症(即,阻止病理和/或症状的进一步发展);(2)减轻疾病;例如,减轻正在经历或表现出疾病、病状或病症的病理或症状的个体的疾病、病状或病症(即,逆转病理和/或症状),诸如降低疾病的严重程度;或者(3)预防可能易患疾病、病状或病症但尚未经历或表现出疾病的病理或症状的个体的疾病、病状或病症。在一些实施方案中,治疗是指抑制或减轻疾病。在一些实施方案中,治疗是预防疾病。
在一些实施方案中,组分精确地以指定的范围存在(例如,没有术语“约”)。在一些实施方案中,“约”意指所述值±10%。
本公开还提供了以下非限制性实施方案:
为了可更高效地理解本文所公开的实施方案,下文提供实例。应当理解,这些实例仅用于说明目的并且不应被解释为以任何方式限制实施方案。
在一些实施方案中,提供了以下实施方案:
1.一种治疗有需要的患者的皮肤病的方法,其包括向所述患者的受影响区域局部施用(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
2.如实施方案1所述的方法,所述皮肤病是自身免疫性皮肤病。
3.如实施方案1或2所述的方法,所述皮肤病是炎性皮肤病。
4.如实施方案1-3中任一项所述的方法,其中所述皮肤病是Th1或Th17相关皮肤病。
5.如实施方案1-4中任一项所述的方法,其中所述皮肤病由白细胞介素22(IL-22)、C-X-C基序趋化因子10(CXCL10)、基质金属肽酶12(MMP12)或其组合介导。
6.如实施方案1-5中任一项所述的方法,其中所述皮肤病由IL-22介导。
7.如实施方案1-5中任一项所述的方法,其中所述皮肤病由MMP12介导。
8.如实施方案1-5中任一项所述的方法,其中所述皮肤病由CXCL10介导。
9.如实施方案1-8中任一项所述的方法,其中所述皮肤病选自银屑病、特应性皮炎、秃头、白癜风、赖特氏综合征、毛发红糠疹、单纯性大疱性表皮松解症、掌跖角化病、先天性厚甲、多发性皮脂囊肿、皮肤扁平苔藓、皮肤T细胞淋巴瘤、化脓性汗腺炎、接触性皮炎和鱼鳞癣。
10.如实施方案9所述的方法,其中所述皮肤病是银屑病。
11.如实施方案9所述的方法,其中所述皮肤病是秃头。
12.如实施方案11所述的方法,其中所述秃头是斑秃。
13.如实施方案9所述的方法,其中所述皮肤病是白癜风。
14.如实施方案1-13中任一项所述的方法,其中(a)所述JAK抑制剂或其药学上可接受的盐和(b)所述维生素D3、维生素D3类似物或其药学上可接受的盐同时施用。
15.如实施方案1-13中任一项所述的方法,其中(a)所述JAK抑制剂或其药学上可接受的盐和(b)所述维生素D3、维生素D3类似物或其药学上可接受的盐依序施用。
16.如实施方案1-15中任一项所述的方法,其中(a)所述JAK抑制剂或其药学上可接受的盐和(b)所述维生素D3、维生素D3类似物或其药学上可接受的盐每天施用至少一次。
17.如实施方案1-15中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐每天施用一次。
18.如实施方案1-15中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐每天施用两次。
19.如实施方案1-18中任一项所述的方法,其中所述维生素D3、维生素D3类似物或其药学上可接受的盐每天施用一次。
20.如实施方案1-18中任一项所述的方法,其中所述维生素D3、维生素D3类似物或其药学上可接受的盐每天施用两次。
21.如实施方案1-20中任一项所述的方法,其中(a)所述JAK抑制剂或其药学上可接受的盐和(b)所述维生素D3、维生素D3类似物或其药学上可接受的盐作为单独的制剂施用。
22.如实施方案1-14中任一项所述的方法,其中(a)所述JAK抑制剂或其药学上可接受的盐和(b)所述维生素D3、维生素D3类似物或其药学上可接受的盐作为单一制剂施用。
23.如实施方案22所述的方法,其中(a)所述JAK抑制剂或其药学上可接受的盐和(b)所述维生素D3、维生素D3类似物或其药学上可接受的盐每天施用一次。
24.如实施方案22所述的方法,其中(a)所述JAK抑制剂或其药学上可接受的盐和(b)所述维生素D3、维生素D3类似物或其药学上可接受的盐每天施用两次。
25.如实施方案1-24中任一项所述的方法,其中所述维生素D3、维生素D3类似物或其药学上可接受的盐以协同量施用。
26.如实施方案1-24中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐与所述维生素D3、维生素D3类似物或其药学上可接受的盐之间存在协同作用。
27.如实施方案1-26中任一项所述的方法,其还包括施用额外治疗剂。
28.如实施方案27所述的方法,其中所述额外治疗剂是皮质类固醇。
29.如实施方案1-28中任一项所述的方法,其中所述患者是人患者。
30.如实施方案1-29中任一项所述的方法,其中所述维生素D3、维生素D3类似物或其药学上可接受的盐是具有式(I)的化合物:
其中:
R
R
R
R
R
R
R
R
R
L是-CH
R
R
R
或者可替代地,R
31.如实施方案1-29中任一项所述的方法,其中所述维生素D3、维生素D3类似物或其药学上可接受的盐是具有式(II)的化合物:
其中:
R
R
R
R
R
R
R
R
R
L是-CH
R
R
R
或者可替代地,R
32.如实施方案1-29中任一项所述的方法,其中(b)是维生素D3类似物或其药学上可接受的盐。
33.如实施方案32所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是维生素1α-(OH)D3类似物或其药学上可接受的盐。
34.如实施方案32所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是维生素1α,25(OH)
35.如实施方案32所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是具有式(III)的化合物:
其中:
R
R
R
R
R
L是-CH
R
R
R
或者可替代地,R
36.如实施方案32所述的方法,其中所述维生素D3类似物或其药学上可接受的盐选自骨化二醇、骨化三醇、卡泊三醇、阿法骨化醇、他卡西醇、马沙骨化醇、氟骨三醇、艾地骨化醇、依奈骨化醇、西奥骨化醇、来克骨化醇、20-表-1α,25(OH)
37.如实施方案32所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是卡泊三醇。
38.如实施方案32所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是马沙骨化醇。
39.如实施方案32所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是他卡西醇。
40.如实施方案32-39中任一项所述的方法,其中所述维生素D3类似物或其药学上可接受的盐以局部制剂施用。
41.如实施方案40所述的方法,其中所述局部制剂是泡沫、软膏、洗剂或乳膏。
42.如实施方案40或41所述的方法,其中所述维生素D3类似物或其药学上可接受的盐作为局部制剂施用,所述局部制剂包含所述制剂的约0.0001重量%至约0.1重量%的所述维生素D3类似物。
43.如实施方案40或41所述的方法,其中所述维生素D3类似物或其药学上可接受的盐作为局部制剂施用,所述局部制剂包含所述制剂的约0.0004重量%至约0.005重量%的所述维生素D3类似物。
44.如实施方案32所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是卡泊三醇或其药学上可接受的盐,其作为局部制剂施用,所述局部制剂包含约50μg卡泊三醇/克所述制剂。
45.如实施方案44所述的方法,其中所述局部制剂是泡沫、软膏、洗剂或乳膏。
46.如实施方案44或45所述的方法,其中所述局部制剂还包含二丙酸倍他米松。
47.如实施方案46所述的方法,其中所述二丙酸倍他米松以约0.5mg/克所述制剂的量存在。
48.如实施方案33所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是他卡西醇,其作为局部制剂施用,所述局部制剂包含约4μg他卡西醇/克所述制剂。
49.如实施方案48所述的方法,其中所述局部制剂是软膏、乳膏或洗剂。
50.如实施方案33所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是马沙骨化醇,其作为局部制剂施用,所述局部制剂包含约6μg、约12.5μg、约25μg或约50μg/克所述制剂。
51.如实施方案50所述的方法,其中所述局部制剂是软膏。
52.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐选自JAK1抑制剂、JAK2抑制剂、JAK3抑制剂、TYK2抑制剂、JAK1/JAK2抑制剂、JAK1/JAK3抑制剂、泛JAK抑制剂和JAK1/TYK2抑制剂或药学上可接受的盐。
53.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是JAK1抑制剂或其药学上可接受的盐。
54.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是JAK2抑制剂或其药学上可接受的盐。
55.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是JAK1/JAK2抑制剂或其药学上可接受的盐。
56.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是JAK1/JAK3抑制剂或其药学上可接受的盐。
57.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是泛JAK抑制剂或其药学上可接受的盐。
58.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是JAK1/TYK2抑制剂或药学上可接受的盐。
59.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐选自鲁索替尼、巴瑞替尼、奥拉替尼、莫洛替尼、CTP-543、AH057、甘多替尼、菲卓替尼、来他替尼、帕克替尼、CHZ868、乌帕替尼、托法替尼、非戈替尼,阿布昔替尼、伊他替尼、布雷西替尼、ATI-501、ATI-1777、ATI-502、迪高替尼、培非替尼、古沙替尼、葫芦素I、赛度替尼、迪西替尼、BMS-986165和利特昔替尼或其药学上可接受的盐。
60.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐选自鲁索替尼、奥拉替尼、巴瑞替尼、莫洛替尼、CTP-543、甘多替尼、菲卓替尼、来他替尼、帕克替尼、乌帕替尼、托法替尼、非戈替尼,阿布昔替尼、伊他替尼、布雷西替尼、迪高替尼、培非替尼、古沙替尼、葫芦素I和赛度替尼或其药学上可接受的盐。
61.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是鲁索替尼或药学上可接受的盐。
62.如实施方案1-51中任一项所述的方法,所述JAK抑制剂或其药学上可接受的盐是磷酸鲁索替尼。
63.如实施方案61或62所述的方法,其中所述JAK抑制剂或其药学上可接受的盐作为乳膏制剂施用。
64.如实施方案63所述的方法,其中所述乳膏制剂是水包油乳液。
65.如实施方案63或64所述的方法,其中所述乳膏制剂具有约2.8至约3.9的pH。
66.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是迪高替尼或其药学上可接受的盐。
67.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是托法替尼或其药学上可接受的盐。
68.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是ATI-1777或其药学上可接受的盐。
69.如实施方案1-51中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是布雷西替尼或其药学上可接受的盐。
70.如实施方案1-69中任一项所述的方法,其中所述JAK抑制剂或其药学上可接受的盐以治疗有效量施用。
71.如实施方案1-70中任一项所述的方法,其中(b)维生素D3、维生素D3类似物或其药学上可接受的盐以治疗有效量施用。
72.一种治疗有需要的患者的皮肤病的方法,其包括向所述患者的受影响区域局部施用(a)鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
73.一种治疗有需要的患者的皮肤病的方法,其包括向所述患者的受影响区域局部施用(a)鲁索替尼或其药学上可接受的盐和(b)维生素D3类似物或其药学上可接受的盐。
74.如实施方案73所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是卡泊三醇或其药学上可接受的盐。
75.如实施方案72-74中任一项所述的方法,其中所述鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
76.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
77.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
78.如实施方案77所述的制剂(或者可替代地,所述的方法),其中所述鲁索替尼或其药学上可接受的盐以基于游离碱的所述制剂的约0.1重量%、约0.15重量%、约0.2重量%、约0.25重量%、约0.3重量%、约0.35重量%、约0.4重量%、约0.45重量%、约0.5重量%、约0.55重量%、约0.6重量%、约0.65重量%、约0.7重量%、约0.75重量%、约0.8重量%、约0.85重量%、约0.9重量%、约0.95重量%、约1.0重量%、约1.05重量%、约1.1重量%、约1.15重量%、约1.2重量%、约1.25重量%、约1.3重量%、约1.35重量%、约1.4重量%、约1.45重量%、约1.5重量%、约1.55重量%、约1.6重量%、约1.65重量%、约1.7重量%、约1.75重量%、约1.8重量%、约1.85重量%、约1.9重量%、约1.95重量%、约2.0重量%、约2.5重量%或约3.0重量%的量存在。
79.一种用于局部治疗皮肤病的药物制剂(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含),其包含(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
80.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
81.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
82.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL至约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。
83.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL至约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。
84.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。
85.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约10μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。
86.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。
87.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约10μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。
88.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。
89.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约1μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。
90.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约10μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。
91.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约50μg/mL的维生素D3、维生素D3类似物或其药学上可接受的盐。
92.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.0001%w/w至约0.01%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。
93.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.0001%w/w至约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。
94.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.0001%w/w至约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。
95.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.0001%w/w至约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。
96.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。
97.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。
98.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)基于游离碱约0.005%w/w的维生素D3、维生素D3类似物或其药学上可接受的盐。
99.如实施方案77-98中任一项所述的制剂(或者可替代地,如实施方案77-98中任一项所述的方法),其中所述鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
100.如实施方案76-99中任一项所述的制剂(或者可替代地,如实施方案76-99中任一项所述的方法),其中所述维生素D3、维生素D3类似物或其药学上可接受的盐是维生素D3类似物或其药学上可接受的盐。
101.如实施方案100所述的制剂(或者可替代地,所述的方法),其中所述维生素D3类似物或其药学上可接受的盐选自骨化二醇、骨化三醇、卡泊三醇、阿法骨化醇、他卡西醇、马沙骨化醇、氟骨三醇、艾地骨化醇、依奈骨化醇、西奥骨化醇、来克骨化醇、20-表-1α,25(OH)
102.如实施方案100所述的制剂(或者可替代地,所述的方法),其中所述维生素D3类似物或其药学上可接受的盐是卡泊三醇。
103.如实施方案100所述的制剂(或者可替代地,所述的方法),其中所述维生素D3类似物或其药学上可接受的盐是他卡西醇。
104.如实施方案100所述的制剂(或者可替代地,所述的方法),其中所述维生素D3类似物或其药学上可接受的盐是马沙骨化醇。
105.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w至约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)约0.005%w/w的卡泊三醇。
106.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约0.75%w/w的鲁索替尼或其药学上可接受的盐和(b)约0.005%w/w的卡泊三醇。
107.一种用于局部治疗皮肤病的药物制剂,其包含(或者可替代地,如实施方案1-75中任一项所述的方法,其中所述制剂包含)(a)基于游离碱约1.5%w/w的鲁索替尼或其药学上可接受的盐和(b)约0.005%w/w的卡泊三醇。
108.如实施方案105-107中任一项所述的制剂(或者可替代地,所述的方法),其中所述鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
109.如实施方案76-108中任一项所述的制剂(或者可替代地,所述的方法),其中所述制剂是乳膏。
110.如实施方案76-108中任一项所述的制剂(或者可替代地,所述的方法),其中所述制剂是洗剂。
111.如实施方案76-110中任一项所述的制剂(或者可替代地,所述的方法),其中所述制剂还包含水。
112.如实施方案76-111中任一项所述的制剂(或者可替代地,所述的方法),其中所述制剂具有不超过约3.6的pH。
113.如实施方案76-111中任一项所述的制剂(或者可替代地,所述的方法),其中所述制剂具有约2.7至约3.9的pH。
114.如实施方案76-111中任一项所述的制剂(或者可替代地,所述的方法),其中所述制剂具有约2.7至约3.6的pH。
115.如实施方案76-111中任一项所述的制剂(或者可替代地,所述的方法),其中所述制剂具有约4至约8的pH。
116.如实施方案76-115中任一项所述的制剂(或者可替代地,所述的方法),其中所述制剂是水包油乳液。
117.如实施方案116所述的制剂(或者可替代地,所述的方法),其中所述水包油乳液包含水、油组分和乳化剂组分。
118.如实施方案117所述的制剂(或者可替代地,所述的方法),其中所述油组分以所述乳液的约10重量%至约40重量%的量存在。
119.如实施方案117所述的制剂(或者可替代地,所述的方法),其中所述油组分以所述乳液的约15重量%至约30重量%的量存在。
120.如实施方案117所述的制剂(或者可替代地,所述的方法),其中所述油组分以所述乳液的约20重量%至约28重量%的量存在。
121.如实施方案117-120中任一项所述的制剂(或者可替代地,所述的方法),其中所述油组分包含一种或多种独立地选自以下的物质:凡士林、脂肪醇、矿物油、甘油三酯和硅油。
122.如实施方案117-120中任一项所述的制剂(或者可替代地,所述的方法),其中所述油组分包含一种或多种独立地选自以下的物质:白凡士林、鲸蜡醇、硬脂醇、轻质矿物油、中链甘油三酯和聚二甲基硅氧烷。
123.如实施方案117-120中任一项所述的制剂(或者可替代地,所述的方法),其中所述油组分包含封闭剂组分。
124.如实施方案123所述的制剂(或者可替代地,所述的方法),其中所述封闭剂组分以所述乳液的约2重量%至约15重量%的量存在。
125.如实施方案123所述的制剂(或者可替代地,所述的方法),其中所述封闭剂组分以所述乳液的约5重量%至约10重量%的量存在。
126.如实施方案123-125中任一项所述的制剂(或者可替代地,所述的方法),其中所述封闭剂组分包含白凡士林。
127.如实施方案117-126中任一项所述的制剂(或者可替代地,所述的方法),其中所述油组分包含硬化剂组分。
128.如实施方案127所述的制剂(或者可替代地,所述的方法),其中所述硬化剂组分以所述乳液的约2重量%至约8重量%的量存在。
129.如实施方案127所述的制剂(或者可替代地,所述的方法),其中所述硬化剂组分以所述乳液的约3重量%至约6重量%的量存在。
130.如实施方案127所述的制剂(或者可替代地,所述的方法),其中所述硬化剂组分以所述乳液的约4重量%至约7重量%的量存在。
131.如实施方案127-130中任一项所述的制剂(或者可替代地,所述的方法),其中所述硬化剂组分包含一种或多种独立地选自脂肪醇的物质。
132.如实施方案131所述的制剂(或者可替代地,所述的方法),其中所述硬化剂组分包含一种或多种独立地选自C
133.如实施方案131所述的制剂(或者可替代地,所述的方法),其中所述硬化剂组分包含一种或多种独立地选自C
134.如实施方案127-130中任一项所述的制剂(或者可替代地,所述的方法),其中所述硬化剂组分包含一种或多种独立地选自鲸蜡醇和硬脂醇的物质。
135.如实施方案117-134中任一项所述的制剂(或者可替代地,所述的方法),其中所述油组分包含润肤剂组分。
136.如实施方案135所述的制剂(或者可替代地,所述的方法),其中所述润肤剂组分以所述乳液的约0.1重量%至约20重量%的量存在。
137.如实施方案135所述的制剂(或者可替代地,所述的方法),其中所述润肤剂组分以所述乳液的约5重量%至约20重量%的量存在。
138.如实施方案135所述的制剂(或者可替代地,所述的方法),其中所述润肤剂组分以所述乳液的约10重量%至约15重量%的量存在。
139.如实施方案135-138中任一项所述的制剂(或者可替代地,所述的方法),其中所述润肤剂组分包含一种或多种独立地选自矿物油、甘油三酯和硅油的物质。
140.如实施方案135-138中任一项所述的制剂(或者可替代地,所述的方法),其中所述润肤剂组分包含一种或多种独立地选自轻质矿物油、中链甘油三酯和聚二甲基硅氧烷的物质。
141.如实施方案117-140中任一项所述的制剂(或者可替代地,所述的方法),其中所述水以所述乳液的约20重量%至约80重量%的量存在。
142.如实施方案117-140任一项所述的制剂(或者可替代地,所述的方法),其中所述水以所述乳液的约35重量%至约65重量%的量存在。
143.如实施方案117-140中任一项所述的制剂(或者可替代地,所述的方法),其中所述水以所述乳液的约40重量%至约65重量%的量存在。
144.如实施方案117-143中任一项所述的制剂(或者可替代地,所述的方法),其中所述乳化剂组分以所述乳液的约0.5重量%至约15重量%的量存在。
145.如实施方案117-143中任一项所述的制剂(或者可替代地,所述的方法),其中所述乳化剂组分以所述乳液的约1重量%至约10重量%的量存在。
146.如实施方案117-143中任一项所述的制剂(或者可替代地,所述的方法),其中所述乳化剂组分以所述乳液的约2重量%至约6重量%的量存在。
147.如实施方案117-143中任一项所述的制剂(或者可替代地,所述的方法),其中所述乳化剂组分以所述乳液的约3重量%至约5重量%的量存在。
148.如实施方案117-147中任一项所述的制剂(或者可替代地,所述的方法),其中所述乳化剂组分包含一种或多种独立地选自甘油脂肪酸酯和脱水山梨糖醇脂肪酸酯的物质。
149.如实施方案117-147中任一项所述的制剂(或者可替代地,所述的方法),其中所述乳化剂组分包含一种或多种独立地选自硬脂酸甘油酯和聚山梨醇酯20的物质。
150.如实施方案117-149中任一项所述的制剂(或者可替代地,所述的方法),其中所述乳液还包含稳定剂组分。
151.如实施方案150所述的制剂(或者可替代地,所述的方法),其中所述稳定剂组分以所述乳液的约0.05重量%至约5重量%的量存在。
152.如实施方案150所述的制剂(或者可替代地,所述的方法),其中所述稳定剂组分以所述乳液的约0.1重量%至约2重量%的量存在。
153.如实施方案150所述的制剂(或者可替代地,所述的方法),其中所述稳定剂组分以所述乳液的约0.3重量%至约0.5重量%的量存在。
154.如实施方案150-153中任一项所述的制剂(或者可替代地,所述的方法),其中所述稳定剂组分包含一种或多种独立地选自多糖的物质。
155.如实施方案150-153中任一项所述的制剂(或者可替代地,所述的方法),其中所述稳定剂组分包含黄原胶。
156.如实施方案117-155中任一项所述的制剂(或者可替代地,所述的方法),其中所述乳液还包含溶剂组分。
157.如实施方案156所述的制剂(或者可替代地,所述的方法),其中所述溶剂组分以所述乳液的约1重量%至约35重量%的量存在。
158.如实施方案156所述的制剂(或者可替代地,所述的方法),其中所述溶剂组分以所述乳液的约5重量%至约25重量%的量存在。
159.如实施方案156所述的制剂(或者可替代地,所述的方法),其中所述溶剂组分以所述乳液的约10重量%至约20重量%的量存在。
160.如实施方案156-159中任一项所述的制剂(或者可替代地,所述的方法),其中所述溶剂组分包含一种或多种独立地选自亚烷基二醇和聚亚烷基二醇的物质。
161.如实施方案156-159中任一项所述的制剂(或者可替代地,所述的方法),其中所述溶剂组分包含一种或多种独立地选自丙二醇和聚乙二醇的物质。
162.一种用于局部治疗皮肤病的药物制剂,其包含(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
163.如实施方案162所述的药物制剂,其中所述JAK抑制剂或其药学上可接受的盐是JAK1/2抑制剂或其药学上可接受的盐;并且所述维生素D3、维生素D3类似物或其药学上可接受的盐是维生素D3类似物或其药学上可接受的盐。
164.如实施方案163所述的药物制剂,其中所述JAK1/2抑制剂或其药学上可接受的盐是鲁索替尼或其药学上可接受的盐。
165.如实施方案165所述的药物制剂,其中所述JAK1/2抑制剂或其药学上可接受的盐是磷酸鲁索替尼。
166.如实施方案162-165中任一项所述的药物制剂,其中所述维生素D3类似物或其药学上可接受的盐是具有式(II)的化合物:
其中:
R
R
R
R
R
R
R
R
R
L是-CH
R
R
R
或者可替代地,R
167.如实施方案162-166中任一项所述的药物制剂,其中所述维生素D3类似物或其药学上可接受的盐是卡泊三醇或马沙骨化醇或其药学上可接受的盐。
168.如实施方案163所述的药物制剂,其中所述JAK1/2抑制剂是鲁索替尼或其药学上可接受的盐,并且所述维生素D3类似物是卡泊三醇。
169.如实施方案163所述的药物制剂,其中所述JAK1/2抑制剂是鲁索替尼或其药学上可接受的盐,并且所述维生素D3类似物是马沙骨化醇。
170.如实施方案164-169中任一项所述的药物制剂,其中所述制剂包含基于游离碱约0.05%至约3.0%或约0.05%至约1.5%w/w的所述鲁索替尼或其药学上可接受的盐。
171.如实施方案164-169中任一项所述的药物制剂,其中所述制剂包含基于游离碱的所述制剂的约0.05重量%、约0.06重量%、约0.07重量%、约0.08重量%、约0.09重量%、约0.1重量%、约0.15重量%、约0.2重量%、约0.25重量%、约0.3重量%、约0.35重量%、约0.4重量%、约0.45重量%、约0.5重量%、约0.55重量%、约0.6重量%、约0.65重量%、约0.7重量%、约0.75重量%、约0.8重量%、约0.85重量%、约0.9重量%、约0.95重量%、约1.0重量%、约1.05重量%、约1.1重量%、约1.15重量%、约1.2重量%、约1.25重量%、约1.3重量%、约1.35重量%、约1.4重量%、约1.45重量%、约1.5重量%、约1.55重量%、约1.6重量%、约1.65重量%、约1.7重量%、约1.75重量%、约1.8重量%、约1.85重量%、约1.9重量%、约1.95重量%、约2.0重量%、约2.5重量%或约3.0重量%的所述鲁索替尼或其药学上可接受的盐。
172.如实施方案163-171中任一项所述的药物制剂,其中所述制剂包含基于游离碱约0.0001%w/w至约0.01%w/w的所述维生素D3类似物或其药学上可接受的盐。
173.如实施方案163-171中任一项所述的药物制剂,其中所述制剂包含基于游离碱约0.0001%w/w至约0.005%w/w的所述维生素D3类似物或其药学上可接受的盐。
174.如实施方案163-171中任一项所述的药物制剂,其中所述制剂包含基于游离碱约0.0001%w/w至约0.01%w/w或约0.0001%w/w至约0.005%w/w的所述维生素D3类似物或其药学上可接受的盐。
175.如实施方案163-171中任一项所述的药物制剂,其中所述制剂包含基于游离碱约0.005%w/w的所述维生素D3类似物或其药学上可接受的盐。
176.如实施方案162-175中任一项所述的药物制剂,其中所述制剂是乳膏或洗剂。
177.如实施方案162-176中任一项所述的药物制剂,其中所述制剂是水包油乳液。
178.如实施方案162-177中任一项所述的药物制剂,其中所述制剂包含水、油组分和乳化剂或稳定剂组分。
179.如实施方案178所述的药物制剂,其中所述水占所述药物制剂的约5重量%至约90重量%、约10重量%至约80重量%、约10重量%至约70重量%、约10重量%至约60重量%、约20重量%至约70重量%、约20重量%至约60重量%或约20重量%至约50重量%。
180.如实施方案178-179中任一项所述的药物制剂,其中所述油组分占所述药物制剂的约5重量%至约90重量%、约5重量%至约80重量%、约5重量%至约70重量%、约5重量%至约60重量%、约5重量%至约50重量%或约5重量%至约40重量%。
181.如实施方案178-180中任一项所述的药物制剂,其中所述乳化剂或稳定剂组分占所述药物制剂的约1重量%至约30重量%或约5重量%至约25重量%。
182.如实施方案178-180中任一项所述的药物制剂,其还包含用于溶解鲁索替尼或其药学上可接受的盐的溶剂组分。
183.如实施方案182所述的药物制剂,其中所述溶剂组分占所述药物制剂的约5重量%至约20重量%、约2重量%至约30重量%、约5重量%至约30重量%、约5重量%至约25重量%、约5重量%至约20重量%或约10重量%至约20重量%。
184.如实施方案163-183中任一项所述的药物制剂,其中所述制剂具有约6.0至约8.0、约6.5至约7.5或约6.5至约7.0的pH。
185.如实施方案184所述的药物制剂,其中所述制剂的pH用三乙醇胺调节。
186.一种治疗有需要的患者的皮肤病的方法,其包括向所述患者的受影响区域局部施用(a)JAK抑制剂或其药学上可接受的盐和(b)维生素D3、维生素D3类似物或其药学上可接受的盐。
187.如实施方案186所述的方法,其中所述JAK抑制剂或其药学上可接受的盐是JAK1/2抑制剂或其药学上可接受的盐;并且所述维生素D3、维生素D3类似物或其药学上可接受的盐是维生素D3类似物或其药学上可接受的盐。
188.如实施方案187所述的方法,其中所述JAK1/2抑制剂或其药学上可接受的盐是鲁索替尼或其药学上可接受的盐。
189.如实施方案187所述的方法,其中所述JAK1/2抑制剂或其药学上可接受的盐是磷酸鲁索替尼。
190.如实施方案187-189中任一项所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是具有式(II)的化合物:
其中:
R
R
R
R
R
R
R
R
R
L是-CH
R
R
R
或者可替代地,R
191.如实施方案187-189中任一项所述的方法,其中所述维生素D3类似物或其药学上可接受的盐是卡泊三醇或马沙骨化醇或其药学上可接受的盐。
192.如实施方案187所述的方法,其中所述JAK1/2抑制剂是鲁索替尼或其药学上可接受的盐,并且所述维生素D3类似物是卡泊三醇。
193.如实施方案187所述的方法,其中所述JAK1/2抑制剂是鲁索替尼或其药学上可接受的盐,并且所述维生素D3类似物是马沙骨化醇。
194.如实施方案187-193中任一项所述的方法,所述皮肤病是自身免疫性或炎性皮肤病。
195.如实施方案187-193中任一项所述的方法,其中所述皮肤病是Th1或Th17相关皮肤病。
196.如实施方案187-193中任一项所述的方法,其中所述皮肤病由白细胞介素22(IL-22)、C-X-C基序趋化因子10(CXCL10)、基质金属肽酶12(MMP12)或其组合介导。
197.如实施方案187-193中任一项所述的方法,其中所述皮肤病由Defb4、S100a12或Serpinb4介导。
198.如实施方案187-193中任一项所述的方法,其中所述皮肤病由丝聚蛋白/FLG、Loricin/LOR、IL-31、TSLP、CAMP、CCL17、CCL22、DefB4a、干扰素-γ、IL-17A、IL-17F、IL-22、IL-33、IL-4或TNFSF18介导。
199.如实施方案187-193中任一项所述的方法,其中所述皮肤病选自银屑病、特应性皮炎、秃头、白癜风、赖特氏综合征、毛发红糠疹、单纯性大疱性表皮松解症、掌跖角化病、先天性厚甲、多发性皮脂囊肿、皮肤扁平苔藓、皮肤T细胞淋巴瘤、化脓性汗腺炎、接触性皮炎和鱼鳞癣。
200.如实施方案187-193中任一项所述的方法,其中所述皮肤病是红斑痤疮、银屑病关节炎、真皮纤维化、硬斑病、斯皮茨痣、皮肤癣菌病或寻常痤疮。
201.如实施方案187-200中任一项所述的方法,其中所述JAK1/2抑制剂或其药学上可接受的盐与所述维生素D3类似物或其药学上可接受的盐之间存在协同作用。
202.如实施方案187-201中任一项所述的方法,其中(a)所述JAK1/2抑制剂或其药学上可接受的盐和(b)所述维生素D3类似物或其药学上可接受的盐每天施用至少一次。
203.如实施方案187-201中任一项所述的方法,其中(a)所述JAK1/2抑制剂或其药学上可接受的盐和(b)所述维生素D3类似物或其药学上可接受的盐每天施用至少两次。
204.如实施方案187-203中任一项所述的方法,其中(a)所述JAK1/2抑制剂或其药学上可接受的盐和(b)所述维生素D3类似物或其药学上可接受的盐同时施用。
205.如实施方案187-203中任一项所述的方法,其中(a)所述JAK1/2抑制剂或其药学上可接受的盐和(b)所述维生素D3类似物或其药学上可接受的盐依序施用。
206.如实施方案187-205中任一项所述的方法,其中(a)所述JAK1/2抑制剂或其药学上可接受的盐和(b)所述维生素D3类似物或其药学上可接受的盐作为单独的制剂施用。
207.如实施方案187-204中任一项所述的方法,其中(a)所述JAK1/2抑制剂或其药学上可接受的盐和(b)所述维生素D3类似物或其药学上可接受的盐以单一制剂施用。
208.如实施方案206所述的方法,其中所述JAK1/2抑制剂或其药学上可接受的盐和所述维生素D3类似物或其药学上可接受的盐各自以局部制剂施用。
209.如实施方案207所述的方法,其中所述JAK1/2抑制剂或其药学上可接受的盐和所述维生素D3类似物或其药学上可接受的盐以单一局部制剂施用。
210.如实施方案208所述的方法,其中每种局部制剂是软膏、乳膏或洗剂。
211.如实施方案209所述的方法,其中所述单一局部制剂是软膏、乳膏或洗剂。
212.如实施方案211所述的方法,其中所述单一局部制剂是乳膏或洗剂。
213.如实施方案211所述的方法,其中所述单一局部制剂是乳膏制剂。
214.如实施方案211-213中任一项所述的方法,其中所述单一局部制剂具有约6.0至约8.0、约6.5至约7.5或约6.5至约7.0的pH。
215.如实施方案187-214中任一项所述的方法,其还包括施用额外治疗剂。
216.如实施方案215所述的方法,其中所述额外治疗剂是皮质类固醇。
217.如实施方案216所述的方法,其中所述皮质类固醇是二丙酸倍他米松。
实施例
将通过具体实施例更详细地描述本发明要求保护的主题。以下实施例是出于说明目的而提供的,并不意图以任何方式限制本发明要求保护的主题。本领域技术人员将容易地识别多种非关键性参数,所述参数可被改变或修改以产生基本上相同的结果。
体外实验的所有统计分析均使用GraphPad prism软件(第7版)使用Kruskal-Wallis-Test和Mann-Whitney U检验进行。使用Partek Flow基因组分析软件和SubioPlatform软件v1.22.5266使用Welch's t检验分析基因表达。置信区间被确定为95%。P<0.05被认为是“显著的”(*),p<0.01被认为是“高度显著的”(**)。使用DAVID v6.8(注释、可视化和集成发现数据库)将KEGG通路映射到差异表达的基因。
实施例1.体外JAK激酶测定
根据Park等人,Analytical Biochemistry 1999,269,94-104中描述的以下体外测定,测试了可用于治疗细胞因子相关疾病或病症的JAK1抑制剂对JAK靶标的抑制活性。使用杆状病毒在昆虫细胞中表达具有N末端His标签的人JAK1(a.a.837-1142)、JAK2(a.a.828-1132)和JAK3(a.a.781-1124)的催化结构域,并将其纯化。通过测量生物素化肽的磷酸化来测定JAK1、JAK2或JAK3的催化活性。通过均相时间分辨荧光(HTRF)来检测磷酸化肽。在40μL反应中针对每种激酶测量化合物的IC
实施例2:对JAK抑制剂和维生素D3类似物的组合进行的离体皮肤药效学实验
材料和方法
本公开中描述的药效学测定涉及与由Susan H.Smith等人发布的引发TH17反应的范例类似的引发Th1、Th2和Th17反应的范例(Development of a Topical Treatment forPsoriasis Targeting RORγ:From Bench to Skin.PlosOne.发布时间:2016年2月,所述文献以引用的方式整体并入)。此范例用于评估局部制剂中活性化合物针对皮肤疾病(即银屑病、白癜风和秃头)的治疗潜力。
可使用
方法A(基底外侧给药)
(i)使用平均表面积为大约0.33cm
(ii)将如本文所述制备的皮肤置于
(iii)向基底室填充0.5mL培养基并且将药物(JAK抑制剂和/或维生素D3类似物)以指定的最终浓度添加到培养基中,在加湿培养箱中在37℃下预处理过夜(约16小时)。
(iv)第二天,将每个插入物的基底室内容物真空吸出并替换为0.5mL预热(约37℃)的含有测试化合物和新鲜刺激混合物的角质化培养基。
(v)可将培养物储存在温度为37℃的加湿培养箱中。
(vi)可在刺激后24小时收获组织外植体。将一半的组织置于RNALater中,以通过RT-qPCR测定细胞因子产生。
(vii)组织均质化:将组织管置于Omni匀浆器中,并以5m/s运行3个循环30秒,停留时间设置为10秒。将均质化重复4次,总共12个循环,每次运行之间在冰上放置1分30秒以冷却样品。最后一次运行后,将组织管在冰上冷却相同的持续时间。
(viii)在Applied Biosystems Quant 6标准RT-qPCR程序上以40个循环阈值一式两份地对样品进行RT-PCR,利用GAPDH作为管家基因。
可根据化合物的IC
方法B(局部给药)
(i)使用平均表面积为大约0.33cm
(ii)将如本文所述制备的皮肤置于
(iii)向基底室填充0.5mL培养基。将药物(JAK抑制剂和/或维生素D3类似物)局部应用于取下的皮肤的顶端侧(约18ul/cm
(iv)第二天,真空吸出每个插入物的基底室内容物。将培养基替换为0.5mL预热(约37℃)的含有新鲜刺激混合物的角质化培养基。
(v)可将培养物储存在温度为37℃的加湿培养箱中。
(vi)可在刺激后24小时收获组织外植体。将一半的组织置于RNALater中,以通过RT-qPCR测定细胞因子产生。
(vii)组织均质化:将组织管置于Omni匀浆器中,并以5m/s运行3个循环30秒,停留时间设置为10秒。将均质化重复4次,总共12个循环,每次运行之间在冰上放置1分30秒以冷却样品。最后一次运行后,将组织管在冰上冷却相同的持续时间。
(viii)在Applied Biosystems Quant 6标准RT-qPCR程序上以40个循环阈值一式两份地对样品进行RT-PCR,利用GAPDH作为管家基因。
鲁索替尼和卡泊三醇—基底外侧给药(方法A)
如上文在实施例2的材料和方法(方法A)部分中所述,针对磷酸鲁索替尼和卡泊三醇进行实验。添加磷酸鲁索替尼(基于游离碱计算)和/或卡泊三醇刺激Th1或Th17的供体2和3的处理条件列表分别如表2和表3所示。
表2
表3
/>
注意:将每种测试化合物以1000倍溶解在100% DMSO中后,将储备液储存在-20℃下。
对关于测试化合物和其组合的生物标志物诸如IL-22、CXCL10和MMP12的水平进行量化,并相计算对于未处理对照的基因表达的倍数变化。出乎意料且令人惊讶的是,卡泊三醇和鲁索替尼的组合在降低IL-22、CXCL10和MMP12水平方面表现出协同作用,如图1至图3所示。例如,测试的组合显著降低了IL-22水平,并且这种降低作用在统计学上是显著的。测试的组合也有效地降低了CXCL10水平,并且这种降低作用在统计学上是显著的。测试的组合有效地降低了MMP12水平,并且这种降低作用在统计学上是显著的。由于几个原因,这些结果是出乎意料且令人惊讶的。本领域通常已知的一个原因为,人体内维生素D的主要来源是在阳光下皮肤合成的,并且迄今为止,JAK抑制剂对皮肤病的抗炎功效尚未与地理位置或阳光暴露相关。另一个原因是维生素D3类似物的临床疗效被认为主要是由它们使角质形成细胞过度增殖正常化并调节表皮分化的能力驱动的,并且这些机制独立于利用JAK通路的炎性细胞因子。参见Hu等人“Reciprocal role of vitamin D receptor onβ-cateninregulated keratinocyte proliferation and differentiation”J Steroid BiochemMol Biol.2014年10月;144Pt A:237-41,PMID:24239508,所述文献以引用的方式整体并入本文。此外,最近一项关于银屑病的研究表明,使用局部卡泊三醇治疗的银屑病患者的皮肤活检物表现出银屑病损伤中CD8(+)IL-17(+)T细胞显著减少,但IL-22(+)或IFN-γ(+)细胞的频率没有变化。参见Dyring-Andersen等人“The Vitamin D Analogue CalcipotriolReduces the Frequency of CD8+IL-17+T Cells in Psoriasis Lesions.Scand JImmunol”2015年7月;82(1):84-91,PMID:25904071,所述文献以引用的方式整体并入本文。因此,出乎意料且令人惊讶地发现卡泊三醇与鲁索替尼之间在降低IL-22、CXCL10和MMP12水平方面存在协同作用。
另外,还对测试化合物(鲁索替尼和卡泊三醇)和其组合的其他基因标志物的水平进行量化。计算相对于未处理对照的基因表达的绝对倍数变化。图6A至图6B示出了与未处理的对照相比,卡泊三醇和鲁索替尼的组合引起某些基因的>2或>4绝对倍数变化(白色表示<2绝对倍数变化,灰色表示>2绝对倍数变化,并且黑色表示>4绝对倍数变化)。在具有最高绝对倍数变化的基因中,屏障功能基因(丝聚蛋白/FLG和Loricin/LOR)与许多皮肤科疾病有关;IL-31和TSLP与瘙痒有关,在许多皮肤科疾病中很普遍;而CAMP和DefB4是抗微生物肽,与屏障破坏(可增加感染)的皮肤病有关。
鲁索替尼和马沙骨化醇—基底外侧给药(方法A)
如上文在实施例2的材料和方法(方法A)部分中所述,针对磷酸鲁索替尼和马沙骨化醇进行实验。添加磷酸鲁索替尼(基于游离碱计算)和/或马沙骨化醇刺激Th1或Th17的供体2和3的处理条件列表分别如表4和表5所示。
表4
表5
注意:将每种测试化合物以1000倍溶解在100% DMSO中后,将储备液储存在-20℃下。
对测试化合物和其组合的生物标志物诸如IL-22和CXCL10的水平进行量化,并计算相对于未处理对照的基因表达的倍数变化。出乎意料且令人惊讶的是,马沙骨化醇和鲁索替尼的组合在降低IL-22和CXCL10水平方面表现出协同作用,如图7A至图7B所示。
鲁索替尼和卡泊三醇—局部给药(方法B)
根据以下程序使用磷酸鲁索替尼和卡泊三醇制备单独和组合的磷酸鲁索替尼和卡泊三醇的水基溶液(见表6):
(i)最初将BHT添加到琥珀色Duran中的Transcutol P中,并以500RPM搅拌直至视觉上均匀。
(ii)将步骤(i)的溶液添加到琥珀色Duran中的其余极性相赋形剂中,并通过磁力搅拌棒以500RPM搅拌直至视觉上均匀。
(iii)将磷酸鲁索替尼添加到步骤(ii)的极性相中并以500RPM搅拌5min,磷酸鲁索替尼在此步骤中没有完全溶解。
(iv)将步骤(iii)的悬浮液的pH用三乙醇胺调节至pH 6.5–7.0,并且磷酸鲁索替尼在此步骤期间溶解。
(v)将卡泊三醇一水合物添加到步骤(iv)的极性相中,并在65℃下以500RPM搅拌1小时,然后在环境实验室温度下搅拌过夜以溶解。
(vi)适量加水至100%。
表6
如上文在实施例2的材料和方法(方法B)部分中所述,针对磷酸鲁索替尼和卡泊三醇测试表6中所示的水溶液。添加磷酸鲁索替尼(基于游离碱计算)和/或卡泊三醇刺激Th1或Th17的供体1和2的处理条件列表分别如表7和表8所示。
表7
表8
对测试化合物和其组合的生物标志物诸如S100a12、Defb4、Serpinb4、MMP12、IL-22和CXCL10的水平进行量化,并计算相对于未处理对照的基因表达的倍数变化(图8A至图8C和图9A至图9C)。出乎意料且令人惊讶的是,在局部应用的水基溶液中组合的卡泊三醇和鲁索替尼在降低S100a12、Defb4、Serpinb4和MMP12的水平方面表现出协同作用,如图8A至图8C和图9A所示。S100a12是银屑病疾病活动的重要标志物(Wilsmann-Theis,D等人,J EurAcad Dermatol Venereol,30(7):1165-70(2016);doi:10.1111/jdv.13269)。Defb4编码抗微生物肽人β-防御素2(hBD2),其在皮肤炎性过程中起着至关重要的作用,并且在银屑病的发病机制中起着重要作用(Johansen C等人,J Invest Derm,136(8):1608-1616(2016);doi:10.1016/j.jid.2016.04.012)。Serpinb4导致患有慢性皮肤病(包括特应性皮炎)的患者的炎症(Sivaprasad,U等人,J Invest Derm 135(1):160-169(2015);DOI:10.1038/jid.2014.353)。由于几个原因,这些结果是出乎意料且令人惊讶的。本领域通常已知的一个原因为,人体内维生素D的主要来源是在阳光下皮肤合成的,并且迄今为止,JAK抑制剂对皮肤病的抗炎功效尚未与地理位置或阳光暴露相关。另一个原因是维生素D3类似物的临床疗效被认为主要是由它们使角质形成细胞过度增殖正常化并调节表皮分化的能力驱动的,并且这些机制独立于利用JAK通路的炎性细胞因子。因此,出乎意料且令人惊讶地发现卡泊三醇与鲁索替尼之间在降低S100a12、Defb4、Serpinb4和MMP12水平方面存在协同作用。在局部应用的水基溶液中组合的卡泊三醇和鲁索替尼也降低了IL-22和CXCL10的基因表达(图9B至图9C);然而,水溶液中高水平的鲁索替尼(0.75%和1.5%)也对基因表达有很强的作用,因此很难评定局部应用的协同效应,尽管在基底外侧应用中以较低浓度观察到这种协同效应(方法A)。
实施例3:用于制备鲁索替尼乳膏的方法以及用于制备鲁索替尼和卡泊三醇组合乳膏的方法。
本文描述了用于制备含有基于游离碱1.5%w/w鲁索替尼的鲁索替尼乳膏(制剂#1、#2、#4和#5)的方法以及制备含有基于游离碱1.5%w/w鲁索替尼和50微克/g卡泊三醇的鲁索替尼和卡泊三醇组合乳膏(制剂#3和#6)的方法。
对于鲁索替尼和卡泊三醇组合乳膏的制备,将鲁索替尼掺入水相中,并且首先将卡泊三醇溶解在中链甘油三酯中,并且然后添加到水包油乳液中。制备步骤详情如下:
1.在中链甘油三酯中的1mg/g卡泊三醇溶液的制备。经由在约60℃下加热将卡泊三醇以1mg/g溶解在中链甘油三酯中。当卡泊三醇完全溶解时,停止加热。将所得储备溶液用铝箔覆盖以避光。
2.水相的制备。将纯化水、EDTA二钠、低分子量PEG和磷酸鲁索替尼根据其如表10所述的相应重量百分比混合在一起,并将所得混合物在约55℃至约60℃下加热,同时搅拌以溶解EDTA二钠和鲁索替尼从而形成水相。
3.对羟基苯甲酸酯相的制备。将对羟基苯甲酸甲酯和对羟基苯甲酸丙酯根据其如表10所述的相应重量百分比添加到丙二醇中以形成混合物。将所得混合物在约55℃至约60℃下加热,同时搅拌以溶解对羟基苯甲酸甲酯和对羟基苯甲酸丙酯从而形成对羟基苯甲酸酯相。
4.黄原胶相的制备。将黄原胶与丙二醇根据表10中描述的相应重量百分比混合,并将所得混合物在约55℃至约60℃下加热以形成呈分散体形式的黄原胶相。
5.油相的制备。将白凡士林、轻质矿物油、硬脂酸甘油酯SE、鲸蜡醇、硬脂醇、聚二甲基硅氧烷、中链甘油三酯和聚山梨醇酯20根据表10中描述的相应重量百分比混合,并将所得混合物加热至约65℃至约68℃,同时搅拌直至所有赋形剂熔化以形成油相。
6.将水相加热至约65℃至约68℃,同时以约600-800rpm搅拌。
7.将对羟基苯甲酸酯相根据表10中描述的百分比转移到加热的水相中,并将所得混合物充分搅拌并保持在约65℃至约68℃下,将搅拌速度保持在约600–800rpm下。
8.将黄原胶根据表10中描述的百分比转移到水相和对羟基苯甲酸酯相的混合物中,并将所得混合物充分搅拌并保持在约65℃至约68℃下,将搅拌速度保持在约600–800rpm下。
9.水包油乳液的制备。将油相根据表10中描述的百分比转移到水相、对羟基苯甲酸酯相和黄原胶相的混合物中。将所得混合物充分搅拌并保持在约65℃至约68℃下,将搅拌速度保持在约600–800rpm下,以形成水包油乳液。
10.将水包油乳液冷却至约38℃至约40℃。
11.将苯氧乙醇根据表10中描述的百分比添加到冷却的水包油乳液中。将所得混合物的温度保持在约38℃至约40℃下,并将搅拌速度保持在约600–800rpm下。
对于鲁索替尼和卡泊三醇的组合乳膏(制剂#3和#6),将卡泊三醇在中链甘油三酯中的溶液和轻质矿物油根据表10中描述的相应百分比添加到水包油乳液中。将所得混合物保持在约38℃至约40℃下,将搅拌速度保持在约600–800rpm下。对于仅鲁索替尼乳膏(制剂#1、#2、#4和#5),将中链甘油三酯和轻质矿物油根据表10中描述的相应百分比添加到水包油乳液中。将所得混合物保持在约38℃至约40℃下,同时将搅拌速度保持在约600–800rpm下。将所得混合物冷却并停止搅拌后,形成并收集乳膏(制剂#1至#6)。
表9列出了乳膏制剂#1至#6的不同相的重量百分比。表10列出了乳膏制剂#1至#6中磷酸鲁索替尼、卡泊三醇和赋形剂的重量百分比。
表9.鲁索替尼乳膏(制剂#1、#2、#4和#5)以及鲁索替尼和卡泊三醇组合乳膏(制剂#3和#6)不同相的重量百分比。应注意,制剂#1至#6的磷酸鲁索替尼的量为1.98%,这对应于基于游离碱1.5%w/w的鲁索替尼。对于制剂#3和#6,卡泊三醇的量为0.005%w/w或50微克/g。制剂#1、#2、#4和#5不含卡泊三醇。
/>
表10.制剂#1至#6的磷酸鲁索替尼、卡泊三醇和赋形剂的重量百分比。
/>
制剂#1至#6的乳膏形式如图5所示。乳膏制剂#1至#3含有7.0%w/w的PEG 300;而乳膏制剂#4至#6含有7.0%w/w的PEG400。乳膏制剂#1、#3、#4和#6中的丙二醇含量为6.5%w/w,而乳膏制剂#2和#5中的丙二醇含量为8.5%w/w。在所有乳膏制剂#1至#6中,鲁索替尼含量为基于游离碱1.5%w/w。制剂#3和#6是含有鲁索替尼(基于游离碱1.5%w/w)和卡泊三醇(0.005%w/w)的鲁索替尼和卡泊三醇组合乳膏。
制备含有基于游离碱1.1%w/w鲁索替尼和0.0005%w/w卡泊三醇的额外制剂(制剂#7)。
对于鲁索替尼和卡泊三醇组合乳膏的制备,将鲁索替尼掺入水相中,并且将卡泊三醇加热溶解于液体油相,将固体油相赋形剂加热至熔化,并且然后将水相、液体油相和熔化的固体油相赋形剂合并并均质化以产生制剂,然后将其冷却。向冷却的制剂中添加抗微生物防腐剂并搅拌所得制剂直至视觉上均匀,如果需要,调节其pH并且根据需要向其中添加水以补足体积。制备步骤详情如下:
(i)最初将EDTA添加到琥珀色Duran中的水中,并以500RPM搅拌直至视觉上均匀。
(ii)最初将BHA添加到琥珀色Duran中的Transcutol P中,并以500RPM搅拌直至视觉上均匀。
(iii)将步骤(i)和(ii)的溶液添加到琥珀色Duran中的其余水相赋形剂(甘油)中,并通过磁力搅拌棒以500RPM搅拌直至视觉上均匀。
(iv)将磷酸鲁索替尼添加到步骤(iii)的水相中并以500RPM搅拌5min,磷酸鲁索替尼在此步骤中没有完全溶解。
(v)将步骤(iv)的悬浮液的pH用三乙醇胺调节至pH 6.0–7.0,并且磷酸鲁索替尼在此步骤期间溶解。
(vi)在单独的琥珀色Duran中,将BHT添加到油醇和甜杏仁油中,并以250RPM搅拌直至视觉上均匀。
(vii)将步骤(vi)的溶液添加到剩余的液体油相赋形剂(聚山梨醇酯80和轻质矿物油)中,并以500RPM搅拌3-5min,直至视觉上均匀。
(viii)将卡泊三醇添加到步骤(vii)的液体油相中并在65℃下以500RPM搅拌1小时,并且然后在环境实验室温度下搅拌过夜以溶解。
(ix)在步骤(viii)中的卡泊三醇溶解后,将泊洛沙姆407通过以500RPM搅拌来分散到步骤(viii)的溶液中。
(x)将固体油相赋形剂称入单独的琥珀色Duran中,置于70℃水浴中直至熔化。也将步骤(v)的水相、步骤(ix)的液体油相和均质器头(silverson、方孔、高剪切筛)置于水浴中3min。
(xi)将各相合并并在10,000RPM下均质化2min。
(xii)将步骤(xi)的制剂使用IKA锚桨以100RPM搅拌,直到制剂冷却至环境实验室温度。
(xiii)将苯氧乙醇添加到步骤(xii)的制剂中并手动搅拌直至视觉上均匀。
(xiv)检查制剂的pH,需要时进行调节,用水定容并进一步手动搅拌直至视觉上均匀。
表11列出了制剂#7的重量百分比。
表11.乳膏制剂#7的组成。应注意,磷酸鲁索替尼的量为1.464%,这对应于基于游离碱1.1%w/w的鲁索替尼。卡泊三醇的量为0.005%w/w。
1
实施例4.具有其他赋形剂浓度的鲁索替尼和卡泊三醇组合乳膏。
如实施例3中所述制备乳膏制剂,其中磷酸鲁索替尼以基于游离碱约0.75%w/w的量存在,需要时调节实施例3中的水百分比。
如实施例3所述制备乳膏制剂,其中丙二醇为约6.5%w/w至约15%w/w(例如,约6.5%w/w、约7%w/w、约7.5%w/w、约8%w/w、约8.5%w/w、约9%w/w、约9.5%w/w、约10%w/w、约10.5%w/w、约11%w/w、约11.5%w/w、约12%w/w、约12.5%w/w、约13%w/w、约13.5%w/w、约14%w/w、约14.5%w/w或约15%w/w),需要时调节实施例3中的水百分比。
如实施例3所述制备乳膏制剂,使用各种低分子量聚乙二醇(PEG),包括PEG200、PEG300、PEG400或其组合作为共溶剂。
如实施例3所述制备乳膏制剂,其中对羟基苯甲酸甲酯含量范围在0与约0.1%w/w之间,并且其中对羟基苯甲酸丙酯含量为0至约0.05%w/w(需要时调节实施例3中的水百分比)。
如实施例3所述制备乳膏制剂,可制备黄原胶含量为约0.2至约0.6%w/w的乳膏制剂(需要时调节实施例3中的水百分比)。
如实施例3所述制备乳膏制剂,其中单独或组合使用丁基化羟基甲苯(BHT)、丁基化羟基茴香醚(BHA)和生育酚,将其添加到油相中(需要时调节实施例3中的水百分比)。
如实施例3所述制备乳膏制剂,其中添加抗坏血酸棕榈酸酯、抗坏血酸或柠檬酸或其组合以增强卡泊三醇的稳定性。
实施例5.IL-23诱导的银屑病样疾病小鼠模型中的鲁索替尼和卡泊三醇组合乳膏
在已建立的IL-23诱导的银屑病样疾病小鼠模型中测试了组合乳膏制剂(实施例3的制剂#7)(Rizzo HL等人,“IL-23-mediated psoriasis-like epidermal hyperplasiais dependent on IL-17A,”J Immunol186:1495–1502(2011);T.P.Singh等人,“IL-23-andImiquimod-induced models of experimental psoriasis in mice,”Curr.Protoc.Immunol.e71,(2019);10.1002/cpim.71),所述疾病包括表皮和真皮中的棘皮症和炎性细胞积聚,导致局部皮肤增厚。在第0天、第2天、第4天和第7天将IL-23真皮内注射到一只耳朵。将局部乳膏媒介物或制剂#7(实施例3)局部应用于IL-23诱导的银屑病样小鼠的一只耳朵。每天两次(B.I.D)应用乳膏(每次应用20ug),持续8天。用工程师卡尺测量耳朵的肿胀程度。与媒介物治疗的小鼠相比,在用制剂#7治疗的小鼠中测量到耳朵增厚的统计学显著减少(p<0.001)(图10)。
根据前述描述,除本文所述的内容外,本发明要求保护的主题的各种修改对于本领域技术人员而言将是清楚的。此类修改也意图落入所附权利要求的范围内。本公开中引用的每个参考文献,包括所有专利、专利申请和出版物,均以引用方式整体并入本文。
- 小檗碱类似物与JAK抑制剂在胃肠道炎症性疾病治疗中的用途
- 小檗碱类似物与JAK抑制剂在胃肠道炎症性疾病治疗中的用途
