一种等电点沉淀结合超滤协同阳离子交换提取咸鸭蛋清溶菌酶的方法
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及溶菌酶提取技术领域,具体为一种等电点沉淀结合超滤协同阳离子交换提取咸鸭蛋清溶菌酶的方法。
背景技术
咸鸭蛋清是咸鸭蛋的重要组成部分,作为咸鸭蛋黄生产过程中产生的副产物,每年都有万吨的咸鸭蛋清被遗留,因其含有质量分数7%~10%的含盐量而导致利用困难,常被大多数食品企业所废弃。一方面造成优质蛋白质资源的浪费,另一方面咸鸭蛋清的腐败分解严重污染周围环境和水源。咸鸭蛋清的氨基酸组成与鸡蛋清极其相似,是一种能被人体充分利用的全价优质蛋白质。因此,研究咸鸭蛋清的合理利用,实现其营养增值,有利于提高资源的合理利用率;
溶菌酶是咸鸭蛋清中主要的生物活性成分之一,可催化水解细菌细胞壁中的N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4糖苷键。溶菌酶是自然界中广泛存在的天然抗菌物质,其在鸟类和家禽的蛋清中含量最为丰富,约占蛋清总蛋白的3.50%,是WHO/FDA安全认可的食品防腐剂,在食品、医药、日用化工等领域中实现了广泛应用。目前,市场上的商品溶菌酶大都是鸡蛋清分离纯化获得,对于咸鸭蛋清中溶菌酶的分离纯化还是鲜有文献报道;
溶菌酶的提取方法主要有直接结晶法、离子交换法、超滤法、双水相系统分离法、反胶团萃取法和亲和膜色谱法等。一些技术中采用活性蓝4和活性红120染料配体固定化复合膜纯化蛋清溶菌酶,对于活性红120和活性蓝4固定膜纯化溶菌酶的回收率分别为72%和16%。活性红120固定化膜为从蛋清中纯化溶菌酶表现出高吸附能力和高选择性。然而该技术实验操作难度大,成本相对较大,难以实现工业化量产。一些技术中采用氧化硅基质层之间保留非共价结合几丁质制备复合生物吸附剂,用于从未稀释的蛋清中纯化溶菌酶。研究结果表明去除了蛋清中87%的溶菌酶,通过过滤回收基质,最后溶菌酶的总收率为64%,纯化因子为20。该工艺具有低成本和高吸附性特点,但工艺制备复合生物吸附剂难度高,过程繁琐,生产上具有一定的局限性。一些技术中利用双水相分配系统与膜分离技术相结合,制得总回收率为47.5%,纯化因子为10.5,比活力为34188U/mg的溶菌酶。此工艺采用二元分离技术相结合的方法提取溶菌酶,获得的溶菌酶纯度较高,但该研究仍需进一步探索回收残余蛋清蛋白以及进一步实现溶菌酶扩大提取过程。
综上所述,针对现有技术对溶菌酶的提取,缺乏从咸鸭蛋中进行提取的合适方法,同时存在提取效率较低,工艺制备成本较高,操作复杂等问题,本研究创新性的采用等电点沉淀、超滤和阳离子交换相结合的方法对咸鸭蛋清溶菌酶进行分离纯化,并对咸鸭蛋清溶菌酶的酶学性质进行初步探究,以期为咸鸭蛋清溶菌酶的工业化提纯提供一条新思路。
针对上述问题,急需在原有溶菌酶提取的基础上进行创新设计。
发明内容
本发明的目的在于提供一种等电点沉淀结合超滤协同阳离子交换提取咸鸭蛋清溶菌酶的方法,以解决上述背景技术提出现有技术中针对溶菌酶提取,存在提取效率较低,工艺制备成本较高,操作复杂的问题,本发明技术方案针对现有技术解决方案过于单一的技术问题,提供了显著不同于现有技术的解决方案。
为实现上述目的,本发明提供如下技术方案:一种等电点沉淀结合超滤协同阳离子交换提取咸鸭蛋清溶菌酶的方法,该提取方法包括以下步骤:
S1:实验材料预处理
S1.1:咸鸭蛋清样品预处理:取一定量咸鸭蛋清,用2-4层纱布过滤,除去蛋清液中的杂质,然后采用磁力搅拌器搅拌20min,搅拌速度以不引起蛋清起泡为宜;
S1.2:离子交换树脂的预处理:量取一定体积D152大孔弱酸性阳离子交换树脂,用蒸馏水反复清洗,去掉其中杂质,再量取1000mL浓度为1mol/L的盐酸浸泡树脂12h,倾出上清液,然后用蒸馏水冲洗至pH值为6左右,再量取1000mL浓度为1mol/L氢氧化钠溶液浸泡树脂12h,倾出上清液,用蒸馏水冲洗至pH值为9左右,用水浸泡备用;
S2:等电点沉淀初步去杂蛋白
量取一定体积经预处理后的咸鸭蛋清,以体积比为1:4的比例加入C=0.20mol/L,pH=6.8的磷酸盐缓冲液混合均匀,放于4℃冰箱静置24h,然后使用冷冻离心机在温度4℃,转速12000r/min条件下离心20min,收集上清液;
S3:咸鸭蛋清超滤处理
S3.1:以10倍pH=8.5,C=0.20mol/L的磷酸盐缓冲液将初步去杂的咸鸭蛋清稀释,用高压均质机在24MPa条件下均质,室温下操作;
S3.2:咸鸭蛋清中杂蛋白的分子量大多大于30kDa,采用截留分子量为30kDa的PES膜超滤后能尽可能去除绝大多数杂蛋白,又充分保留咸鸭蛋清中的溶菌酶透过超滤膜,起到纯化溶菌酶的目的,实验在室温下进行,操作压力为0.35MPa,以pH=8.5,C=0.20mol/L的磷酸盐缓冲液3倍连续稀释,收集透过液,以待进一步纯化;
S3.3:采用截留分子量为5kDa的PES膜,操作压力为0.35MPa,室温下进行超滤除盐浓缩,收集截留液,以待进一步纯化;
S4:阳离子交换吸附纯化溶菌酶
将上述步骤S3.3中经脱盐后的截留液与步骤S1.2中一定量预处理的D152离子交换树脂搅拌混合,使树脂全部悬浮其中,搅拌吸附一段时间后静置分层,弃去上清液,滤干树脂,再加入等体积一定浓度的硫酸铵溶液,搅拌洗脱一段时间,滤出洗脱液,重复洗脱树脂3次,合并滤出的洗脱液;
S5:超滤离心管浓缩,冷冻干燥
采用截留量为10kDa的超滤离心管中,于5000×g,离心20min,保留上层截留液,再将截留液冷冻干燥制成干粉,低温保存,完成制备;
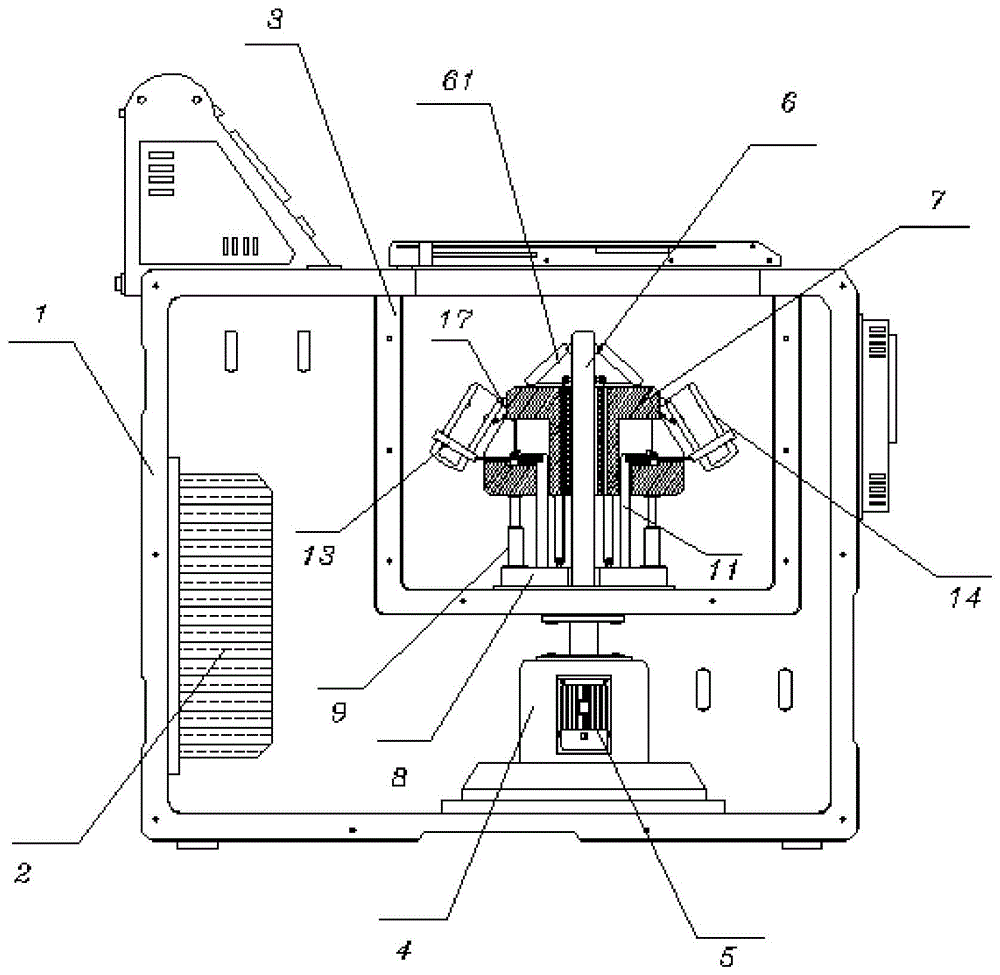
上述步骤S2所述的冷冻离心机包括箱体,所述箱体内部的侧壁上安装有制冷器,且箱体内部的顶部位置固定有安装框,并且箱体内部的顶部设置有安装座,而且安装座内嵌入式固定有电机;
还包括:
驱动杆,所述驱动杆的底部与电机的输出端相连接,且驱动杆贯穿轴承安装于安装框内,并且驱动杆的外侧套设有离心座,而且离心座位于安装框内,所述离心座中部空心处的内壁上竖直开设有定位槽,且定位槽内设置有定位杆,并且定位杆固定于驱动杆的外侧位置,所述安装框内部的底部轴承安装有环座,且环座的顶部边缘处与离心座的底部边缘处固定有弹性伸缩杆,所述离心座的外侧开设有调节槽,且调节槽内竖直贴合滑动有调节杆,并且调节杆的底部贯穿离心座固定于环座的顶部位置,而且调节杆位于弹性伸缩杆的内侧,所述调节杆顶部边端嵌入式滑动安装有限位杆,且限位杆的外端转轴连接有限位套,并且限位套内安装有安装筒,而且安装筒的顶部边缘处转轴连接于离心座的顶部边缘处,所述调节杆外端部的顶部位置处转轴连接有齿辊,且齿辊位于限位杆的上方,所述齿辊的后端固定有齿轮,且齿轮的一侧啮合有齿条,并且齿条竖向固定于调节槽内;
蜗杆,所述蜗杆通过扭簧嵌入式轴承安装于安装筒内壁的顶部位置处,且蜗杆上绕设有第一拉绳,并且第一拉绳的一端固定于离心座外侧的顶部位置,所述蜗杆的中部啮合有蜗轮,且蜗轮嵌入式活动安装于安装筒的内部,并且蜗轮的内壁上固定有凸块,所述安装筒的内壁上通过弹簧嵌入式弹性滑动安装有夹紧杆,且夹紧杆的内端固定有橡胶垫;
配重条,所述配重条的顶部转轴安装于驱动杆顶部的外侧,且配重条位于离心座的上方位置,并且配重条内侧的底部位置固定有第二拉绳,所述第二拉绳绕设在第一导辊和第二导辊上,且第一导辊固定于驱动杆外侧的顶部,并且第二导辊固定于环座的顶部,所述第二拉绳从第一导辊方向贯穿离心座到达第二导辊,且第二拉绳的一端绕过第二导辊固定于离心座的底部。
优选的,所述阳离子吸附交换条件为每100mL蛋清滤液中树脂用量为35mL、吸附时间为6h、(NH4)2SO4浓度为1.00mol/L、洗脱时间为60min。
优选的,所述配重条在驱动杆上等角度分布,且配重条初始状态呈倾斜设置,并且配重条的分布位置与安装筒的分布位置相对应,而且安装筒的初始状态呈倾斜设置。
优选的,所述定位杆在驱动杆上等角度分布有三个,且定位杆与定位槽侧壁相贴,并且定位槽在定位杆上竖直滑动。
优选的,所述限位杆的顶部等间距固定有齿块,且齿块与齿辊相啮合,并且限位杆在调节杆端部横向贴合滑动。
优选的,所述凸块呈弧形结构设计,且凸块与夹紧杆的分布位置相对应,并且夹紧杆等角度分布在安装筒内,而且凸块的运动轨迹与夹紧杆的端部重合。
与现有技术相比,本发明的有益效果是:
1.本发明,首先利用杂蛋白的等电点和分子量性质,通过等电点和超滤技术分离杂蛋白,得到高含盐量溶菌酶粗液,二次超滤实现脱盐和溶菌酶富集,离子交换吸附进行溶菌酶的提纯,通过多重工艺实现咸鸭蛋清溶菌酶的低盐度,高纯度的选择性分离,利用等电点沉淀和两次超滤技术去除咸鸭蛋清中其他的蛋白质、含盐量以及溶菌酶的富集,再以阳离子交换选择性吸附溶菌酶,实现溶菌酶的提纯,最后以超滤离心管进行脱盐浓缩,冷冻干燥制得溶菌酶成品,该方法所用工艺简单快捷,条件温和,可以获得高纯度与高生物活性的溶菌酶,整体操作简单,在获取较高提取率的同时,工艺成本较低;
2.本发明,在对混合后的咸鸭蛋清和磷酸盐缓冲液进行冷冻离心分离过程中,利用离心力带动配重条活动,由配重条带动离心座移动,进而带动安装筒向上转动,可以使得安装筒内的试管趋于水平状态,相较于传统技术中,在试管倾斜状态下进行离心分离而言,本发明,安装筒初始状态下处于倾斜状态,方便试管的放置和拿取,在离心力作用下,由配重条带动安装筒的活动,通过将安装筒和试管调节至趋于水平的状态,使得离心力和试管的放置方向趋于一致,可以有效提高分离效果,而传统倾斜状态下,离心力方向和试管管壁方向趋于垂直状态,使得分离的溶液大部分被甩至管壁上,难以及时沉淀在底部,导致分离效果较差,进一步的,安装筒在向上移动过程中,还可以带动蜗杆转动,由蜗杆和蜗轮带动夹紧杆移动,通过夹紧杆配合橡胶垫对试管进行夹紧,提高使用时的安全性,可以有效避免试管破损,同时,由于安装筒的移动角度是受配重条影响,而配重条的移动角度受驱动杆的转速影响,本发明,还可以通过调整转速来调整配重条的倾斜角度,进而调整安装筒的倾斜角度,适用于不同情况下的离心分离操作。
附图说明
图1为本发明正剖结构示意图;
图2为本发明安装框内部剖面结构示意图;
图3为本发明安装筒俯视分布结构示意图;
图4为本发明图中A处放大结构示意图;
图5为本发明调节杆和限位杆俯视结构示意图;
图6为本发明安装筒俯视剖面结构示意图;
图7为本发明溶菌酶浓度标准曲线图;
图8为本发明单因素实验分析图;
图9为本发明响应面实验分析图;
图10为本发明咸鸭蛋清溶菌酶FTIR谱示图;
图11为本发明pH值对溶菌酶酶活的影响示图;
图12为本发明温度对溶菌酶酶活的影响示图;
图13为本发明溶菌酶的pH稳定性示图;
图14为本发明溶菌酶的温度稳定性示图;
图15为本发明金属离子对溶菌酶酶活的影响示图;
图16为本发明表面活性剂对溶菌酶酶活的影响示图。
图中:1、箱体;2、制冷器;3、安装框;4、安装座;5、电机;6、驱动杆;61、配重条;62、第二拉绳;63、第一导辊;64、第二导辊;7、离心座;71、定位槽;72、定位杆;8、环座;9、弹性伸缩杆;10、调节槽;11、调节杆;12、限位杆;121、齿块;13、限位套;14、安装筒;15、齿辊;16、齿轮;17、齿条;18、蜗杆;19、第一拉绳;20、蜗轮;21、凸块;22、夹紧杆;23、弹簧;24、橡胶垫。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
请参阅图1-6,本发明提供一种技术方案:一种等电点沉淀结合超滤协同阳离子交换提取咸鸭蛋清溶菌酶的方法,箱体1、制冷器2、安装框3、安装座4、电机5、驱动杆6、配重条61、第二拉绳62、第一导辊63、第二导辊64、离心座7、定位槽71、定位杆72、环座8、弹性伸缩杆9、调节槽10、调节杆11、限位杆12、齿块121、限位套13、安装筒14、齿辊15、齿轮16、齿条17、蜗杆18、第一拉绳19、蜗轮20、凸块21、夹紧杆22、弹簧23、橡胶垫24;
实施例1
该提取方法包括以下步骤:
S1:实验材料预处理
S1.1:咸鸭蛋清样品预处理:取一定量咸鸭蛋清,用2-4层纱布过滤,除去蛋清液中的杂质,然后采用磁力搅拌器搅拌20min,搅拌速度以不引起蛋清起泡为宜;
S1.2:离子交换树脂的预处理:量取一定体积D152大孔弱酸性阳离子交换树脂,用蒸馏水反复清洗,去掉其中杂质,再量取1000mL浓度为1mol/L的盐酸浸泡树脂12h,倾出上清液,然后用蒸馏水冲洗至pH值为6左右,再量取1000mL浓度为1mol/L氢氧化钠溶液浸泡树脂12h,倾出上清液,用蒸馏水冲洗至pH值为9左右,用水浸泡备用;
S2:等电点沉淀初步去杂蛋白
量取一定体积经预处理后的咸鸭蛋清,以体积比为1:4的比例加入C=0.20mol/L,pH=6.8的磷酸盐缓冲液混合均匀,放于4℃冰箱静置24h,然后使用冷冻离心机在温度4℃,转速12000r/min条件下离心20min,收集上清液;
S3:咸鸭蛋清超滤处理
S3.1:以10倍pH=8.5,C=0.20mol/L的磷酸盐缓冲液将初步去杂的咸鸭蛋清稀释,用高压均质机在24MPa条件下均质,室温下操作;
S3.2:咸鸭蛋清中杂蛋白的分子量大多大于30kDa,采用截留分子量为30kDa的PES膜超滤后能尽可能去除绝大多数杂蛋白,又充分保留咸鸭蛋清中的溶菌酶透过超滤膜,起到纯化溶菌酶的目的,实验在室温下进行,操作压力为0.35MPa,以pH=8.5,C=0.20mol/L的磷酸盐缓冲液3倍连续稀释,收集透过液,以待进一步纯化;
S3.3:采用截留分子量为5kDa的PES膜,操作压力为0.35MPa,室温下进行超滤除盐浓缩,收集截留液,以待进一步纯化;
S4:阳离子交换吸附纯化溶菌酶
将上述步骤S3.3中经脱盐后的截留液与步骤S1.2中一定量预处理的D152离子交换树脂搅拌混合,使树脂全部悬浮其中,搅拌吸附一段时间后静置分层,弃去上清液,滤干树脂,再加入等体积一定浓度的硫酸铵溶液,搅拌洗脱一段时间,滤出洗脱液,重复洗脱树脂3次,合并滤出的洗脱液;
S5:超滤离心管浓缩,冷冻干燥
采用截留量为10kDa的超滤离心管中,于5000×g,离心20min,保留上层截留液,再将截留液冷冻干燥制成干粉,低温保存,完成制备;
上述步骤S2中的冷冻离心机包括箱体1,箱体1内部的侧壁上安装有制冷器2,且箱体1内部的顶部位置固定有安装框3,并且箱体1内部的顶部设置有安装座4,而且安装座4内嵌入式固定有电机5;驱动杆6的底部与电机5的输出端相连接,且驱动杆6贯穿轴承安装于安装框3内,并且驱动杆6的外侧套设有离心座7,而且离心座7位于安装框3内,离心座7中部空心处的内壁上竖直开设有定位槽71,且定位槽71内设置有定位杆72,并且定位杆72固定于驱动杆6的外侧位置,安装框3内部的底部轴承安装有环座8,且环座8的顶部边缘处与离心座7的底部边缘处固定有弹性伸缩杆9,离心座7的外侧开设有调节槽10,且调节槽10内竖直贴合滑动有调节杆11,并且调节杆11的底部贯穿离心座7固定于环座8的顶部位置,而且调节杆11位于弹性伸缩杆9的内侧,调节杆11顶部边端嵌入式滑动安装有限位杆12,且限位杆12的外端转轴连接有限位套13,并且限位套13内安装有安装筒14,而且安装筒14的顶部边缘处转轴连接于离心座7的顶部边缘处,调节杆11外端部的顶部位置处转轴连接有齿辊15,且齿辊15位于限位杆12的上方,齿辊15的后端固定有齿轮16,且齿轮16的一侧啮合有齿条17,并且齿条17竖向固定于调节槽10内;蜗杆18,蜗杆18通过扭簧嵌入式轴承安装于安装筒14内壁的顶部位置处,且蜗杆18上绕设有第一拉绳19,并且第一拉绳19的一端固定于离心座7外侧的顶部位置,蜗杆18的中部啮合有蜗轮20,且蜗轮20嵌入式活动安装于安装筒14的内部,并且蜗轮20的内壁上固定有凸块21,安装筒14的内壁上通过弹簧23嵌入式弹性滑动安装有夹紧杆22,且夹紧杆22的内端固定有橡胶垫24;配重条61,配重条61的顶部转轴安装于驱动杆6顶部的外侧,且配重条61位于离心座7的上方位置,并且配重条61内侧的底部位置固定有第二拉绳62,第二拉绳62绕设在第一导辊63和第二导辊64上,且第一导辊63固定于驱动杆6外侧的顶部,并且第二导辊64固定于环座8的顶部,第二拉绳62从第一导辊63方向贯穿离心座7到达第二导辊64,且第二拉绳62的一端绕过第二导辊64固定于离心座7的底部;阳离子吸附交换条件为每100mL蛋清滤液中树脂用量为35mL、吸附时间为6h、(NH4)2SO4浓度为1.00mol/L、洗脱时间为60min;配重条61在驱动杆6上等角度分布,且配重条61初始状态呈倾斜设置,并且配重条61的分布位置与安装筒14的分布位置相对应,而且安装筒14的初始状态呈倾斜设置;定位杆72在驱动杆6上等角度分布有三个,且定位杆72与定位槽71侧壁相贴,并且定位槽71在定位杆72上竖直滑动;限位杆12的顶部等间距固定有齿块121,且齿块121与齿辊15相啮合,并且限位杆12在调节杆11端部横向贴合滑动;凸块21呈弧形结构设计,且凸块21与夹紧杆22的分布位置相对应,并且夹紧杆22等角度分布在安装筒14内,而且凸块21的运动轨迹与夹紧杆22的端部重合;
上述步骤中所使用的冷冻离心机的具体操作为:将混合冷冻后的咸鸭蛋清和磷酸盐缓冲液放入试管中,打开箱盖,将试管放入安装筒14内,关闭箱盖,启动电机5和制冷器2,由制冷器2保持箱体1内部恒温,电机5带动驱动杆6转动,驱动杆6通过定位杆72和定位槽71带动离心座7转动,离心座7通过弹性伸缩杆9带动环座8转动,驱动杆6在高速转动中,使得配重条61在离心力的作用下向上转动,配重条61拉动第二拉绳62,通过第一导辊63和第二导辊64的引导,通过配重条61的向上转动拉动离心座7向下活动,弹性伸缩杆9被压缩,同时调节槽10在调节杆11上向上活动,带动齿辊15和齿轮16活动,进而通过齿轮16和齿条17的啮合,由齿轮16带动齿辊15和转动,齿辊15与齿块121啮合,带动限位杆12在调节杆11上向外侧滑动,配合限位杆12在限位套13上的转动,可以推动安装筒14在离心座7外侧向上转动,使得安装筒14和内部试管倾斜角度逐渐趋于水平状态,提高内部溶液的离心分离效果,同时安装筒14的转动,改变了蜗杆18的位置,使得第一拉绳19得以拉动蜗杆18转动,蜗杆18带动蜗轮20转动,使得凸块21与夹紧杆22接触,推动夹紧杆22向内活动,配合橡胶垫24对试管进行夹紧操作,提高离心效率,离心结束后,驱动杆6转速逐渐下降,则配重条61在自身重力作用下逐渐向下转动,进而逐渐失去对离心座7的拉力,离心座7在弹性伸缩杆9的作用下上移复位,使得安装筒14得以复位,便于对试管进行拿取,同时蜗杆18在扭簧作用下复位转动,带动蜗轮20逆向转动,失去与夹紧杆22的推力,夹紧杆22在弹簧23的作用下复位,可以将离心完成的试管取出,方便后续操作;
实施例2
与实施例1不同之处在于:
在阳离子交换吸附纯化溶菌酶步骤中,阳离子吸附交换条件为每100mL蛋清滤液中树脂用量为30mL、吸附时间为4h、(NH4)2SO4浓度为0.8mol/L、洗脱时间为40min;
实施例3
与实施例1不同之处在于:
在阳离子交换吸附纯化溶菌酶步骤中,阳离子吸附交换条件为每100mL蛋清滤液中树脂用量为40mL、吸附时间为8h、(NH4)2SO4浓度为1.2mol/L、洗脱时间为40min;
根据上述实施例,进行响应面法优化咸鸭蛋清溶菌酶提取工艺,以树脂用量、吸附时间、洗脱液浓度、洗脱时间为考察因素,测定洗脱液中溶菌酶酶含量(mg/mL),并以此为指标考察单因素试验结果。在单因素试验的基础上,选择树脂用量(A)、吸附时间(B)、洗脱液(NH4)2SO4浓度(C)、洗脱时间(D)4个因素,选取其中三个因素低、中、高3个水平,采用4因素3水平的Box-Behnken试验,并以溶菌酶酶含量为指标,确定最佳提取工艺;
测定指标与方法
溶菌酶含量的测定
实验以0.90%NaCl溶液作为为参比溶液,用分析天平准确称取溶菌酶标准品试剂0.50g,加入0.90%的NaCl溶液配制浓度为0.50mg/mL,吸取1mL,2mL,3mL,4mL,5mL,分别置于10mL的具塞比色管中,用0.90%的NaCl溶液定容至10mL,混匀,依次在281nm处测定试样溶液的吸光度,实验做3组平行实验取平均值,绘制标准曲线,见图7;由标准曲线回归方程计算试样的溶菌酶浓度;
咸鸭蛋清中溶菌酶的含量计算式如下:
式中:c:洗脱液中溶菌酶的浓度,mg/mL;a:稀释倍数;V:洗脱液的体积,mL;w:提取用咸鸭蛋清的体积,mL。
咸鸭蛋清中溶菌酶的得率计算式如下:
式中:y:溶菌酶得率,%;m:实验最终所制备的溶菌酶成品质量,mg;
M:提取用消耗的咸鸭蛋清的质量,mg;
溶菌酶比活力的测定
于待测管中加入0.40mL待测酶液,再加入2mL溶壁微球菌菌液后开始计时,在波长450nm处分别反应15s和75s后,记录吸光度A15和A75,按每1min较OD450值下降0.001为1个活力单位(U)定义,计算酶活力;
式中:EA:溶菌酶比活力,U/mg;Ew:所测酶液中溶菌酶含量,mg。
溶菌酶提取样品纯度鉴定
采用聚丙烯酰胺凝胶电泳法(SDS-PAGE)检测咸鸭蛋清溶菌酶提取样品的纯度,实验制备1mg/mL溶液,配液10μL,然后用考马斯亮蓝R-250染色2h,脱色过液。此外,分离胶和浓缩胶的比例是12%和5%,电压为80V/120V。
扫描电镜(SEM)显微结构分析
将冷冻干燥机冻干的样品使用双面导电胶带安装在SEM螺根上,存根和样品用溅射装置涂上一层薄薄的金,用扫描电子显微镜检查表观形态。
二次结构特征分析
取用冷冻干燥制得的咸鸭蛋清溶菌酶样品1mg与100mg干燥的溴化钾混合,然后将混合物研磨成均匀的粉末,压成薄晶片,红外光谱有FTIR光谱仪检测400-4000cm-1,吸收度选自1600cm-1-1700cm-1,在32次扫描中,以4cm-1的分辨率采集自动信号,空气被用作基线校正,在扫描每个样本之前减去空气,采用OMNICV8.0软件分析光谱数据,通过FTIR谱的峰值拟合对二次结构含量进行定量分析,根据积分峰面积计算不同二次结构的相对百分比;
溶菌酶酶学性质的测定
最适温度与最适pH值
准确称取一定量的咸鸭蛋清溶菌酶溶于不同pH值(3、4、5、6、7、8、9)的磷酸盐缓冲液中,精确配制成浓度为20μg/mL的溶液,25℃水浴30min,研究其最适pH;再准确称取一定量的咸鸭蛋清溶菌酶分别溶于最适pH下的磷酸盐缓冲液中,精确配制成浓度为20μg/mL,分别在不同温度(20、30、40、50、60、70、80、90℃)和条件下,保温30min,研究其最适反应温度,两者均以其中的最高酶活为100%,其他条件下的相对酶活为该酶活与最高酶活的百分比;
热稳定性与酸碱稳定性
准确称取一定量的咸鸭蛋清溶菌酶,分别溶于不同pH值(3、4、5、6、7、8、9)的磷酸盐缓冲液中,精确配制成浓度为20μg/mL的溶液,分别放在25℃恒温水浴中每隔30min测定在不同pH、不同时间下的相对酶活;准确称取一定量的咸鸭蛋清溶菌酶分别溶于最适pH下的磷酸盐缓冲液中,精确配制成浓度为20μg/mL,再将酶液分别置于不同温度(20、30、40、50、60、70、80、90℃)中,每隔30min测定酶液的相对酶活;
金属离子对溶菌酶酶活的影响
准确称取一定量的咸鸭蛋清溶菌酶,用磷酸盐缓冲液配制成质量浓度为20μg/mL的酶液,再等体积的加入不同金属离子(Na+,K+,Ca2+,Fe2+、Cu2+、Mn2+,Zn2+,Mg2+)溶液,使溶液中各金属离子含量均为0.01mol/L,同时一组不加任何金属离子作为空白对照,设其酶活力为100%,在25℃水浴30min后,测定各实验组的相对酶活;
表面活性剂对溶菌酶酶活的影响
准确称取一定量的咸鸭蛋清溶菌酶,用磷酸盐缓冲液配制成质量浓度为20μg/mL的酶液,等体积加入体积分数10%的甘油、Span20、Span40、Span80、Tween20、Tween40、Tween80,使溶液中的各表面活性剂的含量均为1.0mg/L,同时一份不加表面活性剂作为空白对照组,其酶活力设为100%,25℃水浴30min,测定各实验组的相对酶活;
结果与分析
单因素实验分析
由图8中a可知,当树脂用量超过40mL后溶菌酶浓度不再增加,表明超滤液中基本上无残余溶菌酶。由此可知,最佳树脂用量为超滤液体积的40%;由图8中b可知,随着吸附时间的延长,溶菌酶浓度逐渐增加,直至到达6h时,溶菌酶浓度基本持平,因此选择吸附时间为6h为宜,对溶菌酶浓度有较好影响。由图8中c可知,随着硫酸铵浓度的增加,其洗脱能力逐渐提高,当超过12%以后,溶菌酶浓度又略有上升,可能原因是在高盐浓度下蛋白质会发生部分盐析,造成溶液浑浊,吸光度上升,所以最佳硫酸铵浓度以10%为宜。由图8中d可知,随着洗脱时间的延长,溶菌酶的浓度逐渐增加,在洗脱时间到达60min以后,溶菌酶浓度基本保持不变,故洗脱时间定为60min为宜;
响应面实验分析
根据单因素试验结果可知,采用阳离子交换吸附提取溶菌酶的最优工艺条件为树脂用量40mL/100mL蛋清滤液,吸附时间6h,(NH4)2SO4浓度1mol·L-1,洗脱时间60min。经过分析进一步做Box-Behnken试验优化实验条件,试验设计及结果如下方表格所示,拟合得到多元回归方程:
酶含量=2.57+0.22A+0.18B+0.097C+0.067D+0.081AB-0.038AC+0.058AD+(5.263E-0.003)BC+0.16BD+0.11CD-0.73A2-0.66B2-0.55C2-0.50D2;
/>
采用DesignExpert10.0.7软件对数据进行分析,实验结果如下方表格所示,该模型的P<0.001,达到了显著水平,说明模型与实际情况拟合情况较好;失拟项的P=0.5287>0.05,失拟项不显著,并且因素A、B、A2、B2、C2、D2都达到了显著水平。方程的相关系数R2=0.9312,说明93.12%的数据可以用该模型进行解释,该方程的模型具有较高拟合度;
注:NS.表示不显著;*.表示差异较显著(P<0.1);**.表示差异较显著(P<0.05);***.表示差异极显著(P<0.01);
如图9中,为了得到最高的溶菌酶酶含量,吸附和洗脱的各条件需要合适的交叉选择。响应面图可直观反映各因素及交互作用对酶活力的影响,故取3项显著性较高的交互项制作响应面图,根据Box-Behnken优化试验拟合响应曲面图和方差分析得知,对溶菌酶比活力影响大小顺序为BD>DD>AB;
对二次回归方程求一阶偏导,当响应值(溶菌酶酶含量)为最大值时,各因子水平为每100mL蛋清滤液中,树脂用量(A)为35mL、吸附时间(B)为6h、(NH4)2SO4浓度(C)为1.00mol/L、洗脱时间(D)为60min。此时理论预测溶菌酶酶含量为2.61mg/mL。对所获得的阳离子交换法各最优条件做平行验证试验,重复3次,得到的溶菌酶酶含量为2.59mg/mL,与理论值误差在±1%,说明实验建立的工艺参数是可靠的,具有可行性。
根据响应面优化实验得到的最佳工艺条件,洗脱液经超滤离心管超滤,透析并冷冻干燥,可得溶菌酶的得率为0.36%,酶活力为18300U/mg;
咸鸭蛋清溶菌酶FTIR谱
咸鸭蛋清溶菌酶的FTIR谱如图10所示;咸鸭蛋清溶菌酶形成了特定的二级结构,包括α-螺旋、β-转角、和无规则卷曲等。其中酰胺I区域带(1600-1700cm-1)在FTIR光谱中,与C=O拉伸振动有关,可以用来评估蛋白质中二级结构的变化[i]。在酰胺I波段中,峰值1652cm-1、1535cm-1、1453cm-1三处的吸收峰与溶菌酶标准品的吸收峰吻合,α-螺旋和β-折叠是有序的,β-转角相对松散,部分有序,而无规则卷曲松散无序。经脱盐处理的低浓度盐对溶菌酶的氢键网络的未造成大的破坏作用,提取的咸鸭蛋清溶菌酶与其余的天然溶菌酶二级结构基本相同;
溶菌酶的酶学性质探究
pH值对溶菌酶酶活的影响
由图11可知,pH值对咸鸭蛋清溶菌酶的相对酶活呈现先上升后下降的趋势,pH5-8之间可保持60%,当pH值为到达7时,酶活力达到最大值,因此可以预见,咸鸭蛋清溶菌酶的最适pH值为7左右。pH值对咸鸭蛋清溶菌酶的活力造成影响的原因可能是pH值的改变会使溶菌酶所带电荷的性质和数量发生变化,进而影响酶的带电状态酶的活性降低;
温度对溶菌酶酶活的影响
由图12可知,随着反应温度的升高,咸鸭蛋清溶菌酶的活力均呈现先上升后下降的趋势,在20~60℃时,溶菌酶的相对酶活随温度的升高缓慢上升,可能是因为温度的高造成分子间的运动加快,促进酶活力的升高,而在60~80℃时,温度的升高,溶菌酶会发生部分失活,造成酶活力下降,因此最适反应温度为60℃;
溶菌酶的pH稳定性
由图13可知,在pH4~7的范围内,相对酶活保持在80%以上,稳定性良好,当pH>7时,随着处理时间的增加,酶活力逐渐下降,由此可见,咸鸭蛋清溶菌酶在偏酸性及中性条件下比较稳定,而过酸、过碱的条件下酶活力显著降低,可能的原因是溶菌酶在偏酸性及中性环境中其主链构象随酸度变化影响不大,结构比较稳定,而过酸、过碱可能会造成分子内部基团离解,使得溶菌酶发生伸展、变性;
溶菌酶的温度稳定性
由图14可知,咸鸭蛋清溶菌酶在较低的温度下比较稳定,随着处理时间的延长,酶活力逐渐降低,并且随着温度升高,酶活力的降低加快。原因可能是随温度升高,溶菌酶热变性速率加快,使得酶失活速率加快,进而令酶活力显著降低;
金属离子对溶菌酶酶活的影响
由图15可知,Na+、Mg2+对溶菌酶有的激活作用;而Fe2+、Cu2+、Zn2+对溶菌酶活性有较强的抑制作用;其它金属离子(Mn2+,K+,Ca2+)对溶菌酶活性无明显影响。由此可知,除少数金属离子对酶活力有较强的抑制作用外,大部分金属离子对酶活力影响不大;
表面活性剂对溶菌酶酶活的影响
由图16可知,不同的表面活性剂对咸鸭蛋清溶菌酶均有轻微的抑制作用,其中的Span20、Span40、Span80、Tween20、Tween40、Tween80对酶活力的影响较小,相对酶活力保持在80%以上,而经过体积分数10%的甘油处理的溶菌酶相对酶活力降至75%。添加表面活性剂会与溶菌酶结合形成复合物,表面活性剂的亲水基团与酶通过氢键作用结合ii,降低酶的作用力;
结论
本发明创新性的采用等电点沉淀、超滤和阳离子交换相结合的方法分离提取咸鸭蛋清溶菌酶,并对其酶学性质进行初步探究。实验最终获得纯度较高的溶菌酶,其得率为0.36%,酶活力为18300U/mg。并且提取工艺设备简单,操作方便,生产周期短,对咸鸭蛋清中其他蛋白质影响较小,可最大程度保留其商业价值,适合于工业化大规模生产。实验通过对咸鸭蛋清溶菌酶的酶学性质进行探究,测得最适pH值为7,且在4~7范围内稳定性较好;最适反应温度为60℃,低温时其热稳定性良好,在超过60℃以后其酶活力显著降低;Na+、Mg2+对溶菌酶有一定的激活作用;而Fe2+、Cu2+、Zn2+对溶菌酶活性有较强的抑制作用;其它金属离子(Mn2+,K+,Ca2+)对溶菌酶活性无明显影响。不同的表面活性剂对咸鸭蛋清溶菌酶均有一定的抑制作用,其中以甘油的抑制作用最强。本发明从综合利用咸鸭蛋清资源角度出发,寻找一种提取率和溶菌酶纯度较高且适合工业化生产的工艺途径,确立最佳提取工艺,旨在为咸鸭蛋清实现溶菌酶高效、高产的提取与分离提供了新路径。
本说明书中未作详细描述的内容属于本领域专业技术人员公知的现有技术,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上;术语“上”、“下”、“左”、“右”、“内”、“外”、“前端”、“后端”、“头部”、“尾部”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”、“第三”等仅用于描述目的,而不能理解为指示或暗示相对重要性。在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 基于图像识别的图像处理方法、装置、设备及存储介质
- 夜景图像处理方法、装置、电子设备及存储介质
- 一种图像处理方法及其装置、设备和存储介质
- 人脸图像的处理方法及装置、电子设备和存储介质
- 抓拍检索方法、图像处理方法、装置、设备及存储介质
- 图像处理装置、图像处理方法、执行图像处理方法的程序以及存储程序的存储介质
- 图像重建处理方法、图像重建处理存储介质以及搭载了该图像重建处理存储介质的断层摄影装置
