一种蛋白质构架的人工金属酶的新制备方法和用途
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及化工领域和西药制备领域,具体为一种蛋白质构架的人工金属酶的新制备方法和用途。
背景技术
天然酶具有催化效率高、作用专一性强和反应条件温和等显著特点,但是,天然酶存在纯化困难和价格昂贵等方面的不足,而且因为天然酶的专一性强,不能催化大多数化学反应,这就限制其大规模生产和应用。人工酶可以克服天然酶所存在的问题。人工酶有小分子和大分子两种构架方式。基于小分子构架的人工酶,结构较为简单,缺少底物识别信息,因此表现出较低的催化活性。对比而言,蛋白质大分子作为人工酶的构架,不仅能提供容纳催化中心所需要的三维空间,而且为催化提供了良好的微环境,于是,蛋白质分子构架的人工酶能充分展现其催化能力。因此,利用天然蛋白质作为人工酶的研究工具,对于人工酶的研究与开发都具有十分重要的价值。
基于蛋白质分子构架的人工金属酶,金属活性中心的封装方法有共价键法和非共价键法。共价键法具有接近100%的高封装率,需要利用蛋白质分子的巯基等活性基团与金属配合物反应形成共价键,这种方法对金属配合物的基团种类及其反应性有特殊要求,而且金属配合物在蛋白质锚定位点,也局限在蛋白质分子的巯基等活性基团对应的区域。相反,非共价键法利用疏水作用、配位键、氢键和分子间力等形成金属配合物-蛋白质加合物,其特点是:金属活性中心尺寸越大或其亲和力越弱,封装成功率就越低。Ohash i等报道,利用非共价键法把Cr(sa l en)封装进脱辅基肌红蛋白内部的封装率低于15%,而Mn(sa len)则很难封装成功。
可见,共价键法和非共价键法都不能满足大规模生产要求,仍需要一种新的人工金属酶制备方法,经济、高效地把金属活性中心封装进蛋白质内部。
发明内容
针对现有技术的不足,本发明提供了一种蛋白质构架的人工金属酶的新制备方法和用途,高效地把金属活性中心封装进蛋白质内部。
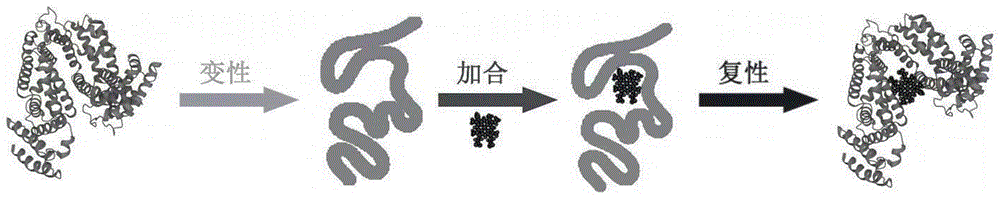
为实现以上目的,本发明提供一种制备人工金属酶新方法,蛋白质变性-加合-复性三步法:
第一步通过变性手段把蛋白质的折叠构象变成张开构象;
第二步加入金属活性中心使之与张开构象的蛋白质分子形成加合物;
第三步解除变性,蛋白质在自主折叠过程中把金属活性中心封装进蛋白质内部。
优选的,所述人工金属酶的制备方法,包括以下步骤:
S1、变性,把1.8μmo l蛋白质溶于3mL变性剂中,室温放置2-6h,得到变性蛋白质溶液;
其中,耐酸金属活性中心所用的变性剂为5-8mo l L
S2、加合,把1.2-1.8μmo l金属活性中心加入步骤A所得的变性蛋白质溶液中,室温放置6-12h,得到变性蛋白质加合物溶液;
S3、复性,将步骤S2中所得的变性蛋白质加合物溶液进行复性,得到蛋白质构架人工金属酶溶液。
其中,变性剂A体系复性:步骤S2所得的变性蛋白质加合物溶液,按加合物溶液与水1.0-1.2体积比加水稀释,室温放置2-6h,然后在pH6.5-7.5磷酸缓冲溶液中透析2-4次除去尿素,得到蛋白质构架人工金属酶溶液;
变性剂B体系复性具体为:步骤S2所得的变性蛋白质加合物溶液,按变性蛋白质加合物溶液与乳酸水溶液1.0-2.5体积比加入0.2mo l L
优选的,所述蛋白质为白蛋白,包括牛血清白蛋白(BSA)和人血清白蛋白(HSA)。
优选的,所述金属活性中心为金属配合物,包括血红素(HEM,耐碱也耐酸),二氯三(三苯基膦)钌(RuL
优选的,所述乳酸为外消旋体乳酸。
经实验检测,金属活性中心封装率高,原料价廉易得,方法工艺简便,对生产设备及环境条件要求不高,非常适合大规模工业化生产,可应用于化工领域和西药制备领域。
本发明提供了一种蛋白质构架的人工金属酶的新制备方法和用途。具备以下有益效果:
鉴于人工金属酶制备三步法具有诸多的优秀品质,便于开发更多人工金属酶新产品,并应用到工业生产中,使其得到充分的利用,对增加化工和西药制备行业的生产能力,提高化工和西药制备行业的竞争力具有重要意义。
附图说明
图1是本发明实施例1中HEM-BSA的紫外-可见吸收谱;
图2是本发明实施例2中HEM-HSA的紫外-可见吸收谱;
图3是本发明实施例3中HEM-BSA的紫外-可见吸收谱;
图4是本发明实施例4中RuL
图5是本发明实施例5中HEM-BSA的活性-pH关系图;
图6是本发明制备蛋白质构架的人工金属酶的原理示意图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:碱变性法制备人工过氧化物酶HEM-BSA
A.变性
把120mg BSA溶于3mL 0.2mo l L
B.加合
把150μL(1.8μmo l)HEM的2mo l L
C.复性
步骤B所得的变性蛋白质加合物溶液(HEM-DBSA),加入3mL 0.2mo l L
HEM-BSA溶液的紫外-可见吸收谱如图1所示,表明HEM已封装进BSA内部。
实施例2:碱变性法制备人工过氧化物酶HEM-HSA
A.变性
把120mg HSA溶于3mL 0.2mo l L
B.加合
把150μL(1.8μmo l)HEM的2mo l L
C.复性
步骤B所得的变性蛋白质加合物溶液(HEM-DHSA),加入3mL 0.2mo l L
HEM-HSA溶液的紫外-可见吸收谱如图2所示,表明HEM已封装进HSA内部。
实施例3:酸变性法制备人工过氧化物酶HEM-BSA
A.变性
把120mg BSA溶于3mL 8mo l L
B.加合
把150μL(1.8μmo l)HEM的2mo l L
C.复性
步骤B所得的变性蛋白质加合物溶液,加入3mL水稀释,室温放置6h,然后在pH7.0磷酸缓冲溶液中透析3次除去尿素,得到人工过氧化物酶HEM-BSA溶液。
HEM-BSA溶液的紫外-可见吸收谱如图3所示,其中HEM+BSA为HEM的2mo l L
实施例4:酸变性法制备人工金属酶RuL
A.变性
把120mg BSA溶于3mL 8mo l L
B.加合
把150μL(1.8μmo l)RuL
C.复性
步骤B所得的变性蛋白质加合物溶液,加入3mL水稀释,室温放置6h,然后在pH7.0磷酸缓冲溶液中透析3次除去尿素,得到人工过氧化物酶RuL
RuL
实施例5:人工过氧化物酶HEM-BSA活性-pH关系测定
在室温(20℃)下,将50μL实施例1所得的HEM-BSA溶液(0.045μmo l)加到500μL1mmo l L
活性实验表明,实施例1所得的HEM-BSA具有过氧化物酶的功能,且与天然酶类似,也具有最适pH。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
