工程化改造的细胞以及工程化改造细胞的方法
文献发布时间:2024-04-18 19:52:40
相关专利申请
本专利申请要求于2020年8月7日递交的申请号为202010788848.0的中国专利申请以及于2021年7月16日递交的申请号为202110807344.3的中国专利申请的优先权。
本发明提供工程化T细胞和产生工程化T细胞的方法。所述工程化T细胞和含有所述工程化T细胞的组合物可用于治疗疾病,如癌症(肿瘤)、自身免疫性疾病。
免疫细胞疗法作为基于细胞的肿瘤疗法是目前最有前景的治疗方法。工程化免疫细胞具有精准靶向肿瘤细胞,同时不伤害正常组织的潜力;临床观察指示它们具有显著主要的抗癌活性。现仍迫切需要通过拓宽免疫细胞适用性和增强其功效用于改善免疫细胞疗法。
发明内容
本发明提供了一种工程化改造T细胞或多能干细胞的方法,还提供工程化的T细胞和多能干细胞。
在本发明的第一方面,提供了一种工程化改造T细胞或多能干细胞的方法,所述方法是:对所述T细胞或多能干细胞进行工程化改造,得到NKG2A的表达、活性和/或信号传导减少的工程化T细胞或工程化多能干细胞。
在一些具体实施方案中,所述的工程化改造包含对NKG2A的表达、活性和/或信号传导相关的核酸或蛋白的修饰。
在一些具体实施方案中,所述工程化改造导致所述工程化T细胞或所述工程化多能干细胞中的NKG2A表达减少的遗传修饰,或导致所述工程化T细胞或所述工程化多能干细胞中的调节NKG2A的表达或活性的蛋白表达减少的遗传修饰,或导致所述工程化T细胞或所述工程化多能干细胞中的参与NKG2A依赖性信号传导的蛋白表达减少的遗性修饰。
在一些具体实施方案中,所述工程化改造为对编码NKG2A的基因的修饰,或是对编码调节NKG2A的表达或活性的蛋白的基因的修饰,或是对编码参与NKG2A依赖性信号传导的蛋白的基因的修饰。
在一些具体实施方案中,所述遗传修饰包括缺失、突变、和/或插入;优选的,所述遗传修饰使得NKG2A、调节NKG2A的表达或活性的蛋白、或参与NKG2A依赖性信号传导的蛋白的开放阅读框发生变化。
在一些具体实施方案中,所述NKG2A的基因、编码调节NKG2A的表达或活性的蛋白的基因、或编码参与NKG2A依赖性信号传导的蛋白的基因的至少一个等位基因被破坏;优选的,两个等位基因都被破坏。
在一些具体实施方案中,所述的工程化改造包括给予所述T细胞或多能干细胞有效量的抑制性核酸分子,所述抑制性核酸分子能够抑制所述T细胞或所述多能干细胞的NKG2A的表达,或能够抑制上调所述T细胞或所述多能干细胞的NKG2A的表达或活性的蛋白的表达,或能够抑制所述T细胞或所述多能干细胞的参与NKG2A依赖性信号传导的蛋白的表达;优选的,所述抑制性核酸分子包含与所述编码NKG2A的基因、抑制上调NKG2A的表达或活性的蛋白的基因、或参与NKG2A依赖性信号传导的蛋白的基因互补的序列。
在一些具体实施方案中,所述抑制性核酸包含RNA干扰剂。
在一些具体实施方案中,所述抑制性核酸包含siRNA、shRNA或miRNA。
在一些具体实施方案中,所述的遗传修饰是通过基因编辑技术进行修饰;优选的,所述的基因编辑技术选自CRISPR/Cas9技术、人工锌指核酸酶(Zinc Finger Nucleases,ZFN)技术、转录激活样效应因子(transcription activator-like effector,TALE)技术或TALE-CRISPR/Cas9技术;更优选的,所述的基因编辑技术为CRISPR/Cas9技术。
在一些优选例中,CRISPR/Cas9技术使用的gRNA选自SEQ ID NO:12、SEQ ID NO:13、SEQ ID NO:14或SEQ ID NO:15所示序列。
在一些具体实施方案中,所述NKG2A的表达、活性和/或信号传导减少是永久的、短暂的或可诱导的。
在一些具体实施方案中,所述T细胞为天然的T细胞、或是能够识别特定靶抗原的T细胞;优选的,所述T细胞为包含特定T细胞亚群的细胞;更优选的,所述特定T细胞亚群是记忆性干细胞样T细胞(Tscm细胞)、中心记忆T细胞(Tcm)、效应性T细胞(Tef)、调节性T细胞(Tregs),效应记忆T细胞(Tem)或γδT细胞。
在一些具体实施方案中,所述多能干细胞为天然的多能干细胞或是能够识别特定靶抗原的多能干细胞。
在一些具体实施方案中,所述靶抗原是肿瘤抗原或病原体抗原。
在一些具体实施方案中,所述靶抗原选自Claudin18.2、Claudin18.1、Claudin 6、血管内皮生长因子受体、磷脂酰肌醇蛋白聚糖-3(GPC3)、B细胞成熟抗原(BCMA)、碳酸酐酶9(CAIX)、tEGFR、CD19、CD20、CD22、间皮素、CEA和乙型肝炎表面抗原、抗叶酸受体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、上皮糖蛋白2(EPG-2)、上皮糖蛋白40(EPG-40)、EPHa2、erb-B2、erb-B3、erb-B4、erbB二聚体、EGFR vIII、叶酸结合蛋白(FBP)、FCRL5、FCRH5、胎儿乙酰胆碱受体、GD2、GD3、HMW-MAA、IL-22R-α、IL-13R-α2、激酶插入结构域受体(kdr)、κ轻链、路易斯Y、L1细胞粘附分子(L1-CAM)、黑色素瘤相关抗原(MAGE)-A1、MAGE-A3、MAGE-A6、优先表达的黑色素瘤抗原(PRAME)、存活蛋白、TAG72、B7-H6、IL-13受体α2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGEA1、HLA-A2、PSCA、叶酸受体-a、CD44v6、CD44v7/8、avb6整合素、8H9、NCAM、VEGF受体、5T4、胎儿AchR、NKG2D配体、CD44v6、双重抗原、癌症-睾丸抗原、间皮素、鼠CMV、粘蛋白1(MUC1)、MUC16、PSCA、NKG2D、NY-ESO-1、MART-1、gp100、G蛋白偶联受体5D(GPCR5D)、ROR1、TAG72、VEGF-R2、癌胚抗原(CEA)、前列腺特异性抗原、PSMA、Her2/neu、雌激素受体、孕酮受体、肝配蛋白B2、CD123、c-Met、GD-2、O-乙酰化GD2(OGD2)、CE7、Wilms肿瘤1(WT-1)、细胞周期蛋白、细胞周期蛋白A2、CCL-1、CD138、病原体特异性 抗原和与通用标签相关的抗原。
在一些具体实施方案中,所述识别特定靶抗原的T细胞或者识别特定靶抗原的多能干细胞表达有识别特定靶抗原的外源蛋白;优选的,所述外源蛋白含有识别所述靶抗原的抗体或靶抗原的配体。
在一些具体实施方案中,所述外源蛋白为嵌合抗原受体、嵌合T细胞受体、T细胞抗原耦合器(TAC)。
在一些具体实施方案中,所述外源蛋白识别至少一种靶抗原。
在一些具体实施方案中,所述外源蛋白识别两种或三种靶抗原。
在一些具体实施方案中,所述两种或三种靶抗原表达在同一类细胞,或同一类病原体,或同一个器官。
在一些具体实施方案中,所述两种或三种靶抗原靶向不同的细胞。
在一些具体实施方案中,所述的靶抗原含有NKG2A;优选的,所述靶抗原还含有肿瘤抗原。在具体实施方案中,所述肿瘤抗原为BCMA或CD19。
在一些具体实施方案中,所述的携带有识别靶抗原的外源蛋白的T细胞或所述的携带有识别靶抗原的多能干细胞含有能够识别不同靶抗原的第一外源蛋白和第二外源蛋白。
在一些具体实施方案中,所述第一外源蛋白和第二外源蛋白所识别的抗原是表达在在同一类细胞,或同一类病原体,或同一个器官。
在一些具体实施方案中,所述第一外源蛋白和第二外源蛋白所识别的抗原表达在不同的细胞;优选的,所述第一外源蛋白识别肿瘤抗原或病原体抗原,所述第二外源蛋白识别NKG2A。
在一些具体实施方案中,所述工程化T细胞或工程化多能干细胞包含有识别NKG2A的蛋白。
在一些具体实施方案中,所述T细胞从以下来源获得,所述来源包括:PBMC、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾组织或肿瘤组织。
在一些具体实施方案中,所述方法还包含工程化改造T细胞或多能干细胞的内源 性TCR分子沉默;进一步优选的,所述工程化改造T细胞或多能干细胞的内源性MHC分子沉默。
在一些具体实施方案中,所述TCR分子沉默是指编码TCR的α和β链中的一种或两种链的基因发生沉默;优选地,所述TCR分子沉默是指编码TCR的α链的基因(即TRAC基因)发生沉默;更优选地,所述TCR分子沉默是指编码TCR的α链恒定区的基因发生沉默;进一步优选地,所述TCR分子沉默是指编码TCR的α链恒定区的基因的第一个外显子发生沉默。
在一些具体实施方案中,所述MHC分子是指HLA分子。在具体实施方案中,所述HLA分子选自HLA-I类和/或HLA-II分子,包含HLA-A、HLA-B、HLA-C、B2M和CIITA分子中的至少一种。在一些具体实施方案中,所述HLA分子为I类的HLA分子。一些在具体实施方案中,所述HLA分子为B2M分子。
在一些具体实施方案中,采用基因编辑技术使内源性TCR分子沉默和内源性MHC分子沉默。在具体实施方案中,所述的基因编辑技术选自CRISPR/Cas技术、人工锌指核酸酶(Zinc Finger Nucleases,ZFN)技术、转录激活样效应因子(transcription activator-like effector,TALE)技术或TALE-CRISPR/Cas技术;优选的,采用CRISPR/Cas技术;更优选地,采用CRISPR/Cas9技术。
在一些具体实施方案中,采用CRISPR/Cas9技术进行B2M分子沉默时,选取的gRNA的序列如SEQ ID NO:54所示。
在一些具体实施方案中,采用CRISPR/Cas9技术进行TCR的α链分子沉默时,选取的gRNA的序列如SEQ ID NO:53所示。
在本发明的第二方面,提供了一种基于CRISPR/Cas系统对细胞中的NKG2A进行基因编辑的方法,其特征在于,采用的gRNA为包含有SEQ ID NO:12、SEQ ID NO:13、SEQ ID NO:14或SEQ ID NO:15所示的序列。
在一些具体实施方案中,所述Cas酶为Cas9酶、Cas12酶。
在一些具体实施方案中,将Cas酶和gRNA的复合物导入所述细胞中进行基因编辑,所述Cas9酶的酶活力为0.1~1nmol,优选为0.2~0.7nmol,进一步优选为0.3~0.5nmol,最优选为0.37nmol。
在一些具体实施方案中,Cas9酶和gRNA的摩尔比比例为1:1~1:10,优选为1:3~1:5,进一步优选为1:4。
在一些具体实施方案中,所述细胞为真核细胞;优选所述真核细胞是T细胞或多能干细胞。
在一些具体实施方案中,还对所述细胞的TRAC的进行编辑和/或对B2M基因进行编辑。
在一些具体实施方案中,所述的T细胞或多能干细胞还表达有嵌合受体、外源性的细胞因子、抑制性/激活性受体或配体,共刺激因子。
在本发明的第三方面,提供了一种RNA构建体,其包含选自SEQ ID NO:12、SEQ ID NO:13、SEQ ID NO:14或SEQ ID NO:15所示的核苷酸序列。
在一些具体实施方案中,所述gRNA构建体用于知道Cas酶的识别;在具体实施方式中,所述Cas酶是天然Cas酶或经工程化不具有切割能力的Cas酶。
在本发明的第四方面,提供了一种工程化T细胞,所述工程化T细胞NKG2A的表达、活性和/或信号传导减少。
在一些具体实施方案中,所述工程化是指基因工程化。
在一些具体实施方案中,所述基因工程化包含:导致所述工程化T细胞中NKG2A的表达减少的遗传修饰,导致调节NKG2A的表达或活性的蛋白的表达减少的遗传修饰,或参与NKG2A依赖性信号传导的蛋白的表达减少的遗性修饰。
在一些具体实施方案中,所述的导致所述工程化T细胞中NKG2A表达减少的遗传修饰为对编码NKG2A的基因的修饰;
所述的导致调节NKG2A的表达或活性的蛋白表达减少的遗传修饰是指对编码调节NKG2A的表达或活性的蛋白的基因的修饰;
所述的参与NKG2A依赖性信号传导的蛋白表达减少的遗性修饰是指对编码参与NKG2A依赖性信号传导的蛋白的基因的修饰。
在一些具体实施方案中,所述遗传修饰包括缺失、突变、和/或插入;优选的,所述遗传修饰使得NKG2A、调节NKG2A的表达或活性的蛋白、或参与NKG2A依赖性信号传导的蛋白的开放阅读框发生变化。
在一些具体实施方案中,所述NKG2A的基因、编码调节NKG2A的表达或活性的蛋白的基因、和/或编码参与NKG2A依赖性信号传导的蛋白的基因的至少一个等位基因被破坏;优选的,两个等位基因都被破坏。
在一些具体实施方案中,所述NKG2A的表达、活性和/或信号传导减少是永久的、短暂的或可诱导的。
在一些具体实施方案中,所述工程化T细胞还表达有识别靶抗原的外源蛋白。
在一些具体实施方案中,所述工程化T细胞在受到所述的靶抗原刺激时,NKG2A的表达不上调。
在一些具体实施方案中,优选的,所述外源蛋白是嵌合抗原受体(CAR)、嵌合T细胞受体(TCR)、T细胞抗原耦合器(TAC)。
在一些具体实施方案中,所述靶抗原是肿瘤抗原或病原体抗原。
在一些具体实施方案中,当出现导致NKG2A表达上调的条件时,所述的工程化T细胞的NKG2A的表达不上调或上调更弱。
在一些具体实施方案中,所述工程化T细胞的NKG2A的表达与没有进行NKG2A的表达、活性、和/或信号传导减少的工程化改造的T细胞相比,NKG2A的表达不上调或上调更弱。
在一些具体实施方案中,所述NKG2A的表达量减少约50%、60%、70%、80%、90%或95%以上。
在一些具体实施方案中,NKG2A的表达采用免疫印迹法或流式检测法进行检测。
在一些具体实施方案中,与NKG2A的表达、活性、和/或信号传导没有减少的T细胞相比,所述工程化T细胞的免疫活性增加或者增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一些具体实施方案中,所述肿瘤抗原是BCMA或CD19;优选地,所述外源蛋白是含有能够特异性识别BCMA的抗体的嵌合抗原受体;更优选的,所述特异性识别BCMA的抗体含有SEQ ID NO:16所示的HCDR1、SEQ ID NO:17所示的HCDR2、SEQID NO:18所示的HCDR3、以及SEQ ID NO:19所示的LCDR1、SEQ ID NO:20所示的LCDR2、SEQ ID NO:21所示的LCDR3;进一步优选的,所述特异性识别BCMA的抗体或其功能片段含有SEQ ID NO:22所示的重链可变区和SEQ ID NO:23所示的轻链可变区。
在一些具体实施方案中,所述工程化T细胞的内源性TCR不表达;
在一些具体实施方案中,编码TCR的α和β链中的一种或两种链的基因发生沉默;优选地,所述TCR分子沉默是指编码TCR的α链的基因(即TRAC基因)发生沉默;更优选地,所述TCR分子沉默是指编码TCR的α链恒定区的基因发生沉默;进一步优选地,所述TCR分子沉默是指编码TCR的α链恒定区的基因的第一个外显子发生沉默。
在一些具体实施方案中,所述工程化T细胞中的MHC分子的表达、活性和/或信号传导降低;优选的,所述MHC分子是指HLA分子;更优选的,所述HLA分子选自HLA-I类和/或HLA-II分子,包含HLA-A、HLA-B、HLA-C,B2M和CIITA分子中的至少一种。
在一些具体实施方案中,所述HLA分子为I类的HLA分子。
在一些具体实施方案中,所述HLA分子为B2M分子。
在一些具体实施方案中,所述工程化T细胞还表达识别NKG2A的抗体或其功能片段。
在一些具体实施方案中,所述识别NKG2A的抗体含有SEQ ID NO:3所示的HCDR1,SEQ ID NO:4所示的HCDR2,SEQ ID NO:5所示的HCDR3,SEQ ID NO:6所示的LCDR1,SEQ ID NO:7所示的LCDR2,SEQ ID NO:8所示的LCDR3;优选的,所述识别NKG2A的抗体含有SEQ ID NO:1所述的重链可变区或SEQ ID NO:2所述的轻链可变区。
在一些具体实施方案中,所述工程化T细胞还表达特异性结合NKG2A的嵌合抗原受体(CAR)、嵌合T细胞受体、T细胞抗原耦合器(TAC);优选地,所述CAR包括:
(i)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域和CD3ζ;和/或
(ii)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD137的共刺激信号结构域和CD3ζ;和/或
(iii)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域、CD137的共刺激信号结构域和CD3ζ。
在一些具体实施方案中,所述工程化T细胞表达靶向NKG2A的嵌合抗原受体和靶向肿瘤抗原的嵌合抗原受体;优选的,所述工程化T细胞表达靶向NKG2A的嵌合抗原受体和靶向BCMA或CD19的嵌合抗原受体
在一些具体实施方案中,所述工程化T细胞表达有如SEQ ID NO:25和SEQ ID NO:9所示的嵌合抗原受体。
在一些具体实施方案中,所述工程化T细胞表达识别NKG2A的抗体和识别肿瘤抗原的抗体。
在一些具体实施方案中,所述的识别NKG2A的抗体和所述的识别肿瘤抗原的抗体相连形成串联抗体。
在一些具体实施方案中,所述识别NKG2A的抗体和所述的识别肿瘤抗原的抗体通过连接链相连;优选的,所述连接链选自SEQ ID NO:34、SEQ ID NO:35、SEQ ID NO:36、SEQ ID NO:37、SEQ ID NO:38、或SEQ ID NO:39所示的序列。
在一些具体实施方案中,所述的识别NKG2A的抗体和所述的识别肿瘤抗原的抗体的连接方式是:
(1)识别NKG2A的抗体的轻链/重链(或轻链可变区/重链可变区)—识别NKG2A的抗体的重链/轻链(或重链可变区/轻链可变区)—识别肿瘤抗原的抗体的重链/轻链(或重链可变区/轻链可变区)轻链/重链—识别肿瘤抗原的抗体的轻链/重链(或轻链可变区/重链可变区);
(2)识别肿瘤抗原的抗体的轻链(或轻链可变区)—识别NKG2A的抗体的重链(或重链可变区)—识别NKG2A的抗体的轻链(或轻链可变区)—识别肿瘤抗原的抗体的重链(或重链可变区);或
(3)识别NKG2A的抗体的轻链(或轻链可变区)—识别肿瘤抗原的抗体的重链(或重链可变区)—识别肿瘤抗原的抗体的轻链(或轻链可变区)—识别NKG2A的抗体的重链(或重链可变区)。
在一些具体实施方案中,所述串联抗体连接有跨膜域和胞内域,形成表达在所 述工程化T细胞上的外源受体。
在一些具体实施方案中,所述胞内域为细胞质信号传导结构域;优选的,所述胞内域还包含共刺激信号域。
在一些具体实施方案中,所述肿瘤抗原为BCMA。
在一些具体实施方案中,所述的串联抗体的序列含有SEQ ID NO:1所示的VH、SEQ ID NO:2所示的VL,SEQ ID NO:22所示的VH、以及SEQ ID NO:23所示的VL。
在一些具体实施方案中,其特征在于,所述外源受体的氨基酸序列如SEQ ID NO:26、SEQ ID NO:55或SEQ ID NO:57所示。
在本发明的第五方面,提供了靶向NKG2A的第一CAR T细胞与靶向靶抗原的第二CAR T细胞的联合使用在疾病治疗中的用途,所述第一CAR T细胞和/或第二CAR T细胞的内源性的NKG2A表达、活性和/或信号传导减少;优选的,所述靶抗原是肿瘤抗原,所述疾病是肿瘤。
在一些具体实施方案中,所述第一CAR T细胞和/或第二CAR T细胞的内源性的NKG2A表达、活性和/或信号传导减少。
在一些具体实施方案中,所述第二CAR T细胞识别肿瘤抗原。
在一些具体实施方案中,所述肿瘤抗原是CD19和BCMA。
在一些具体实施方案中,所述第一CAR T细胞和/或第二CAR T细胞的TCR分子沉默。
在一些具体实施方案中,所述TCR分子沉默是指编码TCR的α和β链中的一种或两种链的基因发生沉默;优选地,所述TCR分子沉默是指编码TCR的α链的基因(即TRAC基因)发生沉默;更优选地,所述TCR分子沉默是指编码TCR的α链恒定区的基因发生沉默;进一步优选地,所述TCR分子沉默是指编码TCR的α链恒定区的基因的第一个外显子发生沉默。
在一些具体实施方案中,所述第一CAR T细胞和/或第二CAR T细胞的内源性MHC分子沉默。
在一些具体实施方案中,所述MHC分子是指HLA分子;优选的,所述HLA分子选自HLA-I类和/或HLA-II分子,包含HLA-A、HLA-B、HLA-C,B2M和CIITA分子中的 至少一种;更优选的,所述HLA分子为I类的HLA分子。
在一些具体实施方案中,所述HLA分子为B2M分子。
在一些具体实施方案中,采用基因编辑技术使内源性TCR分子沉默、内源性MHC分子沉默、或内源性的NKG2A表达、活性和/或信号传导减少。
在本发明的第六方面,提供了靶向NKG2A的第一CAR T细胞与靶向靶抗原的第二CAR T细胞的联合使用在疾病治疗中的用途,其特征在于,同时给予NKG2A蛋白的抑制剂。
在一些具体实施方案中,所述第一CAR T细胞和/或第二CAR T细胞的TCR分子沉默。
在一些具体实施方案中,所述TCR分子沉默是指编码TCR的α和β链中的一种或两种链的基因发生沉默;优选地,所述TCR分子沉默是指编码TCR的α链的基因(即TRAC基因)发生沉默;更优选地,所述TCR分子沉默是指编码TCR的α链恒定区的基因发生沉默;进一步优选地,所述TCR分子沉默是指编码TCR的α链恒定区的基因的第一个外显子发生沉默。
在一些具体实施方案中,所述第一CAR T细胞和/或第二CAR T细胞的内源性MHC分子沉默。
在一些具体实施方案中,所述MHC分子是指HLA分子;优选的,所述HLA分子选自HLA-I类和/或HLA-II分子,包含HLA-A、HLA-B、HLA-C,B2M和CIITA分子中的至少一种;更优选的,所述HLA分子为I类的HLA分子。
在具体实施方案中,所述HLA分子为B2M分子。
在本发明的第七方面,提供了一种组合物,其包含有效量的本发明第四方面所述的工程化T细胞。优选地,还包含药学上可接受的载体;优选地,所述载体是盐水溶液、右旋糖溶液或5%人血清白蛋白。优选地,还包含冷冻保护剂。
本发明第八方面,提供了一种工程化T细胞,所述工程化T细胞被基因工程化为减少所述细胞中的NKG2A的表达、活性和/或信号传导。
在一些具体实施方案中,所述工程化T细胞包含:
编码NKG2A的基因的遗传破坏和/或导致所述工程化T细胞中NKG2A表 达减少的遗传破坏;
编码NKG2A的表达或活性的蛋白质的基因的遗传破坏和/或导致调节NKG2A的表达或活性的蛋白质表达减少的遗传破坏;和/或
编码参与NKG2A依赖性信号传导的蛋白质的基因的遗传破坏和/或导致参与NKG2A依赖性信号传导的蛋白质表达减少的遗传性破坏。
在一些具体实施方案中,所述遗传破坏包括缺失、突变和/或插入,从而导致所述基因中的过早终止密码子或者所述基因的开放阅框的移码。
在一些具体实施方案中,所述工程化T细胞中编码NKG2A的基因、编码调节NKG2A的表达或活性的蛋白质的基因和/或编码参与NKG2A依赖性信号传导的蛋白质的基因的两个等位基因都被破坏。
在一些具体实施方案中,所述工程化T细胞包含靶向所述T细胞中的基因的抑制性核酸分子,从而导致NKG2A的表达减少、调节NKG2A的表达或活性的蛋白质的表达减少和/或参与NKG2A依赖性信号传导的蛋白质的表达减少。
在一些具体实施方案中,与未基因工程化的T细胞中的蛋白质表达相比,所述工程化T细胞中的NKG2A、调节NKG2A的表达或活性的蛋白质和/或参与NKG2A依赖性信号传导的蛋白质的表达减少大于或者大于约50%、60%、70%、80%、90%或95%。
在一些具体实施方案中,所述工程化T细胞中NKG2A的表达减少。
本发明第九方面,提供了一种工程化T细胞,其在编码NKG2A的基因中包含遗传破坏,其中所述细胞中NKG2A的表达减少。
在一些具体实施方案中,所述遗传破坏包括缺失、突变和/或插入,从而导致所述基因中的过早终止密码子或者所述基因的开放阅读框的移码。
在一些具体实施方案中,所述工程化T细胞的基因组中编码NKG2A的基因的两个等位基因都被破坏。
在一些具体实施方案中,所述工程化T细胞包含靶向编码NKG2A的基因的抑制性核酸分子。
在一些具体实施方案中,所述抑制性核酸分子包含与所述编码NKG2A的基因互补的序列。
在一些具体实施方案中,,所述抑制性核酸包含RNA干扰剂。
在一些具体实施方案中,所述抑制性核酸包含siRNA、shRNA或miRNA,优选地,所述抑制性核酸序列含有SEQ ID NO:12、13、14或15所示序列。
在一些具体实施方案中,所述NKG2A的表达、活性和/或信号传导减少是永久的、短暂的或可诱导的。
在一些具体实施方案中,与未基因工程化的T细胞中NKG2A的表达、活性和/或信号传导相比,所述工程化T细胞中NKG2A的表达、活性和/或信号传导减少大于或者大于约50%、60%、70%、80%、90%或95%。
在一些具体实施方案中,在所述细胞中NKG2A的表达在免疫印迹测定中和/或在流式检测中检测不到。
在一些具体实施方案中,与未基因工程化的T细胞相比,所述工程化T细胞的免疫活性增加或者增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%,
在一些具体实施方案中,,与未基因工程化的T细胞相比,所述工程化T细胞体外抑制肿瘤细胞增殖、和/或体内抑制肿瘤细胞增殖、肿瘤体积增加或者增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一些具体实施方案中,所述细胞还表达嵌合抗原受体(CAR)、修饰的T细胞(抗原)受体(TCR)、T细胞融合蛋白(TFP)、T细胞抗原耦合器(TAC)、aTCR-T或其组合。优选地,所述CAR包括:
(i)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域和CD3ζ;和/或
(ii)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD137的共刺激信号结构域和CD3ζ;和/或
(iii)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域、CD137的共刺激信号结构域和CD3ζ;
优选地,所述靶抗原包括肿瘤抗原、病原体抗原;
优选的,所述肿瘤抗原包括Claudin18.2、Claudin18.1、Claudin 6、血管内皮生长因子受体、磷脂酰肌醇蛋白聚糖-3(GPC3)、B细胞成熟抗原(BCMA)、碳酸酐酶 9(CAIX)、tEGFR、CD19、CD20、CD22、间皮素、CEA和乙型肝炎表面抗原、抗叶酸受体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、上皮糖蛋白2(EPG-2)、上皮糖蛋白40(EPG-40)、EPHa2、erb-B2、erb-B3、erb-B4、erbB二聚体、EGFR vIII、叶酸结合蛋白(FBP)、FCRL5、FCRH5、胎儿乙酰胆碱受体、GD2、GD3、HMW-MAA、IL-22R-α、IL-13R-α2、激酶插入结构域受体(kdr)、κ轻链、路易斯Y、L1细胞粘附分子(L1-CAM)、黑色素瘤相关抗原(MAGE)-A1、MAGE-A3、MAGE-A6、优先表达的黑色素瘤抗原(PRAME)、存活蛋白、TAG72、B7-H6、IL-13受体α2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGEA1、HLA-A2、PSCA、叶酸受体-a、CD44v6、CD44v7/8、avb6整合素、8H9、NCAM、VEGF受体、5T4、胎儿AchR、NKG2D配体、CD44v6、双重抗原、癌症-睾丸抗原、间皮素、鼠CMV、粘蛋白1(MUC1)、MUC16、PSCA、NKG2D、NY-ESO-1、MART-1、gp100、G蛋白偶联受体5D(GPCR5D)、ROR1、TAG72、VEGF-R2、癌胚抗原(CEA)、前列腺特异性抗原、PSMA、Her2/neu、雌激素受体、孕酮受体、肝配蛋白B2、CD123、c-Met、GD-2、O-乙酰化GD2(OGD2)、CE7、Wilms肿瘤1(WT-1)、细胞周期蛋白、细胞周期蛋白A2、CCL-1、CD138、病原体特异性抗原和与通用标签相关的抗原;
优选地,所述靶向BCMA的CAR含有能够特异性识别BCMA的抗体;
优选的,所述特异性识别BCMA的抗体含有SEQ ID NO:16所示的HCDR1、SEQ ID NO:17所示的HCDR2、SEQ ID NO:18所示的HCDR3、以及SEQ ID NO:19所示的LCDR1、SEQ ID NO:20所示的LCDR2、SEQ ID NO:21所示的LCDR3;
优选的,所述特异性识别BCMA的抗体或其功能片段含有SEQ ID NO:22所示的重链可变区和SEQ ID NO:23所示的轻链可变区。
在一些具体实施方案中,所述细胞是来源于人的自体T细胞;优选地,所述细胞为原代T细胞。
在具体实施方案中,减少所述细胞中的MHC表达、活性和/或信号传导;优选的,所述MHC为MHC I类分子;更优选地,所述MHC I为HLA;更优选地,所述HLA为HLA-I;更优选地,所述HLA-I选自HLA-A、HLA-B、HLA-C、B2M中的一种或两种以上;最优选的,所述HLA-I包括HLA-A和B2M;
优选地,所述工程化T细胞包含靶向编码MHC的基因的抑制性核酸分子;
优选地,所述抑制性核酸分子包含与所述编码MHC的基因互补的序列;
优选地,所述抑制性核酸包含RNA干扰剂;
优选地,所述抑制性核酸包含siRNA、shRNA或miRNA;
优选地,所述MHC的表达、活性和/或信号传导减少是永久的、短暂的或可诱导的;
优选地,与未基因工程化的T细胞中MHC的表达、活性和/或信号传导相比,所述工程化T细胞中MHC的表达、活性和/或信号传导减少大于或者大于约50%、60%、70%、80%、90%、95%或100%;
优选地,利用免疫印迹测定和/或在流式检测,检测不到所述工程化T细胞中表达的MHC的表达。
在一些具体实施方案中,所述细胞还表达识别NKG2A的抗体或其功能片段,和/或表达特异性结合NKG2A的嵌合抗原受体(CAR)、修饰的T细胞(抗原)受体(TCR)、T细胞融合蛋白(TFP)、T细胞抗原耦合器(TAC)、aTCR-T或其组合。优选地,所述CAR包括:
(i)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域和CD3ζ;和/或
(ii)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD137的共刺激信号结构域和CD3ζ;和/或
(iii)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域、CD137的共刺激信号结构域和CD3ζ;
优选的,所述特异性结合NKG2A的抗体含有SEQ ID NO:3所示的HCDR1,SEQ ID NO:4所示的HCDR2,SEQ ID NO:5所示的HCDR3,SEQ ID NO:6所示的LCDR1,SEQ ID NO:7所示的LCDR2,SEQ ID NO:8所示的LCDR3;
优选的,所述识别NKG2A的抗体含有SEQ ID NO:1所述的重链可变区或SEQ ID NO:2所述的轻链可变区。
在一些具体实施方案中,所述细胞是来源于同种异体T细胞;优选地,所述细胞来源于人的T细胞;优选地,所述细胞为原代T细胞。
本发明第十方面提供了一种产生工程化T细胞的方法,其包括对T细胞进行基因工程化以减少所述细胞中的NKG2A的表达、活性和/或信号传导。优选地,减少表达包括:
在所述T细胞中破坏或抑制编码NKG2A的基因和/或破坏或抑制某一基因,从而导致NKG2A的表达减少;
在所述T细胞中破坏或抑制编码调节NKG2A的表达或活性的蛋白质的基因和/或破坏或抑制某一基因,从而导致调节NKG2A的表达或活性的蛋白质的表达减少;和/或
在所述T细胞中破坏或抑制编码参与NKG2A依赖性信号传导的蛋白质的基因和/或破坏或抑制某一基因,从而导致参与NKG2A依赖性信号传导的蛋白质的表达减少;
优选地,包括在所述基因中引入缺失、突变或插入;
优选地,所述基因编码NKG2A;
优选地,所述基因的破坏或抑制通过在允许破坏或抑制所述基因的条件下在所述T细胞中引入靶向所述基因的内切核酸酶来实现;
优选地,所述内切核酸酶选自TAL核酸酶、巨核酸酶、锌指核酸酶、Cas9和Argonaute;
优选地,破坏或抑制通过在导致抑制所述基因的条件下在所述T细胞中引入靶向所述基因的抑制性核酸来实现;
优选地,所述抑制性核酸分子包含与所述编码NKG2A的基因互补的序列;
优选地,所述抑制性核酸包含RNA干扰剂;
优选地,所述核酸是siRNA、shRNA或miRNA;
优选地,所述表达减少是永久的、短暂的或可诱导的;
优选地,与未基因工程化的T细胞中的表达相比,NKG2A的表达、活性和/或信号传导减少大于或者大于约50%、60%、70%、80%、90%或95%;
优选地,所述NKG2A表达水平不能通过免疫印迹测定和/或流式检测检测到;
优选地,包括在所述基因工程化之前,从人分离所述T细胞;
优选地,包括从外周血单核细胞(PBMC)分离所述T细胞;
优选地,分离所述T细胞包括使用T细胞标记物从PBMC选择T细胞;
优选地,所述T细胞标记物是CD4、CD8。
在具体实施方案中,对所述细胞进行基因工程化表达嵌合抗原受体(CAR)、修饰的T细胞(抗原)受体(TCR)、T细胞融合蛋白(TFP)、T细胞抗原耦合器(TAC)、aTCR-T或其组合。优选地,所述CAR包括:
(i)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域和CD3ζ;和/或
(ii)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD137的共刺激信号结构域和CD3ζ;和/或
(iii)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域、CD137的共刺激信号结构域和CD3ζ;
优选地,所述靶抗原包括肿瘤抗原、病原体抗原;
优选的,所述肿瘤抗原包括Claudin18.2、Claudin18.1、Claudin 6、血管内皮生长因子受体、磷脂酰肌醇蛋白聚糖-3(GPC3)、B细胞成熟抗原(BCMA)、碳酸酐酶9(CAIX)、tEGFR、CD19、CD20、CD22、间皮素、CEA和乙型肝炎表面抗原、抗叶酸受体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、上皮糖蛋白2(EPG-2)、上皮糖蛋白40(EPG-40)、EPHa2、erb-B2、erb-B3、erb-B4、erbB二聚体、EGFR vIII、叶酸结合蛋白(FBP)、FCRL5、FCRH5、胎儿乙酰胆碱受体、GD2、GD3、HMW-MAA、IL-22R-α、IL-13R-α2、激酶插入结构域受体(kdr)、κ轻链、路易斯Y、L1细胞粘附分子(L1-CAM)、黑色素瘤相关抗原(MAGE)-A1、MAGE-A3、MAGE-A6、优先表达的黑色素瘤抗原(PRAME)、存活蛋白、TAG72、B7-H6、IL-13受体α2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGEA1、HLA-A2、PSCA、叶酸受体-a、CD44v6、CD44v7/8、avb6整合素、8H9、NCAM、VEGF受体、5T4、胎儿AchR、NKG2D配体、CD44v6、双重抗原、癌症-睾丸抗原、间皮素、鼠CMV、粘蛋白1(MUC1)、MUC16、PSCA、NKG2D、NY-ESO-1、MART-1、gp100、G蛋白偶联受体5D(GPCR5D)、ROR1、TAG72、 VEGF-R2、癌胚抗原(CEA)、前列腺特异性抗原、PSMA、Her2/neu、雌激素受体、孕酮受体、肝配蛋白B2、CD123、c-Met、GD-2、O-乙酰化GD2(OGD2)、CE7、Wilms肿瘤1(WT-1)、细胞周期蛋白、细胞周期蛋白A2、CCL-1、CD138、病原体特异性抗原和与通用标签相关的抗原;
优选地,所述靶向BCMA的CAR含有能够特异性识别BCMA的抗体;
优选的,所述特异性识别BCMA的抗体含有SEQ ID NO:16所示的HCDR1、SEQ ID NO:17所示的HCDR2、SEQ ID NO:18所示的HCDR3、以及SEQ ID NO:19所示的LCDR1、SEQ ID NO:20所示的LCDR2、SEQ ID NO:21所示的LCDR3;
优选的,所述特异性识别BCMA的抗体或其功能片段含有SEQ ID NO:22所示的重链可变区和SEQ ID NO:23所示的轻链可变区。
在一些具体实施方案中,还包括对所述细胞进行基因工程化以减少所述细胞中的MHC表达、活性和/或信号传导;优选的,所述MHC为MHC I类分子;优选地,所述MHC I为HLA;更优选地,所述HLA为HLA-I;优选地,所述HLA-I选自HLA-A、HLA-B、HLA-C、B2M中的一种或两种以上;优选的,所述HLA-I包括HLA-A和B2M;
优选地,减少表达包括:
在所述T细胞中破坏或抑制编码MHC的基因和/或破坏或抑制某一基因,从而导致MHC的表达减少;
在所述T细胞中破坏或抑制编码调节MHC的表达或活性的蛋白质的基因和/或破坏或抑制某一基因,从而导致调节MHC的表达或活性的蛋白质的表达减少;和/或
在所述T细胞中破坏或抑制编码参与MHC依赖性信号传导的蛋白质的基因和/或破坏或抑制某一基因,从而导致参与MHC依赖性信号传导的蛋白质的表达减少;
优选地,包括在所述基因中引入缺失、突变或插入;
优选地,所述基因编码MHC;
优选地,所述基因的破坏或抑制通过在允许破坏或抑制所述基因的条件下在所述T细胞中引入靶向所述基因的内切核酸酶来实现;
优选地,所述内切核酸酶选自TAL核酸酶、巨核酸酶、锌指核酸酶、Cas9和Argonaute;
优选地,破坏或抑制通过在导致抑制所述基因的条件下在所述T细胞中引入靶向所述基因的抑制性核酸来实现;
优选地,所述抑制性核酸分子包含与所述编码MHC的基因互补的序列;
优选地,所述抑制性核酸包含RNA干扰剂;
优选地,所述核酸是siRNA、shRNA或miRNA;
优选地,所述表达减少是永久的、短暂的或可诱导的;
优选地,与未基因工程化的T细胞中的表达相比,MHC的表达、活性和/或信号传导减少大于或者大于约50%、60%、70%、80%、90%或95%;
优选地,所述MHC表达水平不能通过免疫印迹测定和/或流式检测检测到。
在一些具体实施方案中,对所述细胞进行基因工程化表达识别NKG2A的抗体或其功能片段、和/或表达特异性结合NKG2A的嵌合抗原受体(CAR)、修饰的T细胞(抗原)受体(TCR)、T细胞融合蛋白(TFP)、T细胞抗原耦合器(TAC)、aTCR-T或其组合;
优选地,所述CAR包括:
(i)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域和CD3ζ;和/或
(ii)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD137的共刺激信号结构域和CD3ζ;和/或
(iii)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域、CD137的共刺激信号结构域和CD3ζ;
优选的,所述特异性结合NKG2A的抗体含有SEQ ID NO:3所示的HCDR1,SEQ ID NO:4所示的HCDR2,SEQ ID NO:5所示的HCDR3,SEQ ID NO:6所示的LCDR1,SEQ ID NO:7所示的LCDR2,SEQ ID NO:8所示的LCDR3;
优选的,所述识别NKG2A的抗体含有SEQ ID NO:1所述的重链可变区或SEQ ID NO:2所述的轻链可变区。
在一些具体实施方案中,所述细胞是来源于人的自体T细胞;优选地,所述细胞为原代T细胞。
在一些具体实施方案中,所述细胞是来源于同种异体T细胞;优选地,所述细胞来源于人的T细胞;优选地,所述细胞为原代T细胞。
本发明第十一方面提供了,一种工程化T细胞,其通过本发明第十方面所述的方法产生。
本发明第十二方面提供了,一种组合物,其包含有效量的如本发明第八、九、十一方面所述的工程化T细胞;
优选地,还包含药学上可接受的载体;
优选地,所述载体是盐水溶液、右旋糖溶液或5%人血清白蛋白;
优选地,还包含冷冻保护剂。
本发明第十三方面提供了,一种试剂盒,包括如本发明第八、九、十一方面所述的工程化T细胞或如本发明第十二方面所述的组合物以及用于治疗疾病的另外的药剂。
本发明第十四方面提供了,一种治疗疾病的方法,其包括向有需要的受试者给予如本发明第八、九、十一方面所述的工程化T细胞或如本发明第十二方面所述的组合物或如本发明第十三方面所述的试剂盒;
优选地,在给予所述工程化T细胞之前,通过根据本发明第十方面所述的方法产生所述工程化T细胞;
优选地,其还包括给予另外的药剂;
优选地,所述病症选自炎性病症、感染和肿瘤;
优选地,所述感染是病毒感染或细菌感染;
优选地,其中所述肿瘤包括白血病(如急性白血病、急性淋巴细胞白血病、急性髓细胞性白血病,急性粒细胞白血病,急性早幼粒细胞白血病、急性粒-单核细胞白血病、急性单核细胞白血病、急性白血病、慢性白血病、慢性粒细胞白血病、慢性淋巴细胞白血病、真性红细胞增多症),淋巴瘤(霍奇金病、非霍奇金病)、原发性巨球蛋白血症,重链病,实体瘤如肉瘤和癌症(如纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨肉瘤、脊索瘤、内皮肉瘤、淋巴管肉瘤、血管肉瘤、淋巴管内皮肉瘤,滑膜vioma, 间皮瘤,尤文氏瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、支气管癌、髓样癌、肾细胞癌、肝癌,尼罗河管癌,绒癌、精原细胞瘤、胚胎癌、肾母细胞瘤、宫颈癌、子宫癌、睾丸癌、肺癌、小细胞肺癌、膀胱癌、上皮癌、胶质瘤、星形细胞瘤、髓母细胞瘤,颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤,听神经瘤,少突胶质瘤、神经鞘瘤、脑膜瘤、黑色素瘤、神经母细胞瘤、视网膜母细胞瘤)、食管癌、胆囊癌、肾癌、多发性骨髓瘤;较佳地,所述的“肿瘤”包括但不限于:胰腺癌、肝癌、肺癌、胃癌、食管癌、头颈部鳞状细胞癌、前列腺癌、结肠癌、乳腺癌、淋巴瘤、胆囊癌、肾癌、白血病、多发性骨髓瘤、卵巢癌、宫颈癌和胶质瘤,以及它们的任意组合;
优选地,所述受试者是人;
优选地,其中所述工程化T细胞对于所述受试者是自体的或同种异体的。
附图简要说明
图1:BCMA-NKG2A CAR质粒示意图;
图2:BCMA CAR质粒示意图;
图3:BCMA CAR-T细胞和BCMA-NKG2A CAR-T细胞中CAR阳性率检测结果;
图4.UCAR-T细胞中B2M和TCR敲除结果;
图5.UCAR-T细胞体内接触肿瘤抗原后NKG2A的表达情况检测显示:在小鼠体内UCAR-T与肿瘤细胞(靶细胞)共孵育能显著诱导UCAR-T细胞内源性NKG2A表达;
图6.UCAR-T细胞NKG2A的敲除情况检测显示:UCAR-T细胞在体外受肿瘤细胞(靶细胞)反复刺激后能显著提高内源性NKG2A表达;而内源性NKG2A敲除的UCAR-T细胞在与肿瘤细胞(靶细胞)反复刺激后内源性NKG2A表达受到显著抑制,这也验证了内源性NKG2A被有效敲除;
图7.UCAR-T细胞体外对肿瘤细胞的杀伤结果显示:BCMA UCAR-T-NKG2AKO和BCMA-NKG2A-UCAR-T-NKG2A KO均能有效杀伤RPMI-8226细胞,且杀伤能力与BCMA UCAR-T,BCMA-NKG2A UCAR-T相当,表明BCMA UCAR-T-NKG2A KO、BCMA-NKG2A UCAR-T-NKG2A KO能有效杀伤骨髓瘤细胞;
图8.UCAR-T细胞体内对肿瘤细胞的杀伤结果显示:BCMA UCAR-T-NKG2A KO组相对BCMA UCAR-T组能显著抑制肿瘤体积增长;BCMA-NKG2A UCAR-T-NKG2A KO细胞组相对BCMA-NKG2A UCAR-T组也能显著抑制肿瘤体积增长;
图9:BCMA-loop-NKG2A CAR、NKG2A-loop-BCMA CAR质粒示意图;
图10:NKG2A敲除的串联UCAR-T细胞体外对NK细胞的抵抗功能检测显示:在与活化扩增的NK细胞共孵育时,相对UTD UCAR-T、BCMA UCAR-T细胞,BCMA-loop-NKG2A uCAR-T、NKG2A-loop-BCMA UCAR T细胞在24小时、48小时的比例显著提高;相对BCMA-loop-NKG2A uCAR-T,内源性NKG2A敲除的BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞在24小时、48小时的比例显著提高;相对NKG2A-loop-BCMA UCAR T细胞,内源性NKG2A敲除的NKG2A-loop-BCMA UCAR T-NKG2A KO细胞在24小时、48小时的比例显著提高;
图11:NKG2A敲除的串联UCAR-T细胞体内抗肿瘤功能检测显示:相对NKG2A-loop-BCMA-UCAR-T细胞,NKG2A-loop-BCMA-UCAR-T-NKG2A KO细胞组的肿瘤体积增长速度明显受到抑制;
图12:免疫缺陷小鼠体内检测NKG2A敲除的串联UCAR-T对NK细胞的抵抗功能显示:在D4、D7,BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞中的CD4阳性(图12A)、CD8阳性(图12B)的T细胞数目显著高于BCMA uCAR-T细胞组;
图13:人源化重建小鼠体内检测NKG2A敲除的串联UCAR-T对NK细胞的抵抗功能显示:相对UTD UCAR-T、BCMA uCAR-T细胞,BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞在体内的扩增以及存活显著提高(图13A),且BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞显著抑制了NK细胞的数量(图13B);
图14.NKG2A敲除的串联UCAR-T在NK细胞存在下体外抗肿瘤活性以及抗NK活性检测显示:BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞和BCMA uCAR-T 细胞都能显著杀肿瘤细胞;BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞的数量显著高于BCMA uCAR-T细胞,且BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞组的NK细胞数量低于BCMA uCAR-T组;
图15.NKG2A敲除的串联UCAR-T细胞的体外细胞因子分泌情况显示:BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞与BCMA uCAR-T具有类似的INF-γ、IL2、TNF细胞因子分泌水平(图15A);BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞与BCMA uCAR-T具有类似的IL4、IL6以及IL10细胞因子分泌水平(图15B);
图16.NKG2A敲除的不同形式的串联UCAR-T细胞在体内的抗肿瘤功能检测显示:相比于BCMA UCAR-T,NKG2A敲除的NKG2A-loop-BCMA UCAR T-NKG2A KO、BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞表现出更好的抗肿瘤活性。
除非专门定义,本文所用的所有技术和科学术语具有在基因治疗、生物化学、遗传学、和分子生物学领域内的技术人员通常理解的相同含义。与本文描述的方法和/或材料类似或等效的,都可以在本发明的实践中使用。本文提及的所有出版物、专利、和其他参考文献都以其全部内容结合于本文中作为参考。在冲突的情况下,以本说明书,包括定义为准。此外,除非另有规定,材料、方法和实施例仅是说明性的,而并非旨在进行限制。
除非另有说明,本发明的实践将采用细胞生物学、细胞培养、分子生物学、转基因生物学、微生物学、重组DNA和免疫学的传统技术,这都属于本领域的技术范围。这些技术已充分公开于现有技术中,例如,Current Protocols in Molecular Biology(FrederickM.AUSUBEL,2000,Wileyand sonInc,Library of Congress,USA);Molecular Cloning:A Laboratory Manual,Third Edition,(Sambrooketal,2001,Cold Spring Harbor,NewYork:Cold Spring Harbor Laboratory Press);Oligonucleotide Synthesis(M.J.Gaited.,1984);Mullis et al.U.S.Pat.No.4,683,195;Nucleic Acid Hybridization(B.D.Harries&S.J.Higginseds.1984);Transcription And Translation(B.D.Hames&S.J.Higginseds.1984);Culture Of Animal Cells(R.I.Freshney,Alan R.Liss,Inc.,1987);Immobilized Cells And Enzymes(IRL Press,1986);B.Perbal,A Practical Guide To Molecular Cloning(1984);the series, Methods In ENZYMOLOGY(J.Abelson和M.Simon,eds.-in-chief,Academic Press,Inc.,New York);Gene Transfer Vectors For Mammalian Cells(J.H.Miller和M.P.Caloseds.,1987,Cold Spring Harbor Laboratory);Immunochemical Methods In Cell And Molecular Biology(Mayer和Walker,eds.,Academic Press,London,1987);Hand book Of Experimental Immunology,卷I-IV(D.M.Weir和C.C.Blackwell,eds.,1986);和Manipulating the Mouse Embryo(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,1986)。
本发明中请求保护的主题的以范围形式呈现的,应当理解,范围形式的描述仅仅是为了方便和简洁,并且不应被解释为对所要求保护的主题的范围的硬性限制。因此,范围的描述应当被认为已经具体公开了所有可能的子范围以及该范围内的单个数值。例如,在提供的范围的情况下,在该范围的上限和下限之间的每个中间值以及上下限均包括在要求保护的主题内。在该范围的上限和下限之间的较小的范围内可独立地包含这些较小范围的上下限,它们也属于请求保护的主题的范围。明确排除所述范围的上下限的除外。设定范围包含一个或两个限值时,请求保护的主题也包括排除所述限值之一个或两个的范围。这适用而无关范围的宽度。
本文使用的术语“约”是指本技术领域技术人员容易知晓的各值的通常误差范围。本文中述及“约”值或参数,包括指向该值或参数本身的实施方式。例如,关于“约X”的描述包括“X”的描述。在本文中,“约”可以是在所述技术领域内可以接受的误差范围;。例如,可以是指“约”值或参数的±10%范围内的值或参数,例如,约5uM可包括在4.5uM与5.5uM之间的任何数目。
除非另外指出,本文中所述任何浓度范围、百分比范围、比例范围或整数范围应理解为包括在所述范围内的任何整数,以及在合适情况下,其分数(例如整数的十分之一与百分之一)的数值。
术语
术语“细胞”指人或非人动物来源的细胞。在一个实施例中,所述工程细胞或工程化细胞也可以指内源性NKG2A敲除的细胞。在一个实施例中,所述工程细胞或工程化细胞也可以指内源性NKG2A敲除且表达靶向免疫细胞和/或肿瘤细胞CAR 的T细胞。
术语“宿主”或“受试者”是指接受移植物移植的受体,在一些实施方式中,可以是接受外源细胞植入的个体,如人。在一些实施方式中,“受试者”可以是临床患者、临床试验志愿者、实验动物等等。所述受试者可能被怀疑患有以细胞增殖为特征的疾病或者具有患有以细胞增殖为特征的疾病、被诊断为患有以细胞增殖为特征的疾病、或者是被证实不患有以细胞增殖为特征的疾病的对照受试者。在一些实施例中,所述受试者是患有或可能患有免疫性疾病如自身免疫性疾病,或接受移植物治疗后。
术语“工程化”是指应用细胞生物学和分子生物学的原理和方法,通过某种工程学手段,在细胞整体水平或细胞器水平上,按照人们的意愿来改变细胞内的遗传物质或获得细胞产品的一门综合科学技术。在一个实施例中,所述工程化是指核酸的一个或多个改变,例如生物体基因组内的核酸。在一个实施例中,所述工程化是指基因的改变、添加和/或缺失。在一个实施例中,所述工程细胞或所述工程化细胞还可以指具有加入、缺失和/或改变的基因的细胞。术语“遗传破坏(genetic disruption)”是指对生物个体内的遗传信息,包括但不限于基因、RNA或蛋白质等进行人为操作,使遗传信息的传递,调控或者表达受到干扰。遗传破坏可以通过基因编辑对基因进行修饰,如利用基因敲除技术使基因发生突变或者缺失;可以通过抑制mRNA的表达如RNAi技术使基因发生沉默;也可以通过表达重组蛋白如PROTAC技术使蛋白质发生降解。在一个实施例中,采用CRISPR/Cas9技术敲除内源性NKG2A,或敲除TRAC、内源性NKG2A和B2M。
术语“遗传修饰”、“基因修饰”、“基因工程化”或“经修饰的”是指修饰细胞的方法,包括但不限于通过基因编辑的方法在基因编码或非编码区或其表达调控区;或通过核酸内切酶和/或反义RNA技术;或增加引入外源的蛋白和/或复合体、小分子抑制剂对基因的蛋白表达水平进行改变来造成基因缺陷。在一些实施方案中,经修饰的细胞为干细胞(例如,造血干细胞(HSC)或祖细胞、胚胎干细胞(ES)、诱导性多能干(iPS)细胞),淋巴细胞(例如T细胞),其可以是从受试者或供体获得。可以修饰细胞以表达外源构建体,例如pre-TCRα蛋白,嵌合抗原受体(CAR)或T细胞受体(TCR),其可以整合到细胞基因组中。
术语“多能干细胞”具有分化成三个胚层中的任一个的潜力:内胚层(例如,胃连接、胃肠道、肺等),中胚层(例如,肌肉、骨骼、血液,泌尿生殖组织等)或外胚层(例如表皮组织和神经系统组织)。如本文所用,术语“多能干细胞”还涵盖“诱导多能干细胞”或“iPSC”,是来源于非多能细胞的一种多能干细胞。在一实施例中,所述多能干细胞来自于通过对体细胞进行重新编程转化而来具有多能干细胞特征的细胞。这样的“iPS”或“iPSC”细胞可以通过诱导某些调节基因的表达或通过外源施加某些蛋白质来产生。
“多能干细胞特征”是指将多能干细胞与其他细胞区分开的细胞特征。例如,人多能干细胞表达至少几种以下标志物:SSEA-3、SSEA-4、TRA-1-60、TRA-1-81、TRA-2-49/6E、ALP、Sox2、E-钙粘蛋白、UTF-1、Oct4、Rex1和Nanog。具有与多能干细胞相关的细胞形态也是多能干细胞特征。
本文所述的“T细胞”可以是PBMC、骨髓、淋巴结组织、脐带血、胸腺组织和来自感染部位、腹水、胸腔积液、脾组织、肿瘤组织中获取的天然的T细胞,还可以是经过分选等获得的具有特定表型特征的细胞群,或不同表型特征的混合细胞群体,如“T细胞”可以是包含至少一种T细胞亚群的细胞:记忆性干细胞样T细胞(stem cell-like memory T cells,Tscm细胞)、中心记忆T细胞(Tcm)、效应性T细胞(Tef、Teff)、调节性T细胞(tregs)和/或效应记忆T细胞(Tem)。在一些情况下,“T细胞”可以是某种特定亚型的T细胞,如γδT细胞。在某些情况下,可以使用任何数量的本领域技术人员已知的技术,例如FicollTM分离和/或单采术(apheresis),从个体收集的血液获得T细胞。在一个实施方案中,T细胞来源于诱导的多能干细胞。在一个实施方案中,通过单采血获得来自个体的循环血液的细胞。单采制品通常含有淋巴细胞,包括T细胞、单核细胞、粒细胞、B细胞、其他有核白细胞、红细胞和血小板。在一个实施方案中,可以洗涤通过单采采集收集的细胞以除去血浆分子并将细胞置于合适的缓冲液或培养基中用于随后的加工步骤。所述T细胞可以从健康供体,或者来自诊断患有癌症个体的衍生细胞。T细胞可以是自体T细胞或同种异体T细胞。T细胞可以是原代T细胞。
本文所述的“T细胞”还可以是携带识别靶抗原的外源蛋白的T细胞,如CART细胞、TCR-T细胞、T细胞抗原耦合器(TAC)、T细胞融合蛋白等。
NKG2A(OMIM 161555,将其全部公开内容通过引用结合在此)是NKG2转录物组的成员,NKG2A与CD94一起形成在NK细胞、α/βT细胞、γ/δT细胞、和NKT细胞的亚群的表面上发现的异源二聚体抑制性受体CD94/NKG2A。如本文所使用的,“NKG2A”是指NKG2A基因或编码的蛋白以及任何变体、衍生物或同种型。人NKG2A在3个结构域中包含233个氨基酸,其中是包含残基1-70的胞质域,包含残基71-93的跨膜区,以及包含残基94-233的胞外区,该人NKG2A具有以下序列:
术语“MHC”为组织相容性复合物,是所有编码生物相容复合体抗原的基因群一种统称,MHC抗原表达于所有高等脊椎动物的组织,在人类细胞中称为HLA抗原,在移植反应中发挥重要作用,由对所植入的组织的表面上的组织相容性抗原产生反应的T细胞介导排异。MHC蛋白质在T细胞刺激中发挥至关重要的作用,抗原呈递细胞(通常是树突状细胞)展示属于MHC上的细胞表面上的外源蛋白的降解产物的肽,在共刺激信号的存在下,T细胞被活化并作用于也展示相同肽/MHC复合体的靶细胞。例如,刺激的T辅助细胞会靶向巨噬细胞,该巨噬细胞展示与其MHC结合的抗原,或细胞毒性T细胞(CTL)会作用于展示外源病毒肽的病毒感染的细胞。MHC抗原分为NHC I类抗原和MHC II类抗原。
NKG2A/CD94为异源二聚体,为非经典HLA-I类分子HLA-E的受体,分布于绝大多数NK细胞表面,发挥抑制性作用。在与HLA-E结合后,NKG2A传递抑制性信号来抑制这些免疫细胞的细胞毒活性,从而减弱T细胞对病毒(如多瘤病毒或人类巨细胞病毒)的清除作用,或者抑制免疫细胞对肿瘤细胞的杀伤。HLA-E为非经典HLA-I类分子,其mRNA在所有有核细胞内都能检测到,但蛋白表达仅限于少数的器官及细胞上,且表达强度较弱。与经典HLA-I类分子不同的是,HLA-E的多态性较弱,只有26个等位基因, 编码的蛋白仅有8种,而在中国,较普及的只有两类:HLA-E*01:01和HLA-E*01:03,分布比例约为1:1,表明HLA-E类分子序列相对保守。且其递呈的抗原肽为HLA-I(A、B、C及G等)类分子的先导序列,相对保守性非常高,抑制NK细胞的杀伤效果较显著。
术语“人类白细胞抗原”(Human leukocyte antigen,HLA)是人类的主要组织相容性复合体的编码基因,位于6号染色体上(6p21.31),与人类的免疫系统功能密切相关。HLA包括有I类、II类和III类基因部分。HLA的I类和II类基因所表达的抗原位于细胞膜上,为MHC-I(HLA-A、HLA-B、HLA-C位点编码)和MHC-II(HLA-D区编码),HLA I类几乎分布于身体全部细胞表面,是一个异二聚体,由重链(α链)与β2微球蛋白组成(B2M),II类主要是定位于巨噬细胞和B淋巴细胞表面的糖蛋白。
术语“B2M”为β-2微球蛋白,也称为B2M,是MHC I类分子的轻链。在人类中,B2M由位于15号染色体上的b2m基因编码,与6号染色体上的作为基因簇定位的其他MHC基因相对。有研究表明,当B2M基因发生突变,来自缺乏正常细胞表面MHC I表达的小鼠的造血移植物被正常小鼠中的NK细胞排斥,说明MHC I分子的缺陷性表达使细胞易于被宿主免疫系统排斥(Bix et al.1991)。
术语“外源”指的是一个核酸分子或多肽、细胞、组织等没有在生物体自身内源性表达,或表达水平不足以实现过表达时具有的功能。
术语“内源”是指一个核酸分子或多肽等来自生物体自身。
在一个实施例中,外源蛋白可以是识别靶抗原的外源转入细胞的蛋白,如外源受体。
术语“外源受体”,即用基因重组技术将不同来源的DNA片段或蛋白质相应的cDNA连接而成的融合分子,包括胞外域、跨膜域和胞内域。嵌合受体包括但不限于:嵌合抗原受体(CAR)、嵌合T细胞受体(TCR)、T细胞抗原耦合器(TAC)。
术语“嵌合抗原受体”(CAR)是指两组或以上多肽;当免疫效应细胞表达所述CAR时,那么所述免疫细胞能特异性针对靶细胞(本发明包括肿瘤细胞、NK细胞),并且产生细胞内信号。在某些实施例中,CAR包括至少一个胞外抗原结合结构域、跨膜结构域和胞内信号传导结构域(也称为“细胞质信号传导结构域”)。 胞内信号传导结构域包括刺激性分子和/或共刺激性分子的功能信号传导结构域,在一个方面,刺激性分子为与T细胞受体复合体结合的ζ链;在一个方面,细胞质信号传导结构域进一步包括一种或多种共刺激性分子的功能性信号传导结构域,例如4-1BB(即CD137)、CD27和/或CD28。在某些实施例中,多肽组彼此邻接。示例性,靶向NKG2A的CAR包含SEQ ID NO:9序列。靶向BCMA的CAR包含SEQ ID NO:25所示序列。同时靶向NKG2A和BCMA的CAR包括SEQ ID NO:30和/或32所示的抗原结合域;或者包括SEQ ID NO:55和/或57所示的CAR。在具体实施例中,同时靶向NKG2A和BCMA的工程化T细胞包含SEQ ID NO:26所示氨基酸序列或SEQ ID NO:27所示核苷酸序列。在具体实施例中,同时靶向NKG2A和BCMA的工程化T细胞包含SEQ ID NO:55和/或SEQ ID NO:57所示氨基酸序列;或包含SEQ ID NO:56和/或SEQ ID NO:58所示核苷酸序列。术语“T细胞受体(T cell receptor,TCR)”介导T细胞对特异性主要组织相容性复合物(MHC)-限制性肽抗原进行识别,包括经典的TCR受体和优化的TCR受体。经典的TCR受体,由α、β两条肽链组成,每条肽链又可分为可变区(V区),恒定区(C区),跨膜区和胞质区等,其抗原特异性存在于V区,V区(Vα、Vβ)又各有三个高变区CDR1、CDR2、CDR3,在一个方面,表达经典的TCR的T细胞可以通过对T细胞采用如抗原刺激等方式,诱导T细胞的TCR对靶抗原的特异性应答。
术语“嵌合T细胞受体”,包括构成TCR的各种多肽衍生的重组多肽,其能够结合到靶细胞上的表面抗原,和与完整的TCR复合物的其他多肽相互作用,通常共定位在T细胞表面。嵌合T细胞受体由一个TCR亚基与人或人源化抗体结构域组成的一个抗原结合结构域组成,其中,TCR亚基包括至少部分TCR胞外结构域、跨膜结构域、TCR胞内结构域;该TCR亚基和该抗体结构域有效连接,其中,TCR亚基的胞外、跨膜、胞内信号结构域来源于CD3ε、CD3γ、CD3z、TCR的α链、或TCR的β链,并且,该嵌合T细胞受体整合进T细胞上表达的TCR/CD3复合物。
TCR/CD3复合物中的两个多态型亚单位(TCRαβ或TCRγδ)主要功能是识别结合MHC分子的抗原,胞浆区非常短;CD3分子的主要功能是参与 TCR/CD3复合体的装配和稳定以及信号转导。CD3分子亚单位的胞浆内部分含有一个共同的序列,即D/EX2YX2L/IX8YX2L/I,其中含有两个YXXL/I结构。由于其序列同淋巴细胞抗原识别后淋巴细胞的活化及信号转导关系密切,因而把此序列称为抗原识别活化基序(antigen recognition acivation motifs,ARAMS)其中含有两个YXXL/I结构。由于其序列同淋巴细胞抗原识别后淋巴细胞的活化及信号转导关系密切,因而把此序列称为抗原识别活化基序(antigen recognition activation motifs,ARAMS)。其中CD3γ、ε、δ各含一个ARAM,η链含二个,ζ链含三个。
术语“T细胞抗原耦合器(T cell antigen coupler,TAC)”,包括三个功能结构域:1、抗原结合结构域,包括单链抗体、设计的锚蛋白重复蛋白(designed ankyrin repeat protein,DARPin)或其他靶向基团;2、胞外区结构域,与CD3结合的单链抗体,从而使得TAC受体与TCR受体靠近;3、跨膜区和CD4共受体的胞内区,其中,胞内区连接蛋白激酶LCK,催化TCR复合物的免疫受体酪氨酸活化基序(ITAMs)磷酸化作为T细胞活化的初始步骤。
术语“信号传导结构域”也称为“细胞质信号传导结构域”,是指通过在细胞内传递信息而起作用的蛋白质的功能性部分,用来通过产生第二信使或通过响应这样的信使起效应物作用经由确定的信号传导途径调节细胞的活性。胞内信号传导结构域可以包括所述蛋白质的全部细胞内部分、或全部天然胞内信号传导结构域、或其功能片段或衍生物。示例性,靶向BCMA、靶向NKG2A和/或靶向NKG2A和BCMA的CAR的信号传到结构域包括CD3ζ。在具体实施例中,CD3ζ为人CD3ζ分子,包含SEQ ID NO:51或SEQ ID NO:52所示序列。术语“共刺激分子”是为T(或B)细胞完全活化提供共刺激信号的细胞表面分子及其配体,当与细胞刺激信号分子,例如TCR/CD3结合,组合导致T细胞增殖和/或关键分子的上调或下调的信号,从而介导T细胞的共刺激应答。共刺激分子包括但不限于MHC I类分子、BTLA和Toll配体受体、以及OX40,CD2,CD27,CD28,CDS,ICAM-1,LFA-1(CD11a/CD18)和4-1BB(CD137)。示例性,靶向BCMA、靶向NKG2A和/或靶向NKG2A和BCMA的CAR的信号传到结构域包括4-BB。在具体实施例中,4-1BB为人4-BB分子,包含 SEQ ID NO:49或SEQ ID NO:50所示序列。
术语“激活”和“活化”可互换使用,可以指细胞从静止状态转变为活性状态的过程。该过程可以包括对抗原、迁移和/或功能活性状态的表型或遗传变化的响应。例如,术语“激活”可以指T细胞逐步活化的过程。该活化过程受第一刺激信号和共刺激信号的共同调控。T细胞的活化是一个动态变化的过程,其持续时间和活化程度的强弱均受到外界条件刺激的影响。“T细胞活化”或“T细胞激活”指被刺激以诱导可检测的细胞增殖、细胞因子产生和/或可检测的效应物功能的T细胞的状态。
使用CD3/CD28磁珠,体外抗原刺激或者体内抗原刺激都会对T细胞的活化程度和持续时间造成影响。在一个实施例中,所述工程化T细胞与含特定靶抗原肿瘤细胞共孵育或病毒感染后活化。
术语“基因编辑(Genome editing,Gene editing)”,是指利用部位特异性核酸酶在生物体基因组中的特定位置进行DNA插入、敲除、修改或替换的基因工程技术,会改变DNA序列。这种技术有时称作“基因剪辑”或“基因组工程。基因编辑可以用来实现精确的、高效的基因敲除或者基因敲入。
核酸酶指导的基因组靶向修饰技术通常由一个DNA识别结构域和一个非特异性核酸内切酶结构域构成,由DNA识别结构域识别靶位点,把核酸酶定位到需要进行编辑的基因组区域,然后由非特异性核酸内切酶切断DNA双链,引起DNA断裂自我修复机制,从而引发基因序列的突变和促进同源重组的发生。所述核酸内切酶可以是巨型核酸酶(Meganuclease)、锌指核酸酶、CRISPR/Cas9核酸酶、MBBBD-核酸酶或TALEN-核酸酶。在优选的实施方式中,所述核酸内切酶是CRISPR/Cas9核酸酶、TALEN-核酸酶。利用核酸酶进行基因敲除技术包括CRISPR/Cas9技术、ZFN技术、TALE技术和TALE-CRISPR/Cas9技术。在一些是实施例中,所述的基因编辑技术选自单碱基编辑(Base Editor)技术、引导编辑(Prime Editor)技术归巢核酸内切酶(Meganuclease)技术。
术语“人工锌指核酸酶(Zinc Finger Nucleases,ZFN)”技术,是第一代核酸酶定点修饰技术,利用能够特异性识别三联体DNA片段的锌指基序(motif)而不是碱基作 为识别特定DNA序列的基本单位。最经典的锌指核酸酶是将一个非特异性的核酸内切酶FokI与含有锌指的结构域进行融合,其目的自然是对特定序列进行切割。
术语“转录激活样效应因子(transcription activator-like effector,TALE)”,具有DNA结合特异性,具有能够特异性识别碱基的模块,操作简洁和方便。TALE-DNA结合结构域由串联重复单元组成,大部分单元含3 4个氨基酸,把单元的第12和13位氨基酸设计为可变区(repeat variable residues,RVD)。TALE的RVD识别DNA序列的4个碱基具有高度专一性,第13位氨基酸直接与DNA的碱基特异结合。能够根据DNA序列,在任意位点构建特异的TALEDN识别结合域,可以广泛用于基因序列突变修饰和基因打靶等。设定DNA靶序列,组装TALE-DNA结合域,融合Fok I内切酶的非特异性DNA切割域,组装成TALE核酸酶(tanscription activator-like effector nucleases,TALENs)。TALENs靶向结合DNA,产生DNA双链断裂(DNA double-srand breaks,DSBs)。
CRISPER/Cas9是第三代基因编辑技术。“CRISPR系统”统称为转录物和涉及CRISPR相关(“Cas”)基因的表达或指导其活性的其他元件,包括编码Cas基因的序列、tracr(反式激活CRISPR)序列(例如,tracrRNA或活性部分tracrRNA)、tracr配对序列(涵盖“同向重复”和在内源CRISPR系统背景下的tracrRNA加工的部分同向重复)、指导序列(在内源CRISPR系统背景下也称为“间隔子(spacer)”)、或来自CRISPR座位的其他序列和转录物。CRISPR系统的特征为促进在靶序列的位点处的CRISPR复合物(在内源CRISPR系统的背景下也称为前间区)的形成的元件。在CRISPR复合物形成的背景下,“靶序列”是指指导序列被设计为对其具有互补性的序列,其中在靶序列与指导序列之间的杂交促进CRISPR复合物的形成。完全互补性不是必需的,条件是存在足够互补性以引起杂交并且促进一种CRISPR复合物的形成。CRISPR复合物形成后在cas9酶的作用下可以对基因组特定位点进行切割,引入基因突变;也可以对基因的表达进行调控,如激活或抑制。一个靶序列可以包含任何多核苷酸,如DNA或RNA多核苷酸。在一些实施例中,靶序列位于细胞的细胞核或细胞质中。
术语“基因沉默”,是指由于各种原因,使基因不表达或低表达的现象。基因沉默可以是由于DNA甲基化、异染色质化以及位置效应等引起的转录水平的基因沉默,也可以是转录后基因沉默,即在基因转录后的水平上通过对靶标RNA进 行特异性抑制而使基因失活,包括反义RNA、RNA干扰和微小RNA介导的翻译抑制等。
所述“TCR沉默”是指内源性的TCR不表达或低表达。
所述“MHC沉默”是指内源性的MHC不表达或低表达。
术语“CRISPR(Clustered regularly interspaced short palindromicrepeats)”是指规律成簇间隔短回文重复。
术语“Cas9(CRISPRassociated nuclease)”是CRISPR相关核酸酶,是一种由RNA指导的,利用Cas9核酸酶对靶向基因进行编辑的技术。
一般而言,指导序列(gRNA)是与靶多核苷酸序列具有足够互补性以便与该靶序列杂交并且指导CRISPR复合物与该靶序列的序列特异性结合的任何多核苷酸序列。gRNA用于引导,结合或者识别Cas酶。在一些实施例中,当使用适合的比对算法进行最佳比对时,在指导序列与其相应的靶序列之间的互补程度是约或多于约50%、60%、75%、80%、85%、90%、95%、97.5%、99%、或更多。可以使用用于比对序列的任何适合的算法来确定最佳比对,其非限制性实例包括史密斯-沃特曼(Smith-Waterman)算法、尼德曼-翁施(Needleman-Wunsch)算法、基于伯罗斯-惠勒变换(Burrows-Wheeler Transform)的算法(例如伯罗斯-惠勒比对工具(Burrows Wheeler Aligner))、ClustalW、Clustal X、BLAT、Novoalign(Novocraft技术公司)、ELAND(亿明达公司(Illumina),圣地亚哥,加利福尼亚州)、SOAP(在soap.genomics.org.cn可获得)、以及Maq(在maq.sourceforge.net可获得)。在一些实施例中,该CRISPR酶是包含一个或多个异源蛋白结构域(例如除了该CRISPR酶之外的约或多于约1、2、3、4、5、6、7、8、9、10个或更多个结构域)的融合蛋白的一部分。CRISPR酶融合蛋白可以包含任何其他蛋白质,以及任选地在任何两个结构域之间的连接序列。可以融合到CRISPR酶上的蛋白质结构域的实例包括但不限于,表位标签、报告基因序列、以及具有下列活性的一个或多个蛋白质结构域:甲基酶活性、脱甲基酶活性、转录激活活性、转录阻抑活性、转录释放因子活性、组蛋白修饰活性、RNA切割活性和核酸结合活性。表位标签的非限制性实例包括组氨酸(His)标签、V5标签、FLAG标签、流感病毒血凝素(HA)标签、Myc标签、VSV-G标签、 和硫氧还蛋白(Trx)标签。
术语“Cas9酶”可以是野生型Cas9或人工改造Cas9。
术语“sgRNA”指短小的gRNA。
在进行基因编辑时,給予的gRNA、tracr配对序列、及tracr序列可以单独给予,也可以一条完整的RNA序列给与。
Cas9蛋白与gRNA结合能够实现在特异位点处切割DNA,来源于Streptococcus pyogenes的CRISPR/Cas系统识别序列为23bp,并能靶向20bp,其识别位点最末3位NGG序列被称作PAM(protospacer adjacent motif)序列。
CRISPR/Cas9转基因可以通过载体(例如AAV、腺病毒、慢病毒)和/或粒子和/或纳米粒子、和/或电转来递送。
在一实施例中,分别对在NKG2A、B2M、TCR的α和β链中的一种或两种链的恒定区域的相应编码基因的外显子用CRISPER/Cas技术敲除,使内源性NKG2A、B2M、TCR不具有活性;在一个实施例中,定点敲除内源性TCRα链恒定区的第一外显子,使用的gRNA选自SEQ ID NO:53示序列。在具体实施例中,采用CRISPR/Cas9技术敲除所述工程化T细胞内源性NKG2A基因,使用的gRNA选自SEQ ID NO:12、SEQ ID NO:13、SEQ ID NO:14、SEQ ID NO:15、SEQ ID NO:60、SEQ ID NO:61、SEQ ID NO:62、SEQ ID NO:63、SEQ ID NO:64、SEQ ID NO:65、SEQ ID NO:66、SEQ ID NO:67、SEQ ID NO:68所示序列。采用CRISPR/Cas9技术敲除所述工程化T细胞内源性B2M基因,使用的gRNA选自SEQ ID NO:54示序列。
“抑制”或“遏制”B2M或TCR或NKG2A的表达是指细胞中B2M或TCR或NKG2A的表达减少至少1%、至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或100%。更具体而言,“抑制”或“遏制”B2M或TCR或NKG2A的表达是指细胞中B2M或TCR或NKG2A的含量降低至少1%、至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或100%。可以通过本领域内已知的任何合适的方法,如基因测序、PCR、印迹杂交、ELISA、免疫组织化学、免疫印迹(WesternBlotting)或流式细胞术使用NKG2A、B2M、TCR的特异性抗体测定细胞中相应基因的拷贝数、mRNA的表的或蛋白的表达或含量。
如本文所用的“RNA干扰剂”被定义为通过RNA干扰(RNAi)干扰或抑制靶基因表达的任何制剂。此类RNA干扰剂包括但不限于与靶基因或其片段同源的RNA分子的核酸分子、短干扰RNA(siRNA)、shRNA或miRNA和通过RNA干扰(RNAi)干扰或抑制靶基因的表达的小分子。
在一个实施例中,所述靶基因可以是编码NKG2A的基因,或编码调节NKG2A的表达或活性的蛋白的基因,或是编码参与NKG2A依赖性信号传导的蛋白的基因。
本文所述的“抗体”可以是全长的抗体,也可以是保留抗原结合能力的抗体片段。抗体片段是指包含从该分子所衍生于的抗体的抗原结合部分(例如,CDR)的任何分子。抗体片段的实例包括但不限于,从抗原结合分子形成的Fab、Fab'、F(ab')2和Fv片段、dAb、线性抗体、scFv抗体和多特异性抗体。在某些实施方案中,抗体是指是特异性结合抗原的抗体片段,包括其一个或多个互补决定区(CDR),在进一步的实施方案中,抗体可以是单链抗体(scFv)。在一些实施方案中,抗体包含高亲和性多聚体(avimer)或由高亲和性多聚体组成。示例性的,识别NKG2A的抗体或其功能片段含有SEQ ID NO:3所示的HCDR1,和/或SEQ ID NO:4所示的HCDR2,和/或SEQ ID NO:5所示的HCDR3,和/或SEQ ID NO:6所示的LCDR1,和/或SEQ ID NO:7所示的LCDR2,和/或SEQ ID NO:8所示的LCDR3。示例性的,识别NKG2A的抗体或其功能片段含有SEQ ID NO:1所述的重链可变区和/或SEQ ID NO:2所述的轻链可变区。示例性的,识别NKG2A的抗体或其功能片段含有SEQ ID NO:10所述的SCFV序列。示例性的,识别BCMA的抗体或其功能片段含有SEQ ID NO:16所示的HCDR1、和/或SEQ ID NO:17所示的HCDR2、和/或SEQ ID NO:18所示的HCDR3、和/或SEQ ID NO:19所示的LCDR1、和/或SEQ ID NO:20所示的LCDR2、和/或SEQ ID NO:21所示的LCDR3。示例性的,识别BCMA的抗体或其功能片段含有SEQ ID NO:22所示的重链可变区和/或SEQ ID NO:23所示的轻链可变区。示例性的,识别BCMA的抗体或其功能片段含有SEQ ID NO:24所示的SCFV序列。
术语“转染”是指将外源核酸引入真核细胞。转染可以通过本领域已知的各种手段来实现,包括磷酸钙-DNA共沉淀、DEAE-葡聚糖介导的转染、聚凝胺介导的转染、电穿孔、显微注射、脂质体融合、脂质转染、原生质体融合、逆转录病毒感染和生物弹道技术(biolistics)。
术语“核酸分子编码”、“编码DNA序列”和“编码DNA”是指沿着脱氧核糖核酸链的脱氧核糖核苷酸的顺序或顺序。这些脱氧核糖核苷酸的顺序决定了沿着多肽(蛋白质)链的氨基酸的顺序。因此,核酸序列编码氨基酸序列。
术语“个体”是指任何动物,例如哺乳动物或有袋动物。本发明的个体包括但不限于人类、非人类灵长类动物(例如恒河猴或其他类型的猕猴)、小鼠、猪、马、驴、牛、绵羊、大鼠和任何种类的家禽。
术语“外周血单个核细胞”(peripheral blood mononuclear cell,PBMC)是指外周血中具有单个核的细胞,包含淋巴细胞、单核细胞等。
当用于指核苷酸序列时,本文所用的术语“序列”可以包括DNA或RNA,并且可以是单链或双链。
本文所用的术语“有效量”是指提供治疗或预防益处的量。
本文所用的术语“表达载体”是指包含重组多核苷酸的载体,其包含与待表达的核苷酸序列有效连接的表达调控序列。表达载体包含用于表达的足够的顺式作用元件(cis-acting elements);用于表达的其它元件可以由宿主细胞或体外表达系统提供。表达载体包括本领域所有已知的那些,如质粒、病毒(例如,慢病毒、逆转录病毒、腺病毒和腺相关病毒)。
本文使用的术语“载体”是包含分离的核酸并可用于将分离的核酸递送至细胞内部的组合物。在本领域中已知许多载体,包括但不限于线性多核苷酸、与离子或两亲化合物相关的多核苷酸、质粒和病毒。因此,术语“载体”包括自主复制的质粒或病毒。还可以包括促进核酸转移到细胞中的非质粒和非病毒化合物,例如聚赖氨酸化合物、脂质体等。
本文使用的术语序列“同一性”通过在比较窗口(例如至少20个位置)上比较两个经最佳匹配的序列来确定同一性百分比,其中比较窗口中多核苷酸或多肽序列 的部分可以包含添加或缺失(即间隙),例如对于最佳匹配的两个序列而言,与参考序列(其不包含添加或缺失)相比20%或更少的间隙(例如5至15%、或10至12%)。通常通过确定在两个序列中发生相同的核酸碱基或氨基酸残基的位置的数目来计算百分比,以产生正确匹配的位置的数目,将正确匹配位置的数目除以参考序列中的位置总数(即窗口大小),并将结果乘以100,以产生序列同一性的百分比。
在一些实施方案中,本发明嵌合受体是嵌合抗原受体。
嵌合抗原受体通常包含胞外抗原结合区。在一些实施方案中,胞外抗原结合区可以是全人的,人源化,鼠源的,或者所述胞外抗原结合区中的嵌合体由来自至少两种不同动物的氨基酸序列组成。
胞外抗原结合区的例子可以是scFv、Fv、Fab、Fab'、Fab'-SH、F(ab')2、单结构域片段、或与接合其同源受体的天然配体,以及它们的任何衍生物。
在一些方面,细胞外抗原结合区(例如scFv),可以包含对抗原特异性的轻链CDR。在一些情况下,轻链CDR可以包含两个或更多个轻链CDR,其可以被称为轻链CDR-1,CDR-2等。在一些情况下,轻链CDR可以包含三个轻链CDR,其可分别称为轻链CDR-1,轻链CDR-2和轻链CDR-3。在一实施方式中,存在于普通轻链上的一组CDR可统称为轻链CDR。
在一些方面,细胞外抗原结合区(例如scFv),可以包含对抗原特异的重链CDR。重链CDR可以是抗原结合单元例如scFv的重链互补决定区。在一些情况下,重链CDR可以包含两个或更多个重链CDR,其可以称为重链CDR-1,CDR-2等。在一些情况下,重链CDR可以包含三个重链CDR,其可分别称为重链CDR-1,重链CDR-2和重链CDR-3。在一实施方式中,存在于共同重链上的一组CDR可统称为重链CDR。
通过使用基因工程,可以以各种方式修饰细胞外抗原结合区。在一些情况下,可以突变细胞外抗原结合区域,从而可以选择细胞外抗原结合区域以对其靶抗原标具有更高的亲和力。在一些情况下,细胞外抗原结合区域对其靶抗原的亲和力可针对可在正常组织上以低水平表达的靶抗原进行优化。在其他情况下,对靶抗原的膜结合形式具有更高亲和力的细胞外抗原结合区域的克隆可以优于其可溶形式的对 应物。
在一些情况下,细胞外抗原结合区域还包括铰链或间隔区,术语铰链和间隔区可以互换使用。铰链可以被认为是用于向细胞外抗原结合区提供柔性的CAR的一部分。例如,铰链可以是CD8α分子的天然铰链区。
术语“跨膜域”可以将嵌合蛋白锚定在细胞的质膜上。例如,可以采用CD28、CD8α的跨膜域(也称为CD8跨膜域)。示例地,CD8跨膜域包括SEQ ID NO:45所示氨基酸序列或SEQ ID NO:46所示核苷酸序列。示例地,CD28跨膜域包括SEQ ID NO:47所示的氨基酸序列或SEQ ID NO:48所示的核苷酸序列。
术语“调控”是指正向或负向改变。调节范例包括1%、2%、10%、25%、50%、75%或100%变化。在一具体实施方式中,是指负向改变。
术语“治疗”是指在试图改变疾病过程的干预措施,既可以进行预防也可以在临床病理过程干预。治疗效果包括但不限于,防止疾病的发生或复发、减轻症状、减少任何疾病直接或间接的病理后果、防止转移、减慢疾病的进展速度、改善或缓解病情、缓解或改善预后等。在具体实施例中,本发明提供的工程化T细胞能抑制肿瘤细胞增殖、和/或体内抑制肿瘤细胞增殖、肿瘤体积增加。
术语“预防”是指在试图在疾病(如细胞移植产生的排斥反应)产生前进行的干预措施。
术语“移植免疫排斥”是指宿主进行同种异体的组织、器官、或细胞等移植物移植后,外源的移植物作为一种“异己成分”被宿主的免疫系统识别,并发起针对移植物的攻击、破坏和清除的免疫学反应。本发明提供一种抗移植免疫排斥的细胞及抗抑制排斥的方法。
本发明的所提供的工程化T细胞可用于治疗、预防或改善自身免疫性疾病或炎性疾病,特别是自身免疫疾病相关的的炎症疾病,诸如关节炎(例如类风湿性关节炎、慢性进行性关节炎(arthritis chronica progrediente)和变形性关节炎)和风湿性疾病,包括牵涉骨损失、炎症性疼痛的炎性病况和风湿性疾病、脊椎关节病变(包括强直性脊柱炎)、赖特尔综合征、反应性关节炎、银屑病关节炎、幼年型特发性关节炎和肠病性关节炎、起止点炎、超敏反应(包括气道超敏反应和皮肤超敏反应)和过敏。本发明所提供的工程 化T细胞用于治疗及预防包括自身免疫性血液学障碍(包括例如溶血性贫血、再生障碍性贫血、纯红细胞贫血和特发性血小板减少)、系统性红斑狼疮(SLE)、狼疮性肾炎、炎性肌肉疾病(皮肌炎)、牙周炎、多软骨炎、硬皮病、韦格纳肉芽肿、皮肌炎、慢性活动性肝炎、重症肌无力、银屑病、史蒂芬约翰逊综合征、自发性口炎性腹泻、自身免疫性炎性肠病(包括例如溃疡性结肠炎、克罗恩病和肠易激综合症)、内分泌性眼病、格雷夫斯病、结节病、多发性硬化、系统性硬化病、纤维变性疾病、原发性胆汁性肝硬化、幼年型糖尿病(I型糖尿病)、葡萄膜炎、干燥性角结膜炎和春季角结膜炎、间质性肺纤维化、假体周围骨溶解、肾小球肾炎(有和无肾病综合症,例如包括特发性肾病综合征或微小病变性肾病)、多发性骨髓瘤、其他类型的肿瘤、皮肤和角膜的炎性疾病、肌炎、骨植入物的松动、代谢紊乱(诸如肥胖、动脉粥样硬化和其它心血管疾病,包括扩张型心肌病、心肌炎、II型糖尿病和血脂异常)和自身免疫性甲状腺疾病(包括桥本甲状腺炎)、中小血管原发性血管炎、大血管血管炎包括巨细胞性动脉炎、化脓性汗腺炎、视神经脊髓炎、斯耶格伦氏综合征、白塞氏病、特应性和接触性皮炎、细支气管炎、炎性肌肉疾病、自身免疫性外周神经病、免疫性肾脏、肝脏和甲状腺疾病、炎症和动脉粥样硬化、自身炎症发热综合征、免疫血液学紊乱以及皮肤和粘膜的大疱性疾病。
本发明所提供的工程化T细胞可用于治疗、预防或改善哮喘、支气管炎、细支气管炎、特发性间质性肺炎、尘肺、肺气肿以及气道的其它阻塞性或炎性疾病。
可将本发明的工程化T细胞作为唯一的活性成分或与其它药物例如免疫抑制剂或免疫调节剂或其它抗炎剂或其它细胞毒性剂或抗癌剂结合(例如作为其佐剂或与其组合)施用,例如以治疗或预防免疫紊乱相关疾病。例如,可将本发明的抗体与如下药物组合使用:DMARD,例如金盐、柳氮磺吡啶、抗疟药、甲氨蝶呤、D-青霉胺、硫唑嘌呤、麦考酚酸、他克莫司、西罗莫司、二甲胺四环素、来氟米特、糖皮质激素;钙调神经磷酸酶抑制剂,例如环孢菌素A或FK 506;淋巴细胞再循环的调节剂,例如FTY720和FTY720类似物;mTOR抑制剂,例如雷帕霉素,40-O-(2-羟基乙基)-雷帕霉素、CCI779、ABT578、AP23573或TAFA-93;具有免疫抑制性质的子囊霉素,例如ABT-281、ASM981等;皮质类固醇;环磷酰胺;硫唑嘌呤;来氟米特;咪唑立宾;吗替麦考酚酯;15-脱氧精胍菌素或其免疫抑制同系物、类似物或衍生物;免疫抑制单克隆抗体,例如,针对 白细胞受体,例如,MHC、CD2、CD3、CD4、CD7、CD8、CD25、CD28、CD40。CD45、CD58、CD80、CD86或其配体的单克隆抗体;其它免疫调节化合物。
“肿瘤抗原”指的是过度增生性疾病发生、发展过程中新出现的或过度表达的抗原。在某些方面,本发明的过度增生性病症是指癌症。
本发明所述的肿瘤抗原可以是实体瘤抗原,也可以是血液瘤抗原。
本发明的肿瘤抗原包括但不限于:促甲状腺激素受体(TSHR);CD171;CS-1;C型凝集素样分子-1;神经节苷脂GD3;Tn抗原;CD19;CD20;CD 22;CD 30;CD 70;CD 123;CD 138;CD33;CD44;CD44v7/8;CD38;CD44v6;B7H3(CD276),B7H6;KIT(CD117);白介素13受体亚单位α(IL-13Rα);白介素11受体α(IL-11Rα);前列腺干细胞抗原(PSCA);前列腺特异性膜抗原(PSMA);癌胚抗原(CEA);NY-ESO-1;HIV-1Gag;MART-1;gp100;酪氨酸酶;间皮素;EpCAM;蛋白酶丝氨酸21(PRSS21);血管内皮生长因子受体,血管内皮生长因子受体2(VEGFR2);路易斯(Y)抗原;CD24;血小板衍生生长因子受体β(PDGFR-β);阶段特异性胚胎抗原-4(SSEA-4);细胞表面相关的粘蛋白1(MUC1),MUC6;表皮生长因子受体家族及其突变体(EGFR,EGFR2,ERBB3,ERBB4,EGFRvIII);神经细胞粘附分子(NCAM);碳酸酐酶IX(CAIX);LMP2;肝配蛋白A型受体2(EphA2);岩藻糖基GM1;唾液酸基路易斯粘附分子(sLe);神经节苷脂GM3;TGS5;高分子量黑素瘤相关抗原(HMWMAA);邻乙酰基GD2神经节苷脂(OAcGD2);叶酸受体;肿瘤血管内皮标记1(TEM1/CD248);肿瘤血管内皮标记7相关的(TEM7R);Claudin 6,Claudin18.2、Claudin18.1;ASGPR1;CDH16;5T4;8H9;αvβ6整合素;B细胞成熟抗原(BCMA);CA9;κ轻链(kappa light chain);CSPG4;EGP2,EGP40;FAP;FAR;FBP;胚胎型AchR;HLA-A1,HLA-A2;MAGEA1,MAGE3;KDR;MCSP;NKG2D配体;PSC1;ROR1;Sp17;SURVIVIN;TAG72;TEM1;纤连蛋白;腱生蛋白;肿瘤坏死区的癌胚变体;G蛋白偶联受体C类5组-成员D(GPRC5D);X染色体开放阅读框61(CXORF61);CD97;CD179a;间变性淋巴瘤激酶(ALK);聚唾液酸;胎盘特异性1(PLAC1);globoH glycoceramide的己糖部分(GloboH);乳腺分化抗原(NY-BR-1);uroplakin 2(UPK2);甲型肝炎病毒细胞受体1(HAVCR1); 肾上腺素受体β3(ADRB3);pannexin 3(PANX3);G蛋白偶联受体20(GPR20);淋巴细胞抗原6复合物基因座K9(LY6K);嗅觉受体51E2(OR51E2);TCRγ交替阅读框蛋白(TARP);肾母细胞瘤蛋白(WT1);ETS易位变异基因6(ETV6-AML);精子蛋白17(SPA17);X抗原家族成员1A(XAGE1);血管生成素结合细胞表面受体2(Tie2);黑素瘤癌睾丸抗原-1(MAD-CT-1);黑素瘤癌睾丸抗原-2(MAD-CT-2);Fos相关抗原1;p53突变体;人端粒酶逆转录酶(hTERT);肉瘤易位断点;细胞凋亡的黑素瘤抑制剂(ML-IAP);ERG(跨膜蛋白酶丝氨酸2(TMPRSS2)ETS融合基因);N-乙酰葡糖胺基转移酶V(NA17);配对盒蛋白Pax-3(PAX3);雄激素受体;细胞周期蛋白B1;V-myc鸟髓细胞瘤病病毒癌基因神经母细胞瘤衍生的同源物(MYCN);Ras同源物家族成员C(RhoC);细胞色素P450 1B1(CYP1B1);CCCTC结合因子(锌指蛋白)样(BORIS);由T细胞识别的鳞状细胞癌抗原3(SART3);配对盒蛋白Pax-5(PAX5);proacrosin结合蛋白sp32(OYTES1);淋巴细胞特异性蛋白酪氨酸激酶(LCK);A激酶锚定蛋白4(AKAP-4);滑膜肉瘤X断点2(SSX2);CD79a;CD79b;CD72;白细胞相关免疫球蛋白样受体1(LAIR1);IgA受体的Fc片段(FCAR);白细胞免疫球蛋白样受体亚家族成员2(LILRA2);CD300分子样家族成员f(CD300LF);C型凝集素结构域家族12成员A(CLEC12A);骨髓基质细胞抗原2(BST2);含有EGF样模块粘蛋白样激素受体样2(EMR2);淋巴细胞抗原75(LY75);磷脂酰肌醇蛋白聚糖-3(GPC3);Fc受体样5(FCRL5);免疫球蛋白λ样多肽1(IGLL1)。优选的,所述肿瘤抗原为BCMA或者CD19。
病原体抗原选自:病毒、细菌、真菌、原生动物,或寄生虫的抗原;病毒抗原选自:巨细胞病毒抗原、爱泼斯坦-巴尔病毒抗原、人类免疫缺陷病毒抗原,或流感病毒抗原。
一些实施方案中提供一种工程化细胞,其特征在于,所述工程化T细胞被基因工程化减少所述细胞中的NKG2A的表达、活性和/或信号传导。
在一个实施例中,所述工程化T细胞受外源刺激后内源性NKG2A的表达、活性和/或信号传导相关蛋白表达或活性不上调或微上调。
在一个实施例中,所述工程化T细胞包含:
编码NKG2A的基因的遗传破坏和/或导致所述工程化T细胞中NKG2A表达减少的遗传破坏;
编码调节NKG2A的表达或活性的蛋白质的基因的遗传破坏和/或导致调节NKG2A的表达或活性的蛋白质表达减少的遗传破坏;和/或
编码参与NKG2A依赖性信号传导的蛋白质的基因的遗传破坏和/或导致参与NKG2A依赖性信号传导的蛋白质表达减少的遗传破坏。
在一个实施例中,采用基因编辑技术和/或基因沉默技术导致NKG2A的表达减少、调节NKG2A的表达或活性的蛋白质的表达减少和/或参与NKG2A依赖性信号传导的蛋白质的表达减少。
在一个实施例中,通过基因编辑技术敲除所述工程化T细胞内源性NKG2A基因/调节NKG2A表达或活性的蛋白基因/NKG2A依赖性信号传导蛋白基因;
优选的,所述的基因编辑技术选自CRISPR/Cas9技术、ZFN技术、TALE技术、TALE-CRISPR/Cas9技术、Base Editor技术、引导编辑技术和/或归巢核酸内切酶技术;
更优选的,所述的基因编辑技术为CRISPR/Cas9技术。
在一个实施例中,采用CRISPR/Cas9技术敲除所述工程化T细胞内源性NKG2A基因。
在一个实施例中,CRISPR/Cas9技术使用的gRNA选自SEQ ID NO:12、SEQ ID NO:13、SEQ ID NO:14、SEQ ID NO:15、SEQ ID NO:60、SEQ ID NO:61、SEQ ID NO:62、SEQ ID NO:63、SEQ ID NO:64、SEQ ID NO:65、SEQ ID NO:66、SEQ ID NO:67、和/或SEQ ID NO:68所示序列。
在一个实施例中,所述工程化T细胞为来源于天然的T细胞、和/或经多能干细胞诱导产生的T细胞;
优选地,所述T细胞为自体/同种异体T细胞;
优选地,所述T细胞为原代T细胞;
优选地,所述T细胞来源于人的自体T细胞。
在一个实施例中,所述T细胞包含记忆性干细胞样T细胞(Tscm细胞)、中心记忆 T细胞(Tcm)、效应性T细胞(Tef)、调节性T细胞(tregs),效应记忆T细胞(Tem)、或γδT细胞或其组合。
在一个实施例中,所述工程化T细胞表达靶向自体或同种异体的一种或多种免疫细胞或免疫调节细胞的外源蛋白1;
优选地,所述免疫细胞或免疫调节细胞包括NK细胞、活化的T细胞、Treg细胞、髓系来源的免疫抑制剂细胞、巨噬细胞或其组合。
在一个实施例中,所述外源蛋白1靶向NK细胞。
在一个实施例中,所述外源蛋白1靶向NKG2A。
在一个实施例中,所述外源蛋白1包含识别NKG2A的抗体或其功能片段;
优选地,所述识别NKG2A的抗体或其功能片段含有SEQ ID NO:3所示的HCDR1、SEQ ID NO:4所示的HCDR2、SEQ ID NO:5所示的HCDR3、SEQ ID NO:6所示的LCDR1、SEQ ID NO:7所示的LCDR2、SEQ ID NO:8所示的LCDR3;或
所述识别NKG2A的抗体或其功能片段含有SEQ ID NO:1所述的重链可变区和/或SEQ ID NO:2所述的轻链可变区;或
所述识别NKG2A的抗体或其功能片段含有SEQ ID NO:10所述的SCFV序列。
在一个实施例中,所述工程化T细胞还表达外源蛋白2,所述外源蛋白2识别肿瘤抗原或病原体抗原;
优选地,所述肿瘤抗原包括BCMA、CD19、GPC3、Claudin18.2、EGFR或其组合。
在一个实施例中,所述外源蛋白2包含识别BCMA的抗体或其功能片段;
优选的,所述识别BCMA的抗体或其功能片段含有SEQ ID NO:16所示的HCDR1、SEQ ID NO:17所示的HCDR2、SEQ ID NO:18所示的HCDR3、SEQ ID NO:19所示的LCDR1、SEQ ID NO:20所示的LCDR2、和/或SEQ ID NO:21所示的LCDR3;或所述识别BCMA的抗体或其功能片段含有SEQ ID NO:22所示的重链可变区和/或SEQ ID NO:23所示的轻链可变区;或
所述识别BCMA的抗体或其功能片段含有SEQ ID NO:24所示的SCFV序 列。
在一个实施例中,所述工程化T细胞同时表达外源蛋白1和外源蛋白2,所述外源蛋白1靶向NKG2A,所述外源蛋白2靶向BCMA;优选地,所述工程化T细胞包含SEQ ID NO:26或SEQ ID NO:27所示序列。
在一个实施例中,所述外源蛋白1还靶向肿瘤或病原体;优选地,所述肿瘤表达包括BCMA、CD19、GPC3、Claudin18.2、EGFR或其组合。
在一个实施例中,所述外源蛋白1还包含识别BCMA的抗体或其功能片段;
优选的,所述识别BCMA的抗体或其功能片段含有SEQ ID NO:16所示的HCDR1、SEQ ID NO:17所示的HCDR2、SEQ ID NO:18所示的HCDR3、SEQ ID NO:19所示的LCDR1、SEQ ID NO:20所示的LCDR2、和/或SEQ ID NO:21所示的LCDR3;或所述识别BCMA的抗体或其功能片段含有SEQ ID NO:22所示的重链可变区和/或SEQ ID NO:23所示的轻链可变区;或
所述识别BCMA的抗体或其功能片段含有SEQ ID NO:24所示的SCFV序列。
在一个实施例中,所述外源蛋白1包含识别NKG2A的抗体或其功能片段和包含识别肿瘤抗原的抗体或其功能片段,它们的连接方式是:
(1)识别NKG2A的抗体的轻链/重链(或轻链可变区/重链可变区)—识别NKG2A的抗体的重链/轻链(或重链可变区/轻链可变区)—识别肿瘤抗原的抗体的重链/轻链(或重链可变区/轻链可变区)轻链/重链—识别肿瘤抗原的抗体的轻链/重链(或轻链可变区/重链可变区);
(2)识别肿瘤抗原的抗体的轻链(或轻链可变区)—识别NKG2A的抗体的重链(或重链可变区)—识别NKG2A的抗体的轻链(或轻链可变区)—识别肿瘤抗原的抗体的重链(或重链可变区);或
(3)识别NKG2A的抗体的轻链(或轻链可变区)—识别肿瘤抗原的抗体的重链(或重链可变区)—识别肿瘤抗原的抗体的轻链(或轻链可变区)—识别NKG2A的抗体的重链(或重链可变区);
优选地,所述外源蛋白1包括SEQ ID NO:30和/或SEQ ID NO:32所示的氨 基酸序列。
在一个实施例中,所述外源蛋白1和/或外源蛋白2是嵌合抗原受体、嵌合T细胞受体(CAR)、T细胞抗原耦合器(TAC)或其组合;优选地,所述CAR,包括:
(i)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD3ζ;
(ii)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域和CD3ζ;
(iii)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD137的共刺激信号结构域和CD3ζ;和/或
(iv)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域、CD137的共刺激信号结构域和CD3ζ。
在一个实施例中,外源蛋白1是嵌合抗原受体1,所述嵌合抗原受体1识别的靶抗原包括T细胞、NK细胞、Treg细胞、髓系来源的免疫抑制细胞(MDSC)、巨噬细胞分子标志物或其组合;或者所述嵌合抗原受体1所识别的靶抗原还包括肿瘤抗原和/病原体抗原;外源蛋白2是嵌合抗原受体2,所述嵌合抗原受体2识别的靶抗原包括肿瘤抗原和/病原体抗原。
在一个实施例中,所述嵌合抗原受体1靶向NKG2A或者靶向NKG2A和BCMA;所述嵌合抗原受体2靶向BCMA;优选地,所述嵌合抗原受体1包含SEQ ID NO:9、SEQ ID NO:30、SEQ ID NO:32、SEQ ID NO:55、和/或SEQ ID NO:57所示序列;所述嵌合抗原受体2包含SEQ ID NO:25所示序列。
在一个实施例中,所述工程化T细胞还包括:
编码TCR蛋白的基因的敲除和/或内源性TCR分子低表达或不表达;
编码MHC蛋白的基因的敲除和/或内源性MHC低表达或不表达;
优选地,所述TCR是TRAC分子,所述MHC是B2M分子。
在一个实施例中,采用CRISPR/Cas9技术敲除内源性MHC和内源性TCR;优选地,采用CRISPR/Cas9技术敲除B2M使用的gRNA选自SEQ ID NO:54示序列,敲除TRAC使用的gRNA选自SEQ ID NO:53示序列。
在一个实施例中,与未进行此工程化的T细胞相比,所述工程化T细胞的免疫活性增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一个实施例中,与未进行此工程化的T细胞相比,所述工程化T细胞对NK细胞的抵抗能力和/或对NK细胞的杀伤能力增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一个实施例中,与未进行此工程化的T细胞相比,所述工程化T细胞抑制肿瘤细胞增殖、和/或体内抑制肿瘤细胞增殖、肿瘤体积增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
在一个实施例中,与未进行此工程化的T细胞相比,活化后的工程化T细胞中的NKG2A的表达、活性和/或信号传导减少大于约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或100%。
在一个实施例中,所述工程化T细胞能增强在先、同时、在后导入受试者的T细胞和/或携带靶向靶抗原的CAR-T细胞对肿瘤细胞的杀伤、以及增强所述T细胞和/或CAR-T细胞的存活、增殖。
一些实施方案中提供用于制备本文提及任一所述的工程化T细胞所用的核酸、表达载体、病毒。
一些实施方案中提供用于制备本文提及任一所述的工程化T细胞,或以上所述的核酸、表达载体、病毒的方法。
一些实施方案中提供一种产生工程化T细胞的方法,其包括对T细胞进行基因工程化以减少所述细胞中的NKG2A的表达、活性和/或信号传导;优选地,减少表达包括:
在所述T细胞中破坏或抑制编码NKG2A的基因和/或破坏或抑制某一基因,从而导致NKG2A的表达减少;
在所述T细胞中破坏或抑制编码调节NKG2A的表达或活性的蛋白质的基因和/或破坏或抑制某一基因,从而导致调节NKG2A的表达或活性的蛋白质的表达减少;和/或
在所述T细胞中破坏或抑制编码参与NKG2A依赖性信号传导的蛋白质的基因和/或破坏或抑制某一基因,从而导致参与NKG2A依赖性信号传导的蛋白质的表达 减少。
在一个实施例中,在所述T细胞中引入靶向所述基因的内切核酸酶来实现基因破坏;
优选地,所述内切核酸酶选自TAL核酸酶、巨核酸酶、锌指核酸酶、Cas9和Argonaute;
优选地,采用CRISPR/Cas9技术敲除所述T细胞内源性NKG2A基因。
在一个实施例中,与未进行此基因工程化的T细胞中的表达相比,所述工程化T细胞中NKG2A的表达、活性和/或信号传导减少大于或者大于约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或100%。
在一个实施例中,所述工程化T细胞来源于从人分离的T细胞;
优选地,包括来源于外周血单个核细胞(PBMC)分离的T细胞;
优选地,所述T细胞为原代T细胞。
在一个实施例中,对所述细胞进行基因工程化表达嵌合抗原受体(CAR)、修饰的T细胞(抗原)受体(TCR)、T细胞融合蛋白(TFP)、T细胞抗原耦合器(TAC)、aTCR-T或其组合;优选地,所述CAR包括:
(i)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域和CD3ζ;和/或
(ii)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域和CD3ζ;和/或
(iii)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD137的共刺激信号结构域和CD3ζ;和/或
(vi)特异性结合靶抗原的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域、CD137的共刺激信号结构域和CD3ζ。
在一个实施例中,所述CAR含有能够特异性识别BCMA的抗体:
所述特异性识别BCMA的抗体含有SEQ ID NO:16所示的HCDR1、SEQ ID NO:17所示的HCDR2、SEQ ID NO:18所示的HCDR3、SEQ ID NO:19所示的LCDR1、SEQ ID NO:20所示的LCDR2、和/或SEQ ID NO:21所示的LCDR3;或
含有SEQ ID NO:22所示的重链可变区和/或SEQ ID NO:23所示的轻链可变区;或
含有SEQ ID NO:24所示序列。
在一个实施例中,还包括对所述T细胞进行基因工程化以减少所述细胞中的TCR和MHC表达、活性和/或信号传导;优选的,所述TCR包括TRAC,所述MHC包括B2M。
在一个实施例中,在所述T细胞中引入靶向所述基因的内切核酸酶来实现基因破坏;优选地,所述内切核酸酶选自TAL核酸酶、巨核酸酶、锌指核酸酶、Cas9和Argonaute;优选地,采用CRISPR/Cas9技术敲除所述T细胞TRAC和B2M基因。
在一个实施例中,与未进行此基因工程化的T细胞中的表达相比,所述基因工程化T细胞的TCR和MHC的表达、活性和/或信号传导减少大于或者大于约50%、60%、70%、80%、90%或95%。
在一个实施例中,对所述T细胞进行基因工程化表达识别NKG2A的抗体或其功能片段、和/或表达特异性结合NKG2A的嵌合抗原受体(CAR)、修饰的T细胞(抗原)受体(TCR)、T细胞融合蛋白(TFP)、T细胞抗原耦合器(TAC)、aTCR-T或其组合;优选地,所述CAR包括:
(i)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域和CD3ζ;和/或
(ii)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域和CD3ζ;和/或
(iii)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD137的共刺激信号结构域和CD3ζ;和/或
(vi)特异性结合NKG2A的抗体或其功能片段、CD28或CD8的跨膜区、CD28的共刺激信号结构域、CD137的共刺激信号结构域和CD3ζ。
在一个实施例中,所述特异性结合NKG2A的抗体含有SEQ ID NO:3所示的HCDR1、SEQ ID NO:4所示的HCDR2、SEQ ID NO:5所示的HCDR3、EQ ID NO:6所示的LCDR1、SEQ ID NO:7所示的LCDR2、和/或SEQ ID NO:8所示的LCDR3;或
所述特异性结合NKG2A的抗体含有SEQ ID NO:1所述的重链可变区和/ 或SEQ ID NO:2所述的轻链可变区;或
所述特异性结合NKG2A的抗体含有SEQ ID NO:10所述序列。
一些实施方案中提供一种工程化T细胞,其通过本文提及任一所述的方法产生。
一些实施方案中提供一种组合物,其包含有效量的如本文提及任一所述的工程化T细胞,和/或有效量的用于制备本文提及任一所述的工程化T细胞所用的核酸、表达载体、病毒或其组合物;
优选地,还包含药学上可接受的载体;
优选地,所述载体是盐水溶液、右旋糖溶液或5%人血清白蛋白;
优选地,还包含冷冻保护剂。
一些实施方案中提供一种试剂盒,其特征在于,包括如本文提及任一所述的工程化T细胞、本文所述的核酸、表达载体、病毒,和/或如本文所述的组合物以及用于治疗疾病的另外的药剂。
一些实施方案中提供一种治疗疾病的方法,其包括向有需要的受试者给予如本文提及任一所述的工程化T细胞,本文所述的核酸、表达载体、病毒,本文所述的组合物,和/或本文所述的试剂盒;
优选地,在给予所述工程化T细胞之前,通过根据本文提及任一所述的方法产生所述工程化T细胞;
优选地,所述受试者是人;
优选地,其中所述工程化T细胞是自体的或同种异体的T细胞。
在一个实施例中,所述疾病包括免疫性疾病;优选地,所述免疫性疾病包括自身免疫性疾病和/或抗移植物免疫排斥。
在一个实施例中,所述疾病包括肿瘤;优选地,所述肿瘤包括血液肿瘤和/实体瘤。
在一个实施例中,体内导入内源性NKG2A的表达、活性和/或信号传导减少的工程化T细胞能增强在先、同时、在后导入受试者的携带靶向靶抗原的CAR-T细胞对靶细胞的杀伤、以及增强所述CAR-T细胞的存活、增殖。
一些实施方案提供了内源性NKG2A敲除或沉默的工程化T细胞。这些实施方案 提供的工程化T细胞,其被基因工程化为减少所述细胞中的NKG2A表达、活性和/或信号传导。还提供了工程化所述细胞的方法。在一些实施方案中,所述方法包括引入基因敲除或抑制性核酸,导致NKG2A基因、和/或与NKG2A相互作用分子、和/或NKG2A信号通路相关的上下游信号分子的基因被敲除或被沉默,从而导致T细胞中NKG2A的表达、活性和/或信号传导减少。
在一些实施方案中,工程化T细胞被基因工程化以直接减少或消除NKG2A的表达或活性。
在一些实施方案中,工程化T细胞被基因工程化以间接减少或消除NKG2A的表达或活性,如通过减少或消除调节NKG2A的表达或活性的蛋白质(例如控制NKG2A的表达的转录因子)的表达。在一些实施方案中,工程化T细胞被基因工程化以减少或消除参与NKG2A的下游信号传导的分子的表达或活性。
在一些实施例中,采用CRISPR/Cas9系统针对NKG2A基因、和/或与NKG2A相互作用分子、和/或NKG2A信号通路相关的上下游信号分子进行基因编辑。
在一些实施例中,CRISPR/Cas9系统中gRNA或sgRNA序列如SEQ ID NO:12、SEQ ID NO:13、SEQ ID NO:14、SEQ ID NO:15所示。
在一些实施例中,采用CRISPR/Cas9系统针对NKG2A基因进行基因编辑的T细胞在体内或体外靶细胞反复刺激下,所述T细胞中内源性NKG2A不被诱导表达或仅微弱表达。
在一些实施例中,采用CRISPR/Cas9系统针对NKG2A基因进行基因编辑的T细胞体内或体外抗肿瘤活力增强。
在一些实施例中,采用CRISPR/Cas9系统针对NKG2A基因进行基因编辑的T细胞体内或体外对NK细胞的抵抗能力增强,且所述T细胞在有NK细胞存在的环境下的细胞存活、增殖能力增强。
在一个实施例中,采用CRISPR/Cas9系统针对NKG2A、TCR、B2M基因进行基因敲除,可以用于制备同种异体T细胞。
一些实施方案提供了表达靶向非肿瘤抗原的嵌合受体,且内源性NKG2A敲除或沉默的工程化T细胞。在这些实施方案中,工程化T细胞被基因工程化以直接减少或 消除NKG2A的表达或活性,所述细胞也被基因工程化表达嵌合受体(CAR、修饰的TCR、TFP、TAC、aTCR或其组合)。
在具体的实施方案中,非肿瘤抗原可以是靶向体内一种或者多种在免疫及免疫调节细胞上表达的分子(也称为外源蛋白1)。该类分子可以是T细胞、NK细胞分子标志物;Treg细胞、髓系来源的免疫抑制细胞(MDSC)巨噬细胞分子标志物等。
在具体的实施方案中,上述工程化内源性NKG2A敲除或沉默的T细胞表达靶向NK细胞的嵌合分子保护工程化改造的T细胞免于在宿主个体中被清除。实施方案还包括例如避免在接受组织或器官移植的个体中的同种异体免疫反应的方法。
在一个实施例中,内源性NKG2A的敲除或沉默联合表达NKG2A-CAR的T细胞在体外对NK细胞的抵抗能力显著提升,从而保持T细胞较高的存活率。在一个实施例中,内源性NKG2A的敲除或沉默并表达NKG2A-CAR能显著提高T细胞在免疫完善动物体内对NK细胞的杀伤,进一步提高T细胞在免疫完善动物体内能存活和增殖。在一个实施例中,内源性NKG2A的敲除或沉默并表达NKG2A-CAR的T细胞或CAR-T细胞仍能有效分泌细胞毒性因子,杀伤肿瘤细胞。
在一个实施例中,表达NKG2A-CAR,且内源性NKG2A、TCR、B2M敲除或沉默的工程化同种异体T细胞。
一些实施方案提供了表达靶向肿瘤或病毒的嵌合抗原受体,且内源性NKG2A敲除或沉默的工程化T细胞。在一个实施例中所述嵌合抗原受体靶向BCMA、GPC3、Claudin18.2。
在一个实施例中,表达BCMA-CAR且内源性NKG2A敲除或沉默的工程化T细胞体内或体外抗肿瘤活力增强;在免疫完善动物体内对NK细胞的杀伤增强,进一步提高所述T细胞在免疫完善动物体内能存活和增殖。
在一个实施例中,表达BCMA-CAR且内源性NKG2A的敲除或沉默联合表达NKG2A-CAR的T细胞在体外对NK细胞的抵抗能力显著提升,从而保持T细胞较高的存活率;显著提高T细胞在免疫完善动物体内对NK细胞的杀伤,进一步提高T细胞在免疫完善动物体内能存活和增殖。
在一个实施例中,表达BCMA-CAR且内源性NKG2A的敲除或沉默并表达 NKG2A-CAR的T细胞或CAR-T细胞仍能有效分泌细胞毒性因子,杀伤肿瘤细胞。
在一个实施例中,表达BCMA-CAR和NKG2A-CAR,且内源性NKG2A、TCR、B2M敲除或沉默的工程化同种异体T细胞。
一些实施方案提供了靶向肿瘤或病毒抗原的抗体与靶向NK细胞的抗体串联表达于同一个嵌合抗原受体、且内源性NKG2A敲除或沉默的工程化T细胞。
在一个实施例中所述嵌合抗原受体靶向BCMA和NKG2A。
在一个实施例中,靶向BCMA和NKG2A串联CAR且内源性NKG2A敲除或沉默的工程化T细胞体内或体外抗肿瘤活力增强;在免疫完善动物体内对NK细胞的杀伤增强,进一步提高所述T细胞在免疫完善动物体内能存活和增殖。
在一个实施例中,靶向BCMA和NKG2A串联CAR且内源性NKG2A的敲除或沉默T细胞在体外对NK细胞的抵抗能力显著提升,从而保持T细胞较高的存活率;显著提高T细胞在免疫完善动物体内对NK细胞的杀伤,进一步提高T细胞在免疫完善动物体内能存活和增殖;BCMA-loop-NKG2A UCAR-T和NKG2A-loop-BCMA UCAR-T两种串联表达的CAR-T细胞均能在体内显著抑制肿瘤细胞生长,具有类似水平的抗肿瘤活性。
在一个实施例中,靶向BCMA和NKG2A串联CAR且内源性NKG2A的敲除或沉默的T细胞或CAR-T细胞仍能有效分泌细胞毒性因子,杀伤肿瘤细胞。
在一个实施例中,靶向BCMA和NKG2A串联CAR且内源性NKG2A、TCR、B2M敲除或沉默的工程化同种异体T细胞。
在一些实施方案中,工程化T细胞被基因工程化以直接减少或消除NKG2A和TCR的表达或活性,所述细胞也被基因工程化表达至少两个嵌合受体(CAR、修饰的TCR、TFP、TAC、aTCR或其组合),其中,至少一个所述嵌合受体特异性结合肿瘤抗原或病毒抗原,至少一个所述嵌合受体特异性结合NKG2A。在一些实施方案中,工程化T细胞被基因工程化以直接减少或消除NKG2A和TCR的表达或活性,所述细胞也被基因工程化表达NKG2A抗体或其功能片段和至少一个嵌合受体(CAR、修饰的TCR、TFP、TAC、aTCR或其组合),其中,至少一个所述嵌合受体特异性结合肿瘤抗原或病毒抗原。
本专利纳入,例如,中国专利申请公开号CN107058354A、CN107460201A、CN105194661A、CN105315375A、CN105713881A、CN106146666A、CN106519037A、CN106554414A、CN105331585A、CN106397593A、CN106467573A、CN104140974A、CN 108884459 A、CN107893052A、CN108866003A、CN108853144A、CN109385403A、CN109385400A、CN109468279A、CN109503715A、CN109908176 A、CN109880803A、CN110055275 A、CN110123837A、CN 110438082 A、CN 110468105A,以及国际专利申请公开号WO2017186121A1、WO2018006882A1、WO2015172339A8、WO2018/018958A1、WO2014180306A1、WO2015197016A1、WO2016008405A1、WO2016086813A1、WO2016150400A1、WO2017032293A1、WO2017080377A1、WO2017186121A1、WO2018045811A1、WO2018108106A1、WO 2018/219299、WO2018/210279、WO2019/024933、WO2019/114751、WO2019/114762、WO2019/141270、WO2019/149279、WO2019/170147A1、WO2019/210863、WO2019/219029等公开的那些CAR-T细胞及其制备方法。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
实施例1、过表达靶向NKG2A和BCMA的CAR-T细胞的制备
为了验证NKG2A敲除的效果,我们分别构建了表达靶向BCMA的嵌合抗原受体(CAR)以及同时靶向BCMA和NKG2A的CAR的工程化T细胞,用于测试NKG2A敲除后对抗肿瘤活性的影响(靶向肿瘤肿瘤抗原)以及对NK细胞清除的影响(靶向非肿瘤抗原)。
采用本领域常规分子生物学方法,以PRRLsin为载体,构建了表达NKG2A和BCMA的嵌合抗原受体的慢病毒载体PRRLsin-BCMA-NKG2A-CAR(简称BCMA-NKG2A-CAR)(图1)。BCMA-NKG2A-CAR序列(氨基酸序列如SEQ ID NO:26所示)由CD8信号肽(SEQ ID NO:41,SEQ ID NO:42),BCMA的单链抗体(VH的氨基酸序列如SEQ ID NO:22所示,VL的氨基酸序列如SEQ ID NO:23所示), CD8hinge(SEQ ID NO:43,SEQ ID NO:44),CD8跨膜域(SEQ ID NO:45,SEQ ID NO:46),4-1BB共刺激因子(SEQ ID NO:49,SEQ ID NO:50),T细胞激活因子CD3ζ(SEQ ID NO:51,SEQ ID NO:52),F2A(SEQ ID NO:40),NKG2A的单链抗体(VH的氨基酸序列如SEQ ID NO:1所示,VL的氨基酸序列如SEQ ID NO:2所示),CD8hinge(SEQ ID NO:43,SEQ ID NO:44),CD28跨膜和胞内域(SEQ ID NO:28,SEQ ID NO:29),T细胞激活因子CD3ζ(SEQ ID NO:51,SEQ ID NO:52)组成。
构建表达BCMA的嵌合抗原受体的慢病毒质粒PRRLsin-BCMA-CAR(图2),包含CD8信号肽(SEQ ID NO:41,SEQ ID NO:42),BCMA的单链抗体(VH的氨基酸序列如SEQ ID NO:22所示,VL的氨基酸序列如SEQ ID NO:23所示),CD8hinge(SEQ ID NO:43,SEQ ID NO:44),CD8跨膜(SEQ ID NO:45,SEQ ID NO:46),4-1BB共刺激因子(SEQ ID NO:49,SEQ ID NO:50),T细胞激活因子CD3ζ(SEQ ID NO:51,SEQ ID NO:52)。
将上述两个载体分别转染293T细胞,包装慢病毒,分别得到相应的慢病毒BCMA-NKG2A-CAR、BCMA-CAR。感染方法为本领域表达嵌合抗原受体的T细胞制备过程中常规的感染方法。
利用Ficoll-Paque(GE bioscience)进行密度梯度离心,从外周血中分离出单个核细胞(PBMC),加入抗CD3/CD28的磁珠,体外进行活化与扩增后得到T细胞。将慢病毒BCMA-CAR、BCMA-NKG2A-CAR感染活化后的T细胞培养扩增至需要的数量,分别得到BCMA CAR-T细胞和BCMA-NKG2A CAR-T细胞。未转染病毒的细胞命名为UTD细胞。抗BCMA单链抗体的抗体作为一抗,抗biotin的PE抗体作为二抗,进行流式检测,结果如图3所示,BCMA CAR-T细胞的阳性率约为50%,BCMA-NKG2A CAR-T细胞的阳性率约为40%。
实施例2、UCAR-T细胞以及NKG2A敲除的UCAR-T细胞制备
按照试剂说明书(GeneArt
实施例3.NKG2A表达以及敲除检测
由于NKG2A在正常培养的T细胞中几乎不表达(图6),因此,我们将T细胞注射到荷靶细胞的小鼠体内,来检测T细胞中NKG2A表达以及敲除情况,从而判断TRAC/B2M/NKG2A三敲除的UCAR-T细胞中NKG2A敲除情况。
体外培养多发性骨髓瘤细胞系RPMI-8226,皮下接种5×10
进一步地,我们在体外通过肿瘤细胞反复刺激的实验来模拟体内条件,采用BCMA UCAR-T和NKG2A敲除的BCMA UCAR-T-NKG2A KO进行检测。将上述细胞分别按1:1的比例与表达BCMA抗原的RPMI-8226肿瘤细胞进行共孵育(记为D0天),第D3天进行检测,同时重新按1:1比例进行第二次共孵育,第D8天进行第二次检测。利用抗NKG2A的流式抗体进行染色,检测结果图6显示在不加入RPMI-8226肿瘤细胞时,在D3和D8天时,BCMA UCAR-T和BCMA UCAR-T-NKG2A KO细胞的NKG2A表达均很微弱;当与肿瘤细胞共孵育8天时,BCMA UCAR-T细胞中NKG2A的表达发生显著上调,而BCMA UCAR-T-NKG2A KO细胞在与肿瘤细胞共孵育8天后NKG2A的表达仍很微弱,这表明内源性NKG2A被有效敲除。
图5和图6结果也表明CAR-T细胞与靶细胞共孵育或受靶细胞反复刺激等方式,均能显著提高CAR-T细胞内源性NKG2A的表达;而敲除CAR-T细胞中内源性NKG2A后,与靶细胞孵育的CAR-T细胞中的NKG2A表达受到显著抑制。(图6)。需要说明的是,由此可以推测当T细胞在暴露病毒、细菌等病原微生物后,再次接触相似的病原微生物后也极有可能发生NKG2A上调,这与之前报道的,肿瘤疫苗处理后的T细胞中NKG2A的表达显著上调是类似的(Cell 175,1744–1755,December 13,2018)。上述结果表明,T细胞或CAR-T在体内或体外靶细胞的反复刺激下,内源性NKG2A会发生明显上调;而当NKG2A基因被敲除后,在体内或体外靶细胞的反复刺激下,T细胞或CAR-T中内源性NKG2A将不被诱导表达或仅微弱表达。
实施例4、体外肿瘤杀伤功能检测
体外培养多发性骨髓瘤细胞系RPMI-8226作为肿瘤靶细胞。调整细胞密度,取一定量的细胞接种至96孔板,按效应T细胞:靶细胞为1:3,1:1和3:1三个比例接种相对应的UCAR-T细胞。采用RPMI-1640+10%FBS作为培养基,与37℃、5%CO2培养箱中共孵育18小时。按试剂盒说明书(CytoTox
实施例5、体内抗肿瘤功能检测
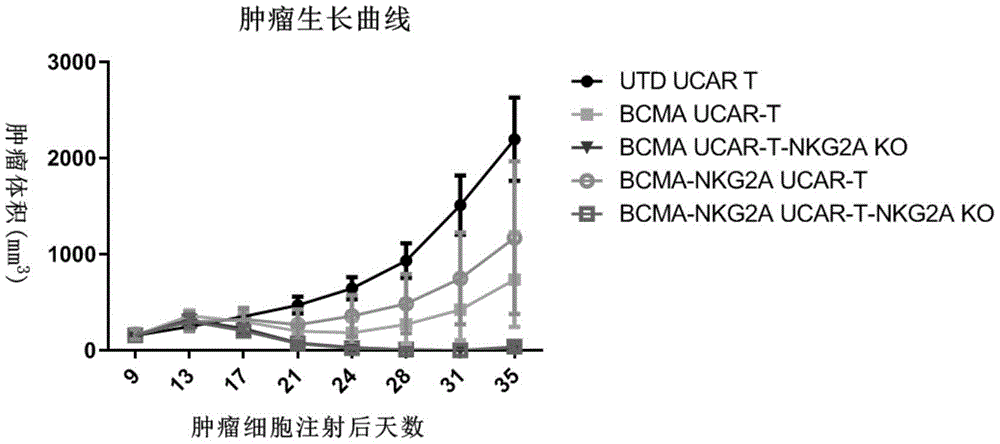
体外培养多发性骨髓瘤细胞系RPMI-8226,皮下接种5×10
上述结果表明,内源性NKG2A的敲除能显著提高T细胞或CAR-T细胞体内抗肿瘤活性。
实施例6:靶向BCMA和NKG2A串联CAR-T细胞的制备
上述实施例中,靶向BCMA和NKG2A的CAR是分开表达,且受不同共刺激因子调控的。进一步地,我们在BCMA和NKG2A串联表达的UCAR-T细胞中验证NKG2A敲除后,对抗肿瘤活性以及清除NK细胞的影响。
采用本领域常规分子生物学方法,将BCMA-loop-NKG2A(氨基酸序列如SEQ ID NO:30)、NKG2A-loop-BCMA(氨基酸序列如SEQ ID NO:32)(表1)分别与CD8信号肽(SEQ ID NO:41,SEQ ID NO:42),CD8hinge、CD8跨膜域、4-1BB共刺激因子以及T细胞激活因子CD3ζ串联,插入载体PRRLsin,构建了载体PRRLsin-BCMA-loop-NKG2A(#1)、PRRLsin-NKG2A-loop-BCMA(#2)(图9)。示例性,BCMA的单链抗体(VH的氨基酸序列如SEQ ID NO:22所示,VL的氨基酸序列如SEQ ID NO:23所示),NKG2A的单链抗体(VH的氨基酸序列如SEQ ID NO:1所示,VL的氨基酸序列如SEQ ID NO:2所示),G4S(氨基酸序列如SEQ ID NO:34所示,核苷酸序列如SEQ ID NO:35所示),(G4S)3(氨基酸序列如SEQ ID NO:36所示,核苷酸序列如SEQ ID NO:37所示),linker1(氨基酸序列如SEQ ID NO:38所示,核苷酸序列如SEQ ID NO:39所示),CD8hinge(氨基酸序列如SEQ ID NO:43所示,核苷酸序列如SEQ ID NO:44所示),CD8跨膜域(氨基酸序列如SEQ ID NO:45所示,核苷酸序列如SEQ ID NO:46所示),4-1BB共刺激因子(氨基酸序列如SEQ ID NO:49所示,核苷酸序列如SEQ ID NO:50所示),T细胞激活因子CD3ζ(氨基酸序列如SEQ ID NO:51所示,核苷酸序列如SEQ ID NO:52所示)。
表1.
利用上述两个载体PRRLsin-BCMA-loop-NKG2A、PRRLsin-NKG2A-loop-BCMA按照实施例1所述方法分别制备得到BCMA-loop-NKG2A-CAR T细胞、NKG2A-loop-BCMA-CAR T细胞。
按照实施例2所述方法分别对上述BCMA-loop-NKG2A CAR T细胞、NKG2A-loop-BCMA CAR T细胞进行TRAC和B2M基因的双敲或TRAC/B2M/NKG2A三敲除,制备得到BCMA-loop-NKG2A-UCAR T细胞、 BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞、NKG2A-loop-BCMA UCAR T细胞、BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞。
实施例7:串联UCAR-T细胞体外对NK细胞的抵抗功能检测
取5×10
更进一步地,在与活化扩增的NK细胞共孵育时,相对BCMA-loop-NKG2A uCAR-T,内源性NKG2A敲除的BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞在24小时、48小时的比例显著提高;相对NKG2A-loop-BCMA UCAR T细胞,内源性NKG2A敲除的NKG2A-loop-BCMA UCAR T-NKG2A KO细胞在24小时、48小时的比例显著提高。上述结果表明,内源性NKG2A的敲除能显著提高T细胞或CAR-T细胞对NK细胞的抵抗功能,从而保持T细胞或CAR-T细胞较高的存活率。
实施例8:串联UCAR-T细胞体内抗肿瘤功能检测
接下来,我们比较了NKG2A敲除后对串联UCAR-T体内抗肿瘤活性的影响。选取UTD UCAR-T,BCMA UCAR-T分别作为阴性和阳性对照,NKG2A-loop-BCMA UCAR-T以及NKG2A敲除的NKG2A-loop-BCMA UCAR-T-NKG2A KO作为实验组。
体外培养多发性骨髓瘤细胞系RPMI-8226,皮下接种5×10
综合实施例7和8所述,在串联表达的CAR-T细胞中,内源性NKG2A敲除不仅能够提高CAR-T细胞的抗肿瘤活性(靶向肿瘤BCMA-CAR),而且可以提高CAR-T细胞对NK细胞的抵抗/清除能力(靶向非肿瘤抗原NKG2A-CAR)。表明内源性NKG2A敲除对靶向肿瘤抗原或者非肿瘤抗原的CAR活性均具有显著的增强作用。
实施例9:串联UCAR-T体内对NK细胞的抵抗功能检测
选取UTD UCAR-T,BCMA UCAR-T分别作为对照,NKG2A敲除的BCMA-loop-NKG2A UCAR-T-NKG2A KO作为实验组,用于检测NKG2A敲除后体内对NK细胞的抵抗作用。
将NPG免疫缺陷的小鼠分成4组,每组3只:给予BCMA UCAR-T(标记为BCMA UCAR-T)、给予BCMA UCAR-T及aNK细胞组(标记为BCMA UCAR-T+aNK)、给予BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞(标记为BCMA-loop-NKG2A UCAR-T-NKG2A KO)、给予BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞及aNK细胞组(标记为BCMA-loop-NKG2A UCAR-T-NKG2A KO+aNK)。
体外扩增活化的NK细胞(aNK),按8×10
进一步采用过表达人源IL-15的NPG小鼠,通过注射造血干细胞进行人免疫系统的重建的人源化重建小鼠(购自江苏集萃药康有限公司),以模拟体内的免疫环境。取1×10
实施例10:串联UCAR-T在NK细胞存在下体外抗肿瘤活性以及抗NK活性检测
选取UTD UCAR-T,BCMA UCAR-T分别作为对照,NKG2A敲除的NKG2A-loop-BCMA-UCAR-T-NKG2A KO作为实验组,用于检测体外肿瘤细胞以及NK细胞同时存在的情况下,NKG2A敲除后串联UCAR-T的抗肿瘤活性和对NK细胞的抵抗作用。
将RPMI-8226肿瘤细胞进行CFSE染色和标记,取2×10
进一步检测了BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞的体外细胞因子分泌情况。取BCMA uCAR-T以及UTD UCAR-T分别作为阳性和阴性对照。取7500RPMI-8226细胞作为肿瘤靶细胞,按T细胞:肿瘤细胞:自体来源的单核细胞=1:1:1进行共孵育,24hr后取上清进行细胞因子微球检测技术(CBA),检测INF-γ、IL2、TNF、IL4、IL6以及IL10的表达情况。结果如图15A、15B所示,BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞与BCMA uCAR-T具有类似的INF-γ、IL2、TNF细胞因子分泌水平,表明BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞能有效分泌细胞毒性因子,杀伤肿瘤细胞;BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞与BCMA uCAR-T具有类似的IL4、IL6以及IL10细胞因子分泌水平,表明BCMA-loop-NKG2A UCAR-T-NKG2A KO细胞不会造成显著的细胞因子炎症。上述结果表明,内源性NKG2A的敲除并表达NKG2A-CAR的T细胞或CAR-T细胞仍能有效分泌细胞毒性因子,杀伤肿瘤细胞。
实施例11:NKG2A敲除后不同形式的串联UCAR-T细胞在体内的抗肿瘤功能检测
由于不同形式的串联表达的CAR-T细胞可能具有不同的抗肿瘤活性,我们比较了BCMA-loop-NKG2A UCAR-T和NKG2A-loop-BCMA UCAR-T两种串联表达的UCAR-T在NKG2A敲除后的体内抗肿瘤效果。选取UTD UCAR-T作为阴性对照,BCMA UCAR-T作为阳性对照。
体外培养多发性骨髓瘤细胞系RPMI-8226,皮下接种5×10
综上所述,NKG2敲除可以显著提高靶向肿瘤抗原BCMA CAR-T细胞的抗肿瘤活性(如图8、图11所示),同时还可以显著提高靶向非肿瘤抗原NKG2A CAR-T对NK细胞的抵抗能力(如图10所示),表明NKG2A敲除可以显著提高T细胞或者CAR-T的功能活性。同时,NKG2A敲除对增强T细胞的功能活性作用,不仅适用于单靶点CAR-T细胞(BCMA CAR),双靶点CAR-T细胞(BCMA-NKG2A CAR),同时也适用于不同串联表达的CAR-T细胞(BCMA-loop-NKG2A CAR,NKG2A-loop-NKG2A CAR)。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
本专利所用序列如下表所示:
