一种海参内脏蛋白肽的制备方法
文献发布时间:2023-06-19 09:55:50
技术领域
本发明属于生物技术领域,具体地说涉及一种海参内脏蛋白肽的制备技术领域。
背景技术
海参营养物质丰富,是我国传统的名贵滋补食品,富含蛋白、微量元素和活性物质,脂肪和胆固醇含量低,具有延缓衰老、消除疲劳、提高免疫力等功效。海参加工中会产生大量的内脏,除少量盐渍加工成食品以外,大部分的海参内脏都被丢弃,不仅浪费资源而且污染环境。海参内脏具有与海参一样的营养价值,因此利用海参内脏提取蛋白肽将使宝贵的海参资源得到充分利用。
蛋白肽通常由2-3个氨基酸组成,具有抗氧化、增强免疫能力、抗高血压、降胆固醇等生物活性,可以抑制细菌、病毒和肿瘤细胞的生长繁殖,同时还具有改善人体微量元素、矿物质的吸收和运输、促进生长等功能,在细胞生理及代谢功能的调节上具有重要的作用。研究发现人体摄入的蛋白质经消化酶作用后,不仅以氨基酸的形式吸收,更多的是以二肽或三肽等小肽的形式吸收,且小肽比游离氨基酸更容易吸收,蛋白肽的生物效价和营养价值比游离氨基酸高。因此,具有生物活性功能的蛋白肽在食品和医疗保健领域有着广泛的应用价值,市场对蛋白肽的需求量也不断增加。
在蛋白肽制备过程中,由于需要复合酶解提高蛋白的酶解程度,需要不断调节酶解的最适pH,其结果会引入大量的无机盐。虽然最终可以通过纳滤除去部分无机盐,但也损失掉大量有营养的寡肽和游离氨基酸。而且,大部分海洋来源的蛋白肽产品颜色深腥味重,影响消费者的接受程度。
因此,提供一种工艺简单、成本低、并能生产出品质优良的海参内脏蛋白肽产品的制备方法是本领域技术人员亟待解决的技术难题。
发明内容
本发明的目的在于提供一种海参内脏蛋白肽的制备方法,它是以海参内脏为原料,利用电解水清洗,再经过酶解、陶瓷膜过滤、纳滤膜过滤、再酶解、脱腥、脱色、干燥等工艺,制备成海参内脏蛋白肽。
为了实现上述目的,本发明的技术方案是:
本发明是一种海参内脏蛋白肽的制备方法,包括以下步骤:
S1.海参内脏清洗、浸泡:海参内脏先用自来水清洗除去肠内杂物,沥干后按3∶1-6∶1(w/v)料液比加入电解水,在10-30℃下浸泡15-45min;
S2.一次酶解:在电解水浸泡过的海参内脏按1∶1~2∶1(w/v)料液比加入复合酶1溶液,将溶液的pH调整至8.0-9.0,在45-55℃下酶解反应1-3h;
S3.超滤和纳滤:将酶解液的pH调整至6.0-7.0后,用陶瓷膜进行过滤分离,将截留的蛋白酶和未完全酶解的海参内脏蛋白添加重新配置的复合酶1溶液中继续酶解,获得的滤液再用纳滤膜进行脱盐浓缩;
S4.二次酶解:在步骤S3纳滤膜截留的酶解液中加入复合酶2,在45-55℃下酶解反应1-3h;
S5.脱色脱腥:将步骤S4制备的蛋白酶解液利用活性炭在45-55℃条件下反应10-15min,进行脱色脱腥;
S6.灭菌干燥:将步骤S5处理过的蛋白酶解液,经加热温度为140-160℃、加热时间为5-10秒的超高温瞬间灭菌后,通过喷雾干燥制备成海参内脏蛋白肽粉末。
进一步地,步骤S1中所述的电解水是0.5%-1%的NaCl水溶液用纳米催化自由基发生器,电流为4-9A,流速为3-5L/min下电解30-60min制备而成,电解水中氯离子含量达到50-200mg/kg。
进一步地,步骤S2中所述的复合酶1指的是胶原蛋白酶、碱性蛋白酶和胰蛋白酶的复配,复配比例为2:2:1,酶溶液中酶的质量浓度为0.75-1.50‰。
进一步地,步骤S3中所述的陶瓷膜截留分子量为10000-20000Da,所述的纳滤膜截留分子量为150-200Da。
进一步地,步骤S3中超滤和纳滤的温度范围是45-55℃。
进一步地,步骤S4中所述的复合酶2指的是木瓜蛋白酶、中性蛋白酶和风味蛋白酶的复配,复配比例为2:2:1,酶相对于溶液中固形物的质量百分比为1.0-2.5%。
本发明相对于现有技术,具有如下的优点及有益效果:
1、水产加工副产物利用酶解制备蛋白肽时,由于担心酶解过程微生物的影响,在酶解前后通常采用加热灭菌。这不仅增加了生产成本,而且加热有可能会破坏蛋白肽的生物活性功能,使蛋白肽的颜色变深。而本发明采用电解水清洗海参内脏,避免反复加热灭菌工艺,可以缩短生产时间,降低生产成本。同时,由于没有采用高温杀菌,还可以充分利用海参内脏自身蛋白酶,降低蛋白酶的用量。与酸性电解水比较,利用氯化钠溶液通过纳米催化电解装置制备的电解水含有更多的氯自由基离子,pH为8.0-8.5,基本上不用调pH就可以进行酶解,杀菌效果更好,实际应用更方便。
2、由于在陶瓷膜和纳滤膜过滤中温度一直保持在45-55℃,不仅可以提高膜通透性,酶解还会持续进行,而且蛋白酶和酶解不完全的海参内脏蛋白还可以实现回收利用,起到缩短蛋白肽制备时间,减少蛋白酶的用量。本发明处理条件温和,可以有效降低生产成本,提高产品的质量。
3、本发明在一次酶解中选择胶原蛋白酶、碱性蛋白酶和胰蛋白酶的复合酶解,获得的蛋白酶解液中多肽分子量主要分布在3000-10000Da,这些酶解液再经过木瓜蛋白酶、中性蛋白酶、风味蛋白酶的复合酶解后,获得的二次酶解液中寡肽的分子量主要分布在200-500Da,有一部分被酶解成分子量低于200Da的寡肽或氨基酸,而且胶原蛋白酶、碱性蛋白酶和胰蛋白酶的分子量都大于20000Da,因此在一次酶解后二次酶解前采用陶瓷膜超滤可以回收蛋白酶和酶解不完全的海参内脏蛋白,用纳滤膜脱盐可以减少酶解物中营养成分的损失。
4、通过选择清水洗掉海参内脏肠内杂物,再用电解水浸泡,一次酶解、超滤、纳滤、二次酶解、脱色脱腥、超高温瞬间杀菌、干燥等综合措施,达到缩短生产时间,降低生产成本、杀菌效果好、制得品质优良的海参内脏蛋白肽产品等效果。
附图说明
下面结合附图表和具体实施例对本发明作进一步的说明。
图1为海参内脏蛋白肽的分子量分布。
图2为海参内脏蛋白肽的菌落总数。
图3为海参内脏蛋白肽抗氧化功能活性。
具体实施方式
实施例1
实验组
S1.海参内脏清洗、浸泡:30kg海参内脏用自来水清洗除去肠内杂物,沥干后加入5L氯离子浓度为200mg/L的电解水(5L质量浓度为1%的NaCl溶液利用纳米催化自由基发生器,电流为9A,流速为3L/min下电解60min制备成电解水,电解水中的氯离子浓度约为200mg/L),在30℃下静泡15min。
S2.一次酶解:在电解水浸泡过的海参内脏中加入30L复合酶1溶液(含18g胶原蛋白酶、18g碱性蛋白酶和9g胰蛋白酶),将溶液的pH调整至8.0,在45℃下酶解反应3h。
S3.超滤纳滤:将酶解液的pH调整至6.0后,用陶瓷膜(截留分子量为10000Da)在45℃下进行过滤分离,未能通过超滤膜的溶液回收并添加至重新配置的复合酶1溶液中继续酶解,通过陶瓷膜的滤液再用纳滤膜(截留分子量为200Da)在45℃下进行脱盐浓缩,经纳滤膜截留后,获得6L左右海参内脏蛋白酶解液,利用手持折射仪测定,酶解液中的可溶性固形物含量为20%。
S4.二次酶解:在海参内脏蛋白酶解液中加入12g木瓜蛋白酶、12g中性蛋白酶和6g风味蛋白酶,在45℃下酶解反应1h。
S5.脱色脱腥:在海参内脏蛋白酶解液中加入30g活性炭,在45℃下脱色脱腥15min,利用碟式离心机除去活性炭。
S6.灭菌干燥:经140℃加热10秒灭菌后,利用喷雾干燥机进行喷雾干燥,可以获得1.21kg水分含量为5%(w/w)左右乳白色的海参内脏蛋白肽粉末。
对照组
S1.海参内脏清洗、浸泡:30kg海参内脏用自来水清洗除去肠内杂物,沥干后加入5L质量浓度为1%的NaCl溶液,在30℃下静泡15min。
S2.一次酶解:在电解水浸泡过的海参内脏中加入30L复合酶1溶液(含18g胶原蛋白酶、18g碱性蛋白酶和9g胰蛋白酶),将溶液的pH调整至8.0,在45℃下酶解反应3h。
S3.超滤纳滤:将酶解液的pH调整至6.0后,用陶瓷膜(截留分子量为10000Da)在45℃下进行过滤分离,未能通过超滤膜的溶液回收并添加至重新配置的复合酶1溶液中继续酶解,通过陶瓷膜的滤液再用纳滤膜(截留分子量为200Da)在45℃下进行脱盐浓缩,经纳滤膜截留后,获得6L左右海参内脏蛋白酶解液,利用手持折射仪测定,酶解液中的可溶性固形物含量为20%。
S4.二次酶解:往海参内脏蛋白酶解液中加入12g木瓜蛋白酶、12g中性蛋白酶和6g风味蛋白酶,在45℃下酶解反应1h。
S5.脱色脱腥:在海参内脏蛋白酶解液中加入30g活性炭,在45℃下脱色脱腥15min,利用碟式离心机除去活性炭。
S6.灭菌干燥:经140℃加热10秒灭菌后,利用喷雾干燥机进行喷雾干燥,可以获得1.13kg水分含量为5%(w/w)左右乳白色的海参内脏蛋白肽粉末。
实施例2
实验组
S1.海参内脏清洗、浸泡:30kg海参内脏用自来水清洗除去肠内杂物,沥干后加入7.5L氯离子浓度为100mg/L的电解水(5L质量浓度为1%的NaCl溶液利用纳米催化自由基发生器,电流为9A,流速为3L/min下电解60min制备成电解水,电解水中的氯离子浓度约为200mg/L),在20℃下静泡30min。
S2.一次酶解:在电解水浸泡过的海参内脏中加入25L复合酶1溶液(含27g胶原蛋白酶、27g碱性蛋白酶和13.5g胰蛋白酶),将溶液的pH调整至8.5,在50℃下酶解反应2h。
S3.超滤纳滤:将酶解液的pH调整至6.5后,用陶瓷膜(截留分子量为15000Da)在50℃下进行过滤分离,未能通过超滤膜的溶液回收并添加至重新配置的复合酶1溶液中继续酶解,通过陶瓷膜的滤液再用纳滤膜(截留分子量为200Da)在50℃下进行脱盐浓缩,经纳滤膜截留后,获得4.6L左右海参内脏蛋白酶解液,利用手持折射仪测定,酶解液中的可溶性固形物含量为25%。
S4.二次酶解:往海参内脏蛋白酶解液中加入7g木瓜蛋白酶、7g中性蛋白酶和3.5g风味蛋白酶,在50℃下酶解反应2h。
S5.在海参内脏蛋白酶解液中加入30g活性炭,在50℃下脱色脱腥10min,利用碟式离心机除去活性炭。
S6.灭菌干燥:经150℃加热8秒灭菌后,利用喷雾干燥机进行喷雾干燥,可以获得1.14kg水分含量为5%(w/w)左右乳白色的海参内脏蛋白肽粉末。
对照组
S1.海参内脏清洗、浸泡:30kg海参内脏用自来水清洗除去肠内杂物,沥干后加入7.5L氯离子浓度为100mg/L的电解水(5L质量浓度为1%的NaCl溶液利用纳米催化自由基发生器,电流为9A,流速为3L/min下电解60min制备成电解水,电解水中的氯离子浓度约为200mg/L),在20℃下静泡30min。
S2.一次酶解:在电解水浸泡过的海参内脏中加入25L复合酶1溶液(含27g胶原蛋白酶、27g碱性蛋白酶和13.5g胰蛋白酶),将溶液的pH调整至8.5,在50℃下酶解反应2h。
S3.二次酶解:将酶解液的pH调整至6.5后,加入7g木瓜蛋白酶、7g中性蛋白酶和3.5g风味蛋白酶,在50℃下酶解反应2h。
S4.超滤纳滤:用陶瓷膜(截留分子量为15000Da)在50℃下进行过滤分离,通过陶瓷膜的滤液用纳滤膜(截留分子量为200Da)在50℃下进行脱盐浓缩,经纳滤膜截留后,获得2.8L左右海参内脏蛋白酶解液,利用手持折射仪测定,酶解液中的可溶性固形物含量为25%。
S5.脱色脱腥:往海参内脏蛋白酶解液中加入30g活性炭,在50℃下脱色脱腥10min,利用碟式离心机除去活性炭。
S6.灭菌干燥:经150℃加热8秒灭菌后,利用喷雾干燥机进行喷雾干燥,可以获得0.68kg水分含量为5%(w/w)左右乳白色的海参内脏蛋白肽粉末。
实施例3
实验组
S1.海参内脏清洗、浸泡:30kg海参内脏用自来水清洗除去肠内杂物,沥干后加入10L氯离子浓度为50mg/L的电解水(5L质量浓度为1%的NaCl溶液利用纳米催化自由基发生器,电流为9A,流速为3L/min下电解60min制备成电解水,电解水中的氯离子浓度约为200mg/L),在10℃下静泡45min。
S2.一次酶解:在电解水浸泡过的海参内脏中加入15L复合酶1溶液(含36g胶原蛋白酶、36g碱性蛋白酶和18g胰蛋白酶),将溶液的pH调整至9.0,在55℃下酶解反应1h。
S3.超滤纳滤:将酶解液的pH调整至7.0后,用陶瓷膜(截留分子量为20000Da)在55℃下进行过滤分离,未能通过超滤膜的溶液回收并添加至重新配置的复合酶1溶液中继续酶解,通过陶瓷膜的滤液再用纳滤膜(截留分子量为150Da)在55℃下进行脱盐浓缩,经纳滤膜截留后,获得4.10L左右海参内脏蛋白酶解液,利用手持折射仪测定,酶解液中的可溶性固形物含量为30%。
S4.二次酶解:往海参内脏蛋白酶解液中加入5g木瓜蛋白酶、5g中性蛋白酶和2.5g风味蛋白酶,在55℃下酶解反应3h。
S5.脱色脱腥:在海参内脏蛋白酶解液中加入30g活性炭,在55℃下脱色脱腥10min,利用碟式离心机除去活性炭。
S6.灭菌干燥:经160℃加热5秒灭菌后,利用喷雾干燥机进行喷雾干燥,可以获得1.21kg水分含量为5%(w/w)左右乳白色的海参内脏蛋白肽粉末。
对照组
S1.海参内脏清洗、浸泡:30kg海参内脏用自来水清洗除去肠内杂物,沥干后加入25L质量浓度为1%的NaCl溶液。
S2.加热灭菌:将电解水浸泡过的海参内脏加热至85℃并保温20min灭菌。
S3.一次酶解:冷却至55℃左右,加入36g胶原蛋白酶、36g碱性蛋白酶和18g胰蛋白酶,将溶液的pH调整至9.0,在55℃下酶解反应1h。
S4.二次酶解:将酶解液的pH调整至7.0后,加入5g木瓜蛋白酶、5g中性蛋白酶和2.5g风味蛋白酶,在55℃下酶解反应3h。
S5.加热灭菌:加热至85℃并保温20min灭菌灭酶。
S6.超滤纳滤:冷却至10℃左右,用陶瓷膜(截留分子量为20000道尔顿)在10℃下进行过滤分离,通过陶瓷膜的滤液再用纳滤膜(截留分子量为150道尔顿)在10℃下进行脱盐浓缩,经纳滤膜截留后,可以获得Brix为30%的海参内脏蛋白酶解液2.06L。
S7.脱色脱腥:在海参内脏蛋白酶解液中加入30g活性炭,在55℃下脱色脱腥10min,利用碟式离心机除去活性炭。
S8.喷雾干燥:利用喷雾干燥机进行喷雾干燥,可以获得0.60kg水分含量为5%(w/w)左右淡黄色的海参内脏蛋白肽粉末。
实施例4
海参内脏蛋白肽产品分子量测定
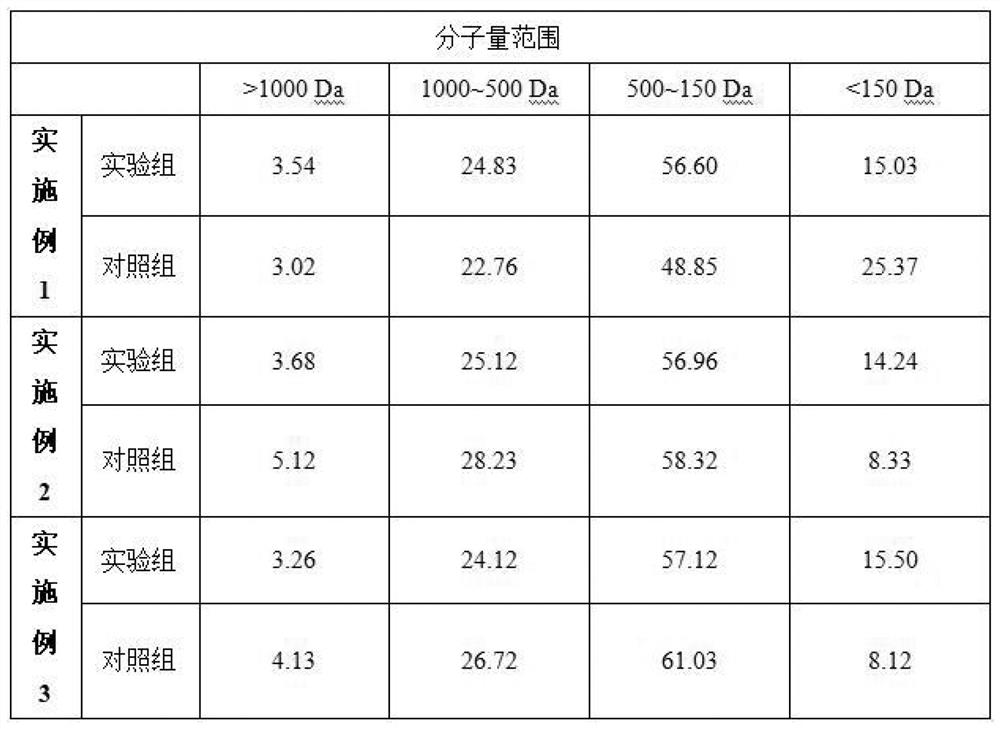
利用高效液相色谱仪分析海参内脏蛋白肽分子量。色谱柱为TSKgel G2000 SWXLL(300mm×7.8mm),流动相为乙腈/双蒸水/TFA(45:55:0.1,V/V/V)。在柱温30℃、流速0.5mL/min、紫外检测波长214nm的条件下,以细胞色素C(12327Da)、抑肽酶(6533Da)、氧化型谷胱甘肽(613Da)、Gly-Gly-Gly(189Da)和Gly(75Da)作为标准品,测定结果如图1所示。
由图1可看出,利用本发明制备的海参内脏蛋白肽的分子量主要分布在150-1000Da,也含有15%左右分子量小于150Da的寡肽/氨基酸。由实施例1可看出,不采用电解水进行预处理,所得到的最终产物分子量小于150Da的寡肽/氨基酸比例明显增加,这可能在酶解过程中微生物的作用引起的。由实施例2或实施例3可看出,当采用电解水处理或者传统的杀菌处理方式,在二次酶解结束后才进行超滤和纳滤处理,虽然分子量小于150Da的寡肽/氨基酸比例明显下降,但是蛋白肽的得率也显著下降。
实施例5
海参内脏蛋白肽产品菌落数测定
分别取上述实施例1-3中实验组和对照组各5g海参内脏蛋白肽产品与95ml无菌生理盐水(0.85%NaCl溶液)混合,利用均质器(
由图2可知,实施例1中实验组利用NaCl溶液制备的电解水替代加热对海参内脏进行处理,最终得到1.21kg水分含量为5%(w/w)左右乳白色的海参内脏蛋白肽粉末,其菌落数为2.5CFU/g。而实施例1中对照组用加热对海参内脏进行处理,最终得到1.21kg水分含量为5%(w/w)左右乳白色的海参内脏蛋白肽粉末,其菌落数为4.7CFU/g。由此可看出,利用NaCl溶液制备的电解水替代加热可以有效的抑制酶解过程的微生物生产繁殖,且产品得率明显高于加热方法制备的产品。
实施例6
海参蛋白肽产品抗氧化功能活性测定
1、羟自由基清除活性的测定:在1.0mL海参内脏蛋白肽样品溶液中依次加入0.3mL8mmol/L FeSO
2、DPPH自由基清除活性的测定:向1.0mL海参内脏蛋白肽样品中加入1.0mL0.2mmol/L DPPH乙醇溶液,室温下避光反应30分钟后,于10000r/min离心10分钟。使用UV-8000A分光光度计在波长为517nm处测定吸光度。样品的DPPH自由基清除率根据式(1)进行计算,其中,A
3、铁离子还原能力:在1.0mL海参内脏蛋白肽样品中分别加入1.0mL磷酸盐缓冲液(PBS,0.2mol/L,pH 6.6)和1.0mL 1%铁氰化钾[K
由图3可知,一方面,由于将纳滤脱盐调整到二次酶解的前面,不影响产品的抗氧化活性功能;另一方面,还可以大幅度地提高产品得率(实施例2)。
综上所述,利用清水洗掉海参内脏肠内杂物,再用电解水浸泡,通过一次酶解、超滤、纳滤、二次酶解、脱色脱腥、超高温瞬间杀菌、干燥等工序,可以生产具有良好抗氧化活性的海参内脏蛋白肽。
虽然以上描述了本发明的具体实施方式,但是熟悉本技术领域的技术人员应当理解,我们所描述的具体的实施例只是说明性的,而不是用于对本发明的范围的限定,熟悉本领域的技术人员在依照本发明的精神所作的等效的修饰以及变化,都应当涵盖在本发明的权利要求所保护的范围内。
- 一种海参内脏蛋白肽的制备方法
- 一种分步高效制备海参内脏抗氧化肽的制备方法
