T细胞受体及其用途
文献发布时间:2023-06-19 11:14:36
技术领域
本发明涉及能够识别来自EB病毒(EBV)的抗原的T细胞受体(TCR)。本发明还涉及TCR 基因转移在产生EBV特异性T细胞中的用途及其在治疗和/或预防EBV相关的疾病、病症或病状中的用途。
背景技术
EBV是世界范围内感染人类的疱疹病毒家族(herpesvirus family)的成员。研究显示,所有成年人中超过95%都具有针对这种病毒的抗体,这意味着他们已经在其生命中的某个阶段感染了该病毒[1]。EBV通常在整个生命中持续存在,且很少引起任何问题。但是,在一些情况下,EBV与癌症和严重疾病的发展有关,所述癌症和严重疾病包括伯基特淋巴瘤、霍奇金淋巴瘤、鼻咽癌、移植后淋巴增生性疾病、NKT细胞淋巴瘤、弥漫性大B细胞淋巴瘤、胃癌和多发性硬化[1-3]。在大多数与EBV相关的疾病中,EBV蛋白表达是非常受限的,但在许多情况下,潜伏膜蛋白(LMP)2、LMP1和EBNA1蛋白表达[1]。
T细胞检测主要组织相容性复合物(MHC)分子呈递的8-15个氨基酸短肽形式的外来抗原,所述MHC在人类中称为人白细胞抗原(HLA)。T细胞通过T细胞受体(TCR)识别肽-MHC复合物[4]。TCR是包含两条链的克隆型、膜结合的糖基化多肽。在αβT细胞中,这些链由TCRα链和β链组成。为了参与与MHC结合的抗原肽的丰富库,TCR通过在发育中的胸腺T细胞的TCRα基因座处的V和J基因以及TCRβ基因座处的V、D和J基因的随机重排而多样化。通过在称为N区的V-(D)-J连接位点处无模板添加或删除可变数目的核苷酸,创建了进一步的潜在多样性。与肽-MHC复合物发生大部分接触的TCR区域称为互补决定区(CDR)。 TCR的第一和第二CDR是在V基因区段(TRAV和TRBV)内编码的种系,而CDR3区衍生自 V-(D)-J区和N区[5]。
在实验室中,EBV将B淋巴细胞转化为永生的类淋巴母细胞细胞系(LCL)。与此相一致,在接受抑制对EBV的免疫反应的免疫抑制药物治疗(例如,在移植后的淋巴增生性疾病中)的患者中,EBV感染的B淋巴细胞经常扩增至危险的高水平[1]。临床试验提供了有力的证据,证明CD8+T淋巴细胞在控制EBV感染中起主要作用,表明采用体外扩增的EBV特异性细胞毒性T淋巴细胞(CTL)进行的过继免疫疗法可以成功治疗移植后的淋巴增生性疾病[6]。使用体外扩增的EBV特异性CTL的过继免疫疗法也显示出有望作为霍奇金淋巴瘤,鼻咽癌和多发性硬化的治疗选择[6]。在这些临床试验中,使用了特异于EBV蛋白LMP2、LMP1和/ 或EBNA1的T细胞,因为这些抗原通常由霍奇金淋巴瘤,鼻咽癌中的恶性细胞或MS患者脑中EBV感染的B细胞表达[6-8]。此外,在大多数暴露于EBV的个体中,T细胞对这些抗原的应答相对较弱[6]。
尽管T细胞过继免疫疗法已在针对EBV相关疾病和其他癌症类型的临床试验中显示出令人鼓舞的功效,但它是劳动密集型且昂贵的治疗选择,并且通常不可能产生特异于需要杀死的靶细胞的足够T细胞[6]。因此,需要用于治疗EBV相关的疾病、病症和病状的改进方法。
发明概述
本发明部分地基于发现具有CDR的α和βTCR链,所述CDR识别当与几种常见的人白细胞抗原缔和而呈递时衍生自EBV的LMP1和LMP2抗原的表位。
因此,本发明的一种形式广泛地涉及TCR及它们在预防和/或治疗EBV相关的疾病、病症或病状中的用途。
在第一方面,本发明提供了T细胞受体(TCR)的分离的α链或其片段,包含根据任一SEQ ID NO:331-411和/或表2-7的至少一个互补决定区(CDR)氨基酸序列或与其至少70%同一的氨基酸序列。
在一个实施方案中,该分离的α链还包含根据任一SEQ ID NO:7-87和169-249和/或表2-7 的一个或多个进一步的CDR氨基酸序列,或与其至少70%同一的氨基酸序列。
在一些实施方案中,该分离的α链包含根据任一SEQ ID NO:655-735和/或图94至99的氨基酸序列或与其至少70%同一的氨基酸序列、基本上由所述氨基酸序列组成或由所述氨基酸序列组成。
在具体的实施方案中,该分离的α链包含在其恒定区的位置48处的半胱氨酸残基。
该分离的α链合适地包含在其恒定区的位置90、91、92和/或93处的一个或多个氨基酸取代。在具体的实施方案中,该分离的α链包含:
(a)在位置90的P至S取代;
(b)在位置91的E至D取代;
(c)在位置92的S至V取代;和/或
(d)在位置93的S至P取代。
在第二方面,本发明提供了TCR的分离的β链或其片段,包含根据任一SEQ ID NO:412-492和/或表2-7的至少一个CDR氨基酸序列或与其至少70%同一的氨基酸序列。
在某些实施方案中,该分离的β链还包含根据任一SEQ ID NO:88-168和250-330和/或表 2-7的一个或多个进一步的CDR氨基酸序列或与其至少70%同一的氨基酸序列。
在一个优选的实施方案中,该分离的β链包含根据任一SEQ ID NO:736-816和/或图94 至99的氨基酸序列或与其至少70%同一的氨基酸序列、基本上由所述氨基酸序列组成或由所述氨基酸序列组成。
合适地,该分离的β链包含在其恒定区的位置57处的半胱氨酸残基。
在一些实施方案中,该分离的β链包含在其恒定区的位置18、22、133、136和/或139处的一个或多个氨基酸取代。在具体的实施方案中,该分离的β链包含:
(a)在位置18的E至K取代;
(b)在位置22的S至A取代;
(c)在位置133的F至I取代;
(d)在位置136的V至A取代;和/或
(e)在位置139的Q至H取代。
在第三方面,本发明提供了分离的TCR或TCR片段,其用于结合衍生自EB病毒(EBV)的抗原,该TCR包含:
(i)根据所述第一方面的分离的α链或其片段;和/或
(ii)根据所述第二方面的分离的β链或其片段。
合适地,抗原至少部分衍生自潜伏膜蛋白1(LMP-1)和/或潜伏膜蛋白2(LMP-2)。
在一个实施方案中,该α链和该β链通过连接子连接。
在第四方面,本发明提供了分离的核酸,其编码:
(i)根据第一方面的分离的α链或其片段;
(ii)根据第二方面的分离的β链或其片段;或者
(iii)根据第三方面的分离的TCR或TCR片段。
在第五方面,本发明提供了一种遗传构建体,其包含上述方面的分离的核酸。
在第六方面,本发明提供了包含第四方面的分离的核酸和/或第五方面的遗传构建体的宿主细胞。
优选地,宿主细胞是或包含T细胞。
在第七方面,本发明提供了产生分离的α链或其片段、分离的β链或其片段和/或分离的 TCR或TCR片段的方法,所述方法包括:
(i)培养上述方面的宿主细胞;
(ii)从步骤(i)中培养的所述宿主细胞分离所述α链、β链和/或TCR。
在第八方面,本发明提供了结合和/或针对以下产生的抗体或抗体片段:
(i)根据第一方面的分离的α链或其片段;
(ii)根据第二方面的分离的β链或其片段;或者
(iii)根据第三方面的分离的TCR或TCR片段。
在第九方面,本发明提供了一种组合物,其包含:
(i)根据第一方面的分离的α链或其片段;
(ii)根据第二方面的分离的β链或其片段;
(iii)根据第三方面的分离的TCR或TCR片段;
(iv)根据第四方面的分离的核酸;
(v)根据第五方面的遗传构建体;和/或
(vi)根据第六方面的宿主细胞;
以及可药用载体、稀释剂或赋形剂。
在第十方面,本发明提供了一种治疗或预防受试者中EBV相关的疾病、病症或病状的方法,所述方法包括施用治疗有效量的根据第一方面所述的分离的α链或其片段,根据第二方面所述的分离的β链或其片段,根据第三方面所述的分离的TCR或TCR片段,根据第四方面所述的分离的核酸,根据第五方面所述的遗传构建体,根据第六方面所述的宿主细胞和/或根据第九方面所述的组合物至受试者的步骤,从而在受试者中治疗或预防EBV相关的疾病、病症或病状。
在第十一方面,本发明提供了一种在患有EBV相关疾病、病症或病状的受试者中进行细胞免疫疗法的方法,所述方法包括施用治疗有效量的根据第六方面所述的宿主细胞和任选地可药用载体、稀释剂或赋形剂至受试者的步骤。
关于第十和第十一方面的方法,EBV相关的疾病、病症或病状合适地是或包含癌症。优选地,EBV相关的疾病、病症或病状选自鼻咽癌,NKT细胞淋巴瘤,霍奇金淋巴瘤,移植后淋巴增生性疾病,伯基特淋巴瘤,弥漫性大B细胞淋巴瘤,胃癌和其任何组合。在一个备选的实施方案中,EBV相关的疾病、病症或病状合适地是或包含多发性硬化。
合适地,根据第一方面的分离的α链或其片段,根据第二方面的分离的β链或其片段,根据第三方面的分离的TCR或TCR片段,根据第四方面的分离的核酸,根据第五方面的遗传构建体,根据第六方面的宿主细胞或根据第九方面的组合物用于第十方面的方法中。
在具体的实施方案中,根据第六方面的宿主细胞用于第十一方面的方法中。
在第十二方面,本发明提供了一种检测或分离来自受试者的生物样品中的T细胞的方法,该方法包括以下步骤:使生物样品与根据第八方面所述的抗体或抗体片段接触一段时间,并在足以检测或分离所述T细胞的条件下由此检测或分离所述T细胞。
在某些实施方案中,所检测或分离的T细胞适用于EBV相关的疾病、病症或病状的细胞免疫疗法。
合适地,T细胞包含第一方面的α链,第二方面的β链和/或第三方面的T细胞受体。
合适地,本发明前述方面的受试者是哺乳动物。
优选地,受试者是人。
在整个说明书中,除非另外指出,否则“包含”,“包括”和“含有”是包括在内而不是排他地使用,从而提及的整数或整数组可以包括一个或多个其他未提及的整数或整数组。
还应当理解,不定冠词“一个”和“一种”不应被理解为单数不定冠词,或不应被理解为排除不定冠词所指的单一对象之外的多于一个或多个对象。例如,“一种”蛋白质包括一种蛋白质,一种或多种蛋白质或多种蛋白质。
在本文中,“基本上由...组成”是指分离的蛋白质或每个免疫原性片段除了所列举的氨基酸序列之外还具有一个、两个或不超过三个氨基酸残基。所述额外的氨基酸残基可以出现在所列举的氨基酸序列的N-和/或C-端,但不限于此,
附图简述
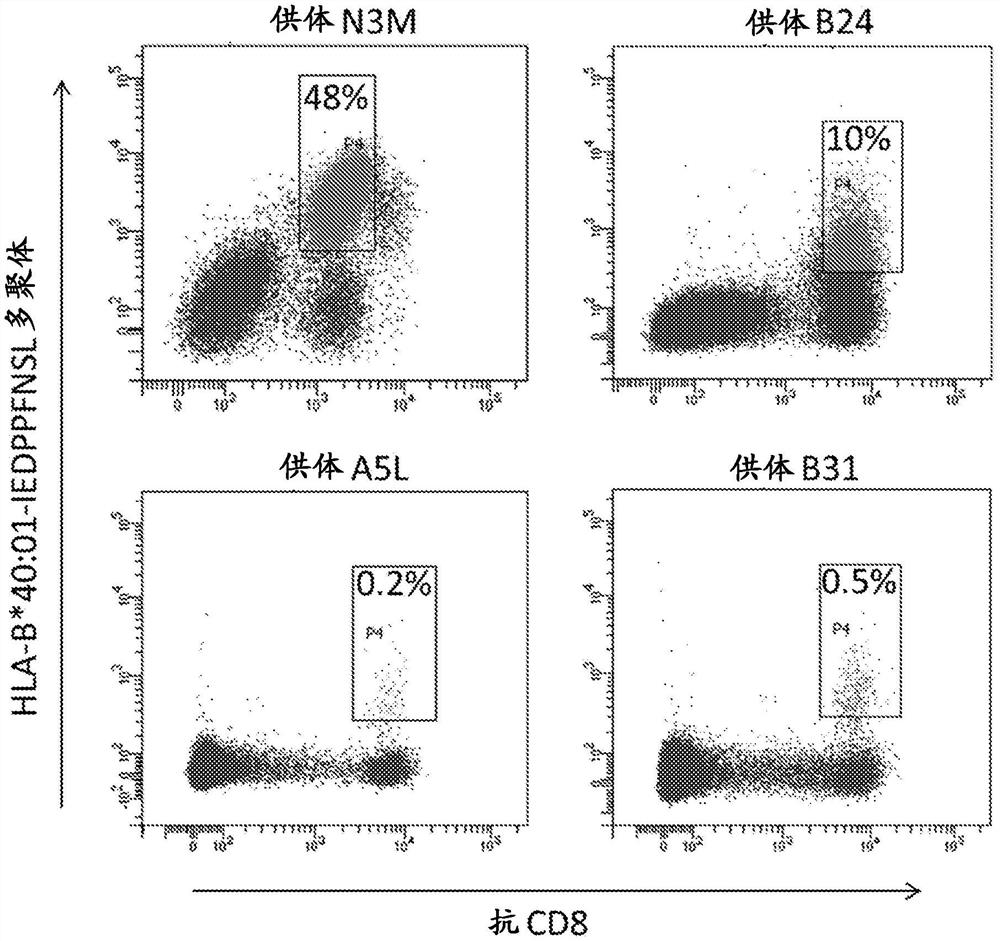
图1.用于分选特异于HLA-B*40:01-IEDPPFNSL的CD8
图2.用于分选特异于HLA-A*11:01-SSCSSCPLSK的CD8
图3.用于分选特异于HLA-A*24:02-TYGPVFMCL(供体D2M和B31)或 HLA-A24:02-TYGPVFMSL(供体Y6W)的CD8
图4.用于分选特异于HLA-A*24:02-PYLFWLAAI的CD8
图5.用于分选特异于HLA-A*02:01-YLLEMLWRL的CD8
图6.用于分选特异于HLA-A*02:01-FLYALALLL的CD8
图7.用于分选和鉴定表达特异于HLA-A*11:01-SSCSSCPLSK的TCR的Jurkat T细胞的流式细胞术数据。
图8.用于分选和鉴定表达特异于HLA-A*24:02-TYGPVFMCL的TCR的Jurkat T细胞的流式细胞术数据。
图9.测试经转导的表达特异于HLA-B*40:01-IEDPPFNSL的TCR的Jurkat T细胞对用 IEDPPFNSL肽(100ug/ml、10ug/ml或1ug/ml)预处理的或不进行处理的HLA-B*40:01
图10.测试经转导的表达特异于HLA-A*11:01-SSCSSCPLSK的TCR的Jurkat T细胞对用SSCSSCPLSK肽(100ug/ml,10ug/ml或1ug/ml)预处理的或不进行处理的HLA-A*11:01
图11.用特异于HLA-A*02:01-FLYALALLL的TCR转导的原代T细胞的粒酶B表达。TCR转导的T细胞的流式细胞术数据:(A)无刺激,(B)具有添加的HLA-A*02:01
图12.EBV诱导的B细胞淋巴瘤的小鼠模型以及用TCR转基因T细胞的治疗。通过皮下注射表达HLA-A*02:01的EBV阳性人B淋巴细胞(LCL)在NOD/RAG小鼠中建立EBV阳性肿瘤。从第2天开始可见肿瘤,并在接种肿瘤后的第2天和第9天进行治疗。这由两次静脉内注射组成,注射衍生自健康EBV血清(sero)阴性供体的转基因T细胞,所述转基因T细胞已通过CD3-CD28珠刺激产生。用特异于HLA-A*02:01-FLYALALLL的TCR转导这些T细胞。作为对照,还在第2天和第9天静脉内注射未转导的T细胞或PBS。将肿瘤体积绘制在 y轴上。将注射肿瘤细胞后的时间绘制在x轴上。绘制每组的平均值。误差棒代表SEM(每组 n=6只小鼠;****p<0.0001;**p<0.01;通过双向重复测量ANOVA分析)。
图13至93.TCR核苷酸序列:具有密码子优化(使用JCat Codon Adaptation Tool:http://www.jcat.de),并在恒定区内编码每个受体链上的单个半胱氨酸的密码子替换,以促进形成额外的链间二硫键并减少与内源性TCR亚基的TCR错配(参考:Cohen等人,CancerRes. 2007,67:3898-3903)。
图94至99.TCR氨基酸序列(未修饰的)
序列简述
SEQ ID NO:1LMP2表位IEDPPFNSL
SEQ ID NO:2LMP2表位SCSSCPLSK
SEQ ID NO:3LMP2表位TYGPVFMSL
SEQ ID NO:4LMP2表位PYLFWLAAI
SEQ ID NO:5LMP1表位YLLEMLWRL
SEQ ID NO.6LMP2表位FLYALALLL
SEQ ID NO:7表2中供体N3M的克隆1的α链CDR1
SEQ ID NO:8表2中供体B24的克隆1的α链CDR1
SEQ ID NO:9表2中供体B24的克隆2的α链CDR1
SEQ ID NO:10表2中供体B24的克隆3的α链CDR1
SEQ ID NO:11表2中供体B24的克隆4的α链CDR1
SEQ ID NO:12表2中供体A5L的克隆1的α链CDR1
SEQ ID NO:13表2中供体A5L的克隆2的α链CDR1
SEQ ID NO:14表2中供体A5L的克隆3的α链CDR1
SEQ ID NO:15表2中供体A5L的克隆4的α链CDR1
SEQ ID NO:16表2中供体A5L的克隆5的α链CDR1
SEQ ID NO:17表2中供体B31的克隆1的α链CDR1
SEQ ID NO:18表2中供体B31的克隆2的α链CDR1
SEQ ID NO:19表3中供体R7Z的克隆1的α链CDR1
SEQ ID NO:20表3中供体R7Z的克隆2的α链CDR1
SEQ ID NO:21表3中供体R7Z的克隆3的α链CDR1
SEQ ID NO:22表3中供体R7Z的克隆4的α链CDR1
SEQ ID NO:23表3中供体R7Z的克隆5的α链CDR1
SEQ ID NO:24表3中供体B5F的克隆1的α链CDR1
SEQ ID NO:25表3中供体B5F的克隆2的α链CDR1
SEQ ID NO:26表3中供体T3V的克隆1的α链CDR1
SEQ ID NO:27表3中供体T3V的克隆2的α链CDR1
SEQ ID NO:28表3中供体T3V的克隆3的α链CDR1
SEQ ID NO:29表3中供体P6G的克隆1的α链CDR1
SEQ ID NO:30表3中供体P6G的克隆2的α链CDR1
SEQ ID NO:31表3中供体P6G的克隆3的α链CDR1
SEQ ID NO:32表3中供体A4T的克隆1的α链CDR1
SEQ ID NO:33表4中供体D2M的克隆1的α链CDR1
SEQ ID NO:34表4中供体D2M的克隆2的α链CDR1
SEQ ID NO:35表4中供体D2M的克隆3的α链CDR1
SEQ ID NO:36表4中供体B31的克隆1的α链CDR1
SEQ ID NO:37表4中供体B31的克隆2的α链CDR1
SEQ ID NO:38表4中供体B31的克隆3的α链CDR1
SEQ ID NO:39表4中供体B31的克隆4的α链CDR1
SEQ ID NO:40表4中供体B31的克隆5的α链CDR1
SEQ ID NO:41表4中供体B31的克隆6的α链CDR1
SEQ ID NO:42表4中供体Y6W的克隆1的α链CDR1
SEQ ID NO:43表4中供体Y6W的克隆2的α链CDR1
SEQ ID NO:44表4中供体Y6W的克隆3的α链CDR1
SEQ ID NO:45表5中供体B33的克隆1的α链CDR1
SEQ ID NO:46表5中供体B5F的克隆1的α链CDR1
SEQ ID NO:47表5中供体Y6W的克隆1的α链CDR1
SEQ ID NO:48表5中供体Y6W的克隆2的α链CDR1
SEQ ID NO:49表5中供体Y6W的克隆3的α链CDR1
SEQ ID NO:50表5中供体Y6W的克隆4的α链CDR1
SEQ ID NO:51表5中供体Y6W的克隆5的α链CDR1
SEQ ID NO:52表5中供体Y6W的克隆6的α链CDR1
SEQ ID NO:53表5中供体Y6W的克隆7的α链CDR1
SEQ ID NO:54表5中供体Y6W的克隆8的α链CDR1
SEQ ID NO:55表5中供体Y6W的克隆9的α链CDR1
SEQ ID NO:56表5中供体Y6W的克隆10的α链CDR1
SEQ ID NO:57表5中供体Y6W的克隆11的α链CDR1
SEQ ID NO:58表5中供体Y6W的克隆12的α链CDR1
SEQ ID NO:59表5中供体Y6W的克隆13的α链CDR1
SEQ ID NO:60表5中供体Y6W的克隆14的α链CDR1
SEQ ID NO:61表5中供体Y6W的克隆15的α链CDR1
SEQ ID NO:62表6中供体N2W的克隆1的α链CDR1
SEQ ID NO:63表6中供体N2W的克隆2的α链CDR1
SEQ ID NO:64表6中供体N2W的克隆3的α链CDR1
SEQ ID NO:65表6中供体N2W的克隆4的α链CDR1
SEQ ID NO:66表6中供体N2W的克隆5的α链CDR1
SEQ ID NO:67表6中供体N2W的克隆6的α链CDR1
SEQ ID NO:68表6中供体B87的克隆1的α链CDR1
SEQ ID NO:69表6中供体B87的克隆2的α链CDR1
SEQ ID NO:70表6中供体B87的克隆3的α链CDR1
SEQ ID NO:71表7中供体J9B的克隆1的α链CDR1
SEQ ID NO:72表7中供体J9B的克隆2的α链CDR1
SEQ ID NO:73表7中供体A5L的克隆1的α链CDR1
SEQ ID NO:74表7中供体A5L的克隆2的α链CDR1
SEQ ID NO:75表7中供体A5L的克隆3的α链CDR1
SEQ ID NO:76表7中供体A5L的克隆4的α链CDR1
SEQ ID NO:77表7中供体A5L的克隆5的α链CDR1
SEQ ID NO:78表7中供体A5L的克隆6的α链CDR1
SEQ ID NO:79表7中供体A5L的克隆7的α链CDR1
SEQ ID NO:80表7中供体A5L的克隆8的α链CDR1
SEQ ID NO:81表7中供体A5L的克隆9的α链CDR1
SEQ ID NO:82表7中供体T4W的克隆1的α链CDR1
SEQ ID NO:83表7中供体T4W的克隆2的α链CDR1
SEQ ID NO:84表7中供体T4W的克隆3的α链CDR1
SEQ ID NO:85表7中供体T4W的克隆4的α链CDR1
SEQ ID NO:86表7中供体T4W的克隆5的α链CDR1
SEQ ID NO:87表7中供体T4W的克隆6的α链CDR1
SEQ ID NO:88表2中供体N3M的克隆1的β链CDR1
SEQ ID NO:89表2中供体B24的克隆1的β链CDR1
SEQ ID NO:90表2中供体B24的克隆2的β链CDR1
SEQ ID NO:91表2中供体B24的克隆3的β链CDR1
SEQ ID NO:92表2中供体B24的克隆4的β链CDR1
SEQ ID NO:93表2中供体A5L的克隆1的β链CDR1
SEQ ID NO:94表2中供体A5L的克隆2的β链CDR1
SEQ ID NO:95表2中供体A5L的克隆3的β链CDR1
SEQ ID NO:96表2中供体A5L的克隆4的β链CDR1
SEQ ID NO:97表2中供体A5L的克隆5的β链CDR1
SEQ ID NO:98表2中供体B31的克隆1的β链CDR1
SEQ ID NO:99表2中供体B31的克隆2的β链CDR1
SEQ ID NO:100表3中供体R7Z的克隆1的β链CDR1
SEQ ID NO:101表3中供体R7Z的克隆2的β链CDR1
SEQ ID NO:102表3中供体R7Z的克隆3的β链CDR1
SEQ ID NO:103表3中供体R7Z的克隆4的β链CDR1
SEQ ID NO:104表3中供体R7Z的克隆5的β链CDR1
SEQ ID NO:105表3中供体B5F的克隆1的β链CDR1
SEQ ID NO:106表3中供体B5F的克隆2的β链CDR1
SEQ ID NO:107表3中供体T3V的克隆1的β链CDR1
SEQ ID NO:108表3中供体T3V的克隆2的β链CDR1
SEQ ID NO:109表3中供体T3V的克隆3的β链CDR1
SEQ ID NO:110表3中供体P6G的克隆1的β链CDR1
SEQ ID NO:111表3中供体P6G的克隆2的β链CDR1
SEQ ID NO:112表3中供体P6G的克隆3的β链CDR1
SEQ ID NO:113表3中供体A4T的克隆1的β链CDR1
SEQ ID NO:114表4中供体D2M的克隆1的β链CDR1
SEQ ID NO:115表4中供体D2M的克隆2的β链CDR1
SEQ ID NO:116表4中供体D2M的克隆3的β链CDR1
SEQ ID NO:117表4中供体B31的克隆1的β链CDR1
SEQ ID NO:118表4中供体B31的克隆2的β链CDR1
SEQ ID NO:119表4中供体B31的克隆3的β链CDR1
SEQ ID NO:120表4中供体B31的克隆4的β链CDR1
SEQ ID NO:121表4中供体B31的克隆5的β链CDR1
SEQ ID NO:122表4中供体B31的克隆6的β链CDR1
SEQ ID NO:123表4中供体Y6W的克隆1的β链CDR1
SEQ ID NO:124表4中供体Y6W的克隆2的β链CDR1
SEQ ID NO:125表4中供体Y6W的克隆3的β链CDR1
SEQ ID NO:126表5中供体B33的克隆1的β链CDR1
SEQ ID NO:127表5中供体B5F的克隆1的β链CDR1
SEQ ID NO:128表5中供体Y6W的克隆1的β链CDR1
SEQ ID NO:129表5中供体Y6W的克隆2的β链CDR1
SEQ ID NO:130表5中供体Y6W的克隆3的β链CDR1
SEQ ID NO:131表5中供体Y6W的克隆4的β链CDR1
SEQ ID NO:132表5中供体Y6W的克隆5的β链CDR1
SEQ ID NO:133表5中供体Y6W的克隆6的β链CDR1
SEQ ID NO:134表5中供体Y6W的克隆7的β链CDR1
SEQ ID NO:135表5中供体Y6W的克隆8的β链CDR1
SEQ ID NO:136表5中供体Y6W的克隆9的β链CDR1
SEQ ID NO:137表5中供体Y6W的克隆10的β链CDR1
SEQ ID NO:138表5中供体Y6W的克隆11的β链CDR1
SEQ ID NO:139表5中供体Y6W的克隆12的β链CDR1
SEQ ID NO:140表5中供体Y6W的克隆13的β链CDR1
SEQ ID NO:141表5中供体Y6W的克隆14的β链CDR1
SEQ ID NO:142表5中供体Y6W的克隆15的β链CDR1
SEQ ID NO:143表6中供体N2W的克隆1的β链CDR1
SEQ ID NO:144表6中供体N2W的克隆2的β链CDR1
SEQ ID NO:145表6中供体N2W的克隆3的β链CDR1
SEQ ID NO:146表6中供体N2W的克隆4的β链CDR1
SEQ ID NO:147表6中供体N2W的克隆5的β链CDR1
SEQ ID NO:148表6中供体N2W的克隆6的β链CDR1
SEQ ID NO:149表6中供体B87的克隆1的β链CDR1
SEQ ID NO:150表6中供体B87的克隆2的β链CDR1
SEQ ID NO:151表6中供体B87的克隆3的β链CDR1
SEQ ID NO:152表7中供体J9B的克隆1的β链CDR1
SEQ ID NO:153表7中供体J9B的克隆2的β链CDR1
SEQ ID NO:154表7中供体A5L的克隆1的β链CDR1
SEQ ID NO:155表7中供体A5L的克隆2的β链CDR1
SEQ ID NO:156表7中供体A5L的克隆3的β链CDR1
SEQ ID NO:157表7中供体A5L的克隆4的β链CDR1
SEQ ID NO:158表7中供体A5L的克隆5的β链CDR1
SEQ ID NO:159表7中供体A5L的克隆6的β链CDR1
SEQ ID NO:160表7中供体A5L的克隆7的β链CDR1
SEQ ID NO:161表7中供体A5L的克隆8的β链CDR1
SEQ ID NO:162表7中供体A5L的克隆9的β链CDR1
SEQ ID NO:163表7中供体T4W的克隆1的β链CDR1
SEQ ID NO:164表7中供体T4W的克隆2的β链CDR1
SEQ ID NO:165表7中供体T4W的克隆3的β链CDR1
SEQ ID NO:166表7中供体T4W的克隆4的β链CDR1
SEQ ID NO:167表7中供体T4W的克隆5的β链CDR1
SEQ ID NO:168表7中供体T4W的克隆6的β链CDR1
SEQ ID NO:169表2中供体N3M的克隆1的α链CDR2
SEQ ID NO:170表2中供体B24的克隆1的α链CDR2
SEQ ID NO:171表2中供体B24的克隆2的α链CDR2
SEQ ID NO:172表2中供体B24的克隆3的α链CDR2
SEQ ID NO:173表2中供体B24的克隆4的α链CDR2
SEQ ID NO:174表2中供体A5L的克隆1的α链CDR2
SEQ ID NO:175表2中供体A5L的克隆2的α链CDR2
SEQ ID NO:176表2中供体A5L的克隆3的α链CDR2
SEQ ID NO:177表2中供体A5L的克隆4的α链CDR2
SEQ ID NO:178表2中供体A5L的克隆5的α链CDR2
SEQ ID NO:179表2中供体B31的克隆1的α链CDR2
SEQ ID NO:180表2中供体B31的克隆2的α链CDR2
SEQ ID NO:181表3中供体R7Z的克隆1的α链CDR2
SEQ ID NO:182表3中供体R7Z的克隆2的α链CDR2
SEQ ID NO:183表3中供体R7Z的克隆3的α链CDR2
SEQ ID NO:184表3中供体R7Z的克隆4的α链CDR2
SEQ ID NO:185表3中供体R7Z的克隆5的α链CDR2
SEQ ID NO:186表3中供体B5F的克隆1的α链CDR2
SEQ ID NO:187表3中供体B5F的克隆2的α链CDR2
SEQ ID NO:188表3中供体T3V的克隆1的α链CDR2
SEQ ID NO:189表3中供体T3V的克隆2的α链CDR2
SEQ ID NO:190表3中供体T3V的克隆3的α链CDR2
SEQ ID NO:191表3中供体P6G的克隆1的α链CDR2
SEQ ID NO:192表3中供体P6G的克隆2的α链CDR2
SEQ ID NO:193表3中供体P6G的克隆3的α链CDR2
SEQ ID NO:194表3中供体A4T的克隆1的α链CDR2
SEQ ID NO:195表4中供体D2M的克隆1的α链CDR2
SEQ ID NO:196表4中供体D2M的克隆2的α链CDR2
SEQ ID NO:197表4中供体D2M的克隆3的α链CDR2
SEQ ID NO:198表4中供体B31的克隆1的α链CDR2
SEQ ID NO:199表4中供体B31的克隆2的α链CDR2
SEQ ID NO:200表4中供体B31的克隆3的α链CDR2
SEQ ID NO:201表4中供体B31的克隆4的α链CDR2
SEQ ID NO:202表4中供体B31的克隆5的α链CDR2
SEQ ID NO:203表4中供体B31的克隆6的α链CDR2
SEQ ID NO:204表4中供体Y6W的克隆1的α链CDR2
SEQ ID NO:205表4中供体Y6W的克隆2的α链CDR2
SEQ ID NO:206表4中供体Y6W的克隆3的α链CDR2
SEQ ID NO:207表5中供体B33的克隆1的α链CDR2
SEQ ID NO:208表5中供体B5F的克隆1的α链CDR2
SEQ ID NO:209表5中供体Y6W的克隆1的α链CDR2
SEQ ID NO:210表5中供体Y6W的克隆2的α链CDR2
SEQ ID NO:211表5中供体Y6W的克隆3的α链CDR2
SEQ ID NO:212表5中供体Y6W的克隆4的α链CDR2
SEQ ID NO:213表5中供体Y6W的克隆5的α链CDR2
SEQ ID NO:214表5中供体Y6W的克隆6的α链CDR2
SEQ ID NO:215表5中供体Y6W的克隆7的α链CDR2
SEQ ID NO:216表5中供体Y6W的克隆8的α链CDR2
SEQ ID NO:217表5中供体Y6W的克隆9的α链CDR2
SEQ ID NO:218表5中供体Y6W的克隆10的α链CDR2
SEQ ID NO:219表5中供体Y6W的克隆11的α链CDR2
SEQ ID NO:220表5中供体Y6W的克隆12的α链CDR2
SEQ ID NO:221表5中供体Y6W的克隆13的α链CDR2
SEQ ID NO:222表5中供体Y6W的克隆14的α链CDR2
SEQ ID NO:223表5中供体Y6W的克隆15的α链CDR2
SEQ ID NO:224表6中供体N2W的克隆1的α链CDR2
SEQ ID NO:225表6中供体N2W的克隆2的α链CDR2
SEQ ID NO:226表6中供体N2W的克隆3的α链CDR2
SEQ ID NO:227表6中供体N2W的克隆4的α链CDR2
SEQ ID NO:228表6中供体N2W的克隆5的α链CDR2
SEQ ID NO:229表6中供体N2W的克隆6的α链CDR2
SEQ ID NO:230表6中供体B87的克隆1的α链CDR2
SEQ ID NO:231表6中供体B87的克隆2的α链CDR2
SEQ ID NO:232表6中供体B87的克隆3的α链CDR2
SEQ ID NO:233表7中供体J9B的克隆1的α链CDR2
SEQ ID NO:234表7中供体J9B的克隆2的α链CDR2
SEQ ID NO:235表7中供体A5L的克隆1的α链CDR2
SEQ ID NO:236表7中供体A5L的克隆2的α链CDR2
SEQ ID NO:237表7中供体A5L的克隆3的α链CDR2
SEQ ID NO:238表7中供体A5L的克隆4的α链CDR2
SEQ ID NO:239表7中供体A5L的克隆5的α链CDR2
SEQ ID NO:240表7中供体A5L的克隆6的α链CDR2
SEQ ID NO:241表7中供体A5L的克隆7的α链CDR2
SEQ ID NO:242表7中供体A5L的克隆8的α链CDR2
SEQ ID NO:243表7中供体A5L的克隆9的α链CDR2
SEQ ID NO:244表7中供体T4W的克隆1的α链CDR2
SEQ ID NO:245表7中供体T4W的克隆2的α链CDR2
SEQ ID NO:246表7中供体T4W的克隆3的α链CDR2
SEQ ID NO:247表7中供体T4W的克隆4的α链CDR2
SEQ ID NO:248表7中供体T4W的克隆5的α链CDR2
SEQ ID NO:249表7中供体T4W的克隆6的α链CDR2
SEQ ID NO:250表2中供体N3M的克隆1的β链CDR2
SEQ ID NO:251表2中供体B24的克隆1的β链CDR2
SEQ ID NO:252表2中供体B24的克隆2的β链CDR2
SEQ ID NO:253表2中供体B24的克隆3的β链CDR2
SEQ ID NO:254表2中供体B24的克隆4的β链CDR2
SEQ ID NO:255表2中供体A5L的克隆1的β链CDR2
SEQ ID NO:256表2中供体A5L的克隆2的β链CDR2
SEQ ID NO:257表2中供体A5L的克隆3的β链CDR2
SEQ ID NO:258表2中供体A5L的克隆4的β链CDR2
SEQ ID NO:259表2中供体A5L的克隆5的β链CDR2
SEQ ID NO:260表2中供体B31的克隆1的β链CDR2
SEQ ID NO:261表2中供体B31的克隆2的β链CDR2
SEQ ID NO:262表3中供体R7Z的克隆1的β链CDR2
SEQ ID NO:263表3中供体R7Z的克隆2的β链CDR2
SEQ ID NO:264表3中供体R7Z的克隆3的β链CDR2
SEQ ID NO:265表3中供体R7Z的克隆4的β链CDR2
SEQ ID NO:266表3中供体R7Z的克隆5的β链CDR2
SEQ ID NO:267表3中供体B5F的克隆1的β链CDR2
SEQ ID NO:268表3中供体B5F的克隆2的β链CDR2
SEQ ID NO:269表3中供体T3V的克隆1的β链CDR2
SEQ ID NO:270表3中供体T3V的克隆2的β链CDR2
SEQ ID NO:271表3中供体T3V的克隆3的β链CDR2
SEQ ID NO:272表3中供体P6G的克隆1的β链CDR2
SEQ ID NO:273表3中供体P6G的克隆2的β链CDR2
SEQ ID NO:274表3中供体P6G的克隆3的β链CDR2
SEQ ID NO:275表3中供体A4T的克隆1的β链CDR2
SEQ ID NO:276表4中供体D2M的克隆1的β链CDR2
SEQ ID NO:277表4中供体D2M的克隆2的β链CDR2
SEQ ID NO:278表4中供体D2M的克隆3的β链CDR2
SEQ ID NO:279表4中供体B31的克隆1的β链CDR2
SEQ ID NO:280表4中供体B31的克隆2的β链CDR2
SEQ ID NO:281表4中供体B31的克隆3的β链CDR2
SEQ ID NO:282表4中供体B31的克隆4的β链CDR2
SEQ ID NO:283表4中供体B31的克隆5的β链CDR2
SEQ ID NO:284表4中供体B31的克隆6的β链CDR2
SEQ ID NO:285表4中供体Y6W的克隆1的β链CDR2
SEQ ID NO:286表4中供体Y6W的克隆2的β链CDR2
SEQ ID NO:287表4中供体Y6W的克隆3的β链CDR2
SEQ ID NO:288表5中供体B33的克隆1的β链CDR2
SEQ ID NO:289表5中供体B5F的克隆1的β链CDR2
SEQ ID NO:290表5中供体Y6W的克隆1的β链CDR2
SEQ ID NO:291表5中供体Y6W的克隆2的β链CDR2
SEQ ID NO:292表5中供体Y6W的克隆3的β链CDR2
SEQ ID NO:293表5中供体Y6W的克隆4的β链CDR2
SEQ ID NO:294表5中供体Y6W的克隆5的β链CDR2
SEQ ID NO:295表5中供体Y6W的克隆6的β链CDR2
SEQ ID NO:296表5中供体Y6W的克隆7的β链CDR2
SEQ ID NO:297表5中供体Y6W的克隆8的β链CDR2
SEQ ID NO:298表5中供体Y6W的克隆9的β链CDR2
SEQ ID NO:299表5中供体Y6W的克隆10的β链CDR2
SEQ ID NO:300表5中供体Y6W的克隆11的β链CDR2
SEQ ID NO:301表5中供体Y6W的克隆12的β链CDR2
SEQ ID NO:302表5中供体Y6W的克隆13的β链CDR2
SEQ ID NO:303表5中供体Y6W的克隆14的β链CDR2
SEQ ID NO:304表5中供体Y6W的克隆15的β链CDR2
SEQ ID NO:305表6中供体N2W的克隆1的β链CDR2
SEQ ID NO:306表6中供体N2W的克隆2的β链CDR2
SEQ ID NO:307表6中供体N2W的克隆3的β链CDR2
SEQ ID NO:308表6中供体N2W的克隆4的β链CDR2
SEQ ID NO:309表6中供体N2W的克隆5的β链CDR2
SEQ ID NO:310表6中供体N2W的克隆6的β链CDR2
SEQ ID NO:311表6中供体B87的克隆1的β链CDR2
SEQ ID NO:312表6中供体B87的克隆2的β链CDR2
SEQ ID NO:313表6中供体B87的克隆3的β链CDR2
SEQ ID NO:314表7中供体J9B的克隆1的β链CDR2
SEQ ID NO:315表7中供体J9B的克隆2的β链CDR2
SEQ ID NO:316表7中供体A5L的克隆1的β链CDR2
SEQ ID NO:317表7中供体A5L的克隆2的β链CDR2
SEQ ID NO:318表7中供体A5L的克隆3的β链CDR2
SEQ ID NO:319表7中供体A5L的克隆4的β链CDR2
SEQ ID NO:320表7中供体A5L的克隆5的β链CDR2
SEQ ID NO:321表7中供体A5L的克隆6的β链CDR2
SEQ ID NO:322表7中供体A5L的克隆7的β链CDR2
SEQ ID NO:323表7中供体A5L的克隆8的β链CDR2
SEQ ID NO:324表7中供体A5L的克隆9的β链CDR2
SEQ ID NO:325表7中供体T4W的克隆1的β链CDR2
SEQ ID NO:326表7中供体T4W的克隆2的β链CDR2
SEQ ID NO:327表7中供体T4W的克隆3的β链CDR2
SEQ ID NO:328表7中供体T4W的克隆4的β链CDR2
SEQ ID NO:329表7中供体T4W的克隆5的β链CDR2
SEQ ID NO:330表7中供体T4W的克隆6的β链CDR2
SEQ ID NO:331表2中供体N3M的克隆1的α链CDR3
SEQ ID NO:332表2中供体B24的克隆1的α链CDR3
SEQ ID NO:333表2中供体B24的克隆2的α链CDR3
SEQ ID NO:334表2中供体B24的克隆3的α链CDR3
SEQ ID NO:335表2中供体B24的克隆4的α链CDR3
SEQ ID NO:336表2中供体A5L的克隆1的α链CDR3
SEQ ID NO:337表2中供体A5L的克隆2的α链CDR3
SEQ ID NO:338表2中供体A5L的克隆3的α链CDR3
SEQ ID NO:339表2中供体A5L的克隆4的α链CDR3
SEQ ID NO:340表2中供体A5L的克隆5的α链CDR3
SEQ ID NO:341表2中供体B31的克隆1的α链CDR3
SEQ ID NO:342表2中供体B31的克隆2的α链CDR3
SEQ ID NO:343表3中供体R7Z的克隆1的α链CDR3
SEQ ID NO:344表3中供体R7Z的克隆2的α链CDR3
SEQ ID NO:345表3中供体R7Z的克隆3的α链CDR3
SEQ ID NO:346表3中供体R7Z的克隆4的α链CDR3
SEQ ID NO:347表3中供体R7Z的克隆5的α链CDR3
SEQ ID NO:348表3中供体B5F的克隆1的α链CDR3
SEQ ID NO:349表3中供体B5F的克隆2的α链CDR3
SEQ ID NO:350表3中供体T3V的克隆1的α链CDR3
SEQ ID NO:351表3中供体T3V的克隆2的α链CDR3
SEQ ID NO:352表3中供体T3V的克隆3的α链CDR3
SEQ ID NO:353表3中供体P6G的克隆1的α链CDR3
SEQ ID NO:354表3中供体P6G的克隆2的α链CDR3
SEQ ID NO:355表3中供体P6G的克隆3的α链CDR3
SEQ ID NO:356表3中供体A4T的克隆1的α链CDR3
SEQ ID NO:357表4中供体D2M的克隆1的α链CDR3
SEQ ID NO:358表4中供体D2M的克隆2的α链CDR3
SEQ ID NO:359表4中供体D2M的克隆3的α链CDR3
SEQ ID NO:360表4中供体B31的克隆1的α链CDR3
SEQ ID NO:361表4中供体B31的克隆2的α链CDR3
SEQ ID NO:362表4中供体B31的克隆3的α链CDR3
SEQ ID NO:363表4中供体B31的克隆4的α链CDR3
SEQ ID NO:364表4中供体B31的克隆5的α链CDR3
SEQ ID NO:365表4中供体B31的克隆6的α链CDR3
SEQ ID NO:366表4中供体Y6W的克隆1的α链CDR3
SEQ ID NO:367表4中供体Y6W的克隆2的α链CDR3
SEQ ID NO:368表4中供体Y6W的克隆3的α链CDR3
SEQ ID NO:369表5中供体B33的克隆1的α链CDR3
SEQ ID NO:370表5中供体B5F的克隆1的α链CDR3
SEQ ID NO:371表5中供体Y6W的克隆1的α链CDR3
SEQ ID NO:372表5中供体Y6W的克隆2的α链CDR3
SEQ ID NO:373表5中供体Y6W的克隆3的α链CDR3
SEQ ID NO:374表5中供体Y6W的克隆4的α链CDR3
SEQ ID NO:375表5中供体Y6W的克隆5的α链CDR3
SEQ ID NO:376表5中供体Y6W的克隆6的α链CDR3
SEQ ID NO:377表5中供体Y6W的克隆7的α链CDR3
SEQ ID NO:378表5中供体Y6W的克隆8的α链CDR3
SEQ ID NO:379表5中供体Y6W的克隆9的α链CDR3
SEQ ID NO:380表5中供体Y6W的克隆10的α链CDR3
SEQ ID NO:381表5中供体Y6W的克隆11的α链CDR3
SEQ ID NO:382表5中供体Y6W的克隆12的α链CDR3
SEQ ID NO:383表5中供体Y6W的克隆13的α链CDR3
SEQ ID NO:384表5中供体Y6W的克隆14的α链CDR3
SEQ ID NO:385表5中供体Y6W的克隆15的α链CDR3
SEQ ID NO:386表6中供体N2W的克隆1的α链CDR3
SEQ ID NO:387表6中供体N2W的克隆2的α链CDR3
SEQ ID NO:388表6中供体N2W的克隆3的α链CDR3
SEQ ID NO:389表6中供体N2W的克隆4的α链CDR3
SEQ ID NO390表6中供体N2W的克隆5的α链CDR3
SEQ ID NO:391表6中供体N2W的克隆6的α链CDR3
SEQ ID NO:392表6中供体B87的克隆1的α链CDR3
SEQ ID NO:393表6中供体B87的克隆2的α链CDR3
SEQ ID NO:394表6中供体B87的克隆3的α链CDR3
SEQ ID NO:395表7中供体J9B的克隆1的α链CDR3
SEQ ID NO:396表7中供体J9B的克隆2的α链CDR3
SEQ ID NO:397表7中供体A5L的克隆1的α链CDR3
SEQ ID NO:398表7中供体A5L的克隆2的α链CDR3
SEQ ID NO:399表7中供体A5L的克隆3的α链CDR3
SEQ ID NO:400表7中供体A5L的克隆4的α链CDR3
SEQ ID NO:401表7中供体A5L的克隆5的α链CDR3
SEQ ID NO:402表7中供体A5L的克隆6的α链CDR3
SEQ ID NO:403表7中供体A5L的克隆7的α链CDR3
SEQ ID NO:404表7中供体A5L的克隆8的α链CDR3
SEQ ID NO:405表7中供体A5L的克隆9的α链CDR3
SEQ ID NO:406表7中供体T4W的克隆1的α链CDR3
SEQ ID NO:407表7中供体T4W的克隆2的α链CDR3
SEQ ID NO:408表7中供体T4W的克隆3的α链CDR3
SEQ ID NO:409表7中供体T4W的克隆4的α链CDR3
SEQ ID NO:410表7中供体T4W的克隆5的α链CDR3
SEQ ID NO:411表7中供体T4W的克隆6的α链CDR3
SEQ ID NO:412表2中供体N3M的克隆1的β链CDR3
SEQ ID NO:413表2中供体B24的克隆1的β链CDR3
SEQ ID NO:414表2中供体B24的克隆2的β链CDR3
SEQ ID NO:415表2中供体B24的克隆3的β链CDR3
SEQ ID NO:416表2中供体B24的克隆4的β链CDR3
SEQ ID NO:417表2中供体A5L的克隆1的β链CDR3
SEQ ID NO:418表2中供体A5L的克隆2的β链CDR3
SEQ ID NO:419表2中供体A5L的克隆3的β链CDR3
SEQ ID NO:420表2中供体A5L的克隆4的β链CDR3
SEQ ID NO:421表2中供体A5L的克隆5的β链CDR3
SEQ ID NO:422表2中供体B31的克隆1的β链CDR3
SEQ ID NO:423表2中供体B31的克隆2的β链CDR3
SEQ ID NO:424表3中供体R7Z的克隆1的β链CDR3
SEQ ID NO:425表3中供体R7Z的克隆2的β链CDR3
SEQ ID NO:426表3中供体R7Z的克隆3的β链CDR3
SEQ ID NO:427表3中供体R7Z的克隆4的β链CDR3
SEQ ID NO:428表3中供体R7Z的克隆5的β链CDR3
SEQ ID NO:429表3中供体B5F的克隆1的β链CDR3
SEQ ID NO:430表3中供体B5F的克隆2的β链CDR3
SEQ ID NO:431表3中供体T3V的克隆1的β链CDR3
SEQ ID NO:432表3中供体T3V的克隆2的β链CDR3
SEQ ID NO:433表3中供体T3V的克隆3的β链CDR3
SEQ ID NO:434表3中供体P6G的克隆1的β链CDR3
SEQ ID NO:435表3中供体P6G的克隆2的β链CDR3
SEQ ID NO:436表3中供体P6G的克隆3的β链CDR3
SEQ ID NO:437表3中供体A4T的克隆1的β链CDR3
SEQ ID NO:438表4中供体D2M的克隆1的β链CDR3
SEQ ID NO:439表4中供体D2M的克隆2的β链CDR3
SEQ ID NO:440表4中供体D2M的克隆3的β链CDR3
SEQ ID NO:441表4中供体B31的克隆1的β链CDR3
SEQ ID NO:442表4中供体B31的克隆2的β链CDR3
SEQ ID NO:443表4中供体B31的克隆3的β链CDR3
SEQ ID NO:444表4中供体B31的克隆4的β链CDR3
SEQ ID NO:445表4中供体B31的克隆5的β链CDR3
SEQ ID NO:446表4中供体B31的克隆6的β链CDR3
SEQ ID NO:447表4中供体Y6W的克隆1的β链CDR3
SEQ ID NO:448表4中供体Y6W的克隆2的β链CDR3
SEQ ID NO:449表4中供体Y6W的克隆3的β链CDR3
SEQ ID NO:450表5中供体B33的克隆1的β链CDR3
SEQ ID NO:451表5中供体B5F的克隆1的β链CDR3
SEQ ID NO:452表5中供体Y6W的克隆1的β链CDR3
SEQ ID NO:453表5中供体Y6W的克隆2的β链CDR3
SEQ ID NO:454表5中供体Y6W的克隆3的β链CDR3
SEQ ID NO:455表5中供体Y6W的克隆4的β链CDR3
SEQ ID NO:456表5中供体Y6W的克隆5的β链CDR3
SEQ ID NO:457表5中供体Y6W的克隆6的β链CDR3
SEQ ID NO:458表5中供体Y6W的克隆7的β链CDR3
SEQ ID NO:459表5中供体Y6W的克隆8的β链CDR3
SEQ ID NO:460表5中供体Y6W的克隆9的β链CDR3
SEQ ID NO:461表5中供体Y6W的克隆10的β链CDR3
SEQ ID NO:462表5中供体Y6W的克隆11的β链CDR3
SEQ ID NO:463表5中供体Y6W的克隆12的β链CDR3
SEQ ID NO:464表5中供体Y6W的克隆13的β链CDR3
SEQ ID NO:465表5中供体Y6W的克隆14的β链CDR3
SEQ ID NO:466表5中供体Y6W的克隆15的β链CDR3
SEQ ID NO:467表6中供体N2W的克隆1的β链CDR3
SEQ ID NO:468表6中供体N2W的克隆2的β链CDR3
SEQ ID NO:469表6中供体N2W的克隆3的β链CDR3
SEQ ID NO:470表6中供体N2W的克隆4的β链CDR3
SEQ ID NO:471表6中供体N2W的克隆5的β链CDR3
SEQ ID NO:472表6中供体N2W的克隆6的β链CDR3
SEQ ID NO:473表6中供体B87的克隆1的β链CDR3
SEQ ID NO:474表6中供体B87的克隆2的β链CDR3
SEQ ID NO:475表6中供体B87的克隆3的β链CDR3
SEQ ID NO:476表7中供体J9B的克隆1的β链CDR3
SEQ ID NO:477表7中供体J9B的克隆2的β链CDR3
SEQ ID NO:478表7中供体A5L的克隆1的β链CDR3
SEQ ID NO:479表7中供体A5L的克隆2的β链CDR3
SEQ ID NO:480表7中供体A5L的克隆3的β链CDR3
SEQ ID NO:481表7中供体A5L的克隆4的β链CDR3
SEQ ID NO:482表7中供体A5L的克隆5的β链CDR3
SEQ ID NO:483表7中供体A5L的克隆6的β链CDR3
SEQ ID NO:484表7中供体A5L的克隆7的β链CDR3
SEQ ID NO:485表7中供体A5L的克隆8的β链CDR3
SEQ ID NO:486表7中供体A5L的克隆9的β链CDR3
SEQ ID NO:487表7中供体T4W的克隆1的β链CDR3
SEQ ID NO:488表7中供体T4W的克隆2的β链CDR3
SEQ ID NO:489表7中供体T4W的克隆3的β链CDR3
SEQ ID NO:490表7中供体T4W的克隆4的β链CDR3
SEQ ID NO:491表7中供体T4W的克隆5的β链CDR3
SEQ ID NO:492表7中供体T4W的克隆6的β链CDR3
SEQ ID NO:493图13中供体N3M的克隆1的α链核苷酸序列
SEQ ID NO:494图14中供体B24的克隆1的α链核苷酸序列
SEQ ID NO:495图15中供体B24的克隆2的α链核苷酸序列
SEQ ID NO:496图16中供体B24的克隆3的α链核苷酸序列
SEQ ID NO:497图17中供体B24的克隆4的α链核苷酸序列
SEQ ID NO:498图18中供体A5L的克隆1的α链核苷酸序列
SEQ ID NO:499图19中供体A5L的克隆2的α链核苷酸序列
SEQ ID NO:500图20中供体A5L的克隆3的α链核苷酸序列
SEQ ID NO:501图21中供体A5L的克隆4的α链核苷酸序列
SEQ ID NO:502图22中供体A5L的克隆5的α链核苷酸序列
SEQ ID NO:503图23中供体B31的克隆1的α链核苷酸序列
SEQ ID NO:504图24中供体B31的克隆2的α链核苷酸序列
SEQ ID NO:505图25中供体R7Z的克隆1的α链核苷酸序列
SEQ ID NO:506图26中供体R7Z的克隆2的α链核苷酸序列
SEQ ID NO:507图27中供体R7Z的克隆3的α链核苷酸序列
SEQ ID NO:508图28中供体R7Z的克隆4的α链核苷酸序列
SEQ ID NO:509图29中供体R7Z的克隆5的α链核苷酸序列
SEQ ID NO:510图30中供体B5F的克隆1的α链核苷酸序列
SEQ ID NO:511图31中供体B5F的克隆2的α链核苷酸序列
SEQ ID NO:512图32中供体T3V的克隆1的α链核苷酸序列
SEQ ID NO:513图33中供体T3V的克隆2的α链核苷酸序列
SEQ ID NO:514图34中供体T3V的克隆3的α链核苷酸序列
SEQ ID NO:515图35中供体P6G的克隆1的α链核苷酸序列
SEQ ID NO:516图36中供体P6G的克隆2的α链核苷酸序列
SEQ ID NO:517图37中供体P6G的克隆3的α链核苷酸序列
SEQ ID NO:518图38中供体A4T的克隆1的α链核苷酸序列
SEQ ID NO:519图39中供体D2M的克隆1的α链核苷酸序列
SEQ ID NO:520图40中供体D2M的克隆2的α链核苷酸序列
SEQ ID NO:521图41中供体D2M的克隆3的α链核苷酸序列
SEQ ID NO:522图42中供体B31的克隆1的α链核苷酸序列
SEQ ID NO:523图43中供体B31的克隆2的α链核苷酸序列
SEQ ID NO:524图44中供体B31的克隆3的α链核苷酸序列
SEQ ID NO:525图45中供体B31的克隆4的α链核苷酸序列
SEQ ID NO:526图46中供体B31的克隆5的α链核苷酸序列
SEQ ID NO:527图47供体B31中的克隆6的α链核苷酸序列
SEQ ID NO:528图48中供体Y6W的克隆1的α链核苷酸序列
SEQ ID NO:529图49中供体Y6W的克隆2的α链核苷酸序列
SEQ ID NO:530图50中供体Y6W的克隆3的α链核苷酸序列
SEQ ID NO:531图51中供体B33的克隆1的α链核苷酸序列
SEQ ID NO:532图52中供体B5F的克隆1的α链核苷酸序列
SEQ ID NO:533图53中供体Y6W的克隆1的α链核苷酸序列
SEQ ID NO:534图54中供体Y6W的克隆2的α链核苷酸序列
SEQ ID NO:535图55中供体Y6W的克隆3的α链核苷酸序列
SEQ ID NO:536图56中供体Y6W的克隆4的α链核苷酸序列
SEQ ID NO:537图57中供体Y6W的克隆5的α链核苷酸序列
SEQ ID NO:538图58中供体Y6W的克隆6的α链核苷酸序列
SEQ ID NO:539图59中供体Y6W的克隆7的α链核苷酸序列
SEQ ID NO:540图60中供体Y6W的克隆8的α链核苷酸序列
SEQ ID NO:541图61中供体Y6W的克隆9的α链核苷酸序列
SEQ ID NO:542图62中供体Y6W的克隆10的α链核苷酸序列
SEQ ID NO:543图63中供体Y6W的克隆11的α链核苷酸序列
SEQ ID NO:544图64中供体Y6W的克隆12的α链核苷酸序列
SEQ ID NO:545图65中供体Y6W的克隆13的α链核苷酸序列
SEQ ID NO:546图66中供体Y6W的克隆14的α链核苷酸序列
SEQ ID NO:547图67中供体Y6W的克隆15的α链核苷酸序列
SEQ ID NO:548图68中供体N2W的克隆1的α链核苷酸序列
SEQ ID NO:549图69中供体N2W的克隆2的α链核苷酸序列
SEQ ID NO:550图70中供体N2W的克隆3的α链核苷酸序列
SEQ ID NO:551图71中供体N2W的克隆4的α链核苷酸序列
SEQ ID NO:552图72中供体N2W的克隆5的α链核苷酸序列
SEQ ID NO:553图73中供体N2W的克隆6的α链核苷酸序列
SEQ ID NO:554图74中供体B87的克隆1的α链核苷酸序列
SEQ ID NO:555图75中供体B87的克隆2的α链核苷酸序列
SEQ ID NO:556图76中供体B87的克隆3的α链核苷酸序列
SEQ ID NO:557图77中供体J9B的克隆1的α链核苷酸序列
SEQ ID NO:558图78中供体J9B的克隆2的α链核苷酸序列
SEQ ID NO:559图79中供体A5L的克隆1的α链核苷酸序列
SEQ ID NO:560图80中供体A5L的克隆2的α链核苷酸序列
SEQ ID NO:561图81中供体A5L的克隆3的α链核苷酸序列
SEQ ID NO:562图82中供体A5L的克隆4的α链核苷酸序列
SEQ ID NO:563图83中供体A5L的克隆5的α链核苷酸序列
SEQ ID NO:564图84中供体A5L的克隆6的α链核苷酸序列
SEQ ID NO:565图85中供体A5L的克隆7的α链核苷酸序列
SEQ ID NO:566图86中供体A5L的克隆8的α链核苷酸序列
SEQ ID NO:567图87中供体A5L的克隆9的α链核苷酸序列
SEQ ID NO:568图88中供体T4W的克隆1的α链核苷酸序列
SEQ ID NO:569图89中供体T4W的克隆2的α链核苷酸序列
SEQ ID NO:570图90中供体T4W的克隆3的α链核苷酸序列
SEQ ID NO:571图91供体T4W中的克隆4的α链核苷酸序列
SEQ ID NO:572图92中供体T4W的克隆5的α链核苷酸序列
SEQ ID NO:573图93中供体T4W的克隆6的α链核苷酸序列
SEQ ID NO:574图13中供体N3M的克隆1的β链核苷酸序列
SEQ ID NO:575图14中供体B24的克隆1的β链核苷酸序列
SEQ ID NO:576图15中供体B24的克隆2的β链核苷酸序列
SEQ ID NO:577图16中供体B24的克隆3的β链核苷酸序列
SEQ ID NO:578图17中供体B24的克隆4的β链核苷酸序列
SEQ ID NO:579图18中供体A5L的克隆1的β链核苷酸序列
SEQ ID NO:580图19中供体A5L的克隆2的β链核苷酸序列
SEQ ID NO:581图20中供体A5L的克隆3的β链核苷酸序列
SEQ ID NO:582图21中供体A5L的克隆4的β链核苷酸序列
SEQ ID NO:583图22中供体A5L的克隆5的β链核苷酸序列
SEQ ID NO:584图23中供体B31的克隆1的β链核苷酸序列
SEQ ID NO:585图24中供体B31的克隆2的β链核苷酸序列
SEQ ID NO:586图25中供体R7Z的克隆1的β链核苷酸序列
SEQ ID NO:587图26中供体R7Z的克隆2的β链核苷酸序列
SEQ ID NO:588图27中供体R7Z的克隆3的β链核苷酸序列
SEQ ID NO:589图28中供体R7Z的克隆4的β链核苷酸序列
SEQ ID NO:590图29中供体R7Z的克隆5的β链核苷酸序列
SEQ ID NO:591图30中供体B5F的克隆1的β链核苷酸序列
SEQ ID NO:592图31中供体B5F的克隆2的β链核苷酸序列
SEQ ID NO:593图32中供体T3V的克隆1的β链核苷酸序列
SEQ ID NO:594图33中供体T3V的克隆2的β链核苷酸序列
SEQ ID NO:595图34中供体T3V的克隆3的β链核苷酸序列
SEQ ID NO:596图35中供体P6G的克隆1的β链核苷酸序列
SEQ ID NO:597图36中供体P6G的克隆2的β链核苷酸序列
SEQ ID NO:598图37中供体P6G的克隆3的β链核苷酸序列
SEQ ID NO:599图38中供体A4T的克隆1的β链核苷酸序列
SEQ ID NO:600图39中供体D2M的克隆1的β链核苷酸序列
SEQ ID NO:601图40中供体D2M的克隆2的β链核苷酸序列
SEQ ID NO:602图41中供体D2M的克隆3的β链核苷酸序列
SEQ ID NO:603图42中供体B31的克隆1的β链核苷酸序列
SEQ ID NO:604图43中供体B31的克隆2的β链核苷酸序列
SEQ ID NO:605图44中供体B31的克隆3的β链核苷酸序列
SEQ ID NO:606图45中供体B31的克隆4的β链核苷酸序列
SEQ ID NO:607图46中供体B31的克隆5的β链核苷酸序列
SEQ ID NO:608图47中供体B31的克隆6的β链核苷酸序列
SEQ ID NO:609图48中供体Y6W的克隆1的β链核苷酸序列
SEQ ID NO:610图49中供体Y6W的克隆2的β链核苷酸序列
SEQ ID NO:611图50中供体Y6W的克隆3的β链核苷酸序列
SEQ ID NO:612图51中供体B33的克隆1的β链核苷酸序列
SEQ ID NO:613图52中供体B5F的克隆1的β链核苷酸序列
SEQ ID NO:614图53中供体Y6W的克隆1的β链核苷酸序列
SEQ ID NO:615图54中供体Y6W的克隆2的β链核苷酸序列
SEQ ID NO:616图55中供体Y6W的克隆3的β链核苷酸序列
SEQ ID NO:617图56中供体Y6W的克隆4的β链核苷酸序列
SEQ ID NO:618图57中供体Y6W的克隆5的β链核苷酸序列
SEQ ID NO:619图58中供体Y6W的克隆6的β链核苷酸序列
SEQ ID NO:620图59中供体Y6W的克隆7的β链核苷酸序列
SEQ ID NO:621图60中供体Y6W的克隆8的β链核苷酸序列
SEQ ID NO:622图61中供体Y6W的克隆9的β链核苷酸序列
SEQ ID NO:623图62中供体Y6W的克隆10的β链核苷酸序列
SEQ ID NO:624图63中供体Y6W的克隆11的β链核苷酸序列
SEQ ID NO:625图64中供体Y6W的克隆12的β链核苷酸序列
SEQ ID NO:626图65中供体Y6W的克隆13的β链核苷酸序列
SEQ ID NO:627图66中供体Y6W的克隆14的β链核苷酸序列
SEQ ID NO:628图67中供体Y6W的克隆15的β链核苷酸序列
SEQ ID NO:629图68中供体N2W的克隆1的β链核苷酸序列
SEQ ID NO:630图69中供体N2W的克隆2的β链核苷酸序列
SEQ ID NO:631图70中供体N2W的克隆3的β链核苷酸序列
SEQ ID NO:632图71中供体N2W的克隆4的β链核苷酸序列
SEQ ID NO:633图72中供体N2W的克隆5的β链核苷酸序列
SEQ ID NO:634图73中供体N2W的克隆6的β链核苷酸序列
SEQ ID NO:635图74中供体B87的克隆1的β链核苷酸序列
SEQ ID NO:636图75中供体B87的克隆2的β链核苷酸序列
SEQ ID NO:637图76中供体B87的克隆3的β链核苷酸序列
SEQ ID NO:638图77中供体J9B的克隆1的β链核苷酸序列
SEQ ID NO:639图78中供体J9B的克隆2的β链核苷酸序列
SEQ ID NO:640图79中供体A5L的克隆1的β链核苷酸序列
SEQ ID NO:641图80中供体A5L的克隆2的β链核苷酸序列
SEQ ID NO:642图81中供体A5L的克隆3的β链核苷酸序列
SEQ ID NO:643图82中供体A5L的克隆4的β链核苷酸序列
SEQ ID NO:644图83中供体A5L的克隆5的β链核苷酸序列
SEQ ID NO:645图84中供体A5L的克隆6的β链核苷酸序列
SEQ ID NO:646图85中供体A5L的克隆7的β链核苷酸序列
SEQ ID NO:647图86中供体A5L的克隆8的β链核苷酸序列
SEQ ID NO:648图87中供体A5L的克隆9的β链核苷酸序列
SEQ ID NO:649图88中供体T4W的克隆1的β链核苷酸序列
SEQ ID NO:650图89中供体T4W的克隆2的β链核苷酸序列
SEQ ID NO:651图90中供体T4W的克隆3的β链核苷酸序列
SEQ ID NO:652图91中供体T4W的克隆4的β链核苷酸序列
SEQ ID NO:653图92中供体T4W的克隆5的β链核苷酸序列
SEQ ID NO:654图93中供体T4W的克隆6的β链核苷酸序列
SEQ ID NO:655图94中供体N3M的克隆1的α链氨基酸序列
SEQ ID NO:656图94中供体B24的克隆1的α链氨基酸序列
SEQ ID NO:657图94中供体B24的克隆2的α链氨基酸序列
SEQ ID NO:658图94中供体B24的克隆3的α链氨基酸序列
SEQ ID NO:659图94中供体B24的克隆4的α链氨基酸序列
SEQ ID NO:660图94中供体A5L的克隆1的α链氨基酸序列
SEQ ID NO:661图94中供体A5L的克隆2的α链氨基酸序列
SEQ ID NO:662图94中供体A5L的克隆3的α链氨基酸序列
SEQ ID NO:663图94中供体A5L的克隆4的α链氨基酸序列
SEQ ID NO:664图94中供体A5L的克隆5的α链氨基酸序列
SEQ ID NO:665图94中供体B31的克隆1的α链氨基酸序列
SEQ ID NO:666图95中供体B31的克隆2的α链氨基酸序列
SEQ ID NO:667图95中供体R7Z的克隆1的α链氨基酸序列
SEQ ID NO:668图95中供体R7Z的克隆2的α链氨基酸序列
SEQ ID NO:669图95中供体R7Z的克隆3的α链氨基酸序列
SEQ ID NO:670图95中供体R7Z的克隆4的α链氨基酸序列
SEQ ID NO:671图95中供体R7Z的克隆5的α链氨基酸序列
SEQ ID NO:672图95中供体B5F的克隆1的α链氨基酸序列
SEQ ID NO:673图95中供体B5F的克隆2的α链氨基酸序列
SEQ ID NO:674图95中供体T3V的克隆1的α链氨基酸序列
SEQ ID NO:675图95中供体T3V的克隆2的α链氨基酸序列
SEQ ID NO:676图95中供体T3V的克隆3的α链氨基酸序列
SEQ ID NO:677图95中供体P6G的克隆1的α链氨基酸序列
SEQ ID NO:678图95中供体P6G的克隆2的α链氨基酸序列
SEQ ID NO:679图95中供体P6G的克隆3的α链氨基酸序列
SEQ ID NO:680图95中供体A4T的克隆1的α链氨基酸序列
SEQ ID NO:681图96中供体D2M的克隆1的α链氨基酸序列
SEQ ID NO:682图96中供体D2M的克隆2的α链氨基酸序列
SEQ ID NO:683图96中供体D2M的克隆3的α链氨基酸序列
SEQ ID NO:684图96中供体B31的克隆1的α链氨基酸序列
SEQ ID NO:685图96中供体B31的克隆2的α链氨基酸序列
SEQ ID NO:686图96中供体B31的克隆3的α链氨基酸序列
SEQ ID NO:687图96中供体B31的克隆4的α链氨基酸序列
SEQ ID NO:688图96中供体B31的克隆5的α链氨基酸序列
SEQ ID NO:689图96中供体B31的克隆6的α链氨基酸序列
SEQ ID NO:690图96中供体Y6W的克隆1的α链氨基酸序列
SEQ ID NO:691图96中供体Y6W的克隆2的α链氨基酸序列
SEQ ID NO:692图96中供体Y6W的克隆3的α链氨基酸序列
SEQ ID NO:693图97中供体B33的克隆1的α链氨基酸序列
SEQ ID NO:694图97中供体B5F的克隆1的α链氨基酸序列
SEQ ID NO:695图97中供体Y6W的克隆1的α链氨基酸序列
SEQ ID NO:696图97中供体Y6W的克隆2的α链氨基酸序列
SEQ ID NO:697图97中供体Y6W的克隆3的α链氨基酸序列
SEQ ID NO:698图97中供体Y6W的克隆4的α链氨基酸序列
SEQ ID NO:699图97中供体Y6W的克隆5的α链氨基酸序列
SEQ ID NO:700图97中供体Y6W的克隆6的α链氨基酸序列
SEQ ID NO:701图97中供体Y6W的克隆7的α链氨基酸序列
SEQ ID NO:702图97中供体Y6W的克隆8的α链氨基酸序列
SEQ ID NO:703图97中供体Y6W的克隆9的α链氨基酸序列
SEQ ID NO:704图97中供体Y6W的克隆10的α链氨基酸序列
SEQ ID NO:705图97中供体Y6W的克隆11的α链氨基酸序列
SEQ ID NO:706图97中供体Y6W的克隆12的α链氨基酸序列
SEQ ID NO:707图97中供体Y6W的克隆13的α链氨基酸序列
SEQ ID NO:708图97中供体Y6W的克隆14的α链氨基酸序列
SEQ ID NO:709图97中供体Y6W的克隆15的α链氨基酸序列
SEQ ID NO:710图98供体N2W中的克隆1的α链氨基酸序列
SEQ ID NO:711图98中供体N2W的克隆2的α链氨基酸序列
SEQ ID NO:712图98中供体N2W的克隆3的α链氨基酸序列
SEQ ID NO:713图98中供体N2W的克隆4的α链氨基酸序列
SEQ ID NO:714图98中供体N2W的克隆5的α链氨基酸序列
SEQ ID NO:715图98中供体N2W的克隆6的α链氨基酸序列
SEQ ID NO:716图98中供体B87的克隆1的α链氨基酸序列
SEQ ID NO:717图98中供体B87的克隆2的α链氨基酸序列
SEQ ID NO:718图98中供体B87的克隆3的α链氨基酸序列
SEQ ID NO:719图99中供体J9B的克隆1的α链氨基酸序列
SEQ ID NO:720图99中供体J9B的克隆2的α链氨基酸序列
SEQ ID NO:721图99中供体A5L的克隆1的α链氨基酸序列
SEQ ID NO:722图99中供体A5L的克隆2的α链氨基酸序列
SEQ ID NO:723图99供体A5L中的克隆3的α链氨基酸序列
SEQ ID NO:724图99中供体A5L的克隆4的α链氨基酸序列
SEQ ID NO:725图99中供体A5L的克隆5的α链氨基酸序列
SEQ ID NO:726图99中供体A5L的克隆6的α链氨基酸序列
SEQ ID NO:727图99中供体A5L的克隆7的α链氨基酸序列
SEQ ID NO:728图99中供体A5L的克隆8的α链氨基酸序列
SEQ ID NO:729图99中供体A5L的克隆9的α链氨基酸序列
SEQ ID NO:730图99中供体T4W的克隆1的α链氨基酸序列
SEQ ID NO:731图99中供体T4W的克隆2的α链氨基酸序列
SEQ ID NO:732图99中供体T4W的克隆3的α链氨基酸序列
SEQ ID NO:733图99中供体T4W的克隆4的α链氨基酸序列
SEQ ID NO:734图99中供体T4W的克隆5的α链氨基酸序列
SEQ ID NO:735图99中供体T4W的克隆6的α链氨基酸序列
SEQ ID NO:736图94中供体N3M的克隆1的β链氨基酸序列
SEQ ID NO:737图94中供体B24的克隆1的β链氨基酸序列
SEQ ID NO:738图94中供体B24的克隆2的β链氨基酸序列
SEQ ID NO:739图94中供体B24的克隆3的β链氨基酸序列
SEQ ID NO:740图94中供体B24的克隆4的β链氨基酸序列
SEQ ID NO:741图94中供体A5L的克隆1的β链氨基酸序列
SEQ ID NO:742图94中供体A5L的克隆2的β链氨基酸序列
SEQ ID NO:743图94中供体A5L的克隆3的β链氨基酸序列
SEQ ID NO:744图94中供体A5L的克隆4的β链氨基酸序列
SEQ ID NO:745图94中供体A5L的克隆5的β链氨基酸序列
SEQ ID NO:746图94中供体B31的克隆1的β链氨基酸序列
SEQ ID NO:747图94中供体B31的克隆2的β链氨基酸序列
SEQ ID NO:748图95中供体R7Z的克隆1的β链氨基酸序列
SEQ ID NO:749图95中供体R7Z的克隆2的β链氨基酸序列
SEQ ID NO:750图95中供体R7Z的克隆3的β链氨基酸序列
SEQ ID NO:751图95中供体R7Z的克隆4的β链氨基酸序列
SEQ ID NO:752图95中供体R7Z的克隆5的β链氨基酸序列
SEQ ID NO:753图95中供体B5F的克隆1的β链氨基酸序列
SEQ ID NO:754图95中供体B5F的克隆2的β链氨基酸序列
SEQ ID NO:755图95中供体T3V的克隆1的β链氨基酸序列
SEQ ID NO:756图95中供体T3V的克隆2的β链氨基酸序列
SEQ ID NO:757图95中供体T3V的克隆3的β链氨基酸序列
SEQ ID NO:758图95中供体P6G的克隆1的β链氨基酸序列
SEQ ID NO:759图95中供体P6G的克隆2的β链氨基酸序列
SEQ ID NO:760图95中供体P6G的克隆3的β链氨基酸序列
SEQ ID NO:761图95中供体A4T的克隆1的β链氨基酸序列
SEQ ID NO:762图96中供体D2M的克隆1的β链氨基酸序列
SEQ ID NO:763图96中供体D2M的克隆2的β链氨基酸序列
SEQ ID NO:764图96中供体D2M的克隆3的β链氨基酸序列
SEQ ID NO:765图96中供体B31的克隆1的β链氨基酸序列
SEQ ID NO:766图96中供体B31的克隆2的β链氨基酸序列
SEQ ID NO:767图96中供体B31的克隆3的β链氨基酸序列
SEQ ID NO:768图96中供体B31的克隆4的β链氨基酸序列
SEQ ID NO:769图96中供体B31的克隆5的β链氨基酸序列
SEQ ID NO:770图96中供体B31的克隆6的β链氨基酸序列
SEQ ID NO:771图96中供体Y6W的克隆1的β链氨基酸序列
SEQ ID NO:772图96中供体Y6W的克隆2的β链氨基酸序列
SEQ ID NO:773图96中供体Y6W的克隆3的β链氨基酸序列
SEQ ID NO:774图97中供体B33的克隆1的β链氨基酸序列
SEQ ID NO:775图97中供体B5F的克隆1的β链氨基酸序列
SEQ ID NO:776图97中供体Y6W的克隆1的β链氨基酸序列
SEQ ID NO:777图97中供体Y6W的克隆2的β链氨基酸序列
SEQ ID NO:778图97中供体Y6W的克隆3的β链氨基酸序列
SEQ ID NO:779图97中供体Y6W的克隆4的β链氨基酸序列
SEQ ID NO:780图97中供体Y6W的克隆5的β链氨基酸序列
SEQ ID NO:781图97中供体Y6W的克隆6的β链氨基酸序列
SEQ ID NO:782图97中供体Y6W的克隆7的β链氨基酸序列
SEQ ID NO:783图97中供体Y6W的克隆8的β链氨基酸序列
SEQ ID NO:784图97中供体Y6W的克隆9的β链氨基酸序列
SEQ ID NO:785图97中供体Y6W的克隆10的β链氨基酸序列
SEQ ID NO:786图97中供体Y6W的克隆11的β链氨基酸序列
SEQ ID NO:787图97中供体Y6W的克隆12的β链氨基酸序列
SEQ ID NO:788图97中供体Y6W的克隆13的β链氨基酸序列
SEQ ID NO:789图97中供体Y6W的克隆14的β链氨基酸序列
SEQ ID NO:790图97中供体Y6W的克隆15的β链氨基酸序列
SEQ ID NO:791图98中供体N2W的克隆1的β链氨基酸序列
SEQ ID NO:792图98中供体N2W的克隆2的β链氨基酸序列
SEQ ID NO:793图98中供体N2W的克隆3的β链氨基酸序列
SEQ ID NO:794图98中供体N2W的克隆4的β链氨基酸序列
SEQ ID NO:795图98中供体N2W的克隆5的β链氨基酸序列
SEQ ID NO:796图98中供体N2W的克隆6的β链氨基酸序列
SEQ ID NO:797图98中供体B87的克隆1的β链氨基酸序列
SEQ ID NO:798图98中供体B87的克隆2的β链氨基酸序列
SEQ ID NO:799图98中供体B87的克隆3的β链氨基酸序列
SEQ ID NO:800图99中供体J9B的克隆1的β链氨基酸序列
SEQ ID NO:801图99中供体J9B的克隆2的β链氨基酸序列
SEQ ID NO:802图99中供体A5L的克隆1的β链氨基酸序列
SEQ ID NO:803图99中供体A5L的克隆2的β链氨基酸序列
SEQ ID NO:804图99中供体A5L的克隆3的β链氨基酸序列
SEQ ID NO:805图99中供体A5L的克隆4的β链氨基酸序列
SEQ ID NO:806图99中供体A5L的克隆5的β链氨基酸序列
SEQ ID NO:807图99中供体A5L的克隆6的β链氨基酸序列
SEQ ID NO:808图99中供体A5L的克隆7的β链氨基酸序列
SEQ ID NO:809图99中供体A5L的克隆8的β链氨基酸序列
SEQ ID NO:810图99中供体A5L的克隆9的β链氨基酸序列
SEQ ID NO:811图99中供体T4W的克隆1的β链氨基酸序列
SEQ ID NO:812图99中供体T4W的克隆2的β链氨基酸序列
SEQ ID NO:813图99中供体T4W的克隆3的β链氨基酸序列
SEQ ID NO:814图99中供体T4W的克隆4的β链氨基酸序列
SEQ ID NO:815图99中供体T4W的克隆5的β链氨基酸序列
SEQ ID NO:816图99中供体T4W的克隆6的β链氨基酸序列
发明详述
本发明部分地源于TCR互补决定区(CDR)序列的鉴定,所述TCR互补决定区序列识别衍生自EBV抗原的并与几种常见的人白细胞抗原结合呈递的表位。这些TCR可能特别适合于产生基因工程改造的T细胞和将它们对人施用来预防和/或治疗EBV相关的疾病、病症或病状,例如EBV阳性的癌症。
在第一方面,本发明提供了T细胞受体(TCR)的分离的α链或其片段,包含根据任一SEQ ID NO:331-411和/或表2-7的至少一个互补决定区(CDR)氨基酸序列(例如,CDR3氨基酸序列) 或与其至少70%同一的氨基酸序列。
为了本发明的目的,术语“分离的”是指已经从其天然状态移出或以其他方式进行人为操作的材料,例如本文所述的α链、β链和TCR蛋白或肽。分离的材料可以基本上或实质上没有通常在其天然状态伴随其的组分,或者可以经操作而处于人造状态,其与通常在其天然状态伴随其的组分在一起。分离的材料可以是天然的、化学合成的或重组的形式。分离的材料也可以或备选地是富集的、部分纯化的或纯化的形式。
将理解的是,T细胞受体或TCR是在T细胞表面上发现的负责识别与MHC或HLA分子结合的抗原肽的分子。TCR异二聚体在95%的T细胞中通常包括α链和β链,而在5%的T 细胞通常具有由γ链和δ链组成的TCR。
关于α链和β链,这些链通常广泛地包含可变区、连接区和恒定区,并且β链在可变区和连接区之间通常也含有一个短的多样性区域,但是通常将该多样性区域视为连接区的一部分。每个可变区包含嵌入构架序列中的三个CDR(即,CDR1,CDR2和CDR3),其中一个是称为CDR3的高变区。本领域中已知通常有几种类型的α链可变区(Vα)和几种类型的β链可变区(Vβ),并且通过它们的构架序列、CDR1和CDR2序列以及通过部分定义的CDR3序列而相区分。
因此,本方面的α链蛋白或肽,包括其片段,可还包含根据任一SEQ ID NO:7-87和169-249和/或表2-7的一个或多个进一步的CDR氨基酸序列,例如CDR1和/或CDR2氨基酸序列:或与其至少70%同一的氨基酸序列。
在一些实施方案中,本方面的α链包含根据任一SEQ ID NO:655-735和/或图94至99 的氨基酸序列或与其至少70%同一的氨基酸序列、基本上由所述氨基酸序列组成或由所述氨基酸序列组成。
在具体实施方案中,分离的α链包含半胱氨酸残基,例如在其恒定区的位置48处。应当理解,这样的半胱氨酸取代可以与对应的TCRβ链上的相应半胱氨酸残基形成二硫桥或键 (即,连接子),例如以下所述,以帮助稳定自其衍生的TCR分子。
应当理解,本发明的TCRα链可以是杂合TCRα链,其包含衍生自多于一种物种的序列,例如衍生自人和小鼠的序列。举例来说,令人惊讶地发现,将人TCR恒定区用鼠对应物交换可以改善人T细胞的功能以及表达水平(参见,例如,Sommermeyer和Uckert,J Immunol,2010, 其通过引用并入本文作为参考)。因此,TCR可以包含人衍生的可变区和鼠衍生的恒定区。
因此,在具体的实施方案中,分离的α链在其恒定区的位置90、91、92和/或93处包含一个或多个氨基酸取代。在具体的实施方案中,分离的α链包含:
(a)在位置90的P至S取代;
(b)在位置91的E至D取代;
(c)在位置92的S至V取代;和/或
(d)在位置93的S至P取代。
在另一方面,本发明提供了TCR的分离的β链或其片段,包含根据任一SEQ ID NO:412-492和/或表2-7的至少一个CDR氨基酸序列或与其至少70%同一的氨基酸序列。
在一些实施方案中,分离的β链或其片段还包含根据任一SEQ ID NO:88-168和250-330 和/或表2-7的一个或多个进一步的CDR氨基酸序列(例如,CDR1和/或CDR2氨基酸序列) 或与其至少70%同一的氨基酸序列。
在具体的实施方案中,本方面的分离的β链包含根据任一SEQ ID NO:736-816和/或图94 至99的氨基酸序列或与其至少70%同一的氨基酸序列、基本上由所述氨基酸序列组成或由所述氨基酸序列组成。
在一个实施方案中,分离的β链包含半胱氨酸残基,例如在其恒定区的位置57处。又,将理解的是,这样的半胱氨酸取代可以与对应的TCRα链上的相应的半胱氨酸残基形成二硫桥或键(即,连接子)。
与上面的TCRα链相似地,本发明的TCRβ链也可以是杂合TCRβ链,其包含衍生自多于一种物种的序列,例如衍生自人和小鼠的序列。举例来说,分离的β链可在其恒定区的位置18、22、133、136和/或139处包含一个或多个氨基酸取代。在具体的实施方案中,分离的β链包含:
(a)在位置18的E至K取代;
(b)在位置22的S至A取代;
(c)在位置133的F至I取代;
(d)在位置136的V至A取代;和/或
(e)在位置139的Q至H取代。
在另一方面,本发明提供了分离的TCR或TCR片段,其用于结合衍生自EB病毒(EBV)的抗原,该TCR或TCR片段包含:
(i)根据所述第一方面的分离的α链或其片段;和/或
(ii)根据所述第二方面的分离的β链或其片段。
鉴于前述,术语“T细胞受体”在本文中以常规方式使用,是指能够识别由MHC或HLA分子呈递的肽的分子。该分子可以是两条链阿尔发(α)和贝塔(β)(或任选地伽玛(γ)和德尔塔(δ)) 的异二聚体,或者它可以是单链TCR构建体。
在具体的实施方案中,抗原至少部分衍生自EBV的潜伏膜蛋白1(LMP-1)蛋白和/或潜伏膜蛋白2(LMP-2)蛋白(包括其片段)。就这一点而言,衍生自LMP-1和/或LMP-2的一个或多个表位或抗原决定簇(即,显示抗原特异性)当由MHC或HLA分子呈递时,TCR或TCR片段可以选择性地结合之。因此,本发明的TCR可以识别EBV的LMP-1和/或LMP 2的全部或部分氨基酸序列(例如,SEQ ID NO:1-6)。
如本文所用,短语“抗原特异性”是指TCR(包括其功能部分和功能变体)可以以高亲合力特异性结合并免疫识别一种或多种EBV抗原,例如SEQ ID NO:1-6中的那些。
在某些实施方案中,本方面的T细胞受体的α链和β链可以通过连接子连接,例如本领域已知的那些连接子。举例来说,连接子可以通过二硫桥或键连接本发明的TCR的α和β链。
分离的α链、分离的β链和分离的TCR蛋白的具体实施方案包含SEQ ID NO:655-816所示的和图94至99所示的氨基酸序列、或与其至少70%同一的氨基酸序列。
在一些实施方案中,本方面的TCR是或包含可溶性TCR。应当理解,可将可溶性TCR缀合至免疫刺激性肽和/或蛋白质和/或部分,例如但不限于CD3激动剂(例如,抗CD3抗体)。该CD3抗原存在于成熟的人T细胞、胸腺细胞和自然杀伤细胞的亚类上。它可以与TCR相关联,以便于TCR的信号转导。特异于人CD3抗原的抗体是本领域众所周知的(参见,例如, PCT国际专利申请公开号WO 2004/106380;美国专利申请公开号2004/0202657;美国专利号 6,750,325;美国专利号6,706,265;英国专利公开GB 224931OA;Clark等人,1988;美国专利号5,968,509;美国专利申请公开号2009/0117102).
合适地,可溶性TCR可包括在一种或多种双特异性免疫治疗剂中,例如ImmTAC(针对癌症的免疫动员TCR)(Liddy等人(2012)Nat Med 18:980-987)或BiTEs(双特异性T细胞结合抗体)(Baeuerle等人(2009).Curr Opin Mol Ther 11(1):22-30)。ImmTAC代表双功能蛋白,该蛋白组合了亲和性单克隆T细胞受体(mTCR)靶向和治疗作用机制(例如抗CD3scFv)。
“蛋白质”是指氨基酸聚合物。氨基酸可以是天然的或非天然的氨基酸、D-或L-氨基酸,它们是本领域众所周知的。
术语“蛋白质”包括并涵盖“肽”(通常用于描述不超过五十(50)个氨基酸的蛋白质)和“多肽”(通常用于描述具有超过五十(50)个氨基酸的蛋白质)。
本发明还提供了本文所述的分离的α链和β链以及TCR蛋白的变体。
如本文所用,蛋白质“变体”与本文所公开的分离的蛋白质或片段共有可定义的核苷酸或氨基酸序列关系。优选地,蛋白质变体与本发明的氨基酸序列,例如任一SEQ ID NO:7-492、 655-816、表2-7和图94-99所示的氨基酸序列共有至少25%,30%,35%,40%,45%,50%或更优选地至少55%,60%或65%或甚至更优选地70%,71%,72%,73%,74%,75%,76%,77%,78%, 79%,80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%, 96%,97%,98%或99%序列同一性。
本文公开的“变体”蛋白质或片段具有缺失或被不同氨基酸取代的一个或多个氨基酸。在本领域中众所周知,一些氨基酸可以被取代或缺失,而不改变免疫原性片段和/或蛋白质的活性(保守取代)。例如,保守氨基酸取代可以是一个酸性氨基酸用另一个酸性氨基酸取代(例如 Asp或Glu),一个具有非极性侧链的氨基酸用具有非极性侧链的另一个氨基酸取代(例如,Ala, Gly,Val,Ile,Leu,Met,Phe,Pro,Trp,Val等),一个碱性氨基酸用另一个碱性氨基酸取代(Lys, Arg等),一个带有极性侧链的氨基酸用具有极性侧链的另一个氨基酸取代(Asn,Cys,Gln,Ser, Thr,Tyr等)等。优选地,当与亲本或野生型TCR、多肽或蛋白质相比时,任何氨基酸变化都应维持或改善本文所描述的变体例如功能变体结合MHC或HLA分子和/或由其呈递的抗原的能力。
术语“变体”还包括这样的本文公开的分离的蛋白质或其片段,其产生自天然存在的(例如等位基因)变体、直向同源物(例如,来自人以外的物种)和合成变体,例如,体外使用诱变技术产生的变体;或包含所述变体的氨基酸序列。
与相应的野生型蛋白质相比,变体可以保留相应的野生型蛋白质的生物学活性(所述变体例如等位基因变体、旁系同源物和直系同源物),或者可以缺乏或具有实质上降低的生物学活性。
本文中通常用于描述各蛋白质和核酸之间的序列关系的术语包括“比较窗口”、“序列同一性”、“序列同一性的百分数”和“基本同一性”。因为各核酸/蛋白质可各自包含(1)所述各核酸/蛋白质共有的全长核酸/蛋白质序列的仅一个或多个部分,和(2)所述核酸/蛋白质之间不同的一个或多个部分,通常通过在“比较窗口”上比较序列来鉴定和比较局部区域的序列相似性。“比较窗口”是指与参考序列比较的通常6、9或12个连续残基的概念区段。与参考序列相比,比较窗口可包含约20%或更少的添加或缺失(即,缺口),以使各序列最佳比对。可以通过计算机化的算法实施(Intelligenetics的Geneworks程序;Wisconsin Genetics Software Package Release 7.0中的GAP、BESTFIT、FASTA和TFASTA,Genetics Computer Group,575 Science Drive Madison,WI,USA,并入本文作为参考)或通过检查以及通过所选的任何各种方法产生的最佳比对(即,在比较窗口上产生最高的百分比同源性)来实施比对比较窗口的序列最佳比对。还可以参考BLAST程序系列,例如由Altschul等人,1997,Nucl.Acids Res.25 3389公开的BLAST程序,其通过引用并入本文作为参考。序列分析的详细讨论可以在Ausubel 等人编辑的CURRENT PROTOCOLS INMOLECULAR BIOLOGY(John Wiley&Sons Inc NY, 1995-1999)单元19.3中找到。
术语“序列同一性”在本文中以其最广泛的含义使用,包括考虑到使用标准算法的适当比对、考虑到在比较窗口上序列同一的程度的确切核苷酸或氨基酸匹配的数目。因此,通过在比较窗口上比较两个最佳比对的序列,确定相同核酸碱基(例如,A,T,C,G,I)在两条序列中存在的匹配位置的数目,除以比较窗口中的位置总数(即窗口大小),然后将结果乘以100 即可得出序列同一性的百分数,由此来计算“序列同一性的百分数”。例如,“序列同一性”可以理解为是指由DNASIS计算机程序(用于Windows的版本2.5;可从HitachiSoftware engineering Co.,Ltd.,South San Francisco,California,USA获得)计算的“匹配百分数”。
还提供了本文所述的α链、β链和TCR蛋白的衍生物。
如本文所用,“衍生物”蛋白已被改变,例如通过与其他化学部分缀合或复合,通过翻译后修饰(例如磷酸化,乙酰化等),糖基化修饰(例如添加、去除或改变糖基化)和/或包括额外的氨基酸序列而改变,这是本领域所理解的。
额外的氨基酸序列可以包括产生融合蛋白的融合配偶体氨基酸序列。举例来说,融合配偶体氨基酸序列可以帮助检测和/或纯化分离的融合蛋白。非限制性实例包括金属结合(例如聚组氨酸)融合配偶体、麦芽糖结合蛋白(MBP)、蛋白A、谷胱甘肽S转移酶(GST)、荧光蛋白序列(例如GFP)、表位标签例如myc、FLAG和血凝素标签。
本发明考虑的其他衍生物包括但不限于在肽或蛋白质合成、以及使用交联剂和其他对本发明的免疫原性蛋白质、片段和变体施加构象限制的方法过程中对侧链的修饰、掺入非天然氨基酸和/或它们的衍生物。
在这个方面,技术人员可参考CURRENT PROTOCOLS IN PROTEIN SCIENCE,Coligan等人编著(John Wiley&Sons NY 1995-2008)第15章,以获得与蛋白质的化学修饰有关的更广泛的方法。
本发明的分离的蛋白质、变体、片段和/或衍生物可以通过本领域已知的任何方式产生,包括但不限于化学合成、重组DNA技术和蛋白水解切割以产生肽片段。
化学合成包括固相和液相合成。此类方法在本领域中是众所周知的,但也可参考SYNTHETIC VACCINES,Nicholson编著(Blackwell Scientific Publications)的第9章和CURRENT PROTOCOLS IN PROTEIN SCIENCE,Coligan等人编著(John Wiley&Sons,Inc. NYUSA 1995-2008)的第15章中提供的化学合成技术的例子。在这个方面,还参考国际公开 WO99/02550和国际公开WO 97/45444。
在一个优选的实施方案中,本发明的分离的α链、分离的β链和/或分离的TCR蛋白是重组蛋白。
重组蛋白可以由本领域技术人员使用例如在Sambrook等人,MOLECULARCLONING.A Laboratory Manual(Cold Spring Harbor Press,1989)中、特别是第16和17章;CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,Ausubel等人编著(John Wiley&Sons,Inc.NY USA 1995-2008)、特别是第10和16章;和CURRENT PROTOCOLS IN PROTEINSCIENCE, Coligan等人编著(John Wiley&Sons,Inc.NY USA 1995-2008)、特别是第第1、5和6章中描述的标准方案方便地制备。
在一些方面,本发明提供了本发明的分离的α链、分离的β链和TCR蛋白的片段。
“片段”是蛋白质的区段、结构域、部分或区域,其构成蛋白质的小于100%的氨基酸序列。
通常,片段可以包含多至5,10,20,30,40,50,60,70,80,90,100,110,120,130,140,150, 200,250,300,350,400,450,550或多至约600个氨基酸的氨基酸序列。
本发明的片段可以通过上文所述的那些方法产生。备选地,可以例如通过用蛋白酶如 endoLys-C,endoArg-C,endoGlu-C和V8-蛋白酶消化α链、β链或TCR蛋白来产生片段。可以通过本领域众所周知的色谱技术纯化消化的片段。
本发明的具体实施方案提供了本发明的分离的α链、分离的β链和/或TCR的免疫原性片段。“免疫原性”是指在施用给动物例如人、小鼠或兔时能够引起免疫应答。免疫应答可以包括免疫系统的先天和/或适应性臂的产生、激活或刺激,所述免疫系统包括诸如B和/或T淋巴细胞、NK细胞、粒细胞、巨噬细胞和树突细胞的免疫细胞和/或分子如抗体、细胞因子和趋化因子,但不限于此。
因此,如下文所述,这类免疫原性片段可能适用于产生本发明的抗体。优选地,免疫原性片段包含任一SEQ ID NO:331-492或表2至7中所列的完整CDR3序列。本发明还提供了分离的蛋白质,其包含一个或多个上述免疫原性片段,例如以“多表位(polytope)”蛋白的形式存在。例如,所述免疫原性片段可以单一存在或作为重复序列存在,其也包括串联重复的片段。异源氨基酸序列(例如“间隔”氨基酸)也可以包括在所述分离的蛋白质中存在的一个或多个免疫原性片段之间。
在又一个实施方案中,本方面的发明提供了分离的蛋白质或肽,其由以下组成:(i)一个或多个本文所述的分离的α链、分离的β链和/或TCR蛋白的区段、结构域、部分或区域(例如,CDR),例如根据SEQ ID NO:7-492、655-816、表2-7和图94-99的那些,并包括其片段、变体或衍生物;和(ii)任选地一个或多个额外的氨基酸序列。在这个方面,额外的氨基酸序列优选是可以在上述蛋白质的所述氨基酸序列的N-和/或C-末端的异源氨基酸序列,但不限于此。
在另一方面,本发明考虑了分离的核酸,所述分离的核酸编码或互补于编码本文所公开的分离的蛋白质(例如,α链、β链和TCR蛋白质,包括其片段,变体和衍生物)的核酸序列。
可以容易地从本文提供的一个或多个完整核酸序列推导出编码本发明的分离的蛋白质、分离的免疫原性片段、变体、衍生物和多表位的核苷酸序列(参见例如SEQ ID NO:493-654),但不限于此。
这个方面还包括所述分离的核酸的片段、变体和衍生物,例如上文所述的那些。
如本文所用,术语“核酸”表示单链或双链DNA和RNA。DNA包括基因组DNA和cDNA。RNA包括mRNA,RNA,RNAi,siRNA,cRNA和自催化RNA。核酸也可以是DNA-RNA杂合体。核酸包含这样的核苷酸序列,该核苷酸序列通常包括包含A,G,C,T或U碱基的核苷酸。但是,核苷酸序列可以包括其他碱基,例如肌苷、甲基胞嘧啶、甲基肌苷、甲基腺苷和/ 或硫尿苷,但不限于此。
因此,在具体的实施方案中,分离的核酸是cDNA。
“多核苷酸”是具有八十(80)个或更多个连续核苷酸的核酸,而“寡核苷酸”具有少于八十(80) 个连续核苷酸。
“探针”可以是单链或双链寡核苷酸或多核苷酸,其被适当地标记,用于例如在Northern 或Southern印迹中检测互补序列的目的。
“引物”通常是单链寡核苷酸,优选地具有15-50个连续核苷酸,其能够退火至互补的核酸“模板”并能够通过DNA聚合酶如Taq聚合酶、RNA依赖性DNA聚合酶或Sequenase
本发明的另一特定方面提供了编码本发明的分离的免疫原性片段或蛋白的分离的核酸的变体。
在一个实施方案中,核酸变体编码本发明的分离的蛋白质的变体。
在另一个实施方案中,核酸变体与本发明的分离的核酸共有至少40%,45%,50%,55%, 60%或65%,66%,67%,68%,69%,优选地至少70%,71%,72%,73%,74%或75%,更优选地至少80%,81%,82%,83%,84%或85%和甚至更优选地至少90%,91%,92%,93%,94%,95%, 96%,97%,98%或99%核苷酸序列同一性。
在一个具体的实施方案中,本方面的该分离的核酸由以下组成:(a)核酸:(i)其编码本文所述的分离的α链蛋白、分离的β链蛋白和/或分离的TCR蛋白的区段、结构域、部分或区域,其中本文所述的分离的α链蛋白、分离的β链蛋白和/或分离的TCR蛋白例如根据SEQID NO:7-492、655-816、表2-7和图94-99的那些并包括其变体或衍生物;或(ii)其包含任一SEQ ID NO:493-654的核酸序列或与其至少70%同一的核酸序列、基本上由所述核酸序列组成或由所述核酸序列组成;和(b)任选地一个或多个额外的核酸序列。就这一点而言,该额外的核酸序列优选地是可以在该分离的核酸序列的5'(5-prime)和/或3'(3-prime)末端的异源核酸序列,但不限于此。
本发明还考虑了经修饰的核酸,例如通过利用密码子序列冗余而修饰。在一个更具体的例子中,可以改变密码子使用以优化核酸在特定生物或细胞类型中的表达。
本发明还提供了修饰的嘌呤(例如肌苷、甲基肌苷和甲基腺苷)和修饰的嘧啶(例如硫尿苷和甲基胞嘧啶)用在本发明的核酸中。
本领域技术人员将很好地认识到,可以使用标准方案方便地制备本发明的分离的核酸,所述标准方案例如在CURRENT PROTOCOLS IN MOLECULAR BIOLOGY(Ausubel等人编著,John Wiley&Sons NY,1995-2008)的第2章和第3章中描述的那些。
又在另一个实施方案中,互补核酸在高严格条件下与本发明的核酸杂交。
本文中使用“杂交”来表示至少部分互补的核苷酸序列的配对以产生DNA-DNA,RNA-RNA或DNA-RNA杂合体。包含互补核苷酸序列的杂合序列通过碱基配对产生。
如本文所用,“严格性”是指杂交期间的温度和离子强度条件,以及某些有机溶剂和/或去污剂的存在或不存在。严格性越高,杂交的核苷酸序列之间所需的互补性水平越高。
“严格条件”是指仅具有高频率的互补碱基的核酸将杂交的条件。
严格条件在本领域中是众所周知的,例如在上文Ausubel等人的第2.9章和第2.10章中描述的,其通过引用并入本文作为参考。熟练的技熟人员还将认识到,可以操纵多种因素来优化杂交的特异性。优化最终洗涤的严格性可用于确保高程度杂交。
互补核苷酸序列可通过印迹技术来鉴定,该技术包括将核苷酸固定在基质(优选地合成膜,例如硝酸纤维素)上的步骤、杂交步骤和检测步骤,通常使用标记的探针或其他互补核酸。 Southern印迹法用于鉴定互补的DNA序列。Northern印迹法用于鉴定互补的RNA序列。斑点印迹法和狭缝印迹法可用于鉴定互补的DNA/DNA,DNA/RNA或RNA/RNA多核苷酸序列。这类技术是本领域技术人员众所周知的,并且已经在上文的Ausubel等人的第2.9.1至2.9.20页中进行了描述。根据这类方法,Southern印迹法涉及通过凝胶电泳根据大小分离DNA 分子,将大小分离的DNA转移至合成膜,并将膜结合的DNA与互补核苷酸序列杂交。当在cDNA或基因组DNA文库中鉴定互补核酸时,使用备选的印迹步骤,例如通过噬斑或菌落杂交方法。该操作的其他典型示例在Sambrook等人,MOLECULAR CLONING.A Laboratory Manual(Cold Spring Harbor Press,1989)的第8-12章中描述。
检测与固定的核酸杂交的标记核酸的方法是本领域技术人员众所周知的。这类方法包括放射自显影,化学发光,荧光和比色检测。
还可以分离、检测核酸和/或使用核酸序列扩增技术对核酸进行重组DNA技术。
涵盖热方法和等温方法的合适的核酸扩增技术是本领域技术人员众所周知的,并且包括聚合酶链反应(PCR);链置换扩增(SDA);滚环复制(RCR);基于核酸序列的扩增(NASBA); Q-β复制酶扩增,重组酶聚合酶扩增(RPA)和解旋酶依赖性扩增,但不限于此。
如本文所用,“扩增产物”是指通过核酸扩增产生的核酸产物。
如本领域众所周知的,核酸扩增技术可以包括特定的定量和半定量技术,例如qPCR、实时PCR和竞争性PCR。
在另一方面,本发明提供了遗传构建体,其包含:(i)本文所述的分离的核酸;或(ii)包含与其互补的核苷酸序列的分离的核酸。优选地,分离的核酸与表达载体中的一个或多个调节序列有效地相连或连接。
合适地,遗传构建体为质粒,噬菌体,粘粒,酵母或细菌人工染色体的形式或包含它们的遗传成分,如本领域众所周知的。遗传构建体可以适用于在细菌或其他宿主细胞中维持和繁殖分离的核酸,用于通过重组DNA技术进行操作和/或表达本发明的核酸或编码的蛋白质。
为了宿主细胞表达的目的,遗传构建体可以是表达构建体。合适地,表达构建体包含与表达载体中的一个或多个额外的序列有效连接的本发明核酸。“表达载体”可以是自我复制的染色体外载体,例如质粒,或者是整合到宿主基因组中的载体。在这方面,载体可以能够将本发明的核苷酸转移至宿主细胞,例如T细胞,从而该细胞表达EBV特异的TCR。理想地,载体应该能够在T细胞中持续高水平表达。
“有效连接的”是指所述额外的核苷酸序列相对于本发明的核酸定位优选地以引发、调节或以其他方式控制转录。
调节核苷酸序列通常对用于表达的宿主细胞是合适的。对于许多宿主细胞,本领域已知许多类型的合适的表达载体和合适的调节序列。
通常,所述一个或多个调节核苷酸序列可以包括但不限于启动子序列、前导序列或信号序列、核糖体结合位点、转录起始和终止序列、翻译起始和终止序列以及增强子或活化子序列。
本发明考虑了本领域已知的组成型或诱导型启动子。
在具体的实施方案中,表达构建体是或包含一种或多种病毒递送系统,例如腺病毒载体、腺相关病毒(AAV)载体、疱疹病毒载体、逆转录病毒载体、慢病毒载体和杆状病毒载体。
在另一方面,本发明提供了用本文所述的核酸分子或遗传构建体转化的宿主细胞。
用于表达的合适宿主细胞可以是原核或真核的。例如,合适的宿主细胞可包括但不限于哺乳动物细胞(例如HeLa,HEK293T,Jurkat细胞),酵母细胞(例如酿酒酵母(Saccharomyces cerevisiae)),使用或不使用杆状病毒表达系统的昆虫细胞(例如Sf9,粉纹夜蛾(Trichoplusia ni)),植物细胞(例如莱茵衣藻(Chlamydomonas reinhardtii),三角褐指藻(Phaeodactylum tricornutum)) 或细菌细胞,例如大肠杆菌。将遗传构建体引入宿主细胞(原核或真核)中是本领域众所周知的,例如在CURRENT PROTOCOLS IN MOLECULARBIOLOGY,Ausubel等人编著(John Wiley&Sons,Inc.1995-2009),尤其是第9章和第16章中描述。
在具体的实施方案中,宿主细胞是或包含T细胞。考虑了T细胞可以是任何T细胞,例如培养的T细胞,例如原代T细胞,或来自培养的T细胞系的T细胞,例如Jurkat,SupT1 等,或从哺乳动物获得的T细胞。如果是从哺乳动物获得的,则T细胞可以从许多来源获得,包括但不限于血液,骨髓,淋巴结,胸腺或其他组织或体液。也可以富集或纯化T细胞。优选地,T细胞是人T细胞。T细胞可以是任何类型的T细胞,并且可以处于任何发育阶段,包括但不限于CD4
合适地,T细胞是或包含CD4+辅助T细胞和/或CD8+细胞毒性T细胞。就这一点而言,本方面的T细胞可以在CD4+辅助T细胞/CD8+细胞毒性T细胞的混合群体中。还应理解,调节性T细胞(例如CD4+25+调节性T细胞)表达本发明的α链、β链和/或TCR蛋白可能是不希望的,因为它们可以抑制也表达此类蛋白质的细胞毒性和辅助T细胞的抗病毒活性。
有利地,本发明的分离的α链、分离的β链和/或分离的TCR可用于TCR基因转移,这是一种快速、可靠并且能够产生对例如本文所述的一种或多种那些EBV抗原(例如,LMP-1和/或LMP-2)具有特异性的大量T细胞(>10
因此,本发明的宿主细胞(例如T细胞)可以通过过继转移用于EBV相关的疾病、病症或病状的治疗。为此目的,通常从取自受试者(包括供体受试者)的生物样品中分离T细胞,以用于遗传修饰细胞的过继转移中。
优选地,用本发明的分离的α链、分离的β链和/或分离的TCR(例如SEQ ID NO:7-492, 655-816,表2-7和图94-99中列出的那些蛋白)转导或转化的T细胞含有幼稚、中央记忆和效应记忆细胞的混合物。
本发明还提供了包含至少一种本文所述的宿主细胞的细胞群体。细胞群体可以是异源群体,其包含含有所述的任何重组表达载体的宿主细胞,以及至少一种其他细胞,例如,不包含任何重组表达载体的宿主细胞(例如,T细胞)或T细胞以外的细胞,例如B细胞,巨噬细胞,嗜中性粒细胞,红细胞,肝细胞,内皮细胞,上皮细胞,肌肉细胞,脑细胞等。备选地,细胞群体可以是基本上均质的群体,其中该群体主要包含含有重组表达载体的宿主细胞(例如,基本上由其组成)。该群体也可以是细胞的克隆群体,其中该群体的所有细胞是包含重组表达载体的单个宿主细胞的克隆,从而该群体的所有细胞都包含重组表达载体。在本发明的一个实施方案中,细胞群体是克隆群体,其包含含有本文所述的重组表达载体的宿主细胞。
在一个实施方案中,群体中的细胞数目可以迅速扩增。T细胞数目的扩增可以通过本领域已知的多种方法中的任何一种来完成,例如在美国专利8,034,334;美国专利8,383,099;美国专利申请公开号2012/0244133;Dudley等人,J.Immunother.,26:332-42(2003);和Riddell等人,J.Immunol.Methods,128:189-201(1990)中所述的方法。
在备选的实施方案中,宿主细胞是干细胞,或衍生自干细胞,例如造血干细胞(HSC)。为此目的,宿主细胞因此可以是基因修饰的干细胞,其在分化时产生表达本发明的α链、β链和/或TCR的T细胞。
又在另一方面,本发明提供了一种产生本文所述的分离的蛋白质的方法,该方法包括:(i) 培养前述的先前转化的宿主细胞;和(ii)从步骤(i)中培养的所述宿主细胞分离所述蛋白质。
重组蛋白可以由本领域技术人员使用例如在Sambrook等人,MOLECULARCLONING.A Laboratory Manual(Cold Spring Harbor Press,1989),特别是第16和17节;CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,Ausubel等人编著(John Wiley&Sons,Inc.1995-2009),特别是第10和16章;和CURRENT PROTOCOLS IN PROTEIN SCIENCE, Coligan等人编著(John Wiley&Sons,Inc.1995-2009),特别是第1、5和6章中描述的标准方案方便地制备。
在又一个方面,本发明提供了结合和/或针对本文所述的分离的α链、分离的β链和/或分离的TCR(包括其片段,变体和衍生物)产生的抗体或抗体片段。
如本文通常使用的,“抗体”是或包含免疫球蛋白。术语“免疫球蛋白”包括哺乳动物免疫球蛋白基因复合物的任何抗原结合蛋白产物,包括免疫球蛋白同种型IgA,IgD,IgM,IgG和 IgE及其抗原结合片段。术语“免疫球蛋白”包括嵌合的或人源化的或包含改变的或变体的氨基酸残基、序列和/或糖基化的免疫球蛋白,无论是天然存在的还是通过人为干预(例如通过重组 DNA技术)产生的。
合适地,所述抗体或抗体片段特异性结合所述分离的蛋白质。优选地,抗体或抗体片段特异性地或选择性地结合或识别本文所述的α链和/或β链的CDR3(例如,SEQ ID NO:331-492) 的全部或部分氨基酸序列。就这一点而言,如下文所述,本方面的抗体或抗体片段可适用于在受试者的生物样品中检测或分离表达具有该特定CDR3的TCR的T细胞的方法中。应当理解,所检测或分离的T细胞可能适合随后用于EBV相关的疾病、病症或病状的细胞免疫疗法中。
抗体可以是多克隆或单克隆的、天然的或重组的。可以在例如Coligan等人,CURRENT PROTOCOLS IN IMMUNOLOGY(John Wiley&Sons NY,1991-1994)的第2章和Harlow,E.& Lane,D.Antibodies:A Laboratory Manual,Cold Spring Harbor,Cold SpringHarbor Laboratory, 1988中找到适用于抗体产生、纯化和使用的众所周知的方案,它们均通过引用并入本文作为参考。
通常,本发明的抗体与本发明的分离的蛋白质、片段、变体或衍生物结合或缀合。例如,抗体可以是多克隆抗体。此类抗体可以例如通过将本发明的分离的蛋白质、片段、变体或衍生物注射到可以包括小鼠或兔的生产物种中以获得多克隆抗血清来制备。产生多克隆抗体的方法是本领域技术人员众所周知的。可以使用的示例性方案例如在上文的Coligan等人, CURRENT PROTOCOLS IN IMMUNOLOGY和上文的Harlow&Lane,1988中描述。
单克隆抗体可以使用例如在
本发明在其范围内还包括抗体片段,例如上述多克隆或单克隆抗体的Fc、Fab或F(ab)2 片段。备选地,抗体可以包含针对本发明的肽的单链Fv抗体(scFv)。这样的scFv可以例如根据分别在美国专利号5,091,513,欧洲专利号239,400或Winter&Milstein,1991,Nature 349:293 的文章中描述的方法制备,它们通过引用并入本文作为参考。本发明还考虑了包括多价重组抗体片段,所谓的双体抗体(diabodies)、三体抗体和/或四体抗体,其包含多个scFv;以及二聚化活化的demibodies(例如,WO/2007/062466)。举例来说,可根据Holliger等人,1993Proc Natl Acad Sci USA 90:6444-6448;或Kipriyanov,2009MethodsMol Biol 562:177-93中描述的方法制备此类抗体,并且它们在此全部并入本文作为参考。
本发明的抗体和抗体片段可以特别适用于本文所述的分离的蛋白质的亲和层析纯化,例如从受试者供体的生物学样品中纯化的那些或重组制备的那些。例如,可以参考上文中 Coligan等人,CURRENT PROTOCOLS IN IMMUNOLOGY的第9.5章中描述的亲和色谱方法。
在另一方面,本发明提供了一种组合物,其包含:
(i)本文所述的分离的α链或其片段、变体或衍生物;
(ii)本文所述的分离的β链或其片段、变体或衍生物;
(iii)本文所述的分离的TCR或TCR片段、变体或衍生物;
(iv)本文所述的分离的核酸或片段、变体或衍生物;
(v)本文所述的遗传构建体;和/或
(vi)本文所述的宿主细胞;
以及任选地可药用载体(carrier)、稀释剂或赋形剂。
“可药用载体、稀释剂或赋形剂”是指可以安全地用于全身给药的固体或液体填充剂、稀释剂或包囊物质。取决于特定的给药途径,可以使用本领域众所周知的多种载体。这些载体可以选自包括糖,淀粉,纤维素及其衍生物,麦芽,明胶,滑石粉,硫酸钙,植物油,合成油,多元醇,藻酸,磷酸缓冲液,乳化剂,等渗盐水和盐,如无机酸盐,包括盐酸盐、溴化物和硫酸盐,有机酸,例如乙酸盐、丙酸盐和丙二酸盐,以及无热原的水。
描述可药用载体、稀释剂和赋形剂的有用参考文献是Remington’sPharmaceutical Sciences(Mack Publishing Co.N.J.USA,1991),其通过引用并入本文作为参考。
在特定的方面,本发明提供了一种治疗或预防受试者中EBV相关的疾病、病症或病状的方法,所述方法包括施用治疗有效量的本文所述分离的α链或其片段、变体或衍生物,本文所述分离的β链或其片段、变体或衍生物,本文所述分离的TCR或TCR片段、变体或衍生物,本文所述分离的核酸或片段、变体或衍生物,本文所述遗传构建体,本文所述宿主细胞和/或本文所述组合物至受试者的步骤,从而在受试者中治疗或预防EBV相关的疾病、病症或病状。
如本文所用,“治疗着”(或“治疗”)是指在EBV相关的疾病、病症或病状开始发展后改善其症状或体征的治疗性干预。关于EBV相关的疾病、病症或病状,术语“改善”是指治疗的任何可观察到的有益作用。治疗无需是绝对有益于受试者的。可以使用普通技术人员已知的任何方法或标准来确定有益效果。
如本文所用,“预防着”(或“预防”)是指在EBV相关的疾病、病症或病状发作之前开始的作用过程,以预防或减轻症状、方面或特征。应该理解的是,这种预防无需是绝对有益于受试者的。“预防性”治疗是施用给不表现出EBV相关的疾病、病症或病状或仅表现出早期病征的受试者的治疗,目的是降低罹患EBV相关的疾病、病症或病状的症状、方面或特征的风险。
在本发明的上下文中,“EBV相关的疾病、病症或病状”是指由EB病毒感染引起的任何临床病理。为此,EBV相关的疾病、病症或病状可以指由EBV直接或间接引起的任何疾病,以及使患者容易受到EBV感染的疾病。属于前一类的疾病的例子包括传染性单核细胞增多症,鼻咽癌和伯基特淋巴瘤。后一类疾病(即,使患者处于EBV感染风险中的疾病)包括获得性免疫缺陷综合症和通常引起免疫抑制状态或降低的免疫系统功能的任何疾病,例如接受器官移植的患者和某些癌症疗法。在一个具体的实施方案中,该EBV相关的疾病、病症或病状合适地是或包含多发性硬化。
在优选的实施方案中,EBV相关的疾病、病症或病状是或包含EBV相关的和/或阳性的癌症。如本文所用,除非另有说明,否则术语“EBV相关的癌症”或“EBV阳性癌症”是指与EB病毒(EBV)关联的癌症。在某些实施方案中,EBV阳性癌症是其中大于约30%,大于约40%,大于约50%,大于约60%,大于约70%或大于约80%含有或表达EBV病毒的癌症。合适地,EBV相关的癌症选自鼻咽癌,NKT细胞淋巴瘤,霍奇金淋巴瘤,移植后淋巴增生性疾病,伯基特淋巴瘤,弥漫性大B细胞淋巴瘤,胃癌,多形胶质母细胞瘤及其任何组合。
如本文中通常使用的,术语“癌症”,“肿瘤”,“恶性的”和“恶性”是指以异常或反常细胞增殖、分化和/或迁移为特征的疾病或病症,或与该疾病或病症相关的细胞或组织,所述异常或反常细胞增殖、分化和/或迁移通常伴随异常或反常的分子表型,包括与肿瘤发生、肿瘤标志物的表达,肿瘤抑制物表达或活性的丧失和/或异常或反常的细胞表面标志物表达相关的一种或多种遗传突变或其他遗传变化。
癌症可能包括任何侵袭性或潜在侵袭性的癌症、肿瘤或其他恶性肿瘤,例如http://www.cancer.gov/cancertopics/αlist的NCI癌症索引所列,包括所有主要癌症形式,例如肉瘤、癌(carcinomas)、淋巴瘤、白血病和母细胞瘤,但不限于此。这些可能包括乳腺癌,包括肺腺癌在内的肺癌,包括卵巢癌、宫颈癌、子宫癌和前列腺癌在内的生殖系统癌,脑和神经系统癌,头颈癌,包括结肠癌、结直肠癌和胃癌在内的胃肠道癌,肝癌,肾癌,皮肤癌(skin cancers)(例如黑素瘤和皮肤癌(skin carcinomas)),血细胞癌(包括淋巴样癌和髓单核细胞癌),内分泌系统的癌症(例如胰腺癌和垂体癌),包括骨骼和软组织癌在内的肌肉骨骼癌,但不限于此。在具体的实施方案中,癌症是实体癌或白血病或体液癌。合适地,癌症表达例如过表达一种或多种EBV抗原,例如上文所述的那些抗原。
“施用”是指通过特定选择的途径将本文公开的分离的蛋白质、编码核酸、遗传构建体、宿主细胞或组合物引入动物受试者。
可以采用任何安全的施用途径,包括口服,直肠,肠胃外,舌下,颊,静脉内,关节内,肌肉内,真皮内,透皮,皮下,吸入,眼内,腹膜内和脑室内施用。
剂型包括片剂,分散剂,混悬剂,注射剂,溶液剂,糖浆剂,锭剂,胶囊剂,鼻喷雾剂,栓剂,气雾剂,透皮贴剂等。这些剂型还可包括专门为此目的设计的注射或植入控释装置,或经改变额外地以这种方式起作用的其他形式的植入物。可以通过用例如疏水性聚合物涂覆其来实现治疗剂的受控释放,所述疏水性聚合物包括丙烯酸树脂,蜡,高级脂肪醇,聚乳酸和聚乙醇酸,以及某些纤维素衍生物例如羟丙基甲基纤维素。另外,可通过使用其他聚合物基质、脂质体和/或微球体来实现控释。
适用于口服或肠胃外施用的本发明的组合物可以以分开的单位存在,例如胶囊,小袋,功能性食品/饲料或片剂,每个单位均含有预定量的一种或多种本发明的治疗剂,可以以散剂或颗粒剂或溶液剂或在水性液体、非水性液体、水包油乳液或油包水液体乳液中的悬浮液的形式存在。此类组合物可以通过任何一种药学方法制备,但是所有方法都包括使一种或多种如上所述的试剂与构成一种或多种必要成分的载体组合的步骤。通常,通过将本发明的试剂与液体载体或细分的固体载体或这两者均匀且紧密地混合,和然后根据需要,将产物成型为所需的外观,来制备组合物。
上述组合物可以与剂型相容的方式和以药学上有效的量施用。在本发明的上下文中,施予患者的剂量应足以在适当的时间段内对患者产生有益的反应。待施用的药剂的量可以取决于待治疗的受试者,包括其年龄,性别,体重及其总体健康状况,这些因素将取决于从业者的判断。
本发明的一个特别广泛的应用是提供一种在患有EBV相关疾病、病症或病状(例如上文所述的那些)的受试者中进行细胞免疫疗法或过继免疫疗法的方法,所述方法包括施予受试者治疗有效量的本文所述的宿主细胞(例如,T细胞)和任选地可药用载体、稀释剂或赋形剂的步骤。
术语“细胞免疫疗法”或“过继免疫疗法”表示用于治疗癌症或感染性疾病的免疫活性细胞,例如T细胞的转移(参见,例如,June,C.H.编著,2001,Cancer Chemotherapy andBiotherapy: Principles and Practice,Lippincott Williams&Wilkins,Baltimore;Vonderheide等人,2003,Immun. Research 27:1-15)。为此,应当理解,过继免疫疗法是通常旨在通过自体或同种异体细胞(例如T-细胞)替代、修复或增强组织或系统(例如免疫系统)的生物学功能的策略。
在具体的实施方案中,EBV相关的疾病、病症或病状是或包含癌症,例如上文所提供的那些。
在另一方面,本发明提供了一种检测或分离来自受试者的生物样品中的T细胞的方法,该方法包括以下步骤:使生物样品与上文所述的抗体或抗体片段接触一段时间,并在足以检测或分离所述T细胞的条件下由此检测或分离所述T细胞。
优选地,该检测或分离的T细胞包含本文提供的α链、β链和/或T细胞受体,由此该检测或分离的T细胞优选地适合用于EBV相关的疾病、病症或病状的细胞免疫治疗中。在这方面,T细胞可以是自体的和/或同种异体的(即,衍生自或获自供体,例如遗传匹配的供体)细胞。
在某些实施方案中,生物学样品可以是病理学样品,其包含从动物获得的一种或多种体液、细胞、组织、器官或器官样品,例如癌细胞和/或组织。非限制性实例包括血液、血浆、血清、淋巴细胞、尿液、粪便、羊水、宫颈样品、脑脊髓液、组织活检、骨髓、支气管肺泡灌洗液、痰和皮肤。
在具体的实施方案中,本方面的方法进一步包括从受试者获得生物样品的步骤。
合适地,本文描述的方法在哺乳动物上进行。
在一个实施方案中,哺乳动物是人。
尽管本文描述的原理是基于对人类的治疗方法,但是本发明还可以扩展到其他哺乳动物,例如牲畜(例如牛,绵羊)、表演动物(例如赛马)和家养宠物(例如狗,猫),但不限于此。
本文所引用的所有计算机程序、算法、专利和科学文献均通过引用并入本文作为参考。
为了使本发明易于理解并付诸实践,参考以下非限制性实施例。
实施例1
从识别EBV的LMP2、LMP1和EBNA1蛋白的T细胞中已经鉴定出很少的αβTCR对。本实施例描述了鉴定αβTCR对,其识别衍生自LMP1和LMP2抗原并与几种通常存在的人白细胞抗原结合而呈递的表位。
材料和方法
T细胞系的产生
通过Ficoll-Hypaque离心将外周血单个核细胞(PBMC)分离到补充有10%FCS的RPMI 1640培养基(R10)中。血液供体是健康的、EBV血清阳性个体,其已经给出了书面知情同意。该研究获得了QIMR Berghofer Medical Research Institute Human EthicsCommittee(Brisbane, Australia)的批准。通过用已使用合成肽(1μg/ml)处理过的并洗涤一次以除去未结合的肽的自体 PBMC(10
分选特异于每一EBV肽表位的单个CD8
将T细胞系用缀合有别藻蓝蛋白(APC)的HLA-肽多聚体(ProImmune Ltd.,Oxford,UK)在室温温育30分钟进行标记。然后洗涤细胞,并与缀合有Cy5.5-PerCP的抗人CD8 mAb(BioLegend,San Diego,CA)4℃温育30分钟。洗涤细胞,使用FACS Aria III流式细胞仪(BDBiosciences)分析细胞,并将其作为单细胞分选到96孔PCR板(Eppendorf,德国汉堡)中。
单细胞配对的TCRαβ测序
如先前所述[14]进行多重巢式RT-PCR,用于配对的TCRαβ测序。简而言之,将细胞中的 mRNA逆转录以产生cDNA,然后使用特异性引物对cDNA进行2轮PCR,所述特异性引物扩增了该一个细胞中存在的TCR基因的α链和β链。纯化该PCR产物并测序,然后使用IMGT 网站软件进行分析。确定了具有各自CDR3区的α链和β链。
TCR基因转移
通过密码子优化和在每个受体链中引入单个半胱氨酸残基来修饰一些TCRα链和β链序列,所述引入的单个半胱氨酸残基用来促进形成额外的链间二硫键和降低与内源TCR亚基发生TCR错配的可能性[15]。还在恒定区内修饰了TCR,其中通过用鼠对应物交换选定的氨基酸来增强稳定性和表达水平。对于α链,氨基酸交换在位置90、91、92和93处进行,对于β链,氨基酸交换在位置18、22、133、136和139处进行[16]。然后将TCRα链和β链序列作为一个转录本人工地导入慢病毒质粒中,使用切割蛋白以产生由启动子人延伸因子1α(EF-1α)驱动的等比例α链和β链作为2个产物(Biosettia Inc.,San Diego)。然后将该慢病毒质粒转导至人T细胞中用于产生慢病毒(Biosettia Inc.,San Diego)。人T细胞是Jurkat细胞系或来自健康供体的T细胞,所述细胞已经用CD3-CD28珠(Thermo Fisher Scientific,Massachusetts)刺激,并用补充了重组IL-2(20IU/ml)的R10培养扩增。然后使用相应的肽-HLA 多聚体和TCR Vβ抗体(如果可获得的话)在Fortessa 4上通过FACS分析测试细胞中是否存在引入的TCR。在一些情况下,通过使用γ-干扰素(IFN-γ)酶联免疫吸附斑点(ELISpot)测定法或通过粒酶B表达的FACS分析,也证实了所转移的TCR识别相关EBV表位的能力。
ELISpot测定法
根据制造商的说明(Mabtech,Stockholm,Sweden),使用细胞因子捕获试剂和检测试剂进行 IFN-γELISpot测定法。简而言之,将预先包被有抗IFN-γ单克隆抗体的96孔硝酸纤维素板接种1-4x10
EBV诱导的B细胞淋巴瘤的小鼠模型和用TCR转基因T细胞的治疗
在18只NOD/RAG小鼠中通过皮下注射来自HLA-A*02:01
结果
本实施例涉及识别EBV的LMP2和LMP1抗原的TCR的鉴定,这些TCR受到人白细胞抗原的限制,而人白细胞抗原在全世界大多数人群中都经常存在。这些可用于TCR基因疗法,以治疗许多与EBV相关的疾病。
第一步涉及使用流式细胞术从肽刺激的T细胞培养物中分选单个T细胞,然后用抗CD8 抗体和特异性结合相关TCR的肽-HLA多聚体染色。图1-6显示了对五个LMP2表位和一个HLA-A*02:01限制性LMP1表位的流式细胞术数据。
在表达一种或多种通常存在的HLA等位基因(A*02:01,A*11:01,A*24:02或B*40:01;表 1)的健康EBV血清阳性血液供体上使用单细胞TCR测序,我们已成功鉴定了识别LMP2表位IEDPPFNSL(由HLA-B*40:01呈递;表2;[17]),SSCSSCPLSK(由HLA-A*11:01呈递;表3;[17]),TYGPVFMSL/TYGPVFMCL(由HLA-A*24:02呈递;表4;[17]),PYLFWLAAI(由 HLA-A*2402呈递;表5;[18]),LMP1表位YLLEMLWRL(由HLA-A*02:01呈递;表6; [19])和LMP2表位FLYALALLL(由HLA-A*02:01呈递;表7;Lautscham等人,J.Virol.2003 年2月;77(4):2757-61)的TCR序列。表8显示了不同人群中这四种HLA等位基因的频率。
为了证实使用上述方法鉴定出的TCR确实识别用于分选T细胞的EBV表位,将特异于一些EBV肽(在表2-4和7中突出显示)的代表性TCR人工地工程化入慢病毒表达系统。然后使用该重组慢病毒构建体用于感染Jurkat T细胞系,并用特异于相关TCRβ链可变基因产物的抗体和相关肽-HLA复合物的多聚体染色这些细胞。特异于SSCSSCPLSK-HLA-A*11:01(图7)和TYGPVFMCL-HLA-A*24:02(图8)的TCR的数据证实,显著比例的经转导Jurkat细胞表达在细胞表面正确组装的TCR。
然后使用功能测定法筛选经重组慢病毒构建体转导的Jurkat T细胞系对相关肽-HLA复合物的识别。这些ELISpot测定法检测到:当添加到表达相关HLA等位基因并已用相关EBV 肽预处理的刺激细胞时,自TCR转导的Jurkat细胞的干扰素γ释放(图9和10)。
还用编码特异于LMP2抗原的TCR的重组慢病毒构建体转导了原代人T淋巴细胞。该TCR特异于HLA-A*02:01-FLYALALLL复合物,并使用通过流式细胞术测量粒酶B表达的功能测定法筛选它对该肽-HLA复合物的识别。添加已用FLYALALLL肽预处理的 HLA-A*02:01
为了研究用LMP2特异的TCR转导的原代人T细胞在控制感染EBV的肿瘤中的体内功效,使用了EBV诱导的B细胞淋巴瘤的小鼠模型。通过皮下注射表达HLA-A*02:01的EBV 阳性人B淋巴细胞(LCL)在NOD/RAG小鼠中建立EBV阳性肿瘤。从第2天可见肿瘤,并在接种肿瘤后的第2天和第9天进行治疗。这由两次静脉内注射转基因T细胞(分别为8x10
表1:研究中使用的供体的I类HLA类型
表2:特异于HLA-B*40:01-IEDPPFNSL的TCR的α链和β链基因使用和CDR序列
将突出显示的TCR随后人工地工程化入慢病毒表达系统。
表3:特异于HLA-A*11:01-SSCSSCPLSK的TCR的α链和β链基因使用和CDR序列
将突出显示的TCR随后人工地工程化入慢病毒表达系统。
表4:特异于HLA-A*24:02-TYGPVFMSL/TYGPVFMCL的TCR的α链和β链基因使用和CDR序列
将突出显示的TCR随后人工地工程化入慢病毒表达系统。
表5:特异于HLA-A*24:02-PYLFWLAAI的TCR的α链和β链基因使用和CDR序列
表6:特异于HLA-A*02:01-YLLEMLWRL的TCR的α链和β链基因使用和CDR序列
表7:特异于HLA-A*02:01-FLYALALLL的TCR的α链和β链基因使用和CDR序列
将突出显示的TCR随后人工地工程化入慢病毒表达系统。
表8:具有HLA等位基因的个体的%
参考:
参考文献
1.Taylor,G.S.,H.M.Long,J.M.Brooks,A.B.Rickinson和A.D.Hislop,EB病毒引起的疾病的免疫学(The immunology of Epstein-Barr virus-induced disease).AnnuRev Immunol,2015.33: p.787-821.
2.Kutok,J.L.和F.Wang,EB病毒相关疾病谱(Spectrum of Epstein-Barr virus-associated diseases).Annu Rev Pathol,2006.1:p.375-404.
3.Pender,M.P.和S.R.Burrows,EB病毒和多发性硬化:免疫治疗的潜在机会(Epstein-Barr virus and multiple sclerosis:potential opportunities forimmunotherapy).Clin Transl Immunology, 2014.3(10):p.e27.
4.Davis,M.M.和P.J.Bjorkman,T细胞抗原受体基因和T细胞识别(T-cellantigen receptor genes and T-cell recognition).Nature,1988.334(6181):p.395-402.
5.Garboczi,D.N.和W.E.Biddison,MHC限制的形状(Shapes of MHCrestriction).Immunity, 1999.10(1):p.1-7.
6.Smith,C.和R.Khanna,EBV诱发的癌症的过继治疗:将移植后淋巴增生性疾病成功应用于其他EBV衍生的肿瘤(Adoptive therapy for EBV-induced cancers:drivingsuccess with post-transplant lymphoproliferative disorder to other EBV-derived tumors).Immunotherapy,2015. 7(5):p.563-72.
7.Serafini,B.,B.Rosicarelli,D.Franciotta,R.Magliozzi,R.Reynolds,P.Cinque,L.Andreoni, P.Trivedi,M.Salvetti,A.Faggioni和F.Aloisi,多发性硬化脑中失调的EB病毒感染 (Dysregulated Epstein-Barr virus infection in the multiplesclerosis brain).J Exp Med,2007. 204(12):p.2899-912.
8.Serafini,B.,M.Severa,S.Columba-Cabezas,B.Rosicarelli,C.Veroni,G.Chiappetta,R. Magliozzi,R.Reynolds,E.M.Coccia和F.Aloisi,多发性硬化脑中EB病毒潜伏感染和B细胞的 BAFF表达:对病毒持久和鞘内B细胞活化的影响(Epstein-Barrvirus latent infection and BAFF expression in B cells in the multiplesclerosis brain:implications for viral persistence and intrathecal B-cellactivation).J Neuropathol Exp Neurol,2010.69(7):p.677-93.
9.Karpanen,T.和J.Olweus,T细胞受体基因治疗-准备病毒化了吗?(T-cellreceptor gene therapy--ready to go viral?)Mol Oncol,2015.9(10):p.2019-42.
10.Garber,K.,推动T细胞免疫疗法治疗实体瘤(Driving T-cell immunotherapyto solid tumors).Nat Biotechnol,2018.36(3):p.215-219.
11.Zheng,Y.,G.Parsonage,X.Zhuang,L.R.Machado,C.H.James,A.Salman,P.F.Searle,E.P. Hui,A.T.Chan和S.P.Lee,人白细胞抗原(HLA)A*1101限制的EB病毒特异的T细胞受体基因转移至目标鼻咽癌(Human Leukocyte Antigen(HLA)A*1101-RestrictedEpstein-Barr Virus-Specific T-cell Receptor Gene Transfer to TargetNasopharyngeal Carcinoma).Cancer Immunol Res,2015.3(10):p.1138-47.
12.Jurgens,L.A.,R.Khanna,J.Weber和R.J.Orentas,用EB病毒(EBV)潜伏膜蛋白特异性 T细胞受体转导原代淋巴细胞诱导了病毒感染细胞的裂解:一种治疗霍奇金病和鼻咽癌的新策略(Transduction of primary lymphocytes with Epstein-Barr virus(EBV)latent membrane protein-specific T-cell receptor induces lysis of virus-infected cells:A novel strategy for the treatment of Hodgkin's disease andnasopharyngeal carcinoma).J Clin Immunol,2006.26(1):p. 22-32.
13.Ikeda,H.,使用肿瘤浸润性T细胞和基因工程改造的TCR-T细胞进行T细胞过继免疫疗法(T-cell adoptive immunotherapy using tumor-infiltrating T cells andgenetically engineered TCR-T cells).Int Immunol,2016.28(7):p.349-53.
14.Nguyen,T.H.,L.C.Rowntree,D.G.Pellicci,N.L.Bird,A.Handel,L.Kjer-Nielsen,K. Kedzierska,T.C.Kotsimbos和N.A.Mifsud,对独特的交叉反应性病毒特异性CD8+T细胞的识别揭示了在临床环境中独特的TCR标签(Recognition of distinct cross-reactive virus-specific CD8+T cells reveals a unique TCR signature in aclinical setting).J Immunol,2014.192(11):p. 5039-49.
15.Cohen,C.J.,Y.F.Li,M.El-Gamil,P.F.Robbins,S.A.Rosenberg和R.A.Morgan,经过工程改造以表达具有第二个二硫键的T细胞受体的T细胞增强的抗肿瘤活性(Enhanced antitumor activity of T cells engineered to express T-cellreceptors with a second disulfide bond). Cancer Res,2007.67(8):p.3898-903.
16.Sommermeyer,D.和W.Uckert,人类TCR恒定区中最少的氨基酸交换增强TCR基因修饰的T细胞的改善功能(Minimal amino acid exchange in human TCR constantregions fosters improved function of TCR gene-modified T cells).J Immunol,2010.184(11):p.6223-31.
17.Lee,S.P.,R.J.Tierney,W.A.Thomas,J.M.Brooks和A.B.Rickinson,EBV潜伏膜蛋白2 中保守的CTL表位:基于CTL的肿瘤治疗的潜在靶标(Conserved CTL epitopeswithin EBV latent membrane protein 2:a potential target for CTL-based tumortherapy).J Immunol,1997. 158(7):p.3325-34.
18.Burrows,S.R.,R.A.Elkington,J.J.Miles,K.J.Green,S.Walker,S.M.Haryana,D.J.Moss, H.Dunckley,J.M.Burrows和R.Khanna,混杂CTL识别多种人白细胞抗原上的病毒表位:提议的HLA A24超型的生物学验证(Promiscuous CTL recognitionof viral epitopes on multiple human leukocyte antigens:biological validationof the proposed HLA A24 supertype).The Journal of Immunology,2003.171(3):p.1407-1412.
19.Khanna,R.,S.R.Burrows,J.Nicholls和L.M.Poulsen,EB病毒(EBV)致癌基因潜伏膜蛋白1(LMP1)中的细胞毒性T细胞表位的鉴定:HLA A2超型限制LMP1特异性细胞毒性T淋巴细胞对EBV感染细胞的免疫识别的证据(Identification of cytotoxic T cellepitopes within Epstein-Barr virus(EBV)oncogene latent membrane protein 1(LMP1):evidence for HLA A2 supertype-restricted immune recognition of EBV-infected cells by LMP1-specific cytotoxic T lymphocytes).Eur J Immunol,1998.28(2):p.451-8.
- 具有高亲和力的T细胞受体及其用途
- T细胞受体及其用途
