一种全肿瘤细胞微载体支架疫苗及其制备方法
文献发布时间:2024-01-17 01:14:25
技术领域
本发明属于免疫治疗技术领域,具体涉及一种微载体支架疫苗及其制备方法。
背景技术
传统的肿瘤治疗方法存在着易复发、易耐受和不良反应大等缺陷。近年来随着免疫学研究的进展,肿瘤免疫疗受到越来越多的关注。肿瘤的免疫疗法通过作用于免疫细胞,激活人体免疫系统,减少肿瘤细胞免疫逃逸,从而增强对肿瘤细胞的杀伤作用。肿瘤疫苗作为免疫治疗的分支,具有极大的发展前途及应用潜力。尽管肿瘤疫苗发展迅速,但目前大多数肿瘤疫苗仍然存在治疗效果有限,临床客观响应率低,生产工艺较复杂等问题。肿瘤疫苗效果欠佳的可能原因主要是:①肿瘤抗原的免疫原性不足;②肿瘤内所存在的免疫抑制性微环境,例如肿瘤内高水平的PD-L1表达和缺乏持久的T细胞浸润;③缺乏高效的癌症疫苗递送技术。因此,开发新兴且便捷的肿瘤疫苗递送系统具有很高的临床应用价值。
生物支架材料由于其具有良好的生物相容性已被广泛应用于癌症疫苗递送领域。相比于纳米材料,生物支架材料不仅可以作为抗原和免疫调节剂的递送系统,还可以创造局部生态位,原位募集免疫细胞。
然而,目前基于生物材料支架的肿瘤疫苗制备过程较繁琐,主要包括制备肿瘤抗原,生物材料支架的制备以及抗原的组装和负载。由于肿瘤细胞上存在一系列突变的肿瘤抗原,全肿瘤细胞抗原比通用型肿瘤抗原的免疫原性更强,可以增强机体产生特异性免疫应答。全肿瘤细胞抗原处理时需要经过反复冻融、放疗、化疗等,而在生物支架材料制备完成后,还需要对肿瘤抗原进行额外负载,进一步使过程复杂化,因此,寻找更简单的方法制备基于生物支架的肿瘤疫苗意义重大。
微载体是一种广泛用于干细胞培养的生物支架材料,具有生物可降解性高,生物安全性好等优点。通过利用微载体递送肿瘤抗原和免疫调节剂,能够对抗原和免疫调节剂的释放进行时间和空间的控制,从而实现对招募的树突状细胞进行原位诱导和活化,进而激活T细胞产生强有力的细胞毒性T淋巴细胞(CTL)的免疫反应,提高抗肿瘤效果。
发明内容
本发明针对现有技术所存在的不足,提供一种全肿瘤细胞微载体支架疫苗及其制备方法。
本发明提供的全肿瘤细胞微载体支架疫苗的制备方法,具体步骤为:
(1)利用微载体接种和培养肿瘤细胞:首先在片状微载体上接种肿瘤细胞,每片的接种细胞量为0.2~1×10
(2)灭活:将所得的混合悬液于液氮(-196℃)中冷冻;然后水浴复融解冻;其中,冷冻时间为24h~96h;水浴复融温度为25℃~37℃;
(3)负载免疫调节:将复融后的空白微载体疫苗组与一定量的免疫调节剂复配,混匀得到混合溶液;
(4)冻干:将步骤(3)中所得的混合溶液进行冷冻干燥,即得全肿瘤细胞微载体支架疫苗。其中,冻干时间为8h~24h中任意时长。
进一步的,所述微载体选自液体微载体、大孔明胶微载体、聚苯乙烯微载体、甲壳质微载体、聚氨酯泡沫微载体、藻酸盐凝胶微载体以及磁性微载体等。
进一步的,所述的肿瘤细胞培养方法可采取静态培养或者转瓶培养的方式。
进一步的,所述的肿瘤细胞可以为CT26结直肠癌细胞、Hepa1-6肝癌细胞、4T1乳腺癌细胞等肿瘤细胞。
进一步的,所述免疫调节剂包括免疫佐剂、免疫检查点抑制剂、对免疫激活起效的化学药物的一种或多种的组合。
在一个较优的实施例中,所述免疫调节剂为瑞奎莫德(R848)与抗OX40抗体的药物组合。
本发明提供了一种微载体的新应用,传统的微载体是应用在干细胞培养,本发明创新性的利用其大孔的性质,将其作为一种生物支架材料应用于肿瘤免疫治疗领域,具有很好的疗效。
本发明还提供如上所述肿瘤疫苗在制备治疗肿瘤的药物中的应用。
与现有技术相比,本发明的有益效果如下:常规的制备基于生物材料支架的肿瘤疫苗的方法主要包括肿瘤抗原的制备、生物支架材料的制备和抗原的负载,制备过程较繁琐。本发明将这三个步骤融合在一起,一体化制备得到全肿瘤细胞微载体支架疫苗,省去了繁琐的制备过程,提高了制备效率。本发明所选用的全细胞肿瘤抗原,相比通用型肿瘤抗原其所含有的抗原谱更广泛,具有更强的免疫原性且与佐剂相结合使用能协同增强机体产生特异性免疫应答。冻干所获得的微载体支架疫苗因其具有大孔的3D结构可招募免疫细胞并促进其成熟,从而引发抗肿瘤免疫反应。使用时,以皮下注射的方式给药(相比传统皮下植入式支架给药的方式,患者的依从性更好),其中全肿瘤细胞作为抗原部分,辅以免疫调节剂,而微载体本身所具有的大孔结构可以作为免疫中心招募免疫细胞,从而引发抗肿瘤免疫应答,用于防止肿瘤术后复发和转移。本发明所提供的全肿瘤细胞微载体支架疫苗能发挥很好的疗效,具有广阔的应用前景。
附图说明
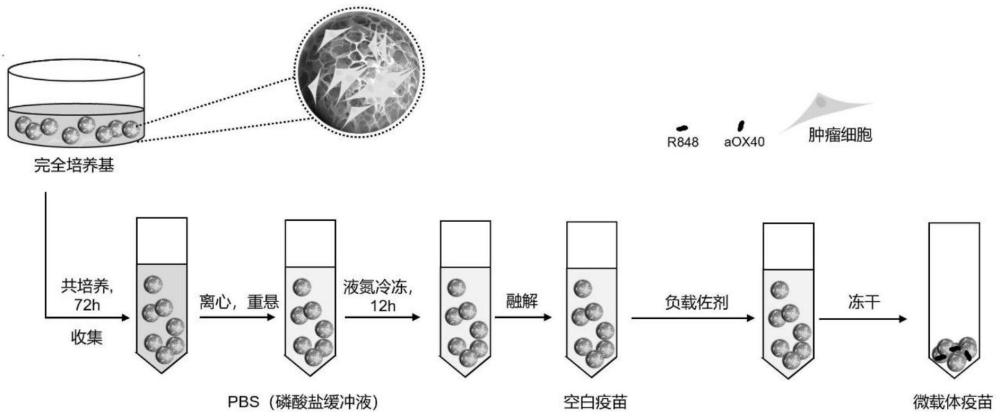
图1 为微载体支架疫苗的具体制备方法流程图示。
图2 为各组经扫描电镜(SEM)记录的图像。其中,(a)为CT26细胞的SEM图、(b)为微载体的SEM图像,(c)为微载体与CT26细胞共培养后的SEM图像。
图3 为CT26细胞、Hepa1-6细胞、4T1细胞与微载体共培养72小时的激光共聚焦图像。
图4 为CT26细胞在微载体其上培养的CCK-8细胞活性实验的结果示意图。
图5 分别为实施例1中所制备得到的微载体支架疫苗。其中,(a)R848、(b)aOX40(以IgG-FITC代替)在pH=7.4和温度37℃条件下的释放曲线示意图。
图6 为微载体支架疫苗的体内降解行为的示意图。
图7 为微载体支架疫苗诱导招募不同免疫细胞的能力。
图8 为实施例1中提供的微载体支架疫苗治疗性实验的肿瘤抑制效果示意图(n=5)。
具体实施方式
下面通过具体实施例结合附图进一步介绍本发明。
下述实施例中所使用到的微载体为3D TableTrix,购自于北京华龛生物有限公司。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
实施例1, CT26全肿瘤细胞微载体支架疫苗的制备
如图1所示,将一定量的CT26结肠癌细胞与微载体(2×10
实施例2 ,4T1全肿瘤细胞微载体支架疫苗的制备
如图1所示,将一定量的4T1乳腺癌细胞与微载体(2×10
实施例3 ,Hepa1-6全肿瘤细胞微载体支架疫苗的制备
如图1所示,将一定量的Hepa1-6肝癌细胞与微载体(2×10
实施例4 ,微载体可用于培养肿瘤细胞的验证
扫描电子显微镜进行表征:在冷冻场发射扫描电镜(Zeiss Gemini SEM500FESEM)下分别观察CT26结肠癌细胞、微载体、微载体与CT26结肠癌细胞共培养后的形貌,如图2所示,可以看见微载体原本所具有的大孔3D结构变少,一部分被肿瘤细胞所占据,故微载体也可应用于肿瘤细胞培养。
激光共聚焦显微镜进行表征:分别收集与微载体共培养72h的CT26结肠癌细胞、4T1乳腺癌细胞和Hepa1-6肝癌细胞的混合悬液,经5%多聚甲醛固定10min后,PBS洗涤后,用FITC-鬼笔环肽和DAPI进行染色。转移至35mm的共聚焦小皿中并用激光共聚焦显微镜(C2+,Nikon)观察。如图3所示,可以看到,三种肿瘤细胞均能依附于微载体上生存,证明了微载体培养肿瘤细胞的可行性以及普适性。
实施例5, 评价微载体的生物相容性
体外细胞增值活力测定采用标准的Cell Counting Kit-8方法。即收获与微载体共培养后12h、24h、48h、72h以及96h时的混合悬液,待其静置沉降后,取100µL混合悬液转移至96孔板中,每孔加入10µL CCK-8溶液,用酶标仪(ELX800,BioTek)测定450nm处的吸光度。结果如图4所示,可以发现72h之前均呈现增长,且在72h吸光度达到最大,而由于微载体的培养面积有限以及培养体系中的营养物质的小号,故96h吸光度呈现下降的趋势。证明了微载体具有良好的生物相容性。
实施例6, R848和aOX40的体外释放
将实施例1中所制备得到的微载体支架疫苗溶解在2mL含5%(w/v)吐温-80的PBS中,将其转移至透析袋内,用封口夹将透析袋封端。随后将透析袋浸于装有30mL含5%(w/v)吐温-80的PBS的离心管中。置于震荡培养箱中孵育(37℃,120rpm),在预设的时间点,分别从离心管中取出1.5mL溶液到ep管中,并补充等量的释放介质。R848药物释放浓度的检测通过紫外可见分光光度计(Lambda750)检测λ=320nm波长处的吸光度,IgG-FITC药物释放浓度的检测则通过微孔板检测仪(Cytation3)检测。实验测定前先分别测定R848于IgG-FITC药物在溶液中浓度与吸光度的标准曲线。
结果如图5所示,可以发现,通过将微载体与R848与IgG-FITC混进行物理混合吸附后,对R848与IgG-FITC的释放具有一定的缓释作用,这种缓释作用确保了应用到机体内能够对机体部位的免疫细胞进行持续的激活。
实施例7 ,微载体支架疫苗的体内降解分析
将实施例1中所制备得到的微载体支架疫苗溶解在PBS中,在靠近小鼠腋下的部位皮下注射200µL的疫苗制剂,注射部位会形成一个隆起的结节,监测并记录不同时间点所形成的结节的体积。
结果如图6所示,皮下结节的体积起初会呈现短暂的体积增长趋势,推测微载体支架疫苗在注射部位招募了免疫细胞,使得体积呈现短暂的增加趋势。而随着时间的延长,所引起的结节变小,微载体支架疫苗逐渐在体内降解,大约25天,结节消失,微载体支架疫苗具有良好的生物相容性,可以在机体内缓慢降解。
实施例8 ,微载体支架疫苗在注射部位招募免疫细胞
将实施例1中所制备得到的微载体支架疫苗溶解在PBS中,在靠近小鼠腋下的部位皮下注射200µL的疫苗制剂。分别在注射后第一天、第三天和第六天,取下一定大小的注射部位,剪切消化处理制备成单细胞悬液进行进一步分析,将悬浮液中的红细胞完全裂解后,用抗体染色剩余细胞并用流式细胞仪(BD Fortessa)检测分析。APC-Cy7 CD45用于标记募集的白细胞。FITC-CD3、PE-Cy7-CD4、APC-CD8、BV786-NK1.1用于标记微载体支架中的T细胞和NK细胞,PE-CD11b、APC-R700-F4/80、BV650-Ly6C、BV421-Ly6G、BB700-MHC I-A/I-E、BV605-CD11c等分析微载体支架疫苗中的巨噬细胞、树突状细胞、单核细胞和中性粒细胞等。
结果如图7所示,微载体支架疫苗组比空白微载体疫苗组更能招募免疫细胞,且招募的具有细胞毒作用的CD8
实施例9 ,微载体支架疫苗的体内免疫治疗效果
取对数生长期的CT26细胞,用胰酶消化后收集细胞,调整细胞浓度为1×10
结果如图8所示,可以发现经微载体支架疫苗组免疫后的小鼠的肿瘤生长均较其他组更慢,且瘤体积小,表现出最佳的的抑瘤效果。
