一种用于评估CD8
文献发布时间:2023-06-19 19:35:22
技术领域
本发明属于生物技术领域,涉及一种用于评估CD8+T细胞功能的标志物及其应用。
背景技术
T细胞耗竭是指常见慢性感染和癌症患者体内T细胞功能丧失。由于长期暴露于持续性抗原和炎症,T细胞逐渐失去效应功能,记忆T细胞特征也开始缺失,抑制性受体(IRS)表达增高且持续,表观遗传和转录谱改变,代谢方式改变,不过这种耗竭是可以逆转的,至少部分逆转,这主要通过阻止PD-1之类的抑制性通路。现有技术对CD8+T细胞功能主要集中在表型评估,评估角度单一,准确性差。
CN108531544A公开了一种miR-181b靶基因筛选的方法,所述方法利用引物RUNX1在PCR条件下进行扩增,得到确定的PCR产物为RUNX1基因3'UTR区的序列;然后构建双荧光素酶报告系统,检测荧光素酶活性,初步鉴定miR-181b的靶基因;采用RT-qPCR法检测miR-181b对RUNX1基因在mRNA水平的影响;采用Western-blot法检测miR-181b对RUNX1基因在蛋白水平的影响。明确了RUNX1 3'UTR区存在与miR-181b的结合位点,利用现代分子生物技术验证了miR-181b与靶基因RUNX1的靶向调控关系,miR-181b可以抑制RUNX1基因在mRNA和蛋白水平上的表达,明确了RUNX1是miR-181b的目标靶基因。
CN113677994A公开了一种用于评估T细胞功能和预测对疗法的应答的方法和药剂,所述方法为在T细胞中检测EOMES的核定位序列和/或DNA结合基序中的翻译后修饰,包括检测T细胞中EOMES-641K、EOMES-641K-Me、EOMES-373K-Me的乙酰化、甲基化或检测在T细胞中细胞核与细胞质定位的比率或细胞质与细胞核定位的比率来评估T细胞功能,但此方法存在操作复杂,成本较高等问题。
综上所述,开发新型有效的评估T细胞功能的标志物,有助于扩充T细胞功能的评估标准,对于T细胞功能的评估及癌症治疗领域具有重要的意义。
发明内容
针对现有技术的不足和实际需求,本发明提供一种用于评估CD8
为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供了一种用于评估CD8
发明首次发现在CD8
第二方面,本发明提供了第一方面所述的用于评估CD8
优选地,所述检测试剂包括RNA提取试剂、RNA逆转录试剂、定量PCR检测试剂或流式细胞分析抗体中任意一种或至少两种的组合。
优选地,所述RNA提取试剂包括:Trizol、三氯甲烷、异丙醇、无水乙醇、75%乙醇或无酶水中任意一种或至少两种的组合。
优选地,所述流式细胞分析抗体包括:CD8、CD69、CCR7、CD45RA、IL-2、IFN-γ或TNF-α中的任意一种或至少两种的组合。
第三方面,本发明提供了一种用于评估CD8
优选地,所述产品包括制剂、核酸膜条、芯片或试剂盒。
第四方面,本发明提供了第一方面所述的用于评估CD8
第五方面,本发明提供了一种评估CD8
检测待测样本中第一方面所述的用于评估CD8
根据第一方面所述的用于评估CD8
优选地,所述评估CD8
通过多色流式分析的方法检测CD8
优选地,所述待测样本包括脐带血来源的CD8
优选地,所述方法可用于非疾病诊断目的的应用,具体应用内容包括:评估用于科研实验用的脐带血或成人外周血来源的CD8
第六方面,本发明提供了第一方面所述的用于评估CD8
优选地,所述筛选包括基于候选制剂使用前和使用后对第一方面所述的用于评估CD8
与现有技术相比,本发明具有如下有益效果:
本发明首次检测到脐带血来源CD8+T细胞中与评估CD8
附图说明
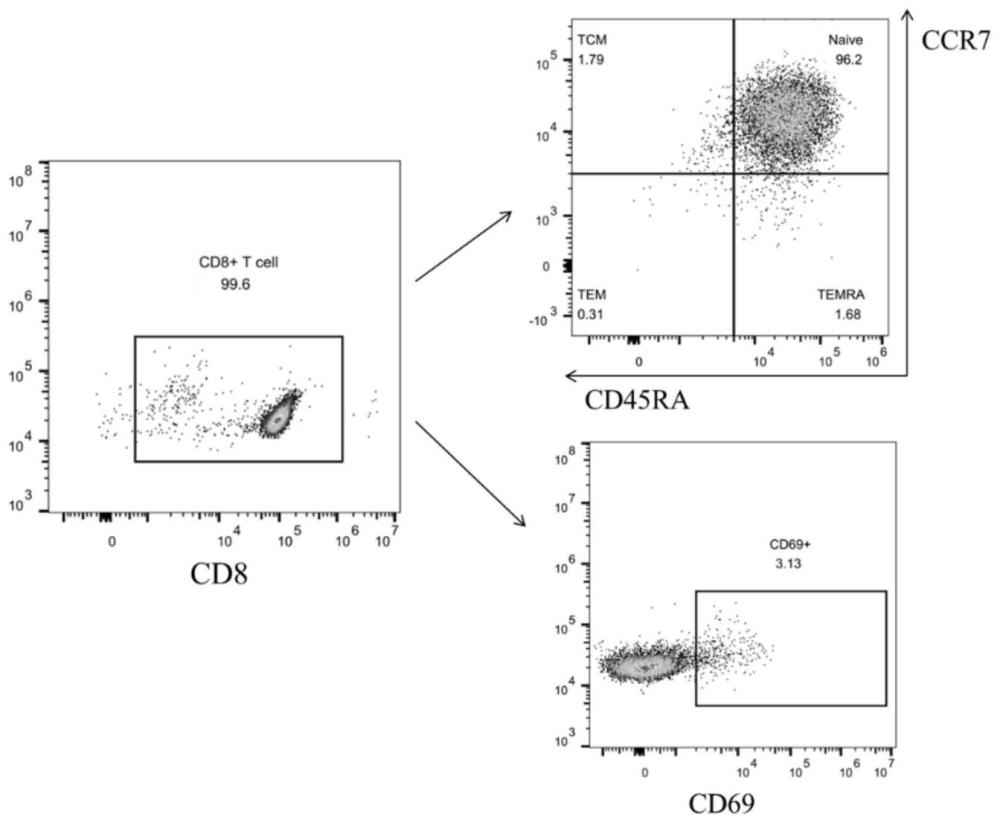
图1为流式细胞分析CD8
图2为流式细胞分析CD8
图3A为CD8
图3B为激活NFAT2后CD8
图4A为激活NFAT2后CD8
图4B为激活NFAT2后CD8
图5A为激活NFAT2后CD8
图5B为激活NFAT2后CD8
图6A为激活NFAT2后CD8
图6B为激活NFAT2后CD8
图7A为激活NFAT2后CD8
图7B为激活NFAT2后CD8
图8A为激活NFAT2后CD8
图8B为激活NFAT2后CD8
图9A为抑制了NFAT2激活的CD8
图9B为抑制了NFAT2激活的CD8
图10A为抑制了NFAT2激活的CD8
图10B为抑制了NFAT2激活的CD8
图11A为抑制了NFAT2激活的CD8
图11B为抑制了NFAT2激活的CD8
图12A为抑制了NFAT2激活的CD8
图12B为抑制了NFAT2激活的CD8
图13A为抑制了NFAT2激活的CD8
图13B为抑制了NFAT2激活的CD8
图14A为AML病人和健康人CD8
图14B为AML病人CD8
图14C.为抑制miR-20a的脐带血来源CD8
图15A为数据库数据预测可能调控PD-1,Tim3,TIGIT和CLTA-4的转录因子与miR-20a-5p的潜在靶基因交叉分析结果图;
图15B为数据库数据预测的18个转录因子中有5个转录因子同时调控PD-1,Tim3,TIGIT和CLTA-4示意图;
图15C为抑制miR-20a的脐带血来源CD8
图15D为AML病人和健康人CD8
图16A为RUNX1慢病毒诱导表达载体构建示意图;
图16B为流式细胞分析Doxcycline处理诱导经过慢病毒感染的Jurkat细胞中GFP表达情况统计图;
图16C为流式细胞分析GFP阳性细胞亚群中PD-1的平均荧光强度统计图。
具体实施方式
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
实施例1
本实施例采用体外培养的方法,新鲜脐带血经过淋巴细胞分离液和密度梯度离心处理后获得单个核细胞,经过德国MiltenyiBiotec公司的CD8
图3A和图3B结果显示,佛波酯/离子霉素处理激活NFAT2可引起幼稚细胞比例减少,即激活NFAT2可以促进CD8
实施例2
本实施例通过调控miR-20a-5p的表达观察对NFAT2激活促进的CD8
图9A和图9B结果显示在佛波酯/离子霉素处理激活NFAT2的CD8
实施例3
本实施例通过转录组测序,生物信息学分析和定量PCR,对比急性髓系白血病(AML)患者CD8
进一步通过构建Doxcycline(DOX)诱导表达的RUNX1慢病毒表达载体(图16A),包装慢病毒后,感染Jurkat细胞(可一定程度模拟人T细胞),通过在培养基中添加不同浓度的Doxcycline,流式细胞分析检测GFP表达情况及GFP阳性亚群中PD-1表达的情况,图16B和图16C结果显示,Doxcycline处理诱导RUNX1表达后,RUNX1过表达组(RUNX1 UP)中PD-1阳性细胞比例和PD-1平均荧光强度较对照组(RUNX1 CK)均显著上调。这也进一步证实RUNX1高表达可能通过上调PD-1等免疫检查点介导脐带血CD8
综上所述,本发明首次发现在脐带血CD8
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
