生物流体分离装置
文献发布时间:2023-06-19 09:57:26
相关申请的交叉参考
本申请要求于2019年6月7日提交的题为“Biological Fluid SeparationDevice”的美国临时申请序列号62/681,894的优先权,其全部公开内容以引用方式并入本文。
背景技术
1.技术领域
本公开总体上涉及适于与生物流体一起使用的装置。更具体地,本公开涉及适于分离生物流体的组分的装置。
2.背景技术
采血是常见的卫生保健程序,涉及从患者身上抽取至少一滴血液。通常通过手指针刺、脚后跟针刺或静脉穿刺从住院、家庭护理和急诊室患者身上采集血液样本。也可以通过静脉管或动脉管从患者身上采集血液样本。一旦收集,就可以分析血液样本以获得医学上有用的信息,包括例如化学成分、血液病或凝结。
血液检验确定了患者的生理和生化状态,诸如疾病、矿物质含量、药物有效性和器官功能。血液检验可以在临床实验室或在患者附近的护理点进行。护理点血液检验的一个示例是对患者的血糖水平的常规检验,所述检验涉及经由手指针刺抽出血液并将血液机械收集到诊断盒中。之后,诊断盒分析血液样本,并且为临床医生提供患者的血糖水平读数。分析血液气体电解质水平、锂水平和钙离子水平的其他装置也是可用的。一些其他护理点装置识别急性冠脉综合征(ACS)和深静脉血栓形成/肺栓塞(DVT/PE)的标志物。
血液样本包含全血或细胞部分和血浆部分。从全血中血浆分离传统上是通过离心来实现的,离心通常需要15至20分钟,并且涉及繁重的劳动或复杂的工作流程。近来,已经使用或尝试分离血浆的其他技术,诸如沉降、纤维或非纤维膜过滤、侧流分离、微流控错流过滤以及其他微流控流体动力分离技术。然而,这些技术中的许多者具有各种挑战,这些挑战包括不良的血浆纯度、分析物偏向(analyte bias)或需要特定涂层来防止分析物偏向、高溶血、需要稀释、分离时间长和/或难以回收血浆。例如,大多数基于膜的分离技术都存在分析物偏向问题,并且经常需要对目标分析物进行特定涂层处理。另外,当装置通过针直接连接到患者时发生的常规分离技术会引起患者不适。
发明内容
本公开提供了一种将血液收集过程与血浆分离过程分开并分离的血液分离装置。血液分离装置包括样本收集模块、激活模块和分离模块。因为在血液分离装置与患者断开连接之后进行血浆分离,所以该装置的性能不再受患者血压和针规的影响,并且极大地减轻了患者的不适。
本公开提供了一种血液分离装置和一种分离方法,该分离方法与静脉血液收集工作流程完全兼容而无需离心和动力。有利地,本公开的血液分离装置允许在临床抽血期间立即分离血浆,并且能够将所分离血浆样本收集在独立的血浆容器中以用于下游诊断。
此外,本公开的血液分离装置提供了仅需要较短的患者身体收集时间的分离装置,该分离装置与使用真空管的常规血液收集装置(诸如可从Becton,Dickinson andCompany公司商购获得的BD
因为本公开的血液分离装置使血液收集过程与血浆分离过程分开和分离,所以所生成血浆的体积不再受能够允许的患者身体收集血液的时间限制。这能够将本公开的血液分离装置潜在地用于护理点以外的其他大体积血浆应用场合。
此外,将分离与收集过程分开的另一益处在于,分离时间、血浆质量和产率不再受针规和患者血压的影响。如果在通过针将装置直接连接到患者时进行分离,则较低的针规和较高的患者血压会减少分离时间、降低产率量并增加溶血,而较高的针规和较低的患者血压会增加分离时间、提高产率并减少溶血。通过使用本公开的血液分离装置将血浆分离过程与血液收集工作流程隔离,血液收集套件和患者血压将仅影响血液收集时间,而不会改变分离时间、产率和溶血水平。
根据本发明的实施例,一种适于接收具有第一相和第二相的血液样本的血液分离装置包括:样本收集模块,所述样本收集模块具有限定收集腔室的壳体;激活模块,所述激活模块连接到所述样本收集模块,所述激活模块具有用于密封所述壳体的第一密封件和第二密封件,所述第一密封件能够通过所述激活模块的一部分的致动从闭合位置转变到打开位置,在所述闭合位置中,所述收集腔室具有第一压力,在所述打开位置中,所述收集腔室与大于所述第一压力的第二压力流体连通;以及分离模块,所述分离模块与所述样本收集模块的收集腔室流体连通,所述分离模块限定具有第一容积的第一腔室和具有第二容积的第二腔室、并且包括设置在所述第一腔室与所述第二腔室之间的分离构件,其中所述第一容积和所述第二容积是不同的。
在一种构型中,所述激活模块包括开关,其中所述开关的致动将所述第一密封件转变到所述打开位置。在一种构型中,所述开关包括按钮和穿刺部分,所述按钮限定穿过其中的通气孔,其中所述开关的致动使所述穿刺部分移动以破坏所述第一密封件,从而将所述第一密封件转变到所述打开位置。在又一种构型中,在所述第一密封件处于所述打开位置的情况下,所述样本收集模块的收集腔室经由所述开关的通气孔与所述第二压力流体连通。在一种构型中,所述第二密封件包括帽,所述帽在所述帽的一部分内具有可刺穿的自密封塞。在另一种构型中,所述血液分离装置能够经由所述帽连接到血液收集装置。在又一种构型中,所述激活模块限定入口通道,并且其中在所述血液收集装置经由所述帽连接到所述血液分离装置的情况下,所述收集腔室经由所述入口通道接收所述血液样本。在一种构型中,所述收集腔室包括入口端和出口端,并且限定多个顺序流方向交替收集通道。在另一种构型中,所述收集腔室包括入口端和出口端,并且限定:第一收集通道,所述第一收集通道从所述入口端延伸到所述出口端;第二收集通道,所述第二收集通道与所述第一收集通道的一部分连通并从所述出口端延伸到所述入口端;以及第三收集通道,所述第三收集通道与所述第二收集通道的一部分连通并从所述入口端延伸到所述出口端。在又一种构型中,所述收集通道的入口端与所述激活模块的入口通道流体连通。在一种构型中,所述血液样本沿第一方向行进穿过所述第一收集通道,所述血液样本沿与所述第一方向相反的第二方向行进穿过所述第二收集通道,并且所述血液样本沿与所述第二方向相反的第三方向行进穿过所述第三收集通道。在另一种构型中,所述第一收集通道与所述第二收集通道隔开,所述第二收集通道与所述第三收集通道隔开。在又一种构型中,所述第一腔室包括第一腔室入口和第一腔室出口,并且所述第二腔室包括第二腔室出口。在一种构型中,所述第一腔室入口与所述收集通道的出口端流体连通。在另一种构型中,在所述第一密封件处于所述打开位置的情况下,由大气压力限定的所述第二压力与在所述收集腔室内限定的所述第一压力之间的第一压力差将所述血液样本抽吸到所述第一腔室中。在又一种构型中,在所述第一密封件处于所述打开位置的情况下,所述第一容积和所述第二容积是不同的,从而在所述第一腔室与所述第二腔室之间提供第二压力差,以驱动所述血液样本的第二相穿过所述分离构件进入所述第二腔室。在一种构型中,所述分离构件将所述第一相捕获在所述第一腔室中,并允许所述第二相穿过所述分离构件进入所述第二腔室。在另一种构型中,所述血液分离装置包括与所述第二腔室出口连通的第二相收集容器,其中所述第二相收集容器接收所述第二相。在又一种构型中,所述血液分离装置包括与所述第一腔室出口连通的血液样本丢弃腔室,其中所述血液样本丢弃腔室接收所述第一相。在一种构型中,所述分离构件包括轨迹蚀刻膜。在又一种构型中,在所述血液收集装置经由所述帽连接到所述血液分离装置的情况下,所述收集腔室经由所述入口通道接收所述血液样本。在又一种构型中,在所述血液收集装置与所述血液分离装置断开连接的情况下,并且其中在致动所述开关以将所述第一密封件转变到所述打开位置时,由大气压力限定的所述第二压力与在所述收集腔室内限定的所述第一压力之间的所述第一压力差将所述血液样本抽吸到所述第一腔室中。在又一种构型中,在所述第一密封件处于所述打开位置的情况下,所述第一容积和所述第二容积是不同的,从而在所述第一腔室与所述第二腔室之间提供第二压力差,以驱动所述血液样本的第二相穿过所述分离构件进入所述第二腔室。在另一种构型中,在所述第二相被容纳在所述第二相收集容器内的情况下,所述第二相收集容器能够从所述血液分离装置移除。在又一种构型中,所述第一相是细胞部分,并且所述第二相是血浆部分。
附图说明
通过参考下面结合附图对本公开的实施例的描述,本公开的上述和其他特征和优点以及实现它们的方式将变得更加显而易见,并且将更好地理解本公开本身,其中:
图1是根据本发明的实施例的血液分离装置的立体图。
图2是根据本发明的实施例的血液分离装置的分解立体图。
图3是根据本发明的实施例的使用本公开的系统的第一步骤的立体图。
图4是根据本发明的实施例的使用本公开的系统的第二步骤的立体图。
图5是根据本发明的实施例的使用本公开的系统的第三步骤的立体图,其示出了本公开的装置独立于装置取向而分离血浆。
图6是根据本发明的实施例的使用本公开的系统的第四步骤的立体图。
图7A是根据本发明的实施例的处于闭合位置的血液分离装置的激活模块的立体图。
图7B是根据本发明的实施例的图7A的激活模块的截面图。
图8A是根据本发明的实施例的处于打开位置的血液分离装置的激活模块的立体图。
图8B是根据本发明的实施例的图8A的激活模块的截面图。
图9是根据本发明的实施例的血液分离装置的收集腔室的立体图。
图10是根据本发明的另一实施例的血液分离装置的收集腔室的立体图。
图11是根据本发明的实施例的血液分离装置的立体图。
图12是根据本发明的实施例的血液分离装置的分离模块的一部分的立体图。
图13是根据本发明的实施例的血液分离装置的立体图。
对应的参考符号在若干视图中表示对应的零件。本文陈述的范例说明本公开的示例性实施例,并且此类范例不应被解释为以任何方式限制本公开的范围。
具体实施方式
提供以下描述以使得本领域技术人员能够制造和使用预期用于实施本发明的所述实施例。然而,对于本领域技术人员而言,各种修改、等同、变化和替代将保持显而易见。任何和所有此类修改、变化、等同和替换旨在落入本发明的精神和范围内。
为了下文描述的目的,术语“上部”、“下部”、“右”、“左”、“垂直”、“水平”、“顶部”、“底部”、“侧向”、“纵向”及其派生词应与本发明在附图中的取向有关。然而,应当理解,除非其中明确相反地指出,否则本发明可以假定替代变型和步骤顺序。还应理解,附图中示出并在以下说明书中描述的特定设备和过程仅是本发明的示例性实施例。因此,与本文所公开的实施例有关的特定尺寸和其他物理特性不应被认为是限制性的。
图1和图2示出了本公开的血液分离装置的示例性实施例。参见图1和图2,本公开的血液分离装置10适于接收生物流体,诸如具有第一相14和第二相16的血液样本12(图3至图6)。血液样本12的第一相14是细胞部分,并且血液样本12的第二相16是血浆部分。
本公开的血液分离装置10将血液收集过程与血浆分离过程分开并分离。因为在血液分离装置10与患者断开连接之后进行血浆分离,所以该装置的性能不再受患者血压和针规的影响,并且极大地减轻了患者的不适。
因为本公开的血液分离装置10将血液收集过程与血浆分离过程分开并分离,所以所生成血浆的体积不再受能容许的患者身体收集血液的时间限制。这能够将本公开的血液分离装置10潜在地用于护理点以外的其他大体积血浆应用场合。
本公开提供了一种血液分离装置10和一种分离方法,该分离方法与静脉血液收集工作流程完全兼容而无需离心和动力。有利地,本公开的血液分离装置10允许在临床抽血期间在装置10离开患者的情况下立即分离血浆,并且能够将所分离的血浆16样本收集在独立的血浆容器(例如,第二相或血浆收集容器80)中以用于下游诊断。
此外,本公开的血液分离装置10提供了仅需要较短的患者身体收集时间的分离装置,该分离装置与使用真空管的常规血液收集装置(诸如可从Becton,Dickinson andCompany公司商购获得的BD
此外,将血浆分离过程与收集过程分开的另一益处在于,分离时间、血浆质量和产率不再受针规和患者血压的影响。如果在将装置通过针直接连接到患者时发生血浆分离过程,则较低的针规和较高的患者血压会减少分离时间、降低产率量并增加溶血,而较高的针规和较低的患者血压会增加分离时间、提高产率并减少溶血。通过使用本公开的血液分离装置10将血浆分离过程与血液收集过程隔离,血液收集套件和患者血压将仅影响血液收集时间,而不会改变分离时间、产率和溶血水平。
参见图1至图13,在示例性实施例中,血液分离装置10通常包括样本收集模块20、激活模块22和分离模块24。在一个实施例中,在收集血液样本12之后,血液分离装置10能够将血液样本12的第二相16与血液样本12的第一相14分离,如下文更详细地描述。有利地,血液分离装置10将血液收集过程与血浆分离过程分开并分离。在一个实施例中,在血浆分离之后,从血液分离装置10可移除的一部分(例如,第二相收集容器80)能够将血液样本12的第二相16转移至护理点检验装置。
参见图1至图6和图9至图11,在示例性实施例中,样本收集模块20包括限定收集腔室32的壳体30。在一个实施例中,收集腔室32包括入口端或入口34和出口端或出口36,并且限定多个顺序流方向交替收集通道38。
收集腔室32利用多个互连平行通道38,以在血液收集套件的受约束直径内最大化收集和储存空间,并且还确保在填充期间毛细作用力超过重力占主导。如图9至图11所示,血液样本12以往复运动填充样本收集模块20的互连通道38。
例如,参见图9,在第一示例性实施例中,样本收集模块20的收集腔室32限定:第一收集通道40,该第一收集通道从入口端34延伸到出口端36;第二收集通道42,该第二收集通道与第一收集通道40的一部分连通并从出口端36延伸到入口端34;以及第三收集通道44,该第三收集通道与第二收集通道42的一部分连通并从入口端34延伸到出口端36。参见图9,第一收集通道40与第二收集通道42隔开,该第二收集通道与第三收集通道44隔开。
以此方式,参见图9中指示血液样本12通过收集腔室32的通道38的流动路径100的箭头,收集到收集腔室32中的血液样本12沿第一方向行进穿过第一收集通道40,血液样本12沿与第一方向相反的第二方向行进穿过第二收集通道42,并且血液样本12沿与第二方向相反的第三方向行进穿过第三收集通道44。参见图9,收集腔室32利用多个互连平行通道38,以在血液收集套件的受约束直径内最大化收集和储存空间,并且还确保在填充期间毛细作用力超过重力占主导。
在一个实施例中,进入收集腔室32的进口是第一收集通道40的入口34,而离开收集腔室32的出口是第三收集通道44的出口36。第一收集通道40的入口34与激活模块22的入口通道66(图7B和图8B)流体连通,如下文更详细地描述。
参见图10,在第二示例性实施例中,样品收集模块20的收集腔室32限定:第一收集通道40,该第一收集通道从入口端34延伸到出口端36;第二收集通道42,该第二收集通道与第一收集通道40的一部分连通并从出口端36延伸到入口端34;第三收集通道44,该第三收集通道与第二收集通道42的一部分连通并从入口端34延伸到出口端36;第四收集通道46,该第四收集通道与第三收集通道44的一部分连通并从出口端36延伸到入口端34;以及第五收集通道48,该第五收集通道与第四收集通道46的一部分连通并从入口端34延伸到出口端36。参见图10,第一收集通道40与第二收集通道42隔开,该第二收集通道与第三收集通道44隔开,该第三收集通道与第四收集通道46隔开,该第四收集通道与第五收集通道48隔开。
以此方式,收集到收集腔室32中的血液样本12沿第一方向行进穿过第一收集通道40,血液样本12沿与第一方向相反的第二方向行进穿过第二收集通道42,血液样本12沿与第二方向相反的第三方向行进穿过第三收集通道44,血液样本12沿与第三方向相反的第四方向上通过第四收集通道46,并且血液样本12沿与第四方向相反的第五方向行进穿过第五收集通道48。参见图10,收集腔室32利用多个互连平行通道38,以在血液收集套件的受约束直径内最大化收集和储存空间,并且还确保在填充期间毛细作用力超过重力占主导。
在一个实施例中,进入收集腔室32的进口是第一收集通道40的入口34,而离开收集腔室32的出口是第五收集通道48的出口36。第一收集通道40的入口34与激活模块22的入口通道66(图7B和图8B)流体连通,如下文更详细地描述。
在其他示例性实施例中,样本收集模块20的收集腔室32可基于特定体积要求限定任何奇数个通道38。重要的是,样本收集模块20的收集腔室32利用多个互连平行通道38,以在血液收集套件的受约束直径内最大化收集和储存空间,并且还确保在填充期间毛细作用力超过重力占主导。如上所述,血液样本12以往复运动填充样本收集模块20的互连通道38。
在一个示例性实施例中,如图9和图10所示,多个顺序流方向交替收集通道38被构造成平行构型。在其他示例性实施例中,收集通道38被构造成螺旋形或曲折形通道构型、或在血液收集套件的受约束直径内最大化收集和储存空间并还确保在填充期间毛细作用力超过重力占主导的其他构型。
在示例性实施例中,收集腔室32被设计为确保无论装置取向和血液流率如何,血液12都连续地填充收集腔室32的通道38而不捕获气泡。这通过控制用于期望应用场合的通道38的直径来实现。例如,在示例性实施例中,为了防止血流破裂(breaking up)并捕获气泡,通道38的直径需要同时满足两个要求。首先,在任何取向的流动前沿处的静压差都必须小于拉普拉斯压力,以使弯液面保持其形状。其次,所选择直径需要确保惯性力小于最高流率下的表面张力。
参见图1、图2和图7A至图8B,在示例性实施例中,激活模块22连接到或可连接到样本收集模块20,并且包括壳体49、第一密封件50和第二密封件52以用于密封血液分离装置10,例如样本收集模块20的壳体30、激活模块22的壳体49和分离模块24的壳体68。以此方式,激活模块22的密封件50、52控制血液分离装置10内的压力,如下文更详细地描述。第一密封件50可通过致动激活模块22的一部分而从闭合位置(图7A和图7B)转变到打开位置(图8A和图8B),在该闭合位置中,收集腔室32具有第一压力P1(图13),在该打开位置中,收集腔室32与大于第一压力P1的第二压力P2(图13)流体连通。
在示例性实施例中,参见图7A至图8B,激活模块22包括开关54。在这样的实施例中,开关54的致动使第一密封件50从闭合位置(图7A和图7B)转变到打开位置(图8A和图8B)。参见图7A至图8B,开关54包括按钮56和穿刺部分60,该按钮限定穿过其中的通气孔58。以此方式,开关的致动(例如,将按钮56按下或推入图8A和图8B所示的位置中)使穿刺部分60移动以破坏第一密封件50,从而将第一密封件50转变到打开位置。
在第一密封件50处于打开位置的情况下,样本收集模块20的收集腔室32经由开关54的通气孔58与第二压力P2流体连通。通气孔58为血液分离装置10提供通气机构。例如,在一个实施例中,穿刺部分60破坏第一密封件50(例如铝箔密封件),以形成通气口从而为血浆分离过程提供动力。
由大气压力限定的第二压力P2大于在血液分离装置10(例如,样本收集模块20的收集腔室32)内限定的第一压力P1。以此方式,由大气压力限定的第二压力P2与血液分离装置10中的残余真空(即,在血液分离装置10内限定的第一压力P1)之间的压力差连续地驱动血浆分离过程,如下文更详细地描述。有利地,使用本公开的激活模块22,使用者可以精确地控制血浆分离过程何时开始。
在示例性实施例中,参见图7A至图8B,激活模块22的第二密封件52包括帽62,该帽在帽62的一部分内具有可刺穿的自密封塞64。帽62提供了允许血液分离装置10可连接到血液收集装置200(图3)的机构,如下文更详细地描述。
在一个示例性实施例中,本公开的帽62可以形成为基本上与在2018年5月4日提交的题为“Closure for a Biological Fluid Collection Device”的美国临时申请62/666,765中描述的封闭件类似,该申请的全部公开内容以引用方式明确地并入本文。
参见图7A至图8B,在一个实施例中,激活模块22限定入口通道66。参见图3,在血液收集装置200经由帽62连接到血液分离装置10的情况下,样本收集模块20的收集腔室32经由入口通道66接收血液样本12。血液样本12从激活模块22的入口通道66经由入口34流动到收集腔室32的多个通道38。
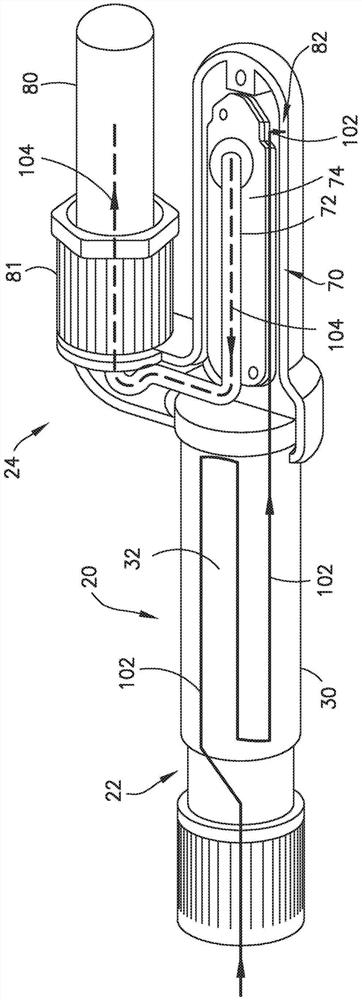
参见图1至图6和图11至图13,在示例性实施例中,分离模块24与样本收集模块20的收集腔室32流体连通,并且包括壳体68、并限定具有第一容积V1(图13)的第一腔室70和具有第二容积V2(图13)的第二腔室72,并且包括设置在第一腔室70与第二腔室72之间的分离构件74。第一腔室70的第一容积V1和第二腔室72的第二容积V2不同,以在第一腔室70与第二腔室72之间产生第二压力差,以驱动血液样本12的第二相16穿过分离构件74进入第二腔室72,如下文更详细地描述。在一个实施例中,分离模块24的一部分形成微流控芯片。
参见图11和图12,在示例性实施例中,分离构件74将第一相14捕获在第一腔室70中,并且允许第二相16穿过分离构件74进入第二腔室72。在一个实施例中,分离构件74包括轨迹蚀刻膜。在某些构型中,膜的厚度可以小于100微米,诸如厚度为5至25微米。膜可具有亚微米的孔隙或孔,诸如直径为0.2至0.8微米。该尺寸允许对平行于膜表面流动的血液样本的血浆部分进行连续过滤,从而防止了膜孔隙或孔的堵塞。在其他实施例中,分离构件74可以包括能够将第一相14捕获在第一腔室70中并且允许第二相16穿过分离构件74进入第二腔室72的任何过滤器和/或任何其他分离装置。
参见图11和图12,第一腔室70包括第一腔室入口75和第一腔室出口76,并且第二腔室72包括第二腔室出口78。第一腔室入口75与收集通道38的出口36流体连通。以此方式,在致动激活模块22的一部分时,血液样本12可从样本收集模块20的收集腔室32流动到分离模块24的第一腔室70以进行血浆分离。
参见图1至图6、图11和图13,血液分离装置10的分离模块24包括与第二腔室出口78连通的第二相收集容器80。第二相收集容器80接收血液样本12的第二相16。第二相收集容器80能够收集并储存分离的第二相16。有利地,参见图6,在第二相16被容纳在第二相收集容器80内的情况下,第二相收集容器80可从血液分离装置10移除。以此方式,血液样本12的第二相16可以被收集或储存在辅助第二相容器(例如,第二相收集容器80)中以用于进一步的诊断检验。例如,在分离之后,在第二相收集容器80从血液分离装置10移除的情况下,第二相收集容器80能够将血液样本12的第二相16转移到护理点检验装置或其他检验装置。在示例性实施例中,第二相收集容器80包括允许第二相收集容器80在需要时分配血浆16的一部分的结构。在一个实施例中,第二相收集容器80经由帽或隔膜81密封,以将血浆部分16保护性地密封在第二相收集容器80内。
参见图11,在示例性实施例中,分离模块24的第二腔室72的一部分与第二相收集容器80的内部流体连通,以允许血浆部分16穿过分离构件74和第二腔室72流入第二相收集容器80的内部,以用于收集。
参见图11至图13,血液分离装置10的分离模块24还包括与第一腔室出口76连通的血液样本丢弃腔室82。在血液样本12流经第一腔室70中的分离构件74之后,血液样本丢弃腔室82接收血液样本12的剩余的第一相14。以此方式,血液样本12的剩余的第一相14可以被收集并储存在血液样本丢弃腔室82中。另外,血液样本丢弃腔室82确保当在使用之后丢弃血液分离装置10的其余部分时,可以安全地储存血液样本12的剩余的第一相14。
参见图3至图6,现在将描述本公开的血液分离装置10的使用。
参见图3,使用本公开的血液分离装置10的第一步骤涉及从患者收集血液样本12,例如血液收集过程。例如,首先,在将血液分离装置10连接到血液收集装置200(诸如管保持器202)之后,立即在真空力下将来自患者的给定体积的血液样本12拉入血液分离装置10的收集腔室32中。在一个实施例中,这种连接件包括刺穿帽的塞64(图7B)的管保持器202的非患者针(未示出)。管保持器202的管线204的相对端包括与患者连通的静脉进入套件的患者针。
参见图3,在血液收集装置200的管保持器202经由帽62连接到血液分离装置10的情况下(图7B),样本收集模块20的收集腔室32经由激活模块22的入口通道66(图7B)接收血液样本12。本公开的血液分离装置10收集并储存固定量的患者血液。在一个示例性实施例中,本公开的血液分离装置10在少于30秒内收集并储存3mL的患者血液。
血液样本12流过激活模块22的入口通道66到达样本收集模块20的收集腔室32。有利地,在血液收集期间,收集腔室32的多个顺序流方向交替收集通道38在血液收集套件的受约束直径内最大化收集和储存空间,并且还确保在填充期间毛细作用力超过重力占主导。
使用者可以选择血液分离装置10能够接收血液样本12的多种方式、来源或方法中的一种。例如,参见图3,本公开的血液分离装置10能够从常规血液收集装置200接收血液样本12。例如,血液收集装置200可以包括管保持器202和对应的静脉进入套件(诸如可从Becton,Dickinson and Company公司商购获得的BD
一旦将所需量的血液样本12收集到收集腔室32中并且完成了血液收集过程,就将血液分离装置10与血液收集装置200断开连接。以此方式,本公开的血液分离装置10将血液收集过程与血浆分离过程分开并分离。因为在血液分离装置10与患者断开连接之后发生血浆分离,所以该装置的性能不再受患者血压和针规的影响,并且极大地减轻了患者的不适。
在将本公开的血液分离装置10与血液收集装置200和患者断开连接时,所收集的血液在通道38中保持静止,直到启动血浆分离为止。血液分离装置10通过利用第二密封件52(例如帽62的塞64)来实现这一点。帽62的塞64确保在将血液收集装置200的针从塞64中抽出之后,第二密封件52被正确地重新密封,使得在血液分离装置10内所储存血液的前端和后端之间没有压力差。
参见图4,在将血液分离装置10与血液收集装置200断开连接之后,可以开始血浆分离过程。有利地,本公开的血液分离装置10不需要连接到患者以进行血浆分离。血浆分离过程是完全可控的,并且可以在方便且理想的时间开始。
参见图4,通过简单地致动血液分离装置10上的开关54(图8A和图8B)(例如,推动按钮56),在血液分离装置10离开患者的情况下开始血浆分离过程。开关54的致动允许血液分离装置10从储存在血液分离装置10内的血液样本12自动地生成血浆16。
开关54的致动将第一密封件50转变到打开位置(图8B),在该打开位置中,收集腔室32与由大气压力限定的第二压力P2流体连通,该第二压力大于在收集腔室32内限定的第一压力P1。以此方式,第一压力差(例如,由大气压力限定的第二压力P2与在收集腔室32内限定的第一压力P1之间的压力差)将血液样本12抽吸到分离模块24的第一腔室70中。换句话说,大气压力与血液分离装置10中的残余真空之间的第一压力差连续地驱动血液分离装置10内的血浆分离。在示例性实施例中,当血液样本12流过第一腔室70并流经分离构件74时,分离模块24允许通过利用微流控芯片(例如,分离模块24)中的错流过滤流模式进行连续血浆分离,如图12所示。在一种构型中,收集腔室32中的压力受到跨膜的最大允许压力差的限制,使得在血液收集之后且过滤之前的收集腔室32内的终点压力应小于5.5psi。
有利地,激活模块22在血液收集之后并且在血液分离装置10与血液收集装置200和患者断开连接的情况下开始血浆分离过程。为了在血液收集之后开始血浆分离过程,必须在收集腔室32内的所储存血液上重新建立压力梯度。这经由激活模块22控制血液分离装置10内的压力来完成。在激活之前,激活模块22的第一密封件50和第二密封件52密封血液分离装置10的壳体30,并且在第一密封件50处于闭合位置(图7B)的情况下,激活模块22将收集腔室32密封处于第一压力P1下。在激活模块22的激活之后,第一密封件50转变到打开位置(图8B),在该打开位置中,收集腔室32与由大气压力限定的第二压力P2流体连通,该第二压力大于在收集腔室32内限定的第一压力P1。
重要的是,在血液分离装置10内使用第二压力差来驱动血浆16穿过分离构件74进入第二腔室72,并被收集在第二相收集容器80中。在第一密封件50处于打开位置(图8B)中,分离模块24的第一腔室70的第一容积V1和分离模块24的第二腔室72的第二容积V2是不同的,从而在第一腔室70与第二腔室72之间提供第二压力差,以驱动血液样本12的第二相16穿过分离构件74进入第二腔室72并被收集在第二相收集容器80中。换句话说,在分离期间跨第一腔室70中的血液流动和第二腔室72中的血浆流动路径及其动态剖面(dynamicprofile)的第二压力差提供了进一步驱动血浆分离过程的动力源。在示例性实施例中,对于给定的血浆分离芯片(例如分离模块24),经由设置适当的初始真空水平并平衡血液样本丢弃腔室82和第二相收集容器80的体积比来控制跨第一腔室70中的血液流动和第二腔室72中的血浆流动路径及其动态剖面的第二压力差。在示例性实施例中,血液样本丢弃腔室82的容积被设计成确保该容积足够大,以在端部具有足够的残余真空以驱动血液流动而不会堵塞分离构件74。在示例性实施例中,该容积还需要足够小,以使得在分离结束时,血液样本丢弃腔室82中的压力高于第二相收集容器80中的压力,以防止分离构件74塌缩。在一种构型中,血液样本丢弃腔室82的容积至少是收集腔室32的容积的两倍,并且小于第二相收集容器80的容积乘以系数(1-产率)/产率。在过滤期间,跨膜的压力差始终需要小于5.5psi。
利用血液分离装置10内的第一压力差和第二压力差迫使血液12流过第一腔室70并流经分离构件74。当血液12流经分离模块24时,血浆16与血液样本12的第一相14连续分离。
在血浆分离期间,分离构件74允许第二相或血浆16穿过分离构件74进入第二腔室72,该第二相或血浆可被收集或储存在辅助血浆容器(例如,第二相收集容器80)中以用于进一步的诊断检验。参见图11,包括虚线的箭头指示血浆16在穿过分离构件74之后所采用的第二相流动路径104。在一个实施例中,在血浆分离之后,在第二相或血浆16被容纳在第二相收集容器80内的情况下,第二相收集容器80可从血液分离装置10移除。然后,第二相收集容器80可用于将血浆部分16转移到护理点检验装置或其他诊断检验系统。
在血浆分离期间,分离构件74将血液样本12的第一相14捕获在第一腔室70内,例如,血液样本12的第一相14不允许穿过分离构件74进入第二腔室72。参见图11,包括直线的箭头指示血液样本12穿过收集腔室32所采用的流动路径102和血液样本12的第一相14在经过分离构件74并到达血液样本丢弃腔室82之后所采用的流动路径102。参见图11和图12,血液样本12的第一相14通过第一腔室入口75流入第一腔室70中并流经分离构件74的表面,然后经由第一腔室出口76离开第一腔室70进入血液样本丢弃腔室82。
在一个示例性实施例中,本公开的血液分离装置10能够在小于7分钟的时间内从所储存的3mL血液中生成350至600uL的血浆16。
参见图5,本公开的血液分离装置10允许独立于血液分离装置10的取向而进行血浆分离。换句话说,不管血液分离装置10是否处于直立取向(例如,血液分离装置10被容纳在管架中)或者血液分离装置10是否位于桌子或托盘上的平面取向,血液分离装置10都分离血浆。
参见图6,在第二相或血浆16被容纳在第二相收集容器80内的情况下,第二相收集容器80可从血液分离装置10移除。然后,第二相收集容器80可用于将血浆部分16转移到护理点检验装置或其他诊断检验系统。在一个实施例中,第二相收集容器80经由鲁尔锁隔膜密封件可移除地连接到血液分离装置10。
换句话说,在血浆分离完成之后,将第二相收集容器80内的血浆16从血液分离装置10中移除以用于临床检验。然后可以将血液分离装置10的其余部分丢弃。
如本文所述,本公开提供了一种将血液收集过程与血浆分离过程分开并分离的血液分离装置。血液分离装置包括样本收集模块、激活模块和分离模块。因为在血液分离装置与患者断开连接之后发生血浆分离,所以该装置的性能不再受患者血压和针规的影响,并且极大地减轻了患者的不适。
虽然本公开已被描述为具有示例性设计,但是可在本公开的精神和范围内进一步修改本公开。因此,本申请旨在涵盖使用其一般原理的本公开的任何变化、使用或改编。此外,本申请旨在覆盖本公开的此类偏离,所述偏离属于本公开所属领域的已知或惯常实践,并且落入所附权利要求的范围内。
