利用细胞融合技术的基因及细胞治疗剂以及其的用途
文献发布时间:2023-06-19 09:54:18
技术领域
本发明涉及利用细胞融合技术的基因及细胞治疗剂以及其的用途,具体地,涉及如下的利用细胞融合技术的基因及细胞治疗剂以及与细胞损伤相关的疾病中的用途:将血凝素神经氨酸酶(hemagglutinin neuraminidase,HN)及融合(F,fusion)基因转导到细胞来使其超表达,由此,促进与其他细胞的细胞融合力,通过与损伤或凋亡中的细胞或者具有基因异常的细胞的细胞融合来恢复细胞损伤并传递正常基因。
背景技术
通常,疾病及老化通过细胞损伤及细胞凋亡进行。作为诱发细胞损伤及凋亡的代表性疾病具有神经退行性疾病(neurodegenerative disease)、肌肉退行萎缩症(musculardystrophy)等。
随着老龄人口的迅速增长,包括脑、脊柱、末梢神经的损伤在内的神经退行性疾病呈持续增长的趋势。神经退行性疾病的原因尚不明确。并且,已知各个神经退行性疾病的病理机制具有稍微不同的机制。
例如,肌萎缩性脊髓侧索硬化症(amyotrophic lateral sclerosis,ALS)、脊髓性肌肉萎缩症(Spinal muscular atrophy)、肯尼迪病(spinal bulbar muscular atrophy)等为仅使运动神经细胞选择性凋亡来仅使运动功能退行。结果,可示出四肢麻痹的症状,还称为运动神经元疾病。
另一方面,与上述运动神经元疾病不同,阿尔茨海默病、帕金森病等以大脑神经细胞丢失的代表性神经退行性疾病而周知。在阿尔茨海默病的情况下,由于神经细胞的丢失,示出整体脑萎缩症状。这种脑病理症状在疾病初期局限于主要负责记忆力的主要脑部位的海马体和嗅觉皮层部位,逐渐经过顶叶、额叶等扩散至整个大脑。随着这种脑病理侵袭部位的发展,在初期主要是示出记忆力减退,随着疾病的进展,逐渐进展且临床症状多样化,由此,变得越来越严重。在帕金森病的情况下,由于位于中脑的黑质(substantia nigra,SN)的多巴胺能神经元(dopaminergic neuron)的丢失而诱发。多巴胺能神经元的丢失诱发纹状体(striatum)中的严重的多巴胺减少,示出包括基底核(basal ganglia)、丘脑(thalamus)及运动皮质(motor cortex)的锥体外系统(extrapyramidal system)引起的运动调节功能障碍。
如上所述,由于各种病理机制起作用,难以利用作用于一种机制的治疗剂治疗疾病,因此,目前为止的几乎所有临床试验均失败,没有根本治疗剂。具体地,作为与肌萎缩性脊髓侧索硬化症相关的治疗剂,除抑制破坏运动神经细胞的过量谷氨酸的利鲁唑(riruzole)、抑制自由基引起的氧化应激损伤的依达拉奉(edaravone)之外,几乎没有美国食品药品监督管理局(FDA)批准的治疗剂,唯一功效为约3个月的延长生存期或微微减缓身体功能恶化。在阿尔茨海默病的情况下,美国食品药品监督管理局批准的治疗剂为使帮助脑神经细胞的活动的神经传递物质乙酰胆碱活性化的安理申(Aricept)、艾斯能(Exelon)、Namenda、加兰他敏(Razadyne)等,它们也仅使脑细胞损伤最小化来缓和症状或减慢其进展速度,但不足以用作治疗剂。在帕金森病的情况下,最近作为多巴胺作用剂使用左旋多巴(levodopa),但是长期功效有限。在其他神经退行性疾病的情况下,也没有根治的治疗剂。因此,急需作用于更广泛的机制且具有强力效果的治疗剂,由此,可称为迫切需要包括干细胞治疗的新的治疗方法的疾病。
目前,为了治疗神经退行性疾病,提出了细胞移植、给药用于改善症状的药物等多种治疗法,尤其,近来的重点在于细胞治疗。但是,以往的细胞治疗技术的目标在于,向疾病部位插入健康的细胞(或干细胞)来代替凋亡的细胞或者改善凋亡中的细胞周围的环境来使其再生,这种尝试在许多临床前或临床试验中没有效果或效果甚微。并且,在神经细胞的情况下,与其他器官不同,形成神经回路在功能上非常重要,因此,难以期望从外部供给的细胞分化为神经细胞并直接回复现有的神经回路。因此,除现有的方法之外,迫切研发用于缓解或保护新的神经细胞损伤的治疗方法。
另一方面,肌肉为支撑人类身体且维持生命现象的重要组织。在肌肉中,成肌细胞(myoblast)分化形成多核肌管细胞(multinucleated myotube),并生成肌肉细胞(myocyte),成肌细胞和肌肉细胞的凋亡成为多种疾病的原因。并且,据报告,有基因突变或各种原因引起的丢失肌肉细胞的疾病,但是,目前为止,没有根本性治疗剂。这种肌肉疾病的症状及疾病的强度根据种类不同,还呈现神经元或脊髓等神经系统的问题引发的复合形态。
如一例,肌肉退行萎缩症为肌肉细胞被破坏的疾病,是由基因异常发生,症状从力量减弱且难以起身,逐渐严重,从而麻痹呼吸肌肉并导致死亡。具有杜兴氏肌肉营养不良症(Duchenne muscular dystrophy,DMD)、贝克型肌营养不良症(Becker musculardystrophy,BMD)、肢带型肌营养不良症(Limb Girdle muscular dystrophy)等各种种类,症状也根据种类不同。上述杜兴氏肌肉营养不良症及贝克型肌营养不良症由于存在于X染色体的肌营养不良蛋白(Dystrophin)基因的异常而发生,1/3左右为自然突变引起的,剩余为伴性遗传引起的。杜兴氏肌肉营养不良症和贝克型肌营养不良症均由同一基因的异常引起的,将移码突变(frame-shift mutation)等引起的示出严重的表现型的情况称为杜兴氏肌肉营养不良症。在杜兴氏肌肉营养不良症的情况下,疾病的经过不良,大多数患者在9~13岁之间无法行走,不仅肌无力,还使认知能力下降,并伴随心肌病、呼吸肌障碍而导致死亡。在杜兴氏肌肉营养不良症的情况下,最近,出现了通过外显子跳跃(exon skipping)治疗的方法。外显子跳跃将肌营养不良蛋白基因(Dystrophin gene)的外显子51(exon 51)的剪接增强子(splicing enhancer)序列作为靶,其原理为仅恢复读框(reading frame)来转换为不太严重的基因变异,因此,无法称为根本性治疗方案,并不是以所有杜兴氏肌肉营养不良症为对象的治疗方法。
如上所述,随着疾病的进展,肌肉疾病患者无法独自生活,并且,技术没有根本性治疗剂,因此,迫切需要能够有效治疗肌肉细胞损伤或凋亡引起的肌肉疾病的新的治疗法。
由此,本发明人为了研发与神经退行性疾病、肌肉退行性疾病等细胞损伤相关的疾病治疗剂而努力的结果,经确认,超表达血凝素神经氨酸酶及融合蛋白的细胞通过血凝素神经氨酸酶及融合蛋白增强与其他细胞的细胞融合力,在损伤或凋亡中的细胞或具有基因异常的细胞中,恢复细胞损伤且传递正常基因的能力高。由此发现,可将通过血凝素神经氨酸酶及融合蛋白的细胞融合技术有用地用于治疗诱发细胞损伤的神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病,从而完成了本发明。
现有技术文献
专利文献
韩国公开专利第10-2008-0026786号
韩国公开专利第10-2006-0119064号
非专利文献
Annemieke Aartsma-Rus et al”Development of Exon Skipping Therapiesfor Duchenne Muscular Dystrophy:A Critical Review and a Perspective on theOutstanding Issues,Nucleic Acid Ther.2017Oct 1;27(5):251-259
发明内容
技术问题
本发明的目的在于,提供利用细胞融合技术的基因及细胞治疗剂以及其的与细胞损伤相关的疾病,更具体地,神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病中的用途。
技术方案
为了实现上述目的,本发明提供如下的用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的药学组合物:包含载体作为有效成分,上述载体包含对血凝素神经氨酸酶及融合蛋白进行编码的基因。
并且,本发明提供如下的用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的药学组合物:包含利用载体转化的细胞作为有效成分,上述载体包含对血凝素神经氨酸酶及融合蛋白进行编码的基因。
并且,本发明提供如下的神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的预防或治疗方法:包括以治疗有效量向个体给药载体的步骤,上述载体包含对血凝素神经氨酸酶及融合蛋白进行编码的基因。
并且,本发明提供如下的神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的预防或治疗方法:包括以治疗有效量向个体给药利用载体转化的细胞的步骤,上述载体包含对血凝素神经氨酸酶及融合蛋白进行编码的基因。
并且,本发明提供如下的包含对血凝素神经氨酸酶及融合蛋白进行编码的基因的载体的用途:用作用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的药学组合物。
同时,本发明提供如下的利用包含对血凝素神经氨酸酶及融合蛋白进行编码的基因的载体转化的细胞的用途:用作用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的药学组合物。
发明的效果
在本发明中,经确认,超表达血凝素神经氨酸酶及融合蛋白的细胞通过血凝素神经氨酸酶及融合蛋白增强与其他细胞的细胞融合力,通过与损伤的细胞的融合向损伤的细胞的核内传递超表达血凝素神经氨酸酶及融合蛋白的细胞内的正常基因及转录调节因子,通过调节参与损伤的细胞中的细胞恢复的基因的表达或者通过正常基因传递恢复正常蛋白质,由此恢复损伤的细胞。并且,经确认,在与细胞损伤相关的多种疾病模型中,血凝素神经氨酸酶及融合蛋白超表达细胞与损伤的细胞或诱发基因异常的细胞进行细胞融合来恢复至正常细胞。
因此,可利用通过血凝素神经氨酸酶及融合蛋白的细胞融合技术恢复细胞损伤并引入正常基因,由此,可有用地将包含对血凝素神经氨酸酶及融合蛋白进行编码的基因的载体或利用其转化的细胞用于治疗与细胞损伤相关的疾病,具体为神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病。
附图说明
图1为示出本发明一实施例的通过与人脂肪组织来源间叶系干细胞(hATMSCs)进行细胞融合的凋亡中的NSC34运动神经细胞株的细胞凋亡抑制效果的图。
图2为示出本发明一实施例的与人脂肪组织来源间叶系干细胞进行细胞融合的NSC34细胞组(cell group)中的Bax及Bcl-xL的表达分析的图。
图3为用于根据本发明的一实施例制备分别插入血凝素神经氨酸酶及融合蛋白的PcDNA3.1表达载体的示意图。
图4为在本发明一实施例的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞(F-hATMSCs)中分析血凝素神经氨酸酶及融合信使核糖核酸(F mRNA)表达的图。
图5为本发明一实施例的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞中的血凝素神经氨酸酶及融合蛋白表达的图像分析的图。
图6为对本发明一实施例的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的免疫表型(immunophenotyping)进行分析的图。
图7为对本发明一实施例的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞中的与NSC34运动神经细胞株的细胞融合能力进行分析的图。
图8为对本发明一实施例的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与NSC34运动神经细胞株融合的细胞中的胆碱乙酰基转移酶(ChAT)及CD 105表达进行分析的图。
图9为示出本发明一实施例的NSC34运动神经细胞株、凋亡中的NSC34运动神经细胞株及血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞之间的蛋白质组(proteomics)分析结果的图。
图10为示出本发明一实施例的NSC34运动神经细胞株、凋亡中的NSC34运动神经细胞株及血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞之间的热图(heatmap)分析结果的图。
图11为对本发明一实施例的NSC34运动神经细胞株、凋亡中的NSC34运动神经细胞株及血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞中的与细胞恢复相关的基因DDB1、HMGB1及MSH2信使核糖核酸表达进行分析的图。
图12为示出本发明一实施例的通过与血凝素神经氨酸酶/融合蛋白的源于诱导多能干细胞的神经干细胞(F-NSCs)进行细胞融合来抑制凋亡中的C2C12肌肉成肌细胞株的细胞凋亡效果的图。
图13为对本发明一实施例的血凝素神经氨酸酶/融合海拉细胞(F-HeLa)中的血凝素神经氨酸酶及融合信使核糖核酸的表达进行分析的图。
图14为对本发明一实施例的血凝素神经氨酸酶/融合海拉细胞中的与N2A成神经细胞瘤细胞株的细胞融合能力进行分析的图。
图15为根据本发明的一实施例用于制备插入有血凝素神经氨酸酶及融合蛋白的PcDNA3.1-P2A表达载体的示意图。
图16为对本发明一实施例的血凝素神经氨酸酶/融合海拉细胞或F-P2A-血凝素神经氨酸酶-海拉细胞(HeLa)中的与C2C12肌肉成肌细胞株的细胞融合能力进行分析的图。
图17为在根据本发明的一实施例筛选的与细胞恢复相关的基因DDB1的启动子区(promoter region)确认作为转录因子(transcriptional factor,TF)的TDP-43结合基序(binding motif)的图。
图18为根据本发明的一实施例用于制备与小鼠DBBl(mDDBl)特异性结合的启动子的示意图。
图19为对本发明一实施例的N2A成神经细胞瘤细胞株与转导有绿色荧光蛋白(GFP)-TDP-43的海拉细胞细胞株融合的细胞中的通过TDP-43的小鼠DDBl表达进行分析的图。
图20对在本发明一实施例的N2A成神经细胞瘤细胞株与转导有绿色荧光蛋白-TDP-43的海拉细胞细胞株融合的细胞中的TDP-43向N2A成神经细胞瘤细胞株的核内易位(translocation)进行图像分析的图。
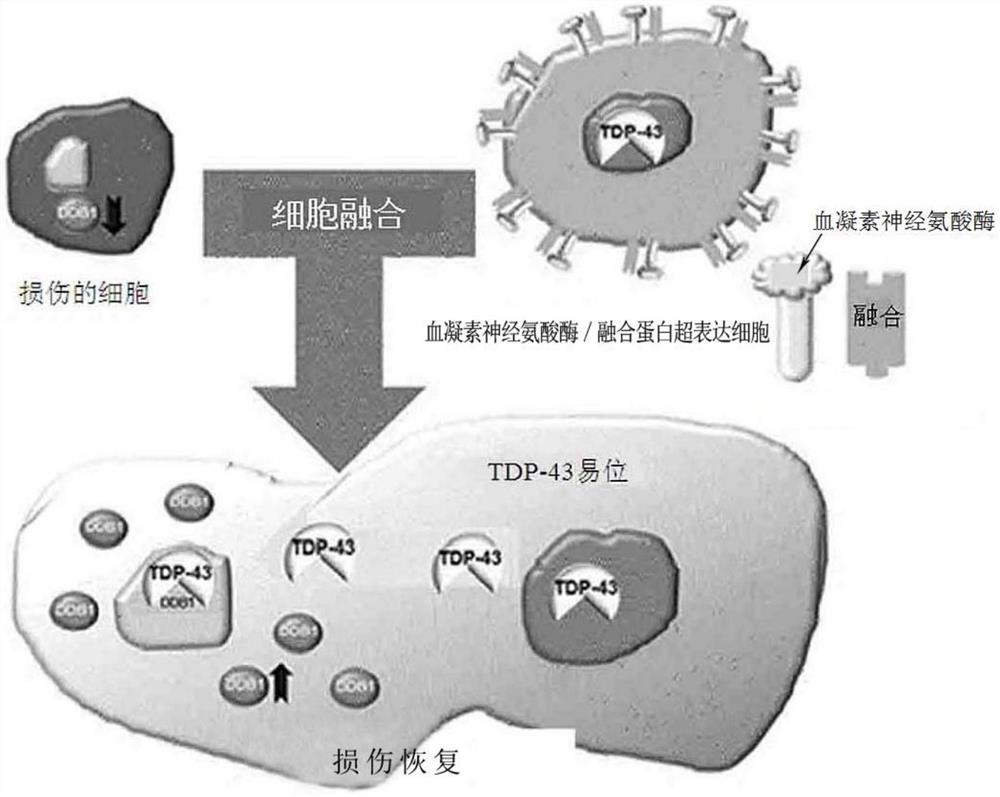
图21为损伤的细胞中的通过血凝素神经氨酸酶/融合蛋白超表达细胞的细胞损伤恢复机制的示意图。
图22为示出与本发明一实施例的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞进行细胞融合的凋亡中的阿尔茨海默病(Alzheimer's disease,AD)细胞模型的细胞凋亡抑制效果的图。
图23为示出与本发明一实施例的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞进行细胞融合的凋亡中的亨廷顿病(Huntington's disease,HD)疾病细胞模型的细胞凋亡抑制效果的图。
图24为示出本发明一实施例的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞进行细胞融合的凋亡中的心衰竭疾病细胞模型的细胞凋亡抑制效果的图。
图25为示出根据本发明的一实施例用于向肌萎缩性脊髓侧索硬化症或杜兴氏肌肉营养不良症疾病小鼠模型注入血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的脊髓内注射(intra-spinal cord injection)方法的图。
图26为对根据本发明的一实施例注入血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的G93A SOD Tg小鼠的运动性能进行分析的图。
图27为对根据本发明的实施例制备的杜兴氏肌肉营养不良症疾病细胞模型的肌营养不良蛋白及结缔组织生长因子(CTGF)表达进行分析的图。
图28为对根据本发明的实施例处理血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的杜兴氏肌肉营养不良症疾病细胞模型的肌营养不良蛋白及结缔组织生长因子表达进行分析的图。
图29为对作为杜兴氏肌肉营养不良症疾病动物模型的mdx小鼠的骨骼肌中的肌营养不良蛋白表达进行分析的图。
图30为对在根据本发明的一实施例注入血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的mdx小鼠的骨骼肌组织中的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的移植能力进行分析的图。
图31为对在根据本发明的一实施例注入血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的mdx小鼠的骨骼肌组织中对注入3周后及注入15周后的肌营养不良蛋白表达进行分析的图。
图32为对在根据本发明的一实施例注入血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的mdx小鼠的骨骼肌组织中的结缔组织生长因子表达进行分析的图。
具体实施方式
以下,通过下述实施例详细说明本发明。
本发明提供包含对血凝素神经氨酸酶及融合蛋白进行编码的基因的载体。
在本发明中,上述血凝素神经氨酸酶及融合蛋白可源于仙台病毒(sendaivirus)、人类免疫缺陷病毒1型(human immunodeficiency virus 1)、人类副流感病毒(Human parainfluenza virus)、人类呼吸道合胞病毒(Human respiratory syncytialvirus,HRSV)、流感病毒(influenza virus)或水疱性口炎病毒(vesicular stomatitisvirus),但并不局限于此,只要可通过与这些蛋白质相同或相似的机制促进细胞融合、抑制凋亡、恢复损伤的细胞,就可使用多种来源和/或全长和/或片段的多种形态的血凝素神经氨酸酶及融合蛋白(Eckert DM,Kim PS.Annu Rev Biochem.2001;70:777-810.;Sapir A,Avinoam O,Podbilewicz B,Chernomordik LV.Dev Cell.2008Jan;14(1):11-21.;KourisNA,Schaefer JA,Hatta M,Freeman BT,Kamp TJ,Kawaoka Y,Ogle BM.Stem CellsInt.2012;2012:414038)。
本发明的血凝素神经氨酸酶为在病毒中表达的糖蛋白,能够以具有血凝素及神经氨酸酶两者的活性的单一病毒蛋白或者各个以独立的蛋白质存在,但并不局限于此,只要是可实现本发明的效果,则均可包含于本发明。作为前者的例,可例举如腮腺炎病毒(mumpvirus)、仙台病毒、人类副流感病毒或鸡新城疫病毒(avian newcastle disease virus)等的源于副粘病毒(paramyxovirus)的病毒,上述人类副流感病毒可例举人类副流感病毒1型(HPIV-1)、人类副流感病毒2型(HPIV-2)或人类副流感病毒3型(HPIV-3),作为后者的例,可例举源于流感病毒的病毒。这些蛋白质及核酸序列均已公知,例如,血凝素神经氨酸酶可参照酶条目(Enzyme entry)(http://enzyme.expasy.org)EC:3.2.1.18的信息,例如,蛋白质序列源于仙台病毒,公开为GenBank accession no.AAB06288.1。在本发明的一实例中,使用可根据本发明的实施例2的方法制备的源于仙台病毒的血凝素神经氨酸酶单一蛋白。
并且,融合蛋白(Fusion protein,F protein)指用于细胞之间的融合或者与病毒的细胞的融合/进入、内吞作用(endocytosis)、膜运输(membrane trafficking)的糖蛋白。在本发明的一实例中,使用源于病毒的融合蛋白,这根据结构特征分为I类、II类及III类。作为I类的例,包括埃博拉病毒的GP2、莫洛尼鼠白血病病毒(MoMuLv,Moloney murineleukemia virus)的Mo-55、免疫缺陷病毒HIV的gp41、猿猴病毒(SIV)gp41等。作为II类的例,可包括SFV E1、TBEV E等。作为III类的例,可包括单纯性疱疹病毒(HSV,HerpesSimplex virus)的糖蛋白b(gB,glycoprotein B)、人类疱疹病毒第四型(EBV,Epstein-Barr virus)的糖蛋白b、水疱性口炎病毒(VSV,Vesicular Stomatitis virus)的蛋白质G及作为杆状病毒的糖蛋白的gp64等。这种融合糖蛋白及核酸序列已公开,例如,公开为GenBank Accession no.AAC82300.1。
在本发明中,对上述血凝素神经氨酸酶及融合蛋白进行编码的基因能够以全长和/或片段形态使用。具体地,包含对在本发明中公开的蛋白质进行编码的野生型基因序列及其片段、以有利于如细胞中的表达或蛋白质的稳定性等的特征的方式人为变形碱基序列的一部分的基因、及自然发现的碱基序列的一部分变形的基因或者它们的所有片段。
在本发明中,上述载体意味着用于在宿主细胞中表达靶基因的手段。上述载体包含用于表达靶基因的要素(elements),可包含复制起点(replication origin)、启动子、运算基因(operator)、转录终止序列(terminator)等,还可包含用于向宿主细胞的基因组内导入的适当酶位点(例如,限制酶位点)和/或用于确认成功向宿主细胞内导入的筛选标记和/或用于翻译为蛋白质的核蛋白体结合位点(ribosome binding site,RBS)、内部核糖体进入位点(IRES,Internal Ribosome Entry Site)等。上述载体除上述启动子之外还可包含转录调节序列(例如,增强子等)。
并且,上述载体可以为在相应领域公知的质粒脱氧核糖核酸(DNA)、重组载体或其他媒介,具体地,可以为线性脱氧核糖核酸、质粒脱氧核糖核酸、重组非病毒性载体、重组病毒性载体或诱导性基因表达载体系统(inducible gene expression vector system),上述重组病毒性载体可以为逆转录病毒(retrovirus)、腺病毒(adenovirus)、腺伴随病毒(adeno associated virus)、辅助依赖性腺病毒(helper-dependent adenovirus)、单纯疱疹病毒、慢病毒(lentivirus)或牛痘病毒(vaccinia virus)载体,但并不局限于此。
并且,上述载体意味着用于治疗基因的表达载体。上述术语“基因治疗(genetherapy)”指如下的方法:为了治疗由于基因异常诱发的各种遗传病,向基因异常的细胞插入正常基因或提供新功能,使得其功能正常化。因此,在本发明中,用于治疗基因的表达载体意味着如下的表达载体:向体内正常细胞传递血凝素神经氨酸酶及融合蛋白基因并表达,通过使基因异常的细胞与正常细胞进行细胞融合来提供新的功能,使得其功能正常化。
在本发明的一实例中,血凝素神经氨酸酶及融合蛋白基因通过如上所述的所公知的序列制备可特异性识别其的引物,利用其并通过聚合酶链式反应(Polymerase ChainReaction)扩增上述基因,将其导入至如上所述的表达载体后,能够以后述的方式向本发明的细胞导入其。导入方法已公知,例如,包括脂质体介导的转导、磷酸钙法、二乙氨基乙醇(DEAE)-葡聚糖介导的转导、带正电荷的脂质介导的转导、电穿孔、使用噬菌体系统的转导(transduction)或利用病毒的感染方法等,但并不局限于此。
并且,本发明提供利用包含对血凝素神经氨酸酶及融合蛋白进行编码的基因的载体转化的细胞。
在本发明中,上述术语“转化”的含义如下:通过从外部提供的脱氧核糖核酸改变生物的遗传性质,即,当将从生物的任一系统的细胞中提取的作为核酸的一种的脱氧核糖核酸导入至其他系统的活细胞时,脱氧核糖核酸进入其细胞并使遗传性状改变的现象。
在本发明中,上述转化的细胞可以为干细胞、前体细胞或动物细胞,但并不局限于此。并且,具体地,上述干细胞可以为胚胎干细胞、成体干细胞或诱导多能干细胞(inducedpluripotent stem cell,iPS),但并不局限于此,包含所有从上述干细胞分化的干细胞,例如,源于胚胎干细胞的间充质干细胞、源于诱导多能干细胞的间充质干细胞、源于诱导多能干细胞的神经干细胞等。并且,上述细胞可以为自体(autologous)或异体或者同种异体(allogenic)或异种(Xenogenic)细胞。最优选地,由于以自体衍生来源于受体,当给药药剂学组合物时,具有没有免疫反应的问题且安全的优点。
上述胚胎干细胞从作为胚胎发育早期的胚细胞(blastocyte)的内细胞团(innercell mass)形成,具有可分化为所有细胞的潜能(totipotent),具有可分化为任何组织细胞的优点,由此利用于研究细胞治疗。
上述成体干细胞意味着在胚胎发育阶段之后在整个成体中发现的未分化的干细胞。这种成体干细胞具有按照周围组织的特性分化细胞本身的局部专一性分化能力(site-specific differentiation)。成体干细胞可源于骨髓、血液、脑、皮肤、脂肪、骨骼肌、脐带、脐带血等的多种成体细胞。如具体例,可例举间充质干细胞(Mesenchymal Stem Cell,MSC)、骨骼肌干细胞(skeletal muscle stem cell)、造血干细胞(hematopoietic stemcell)、神经干细胞(neural stem cell,NSC),源于脂肪的干细胞(adipose-derived stemcell)、源于脂肪的前体细胞(adipose-derived progenitor cell)、血管内皮前驱细胞(vascular endothelial progenitor cell)等,但并不局限于此。
并且,上述间充质干细胞为从源于从已成人的身体各个部位获取的成体组织的干细胞,意味着可从脐带、脐带血、骨髓、血液、脑、皮肤、脂肪、骨骼、肌肉、神经、骨膜、羊膜或胎盘分离且可分化为多种细胞,例如脂肪细胞及运动神经细胞等的全能性(pluripotent)或多能性(multipotent)细胞。并且,间充质干细胞具有不使用免疫抑制剂也可有效地在同种或异种受体移植的特征。上述间充质干细胞可以为动物间充质干细胞,具体为哺乳动物间充质干细胞,更具体为人类的间充质干细胞。
在本发明的一实例中,间充质干细胞为源于脂肪组织的间充质干细胞。与骨髓、羊水、脐带血干细胞不同,源于脂肪组织的间充质干细胞具有可大量供给的实用优点,据推测,脂肪细胞的1%左右为干细胞,考虑近来在发达国家广泛进行的整形手术为抽脂术(liposuction),源于脂肪的干细胞因其无限的供给性,其有用性尤其高。
获取上述间充质干细胞的过程如下:从包括人或小鼠的哺乳动物,优选地,从人的间充质干细胞源,如脂肪组织、血液或骨髓分离间充质干细胞。接着,在适当的培养基培养上述细胞。在培养过程中,去除悬浮细胞,传代培养附着在培养板上的细胞,获取最终建立的(established)间充质干细胞。
并且,分离及培养以非常少量存在于骨髓等的间充质干细胞的过程在相应领域周知,例如,在美国专利第5486359号公开。
作为利用于上述过程的培养基,可利用在干细胞的的培养中利用的常规的任何培养基。更具体地,可利用包含血清(例如,胎牛血清、马血清及人血清)或血清替代物(serumreplacement)培养基。在本发明中可利用的培养基,包括如RPMI系列、Eagles's MEM(Eagle's minimum essential medium,Eagle,H.Science 130:432(1959))、α-MEM(Stanner,C.P.et al.,Nat.New Biol.230:52(1971))、Iscove's MEM(Iscove,N.et al.,J.Exp.Med.147:923(1978))、199培养基(Morgan et al.,Proc.Soc.Exp.Bio.Med.,73:1(1950))、CMRL 1066、RPMI 1640(Moore et al.,J.Amer.Med.Assoc.199:519(1967))、F12(Ham,Proc.Natl.Acad.Sci.USA 53:288(1965))、F10(Ham,R.G.Exp.Cell Res.29:515(1963))、DMEM(Dulbecco's Modified Eagle's medium,Dulbecco,R.et al.,VirProcy 8:396(1959))、DMEM和F12的混合物(Barnes,D.et al.,Anal.Biochem.102:255(1980))、Way-mo,h's MB752/1(Waymo,h,C.J.Natl.Cancer Inst.22:1003(1959))、McCoy's5A(McCoy,T.A.,et al.,Proc.Soc.Exp.Biol.Med.100:115(1959))及MCDB系列(Ham,R.G.et al.,InVitro 14:11(1978)),但并不局限于此。上述培养基可包含其他成分,例如抗生素或抗真菌剂(例如,青霉素、链霉素)及谷氨酰胺等。与培养基及培养有关的常规说明记载于R.IanFreshney,Culture of Animal Cells,Alan R.Liss,Inc.,New York(1984),该文献作为参照插入于本说明书中。
间充质干细胞的确认,例如可通过薄壁细胞分析进行。这种薄壁细胞分析利用间充质干细胞的特异性表面标记实施。在本发明的一实例中,本发明的间充质干细胞具有CD29、CD44及CD90作为标记以及具有CD34、CD45及HLA-DR的表现型作为阴性标记。
并且,在上述诱导多能干细胞中,向如没有多能性的成人皮肤细胞的体细胞导入引起去分化的四种特定基因后,提取从导入表达或引起去分化的四种基因的细胞中制备的去分化诱导蛋白质,将其再次向体细胞注入,由此可制备如胚胎干细胞的具有多能性的干细胞,将其称为又高多能性干细胞或去分化干细胞。研究利用诱导多能干细胞的干细胞治疗、从患者获取体细胞来制备诱导多能干细胞并在体外分化的各种疾病的经过,从而用于疾病模型、新药研发中的基于细胞研究等。上述诱导多能干细胞可根据公知的方法如在YuJ et al.(2007)Induced pluripotent stem cell lines derived from human somaticcells.Science.318,1917-1920或Takahashi K et al.(2007).Induction ofpluripotent stem cells from adult human fibroblasts by defined factors.Cell131,861-872等公开的方法获取。并且,包含源于诱导多能干细胞的干细胞,如源于诱导多能干细胞的间充质干细胞(induced Pluripotent Stem Cells-derived mesemchymalstem cells,iPSCs-MSCs)或源于诱导多能干细胞的神经干细胞(induced PluripotentStem Cells-derived neural stem cells,iPSCs-NSCs)等所有。在本发明的一实例中,源于上述诱导多能干细胞的干细胞为源于诱导多能干细胞的神经干细胞。
源于上述诱导多能干细胞的间充质干细胞或源于诱导多能干细胞的神经干细胞可根据公知的方法,如在L.G.VILLA-DIAZ et al.(2012)Derivation of MesenchymalStem Cells from Human Induced Pluripotent Stem Cells Cultured on SyntheticSubstrates.STEM CELLS.30,1174-1181或Hyun Soo Choi et al.(2014)Neural StemCells Differentiated From iPS Cells Spontaneously RegainPluripotency.STEMCELLS.32,2596-2604等公开的方法获取。
并且,上述前体细胞为在具有特定细胞的形态及功能之前阶段的细胞,为可分化为特定细胞系统的细胞或可形成为特定类型的组织的细胞,指具有自我恢复能力(self-renewal)且具有极其有限的分化能力的细胞。内胚层前体细胞、中胚层前体细胞及外胚层前体细胞均包括于此。
并且,上述动物细胞为源自包括人在内的动物的功能性及结构基本单位,只要是源自包括人在内的动物(例如,猴、狗、山羊、猪或鼠等的哺乳动物)的细胞,则可包含于本发明的范围。因此,本发明的动物细胞并不局限于此,包括上皮细胞、内皮细胞、肌肉细胞、生殖细胞、皮肤细胞(例如,成纤维细胞、角质细胞)、免疫细胞、癌细胞等。作为具体例,可例示中国仓鼠卵巢(CHO,Chinese hamster ovary)细胞、NS0(小鼠骨髓瘤(mouse myeloma))细胞、幼仑鼠肾(BHK,baby hamster kidney)细胞、Sp2/0(小鼠骨髓瘤)细胞、人视网膜细胞(human retinal cell)、HUVEC细胞、HMVEC细胞、COS-1细胞、COS-7细胞、海拉细胞、HEK-293细胞、HepG-2细胞、HL-60细胞、IM-9细胞、Jurkat细胞、MCF-7细胞或T98G细胞等,但并不局限于此。
并且,本发明提供用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的药学组合物,包含载体作为有效成分,上述载体包含对血凝素神经氨酸酶及融合蛋白进行编码的基因。
在本发明中,上述载体的说明与包含对上述血凝素神经氨酸酶及融合蛋白进行编码的基因的载体的说明相同,具体说明引用上文所述,以下,仅对用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的药学组合物的特有结构进行说明。
另一方面,在本发明中,经确认,超表达血凝素神经氨酸酶及融合蛋白的细胞通过血凝素神经氨酸酶及融合蛋白增强与其他细胞的细胞融合能力,通过与损伤的细胞融合来传递正常基因并表达,调节恢复细胞损伤的基因的表达。并且,经确认,在与细胞损伤相关的多种疾病模型中,血凝素神经氨酸酶及融合蛋白超表达细胞与损伤的细胞或诱发基因异常的细胞进行细胞融合来恢复至正常细胞。由此,可将包含对上述血凝素神经氨酸酶及融合蛋白进行编码的基因的载体有用地用作用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的组合物的有效成分。
在本发明中,上述神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病为与细胞损伤相关的疾病。
上述神经退行性疾病或神经疾病可诱发神经细胞损伤、脊髓神经损伤、末梢神经损伤或神经细胞凋亡。
并且,上述神经退行性疾病或神经疾病可分为诱发运动神经细胞损伤或凋亡的神经退行性疾病或神经疾病以及诱发大脑神经细胞损伤或凋亡、脊髓神经损伤或末梢神经损伤的神经退行性疾病或神经疾病。
为了改善或治疗诱发上述运动神经细胞损伤或凋亡的神经退行性疾病或神经疾病,必须保存及恢复运动神经细胞。作为这种神经退行性疾病或神经疾病的例,可例举脊髓性肌肉萎缩症、肯尼迪病、肌萎缩性脊髓侧索硬化症、多发性硬化症(multiplesclerosis)、原发性侧索硬化症(primary lateral sclerosis)或进行性延髓麻痹(progressive bulbar palsy),但并不局限于此。
诱发上述大脑神经细胞损伤或凋亡、脊髓神经损伤或末梢神经损伤的神经退行性疾病或神经疾病可通过恢复损伤的脑或脊髓的神经细胞、末梢神经来预防或治疗疾病。作为这种神经退行性疾病或神经疾病的例,可例举阿尔茨海默病、痴呆(dementia)、多发性梗死性痴呆(multi-infact dementia,mid)、额颞叶痴呆(frontotemporal dementia)、路易体痴呆(dementia with Lewy bodies)、轻度认知功能障碍(mild cognitiveimpairment)、皮质基底核退化症(corticobasal degeneration)、帕金森病(Parkinson'sdisease,PD)、抑郁症(depression)、代谢性脑病(metabolic brain disease)、多系统萎缩症(multiple system atrophy,MSA)、亨廷顿病(Huntington's disease)、进行性核上性麻痹(progressive supranuclear palsy,PSP)、癫痫(epilepsy)、齿状核红核苍白球路易体萎缩(dentatorubropallidoluysian atrophy,DRPLA)、脊髓小脑失调症(spinocerebellarataxia)、青光眼(glaucoma)、脑卒中(stroke)、脑缺血(brain ischemia)、脑炎后帕金森综合征(post-encephalitic parkinsonism)、图雷特综合征(Tourette's syndrome)、不安腿综合征(restless legs syndrome)或多动性注意缺陷障碍(attention deficitdisorders with hyperactivity),但并不局限于此。
上述肌肉退行性疾病或肌肉疾病可诱发肌肉细胞损伤或肌肉细胞凋亡。作为这种肌肉退行性疾病或肌肉疾病的例,可例举肌病(myopathy)、先天性肌病(congenitalmyopathy)、先天性肌营养不良症(congenital muscular dystrophy)、杜兴氏肌肉营养不良症(Duchenne muscular dystrophy)、贝克型肌营养不良症(Becker musculardystrophy)、肢带型肌营养不良症(Limb Girdle muscular dystrophy)、面肩胛肱型肌营养不良症(Facioscapulohumeral muscular dystrophy)、眼咽型肌萎缩症(oculopharyngeal muscular atrophy)、远端肌营养不良症(distal musculardystrophy)、Emery-Dreifuss肌营养不良症(Emery-Dreifuss muscular dystrophy)、强直性肌营养不良症(Myotonic dystrophy)、巴氏综合征(Barth syndrome)、心衰竭(heartfailure)、肌少症(sarcopenia)或X连锁扩张型心肌病(X-linked dilatedcardiomyopathy),但并不局限于此。
本发明的药学组合物与通常使用的药剂学上可接受的载体一同以适合的形态剂型化。作为药剂学上可接受的载体,可例举如水、适用油、盐水、水性葡萄糖及甘醇等的非口服给药用载体等,还可包含稳定化剂及保存剂。作为适合的稳定化剂,具有如亚硫酸氢钠、亚硫酸钠或抗坏血酸的抗氧化剂。作为适合的保存剂有氯化苯甲烃铵、羟苯甲酯或羟苯丙酯及氯丁醇。并且,在所需的情况下,本发明的细胞治疗用组合物根据其给药方法或剂型适当包含悬浮剂、溶解辅助剂、稳定化剂、等渗剂、保存剂、抗吸附剂、表面活化剂、稀释剂、赋形剂、pH值调节剂、无痛剂、缓冲剂、抗氧化剂等。包括在上文中例示的物质在内的适合本发明的药剂学上可接受的载体及制剂详细记载于文献《雷氏药学大全(Remington'sPharmaceutical Sciences),最新版》。
根据相应发明所属技术领域的普通技术人员容易实施的方法,本发明的药学组合物利用药学上可接受的载体和/或赋形剂来制剂化,能够以单位容量形态制备或者将其放入多容量容器中来制备。
并且,上述药学组合物还可通过有效成分可向靶细胞移动的任意装置给药。本发明的药学组合物为了治疗疾病而包含治疗有效量。在本发明中,除非另行提及,术语“治疗”意味着逆转、缓解适用上述本属于的疾病或疾病的一种以上的症状或抑制其进展或预防。并且,上述术语“治疗有效量”意味着研究人员、兽医、医生或其他临床考虑的在组织系统、动物或人体中诱导生物或医学反应的有效成分或药学组合物的量,其包含诱导缓解所治疗的疾病或障碍的症状的量。包含在本发明的药学组合物的有效成分可根据效果变化,这对普通技术人员而言是显而易见的。
因此,普通技术人员可容易确定最优药学组合物含量,可根据包括疾病的种类、疾病的严重程度、包含在组合物的其他成分的含量、剂型的种类及患者的年龄、体重、总体健康状态、性别、饮食、给药时间、给药途径及组合物的分泌率、治疗时间、同时使用的药物在内的多种因子调节。
在本发明的一实例中,药学组合物可静脉给药或脊髓内给药。
需考虑所有上述要素来包含可获得最大效果且无副作用的最小量是重要的。例如,本发明组合物的剂量可以为0.1×10
并且,本发明提供用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的药学组合物,包含利用载体转化的细胞作为有效成分,上述载体包含对血凝素神经氨酸酶及融合蛋白进行编码的基因。
在本发明中,上述细胞的说明与利用包含对上述血凝素神经氨酸酶及融合蛋白进行编码的基因的载体转化的细胞的说明相同,具体说明引用上文所述。并且,上述疾病、细胞的给药方法、剂量等的说明与包含上述载体的药学组合物的给药方法、剂量等的说明相同,具体说明引用上文所述。
另一方面,在本发明中,经确认,超表达血凝素神经氨酸酶及融合蛋白的细胞通过血凝素神经氨酸酶及融合蛋白增强与其他细胞的细胞融合能力,通过与损伤的细胞融合来传递正常基因并表达,调节恢复细胞损伤的基因的表达。并且,经确认,在与细胞损伤相关的多种疾病模型中,血凝素神经氨酸酶及融合蛋白超表达细胞与损伤的细胞或诱发基因异常的细胞进行细胞融合来恢复至正常细胞。由此,可将利用包含对上述血凝素神经氨酸酶及融合蛋白进行编码的基因的载体转化的细胞有用地用作用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的组合物的有效成分。
并且,本发明提供神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的预防或治疗方法,包括以治疗有效量向个体给药载体的步骤,上述载体包含对血凝素神经氨酸酶及融合蛋白进行编码的基因。
并且,本发明提供神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的预防或治疗方法,包括以治疗有效量向个体给药利用载体转化的细胞的步骤,上述载体包含对血凝素神经氨酸酶及融合蛋白进行编码的基因。
在本发明中,上述载体或利用上述载体转化的细胞及其的给药方法、剂量等的说明与包含对上述血凝素神经氨酸酶及融合蛋白进行编码的基因的载体及利用上述载体转化的细胞及包含其的药学组合物的给药方法、剂量等的说明相同,具体说明引用上文所述。
在本发明中,上述个体为患有神经退行性疾病、神经疾病、肌肉退行性疾病或肌肉疾病的个体,更具体地,为可通过给药如上所述的包含对血凝素神经氨酸酶及融合蛋白进行编码的基因的载体或利用上述载体转化的细胞来缓解和/或恢复上述疾病引起的细胞损伤,如神经细胞损伤或者肌肉细胞损伤的哺乳动物,例如,包括人、猴、小鼠、大鼠、兔子、羊、牛、狗、山羊、马、猪等。
上述神经退行性疾病或神经疾病可诱发神经细胞损伤、脊髓损伤、末梢神经损伤或神经细胞凋亡。
并且,上述神经退行性疾病或神经疾病可分为诱发运动神经细胞损伤或凋亡的神经退行性疾病或神经疾病以及诱发大脑神经细胞损伤或凋亡、脊髓损伤或末梢神经损伤的神经退行性疾病或神经疾病。
为了改善或治疗诱发上述运动神经细胞损伤或凋亡的神经退行性疾病或神经疾病,必须保存及恢复运动神经细胞。作为这种神经退行性疾病或神经疾病的例,可例举脊髓性肌肉萎缩症、肯尼迪病、肌萎缩性脊髓侧索硬化症、多发性硬化症、原发性侧索硬化症或进行性延髓麻痹,但并不局限于此。
诱发上述大脑神经细胞损伤或凋亡、脊髓损伤或末梢神经损伤的神经退行性疾病或神经疾病可通过恢复损伤的脑或脊髓的神经细胞、末梢神经来预防或治疗疾病。作为这种神经退行性疾病或神经疾病的例,可例举阿尔茨海默病、痴呆、多发性梗死性痴呆、额颞叶痴呆、路易体痴呆、轻度认知功能障碍、皮质基底核退化症、帕金森病、抑郁症、代谢性脑病、多系统萎缩症、亨廷顿病、进行性核上性麻痹、癫痫、齿状核红核苍白球路易体萎缩、脊髓小脑失调症、青光眼、脑卒中、脑缺血、脑炎后帕金森综合征、图雷特综合征、不安腿综合征或多动性注意缺陷障碍,但并不局限于此。
上述肌肉退行性疾病或肌肉疾病可诱发肌肉细胞损伤或肌肉细胞凋亡。作为这种肌肉退行性疾病或肌肉疾病的例,可例举肌病、先天性肌病、先天性肌营养不良症、杜兴氏肌肉营养不良症、贝克型肌营养不良症、肢带型肌营养不良症、面肩胛肱型肌营养不良症、眼咽型肌萎缩症、远端肌营养不良症、Emery-Dreifuss肌营养不良症、强直性肌营养不良症、巴氏综合征、心衰竭、肌少症或X连锁扩张型心肌病,但并不局限于此。
在本发明中,经确认,超表达血凝素神经氨酸酶及融合蛋白的细胞通过血凝素神经氨酸酶及融合蛋白增强与其他细胞的细胞融合能力,通过与损伤的细胞融合来传递正常基因并表达,调节恢复细胞损伤的基因的表达。并且,经确认,在与细胞损伤相关的多种疾病模型中,血凝素神经氨酸酶及融合蛋白超表达细胞与损伤的细胞或诱发基因异常的细胞进行细胞融合来恢复至正常细胞。由此,可将包含对上述血凝素神经氨酸酶及融合蛋白进行编码的基因的载体或利用其转化的细胞有用地用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病。
并且,本发明提供包含对血凝素神经氨酸酶及融合蛋白进行编码的基因的载体的用途,用作用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的组合物。
同时,本发明提供利用包含对血凝素神经氨酸酶及融合蛋白进行编码的基因的载体转化的细胞的用途,用作用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的组合物。
在本发明中,上述载体或利用上述载体转化的细胞及其的给药方法、剂量等的说明与包含对上述血凝素神经氨酸酶及融合蛋白进行编码的基因的载体及利用上述载体转化的细胞及包含其的药学组合物的给药方法、剂量等的说明相同,具体说明引用上文所述。并且,上述疾病的说明与用于预防或治疗上述神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病的药学组合物的说明相同,具体说明引用上文所述。
在本发明中,经确认,超表达血凝素神经氨酸酶及融合蛋白的细胞通过血凝素神经氨酸酶及融合蛋白增强与其他细胞的细胞融合能力,通过与损伤的细胞融合来传递正常基因并表达,调节恢复细胞损伤的基因的表达。并且,经确认,在与细胞损伤相关的多种疾病模型中,血凝素神经氨酸酶及融合蛋白超表达细胞与损伤的细胞或诱发基因异常的细胞进行细胞融合来恢复至正常细胞。由此,可将包含对上述血凝素神经氨酸酶及融合蛋白进行编码的基因的载体或利用其转化的细胞有用地用于预防或治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病。
以下,通过下述实施例详细说明本发明。但是,下述实施例仅用于例示本发明,本发明的内容并不限定于下述实施例。
实施例
细胞培养
经K-STMECELL IRB(机构审查委员会(Institutional review board))的同意及谅解下获取的人脂肪组织来源间叶系干细胞(human adipose tissue-derivedmesenchymal stem cells,hATMSCs)在添加有抗生素的RKCM培养基(添加10%的胎牛血清(FBS),K-STEMCELL提供)培养。小鼠运动神经细胞株(NSC34 Motor Neuron-Like HybridCell line,CEDARLANE,USA)在添加有抗生素的DMEM(Dulbecco's Modified Eagle'sMedium)培养基(添加有10%的胎牛血清)培养。小鼠成神经细胞瘤细胞株(N2A cell line,ATCC)在添加有抗生素的EMEM(Eagle's Minimum Essential Medium)培养基(添加有10%的胎牛血清)培养。人宫颈癌细胞株(HeLa cell line,ATCC)在添加有抗生素的EMEM(Eagle's Minimum Essential Medium)培养基(添加有10%的胎牛血清)培养。小鼠肌肉成肌细胞株(C2C12 muscle myoblast cell line,ATCC)在添加有抗生素的DMEM培养基(添加有10%的胎牛血清)培养。大鼠心脏成肌细胞株(H9c2 heart myoblast cell line,ATCC)在添加有抗生素的DMEM培养基(添加10%的胎牛血清)培养。
并且,将在正常人同意下接收血液而制备的人诱导多能干细胞(inducedPluripotent Stem Cells,iPSCs)以悬浮状态在不包含碱性成纤维细胞生长因子(bFGF)的添加有人胚胎干细胞(hES cell)培养基(ThermoFisher)的培养板培养4天。之后,在添加有视黄酸(Retinoic acid)(RA,5x 10
上述细胞均在5%的CO
实施例1.通过凋亡中的运动神经细胞株和源于脂肪组织的间充质干细胞的细胞融合的运动神经细胞株细胞凋亡抑制效果分析
在利用细胞追踪器(tracker)CM-DiI(Thermofisher)标记的运动神经细胞株NSC34细胞处理2.5μM的作为细胞凋亡诱导因子的毒胡萝卜素(thapsigargin)后培养24小时。在膜联蛋白(Annexin)V染色后,利用膜联蛋白V抗体通过薄壁细胞分析仪(流式细胞术(flow cytometry))分离膜联蛋白V阳性(V-positive)NSC34细胞。对于利用绿色染料(cell-stalker
并且,在分子水平确认凋亡抑制效果。简而言之,通过薄壁细胞分析仪分离与人脂肪组织来源间叶系干细胞进行细胞融合的NSC34细胞组后,逆转录-聚合酶链式反应(Reverse Transcription polymerase chain reaction,RT-PCR)及定量逆转录-聚合酶链式反应(quantitative RT-PCR)分析作为促凋亡(pro-apoptotic)基因的Bax和作为抗凋亡(anti-apoptotic)基因的Bcl-xL的表达。如图2,相比于未与人脂肪组织来源间叶系干细胞进行细胞融合的NSC34细胞组,在与人脂肪组织来源间叶系干细胞进行细胞融合的NSC34细胞组中,Bax信使核糖核酸的表达显著减少,Bcl-xL信使核糖核酸的表达显著增加。
上述结果表示,当凋亡中的NSC34运动神经细胞株与人脂肪组织来源间叶系干细胞进行细胞融合时,通过作为促凋亡基因的Bax的表达减少及作为抗凋亡基因的Bcl-xL的表达增加抑制细胞凋亡。
实施例2.制备超表达血凝素神经氨酸酶/融合蛋白的人脂肪组织来源间叶系干细胞(血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞)
以仙台病毒基因组为模板,利用如表1的引物通过聚合酶链式反应(PCR)扩增血凝素神经氨酸酶和融合蛋白基因。将扩增的脱氧核糖核酸分别向PcDNA3.1表达载体插入并克隆在大肠杆菌菌株DH5α(E.coli strain DH5α),并确认序列(未示出结果)。克隆的血凝素神经氨酸酶及融合蛋白分别与公开的序列GenBnak Accesssion No.AAB06288.1及AAC82300.1相同。
表1
在本发明中使用的用于克隆血凝素神经氨酸酶及融合基因的引物序列
将克隆后获取的克隆(clone)在LB液体培养基中扩增、培养24小时,利用质粒(plasmid)提取试剂盒(Midiprep kit)(Invitrogen,USA)提取质粒后,按照制造公司的方法利用脂质体(liposome)(lipofectamine3000,Invitrogen)转导至人脂肪组织来源间叶系干细胞来获取了导入血凝素神经氨酸酶/融合基因的人脂肪组织来源间叶系干细胞(血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞)。从转导的细胞株提取总核糖核酸(RNA)并通过逆转录-聚合酶链式反应及实时定量逆转录-聚合酶链式反应分析了血凝素神经氨酸酶及融合基因的表达。作为对照组利用人脂肪组织来源间叶系干细胞。将部分(partial)血凝素神经氨酸酶及融合引物用于确认利用逆转录-聚合酶链式反应及实时定量聚合酶链式反应的血凝素神经氨酸酶或融合信使核糖核酸的表达。
表达分析结果,如图4,确认了血凝素神经氨酸酶及融合基因的超表达。这种结果表示,通过利用脂质体的转染(liposomal transfection)成功地同时超表达血凝素神经氨酸酶及融合基因。
并且,如表1所示,在用于扩增血凝素神经氨酸酶基因的正向引物附着对myc蛋白质进行编码的碱基序列,在用于扩增融合基因的正向引物附着对组氨酸进行编码的碱基序列,因此,利用对于myc蛋白质和组氨酸的抗体(Santcruz Biotechnology,USA)在血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞通过共焦激光扫描显微镜(Nicon,Japan)分析血凝素神经氨酸酶和融合蛋白的表达。
图像分析结果确认,如图5,在血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的细胞表面表达血凝素神经氨酸酶和融合蛋白。这种结果表示,成功制备超表达血凝素神经氨酸酶和融合蛋白的人脂肪组织来源间叶系干细胞。
实施例3.对于血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的干细胞标记的表达评价
利用作为源于脂肪组织的间充质干细胞的阳性标记的CD29、CD44及CD90和作为阴性标记的CD34、CD45及对于HLA-DR的抗体(Santcruz Biotechnology,USA)且通过薄壁细胞分析仪在血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞分析对于源于脂肪组织的间充质干细胞标记的表达。作为对照组利用人脂肪组织来源间叶系干细胞。表达分析结果确认,如图6,相比于对照组,对于作为阳性标记的CD29、CD44及CD90和作为阴性标记的CD34、CD45及HLA-DR的表达没有差异。实施这种免疫表现型分析法(Immunophenotyping)的结果表示,导入血凝素神经氨酸酶和融合基因的人脂肪组织来源间叶系干细胞维持作为干细胞的特性。
实施例4.对于血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞和NSC34运动神经细胞株的细胞融合能力的评价
为了评价以如实施例2的方式制备的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的细胞融合能力,对利用绿色染料标记的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞和利用细胞追踪器CM-DiI标记的NSC34运动神经细胞株实施融合分析法(fusion assay)。将两种细胞以细胞数1∶1的比向1.5ml的试验管混合,在4℃的条件下反应5分钟后,在37℃的细胞培养箱反应15分钟。移到含有添加有抗生素的DMEM培养基(添加10%的胎牛血清)的6孔板后,在5%的CO
并且,如图7所公开,可通过共焦激光扫描显微镜的图像分析确认融合有表示绿色荧光的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞和表示红色荧光的NSC34运动神经细胞株的细胞的图像。
实施例5.在血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与NSC34运动神经细胞株进行融合的细胞中的人脂肪组织来源间叶系干细胞的标记及运动神经细胞标记的表达分析
对于实施例4的融合细胞,利用对于作为运动神经细胞标记的胆碱乙酰基转移酶(choline acetyltransferase,ChAT)和作为源于脂肪组织的间充质干细胞标记的CD105的抗体(Santcruz Biotechnology,USA),通过共焦激光扫描显微镜分析作为源于脂肪组织的间充质干细胞标记的胆碱乙酰基转移酶和CD105的表达。分析结果确认,如图8,在血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与NSC34运动神经细胞株融合的细胞确认作为运动神经细胞标记的胆碱乙酰基转移酶、作为源于脂肪组织的间充质干细胞标记的CD105的表达。
这种结果确认血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与NSC34运动神经细胞株融合,表示融合的细胞表达所有在源于脂肪组织的间充质干细胞和运动神经细胞株中表达的标记蛋白质。
实施例6.凋亡中的NSC34运动神经细胞株和血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与NSC34运动神经细胞株融合的细胞的蛋白质组分析
为了研究凋亡中的运动神经细胞与血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞通过细胞融合的细胞损伤恢复机制,利用ESI-LTQ-Orbitrap(Termo Fiher)及nanoHPLC(RSLC,Dionex)实施对于实施例2的膜联蛋白V阳性NSC34运动神经细胞株及实施例4的融合细胞的蛋白质组分析(proteomics analysis),利用MeV software实施热图分析(heatmap analysis)。作为对照组利用NSC34运动神经细胞株。分析结果确认,如图9及图10,与细胞恢复(cell repair)相关的5个基因(DDB1、HMGB1、MSH2、NONO及PCNA)在凋亡中的NSC34运动神经细胞中减少,相反,在血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与NSC34运动神经细胞株融合的细胞中增加,由此将上述5个基因作为细胞损伤恢复靶基因筛选。
并且,在实施例2的膜联蛋白V阳性NSC34运动神经细胞株及实施例4的融合细胞中确认与上述细胞恢复相关的5个基因(DDB1、HMGB1、MSH2、NONO及PCNA)中的DDB1、HMGB1及MSH2的表达变化。简而言之,对于实施例2的膜联蛋白V阳性NSC34运动神经细胞株及实施例4的融合细胞,通过逆转录-聚合酶链式反应及定量逆转录-聚合酶链式反应分析DDB1、HMGB1及MSH2的表达。作为对照组利用NSC34运动神经细胞株。如图11,在凋亡中的NSC34运动神经细胞中,DDB1、HMGB1及MSH2信使核糖核酸的表达减少,相反,在血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与NSC34运动神经细胞株融合的细胞中显著增加。
这种结果表示,在超表达血凝素神经氨酸酶和融合蛋白的人脂肪组织来源间叶系干细胞与凋亡中的NSC34运动神经细胞株融合来恢复细胞损伤的过程中,有DDB1、HMGB1及MSH2的参与。
实施例7.凋亡中的C2C12肌肉成肌细胞株与超表达血凝素神经氨酸酶/融合蛋白的源于诱导多能干细胞的神经干细胞(HN/F-NSCs)通过细胞融合的C2C12肌肉成肌细胞株细胞凋亡抑制效果分析
为了研究超表达血凝素神经氨酸酶和融合蛋白的细胞中是否示出细胞融合能力,制备了超表达血凝素神经氨酸酶和融合蛋白的源于诱导多能干细胞的神经干细胞。简而言之,按照制造公司的方法利用脂质体(lipofectamine 3000,Invitrogen),向源于诱导多能干细胞的神经干细胞(iPSCs-NSCs)转导在实施例2中克隆的分别插入血凝素神经氨酸酶及融合蛋白的PcDNA3.1表达载体,由此获取导入血凝素神经氨酸酶/融合基因的iPSCs-NSCs。从转导的细胞株提取总核糖核酸并通过逆转录-聚合酶链式反应及实时定量逆转录-聚合酶链式反应分析了血凝素神经氨酸酶及融合基因的表达(未示出结果)。
之后,在利用细胞追踪器CM-DiI标记的C2C12肌肉成肌细胞株处理作为细胞凋亡诱导因子的毒胡萝卜素2.5μg/ml后培养24小时。在膜联蛋白V染色后,利用膜联蛋白V抗体通过薄壁细胞分析仪分离膜联蛋白V-C2C12肌肉成肌细胞株。利用绿色染料标记上述血凝素神经氨酸酶/融合蛋白的源于诱导多能干细胞的神经干细胞,通过与在实施例1记载的方法相同的方法对膜联蛋白V-C2C12肌肉成肌细胞株进行细胞融合后,回收细胞并通过薄壁细胞分析对V阳性细胞进行分析。分析结果如下,如图12,在未与血凝素神经氨酸酶/融合蛋白的源于诱导多能干细胞的神经干细胞进行细胞融合的C2C12细胞组中,确认了72.3%的膜联蛋白V阳性细胞,在与血凝素神经氨酸酶/融合蛋白的源于诱导多能干细胞的神经干细胞进行细胞融合的C2C12细胞组中,确认了21.6%的膜联蛋白V阳性细胞。
这种结果表示,超表达血凝素神经氨酸酶和融合蛋白的iPSCs-NSCs与凋亡中的C2C12肌肉成肌细胞株进行融合来恢复细胞损伤。
实施例8.对于N2A成神经细胞瘤细胞株和超表达血凝素神经氨酸酶/融合蛋白的海拉细胞细胞株(血凝素神经氨酸酶/融合海拉细胞)的细胞融合能力的评价
为了研究在超表达血凝素神经氨酸酶和融合蛋白的普通细胞株中是否示出细胞融合能力,制备了超表达血凝素神经氨酸酶和融合蛋白的海拉细胞细胞株(血凝素神经氨酸酶/融合海拉细胞)。简而言之,利用绿色荧光蛋白-PcDNA3.1表达载体及在实施例2中获取的血凝素神经氨酸酶蛋白基因克隆来克隆了插入绿色荧光蛋白-血凝素神经氨酸酶的PcDNA3.1表达载体。并且,利用RFP-PcDNA3.1表达载体及在实施例2获取的融合蛋白基因克隆来克隆了插入RFP-融合蛋白的PcDNA3.1表达载体。之后,按照制造公司的方法利用脂质体(lipofectamine 3000,Invitrogen)来向海拉细胞转导来获取了导入血凝素神经氨酸酶/融合基因的海拉细胞(血凝素神经氨酸酶/融合海拉细胞)。从转导的细胞株提取总核糖核酸并通过逆转录-聚合酶链式反应及实时定量逆转录-聚合酶链式反应分析了血凝素神经氨酸酶及融合基因的表达。作为对照组利用海拉细胞株。表达分析结果,如图13,确认了血凝素神经氨酸酶及融合基因的超表达。
为了评价在上文中制备的血凝素神经氨酸酶/融合海拉细胞的细胞融合能力,通过与在实施例4记载的方法相同的方法对血凝素神经氨酸酶/融合海拉细胞与利用6-二脒基-2-苯基吲哚(DAPI)标记的N2A成神经细胞瘤细胞株进行细胞融合后,回收细胞,通过薄壁细胞分析仪及共焦激光扫描显微镜分析血凝素神经氨酸酶/融合海拉细胞和N2A成神经细胞瘤细胞株的细胞融合率。作为对照组,通过与在实施例4记载的方法相同的方法对转导有绿色荧光蛋白的N2A成神经细胞瘤细胞株与转导有mCherry的海拉细胞株进行细胞融合后,回收细胞,通过共焦激光扫描显微镜比较分析细胞融合率。分析结果,如图14,在血凝素神经氨酸酶/融合海拉细胞与N2A成神经细胞瘤细胞株中进行细胞融合,相比于对照组,确认了血凝素神经氨酸酶/融合海拉细胞与N2A成神经细胞瘤细胞株的细胞融合率增加7倍以上。
这种结果表示,与细胞无关地,通过血凝素神经氨酸酶和融合蛋白进行细胞融合。
实施例9.对于C2C12肌肉成肌细胞株和超表达血凝素神经氨酸酶/融合蛋白的海拉细胞株的细胞融合能力的评价
为了评价通过多种载体超表达血凝素神经氨酸酶和融合蛋白的海拉细胞株的细胞融合能力,利用PcDNA3.1表达载体或PcDNA3.1-P2A表达载体向海拉细胞株导入血凝素神经氨酸酶和融合蛋白基因。简而言之,如图15,利用PcDNA3.1-P2A表达载体和在实施例2中获取的血凝素神经氨酸酶蛋白基因及融合蛋白基因克隆来克隆了插入有血凝素神经氨酸酶及融合蛋白的PcDNA3.1-P2A表达载体。之后,按照制造公司的方法利用脂质体(lipofectamine 3000,Invitrogen)向海拉细胞株转导来获取了导入血凝素神经氨酸酶/融合基因的海拉细胞株(融合-P2A-血凝素神经氨酸酶-海拉细胞(F-P2A-HN-HeLa))。并且,通过上述方式将分别插入在实施例2中克隆的血凝素神经氨酸酶及融合蛋白的PcDNA3.1表达载体向海拉细胞株转导来获取了导入血凝素神经氨酸酶/融合基因的海拉细胞株(血凝素神经氨酸酶/融合海拉细胞)。从转导的细胞株提取总核糖核酸并通过逆转录-聚合酶链式反应及实时定量逆转录-聚合酶链式反应分析血凝素神经氨酸酶及融合基因的表达(未示出结果)。
之后,为了评价细胞融合能力,利用绿色荧光蛋白分别标记在上文中获取的海拉细胞株,通过与在实施例4记载的方法相同的方法与利用RFP标记的C2C12肌肉成肌细胞株进行细胞融合后,回收细胞并通过薄壁细胞分析仪分析海拉细胞株与C2C12肌肉成肌细胞株的细胞融合率。作为对照组,通过与在实施例4记载的方法相同的方法对利用绿色荧光蛋白标记的海拉细胞株与利用RFP进行标记的C2C12肌肉成肌细胞株进行细胞融合后,回收细胞并通过薄壁细胞分析仪比较分析细胞融合率。分析结果,如图16,融合-P2A-血凝素神经氨酸酶-海拉细胞的细胞融合率为26.9%,血凝素神经氨酸酶/融合海拉细胞的细胞融合率为50.1%,相比于对照组,细胞融合分别约增加4倍、7倍。
这种结果表示,通过多种载体在细胞超表达血凝素神经氨酸酶和融合蛋白,超表达血凝素神经氨酸酶及融合蛋白的细胞与其他细胞的细胞融合力增强。
实施例10.N2A成神经细胞瘤细胞株与海拉细胞株进行融合的细胞中的与细胞恢复相关的基因表达分析
为了确认当通过血凝素神经氨酸酶和融合蛋白进行细胞融合时的细胞损伤恢复机制,筛选在实施例6中筛选的与细胞恢复相关的基因DDB1的启动子区(promoterregion),如图17,确认了作为转录调节因子(transcriptional factor,TF)的TDP-43(TARDNA-binding protein 43)的结合基序(binding motif)存在于DDB1的启动子区。
由此,为了确认当血凝素神经氨酸酶与融合蛋白进行细胞融合时DDB1的表达是否随着TDP-43的增加而增加,如图18,制备了与小鼠DDB1(mDDB1)特异性结合的引物,利用其从N2A成神经细胞瘤细胞株和海拉细胞株提取总脱氧核糖核酸,通过聚合酶链式反应确认了小鼠特异性DDB1基因。为了确认DDB1的表达被TDP-43调节,在N2A成神经细胞瘤细胞株超表达TDP-43后提取核糖核酸,并利用定量逆转录-聚合酶链式反应进行分析。之后,按照制造公司的方法利用仙台病毒包膜细胞融合试剂盒(GenomONETM-CF EX Sendai virus(HVJ)Envelope Cell Fusion Kit,COSMO BIO,Japan)来对N2A成神经细胞瘤细胞株和转导有绿色荧光蛋白的海拉细胞株以及N2A成神经细胞瘤细胞株和转导有绿色荧光蛋白-TDP-43的海拉细胞株分别实施细胞融合后,利用融合绿色荧光蛋白抗体(Rockland)执行染色质免疫沉淀(ChIP,Chromatin immunoprecipitation)assay(Millipore)。结果如下,如图19,在N2A成神经细胞瘤细胞株和转导有绿色荧光蛋白-TDP-43的海拉细胞株进行融合的细胞株中,小鼠DDB1随着融合时间增加,在小鼠DDB1启动子区中,TDP-43的占据(occupancy)增加4倍以上,随着TDP-43的增加调节DDB1的表达。
并且,为了确认当通过血凝素神经氨酸酶和融合蛋白进行细胞融合时TDP-43是否向受体细胞(recipient cell)的核内易位,通过在上文记载的方法相同的方法对利用CM-DiI标记的N2A成神经细胞瘤细胞株与转导有绿色荧光蛋白-TDP-43的海拉细胞株进行细胞融合,进行6-二脒基-2-苯基吲哚染色后通过共焦激光扫描显微镜分析TDP-43的易位,利用NucBlue(ThermoFisher)染色N2A成神经细胞瘤细胞株,通过与在上文记载的方法相同的方法与转导有绿色荧光蛋白-TDP-43的海拉细胞株进行细胞融合后,利用人细胞核(humannuclei)抗体(abcam)进行免疫染色实施后通过共焦激光扫描显微镜进行分析。分析结果,如图20,确认了转导有绿色荧光蛋白-TDP-43的海拉细胞株的TDP-43向N2A成神经细胞瘤细胞株的核内易位。
这种结果表示,当通过血凝素神经氨酸酶和融合蛋白进行细胞融合时,通过供体细胞(donor cell)的TDP-43向受体细胞(recipient cell)的核内易位后,与小鼠DDB1的启动子区结合来调节与细胞恢复相关的基因DDB1的表达增加。并且,如图21,在与细胞损伤相关的疾病中,通过使血凝素神经氨酸酶/融合蛋白超表达细胞与损伤的细胞进行融合来向损伤的细胞核内传递血凝素神经氨酸酶/融合蛋白超表达细胞内的转录调节因子,通过传递的转录调节因子调节参与损伤的细胞内细胞恢复的基因的表达,并恢复损伤的细胞,由此可治疗与细胞损伤相关的疾病。
实施例11.阿尔茨海默病细胞模型中的利用血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的细胞融合的治疗效果分析
为了确认作为与细胞损伤相关的疾病的阿尔茨海默病中的利用通过超表达血凝素神经氨酸酶/融合蛋白的细胞的细胞融合的治疗效果,制备了阿尔茨海默病细胞模型。简而言之,从杰克逊实验室(Jackson laboratory)接收作为阿尔茨海默病动物模型的TG2576小鼠(出生后80日)。之后,分离TG2576小鼠的室管膜下层(subventricular zone),在分离的组织利用胰蛋白酶分离及过滤干细胞。接着,向包含B27补充剂(supplement)的DMEM培养基分别添加20ng/ml的表皮生长因子及成纤维细胞生长因子(FGF),来以球形态培养4天。4天后移到孔板,在包含5%的胎牛血清及B27补充剂的DMEM培养基培养7天,由此,诱导源于阿尔茨海默病小鼠的神经干细胞的分化。
之后,通过与在实施例4记载的方法相同的方法对在上述实施例2中获取的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与在上文中获取的源于阿尔茨海默病小鼠的神经干细胞进行细胞融合。在进行细胞融合的24小时后,添加5μl的膜联蛋白V抗体,在常温条件下反应15分钟后,通过薄壁细胞分析仪对V阳性细胞进行分析。分析结果,如图22,在源于阿尔茨海默病小鼠的神经干细胞中确认50.7%的膜联蛋白V阳性细胞,在与血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞进行细胞融合的源于阿尔茨海默病小鼠的神经干细胞中确认15.9%的膜联蛋白V阳性细胞。
这种结果表示,超表达血凝素神经氨酸酶和融合蛋白的人脂肪组织来源间叶系干细胞通过血凝素神经氨酸酶及融合蛋白与阿尔茨海默病神经细胞进行融合来恢复在亨廷顿病神经细胞示出的细胞损伤。
实施例12.亨廷顿病疾细胞模型中的利用血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的细胞融合的治疗效果分析
为了确认作为与细胞损伤相关的疾病的亨廷顿病中的利用通过超表达血凝素神经氨酸酶/融合蛋白的细胞的细胞融合的治疗效果,制备了亨廷顿病细胞模型。简而言之,从杰克逊实验室接收作为亨廷顿病动物模型的R6/2Tg小鼠(出生后80日)。之后,分离R6/2小鼠的室管膜下层,在分离的组织利用胰蛋白酶分离及过滤干细胞。接着,在包含B27补充剂的DMEM培养基分别添加20ng/ml的表皮生长因子及成纤维细胞生长因子来以球形态培养4天,之后,移到孔板,在包含5%的胎牛血清及B27补充剂的DMEM培养基中培养7天,从而诱导源于亨廷顿病小鼠的神经干细胞的分化。
之后,通过与在实施例4记载的方法相同的方法对在上述实施例2中获取的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与在上文中获取的源于亨廷顿病小鼠的神经干细胞进行细胞融合。在进行细胞融合的24小时后,添加5μl的膜联蛋白V抗体,在常温条件下反应15分钟后,通过薄壁细胞分析仪对V阳性细胞进行分析。分析结果,如图23,在源于亨廷顿病小鼠的神经干细胞中确认了37.5%的膜联蛋白V阳性细胞,在与血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞进行细胞融合的源于亨廷顿病小鼠的神经干细胞中确认了11.1%的膜联蛋白V阳性细胞。
这种结果表示,超表达血凝素神经氨酸酶和融合蛋白的人脂肪组织来源间叶系干细胞通过血凝素神经氨酸酶及融合蛋白与亨廷顿病神经细胞进行融合来恢复在亨廷顿病神经细胞中示出的细胞损伤。
实施例13.心衰竭疾病细胞模型中的利用血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的细胞融合的治疗效果分析
为了确认作为与细胞损伤相关的疾病的心衰竭疾病中的利用通过超表达血凝素神经氨酸酶/融合蛋白的细胞的细胞融合的治疗效果,制备了心衰竭疾病细胞模型。简而言之,在利用细胞追踪器CMDFA(Invitrogen)标记的H9c2心脏成肌细胞株处理200μM的过氧化氢(H
之后,利用CM-DiI标记在上述实施例2获取的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞,通过与在实施例4记载的方法相同的方法对在上文中获取的心衰竭疾病细胞模型进行细胞融合后回收细胞。利用膜联蛋白V染色回收的细胞,通过薄壁细胞分析仪分离膜联蛋白V阳性细胞后,在分离的细胞中分析绿色荧光阳性细胞。分析结果,如图24,在心衰竭疾病细胞模型中确认了29%的膜联蛋白V阳性细胞,在与血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞进行细胞融合的心衰竭疾病细胞模型中确认了13.4%的膜联蛋白V阳性细胞。
这种结果表示,超表达血凝素神经氨酸酶和融合蛋白的人脂肪组织来源间叶系干细胞通过血凝素神经氨酸酶及融合蛋白与诱导心衰竭的细胞进行融合来恢复细胞损伤。
实施例14.肌萎缩性脊髓侧索硬化症疾病动物模型中的利用血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的细胞融合的治疗效果分析
为了确认作为与细胞损伤相关的疾病的肌萎缩性脊髓侧索硬化症疾病中的利用通过超表达血凝素神经氨酸酶/融合蛋白的细胞的细胞融合的治疗效果,从杰克逊实验室接收作为肌萎缩性脊髓侧索硬化症疾病动物模型的G93A SOD1 Tg小鼠(出生后80日)。之后,将G93A SOD1 Tg小鼠分为对照组(Tg-saline)、Tg-MSC组及TG-融合性MSC(TG-fusogenic MSC)组,如图25,利用脊髓内注射方法向对照组注入盐溶液(saline)、向Tg-MSC组注入细胞数为0.5-2×10
实施例15.杜兴氏肌肉营养不良症疾病细胞模型中的利用血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的细胞融合的治疗效果分析
为了确认作为与细胞损伤相关的疾病的杜兴氏肌肉营养不良症疾病中的利用通过超表达血凝素神经氨酸酶/融合蛋白的细胞的细胞融合的治疗效果,制备了杜兴氏肌肉营养不良症疾病细胞模型。简而言之,杜兴氏肌肉营养不良症疾病为肌肉纤维的肌营养不良蛋白缺乏而发病的肌肉疾病,获取了对于肌营养不良蛋白特异性的小干扰核糖核酸(siRNA)(siDystrophin,GenePharma),按照制造公司的方法利用其来向C2C12肌肉成肌细胞导入来制备了抑制肌营养不良蛋白表达的C2C12肌肉成肌细胞株。为了确认作为杜兴氏肌肉营养不良症疾病的病理症状的肌营养不良蛋白及结缔组织生长因子表达,制备与肌营养不良蛋白及结缔组织生长因子特异性结合的引物,从导入上述si肌营养不良蛋白的C2C12肌肉成肌细胞株提取总核糖核酸,利用定量逆转录-聚合酶链式反应对肌营养不良蛋白及结缔组织生长因子基因表达进行分析。并且,利用结缔组织生长因子抗体(Abcam)且利用蛋白质印迹(western blot)对CTGF蛋白表达进行分析。作为对照组利用C2C12细胞株。表达分析结果,如图27,确认导入si肌营养不良蛋白的C2C12肌肉成肌细胞株减少作为杜兴氏肌肉营养不良症疾病细胞模型中的肌营养不良蛋白的基因表达且增加结缔组织生长因子的基因及蛋白质表达。
为了确认在上文中制备的杜兴氏肌肉营养不良症疾病细胞模型中的利用通过超表达血凝素神经氨酸酶/融合蛋白的细胞的细胞融合的治疗效果,通过与在实施例4记载的方法相同的方法对通过如实施例2的方式制备的血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与在上文中制备的杜兴氏肌肉营养不良症疾病细胞模型进行细胞融合后,回收细胞,利用定量逆转录-聚合酶链式反应及蛋白质印迹分析肌营养不良蛋白及结缔组织生长因子的表达。分析结果,如图28,杜兴氏肌肉营养不良症疾病细胞模型中的肌营养不良蛋白表达减少且结缔组织生长因子表达增加,相反,血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞与杜兴氏肌肉营养不良症疾病细胞模型进行融合的细胞中的肌营养不良蛋白表达显著增加且结缔组织生长因子表达显著减少。
这种结果表示,超表达血凝素神经氨酸酶和融合蛋白的细胞与杜兴氏肌肉营养不良症疾病细胞模型进行细胞融合,在细胞融合的杜兴氏肌肉营养不良症疾病细胞模型中恢复为正常细胞。并且,向细胞融合的杜兴氏肌肉营养不良症疾病细胞模型传递正常肌营养不良蛋白基因来恢复肌营养不良蛋白的表达。
实施例16.杜兴氏肌肉营养不良症疾病动物模型中的利用血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的细胞融合的治疗效果分析
为了确认杜兴氏肌肉营养不良症疾病中的利用通过超表达血凝素神经氨酸酶/融合蛋白的细胞的细胞融合的治疗效果,从杰克逊实验室接收作为杜兴氏肌肉营养不良症疾病动物模型的mdx小鼠(出生后2周~4周)。从mdx小鼠分离骨骼肌,利用肌营养不良蛋白抗体(abcam)实施免疫组织化学,如图29,确认减少肌营养不良蛋白。之后,将mdx小鼠分为对照组(saline)、MSC组及fMSC组,如图25,利用脊髓内注射方法向对照组注入盐溶液、向MSC组注入细胞数为0.5-2×10
结果,如图30,利用绿色染料在MSC组及fMSC组中分别确认人脂肪组织来源间叶系干细胞及血凝素神经氨酸酶/融合人脂肪组织来源间叶系干细胞的移植能力。并且,如图31,在fMSC组中,注入3周后及注入15周后,人正常肌营养不良蛋白表达显著增加,由此确认肌营养不良蛋白表达得以持续。并且,如图32,确认在fMSC组中,注入1周后,结缔组织生长因子基因表达显著减少。
这种结果表示,在mdx小鼠的肌肉中,正常表达肌营养不良蛋白的细胞通过血凝素神经氨酸酶及融合蛋白增强与缺乏肌营养不良蛋白的肌肉细胞的细胞融合,从细胞融合的肌肉细胞中恢复为正常肌肉细胞。
上述结果表示,超表达血凝素神经氨酸酶及融合蛋白的细胞通过血凝素神经氨酸酶及融合蛋白与损伤的细胞进行融合,通过与损伤的细胞的融合向损伤的细胞的核内传递血凝素神经氨酸酶及融合蛋白超表达细胞内的转录调节因子,通过调节参与损伤的细胞内细胞恢复的基因的表达来恢复损伤的细胞,因此,可通过利用血凝素神经氨酸酶及融合蛋白的细胞融合技术治疗与细胞损伤相关的神经退行性疾病或神经疾病、肌肉退行性疾病或肌肉疾病。并且,血凝素神经氨酸酶/融合蛋白超表达细胞通过血凝素神经氨酸酶/融合蛋白与示出基因异常的细胞进行融合,通过细胞融合传递并表达正常基因,因此可将利用血凝素神经氨酸酶及融合蛋白的细胞融合技术用作基因治疗(gene therapy)的传递工具(delivery tool)。
产业上的可利用性
本发明涉及利用细胞融合技术的基因及细胞治疗剂及其的用途,具体地,可利用通过血凝素神经氨酸酶及融合蛋白的细胞融合技术恢复细胞损伤并导入正常基因,由此,可将包含对血凝素神经氨酸酶及融合蛋白进行编码的基因的载体或利用其转化的细胞有用地用于治疗与细胞损伤相关的疾病,更具体地,可有用地治疗神经退行性疾病或神经疾病或者肌肉退行性疾病或肌肉疾病。
- 利用细胞融合技术的基因及细胞治疗剂以及其的用途
- 异源融合基因修饰的癌细胞/树突状细胞融合肿瘤疫苗及其制备方法
