一种细胞迁移特性分析用多通道微流控芯片及方法
文献发布时间:2023-06-19 10:16:30
技术领域
本发明涉及细胞生物学实验装置,尤其是涉及一种细胞迁移特性分析用多通道微流控芯片及方法。
背景技术
微流控芯片是一种以在微米尺度空间对流体进行操控为主要特征的科学技术,能够将生物化学、医学等实验操作单元集成到一个微米尺度的芯片上。微流控芯片能够实现多种单元操作技术在整体可控的微小平台上灵活组合、规模集成,已经成为一种最具有发展潜力的细胞研究平台,可以用于免疫细胞迁移特性研究。中性粒细胞作为先天性免疫系统的一种关键细胞,其趋化性和吞噬功能在机体抗感染免疫反应中发挥着重要作用。这是因为当机体发生感染或炎症时,中性粒细胞会第一时间激活极化并外渗出血管壁,然后朝向感染灶释放的趋化因子迁移,最后识别并吞噬致病菌,同时释放活性氧(ROS)和蛋白水解酶来杀死细菌和微生物。因此,研究中性粒细胞的趋化运动及其发挥吞噬作用的全过程,对于监测糖尿病等慢病患者的免疫功能状态和进行疗效评估具有非常重要的科学意义。
评价细胞迁移特性常用方法主要有划痕实验法和transwell实验法,但是这两种方法都有明显的不足,主要表现为划痕实验法重复性较差,且损伤细胞。Transwell实验法则操作复杂且不适合动态观测。为此,人们发展了以微流控芯片为基础的微流体梯度发生器。微流控芯片的管道尺寸在微米量级,与细胞的大小相当,消耗的细胞和试剂量少,且能较好的模拟体内环境,不损伤细胞,适合动态观察。然而,目前的研究多使用单通道微流控芯片,具有通量低,集成度差,芯片间重复性差等缺陷。此外,基于微流控芯片的细胞迁移特性研究通常需要依托专业的活细胞成像设备,且在定时采集一系列的细胞图像之后,需要专业的科研人员使用ImageJ图像处理软件手动追踪细胞运动轨迹并分析细胞趋化性,检测方法较为繁琐,时间和实验成本较高。此外,不同实验人员的主观意识会严重影响细胞趋化迁移分析数据的准确性和重复性。
发明内容
本发明提出一种细胞迁移特性分析用多通道微流控芯片及方法,以解决目前单通道微流控芯片通量低、集成度差、芯片间重复性差的问题,以在注入中性粒细胞之后,可以模拟人体毛细血管中的中性粒细胞受到趋化因子刺激后发生的定向迁移现象,具有一定的检测通量。
本发明的技术方案是这样实现的:
一种细胞迁移特性分析用多通道微流控芯片,包括玻璃基板及紧密贴合设置在玻璃基板上的PDMS芯片主体;所述PDMS芯片主体上并列设置有若干组用于生成不同趋化因子浓度梯度环境的细胞迁移运动分析单元;每一个细胞迁移运动分析单元均包括:
细胞加载单元,用于注入细胞和确定细胞初始位置;
细胞趋化迁移单元,用于加入细胞培养液和趋化因子,并能够形成趋化因子浓度梯度,吸引细胞发生迁移运动;以及
细胞阻拦单元,用于在浓度梯度未形成时,阻拦细胞越过细胞初始位置定位区域。
进一步优化技术方案,所述细胞加载单元包括:
细胞加载口,用于注入细胞;
细胞加载管道,与细胞加载口相连通;以及
细胞初始位置定位区域,细胞能够沿着细胞加载管道到达细胞初始位置定位区域。
进一步优化技术方案,所述细胞趋化迁移单元包括:
细胞培养液加载口,用于加入细胞培养液;
趋化因子加载口,用于加入趋化因子;
蛇形管道,通过细胞迁移运动管道与细胞培养液加载口相连接,并通过细胞培养液管道与趋化因子加载口相连接,加入的趋化因子和细胞培养液能够通过蛇形管道平衡双方压力差;
细胞迁移运动管道,经蛇形管道平衡双方压力差后的趋化因子和细胞培养液能够汇入细胞迁移运动管道,在细胞迁移运动管道形成稳定的浓度梯度;以及
废液出口,与细胞迁移运动管道相连接,能够将废液排出。
进一步优化技术方案,所述细胞迁移运动分析单元并列设置有四个。
一种细胞迁移特性分析方法,包括以下步骤:
S1、制备微流控芯片,分离中性粒细胞,制备不同浓度的葡萄糖溶液、趋化因子溶液、细胞培养溶液以及fibrenectin溶液;
S2、将中性粒细胞放入不同浓度葡萄糖溶液中进行培育;
S3、将微流控芯片管道铺满fibrenectin溶液中进行放置;
S4、将fibrenectin溶液吸出,将微流控芯片管道铺满细胞培养溶液;
S5、将微流控芯片放入显微镜系统并调好焦距,找到细胞迁移运动区域,同时设定图像采集间隔时间和数量;
S6、将分离的中性粒细胞用移液枪注入细胞注入口中;
S7、待中性粒细胞排列在细胞初始位置定位区域后,用移液枪取趋化因子注入趋化因子注入口中;同时,用移液枪取细胞培养液注入细胞培养液注入口;
S8、趋化因子注入口和细胞培养液注入口中的试剂将沿着趋化因子注入管道和细胞培养液管道流入,在蛇形管道内稳定压力差后,流入细胞迁移运动管道,并构建稳定的浓度梯度环境;
S9、细胞感受到趋化因子的存在后,将会穿过细胞阻挡单元,从细胞初始位置定位区域进入细胞迁移运动管道;
不同趋化因子浓度梯度环境中的细胞趋化迁移运动状态被细胞趋化迁移分析系统同时记录并分析。
进一步优化技术方案,在进行细胞迁移特性分析时,通过将第一幅和最后一幅细胞图像的宽度像素均分为10份,采用细胞分区计数和数字得分方法对细胞趋化性进行简单分析。
进一步优化技术方案,在进行细胞迁移特性分析时,通过识别细胞的中心坐标并结合最小距离法追踪细胞运动追迹,进而计算细胞的趋化性指数、总迁移距离、运动速度和梯度位移。
采用了上述技术方案,本发明的有益效果为:
本发明能够同时观察不同浓度梯度下中性粒细胞在微流控芯片内的趋化迁移运动情况,具有一定的实验通量。本发明在注入中性粒细胞之后,可以模拟人体毛细血管中的中性粒细胞受到趋化因子刺激后发生的定向迁移现象,具有一定的检测通量,有效地解决了目前单通道微流控芯片通量低、集成度差、芯片间重复性差的问题。
本发明可自动分析细胞迁移状态,该微流控芯片和系统可用于各类细胞趋化迁移研究。本发明在趋化因子加载口和细胞培养液加载口中的液体可以在细胞迁移运动区域形成稳定的浓度梯度。细胞感受到趋化因子的存在以后,将会穿过细胞阻挡区域,进而从细胞初始位置定位区域进入细胞迁移运动区域。细胞迁移运动区域可以被置于显微镜观测装置下方观察细胞的迁移运动特性。4组不同趋化因子浓度梯度环境中的细胞趋化迁移运动状态可以被同时记录并分析。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
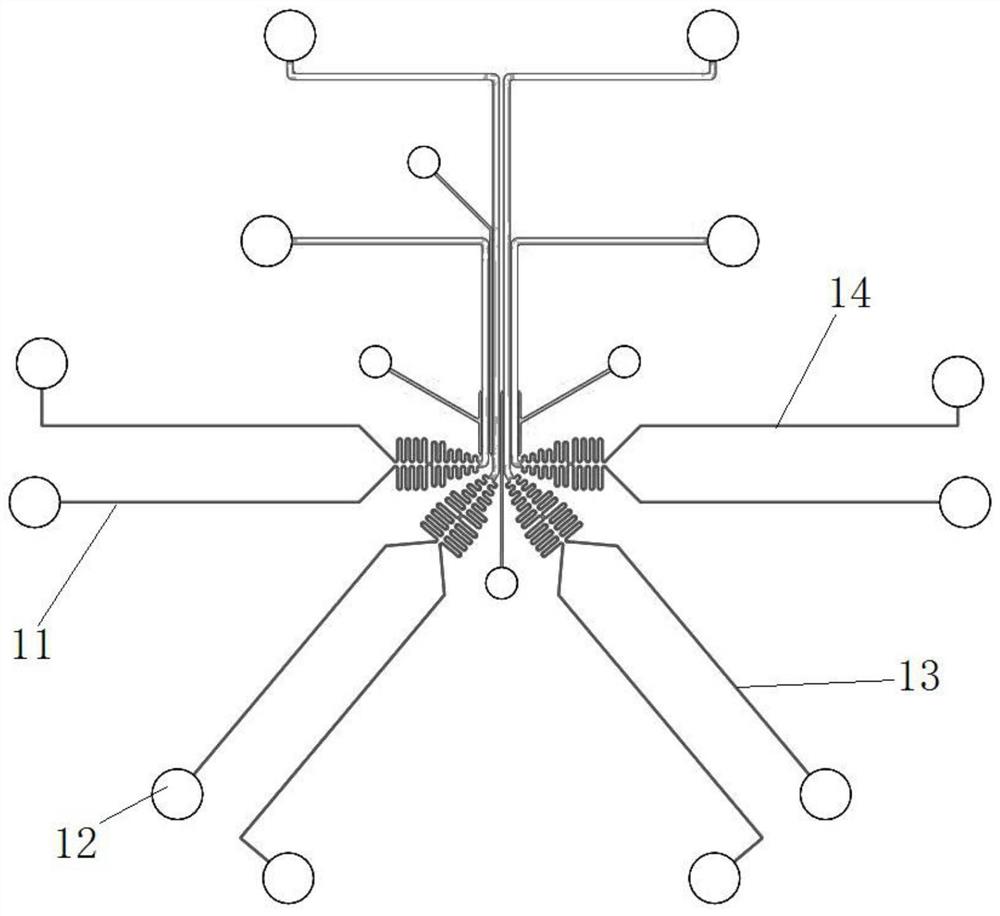
图1为本发明一种细胞迁移特性分析用多通道微流控芯片的结构示意图;
图2为本发明一种细胞迁移特性分析用多通道微流控芯片中细胞迁移运动分析单元一的结构示意图;
图3为本发明一种细胞迁移特性分析用多通道微流控芯片中细胞迁移运动分析单元二的结构示意图;
图4为本发明一种细胞迁移特性分析用多通道微流控芯片中细胞迁移运动分析单元三的结构示意图;
图5为本发明一种细胞迁移特性分析用多通道微流控芯片中细胞迁移运动分析单元四的结构示意图;
图6为本发明四通道芯片四个细胞迁移运动分析单元结构示意图;
图7为本发明高血糖-相同FMLP的结论图;
图8为本发明正常细胞-不同FMLP得出的结论图;
图9为本发明从左往右依此为0mM/L、1mM/L、5mM/L、25mM/L浓度葡萄糖处理下的中性粒细胞在0min和15min的迁移情况。
其中:
11、细胞迁移运动分析单元一,11(1)、细胞加载单元一,11(1)a、细胞注入口一,11(1)b、细胞注入管道一,11(2)、细胞趋化单元一,11(2)a、趋化因子注入口一,11(2)b、细胞培养液注入口一,11(2)c、趋化因子注入管道一,11(2)d、细胞培养液注入管道一,11(2)e、蛇形管道一,11(2)f、细胞迁移运动管道一,11(2)g、废液排出口一,11(3)、细胞阻拦单元一;
12、细胞迁移运动分析单元二,12(1)、细胞加载单元二,12(1)a、细胞注入口二,12(1)b、细胞注入管道二,12(2)、细胞趋化单元二,12(2)a、趋化因子注入口二,12(2)b、细胞培养液注入口二,12(2)c、趋化因子注入管道二,12(2)d、细胞培养液注入管道二,12(2)e、蛇形管道二,12(2)f、细胞迁移运动管道二,12(2)g、废液排出口二,12(3)、细胞阻拦单元二;
13、细胞迁移运动分析单元三,13(1)、细胞加载单元三,13(1)a、细胞注入口三,13(1)b、细胞注入管道三,13(2)、细胞趋化单元三,13(2)a、趋化因子注入口三,13(2)b、细胞培养液注入口三,13(2)c、趋化因子注入管道三,13(2)d、细胞培养液注入管道三,13(2)e、蛇形管道三,13(2)f、细胞迁移运动管道三,13(2)g、废液排出口三,13(3)、细胞阻拦单元三;
14、细胞迁移运动分析单元四,14(1)、细胞加载单元四,14(1)a、细胞注入口四,14(1)b、细胞注入管道四,14(2)、细胞趋化单元四,14(2)a、趋化因子注入口四,14(2)b、细胞培养液注入口四,14(2)c、趋化因子注入管道四,14(2)d、细胞培养液注入管道四,14(2)e、蛇形管道四,14(2)f、细胞迁移运动管道四,14(2)g、废液排出口四,14(3)、细胞阻拦单元四。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
一种细胞迁移特性分析用多通道微流控芯片,结合图1至图6所示,包括玻璃基板及紧密贴合设置在玻璃基板上的PDMS芯片主体,PDMS芯片主体与玻璃基板通过等离子体键合工艺处理后实现两者之间的紧密贴合。
PDMS芯片主体上并列设置有若干组用于生成不同趋化因子浓度梯度环境的细胞迁移运动分析单元。本发明中细胞迁移运动分析单元并列设置有四个,可以同时设置四组不同的趋化因子浓度梯度环境。
每一个细胞迁移运动分析单元均包括:细胞加载单元、细胞趋化迁移单元、细胞阻拦单元。
细胞加载单元,用于注入细胞和确定细胞初始位置。
细胞趋化迁移单元,用于加入细胞培养液和趋化因子,并能够形成趋化因子浓度梯度,吸引细胞发生迁移运动。
细胞阻拦单元,用于在浓度梯度未形成时,阻拦细胞越过细胞初始位置定位区域。
细胞加载单元包括:细胞加载口、细胞加载管道和细胞初始位置定位区域。
细胞加载口,用于注入细胞。
细胞加载管道,与细胞加载口相连通。
细胞初始位置定位区域,细胞能够沿着细胞加载管道到达细胞初始位置定位区域。
细胞阻挡单元距玻璃基板的距离为5μm,略小于细胞直径,注入的细胞将被细胞阻挡单元阻隔在细胞初始位置定位区域。
细胞趋化迁移单元包括:细胞培养液加载口、趋化因子加载口、细胞培养液管道、趋化因子管道、废液出口、细胞迁移运动管道。
细胞培养液加载口,用于加入细胞培养液;
趋化因子加载口,用于加入趋化因子;
蛇形管道,通过细胞迁移运动管道与细胞培养液加载口相连接,并通过细胞培养液管道与趋化因子加载口相连接,加入的趋化因子和细胞培养液能够通过蛇形管道平衡双方压力差;
细胞迁移运动管道,经蛇形管道平衡双方压力差后的趋化因子和细胞培养液能够汇入细胞迁移运动管道,在细胞迁移运动管道形成稳定的浓度梯度;废液出口,与细胞迁移运动管道相连接,能够将废液排出。
趋化因子加载口和细胞培养液加载口中的液体沿着趋化因子管道和细胞培养液管道流入,在经过蛇形管道平衡双方压力差之后,汇入细胞迁移运动管道,在细胞迁移运动管道形成稳定的浓度梯度。
细胞感受到趋化因子的存在以后,将会穿过细胞阻挡单元,进而从细胞初始位置定位区域进入细胞迁移运动管道。细胞迁移运动管道可以被置于显微镜观测装置下方观察细胞的迁移运动特性。4组不同趋化因子浓度梯度环境中的细胞趋化迁移运动状态可以被同时记录并分析。
实施例2
本实施例公开了一种细胞迁移特性分析方法,包括以下步骤:
S1、制备微流控芯片,分离中性粒细胞,制备不同浓度的葡萄糖溶液、趋化因子溶液、细胞培养溶液以及fibrenectin溶液。
S2、将中性粒细胞放入不同浓度葡萄糖溶液中进行培育,培育一个小时。
S3、将微流控芯片管道铺满fibrenectin溶液中进行放置,放置四十五分钟。
S4、将fibrenectin溶液吸出,将微流控芯片管道铺满细胞培养溶液,放置四十五分钟。
S5、将微流控芯片放入显微镜系统并调好焦距,找到细胞迁移运动区域,同时设定图像采集间隔时间和数量。
S6、将分离的中性粒细胞用移液枪注入细胞注入口一11(1)a、细胞注入口二12(1)a、细胞注入口三13(1)a、细胞注入口四14(1)a四个细胞注入口当中。
S7、待中性粒细胞排列在细胞初始位置定位区域后,用移液枪取100μL趋化因子分别注入趋化因子注入口一11(2)a、趋化因子注入口二12(2)a、趋化因子注入口三13(2)a、趋化因子注入口四14(4)a四个趋化因子注入口中。同时,用移液枪取100μL的细胞培养液注入细胞培养液注入口一11(2)b、细胞培养液注入口二12(2)b、细胞培养液注入口三13(2)b、细胞培养液注入口四14(2)b四个细胞培养液注入口。
S8、趋化因子注入口和细胞培养液注入口中的试剂将沿着趋化因子注入管道和细胞培养液管道流入,在蛇形管道一11(2)e、蛇形管道二12(2)e、蛇形管道三13(2)e、蛇形管道四14(2)e内稳定压力差后,流入细胞迁移运动管道一11(2)f、细胞迁移运动管道二12(2)f、细胞迁移运动管道三13(2)f、细胞迁移运动管道四14(2)f,并构建稳定的浓度梯度环境。
S9、细胞感受到趋化因子的存在后,将会穿过细胞阻挡单元,从细胞初始位置定位区域进入细胞迁移运动管道。
不同趋化因子浓度梯度环境中的细胞趋化迁移运动状态被细胞趋化迁移分析系统同时记录并分析。
在进行细胞迁移特性分析时,通过将第一幅和最后一幅细胞图像的宽度像素均分为10份,采用细胞分区计数和数字得分方法对细胞趋化性进行简单分析。
也可在进行细胞迁移特性分析时,通过识别细胞的中心坐标并结合最小距离法追踪细胞运动追迹,进而计算细胞的趋化性指数、总迁移距离、运动速度和梯度位移。
实施例3
本实施例公开了高血糖对中性粒细胞趋化影响,包括以下步骤:
步骤1:制备微流控芯片,分离中性粒细胞,制备0mM/L、1mM/L、5mM/L、25mM/L的葡萄糖,0.4%的BSA(牛血清白蛋白)溶液,1g/L的fibrenectin溶液,10nM/L的fMLP(N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸)溶液。
步骤2:将微流控芯片管道铺满fibrenectin溶液,放置四十五分钟。
步骤3:将fibrenectin溶液吸出,将微流控芯片管道铺满0.4%的BSA溶液,放置四十五分钟。
步骤4:将微流控芯片放入常规的显微镜系统或者本发明所提供的便携式细胞趋化迁移分析系统上并调好焦距,找到细胞迁移运动区域。同时设定图像采集间隔时间和数量。
步骤5:将分离的中性粒细胞用移液枪注入细胞注入口一1(1)a、细胞注入口二2(1)a、细胞注入口三3(1)a、细胞注入口四4(1)a四个细胞注入口当中。
步骤6:待中性粒细胞排列在细胞初始位置定位区域后,用移液枪取100μL的10nM/L fMLP分别注入趋化因子注入口一11(2)a、趋化因子注入口二12(2)a、趋化因子注入口三13(2)a、趋化因子注入口四14(4)a四个趋化因子注入口。同时,用移液枪取100μL的0.4%的BSA溶液注入细胞培养液注入口一11(2)b、细胞培养液注入口二12(2)b、细胞培养液注入口三13(2)b、细胞培养液注入口四14(4)b四个细胞培养液注入口。
步骤7:fMLP溶液和BSA溶液沿着趋化因子注入管道和细胞培养液管道流入,在蛇形管道一11(2)e、蛇形管道二12(2)e、蛇形管道三13(2)e、蛇形管道四14(2)e内稳定压力差后,流入细胞迁移运动管道一11(2)f、细胞迁移运动管道二12(2)f、细胞迁移运动管道三13(2)f、细胞迁移运动管道四14(2)f,并构建稳定的浓度梯度环境。
步骤8:将微流控芯片安装在便携式细胞趋化迁移分析系统上,并开启相机采集微流控芯片内细胞的实时运动图像并进行细胞趋化迁移行为分析。
步骤9:细胞趋化迁移分析系统软件经过图像采集、图像预处理、Canny算法、细胞图像分区技术算法、细胞图像分区技术算法对中性粒细胞的趋化速度V
实施例4
本实施例公开了不同浓度趋化因子(fMLP)对中性粒细胞趋化影响,包括以下步骤:
步骤1:制备微流控芯片,分离中性粒细胞,制备0nM/L、1nM/L、10nM/L、100nM/LfMLP,0.4%的BSA溶液以及1g/L fibrenectin溶液。
步骤2:将微流控芯片管道铺满fibrenectin溶液,放置四十五分钟。
步骤3:将fibrenectin溶液吸出,将微流控芯片管道铺满0.4%的BSA溶液,放置四十五分钟。
步骤4:将微流控芯片放入常规的显微镜系统或者本发明所提供的便携式细胞趋化迁移分析系统上并调好焦距,找到细胞迁移运动区域。同时设定图像采集间隔时间和数量。
步骤5:将分离的中性粒细胞用移液枪注入细胞注入口一1(1)a、细胞注入口二2(1)a、细胞注入口三3(1)a、细胞注入口四4(1)a四个细胞注入口当中。
步骤6:待中性粒细胞排列在细胞初始位置定位区域后,用移液枪取100μL的0nM/L、1nM/L、10nM/L、100nM/L fMLP溶液分别注入趋化因子注入口一11(2)a、趋化因子注入口二12(2)a、趋化因子注入口三13(2)a、趋化因子注入口四14(4)a四个趋化因子注入口。同时,用移液枪取100μL的0.4%的牛血清白蛋白注入细胞培养液注入口一11(2)b、细胞培养液注入口二12(2)b、细胞培养液注入口三13(2)b、细胞培养液注入口四14(4)b四个细胞培养液注入口。
步骤7:趋化因子注入口和细胞培养液注入口中的试剂将沿着趋化因子注入管道和细胞培养液管道流入,在蛇形管道一11(2)e、蛇形管道二12(2)e、蛇形管道三13(2)e、蛇形管道四14(2)e内稳定压力差后,流入细胞迁移运动管道一11(2)f、细胞迁移运动管道二12(2)f、细胞迁移运动管道三13(2)f、细胞迁移运动管道四14(2)f,并构建稳定的浓度梯度环境。
步骤8:将微流控芯片安装在便携式细胞趋化迁移分析系统上,并开启相机采集微流控芯片内细胞的实时运动图像并进行细胞趋化迁移行为分析。
步骤9:细胞趋化迁移分析系统软件经过图像采集、图像预处理、Canny算法、细胞图像分区技术算法、细胞图像分区技术算法对中性粒细胞的趋化速度V
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种细胞迁移特性分析用多通道微流控芯片及方法
- 一种适用于细胞迁移分析的多通道微流控芯片及其应用
