药物制剂
文献发布时间:2023-06-19 10:51:07
技术领域
本发明涉及一种膜,其包含一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物,和一种或多种大麻素,例如Δ
背景技术
大麻素是一类不同的化合物,其作用于细胞中的大麻素受体。大麻素受体是膜结合G蛋白偶联受体(GPCR)。目前,有两种公认类型的大麻素受体,CB
CB
CB
大麻素可以作为任何不同的大麻素受体,如CB
大麻素可以基于它们的来源广泛地分成三种不同的类别,尽管这些类别在它们中包含各种各样的化学结构:(i)植物大麻素;(ii)内源性大麻素;和(iii)合成大麻素。
植物大麻素(有时称为“经典大麻素”)是可以从植物,特别是大麻属(Cannabis)植物属(包括大麻(Cannabis sativa)、印度大麻(Cannabis indica)和莠草大麻(Cannabisruderalis))。它们在植物的腺毛中作为粘性树脂产生。从大麻属植物中至少分离了113种化合物。这些化合物最普遍和充分研究的包括四氢大麻酚(THC)和大麻二酚(CBD)。THC是大麻属植物的主要精神活性成分。Delta-9-THC(Δ
内源性大麻素是体内产生的激活大麻素受体的物质。常见的内源性大麻素包括花生四烯酰胺(AEA)、2-花生四烯酸甘油酯(2-arachidonoylglycerol)(2-AG)、2-花生四烯基甘油醚(2-arachidonyl glyceryl ether)(诺兰丁醚(noladin ether))、N-花生四烯基多巴胺(NADA)、O-花生四烯基乙醇胺(virodhamine)(OAE)和溶血磷脂酰肌醇(lysophosphatidylinositol)(LPI)。内源性大麻素是作为细胞内“脂质信使”的信号分子,其从一个细胞释放并激活其它邻近细胞上的大麻素受体。与许多神经递质相反,内源性大麻素可以作为逆行递质,其以与普通突触递质流相反的方向行进。因此,内源性大麻素从突触后神经元有效释放,并作用于突触前神经元,其中靶受体通常密集地集中在释放常规神经递质的区域中的轴突末梢上。大麻素受体的活化暂时减少了释放的常规神经递质的量。这种信号传导的下游效应取决于被抑制的神经递质分泌。例如,如果内源性大麻素激活降低了抑制性递质GABA的释放,则净效应是(内源性大麻素释放)突触后神经元的兴奋的增加。
大麻素也可以合成生产。许多合成大麻素是天然存在的大麻素(如THC)的结构类似物。其它合成的大麻素在结构上更不同(所谓的“非经典的”大麻素或“拟大麻”(cannabimimetics)),包括氨烷基吲哚、1,5-二芳基吡唑、喹诺酮和芳基磺酰胺以及二十碳六烯酸酯类(其与内源性大麻素相关)。合成的大麻素包括大麻隆(nabilone,一种屈大麻酚(marinol)的类似物)、利莫那班(一种用作抗肥胖药物和鼓励戒烟的选择性CB
大麻素可以通过降低兴奋性毒性、降低氧化损伤和提高N-花生四烯基乙醇胺(anandamide)水平而在体内稳态和疾病治疗中起作用。[5]大麻素在几个方面具有令人感兴趣的治疗潜力,包括它们可能用作止吐药、食欲刺激剂(例如在衰弱性疾病如癌症和AIDS中)、镇痛药,以及用于治疗多发性硬化、脊髓损伤、图雷特综合征、癫痫和青光眼。[6]
然而,大麻素通常是高度亲脂性的,并且通常具有非常低的水溶性和脂溶性,这给患者施用大麻素造成困难。大麻素可以储存在体内的脂肪沉积物中,这降低了它们的生物利用度。此外,大多数大麻素在肝脏中代谢,尤其是通过细胞色素P450混合功能氧化酶代谢。[7]
源自天然来源的大麻素通常以干燥植物材料的形式(例如通过香烟)或作为浓缩油给予患者。大麻素给药的常用方法包括吸入(即吸烟或气化)、口服给药和透皮给药。例如,那西莫醇(nabiximols)是一种口腔喷雾剂,其包含Δ
然而,现有的每种给药方法都有明显的缺点。吸大麻素烟被许多人认为是令人不愉快的,并且与低剂量准确性和递送至患者的肺的剂量的高度差异有所有关。此外,烟雾中的许多化学物质是已知的致癌物,并且吸大麻烟可能与支气管刺激和支气管扩张有关。[8][9]气化被认为比吸入烟更安全,并且允许患者对剂量更好地控制,但是仍然与递送至肺的剂量的高度差异有关,并且仍然经常被认为是令人不愉快的。同时,口服制剂与极差的生物利用度和高的起效时间有关。给药剂量的大部分在胃的酸性环境中被水解,而更多的剂量在肝脏中进行首过代谢。特别是,Δ
总之,目前没有大麻素制剂可以以不使患者不愉快的方式给药,没有吸入致癌物质的危险,起效时间短,并且其产生大麻素的可接受的生物利用度和血浆浓度,且患者之间的差异性低。
发明内容
本发明基于出乎意料的发现,即大麻素或其药学上可接受的盐的制剂,在适于施用至口腔的膜中,可提供用于治疗广泛的病症的期望的特性的平衡。
因此,本发明首次提供了包含一种或多种大麻素或其药学上可接受的盐的适于施用至口腔的膜,其在治疗患有可通过大麻素治疗或减轻的病症的患者中的用途,及其制造方法。
在一个方面,本发明提供了适于口腔施用的膜,包含:
(i)一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物;以及
(ii)活性药物成分(API),其是一种或多种大麻素或其药学上可接受的盐。
在另一方面,本发明提供用于治疗人类患者的本发明所述的膜。
在另一方面,本发明提供了用于治疗人类患者的疾病或病症的本发明所述的膜,其中所述疾病或病症选自由:癌症;痴呆;阿尔茨海默病;肌萎缩性侧索硬化;肌张力障碍;癫痫;亨廷顿氏病;多发性硬化;帕金森氏病;痉挛;图雷特综合征;肠易激病(IBD);克罗恩氏病;溃疡性结肠炎;厌食症;恶病质;癌症引起的恶心和/或呕吐;癌症诱导的恶病质;青光眼;慢性疼痛;癌症诱导的疼痛;纤维肌痛;神经性疼痛;成瘾;焦虑;双相性精神障碍;创伤后应激障碍;精神病;精神分裂症;硬皮病;和I型糖尿病,所组成的群组。
在另一方面,本发明提供了治疗人类患者的疾病或病症的方法,其中所述方法包括向人类患者施用至少一种本发明所述的膜,并且其中所述疾病或病症选自由:癌症;痴呆;阿尔茨海默病;肌萎缩性侧索硬化;张力障碍;癫痫;亨廷顿氏病;多发性硬化;帕金森氏病;痉挛;图雷特综合征;肠易激病;克罗恩氏病;溃疡性结肠炎;厌食症;恶病质;癌症引起的恶心和/或呕吐;癌症诱导的恶病质;青光眼;慢性疼痛;癌症诱导的疼痛;纤维肌痛;神经性疼痛;成瘾;焦虑;双相性精神障碍;创伤后应激障碍;精神病;精神分裂症;硬皮病;和I型糖尿病,所组成的群组。
在另一方面,本发明提供了本发明所述的膜用于制造用于治疗人类患者的疾病或病症的药物的用途,其中所述疾病或病症选自由:癌症;痴呆;阿尔茨海默病;肌萎缩性侧索硬化;张力障碍;癫痫;亨廷顿氏病;多发性硬化;帕金森氏病;痉挛;图雷特综合征;肠易激病;克罗恩氏病;溃疡性结肠炎;厌食症;恶病质;癌症引起的恶心和/或呕吐;癌症诱导的恶病质;青光眼;慢性疼痛;癌症诱导的疼痛;纤维肌痛;神经性疼痛;成瘾;焦虑;双相性精神障碍;创伤后应激障碍;精神病;精神分裂症;硬皮病;和I型糖尿病,所组成的群组。
在另一方面,本发明提供制造本发明所述的膜的方法,所述方法包含以下步骤:
(a)以下任一步骤:
(i)可选地,将至少一种抗氧化剂混合在水中、或在水/有机溶剂的混合中、或在一种或多种有机溶剂中;
(ii)将API混合在水中、或在水/有机溶剂的混合中、或在随后向其中加入水的一种或多种有机溶剂中,或在步骤(i)中获得的溶液中,可选地其中在加入API之前或之后通过加入合适的酸或碱,通常是稀释的酸或碱的水溶液,更通常是稀释的碱的水溶液,将溶液的pH调节至所需水平,并且优选地其中将溶液的pH调节至3.0至13.5;
(iii)可选地,超声处理所述溶液;
(iv)可选地,将一种或多种赋形剂、调味剂、缓冲组分、渗透促进剂、SEDDS(例如SMEDDS或SNEDDS)、螯合剂、抗氧化剂和/或抗微生物剂混合到步骤(ii)或步骤(iii)中获得的溶液中;以及
(v)在合适的条件下添加一价阳离子海藻酸盐,形成粘性浆液(cast);
或者以下步骤:
(i)将一价阳离子海藻酸盐在水中混合,直到获得无团块的分散体,并且可选地在加入海藻酸盐之前或之后,将一种或多种赋形剂、调味剂、缓冲组分、渗透促进剂、SEDDS(例如SMEDDS或SNEDDS)、螯合剂、抗氧化剂和/或抗微生物剂加入水溶液中;
(ii)分别地,将API溶解在水、水/有机溶剂的混合或一种或多种有机溶剂中,可选地,其中至少一种抗氧化剂预先溶解在溶剂中,可选地,其中在API加入之前或之后通过加入合适的酸或碱,通常是稀释的酸或碱的水溶液,更通常是稀释的碱的水溶液,将溶液的pH调节至所需水平,并且优选地,其中将溶液的pH调节至3.0至13.5;以及
(iii)在合适的条件下将步骤(i)中获得的溶液加入到步骤(ii)中获得的溶液中,形成粘性浆液;
或者以下步骤:
(i)将API混合在油相中;
(ii)将表面活性剂和助溶剂预混合,然后将其加入到所得溶液中;
(iii)可选地,在步骤(i)中在混合下向水中加入一种或多种赋形剂、调味剂、缓冲组分、渗透促进剂、螯合剂、抗氧化剂和/或抗微生物剂;
(iv)在搅拌下,优选连续搅拌,并且更优选其中以滴加方式将水或步骤(iii)中获得的溶液加入到步骤(ii)中获得的溶液中;以及
(v)将一价阳离子海藻酸盐混入溶液中,直至获得无团块的分散体,并可选地加入另外的水以调节形成的浆液的粘度;
或者以下步骤:
(i)将API混合在增溶剂中;
(ii)将所得溶液加入水中,优选在高剪切混合下加入;
(iii)可选地,加入一种或多种赋形剂、调味剂、缓冲组分、渗透促进剂、螯合剂、抗氧化剂和/或抗微生物剂;以及
(iv)将一价阳离子海藻酸盐混合到溶液中,直至获得无团块的分散体,并可选地加入另外的水以调节形成的浆液的粘度;
(b)可选地,向步骤(a)中获得的浆液中加入一种或多种其它赋形剂、调味剂、缓冲组分、渗透促进剂、SEDDS(例如SMEDDS或SNEDDS)、螯合剂、抗氧化剂和/或抗微生物剂;
(c)可选地,使所述浆液脱气;
(d)将所述浆液倒到表面上,并将所述浆液铺开至所需厚度;
(e)干燥所述浆液层,通常在30至70℃的温度下干燥,直到所述膜的残余水含量为按重量计0至20%并且形成固体膜;以及
(f)可选地,将所述固体膜切成期望大小的小块,进一步可选地将这些小块置于小袋中,优选地其中所述小袋由衬有PET的铝制成,将所述小袋密封,并进一步可选地对其进行标记。
附图说明
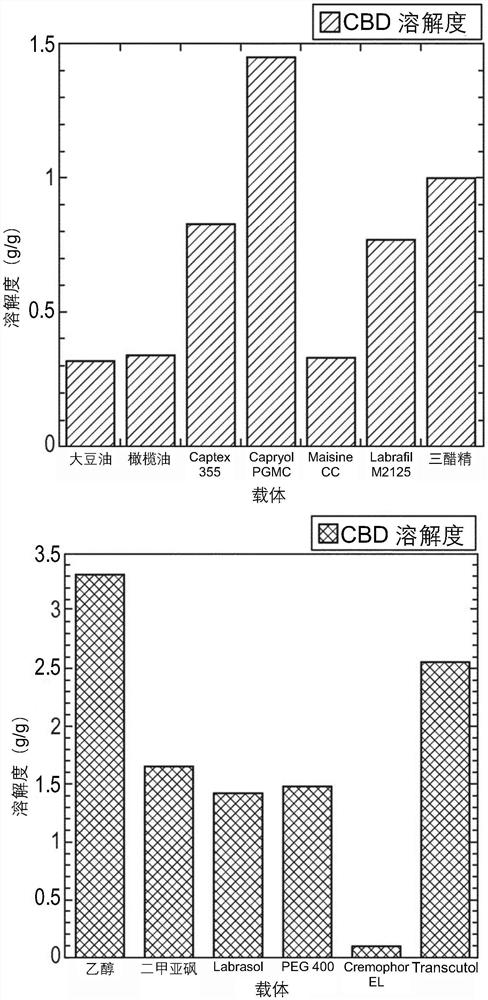
图1显示了表示CBD在各种不同溶剂中的溶解度(g/g)的柱状图。
图2显示了在给予用于口服给药的基于乳剂的CBD膜(F1)、基于非乳剂的CBD膜(F2)或包封在明胶片剂中的基于乳剂的CBD膜(F3)后0至480分钟的时间段内,成年比格犬(n=3)的血浆中CBD的剂量调整的血浆水平。所有剂量水平被调整为10mg(实际9.93mg)剂量当量。
图3显示了在给予用于口服给药的基于乳剂的CBD膜(F1)、基于非乳剂的CBD膜(F2)或包封在明胶片剂中的基于乳剂的CBD膜(F3)后0至60分钟的时间段内,成年比格犬(n=3)的血浆中CBD的剂量调整的血浆水平。所有剂量水平被调整为10mg(实际9.93mg)剂量当量。
具体实施方式
本发明涉及一种适用于口腔施用的膜,其可用于向人类患者递送大麻素或其药学上可接受的盐。这种膜还可称作可口腔溶解膜(ODF)和/或透口腔粘膜膜(OTF)。所述膜通常是海藻酸盐膜,其由患者自身或其他人,例如医师、护士、护理人员、社会工作者、患者同事或患者家庭成员施用于口腔粘膜。所述膜具有生物粘附性,并在施用之后粘附至口腔表面。在施用之后,海藻酸盐膜开始溶解,释放活性药物成分。本发明特别用于治疗疾病或病症,例如痴呆、阿尔茨海默病、癫痫、炎性肠病、克罗恩病、溃疡性结肠炎、慢性疼痛、癌症诱导的疼痛、纤维肌痛和神经性疼痛。
为避免疑义,所有与膜本身相关的替代和优选特征同样适用于所述膜在人类患者治疗中的用途。
定义
如本文所定义,术语“烷基”是指具有前缀中所示的碳原子数的直链或支链饱和一价烃基。因此,术语“C
如本文所定义,术语“烯基”是指具有前缀中所示的碳原子数且含有至少一个双键的直链或支链饱和一价烃基。因此,术语“C
如本文所定义,术语“酰基”是指-COR基团,其中R是各自如本文所定义的烷基、卤代烷基、环烷基、环烷烷基、芳基、芳烷基、杂芳基、杂芳烷基(heteroaralkyl)、杂环基或杂环烷基,或聚(乙二醇),且其中R可选地进一步被一个、两个、三个、四个或更多个取代基取代,所述取代基独立地选自烷基、烷氧基、卤素、卤代烷氧基、-OH、-NH
如本文所定义,术语“亚烷基”是指直链饱和二价烃基或支链饱和二价烃基,例如亚甲基、亚乙基、亚丙基、1-甲基亚丙基、2-甲基亚丙基、亚丁基、亚戊基等。
如本文所定义,术语“烷氧基”是指-OR基团,其中R是如上定义的烷基,例如甲氧基、乙氧基、正丙氧基、异丙氧基、正丁基、异丁基、叔丁基等。
如本文所定义,术语“烷氧羰基”是指-C(O)OR基团,其中R是各自如本文所定义的烷基、卤代烷基、环烷基、环烷烷基、芳基、芳烷基、杂芳基、杂芳烷基、杂环基或杂环烷基,或聚(乙二醇),并且其中R可选地进一步被一个、两个、三个、四个或更多个取代基取代,所述取代基独立地选自烷基、烷氧基、卤素、卤代烷氧基、-OH、-NH
如本文所定义,术语“烷氨基”是指-NHR基团,其中R是如上定义的烷基,例如甲氨基、乙氨基、正丙氨基、异丙氨基等。
如本文所定义,术语“芳基”是指具有6至10个环原子的一价单环或双环芳族烃基,例如苯基或萘基等。
如本文所定义,术语“芳烷基”是指-(亚烷基)-R基团,其中R是如上定义的芳基。
如本文所定义,术语“大麻二酚酸-C
其中虚线(-----)表示与分子的其余部分的接触点。
如本文所定义,术语“氨基甲酸酯”是指-C(O)NR
如本文所定义,术语“环烷基”是指三至十个碳原子的环状饱和一价烃基,其中一个或两个碳原子可被氧代基置换,例如环丙基、环丁基、环戊基或环己基等。
如本文所定义,术语“环烷烷基”是指-(亚烷基)-R基团,其中R是如上定义的环烷基,例如环丙甲基、环丁甲基、环戊乙基或环己甲基等。
如本文所定义,术语“卤代”是指氟代、氯代、溴代或碘代,优选氟代或氯代。
如本文所定义,术语“卤代烷基”是指如上定义的烷基,其被一个或多个卤原子,优选一至五个卤原子,优选氟或氯取代,包括被不同卤素取代者,例如CH
如本文所定义,术语“卤代烷氧基”是指-OR基团,其中R是如上定义的卤代烷基,例如-OCF
如本文所定义,术语“杂芳基”是指5至10个环原子的一价单环或双环芳族基团,其中一个或多个,优选一个、两个或三个环原子为选自N、O或S的杂原子,其余环原子为碳。代表性的实例包括但不限于吡咯基、噻吩基、噻唑基、咪唑基、呋喃基、吲哚基、异吲哚基、噁唑基、异噁唑基、苯并噻唑基、苯并噁唑基、喹啉基、异喹啉基、吡啶基、嘧啶基、吡嗪基、哒嗪基、三唑基、四唑基等。
如本文所定义,术语“杂芳烷基”是指-(亚烷基)-R基团,其中R是如上定义的杂芳基。
如本文所定义,术语“杂环基”是指4至8个环原子的饱和或不饱和一价单环基团,其中一个或两个环原子为选自N、O或S(O)
如本文所定义,术语“杂环烷基”是指-(亚烷基)-R基团,其中R是如上定义的杂环基环,例如四氢呋喃基甲基、哌嗪基甲基、吗啉基乙基等。
如本文所定义,术语“口腔”被理解为指口腔,包括内上唇和下唇、内颊的所有部分、舌下区域、舌本身、以及上齿龈和下齿龈以及硬腭和软腭。
如本文所定义,术语“口腔粘膜”应理解为指口腔内部的粘膜衬里,并且包括(但不是唯一指)颊、唇、舌下、齿龈或唇区域、软腭和硬腭中的粘膜。
如本文所定义,波浪线
本发明的膜
本发明提供了一种适于口腔施用的膜,其包含:
(i)一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物;以及
(ii)活性药物成分(API),其是一种或多种大麻素或其药学上可接受的盐。
所述一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物在膜内的功能是作为成膜剂。如本文中所使用,术语“成膜剂”是指一种化学品或一群化学品,其在施用至表面时会形成韧性的、粘着的并且连续的覆盖。
海藻酸盐,即海藻酸的盐,是由褐藻(褐藻纲,主要是海带属)天然产生的线性多糖。本发明中使用的海藻酸盐通常包含在柔性链中连接在一起的100至3000个单体残基。这些残基有两种类型,即β-(1,4)-连接的D-甘露糖醛酸(M)残基和α-(1,4)-连接的L-古洛糖醛酸(G)残基。通常,聚合物中每个残基的羧酸基团在生理pH下通常会被离子化。所述两种残基类型互为差向异构体,仅在其C5位置处的立体化学方面不同,D-甘露糖醛酸残基在聚合后通过酶转化为L-古洛糖醛酸残基。但是,在聚合物链中,所述两种残基类型会产生非常不同的构型:如以下式(A)所示,相邻的任意两个D-甘露糖醛酸残基是
通常在海藻酸盐聚合物中,残基以重复或严格交替的残基嵌段组织,例如MMMMM……、GGGGG……或GMGMGM……。可存在不同的一价阳离子和多价阳离子,作为海藻酸盐聚合物的D-甘露糖醛酸残基和L-古洛糖醛酸残基带负电荷的羧酸根基团的反离子。通常,所述膜包含其中海藻酸盐聚合物的反离子是一价阳离子海藻酸盐。作为单个海藻酸盐聚合物分子的反离子的阳离子可全都彼此相同,或可彼此不同。优选地,海藻酸盐聚合物的反离子选自由Na
通常,所述膜包含海藻酸盐组合物,其动力粘度使用Brookfield LVF粘度计(从Brookfield Engineering Laboratories,Inc.获得)使用2号锭子在其10%的水溶液(w/w)上在20℃的温度下在20rpm的剪切速率下所测量为100-1000mPa·s,或200-800mPa·s,或300-700mPa·s。
优选地,所述膜包括平均古洛糖醛酸盐(G)含量为按重量计50至85%,更优选按重量计60至80%,最优选按重量计65至75%的藻酸盐组合物。优选地,所述膜包含平均甘露糖醛酸盐(M)含量为按重量计15%至50%、更优选按重量计20%至40%、最优选按重量计25%至35%的海藻酸盐组合物。优选地,所述膜包含平均分子量为30,000g/mol至90,000g/mol的海藻酸盐组合物,例如35,000g/mol至85,000g/mol,或者40,000g/mol至70,000g/mol,或者40,000g/mol至50,000g/mol。优选地,所述膜包含平均古洛糖醛酸盐(G)含量为50至85%、平均甘露糖醛酸盐(M)含量为15至50%、和平均分子量范围为30,000g/mol至90,000g/mol的藻酸盐组合物。更优选地,所述膜包含平均古洛糖醛酸盐(G)含量为60至80%、平均甘露糖醛酸盐(M)含量为20至40%、且平均分子量范围为30,000g/mol至90,000g/mol的藻酸盐组合物。最优选地,所述膜包含平均古洛糖醛酸盐(G)含量为65至75%、平均甘露糖醛酸盐(M)含量为25至35%、和平均分子量为30,000g/mol至90,000g/mol的藻酸盐组合物。
一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物可以是膜中存在的仅有的成膜剂。或者是,除了一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物之外,所述膜还可包含一种或多种进一步的成膜剂。
所述膜优选包含
不希望受到任何特定理论的约束,在通过粘附至所述口腔的粘膜给口腔施用之后,包含较高粘度海藻酸盐的膜被认为具有比包含类似厚度的较低粘度海藻酸盐的膜具有更长的停留时间(即溶解时间)。可以设想,可通过将任意数量的具有不同粘度的海藻酸盐混合对膜内的海藻酸盐组合物的粘度进行调节。通常,包含
因此,如果期望所述膜在口腔内具有较长的停留时间,那么所述膜通常优选包含
所述膜特别优选包含
所述膜还可包含一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物之外的成膜剂。这种其它成膜剂包括像聚(乙烯基吡咯烷酮)(PVP)、普鲁兰多糖(pullulan)等。但是,如果除了一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物之外在膜中还存在任何其它成膜剂,那么一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物通常将以比存在的任何其它成膜剂更多的量存在于膜中。优选地,所述膜中存在的一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物,与膜中存在的所有其它成膜剂(例如PVP和/或普鲁兰多糖)的合并总和的比例(以重量计)是1:1或更高,或者2:1或更高,或者3:1或更高,或者4:1或更高,或者5:1或更高,或者10:1或更高,或者20:1或更高,或者50:1或更高,或者100:1或更高,或者500:1或更高,或者1000:1或更高,或者10000:1或更高。优选地,一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物会构成膜中存在的所有成膜剂的按重量计至少50%,更优选构成膜中存在的所有成膜剂的按重量计至少60%、按重量计至少70%、按重量计至少80%、按重量计至少90%、按重量计至少95%、按重量计至少98%、按重量计至少99%、按重量计至少99.5%、按重量计至少99.9%、按重量计至少99.95%,或按重量计至少99.99%。
优选地,一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物基本上是膜中存在的仅有的成膜剂。更优选地,一价阳离子的藻酸盐或含有至少一种一价阳离子的藻酸盐混合物是存在于膜中的唯一成膜剂。或者是,所述膜优选不包含任何或基本上任何聚(乙烯基吡咯烷酮)。或者是,所述膜优选不包含任何或基本上任何普鲁兰多糖。
如本文中所使用,在提及不包含“基本上任何”特定组分的膜时是指所述膜可含有痕量的所述特定组分,只要所述特定组分不会实质影响膜的基本特征。通常,因此,不包含基本上任何特定组分的膜通常含有小于5重量%的所述特定组分,优选小于1重量%的所述特定组分,最优选小于0.1重量%的所述特定组分。
本发明的一个发现是,使用一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物作为成膜剂优于使用像PVP和/或普鲁兰多糖这样的可替代成膜剂。特别地,使用海藻酸盐作为主要成膜剂会确保本发明的膜具有比主要包含其它成膜剂,例如PVP和/或普鲁兰多糖,的膜更佳的粘性特性。本发明的膜具有生物粘附性;也就是说,本发明的膜可在其完全溶解之前牢固地粘附至哺乳动物对象的口腔内的潮湿表面(即粘膜)。海藻酸盐不是主要成膜剂的膜通常不具有这一期望的特性。本发明的一个进一步的有利发现是,选择海藻酸盐作为主要成膜剂使得能够向膜中加载治疗有效剂量的活性药物成分(例如Δ
通常,所述膜包含按重量计25%至99%的一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物,优选包含按重量计27%至95%、更优选按重量计29%至93%、再更优选按重量计35%至91%、最优选按重量计35%至90%的一价阳离子海藻酸盐或者含有至少一种一价阳离子海藻酸盐的海藻酸盐混合物。
本发明所述的膜还可含有残留的水含量。通常,所述膜包含按重量计0%至20%的残留水。更典型地,所述膜包含按重量计5%至15%的残留水。优选地,所述膜包含按重量计9%至11%的残留水。最优选地,所述膜包含按重量计约10%的残留水。
本发明所述的膜还包含活性药物成分(API),为一种或多种大麻素或其药学上可接受的盐。通常,API是一种至二十种大麻素或其药学上可接受的盐,优选一种至十种大麻素或其药学上可接受的盐,更优选一种至五种大麻素或其药学上可接受的盐,最优选一种至三种大麻素或其药学上可接受的盐的混合物。API可以是一种大麻素或其药学上可接受的盐。API可以是两种大麻素或其药学上可接受的盐的混合物。API可以是三种大麻素或其药学上可接受的盐的混合物。
每种大麻素通常是大麻素受体的激动剂、大麻素受体的反向激动剂或大麻素受体的拮抗剂。因此,通常,每种大麻素是大麻素受体的激动剂。或者,每种大麻素是大麻素受体的反向激动剂。或者,每种大麻素是大麻素受体的拮抗剂。每种大麻素可以作用于一种或多种大麻素受体,如大麻素受体1(CB
每种大麻素通常是植物大麻素、内源性大麻素或合成大麻素。因此,通常,每种大麻素是植物大麻素。或者,每种大麻素是内源性大麻素。或者,各大麻素是合成大麻素。
通常,存在于膜中的一种或多种大麻素选自由式(I)至(XXI)的化合物组成的群组
其中:
R
R
R
R
R
R
R
式(I)代表所谓的“CBG”型大麻素。式(II)代表所谓的“CBC”型大麻素。式(III)代表所谓的“CBD”型大麻素。式(IV)表示所谓的“Δ
优选地,R
优选地,式(I)至(XXI)的化合物选自大麻萜酚酸A、大麻萜酚酸A单甲醚、大麻萜酚、大麻萜酚单甲醚、次大麻萜酚酸A、次大麻萜酚、大麻橙花酸A(cannabinerolic acidA)、(±)-大麻色烯酸、(±)-大麻色烯、(±)-次大麻色酚酸、(±)-次大麻色烯、(+)-次大麻色酚、2-甲基-2-(4-甲基-2-戊烯基)-7-丙基-2H-1-苯并吡喃-5-醇、大麻二酚酸、(-)-大麻二酚(CBD)、大麻二酚单甲醚、大麻二酚-C
最优选地,式(I)至(XXI)的化合物选自由Δ
为了避免疑义,术语“四氢大麻酚”、“Δ
存在于膜中的一种或多种大麻素可以是内源性大麻素。在这种情况下,优选地,每种内源性大麻素选自N-花生四烯基乙醇胺、2-花生四烯酸甘油酯、2-花生四烯基甘油醚、N-花生四烯基多巴胺、O-花生四烯基乙醇胺和溶血磷脂酰肌醇。N-花生四烯基乙醇胺、2-花生四烯酸甘油酯、2-花生四烯基甘油醚、N-花生四烯基多巴胺、O-花生四烯基乙醇胺和溶血磷脂酰肌醇的结构分别如下面的式(XXIV)至(XXIX)所示。
存在于膜中的一种或多种大麻素可以选自由氨烷基吲哚、1,5-二芳基吡唑、喹诺酮、芳基磺酰胺、二十碳六烯酸组成的群组。在这种情况下,更优选一种或多种大麻素选自由大麻隆、利莫那班、JWH-018、JWH-073、CP-55940、二甲基庚基吡喃、HU-210、HU-331、SR144528、WIN 55,212-2、JWH-133、左旋萘醌、AM-2201和阿佳酸组成的群组。本文所用的术语“大麻隆”可以指(R,R)-(-)-大麻隆、(S,S)-(+)-大麻隆,或其混合物,包括其外消旋混合物。(R,R)-(-)-萘醌、(S,S)-(+)-萘醌、利莫那班、JWH-018、JWH-073、CP-55940、二甲基庚基吡喃、HU-210、HU-331、SR144528、WIN 55,212-2、JWH-133、左南曲多、AM-2201和阿佳酸的结构分别如以下通式(XXX)至(XLIV)所示。
API可以是一种或多种大麻素或药学上可接受的盐的药学上可接受的多晶型物、共晶体、水合物或溶剂化物,优选Δ
或者,API可以是一种或多种大麻素的前药或其药学上可接受的盐,优选Δ
因此,存在于膜中的一种或多种大麻素可以选自式(XLV)的化合物和式(XLVI)的化合物
其中:
R
R
式(I)至(XLVI)的化合物可以含有一个或多个立体中心。例如,在式(II)中,碳2是立体中心。因此,式(II)化合物可以是(R)-对映体、(S)-对映体或其混合物,包括其外消旋混合物。因此,可以将式(I)至(XLVI)的某些化合物分离成光学活性或外消旋形式。如何制备光学活性形式,如通过材料的拆分(resolution),在本领域中是众所周知的。为了避免疑问,除非另有说明(例如通过明确使用虚线
通常,API是一种或多种大麻素的一种或多种药学上可接受的盐。通常,每种大麻素的药学上可接受的盐选自由其乙酸盐、丙酸盐、异丁酸盐、苯甲酸盐、琥珀酸盐、辛二酸盐、酒石酸盐、柠檬酸盐、富马酸盐、丙二酸盐、马来酸盐、己二酸盐、二甲磺酸盐、硫酸盐、苯磺酸盐、硝酸盐、碳酸盐、盐酸盐、氢溴酸盐、磷酸盐、铝、铵、钙、铜、铁、亚铁、锂、镁、锰、亚锰、钾、钠、锌、精氨酸、甜菜碱、咖啡因、胆碱、N,N′-二苄基乙二胺、二乙胺、2-二乙氨基乙醇、2-二甲氨基乙醇、乙醇胺、乙二胺、N-乙基吗啉、N-乙基哌啶、葡糖胺、组氨酸、海巴胺、异丙胺、赖氨酸、甲基葡糖胺、吗啉、哌嗪、哌啶、聚胺树脂、普鲁卡因、嘌呤、可可碱、三乙胺、三甲胺、三丙胺和氨丁三醇盐,所组成的群组。优选的盐形式包括大麻素的铝、铵、钙、铜、铁、亚铁、锂、镁、锰、亚锰、钾、钠、锌、精氨酸、甜菜碱、咖啡因、胆碱、N,N′-二苄基乙二胺、二乙胺、2-二乙氨基乙醇、2-二甲氨基乙醇、乙醇胺、乙二胺、N-乙基吗啉、N-乙基哌啶、葡糖胺、组氨酸、海巴胺、异丙胺、赖氨酸、甲基葡糖胺、吗啉、哌嗪、哌啶、聚胺树脂、普鲁卡因、嘌呤、可可碱、三乙胺、三甲胺、三丙胺和氨丁三醇盐。
API可以是从大麻植物获得的提取物。因此,API可以是从大麻获得的提取物。或者,API可以是从印度大麻的提取物。或者,API可以是从莠草大麻获得的提取物。
API可以以不同的量存在于膜内。通常,所述膜包含按重量计0.001%至75%的API,优选按重量计0.01%至60%的API,更优选按重量计0.15%至50%的API,还更优选按重量计0.2%至45%的API,最优选按重量计0.25%至40%的API。在一个实施方案中,所述膜包含按重量计0.25%至20%的API,优选按重量计0.5%至15%的API,更优选按重量计1%至10%的API。
通常,一种或多种大麻素或其药物可接受的盐构成存在于膜中的唯一API。然而,除了大麻素或其药学上可接受的盐之外,所述膜可以可选地包含一种或多种另外的活性药物成分。
优选地,所述膜包含按重量计25%至99%的一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐混合物、按重量计0%至20%的水和按重量计0.001%至75%的API。更优选地,所述膜包含按重量计29%至93%的一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐混合物、按重量计5%至15%的水和按重量计0.15%至50%的API。甚至更优选地,所述膜包含按重量计30%至91%的一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐混合物、按重量计9%至11%的水和按重量计0.2%至45%的API。还更优选地,包含按重量计30%至91%的一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐混合物,按重量计9%至11%的水,和按重量计0.5%至15%的API。
本发明的膜除了API、水和成膜剂外,还可以可选地包含其它组分。通常,本发明所述的膜还包含以下中的一种或多种:
(i)至少一种药学上可接受的溶剂;
(ii)至少一种缓冲组分;
(iii)至少一种赋形剂,例如一种或多种增塑剂或填料;
(iv)至少一种掩味剂或调味剂;
(v)至少一种酸化剂或碱化剂;
(vi)至少一种渗透增强剂;
(vii)自乳化药物递送系统(SEDDS),例如自微乳化药物递送系统(SMEDDS)或自纳米乳化药物递送系统(SNEDDS);
(viii)至少一种螯合剂;
(ix)至少一种抗氧化剂;
(x)至少一种抗微生物剂;以及
(xi)至少一种无机盐。
所述膜可以另外包含一种或多种药学上可接受的溶剂。这种溶剂可以是非水溶剂,或者水和非水溶剂的组合。非水溶剂的实例应该是无毒的,并且包括但不限于乙醇、丙酮、苯甲醇、二乙二醇单乙醚、甘油、己二醇、异丙醇、聚乙二醇、甲氧基聚乙二醇、癸二酸二乙酯、异山梨醇二甲酯、碳酸异丙烯酯、二甲亚砜(DMSO)、transcutol、三醋精、脂肪酸酯和油,例如大豆油、花生油、橄榄油、棕榈油、菜籽油、玉米油、其它植物油等。优选地,所述溶剂是非水溶剂。更优选地,所述溶剂是三醋精。所述膜可包含0%至15%的每种非水溶剂,优选按重量计0.001%至10%的每种非水溶剂,更优选按重量计0.01%至1%的每种非水溶剂。
所述膜可另外还包含任何合适的缓冲组分。如本文所定义,“缓冲组分”是指任何化学实体,其在溶于溶液中时,会使得所述溶液能够防止其在随后添加酸或碱之后的pH改变。用于本发明的膜的合适的缓冲组分是在3.0至13.5的pH范围内是有效缓冲液的缓冲组分。优选地,所述缓冲组分是pH范围为8.0至13.5,更优选10.0至13.0,最优选12.5至13.0的有效缓冲液。合适的缓冲组分的实例包括但不限于:磷酸盐、硫酸盐、柠檬酸盐和乙酸盐。缓冲液可以是一价阳离子的盐,例如钠、钾或铵盐。特别优选的缓冲组分包括柠檬酸和磷酸二氢钠。不希望受任何特定理论的束缚,认为海藻酸盐倾向于在小于3.8的pH下胶凝。因此,希望膜的pH大于3.8。
所述膜可包含按重量计0.1%至10%的缓冲组分,通常按重量计0.2%至8%,通常按重量计0.3%至6%,通常按重量计0.5%至5%。或者,所述膜可以不另外包含缓冲组分。
所述膜可另外还包含任何合适的赋形剂,例如一种或多种填料或增塑剂。所述膜可以同时包含增塑剂和填料。或者,所述膜可以仅包含增塑剂或填料中的一种。所述膜优选包含增塑剂。在一些情况下,可能期望所述膜不包含填料。所述膜特别优选包含增塑剂但是不包含填料。
增塑剂在存在时可选自由聚乙二醇、甘油、山梨醇、木糖醇及其组合组成的群组。通常,所述膜包含选自由甘油、山梨醇及其组合组成的群组的增塑剂。优选地,所述膜包含选自由甘油、山梨糖醇及其组合组成的群组的增塑剂。更优选地,所述膜包含甘油和山梨糖醇作为增塑剂。还更优选地,所述膜包含甘油、山梨糖醇和木糖醇中的全部作为增塑剂。所述膜可包含按重量计0%至40%的存在的每种增塑剂,优选按重量计1%至35%的每种增塑剂,更优选按重量计2%至30%的每种增塑剂,并且最优选按重量计3%至25%的每种增塑剂。
填料在存在时可以是例如微晶纤维素或二氧化钛。合适的填料的量可以是按总的药物组合物的重量计0%至20%,例如按总的药物组合物的重量计0.1%至10%。
所述膜可以另外包含掩味剂或调味剂。掩味剂可以是甜味剂。调味剂在存在时可以例如选自阿拉伯胶、茴香油、葛缕子油、小豆蔻、樱桃糖浆、肉桂、柠檬酸糖浆、丁香油、可可、芫荽油、乙基香草醛、茴香油、姜、甘油、甘草、蜂蜜、熏衣草油、柠檬油、甘露醇、肉豆蔻油、橙油、橙花水、薄荷油、覆盆子、玫瑰油、玫瑰花水、迷迭香油、洋菝葜糖浆、留兰香油、百里香油、甲苯酰香脂糖浆、香草、野生樱桃糖浆及其混合物。所述膜可以包含按重量计0.001%至10%的存在的每种调味剂,优选按重量计0.01%至5%的每种调味剂,并且最优选按重量计0.1%至3%的每种调味剂。
所述膜可以另外包含酸化剂或碱化剂。如本文所定义,“酸化剂”是指可单独或与其它化合物组合用于酸化药物组合物的化合物。如本文所定义,“碱化剂”是指单独或与其它化合物组合可用于碱化药物组合物的化合物。
通常,所述膜包含碱化剂。通常,碱化剂是碱。合适的碱化剂的实例包括但不限于:氢氧化钠、氢氧化锂、氢氧化钾、氢氧化镁和氢氧化钙。优选的碱化剂是氢氧化钠。或者,所述膜可包含酸化剂。合适的酸化剂的实例包括但不限于:乙酸、脱水乙酸、抗坏血酸、苯甲酸、硼酸、柠檬酸、乙二胺四乙酸、盐酸、异硬脂酸、乳酸、硝酸、油酸、磷酸、山梨酸、硬脂酸、硫酸、酒石酸,以及十一碳烯酸。优选的酸化剂是磷酸。
通过干燥成膜溶液(见下文)制备本发明的膜。通常,加入足够量的酸化剂或碱化剂以将成膜溶液的pH调节到3.0至13.5的pH(在干燥成膜之前),优选调节到8.0至13.5的pH,更优选调节到10.0至13.0的pH,最优选调节到12.5至13.0的pH。
膜可以另外包含任何合适的渗透增强剂。如本文所定义,“渗透增强剂”是指单独或与其它化合物组合可用于帮助穿过上皮或其它生物膜摄取其它物质的化合物。特别地,术语“渗透增强剂”在本文中用于指单独或与其它化合物组合可用于帮助穿过颊粘膜摄取其它物质的化合物。渗透增强剂根据其作用机制通常可分为两种不同的类型,细胞旁(para)或跨细胞(trans)渗透增强剂。副细胞渗透增强剂是那些帮助通过上皮或其它生物膜中的细胞间空隙吸收其它物质的增强剂。跨细胞渗透增强剂是帮助通过上皮或其它生物膜中的细胞摄取另外的物质的那些增强剂,其中所述另外的物质通过上皮或其它生物膜中的顶端和基底外侧细胞膜。
通常,所述膜可包含一种或多种细胞旁渗透增强剂。或者,所述膜可包含一种或多种跨细胞渗透增强剂。或者,所述膜可包含至少一种细胞旁渗透增强剂和至少一种跨细胞渗透增强剂。
通常,渗透增强剂,如果存在,是一种或多种选自由非离子、阳离子、阴离子或两性离子表面活性剂(例如辛酰己酰聚氧乙烯-8-甘油酯、月桂基硫酸钠、十六烷基三甲基溴化铵、癸基二甲基铵基丙烷磺酸盐);胆汁盐(例如脱氧胆酸钠);脂肪酸(例如己酸、庚酸、油酸);脂肪胺;脂肪脲;脂肪酸酯(例如月桂酸甲酯、棕榈酸甲酯);取代或未取代的含氮杂环化合物(例如甲基吡咯烷酮、甲基哌嗪、氮酮);萜烯(例如柠檬烯、小茴香酮、薄荷酮、桉树脑);亚砜(例如二甲亚砜(DMSO));乙二胺四乙酸(EDTA);以及其组合所组成的群组,的化合物。优选地,渗透增强剂,如果存在,选自由EDTA、油酸及其组合所组成的群组。
通常,所述膜可包含EDTA。不希望受任何特定理论的束缚,据信EDTA通过瞬时影响互连膜细胞的紧密连接,随后增加细胞旁或孔转运,而作为细胞旁渗透增强剂。EDTA还据信通过与磷脂首基相互作用和增加膜流动性而作为跨细胞渗透增强剂。[12]或者,所述膜可包含油酸。不希望受任何特定理论的束缚,据信油酸通过与细胞膜中或细胞膜上的磷脂的极性头部基团相互作用并增加细胞膜柔性而作为跨细胞渗透增强剂,从而促进跨细胞药物渗透性。已经表明油酸在1-10%的浓度下对猪颊上皮显示出增强的渗透性。[13]
所述膜可另外包含自乳化药物递送系统(SEDDS)或其所得的乳液。这种系统优选是自微乳化药物递送系统(SMEDDS)或自纳米乳化药物递送系统(SNEDDS)或其所得的乳液。自微乳化药物传递系统是微乳预浓缩物或无水形式的微乳。自纳米乳化药物递送系统是纳米乳剂预浓缩物或纳米乳剂的无水形式。这些体系通常是油(例如甘油三酯、甘油二酯或甘油单酯或其混合物)和至少一种表面活性剂(例如Span、吐温(Tween))的无水各向同性混合物,当在温和搅拌的条件下将其引入到水相中时,自发地形成(分别)水包油(O/W)微乳液或纳米乳液。SNEDDS系统通常用于小球尺寸小于200nm的乳液。[14]SEDDS(例如SMEDDS或SNEDDS)也可包含辅助乳化剂或辅助表面活性剂和/或增溶剂以促进乳化(例如微乳化或纳米乳化)或改善药物掺入SEDDS(例如SMEDDS或SNEDDS)。
优选地,油相选自橄榄油、豆油、Capryol PGMC、Maisine CC、Labrafil M2125、Captex 355和三醋精。更优选地,油相是Capryol PGMC。优选地,所述至少一种表面活性剂选自Cremophor EL、吐温80(Tween 80)和Labrasol。更优选地,SEDDS包括至少两种表面活性剂,还更优选地,其中所述表面活性剂选自Cremophor EL、吐温80和Labrasol。最优选地,SEDDS包括Cremophor EL和Labrasol作为表面活性剂。优选地,SEDDS还包含增溶剂(助溶剂)。典型的增溶剂包括transcutol、聚乙二醇(PEG)、DMSO和乙醇。特别优选的增溶剂是transcutol。
通常,SEDDS(例如SMEDDS或SNEDDS)组件选自由:吐温与一种或多种甘油酯和亲水性助溶剂的混合物;低HLB助表面活性剂吐温和亲水性助溶剂的混合物;聚乙二醇(PEG)、Labrasol和Chremophore EL的混合物;聚乙二醇(PEG)、Labrasol和Kollihorse EL的混合物;聚乙二醇(PEG)、Labrasol、Chremophore EL和Chremophore RH40的混合物;CapryolPGMC、Cremophor EL和Transcutol的混合物;Capryol PGMC、Cremophor EL和Labrasol的混合物;以及Capryol PGMC、Cremophor EL、Labrasol和Transcutol的混合物,所组成的群组。PEG可以是任何合适的聚乙二醇,例如平均分子量为100至>1000Da的PEG,优选200至800Da,更优选300至600Da,最优选约400。更优选地,SEDDS组分选自由:Capryol PGMC、CremophorEL和Transcutol的混合物;Capryol PGMC、Cremophor EL和Labrasol的混合物;以及Capryol PGMC、Cremophor EL、Labrasol和Transcutol的混合物,所组成的群组。
如本文所定义,术语“甘油酯”是指在甘油和一种或多种脂肪酸之间形成的任何酯。术语“甘油酯”可以与术语“酰基甘油”互换使用。通常,甘油酯是甘油单酯、甘油二酯或甘油三酯。优选地,甘油酯是甘油三酯。通常,甘油酯是简单的甘油酯。术语“简单甘油酯”是指其中两种脂肪酸彼此相同的甘油二酯,或其中三种脂肪酸彼此相同的甘油三酯。或者,甘油酯是混合甘油酯。术语“混合甘油酯”是指其中两种脂肪酸彼此不同的甘油二酯,或其中三种脂肪酸中的任一种与另外两种不同或所有三种脂肪酸彼此不同的甘油三酯。因此,甘油酯通常是甘油单酯、简单甘油二酯、简单甘油三酯、混合甘油二酯或混合甘油三酯。优选地,甘油酯是简单的甘油三酯或混合的甘油三酯。
如本文所定义,“亲水性助溶剂”是可与水混溶的任何溶剂。合适的亲水性助溶剂的实例包括但不限于:甘油、乙醇、2-(2-乙氧基乙醇)、PEG-400和丙二醇。
如本文所定义,术语“低HLB辅助表面活性剂”是指落入C.W.Pouton[15]所述的脂质制剂分类系统的IIIA、IIIB或IV类的任何脂质,其内容通过引用整体并入本文。
通常,所述膜可以另外包含任何合适的螯合剂。螯合剂可以加入到膜中作为防腐剂。如本文所定义,“螯合剂”是指,能够与单个中心原子,通常为金属离子,形成两个或更多个单独的键的多齿配体,的化合物。合适的螯合剂的实例包括但不限于:乙二胺四乙酸(EDTA)、乙二醇-双(β-氨基乙醚)-N,N,N′,N′-四乙酸(EGTA)、1,2-双(邻氨基苯氧基)乙烷-N,N,N′,N′-四乙酸(BAPTA)、柠檬酸、膦酸、谷氨酸、组氨酸、苹果酸盐及其衍生物。优选地,螯合剂,如果存在的话,是乙二胺四乙酸(EDTA)。优选地,所述膜可包含按重量计0.001%至4%的每种存在的螯合剂,更优选按重量计0.001%至0.1%的每种存在的螯合剂。
所述膜可以另外包含任何合适的抗氧化剂。如本文所定义,“抗氧化剂”是抑制其它化学物质氧化的任何化合物。合适的抗氧化剂的实例包括但不限于:抗坏血酸;柠檬酸;亚硫酸氢钠;焦亚硫酸钠;乙二胺四乙酸(EDTA);丁基羟基甲苯;及其组合。优选地,如果存在抗氧化剂,则其为抗坏血酸、亚硫酸氢钠或其组合。更优选地,如果存在抗氧化剂,则其为抗坏血酸。最优选地,抗坏血酸和亚硫酸氢钠都作为抗氧化剂存在。优选地,所述膜可包含按重量计0.001%至4%的每种存在的抗氧化剂,更优选按重量计0.001%至0.1%的每种存在的抗氧化剂。
通常,所述膜可以另外包含任何合适的抗微生物剂。如本文所定义,“抗微生物剂”是杀死微生物或阻止其生长的任何化合物。合适的抗微生物剂的实例包括但不限于:苯甲醇;苯扎氯铵;苯甲酸;对羟基苯甲酸甲酯、乙酯或丙酯;和季铵化合物。优选地,所述膜可包含按重量计0.001%至4%的每种存在的抗微生物剂,更优选地按重量计0.001%至0.1%的每种存在的抗微生物剂。
因此EDTA可以作为抗氧化剂、渗透促进剂或螯合剂存在于本发明的膜中。通常,如果存在EDTA,EDTA作为所有的抗氧化剂、渗透增强剂和螯合剂。或者,如果存在EDTA,EDTA可能仅起抗氧化剂的作用。或者,如果存在EDTA,EDTA可能仅作为渗透增强剂。或者,如果存在EDTA,EDTA可以仅作为螯合剂。
通常,所述膜可以另外包含至少一种无机盐。所述无机盐可以是任何适用于制备药物的盐。这些盐的实例包括但不限于碱金属、碱土金属、铝、锌和铵的卤化物、氧化物、氢氧化物、硫酸盐、碳酸盐、磷酸盐、硝酸盐、乙酸盐和草氨酸盐。通常,所述无机盐可选自由氯化钠、氯化钾、氯化镁、氯化钙和氯化铵组成的群组。优选地,无机盐是氯化钠。通常,无机盐在膜中的总浓度为至少0.05重量%,优选为0.1至5重量%,更优选为0.2至2重量%,还更优选为0.25至1重量%,最优选为约0.5重量%。
通常,所述膜可以另外包含至少一种赋形剂、可选地至少一种碱化剂或酸化剂、可选地至少一种渗透促进剂、可选地至少一种药学上可接受的溶剂、可选地至少一种缓冲组分、可选地SEDDS(例如SMEDDS或SNEDDS)、可选地至少一种调味剂和可选地至少一种抗氧化剂。例如,所述膜可以包含至少一种赋形剂、可选地至少一种碱化剂或酸化剂、可选地至少一种渗透增强剂、可选地至少一种药学上可接受的溶剂和可选地至少一种调味剂。优选地,所述膜可以包含甘油、山梨糖醇、可选地至少一种碱化剂或酸化剂、可选地至少一种渗透促进剂、可选地至少一种药学上可接受的溶剂和可选地至少一种调味剂。更优选地,所述膜可以包含甘油、山梨糖醇、可选地至少一种碱化剂、可选地至少一种药学上可接受的溶剂、以及可选地至少一种调味剂,该碱化剂优选地是氢氧化钠,该药学上可接受的溶剂优选地是DMSO或一种油或其混合物。
或者,所述膜可另外包含至少一种赋形剂、至少一种SEDDS和任选的至少一种无机盐。优选地,在本实施方式中,所述膜另外包含甘油、山梨醇、至少一种SEDDS和任选的至少一种无机盐。更优选地,所述膜另外包含甘油、山梨醇、至少一种SEDDS和至少一种无机盐。更优选地,所述膜另外包含甘油、山梨醇、Capryol PGMC、Chremophor EL和至少一种无机盐。更优选地,所述膜另外包含甘油、山梨醇、Capryol PGMC、Chremophor EL、transcutol和氯化钠。最优选地,所述膜另外包含甘油、山梨醇、木糖醇、Capryol PGMC、Chremophor EL、transcutol和氯化钠。
或者,所述膜可以另外包含至少一种赋形剂和至少一种非水的药学上可接受的溶剂。优选地,在该实施方案中,所述膜另外包含甘油、山梨醇和三醋精。更优选地,所述膜另外包含甘油、山梨醇、木糖醇和三醋精。
优选地,本发明所述的膜包含按重量计25%至99%的一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐混合物、按重量计0%至20%的水、按重量计0.001%至75%的API、按重量计0%至40%的甘油、按重量计0%至40%的山梨糖醇、可选地按重量计0%至40%的木糖醇、可选地碱化剂或酸化剂、可选地按重量计0.01%至5%的渗透促进剂、可选地按重量计0.1%至10%的SEDDS(例如SMEDDS或SNEDDS)、可选地按重量计0.01%至5%的调味剂、可选地按重量计0.001%至4%的螯合剂和可选地按重量计0.001%至4%的至少一种抗氧化剂。更优选地,本发明所述的膜按重量计30%至91%的一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐的混合物、按重量计9%至11%的水、按重量计0.2%至45%的API、按重量计10%至20%的甘油、按重量计10%至20%的山梨糖醇、可选地按重量计10%至20%的木糖醇、可选地按重量计0.1%至3%的调味剂和可选地碱化剂或酸化剂。
或者,本发明所述的膜按重量计25%至99%的一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐混合物、按重量计0%至20%的水、按重量计0.001%至75%的API、按重量计0%至40%的甘油、按重量计0%至40%的山梨糖醇、可选地按重量计0%至40%的木糖醇、可选地碱化剂或酸化剂、可选地按重量计0.01%至5%的渗透促进剂、可选地按重量计0.1%至10%的SEDDS(例如SMEDDS或SNEDDS)、可选地按重量计0.01%至5%的调味剂、可选地按重量计0.001%至4%的螯合剂和可选地按重量计0.001%至4%的至少一种抗氧化剂组成。更优选地,本发明所述的膜按重量计30%至91%的一价阳离子海藻酸盐或含有至少一种一价阳离子海藻酸盐的混合物、按重量计9%至11%的水、按重量计0.2%至45%的API、按重量计10%至20%的甘油、按重量计10%至20%的山梨糖醇、可选地按重量计10%至20%的木糖醇、可选地按重量计0.1%至3%的调味剂和可选地碱化剂或酸化剂组成。
本发明所述的膜在干燥之前具有优选200至2000μm、更优选300至1750μm、甚至更优选400至1500μm、最优选约1000μm的厚度。
本发明所述的膜优选在其最大的两个表面上各自具有0.1至20cm
本领域技术人员考虑到给定应用的期望溶解时间,将能够通过简单地制备一系列不同厚度和表面积的膜,并对所得膜进行测试,从而测量溶解时间,来选择合适的膜的厚和表面积。
本发明所述的膜的机械特性非常令人满意。特别地,所述膜是柔性的(即其允许弯曲和折叠而不断裂),并且具有高拉伸强度。重要的是,本发明的膜不是凝胶,因为海藻酸盐聚合物链并未彼此交联。本发明的膜具有生物粘附性;也就是说,所述膜包含可作为粘合剂的天然聚合材料(海藻酸盐)。所述膜对于像粘膜这样的潮湿表面具有粘性。特别地,所述膜对于口腔粘膜具有粘性,例如颊部、唇部、舌下、齿龈或嘴唇区域、软腭和硬腭中的粘膜。
本发明所述的膜可在其上提供印刷文字物质或印刷图像,例如品牌名称、商标、剂量标识或符号。
在治疗中膜的施用与用途
通常,本发明的膜给人类患者施用,以便向患者递送其中含有的治疗有效量的活性药物成分(API)。
如本文中所使用,术语“治疗有效量”是指API的量足以降低或缓解所治疗的疾病的严重程度、持续时间、进展,或发作,防止所治疗的疾病进展,使得与所治疗的疾病相关的症状退化,防止与所治疗的疾病相关的症状复发、产生、发作或进展,或者增强或改进另一种疗法的预防效果或治疗效果。给患者施用的API的精确量将取决于疾病或状况的类型和严重程度,还取决于患者的特征,例如一般健康状况、年龄、性别、体重,以及对药物的抗性。它还会取决于所治疗的疾病的程度、严重性和类型。本领域技术人员将能够根据这些因素和其它因素确定适当的剂量。
如本文中所使用,术语“治疗(treat)”、“治疗(treatment)”和“治疗(treating)”是指所治疗的疾病的进展、严重程度和/或持续时间减少或改善,或者通过给患者施用本发明所述的膜来治疗的疾病的一种或多种症状(优选为一种或多种可辨别的症状)改善。
通常,本发明所述的膜被提供用于治疗人类患者。优选地,本发明所述的膜被提供用于治疗选自由:癌症;痴呆;阿尔茨海默病;肌萎缩性侧索硬化;张力障碍;癫痫;亨廷顿氏病;多发性硬化;帕金森氏病;痉挛;图雷特综合征;肠易激病(IBD);克罗恩氏病;溃疡性结肠炎;厌食症;恶病质;癌症引起的恶心和/或呕吐;癌症诱导的恶病质;青光眼;慢性疼痛;癌症诱导的疼痛;纤维肌痛;神经性疼痛;成瘾;焦虑;双相性精神障碍;创伤后应激障碍;精神病;精神分裂症;硬皮病;和I型糖尿病。更优选地,本发明所述的膜被提供用于治疗选自以下的疾病或病症:痴呆;阿尔茨海默病;癫痫;炎性肠病;克罗恩氏病;溃疡性结肠炎;慢性疼痛;癌症诱导的疼痛;纤维肌痛;和神经性疼痛,所组成的群组,的疾病或病症。
本发明提供了本发明所述的膜,其用于治疗阿尔茨海默氏相关性痴呆。痴呆指包括思维和记忆受损的一组症状。许多病症可引起痴呆,例如帕金森病。所有痴呆病例中约50-70%是由阿尔茨海默病引起的,阿尔茨海默病的特征不仅在于思维和记忆受损,而且在于难以解决问题、难以完成简单的任务、在地点和时间上混淆、以及难以说话和书写。[16]
本发明提供了本发明所述的用于治疗癫痫的膜。癫痫影响大约1%的人口,并且是特征在于近期发作的慢性疾病。癫痫发作定义为与瞬时、超同步神经元放电相关的临床事件。癫痫发作有几种不同类型,包括失神发作(也称为小发作)、强直阵挛性或惊厥性发作(以前称为大发作)、无张力性发作(也称为跌落发作)、阵挛性发作、强直性发作、肌阵挛性发作和部分发作性发作。一些发作是更一般化的,影响整个脑(例如,无发作),而其他发作倾向于保持更局部化,在发作时仅影响部分脑(例如,部分发作)。
本发明提供了一种本发明所述的膜,其用于治疗炎性肠病(IBS)。IBS是描述小肠和/或大肠中的炎症的总称。有IBS的亚型,取决于症状学和位置,例如IBS伴有便秘、腹泻等。鉴于疾病的模糊症状,确切的患病率是不确定的。据称美国7-21%的成年人群具有某种形式的IBS。[17]在一些情况下,生活方式、饮食和药物的改变足以减轻症状。然而,对于许多IBS仍然是一个持续的问题,其可能负面地影响生活质量。
本发明提供了用于治疗克罗恩病(Crohn’s disease)的本发明的膜。克罗恩病被定义为小肠和上行结肠开头的慢性炎症。估计美国有50万人患有克罗恩病,并且由于未知原因流行率正在增加。克罗恩氏病患者发生结肠癌的可能性非常高。目前的治疗方法包括从口服抗炎剂(水杨酸衍生物、类固醇)到抗TNF和其它单克隆抗体。在严重的情况下,进行受影响区域的手术切除。[18]
本发明提供了用于治疗溃疡性结肠炎(UC)的本发明的膜。与克罗恩病一样,UC是慢性炎症,但是是位于大肠中。超过900,000名美国人患有溃疡性结肠炎,使其远比克罗恩病流行。[19]其体征、症状和治疗与克罗恩病大部分相同。
本发明提供了本发明所述的用于治疗慢性疼痛的膜。疼痛缓解是目前最常见的通过药用大麻治疗的病症。例如,在科罗拉多,94%的对医学大麻身分证的要求是治疗疼痛。[20]大麻素类物质不仅可用于减轻疼痛,而且可减少对形成习惯的阿片样物质的使用/暴露,这构成了该患者亚型的替代疗法。
本发明提供了本发明所述的用于治疗纤维肌痛的膜。纤维肌痛是一种复杂的疾病,其中疼痛与其它症状如疲劳、肌肉僵硬、失眠和心境障碍一起存在。据信大麻素治疗可以实现纤维肌痛的多面治疗,因为大麻素已经涉及治疗疾病的几种个体症状。
本发明提供了用于治疗神经性疼痛的本发明所述的膜。神经性疼痛是由影响体感神经系统的损伤或疾病引起的疼痛。它可能与来自正常无痛刺激(异常性疼痛)的称为感觉迟钝或疼痛的异常感觉有关。它可以具有连续和/或间歇(阵发性)组分。后者类似于刺伤或电击。常见的性质包括灼热或寒冷、“如坐针毡”(pins and needles)感、麻木和瘙痒。高达7%至8%的欧洲人群受到影响,而在5%的人中,该病症可能是严重的。[21]
通常,待治疗的患者是成人。或者,待治疗的患者可以是儿童。待治疗的患者可以是老年患者。待治疗的患者可能正在经历化疗,并且可能因此遭受化疗引起的恶心和/或呕吐,或癌症相关的疼痛。
通常,所述膜施用于患者口腔。所述膜优选施用于口腔或唇或舌下区域的口腔粘膜或施用于软腭。所述膜通常由患者自己施用。或者,由另一个人,例如执业医生、护士、护理人员、社会工作者、患者同事或患者的家庭成员将膜施用给患者。
所述膜具有生物粘附性,并在施用之后粘附至口腔表面。在施用后,海藻酸盐膜开始溶解,释放活性药物成分。通常,在施用于口腔粘膜后,所述膜在0.1至60分钟或更长的时间内完全溶解。优选地,在施用于口腔粘膜后,所述膜在0.5至30分钟,更优选1至20分钟,还更优选3至10分钟,最优选3至5分钟的时间段内完全溶解。
不希望受到任何特定理论的束缚,随着膜在口腔内溶解,认为同时释放的活性药物成分可通过两种不同途径中的一种或两种进入血流:(a)通过吸收穿过口腔粘膜直接进入血流中(“口服透粘膜途径”);(b)通过吞咽到胃中,并随后吸收穿过肠的上皮细胞进入血流中。典型地,可以在膜粘附至口腔粘膜后120分钟内,优选在粘附后60分钟内,更优选在粘附后45分钟内,甚至更优选在粘附后30分钟或20分钟内,最优选在粘附后10分钟内达到API在患者中的峰值血浆浓度。
通常,在给定时间将单个膜施用于患者,通常施用于口腔粘膜。但是在一些情况下,可期望同时施用两个膜,以便为单个患者获得正确的剂量。在一些情况下,可期望同时施用两个以上的膜,以便为单个患者获得正确剂量,例如同时施用三个、四个、五个、六个、七个、八个、九个、十个或更多个膜。通常,给予患者的单剂量含有1至20mg的API,优选2至15mg的API。
因此,本发明还提供了治疗人类患者的病症的方法,其中所述方法包括将至少一种本发明的膜施用至人类患者的口腔,可选地其中待治疗的病症选自:癌症;痴呆;阿尔茨海默病;肌萎缩性侧索硬化;张力障碍;癫痫;亨廷顿氏病;多发性硬化;帕金森氏病;痉挛;图雷特综合征;肠易激病(IBD);克罗恩氏病;溃疡性结肠炎;厌食症;恶病质;癌症引起的恶心和/或呕吐;癌症诱导的恶病质;青光眼;慢性疼痛;癌症诱导的疼痛;纤维肌痛;神经性疼痛;成瘾;焦虑;双相性精神障碍;创伤后应激障碍;精神病;精神分裂症;硬皮病;和I型糖尿病。
本发明还提供了本发明所述的膜用于制造用于治疗人类患者的病症的药物的用途,可选地其中待治疗的病症选自:癌症;痴呆;阿尔茨海默病;肌萎缩性侧索硬化;张力障碍;癫痫;亨廷顿氏病;多发性硬化;帕金森氏病;痉挛;图雷特综合征;肠易激病(IBD);克罗恩氏病;溃疡性结肠炎;厌食症;恶病质;癌症引起的恶心和/或呕吐;癌症诱导的恶病质;青光眼;慢性疼痛;癌症诱导的疼痛;纤维肌痛;神经性疼痛;成瘾;焦虑;双相性精神障碍;创伤后应激障碍;精神病;精神分裂症;硬皮病;和I型糖尿病。
本发明还提供包含一种或多种本发明所述的膜的产品,以及包装。可将每个膜单独包裹在小袋中,或者可将多个膜一起包裹在同一个小袋中。可选地,所述小袋由衬有PET的铝制成。所述产品可进一步包含使用所述膜的说明书。这些说明书可含有关于患者使用所述膜的建议频率或时间、如何将膜从其小袋或包装除去、如何将膜粘附至粘膜,以及在口腔内的哪个位置将膜粘附至粘膜,的信息。
本发明的任何一种或多种膜还可联合一种或多种其它药物或药物组合物组合用于治疗疾病或者状况,对本发明的膜和/或其它药物或药物组合物可用于其的疾病或状况的治疗中使用。
可通过任何一种或多种以下途径给患者施用一种或多种其它药物或药物组合物:口服、系统(例如经皮肤、经鼻内、透粘膜或通过栓剂),或肠胃外(例如肌内、静脉内或皮下)。一种或多种其它药物的组合物或者药物组合物可采用片剂、丸剂、胶囊剂、半固体、粉末、缓释制剂、溶液、悬浮液、酏剂、气溶胶、透皮贴片、生物粘附性膜的形式,或者可以是任何其它适当的组合物。制剂的选择取决于各种因素,例如药物给药方式(例如对于口服给药,制剂优选采用片剂、丸剂或胶囊剂的形式)和药物物质的生物利用度。
膜的制造
本发明所述的膜可通过,添加和混合膜的构成组分制备成膜溶液,将该溶液分布到固体表面上,并让溶液在表面上干燥形成膜,来制造。为了将溶液或组合物分布到固体表面上,可简单地将所述溶液或组合物倒到且/或均匀地展开到表面上,例如使用刮涂刀(draw-down blade)或类似设备倒到且/或均匀地展开到表面上。
典型的方法包括以下工艺步骤:
(a)可选地,在水中、或在水/有机溶剂的混合中、或在一种或多种有机溶剂中混合至少一种抗氧化剂;
(b)将API混合在水中,或在水/有机溶剂的混合中,或在随后向其中加入水的一种或多种有机溶剂中,或混合在步骤(a)中获得的溶液中,可选地其中在加入API之前或之后通过加入合适的酸或碱,通常是稀释的酸或碱的水溶液,更通常是稀释的碱的水溶液将溶液的pH调节至所需水平,并且优选地其中将溶液的pH调节至3.0至13.5,更优选8.0至13.5,并且还更优选10.0至13.0;
(c)可选地,例如用超声处理棒超声处理溶液,直至获得乳液;
(d)可选地,加入一种或多种赋形剂、调味剂、缓冲组分、渗透促进剂、SEDDS(例如SMEDDS或SNEDDS)、螯合剂、抗氧化剂和/或抗微生物剂;
(e)在合适的条件下加入一价阳离子海藻酸盐,例如通过混合约30分钟或直到获得无团块分散体,从而形成粘稠的浆液,可选地其中在混合过程中向溶液中加入另外的酸或碱,以将溶液的pH保持在所需水平;
(f)可选地,加入一种或多种其它赋形剂、调味剂、缓冲组分、渗透促进剂、SEDDS(例如SMEDDS或SNEDDS)、螯合剂、抗氧化剂和/或抗微生物剂;
(g)可选地,使浆液脱气,通常5-14小时;
(h)将浆液倒到表面上,例如倒到板上,优选倒到玻璃板上,并将浆液展开为期望厚度,通常借助于涂覆器展开;
(i)通常在45℃至70℃、优选55℃至60℃的温度下干燥所述浆液层,直到所述膜的残余水含量为按重量计0%至20%、优选按重量计5%至15%、更优选按重量计8%至10%,形成固体膜;
(j)可选地,将所述固体膜切成期望大小的小块,进一步可选地将这些小块置于小袋中,优选地其中所述小袋由衬有PET的铝制成,将所述小袋密封,并进一步可选地对其进行标记。
本发明所述的用于制造膜的替代方法包括以下工艺步骤:
(a)将一价阳离子海藻酸盐在水中混合,直到获得无团块的分散体,并且可选地在加入海藻酸盐之前或之后,将一种或多种赋形剂、调味剂、缓冲组分、渗透促进剂、SEDDS(例如SMEDDS或SNEDDS)、螯合剂、抗氧化剂和/或抗微生物剂加入水溶液中;
(b)单独地,将API溶解在水、水/有机溶剂的混合或一种或多种有机溶剂中,可选地,其中将至少一种抗氧化剂预先溶解在溶剂中,可选地,其中在API加入之前或之后通过加入合适的酸或碱,通常是稀释的酸或碱的水溶液,更通常是稀释的碱的水溶液将溶液的pH调节至所需水平,并且优选地,其中将溶液的pH调节至3.0至13.5,更优选8.0至13.5,并且还更优选10.0至13.0;
(c)在合适的条件下,例如通过混合约20分钟或直到获得无团块的分散体,将步骤(a)中获得的溶液加入到步骤(b)中获得的溶液中,以导致形成粘性的浆液;
(d)可选地,加入一种或多种其它赋形剂、调味剂、缓冲组分、渗透促进剂、SEDDS(例如SMEDDS或SNEDDS)、螯合剂、抗氧化剂和/或抗微生物剂;
(e)可选地,使浆液脱气,通常5至14小时;
(f)将浆液倒到表面上,例如倒到板上,优选倒到玻璃板上,并将浆液展开为期望厚度,例如约1mm,通常借助于涂覆器展开;
(g)通常在30至70℃,优选40至60℃的温度下干燥所述浆液层,直到所述膜的残余水含量为按重量计0至20%,优选按重量计5至15%,更优选按重量计8至10%;以及
(h)可选地将所述固体膜切成期望大小的小块,进一步可选地将这些小块置于小袋中,优选地其中所述小袋由衬有PET的铝制成,将所述小袋密封,并进一步可选地对其进行标记。
典型地,在本发明所述的膜的制备方法的步骤(b)中,将API溶解在水中或通过将抗氧化剂混合在水中获得的溶液中。在这种情况下,优选通过加入碱,优选碱水溶液,更优选稀碱水溶液,最优选稀氢氧化钠,将溶液的pH预先调节或随后调节至碱性pH。不希望受任何特定理论的束缚,据信使用碱性pH增加大麻素在水溶液中的溶解度,有助于制备其中大麻素在整个膜中实现均匀分散的膜。
或者,在本发明的膜的制造方法的步骤(b)中,将API溶解在水/有机溶剂的混合中,或溶解在通过将抗氧化剂混合在水/有机溶剂的混合中所获得的溶液中。在这种情况下,所用的有机溶剂可以是任何合适的无毒溶剂,包括例如乙醇、丙酮、苯甲醇、二乙二醇单乙醚、甘油、己二醇、异丙醇、聚乙二醇甲醚、癸二酸二乙酯、异山梨醇二甲酯、碳酸异丙烯酯、二甲亚砜(DMSO)、脂肪酸酯和油,例如大豆油、花生油、橄榄油、棕榈油、菜籽油、玉米油、其它植物油等。水/有机溶剂的混合体系可以还包括两种、三种、四种或更多种有机溶剂。优选地,有机溶剂选自乙醇、二甲亚砜和油,例如大豆油、花生油、橄榄油、棕榈油、菜籽油、玉米油、其它植物油等。最优选地,水/有机溶剂的混合体系包含乙醇和油,例如橄榄油。或者,水/有机溶剂的混合体系包含二甲亚砜和油,例如橄榄油。在水/有机溶剂的混合体系中,水:非水溶剂可以是1:10,000至10,000:1,优选1:100至100:1,更优选1:10至100:1,甚至更优选1:1至100:1,还更优选2:1至100:1,还更优选5:1至50:1,并且最优选4:1至20:1。
或者,在本发明的膜的制造方法的步骤(b)中,将API溶解在一种或多种有机溶剂中,或溶解在通过将抗氧化剂混合在一种或多种有机溶剂中而获得的溶液中。在这种情况下,在将API加入到有机溶剂中之后,将水加入到包含API和任选的抗氧化剂的有机溶液中。所用的每种有机溶剂可以是任何合适的无毒溶剂,例如上文段落中所列者。典型地,API溶解在单一有机溶剂中,优选乙醇、二甲亚砜或油,例如大豆油、花生油、橄榄油、棕榈油、菜籽油、玉米油、其它植物油等。或者,将API溶解在两种、三种、四种或更多种有机溶剂的混合物中,优选包含乙醇和油的混合物,例如橄榄油,或包含二甲亚砜和油的混合物,例如橄榄油。
通常,当在前述步骤中获得的溶液包含水性溶剂和有机溶剂时,在上述第一方法的步骤(c)中对溶液进行超声处理。
通常,在本发明所述的制备膜的方法中,当抗氧化剂存在于膜中时,在加入API之前将抗氧化剂溶解在水溶液中。
在上述方法的任一替代变型中,在将粘性浆液倒到表面上之后,首先通过狭缝高度为约2mm的涂覆器将粘性浆液展开至厚度为约2mm,然后通过狭缝高度为约1mm的涂覆器将粘性浆液展开至厚度为约1mm。
当膜要被配制为乳液基膜时,特别优选的用于制造本发明所述的膜的替代方法包括以下工艺步骤:
(a)将API混合在油相中;
(b)预混合表面活性剂和助溶剂,然后在混合下将其加入步骤(a)中获得的溶液中;
(c)可选地,将一种或多种赋形剂、调味剂、缓冲组分、渗透促进剂、螯合剂、抗氧化剂和/或抗微生物剂加入水中;
(d)在搅拌下,优选连续搅拌,并且更优选其中以滴加方式,将水或步骤(c)中获得的溶液加入到步骤(b)中获得的溶液中;
(e)可选地,将步骤(d)中获得的溶液储存过夜,随后评价其物理稳定性;
(f)将一价阳离子海藻酸盐混入溶液中,直至获得无团块的分散体,并可选地加入另外的水以调节形成的浆液的粘度;
(g)将浆液倒到表面上,例如倒到板上,优选倒到玻璃板上,并将浆液展开为期望厚度,例如约1mm,或如果在步骤(f)中进一步添加水,则约1.2mm,通常借助于涂覆器展开;
(h)通常在30至70℃,优选30至50℃,最优选约40℃的温度下干燥所述浆液层,直到所述膜的残余水含量为按重量计0至20%,优选按重量计5至15%,更优选按重量计9至11%;以及
(i)可选地将所述固体膜切成期望大小的小块,进一步可选地将这些小块置于小袋中,优选地其中所述小袋由衬有PET的铝制成,将所述小袋密封,并进一步可选地对其进行标记。
当膜要被配制为非乳液基膜时,特别优选的用于制造本发明所述的膜的替代方法包括以下工艺步骤:
(a)将API混合在增溶剂中;
(b)将所得溶液加入水中,优选在高剪切混合下加入;
(c)可选地,加入一种或多种赋形剂、调味剂、缓冲组分、渗透促进剂、螯合剂、抗氧化剂和/或抗微生物剂;
(d)将一价阳离子海藻酸盐混入溶液中,直至获得无团块的分散体,并可选地加入另外的水以调节形成的浆液的粘度;
(e)将浆液倒到表面上,例如倒到板上,优选倒到玻璃板上,并将浆液展开为期望厚度,例如约1mm,通常借助于涂覆器展开;
(f)通常在30至70℃,优选50至70℃,最优选约60℃的温度下干燥所述浆液层,直到所述膜的残余水含量为按重量计0至20%,优选按重量计5至15%,更优选按重量计9至11%;以及
(g)可选地将所述固体膜切成期望大小的小块,进一步可选地将这些小块置于小袋中,优选地其中所述小袋由衬有PET的铝制成,将所述小袋密封,并进一步可选地对其进行标记。
通常来说,向含有API的水溶液中添加海藻酸盐。或者,将API和藻酸盐一起溶解在溶液中。或者是,可向海藻酸盐溶液中添加API,以便在海藻酸盐溶液中得到API的乳液或悬浮液。或者是,本发明的成膜组合物可包含溶解的和未溶解的活性成分。例如,成膜组合物可包含海藻酸盐溶液中溶解的活性成分和溶液中悬浮的活性成分的组合。
可在干燥之前或之后向膜的表面施加更多的API,例如将API作为气溶胶喷雾剂施加到干燥膜或湿膜上。活性成分也可以作为粉末施用到膜的表面上。可以以这种方式另外施加调味剂。
本文提及的公开物、专利公开物和其它专利文件通过引用整体并入本文。在本文中,任何对单数形式的术语的引用也包括其复数形式。在使用术语“包含”(comprising)、“包含”(comprise)或“包含”(comprises)时,所述术语可分别被“由……组成”(consistingof)、“由……组成”(consist of)或“由……组成”(consists of)替代,或者分别被“基本上由……组成”(consisting essentially of)、“基本上由……组成”(consist essentiallyof)或“基本上由……组成”(consists essentially of)替代。任何时候提及一个数值范围或者单个数值也包括约为该范围或该单个值的值。任何时候提及式(I)至(XLVI)的化合物也包括其生理学上可接受的盐,除非另有说明。任何时候提及海藻酸盐也包括其任何生理学上可接受的盐,除非另有说明。任何%值都是基于所讨论的一种或多种组分的相对重量,除非另有说明。
以下是说明本发明的实施例。但是,这些实施例绝非旨在对本发明的范围进行限制。
实施例1:含大麻二酚的膜的制备
开发了四种基本的膜配制方案。第一种膜制剂方案(方法A)通过在水溶液中混合膜组分而不进行pH调节来制备含大麻二酚的膜。第二种膜制剂方案(方法B)通过将膜组分在碱性水溶液中混合而制备含大麻二酚的膜,其中在涂覆和干燥之前将膜制剂的pH调节至约12.5-13。第三种和第四种膜制剂方案(方法C和D)通过将膜组分分别在水/DMSO或水/油混合物中混合而制备含大麻二酚的膜,但不进行pH调节。
下表1中列出了以5mg/剂包含大麻二酚作为API的批量配方。计算基于2000剂/批次的产率(每剂大小=6cm
表1.用于制备含大麻二酚的膜的批料配方。
根据以下方法(方法A)制备批次配方A中的膜:
·将大麻二酚加入到纯化水中并混合10分钟。
·在混合下将海藻酸钠、甘油、山梨糖醇和薄荷油加入溶液中,并继续混合至少15分钟。
·将浆液放置过夜以进行脱气。
·将浆液倒到玻璃板上,并借助于涂覆器展开为1mm的厚度。
·将浆液层在加热至约60℃的干燥箱中烘干,直到残留水含量达到按重量计8%至10%,形成固体膜。
·使用刀将固体膜切成20×30mm的小块。
·将所得的各个膜分别置于PET衬里的铝袋中,用热封机密封,并进行标记。
·根据以下方法(方法B)制备批料配方B中的膜:
·向混合容器中加入纯净水,通过加入4M氢氧化钠将pH调节至12.5-13。
·将大麻二酚加入到碱性溶液中并混合直至获得澄清溶液。
·在混合下将海藻酸钠加入到混合物中,直到获得无团块的分散体。在整个混合过程中,通过加入另外的4M氢氧化钠将pH连续保持在12.5至13。
·在混合下将甘油、山梨糖醇和薄荷油加入到溶液中,并继续混合至少15分钟。
·将浆液放置过夜以进行脱气。
·将浆液倒到玻璃板上,并借助于涂覆器展开为1mm的厚度。
·将浆液层在加热至约60℃的干燥箱中烘干,直到残留水含量达到按重量计8%至10%,形成固体膜。
·使用刀将固体膜切成20×30mm的小块。
·将所得的各个膜分别置于PET衬里的铝袋中,用热封机密封,并进行标记。
·根据以下方法(方法C)制备批料式C中的膜:
·在混合下将海藻酸钠溶解在纯化水中,直到获得无团块的分散体。
·然后在混合下将甘油和山梨醇加入到该溶液中。
·另外地,在混合下将大麻二酚溶解在DMSO中。
·在混合下将大麻二酚/DMSO溶液加入到含海藻酸盐的水溶液中。
·在混合下将薄荷油加入溶液中,并继续混合至少15分钟或直到获得光滑且均匀的溶液。
·将浆液放置过夜以进行脱气。
·将浆液倒到玻璃板上,并借助于涂覆器展开为1mm的厚度。
·将浆液层在加热至约60℃的干燥箱中烘干,直到残留水含量达到按重量计8%至10%,形成固体膜。
·使用刀将固体膜切成20×30mm的小块。
·将所得的各个膜分别置于PET衬里的铝袋中,用热封机密封,并进行标记。
·根据以下方法(方法D)制备批料配方D中的膜:
·在混合下将大麻二酚溶解在橄榄油中以获得澄清溶液。
·将该大麻二酚/油溶液加入到纯化水中。
·使用超声棒对油/水混合物进行超声处理,直到形成乳液。
·在混合下将海藻酸钠加入溶液/乳液中,直到获得无团块和光滑的溶液/乳液。
·在混合下将薄荷油加入溶液中,并继续混合至少15分钟或直到获得光滑且均匀的溶液。
·将浆液放置过夜以进行脱气。
·将浆液倒到玻璃板上,并借助于涂覆器展开为1mm的厚度。
·将浆液层在加热至约60℃的干燥箱中烘干,直到残留水含量达到按重量计8%至10%,形成固体膜。
·使用刀将固体膜切成20×30mm的小块。
·将所得的各个膜分别置于PET衬里的铝袋中,用热封机密封,并进行标记。
实施例2:含大麻二酚的膜的物理评价
在制造之后,可以根据以下标准评价每批含大麻二酚的膜:
性质 标准
1.浆液质地: 无团块均质粘稠浆液(目视检查)
在涂覆之前无气泡(目视检查)
2.残留水分*: 8-10%(过程中控制)
3.膜外观: -半透明、透明且颜色均匀(目视检查)
-平滑的表面结构(目视检查)
-韧性且柔性的(目视检查)
4.剂量重量均匀性: 在膜批次内随机选择的剂量的称重
5.大麻二酚含量**: 在按重量继±10%范围内的目标剂量强度(RP-HPLC分析)
*残留水分:IR引起的水蒸发与实时重量测量的组合。从开始时观察重量变化百分比,直到观察不到进一步的变化,作为残留水分的量度。
**大麻二酚含量和均匀性:使用在220nm检测的反相高效液相色谱(RP-HPLC)分离。使用大麻二酚标准曲线计算每剂大麻二酚的量。[22]
注意到,使用方法A制备的含大麻二酚的膜含有大麻二酚的晶体,这是不希望的。使用方法B、C和D制备的膜具有更高的质量。这表明,为了最佳制备含大麻二酚的膜,需要使用碱性溶液和/或水/有机溶剂的混合体系。
实施例3:进一步制备含大麻二酚的海藻酸盐膜
随后在含大麻二酚的海藻酸盐膜的制备中进行进一步的开发工作,以探索用于临床前研究的实验室规模原型开发的各种制剂条件,并作为扩大至全规模产品方案的基础。
使用下表2中列出的初始批料配方作为这些研究的起点。
表2.海藻酸盐基膜的基本批料配方。如果涂覆厚度为1.0mm,则基本的批量配方对应于大约200mL浆液,在3cm
剂量的大小设定为1.5×2.0cm(3cm
在本研究中,CBD口腔膜剂的目标剂量强度被设定为尽可能高,即10-15mg/剂,其中所需药物产品是物理和化学稳定的(无晶体以及在膜中无油释出)。然而,最初的实验在较低的剂量强度5mg/剂下进行。
选用的海藻酸盐是Protanal 5/60,以使粘膜粘附的可能性最大化。Protanal 5/60通常具有约20,000g/mol至约90,000g/mol范围内的平均分子量。Protanal 5/60的古洛糖醛酸的平均含量为65至75%,而甘露糖醛酸的平均含量为25至35%。该藻酸钠还具有300-700mPa·s的粘度,粘度是在10%水溶液中,在20℃的温度和20rpm的剪切速率下,使用轴数为2的Brookfield粘度计测定的。
大麻二酚(CBD)的水溶性为0.0126mg/mL,log P值为6.33,被认为是水溶性差的或亲脂性的药物。然而,CBD的pKa值为9.13,这表明在较高pH即高于pH 12时,浓度高达300mg/mL时它是可溶的。因此,可以在较高pH值时配制CBD膜,但认为研究基于脂质的CBD膜制剂更合乎需要。
基于脂质的CBD膜可以是基于乳剂或油(非乳剂)的制剂。在这方面,自乳化药物递送系统或制剂(SEDDS)已经用于乳液基CBD膜,其可以是微米尺寸,即自微乳化药物递送系统(SMEDDS),或纳米尺寸,即自纳米乳化药物递送系统(SNEDDS)。在本研究中,乳液基CBD制剂被认为是SEDDS或SMEDDS,这取决于含有药物的脂质混合物在用水稀释时是否自发形成乳液或微乳液。通常,SEDDS和SMEDDS是脂质、表面活性剂和助溶剂(也称为助表面活性剂)与溶解的药物的混合物,其自发地或在温和搅拌下分散在水中以形成微乳液(油滴尺寸<250nm)、细乳液(250-1000nm)或常规乳液(油滴尺寸>1000nm)。
通常将短链醇如乙醇、丙二醇等作为助溶剂加入制剂中以增加载药量、减少凝胶相形成和减少乳液或微乳液中液滴的尺寸。此外,具有较高HLB值(10-15)的表面活性剂被认为获得了具有较细液滴尺寸的稳定乳液。在这方面,选择非离子表面活性剂,因为与离子表面活性剂相比,它们对人细胞的毒性较低。非离子表面活性剂如Cremophor EL、吐温80、吐温20(Tween 20)、Labrasol或其组合在制剂中用作表面活性剂。
CBD在各种油、表面活性剂和助溶剂中的溶解度,如下表3所示,是通过在不同的添加步骤中,在1g的每种油、表面活性剂和助溶剂中加入已知量的药物来测定的。为此,在每个步骤中加入50mg CBD直至溶液达到饱和。在室温下保持磁力搅拌混合物。在前五小时期间,每半小时检查小瓶,但物质没有完全溶解。然后将小瓶在室温下搅拌过夜。第二天,检查测试溶液,发现溶液是不清楚的,即已经处于饱和状态。停止实验,计算在每种溶液的饱和条件之前加入的药物总量。从图1中可以看出,计算值表示CBD在不同溶剂中的大致溶解度(g/g)。
表3.用于CBD溶解性筛选实验的不同类型的溶剂、其化学描述和具体功能。
由于需要更高剂量强度的CBD制剂,因此可能需要更高的含油量以在自乳化混合物中溶解更多的药物并增加其在膜中的含量。然而,由于对乳液稳定性和膜韧性可能产生不利影响,因此对可以使用多少油存在限制。因此,选择显示最大药物溶解度的溶剂,即作为油相的Capryol PGMC(其由辛酸的丙二醇单酯和二酯组成)和作为助溶剂的transcutol(高度纯化的二甘醇单乙醚),用于乳液基制剂。选择显示出较高HLB值的表面活性剂,如聚氧乙烯蓖麻油衍生物Cremophor EL(13.9)和吐温80,用于乳液基制剂。
据信使用transcutol作为助溶剂有助于通过多种机理形成乳液/微乳液,例如通过降低界面张力和粘度,其中助溶剂分子将其自身置于表面活性剂尾部之间,并因此增加界面膜的柔性和流动性。
用于乳液基CBD膜的乳液的制备
因此,使用卡麦角醇PGMC(油)、Cremophor EL和吐温80(表面活性剂)和Transcutol(助溶剂)制备用于溶解CBD的微乳剂(参见下表4)。此外,还制备了含有不同浓度的油以及表面活性剂与助溶剂的质量比(S
表4. 5mg CBD膜的SMEDDS与基本配方的组成。
非乳液型CBD胶片用的载色剂的制备
基于上述溶解度实验,考虑了非乳剂基CBD制剂的显示最大CBD溶解度的载体。为此选择DMSO、transcutol和三醋精。如下表5所示,用这些载体制备安慰剂制剂以决定膜外观、质地和韧性。
表5.非乳液基CBD膜的不同载体的基本配方。
物理评价标准
在制造之后,可以根据以下标准评价每批含大麻二酚的膜:
性质 标准
1.浆液质地: 无团块均质粘稠浆液(目视检查)
在涂覆之前无气泡(目视检查)
2.残留水分*: 9-11%(过程中控制)
3.膜外观**: -半透明且颜色均匀(目视检查)
-平滑的表面结构(目视检查)
-韧性且柔性的(目视检查)
4.剂量重量均匀性: 在膜批次内随机选择的剂量的称重
5.大麻二酚含量***: 目标剂量浓度在按重量计±12%内(RP-HPLC分析)
6.物理稳定性 -油释出(目视检查)
-膜无晶体(光学显微镜研究)
*残留水分:IR引起的水蒸发与实时重量测量的组合。从开始时观察重量变化百分比,直到观察不到进一步的变化,作为残留水分的量度。
**在光学显微镜下检查和分析一些批次的膜的表面结构。
***大麻二酚含量和均匀性:使用在210nm检测的反相高效液相色谱(RP-HPLC)分离。使用大麻二酚标准曲线计算每剂大麻二酚的量。[22]
制剂的制备方案
在本研究中评价下表6中列出的制剂。通过使用不同类型的用于非乳液基制剂的载体以及影响乳液基CBD制剂的因素来制备制剂。
表6.本研究中评价的制剂。
乳液基CBD膜的制备
用于5mg剂量浓度的乳液基CBD膜的批料配方列于以上表4中。为此,自乳化混合物由中链甘油三酯、油相的癸醇PGMC、表面活性剂的Cremophor EL和助溶剂的Transcutol组成。表面活性剂与助溶剂的质量比(S
在5mg剂量强度下物理稳定(无油释出)的膜进一步在增加的剂量强度下配制,即10mg/剂。在这种情况下,考虑如上表6中所述的不同因素的影响,以在较高剂量强度(10mg/剂)下获得物理稳定的CBD膜。
由于当在浆液前溶液中混合海藻酸盐时,乳液基CBD制剂产生粘性的浆液,因此需要进一步稀释浆液以获得粘性更小的浆液。为此,向最终的浆液中加入另外的10mL毫升水,导致每张膜的CBD剂量比标准API剂量计算更低。为了补偿这一点,将乳液基浆液以1.2mm的厚度(而非1mm的厚度)涂覆以获得所需的剂量强度。
非乳液型CBD膜的制备
还制备了非乳液基CBD膜,其使用载体作为CBD的增溶剂,以评价CBD膜在较高剂量强度(10mg/剂)下的基本特性,例如韧性、拉伸强度,以及避免获得海藻酸盐基CBD膜的非常粘稠的浇铸。所用的增溶剂是有机溶剂、二醇或油。这些膜使用以下方案制备:
·将CBD加入到载体中,并在磁力搅拌下混合1小时,以获得澄清溶液(溶液1)。
·将甘油、山梨醇和木糖醇加入水中并混合(溶液2)。
·使用
·在搅拌(在小型食品加工机中)下将海藻酸钠加入到预制溶液中约20分钟或直至获得无团块的分散体,得到粘性的浆液。
·立即用涂覆器将该浆液以1.2mm的厚度涂覆在玻璃板上。
·将浆液层在加热至约60℃的干燥箱中烘干,直到水含量达到9%-11%,形成固体膜。
·用刀将固体膜切成尺寸为1.5×2.0cm的矩形。
·将所得的各个膜分别置于铝袋中,用热封机密封,并进行标记。
在这些制剂中使用的具体增溶剂列于以上表6中。
乳液基CBD膜的性质
CBD完全溶解在油相中。可使用各自独立的批次配方/方案制备无团块且均匀(发白)的粘性浆液。发现粘度随着微乳液组分即油相、表面活性剂或助溶剂含量的增加而增加。
观察到乳液基浆液的粘度随时间而增加。因此,在制备浆液后立即将膜涂覆在玻璃板上。通过将浆液涂覆在玻璃板上并在室温下静置20分钟以在干燥前被动脱气,除去在浆液制备过程中产生的气泡,这些气泡的产生使得在膜中引入不均匀性。
所有制备的膜在干燥至含水量为9%-11%时具有光滑且平坦的表面结构,并具有柔性。特别地,乳液基CBD膜发白,外观均匀,但更不透明。
使用FAST分析法(其中使用210nm波长的UV检测),通过RP-HPLC以等度模式定量测定膜中的CBD。然而,使用了使用在波长210nm下的UV检测的梯度分析法,分析了较高剂量强度(10mg)下更稳定(无油释出)的CBD制剂。
研究中考虑了在干燥条件下影响含有不同剂量浓度CBD的乳液稳定性的几个因素。
(a)盐的影响
为了评价盐对乳液基CBD膜稳定性的影响,使用了自乳化制剂的概念。为此,使用Capryol PGMC(油)、Cremophor(表面活性剂)和Transcutol(助溶剂)。制备的配合料配方列于下表7中。
表7.本研究中产生的不同剂量强度(5mg和10mg)的CBD膜的批料配方。批量大小为约250剂(一剂尺寸3cm
加入或不加入表7所列的NaCl组分,制备乳液基5mg CBD膜。发现未加入盐的CBD膜在干燥过程中导致膜中局部冒出油滴。膜表面和玻璃板(在除去膜之后检查)有些油腻。相反,用含NaCl的CBD制剂没有观察到这种部分油释出。如使用光学显微镜所证实的,在5mgCBD剂量强度下形成均匀的、无晶体的乳液。
在新鲜的5mg CBD膜的偏振光显微镜图像中,在室温暴露于正常空气5天的膜中,均未出现晶体。同时,在新鲜的5mg CBD膜和在室温下暴露于正常空气5天的膜中没有观察到油释出。然而,在非偏振视图中,在CBD膜中看到了尺寸更大的少量分散的液滴。这些被认为是由于小油滴在干燥过程中聚结而形成的油滴。
膜重量、剂量和均匀性数据列于下表8中。观察到可接受的剂量变化以及批料内各膜之间良好的均匀性(μg CBD/mg膜)。
表8.在少量盐存在下,以1.2mm膜厚度包衣的物理稳定的5mg乳液基CBD制剂的重量、剂量和均匀性数据。
乳液基CBD制剂(5mg/剂)(#批次25)
向乳液中加入少量盐的稳定作用,被认为是参与了油滴表面上的电荷的局部遮蔽,以及作为促进乳化剂在液滴表面上凝聚的试剂,从而增加了干燥过程中的乳液稳定性。然而,以增加的浓度添加盐可能破坏油滴表面上的保护性双层,引起附聚和相分离,并因此降低乳液的稳定性。该过程称为“盐析”。因此,就稳定油滴而言,在乳液中以较低浓度(<0.1M)添加盐可能是最优选的。
由于乳液组分浓度的增加与浆液粘度的增加有关,因此使用与5mg CBD膜相同量的乳液组分配制10mg CBD膜(表7)。如光学显微镜下所见,形成均匀、稳定且无晶体(偏振视图)的乳液。涂覆10mg剂量的CBD浆液并进行干燥处理。在干燥过程中观察到油从膜上释出。在光学显微镜下分析这些膜,在偏振光下观察到闪亮斑点的存在,从而证实在10mg CBD膜中存在晶体。似乎低浓度盐的加入不一定足以克服油滴曲率处的渗透压并在较高CBD剂量强度下最佳地稳定油滴表面。
此外,另一种HLB值比Cremophor EL高的表面活性剂,吐温80(HLB值15),在加入或不加入盐的情况下交替使用,以制备10mg CBD膜。如光学显微镜下所观察到的,在无盐的情况下形成了均匀且无晶体(偏振视图)的乳液,其与含有Cremophor EL的制剂相比,具有相对较大的液滴尺寸。然而,再次观察到油在干燥膜的同时释出,并且通过光学显微镜(偏振视图)证实在膜中存在晶体。当向乳液中加入NaCl时,获得了类似的结果。
可以得出结论,具有较高HLB值的表面活性剂与少量盐的组合在较高CBD剂量强度下在干燥过程中不能最佳地稳定油滴。
(b)缓冲液的影响
另一种稳定高剂量强度CBD膜的方法包括在中性pH下将缓冲液掺入10mg CBD制剂中。不希望受任何特定理论的束缚,据信缓冲液可作为乳液液滴的间接稳定剂,其通过作为反离子在液滴表面作用,并因此在干燥过程中稳定乳液液滴。当整个界面层由于干燥所述膜而被足够紧密地填充时,液滴可以足够稳定以聚结,从而补偿由乳剂液滴中较高的药物负载引起的液滴的较高渗透压。
为此,在CBD制剂中单独使用50mM pH 6.5的磷酸盐缓冲液,并与0.5%w/v NaCl组合,如表9所示。
表9.本研究中制备的10mg CBD膜的批料配方。批量大小为约250剂(一剂尺寸3cm
在两种情况下,在干燥过程中在膜中观察到部分油释出。因此,结论是,在盐的存在下加入缓冲液在干燥过程中对乳液液滴具有一些稳定作用。
(c)额外的助溶剂的影响
另一种用于优化10mgCBD膜的物理稳定性的策略是,在制剂中使用额外的助溶剂。在这方面,DMSO、乙醇或PEG400以较高的剂量强度用于制剂中(参见下表10)。
在所有情况下,在干燥过程中在膜中观察到油释出。因此,结论是,在制剂中添加助溶剂对膜中的乳液液滴几乎没有稳定作用。
表10.含不同类型助溶剂的10mg CBD膜的批料配方。批量大小为约250剂(一剂尺寸3cm
(d)附加表面活性剂的影响
还试验了使用表面活性剂的混合物形成微乳液。为此,将Labrasol(HLB值12),一种非离子水分散性表面活性剂,与浓度增加的Cremophor EL一起加入脂质制剂中,如表11所示。
发现在该制剂中,在10mg剂量强度时CBD膜中的油在干燥膜时没有释出。得到白色非油脂性膜,由于制剂中使用的表面活性剂浓度较高,所述膜本质上是脆性的。该实验表明,混合表面活性剂方法在干燥过程中对乳液液滴表现出有效的稳定作用,从而防止油在膜中释放,并能够产生含有较高剂量强度CBD的更优的膜。
表11.10mg CBD膜与另外的表面活性剂的批料配方。批量大小为约250剂(一剂尺寸3cm
(e)增塑剂的影响
进一步假定添加额外的增塑剂木糖醇可能导致较高CBD剂量强度膜的韧性的改善。所开发的配方列于下表12中。
发现木糖醇的加入在干燥过程中引起膜中局部油释出,但这是暂时的影响。不希望受任何特定理论的束缚,据信,木糖醇,性质上为结晶,在制剂中作为内部增塑剂,其干扰液滴的结构排列(例如通过氢键),因此增加膜中乳液液滴的稳定性。
通过增加配方中外部增塑剂(如甘油和山梨醇)的浓度,也可观察到类似的韧性改善。同时,制剂中的海藻酸盐浓度增加以保持最佳拉伸强度。还增加相应的水含量以保持浆液的最佳粘度。所得的制剂描述于表13中。
表12.10mg CBD膜的批料配方,其中木糖醇作为增塑剂。批量大小为约250剂(一剂尺寸3cm
表13.10mg CBD膜的批料配方,其具有改善的韧性与好的拉伸强度。批量大小为约250剂(一剂尺寸3cm
(f)干燥温度的影响
还研究了干燥温度的影响。使用两个不同的温度,40℃和60℃来干燥乳液基CBD膜。发现,当在60℃下干燥膜时,在膜的侧面发生部分油泄漏,但这是暂时的影响。然而,当在40℃下干燥相同制剂时,未观察到这种油泄漏,然而,其他实际因素也可起作用,例如膜在侧面比在中间更薄的事实,以及膜侧面比在中间部分相对更高的温度。不希望受任何特定理论的束缚,认为较高的干燥温度可在干燥过程期间对液滴的结构重排产生较大影响,从而导致在膜的侧面上的部分的油释出。
非乳液型CBD膜的性质
非乳液基CBD制剂被认为保留了膜的所需物理性质(例如韧性、拉伸强度)以及能够实现CBD活性剂的高剂量负载。DMSO、PEG400和Transcutol都作为增溶载体进行了测试,以在更高的剂量强度下配制CBD膜(见下表14)。
表14. 5mg CBD膜的批料配方,其中使用不同载体作为CBD增溶剂。
CBD在与包含增塑剂的水溶液混合之前完全溶解在载体中。由于CBD是一种疏水性药物,因此CBD溶液一与水混合就观察到药物沉淀。
随后,测试三醋精作为替代增溶剂(参见表15)。
表15. 10mg CBD非乳液基膜的批料配方。批次大小为约250剂(一剂尺寸3cm
将CBD加入到三醋精中并混合,直至获得澄清溶液。使用高剪切混合器(UltraturraxT25,IKA Germany)将该CBD溶液与含有增塑剂的水溶液混合。将海藻酸盐立即加入上述预制溶液中并混合,直至获得均匀、粘稠、发白的浆液。在该制剂中使用比以前多20%的海藻酸盐,以防止最终的膜是油腻的。将该浆液立即涂覆在玻璃板上以避免可能导致相分离的油滴的任何聚结。接着在60℃下干燥此膜。
在光学显微镜下检查所得CBD膜,证实在新鲜的10mg CBD膜以及在室温下暴露于正常空气5天的膜中不存在晶体。此外,发现该非乳液基的10mg CBD膜制剂在室温下储存在包装中至少10周是无晶体的(也通过光学显微镜)。
膜重量、剂量和均匀性数据列于下表16中。观察到可接受的剂量变化以及批料内各膜之间良好的均匀性(μg CBD/mg膜)。
表16.涂覆膜厚1.2mm的含有三醋精作为增溶剂的物理稳定的10mg非乳液基制剂的重量、剂量和均一性数据。
乳液基CBD制剂(10mg/剂)(#Batch 24)
结论
从上述研究中,已经发现可以配制基于海藻酸盐的大麻二酚口腔膜剂,其可以是基于乳剂的或非基于乳剂的。特别是,发现了:
·可以获得具有一些气泡的无团块的均匀粘性浆液。
·所制备的膜是均匀的并且具有光滑且平坦的表面。它们是韧性且柔性的,并且易于处理,并且被认为易于处理和对患者给药。
·具有高达约5mg大麻二酚/3cm
·使用三醋精作为增溶剂,可以将剂量强度高达约10mg大麻二酚/3cm
·所得剂量-重量变化被认为是实验室规模样品制备可接受的,并且均匀性数据(μg CBD/mg膜)在批次内显示出良好的一致性。
·基于乳剂的大麻二酚口腔膜剂应当优选在较低温度,即约40℃下干燥。
·包含大麻二酚制剂的海藻酸盐浆液在过夜储存期间变得更粘稠。因此,优选用新制备的浆液进行膜涂覆。
预期从这种模型研究中得出的关于大麻二酚的结论也适用于其它大麻素(例如THC),这是由于大麻素家族的不同成员之间物理性质(特别是溶解度)的相似性。
实施例4:使用大麻二醇膜的犬研究
将两个实施例的含CBD的膜剂(如上述实施例3中制备的)给予成年比格犬(n=3)。第一制剂(F1)是5mg基于乳剂的CBD海藻酸盐膜,第二制剂(F2)是10mg非基于乳剂的CBD海藻酸盐膜。通过将单个膜放置在狗的颊粘膜上,将膜施用给研究组中的每只狗。作为对照,也将第一膜制剂置于明胶胶囊(F3)中,并经口给予对照组的狗。在0至480分钟的时间过程中,从两组试验组和对照组的每组中抽取血浆,分析血浆样品的CBD浓度(表示为ng CBD/mL血浆)。为了比较绝对暴露水平,将F1和F3组剂量调整至9.93mg CBD/胶片,这是给予F2组的最终CBD浓度。
配方F1和F2的详细情况分别提供于下表17和18中。
表17.目标5mg CBD乳液基膜的批料配方(每张膜实际最终CBD量=3.92mg)。批次大小=50mL;膜厚度=1.2mm;干燥温度=40℃;干燥时间=2小时10分钟;pH=6.28;相对湿度=11.84%;CBD含量=3.92±0.3mg/剂。
表18.目标10mg非乳液型CBD胶片的批料配方(每张胶片的实际最终CBD量=9.93mg)。批次大小=50mL;膜厚度=1.2mm;干燥温度=60℃;干燥时间=1小时;pH=5.89;相对湿度=9.48%;CBD含量=9.92±0.2mg/剂。
各研究组F1-F3在480分钟时间段内的剂量调整的血浆水平显示于图2中。仅显示前60分钟的部分时间-过程研究显示于图3中。来自研究的药物动力学参数显示于下表19和20中。
表19.给成年比格犬(n=3)的CBD制剂的平均药代动力学参数的总结。
表20.给予成年比格犬(n=3)的CBD制剂的剂量调整的平均药代动力学参数的总结。将F1和F3的剂量调整为9.93mg剂量(F2)。
这些研究表明,通过粘附到口腔(F1和F2)施用的两种膜剂在犬只中导致比口服施用膜(F3)更高水平的血浆暴露。在调整剂量变化之后,当使用非乳胶基胶片(F2)而非乳胶基胶片(F1)时,观察到更高的曝光水平。在时间过程研究中,从早期(20分钟)开始,经颊给予CBD能够使CBD的暴露水平显著提高。
总之,与口服给药相比,经颊放置CBD制剂似乎提供了令人惊讶的更高水平的血浆CBD暴露。
[1]Begg,M.;Pacher,P.;Batkai,S.;Oseihyiaman,D.;Offertaler,L.;Mo,F.M.;Liu,J.;Kunos,G.Evidence for novel cannabinoid receptors.Pharmacology&Therapeutics,2005,106(2),133-145.
[2]Kaminski,N.E.Inhibition of the cAMP signaling cascade viacannabinoid receptors:a putative mechanism of immune modulation bycannabinoid compounds.Toxicology Letters,1998,102-103,59-63.
[3]Basu S.;Ray A.;Dittel B.N.Cannabinoid receptor 2is critical forthe homing and retention of marginal zone B lineage cells and for efficientT-independent immune responses.Journal of Immunology,2011,187(11),5720-5732.
[4]Mechoulam,R.;Peters,M.;Murillo-Rodriguez,E.;
[5]Lim,K.A Systematic Review of the Effectiveness of Medical Cannabisfor Psychiatric,Movement and Neurodegenerative Disorders.ClinicalPsychopharmacology and Neuroscience,2017,15(4),301-312.
[6]Ben Amar,M.Cannabinoids in medicine:A review of their therapeuticpotential.J Ethnopharmacol,2006,105(1-2),1-25.
[7]Stout,S.M.;Cimino,N.M.Exogenous cannabinoids as substrates,inhibitors,and inducers of human drug metabolizing enzymes:a systematicreview.Drug Metabolism Reviews,2014,46(1),86-95.
[8]Nadel,J.A.Acute effects of inhalation of cigarette smoke on airwayconductance.J Appl Physiol,1961,16,713-716.
[9]Tashkin,D.P.Acute effects of smoked marijuana and oralΔ
[10]
[11]Pertwee,R.G.The pharmacology of cannabinoid receptors and theirligands:an overview.International Journal of Obesity,2006,30,513-518.
[12]Prachayasittikul,V.;Isarankura-Na-Ayudhya,C.;Tantimongcolwat,T.;Nantasenamat,C.;Galla,H.J.EDTA-induced Membrane Fluidization andDestabilization:Biophysical Studies on Artificial Lipid Membranes.Actabiochimica et biophysica Sinica,2007,39(11),901-913.
[13]Managaro,A.;Wertz,P.The effect of permeabilizer on the in vitropenetration of propranolol through porcine buccal epithelium.
[14]Date,A.A.;Desai,N.;Dixit,R.;Nagarsenker,M.Self-nanoemulsifyingDrug Delivery Systems:Formulation Insights,Applications andAdvances.Nanomedicine,2010,5(10),1595-1616.
[15]Pouton,C.W.Formation of poorly water-soluble drugs for oraladministration:Physicochemical and physiological issues and the lipidformulation classification system.European Journal of PharmaceuticalSciences,2006,29(3-4),278-287.
[16]Alzheimer's Association.10Early Signs and Symptoms of Alzheimer's,2018.
[17]Chey,W.D.“Irritable Bowel Syndrome:A Clinical Review.”JAMA,2015,313(9),949-958.
[18]NIDDK.Definition&Facts for Crohn’s Disease,2017
[19]Nicholson,A.Ulcerative Colitis Statistics,2016.
[20]
[21]Bouhassira,D.;Lantéri-Minet,M.;Attal,N.;Laurent,B.;Touboul,C.Prevalence of chronic pain with neuropathic characteristics in the generalpopulation.Pain,2008,136(3),380-387.
[22]Zgair,A.;Wong,J.C.M.;Sabri,A.;Fischer,P.M.;Barrett,D.A.;Constantinescu,C.S.;Gershkovich,P.Development of a simple and senistive HPLC-UV method for the simultaneous determination of cannabidiol andΔ
- 一种持续释放药物制剂的基料,一种持续释放药物制剂,以及该药物制剂的一种生产方法
- 千金藤碱在制备抑制或治疗皮肤恶性黑素瘤的药物制剂中的应用及该药物制剂
