用于乳酸脱氢酶(LDHA)基因编辑的组合物和方法
文献发布时间:2023-06-19 11:39:06
本申请要求2018年9月28日提交的美国临时专利申请第62/738,956号、2019年4月15日提交的美国临时专利申请第62/834,334号和2019年5月1日提交的美国临时专利申请第62/841,740号的优先权的权益,这些申请中每一个的全部内容出于所有目的通过引用并入本文。
通常通过肾脏作为废物从尿中清除的草酸盐在高草酸尿症受试者中升高。高草酸尿症有多种类型,包括原发性高草酸尿症、草酸过多症、肠源性高草酸尿症以及与食用高草酸盐食物相关的高草酸尿症。过量的草酸盐可与钙结合,在肾脏和其他器官中形成草酸钙。草酸钙沉积可导致草酸钙广泛沉积(肾钙质沉着症)或形成肾和膀胱结石(尿石症),并导致肾脏损害。高草酸尿症中常见的肾脏并发症包括尿中带血(血尿)、尿路感染、肾脏损害和终末期肾脏疾病(ESRD)。随着时间的推移,高草酸尿症患者的肾脏可能开始衰竭,并且血液中的草酸盐水平可能升高。草酸盐在全身组织中的沉积,例如全身性草酸过多症可能由于高血草酸盐水平而发生,并且可导致在至少骨、心脏、皮肤和眼睛中的并发症。肾衰竭可发生于任何年龄段,包括儿童,尤其是发生在患有高草酸尿症的受试者中。肾透析或双肾/双肝器官移植是唯一的治疗选择。
原发性高草酸尿症(PH)是一种影响从婴儿到老年人的所有年龄段的受试者的罕见遗传病。PH包括三种亚型,涉及改变三种不同蛋白表达的遗传缺陷。PH1涉及丙氨酸-乙醛酸盐转氨酶或AGT/AGT1。PH2涉及乙醛酸盐/羟基丙酮酸盐还原酶或GR/HPR,并且PH3涉及4-羟基-2-氧化戊二酸醛缩酶或HOGA。在PH1中,在由AGXT基因编码的酶丙氨酸乙醛酸盐转氨酶(AGT或AGT1)中发现突变。正常情况下,AGT在肝过氧化物酶体中将乙醛酸盐转化为甘氨酸。在PH1患者中,突变型AGT无法分解乙醛酸盐,并且乙醛酸盐及其代谢产物草酸盐的水平升高。人无法氧化草酸盐,并且PH1受试者中高草酸盐水平会导致高草酸尿症。
为了确定受试者是否患有高草酸尿症,可收集24小时尿,并且测量草酸盐、乙醇酸盐和其他有机酸水平。可进行基因检测或肝脏活检,以对遗传性高草酸尿症进行最后诊断。参见例如Cochat P等人,(2012)《肾脏病透析与移植(Nephrol Dial Transplant)》5:1729-36。在正常健康受试者中,24小时尿草酸盐和乙醇酸盐水平低于45mg/天,但在高草酸尿症患者中,通常尿草酸盐水平大于100mg/天。参见例如Cochat P.(2013).《新英格兰医学杂志(N Engl J Med)》369:649-658。
正常受试者中的血浆乙醇酸盐水平通常为4-8微摩尔,但在高草酸尿症患者中,乙醇酸盐水平的范围可能很广,并且在2/3的高草酸尿症受试者中会升高。参见例如Marangella,M等人(1992)《泌尿学杂志(J.Urol.)》148:986-989。虽然现在大多数遗传性高草酸尿症患者是通过基因检测确诊,但24小时尿检是用于跟踪高草酸尿症受试者治疗反应的主要方法。Id。
乳酸脱氢酶(LDH)是存在于几乎所有细胞中的酶,其调节乳酸盐和丙酮酸盐以及乙醛酸盐和草酸盐代谢的内稳态。LDH由形成四聚体的4种多肽构成。已确定出5种亚单位组成和组织分布不同的LDH同工酶。LDH最常见的两种形式是由LDHA基因编码的肌肉(M)形式和由LDHB基因编码的心脏(H)形式。在肝细胞的过氧化物酶体中,LDH是负责将乙醛酸盐转化为草酸盐的关键酶,草酸盐随后分泌到血浆中并由肾脏排泄。Lai等人(2018)《分子治疗(Mol Ther.)》26(8):1983-1995。
草酸盐产生的增加会导致草酸钙晶体在肾脏中沉淀并导致肾病。随着高草酸尿症的进展,草酸盐沉积在所有组织中。遗传性乳酸脱氢酶M-亚单位缺乏的受试者未表现出肝功能受损或肝脏特异性表型,这表明抑制或减少肝脏乳酸脱氢酶(LDH)表达量(负责将乙醛酸盐转化为草酸盐的提议关键酶)可防止高草酸尿症受试者中草酸盐的积聚,且不会因乳酸脱氢酶M-亚单位损失而产生不良影响。在高草酸尿症的基因工程小鼠模型以及用乙二醇(EG)化学诱导高草酸尿症的小鼠模型中测试了这一假设。参见Kanno,T等人(1988)《临床化学学报(Clin.Chim.Acta)》173,89-98;Takahashi,Y等人(1995)《内科学(Intern.Med.)》34,326-329;和Tsujino,S等人(1994)《神经学年鉴(Ann.Neurol.)》36,661-665。
由于LDH在草酸盐产生的最后一步是关键的,因此使用通过与N-乙酰基半乳糖胺(GalNAc)残基共轭而被引向肝细胞的LDHA siRNA来在高草酸尿症小鼠模型中介导LDHA沉默。参见Lai等人(2018)《分子治疗》26(8):1983-1995。在高草酸尿症的基因工程小鼠模型和化学诱导的高草酸尿症小鼠模型中,用这种LDHA siRNA治疗小鼠导致肝LDH减少和高效的草酸盐减少,并且防止草酸钙晶体沉积。Id。抑制小鼠肝LDH未导致循环肝酶急性升高、乳酸性酸中毒或劳力性肌病。
通过抑制LDHA来治疗高草酸尿症患者的想法进一步得到非人灵长类动物和人源化嵌合小鼠(其中肝脏由至多80%的人肝细胞构成)的LDHA siRNA治疗的支持。Id。
因此,提供以下实施例。在一些实施例中,本公开提供组合物和方法,所述组合物和方法使用具有RNA引导的DNA结合剂例如CRISPR/Cas系统的引导RNA,以基本上减少或敲除LDHA基因的表达,从而基本上减少或消除LDH的产生,从而减少尿草酸盐并增加血清乙醇酸盐。通过改变LDHA基因显著减少或消除LDH的产生可作为高草酸尿症的长期或永久治疗方法。
发明内容
提供以下实施例。
实施例01.一种诱导LDHA基因内双链断裂(DSB)或单链断裂(SSB)的方法,包含将组合物递送至细胞,其中所述组合物包含:
a.引导RNA,包含
i.选自SEQ ID NO:1-84和100-192的引导序列;或者
ii.选自SEQ ID NO:1-84和100-192的序列的至少17、18、19或20个连续核苷酸;或者
iii.与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列;或者
iv.包含SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80中的任一个的引导序列;或者
v.包含SEQ ID No:1,5,7,8,14,23,27,32,45和48中的任一个的引导序列;或者
vi.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个的引导序列;或者
vii.包括SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个的引导序列;和任选地
b.RNA引导的DNA结合剂或编码RNA引导的DNA结合剂的核酸。
实施例02.一种减少LDHA基因表达的方法,包含将组合物递送至细胞,其中所述组合物包含:
a.引导RNA,包含
i.选自SEQ ID NO:1-84和100-192的引导序列;或者
ii.选自SEQ ID NO:1-84和100-192的序列的至少17、18、19或20个连续核苷酸;或者
iii.与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列;或者
iv.包含SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80中的任一个的引导序列;或者
v.包含SEQ ID No:1,5,7,8,14,23,27,32,45和48中的任一个的引导序列;或者
vi.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个的引导序列;或者
vii.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个的引导序列;和任选地
b.RNA引导的DNA结合剂或编码RNA引导的DNA结合剂的核酸。
实施例03.一种治疗或预防高草酸尿症的方法,包含向有需要的受试者施用组合物,其中所述组合物包含:
a.引导RNA,包含
i.选自SEQ ID NO:1-84和100-192的引导序列;或者
ii.选自SEQ ID NO:1-84和100-192的序列的至少17、18、19或20个连续核苷酸;或者
iii.与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列;或者
iv.包含SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80中的任一个的引导序列;或者
v.包含SEQ ID No:1,5,7,8,14,23,27,32,45和48中的任一个的引导序列;或者
vi.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个的引导序列;或者
vii.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个的引导序列;和任选地
b.RNA引导的DNA结合剂或编码RNA引导的DNA结合剂的核酸,从而治疗或预防高草酸尿症。
实施例04.一种治疗或预防由高草酸尿症引起的终末期肾脏疾病(ESRD)的方法,包含向有需要的受试者施用组合物,其中所述组合物包含:
a.引导RNA,包含
i.选自SEQ ID NO:1-84和100-192的引导序列;或者
ii.选自SEQ ID NO:1-84和100-192的序列的至少17、18、19或20个连续核苷酸;或者
iii.与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列;或者
iv.包含SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80中的任一个的引导序列;或者
v.包含SEQ ID NO:1,5,7,8,14,23,27,32,45和48中的任一个的引导序列;或者
vi.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个的引导序列;或者
vii.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个的引导序列;和任选地
b.RNA引导的DNA结合剂或编码RNA引导的DNA结合剂的核酸,从而治疗或预防由高草酸尿症引起的(ESRD)。
实施例05.一种治疗或预防草酸钙产生和沉积、原发性高草酸尿症(包括PH1、PH2和PH3)、草酸过多症、血尿、肠源性高草酸尿症、与食用高草酸盐食物有关的高草酸尿症中的任何一种,以及延迟或改善对肾脏或肝脏移植的需求的方法,所述方法包含向有需要的受试者施用组合物,其中所述组合物包含:
a.引导RNA,包含
i.选自SEQ ID NO:1-84和100-192的引导序列;或者
ii.选自SEQ ID NO:1-84和100-192的序列的至少17、18、19或20个连续核苷酸;或者
iii.与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列;或者
iv.包含SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80中的任一个的引导序列;或者
v.包含SEQ ID No:1,5,7,8,14,23,27,32,45和48中的任一个的引导序列;或者
vi.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个的引导序列;或者
vii.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个的引导序列;和任选地
b.RNA引导的DNA结合剂或编码RNA引导的DNA结合剂的核酸,从而治疗或预防草酸钙产生和沉积、原发性高草酸尿症、草酸过多症、血尿中的任何一种,以及延迟或改善对肾脏或肝脏移植的需求。
实施例06.一种增加血清乙醇酸盐浓度的方法,包含向有需要的受试者施用组合物,其中所述组合物包含:
a.引导RNA,包含
i.选自SEQ ID NO:1-84和100-192的引导序列;或者
ii.选自SEQ ID NO:1-84和100-192的序列的至少17、18、19或20个连续核苷酸;或者
iii.与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列;或者
iv.包含SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80中的任一个的引导序列;或者
v.包含SEQ ID No:1,5,7,8,14,23,27,32,45和48中的任一个的引导序列;或者
vi.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个的引导序列;或者
vii.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个的引导序列;和任选地
b.RNA引导的DNA结合剂或编码RNA引导的DNA结合剂的核酸,从而增加血清乙醇酸盐浓度。
实施例07.一种减少受试者尿中的草酸盐的方法,包含向有需要的受试者施用组合物,其中所述组合物包含:
a.引导RNA,包含
i.选自SEQ ID NO:1-84和100-192的引导序列;或者
ii.选自SEQ ID NO:1-84和100-192的序列的至少17、18、19或20个连续核苷酸;或者
iii.与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列;或者
iv.包含SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80中的任一个的引导序列;或者
v.包含SEQ ID No:1,5,7,8,14,23,27,32,45和48中的任一个的引导序列;或者
vi.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个的引导序列;或者
vii.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个的引导序列;和任选地
b.RNA引导的DNA结合剂或编码RNA引导的DNA结合剂的核酸,从而减少受试者尿中的草酸盐。
实施例08.根据前述实施例中任一项所述的方法,其中施用RNA引导的DNA结合剂或编码RNA引导的DNA结合剂的核酸。
实施例09.一种组合物,包含:
a.引导RNA,包含
i.选自SEQ ID NO:1-84和100-192的引导序列;或者
ii.选自SEQ ID NO:1-84和100-192的序列的至少17、18、19或20个连续核苷酸;或者
iii.与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列;或者
iv.包含SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80中的任一个的引导序列;或者
v.包含SEQ ID No:1,5,7,8,14,23,27,32,45和48中的任一个的引导序列;或者
vi.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个的引导序列;或者
vii.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个的引导序列;和任选地
b.RNA引导的DNA结合剂或编码RNA引导的DNA结合剂的核酸。
实施例10.一种包含短单链引导RNA(短sgRNA)的组合物,包含:
a.引导序列,包含:
i.选自SEQ ID NO:1-84和100-192的所述引导序列中的任一个;或者
ii.选自SEQ ID NO:1-84和100-192的所述引导序列中任一个的至少17、18、19或20个连续核苷酸;或者
iii.与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同;或者
iv.SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80中的任一个;或者
v.SEQ ID No:1,5,7,8,14,23,27,32,45和48中的任一个;或者
vi.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个的引导序列;或者
vii.包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个的引导序列;和
b.包含发夹区的sgRNA的保守部分,其中所述发夹区缺失至少5-10个核苷酸,并且任选地其中所述短sgRNA包含5’末端修饰和3’末端修饰中的一种或多种。
实施例11.根据实施例10所述的组合物,包含SEQ ID NO:202的序列。
实施例12.根据实施例10或实施例11所述的组合物,包含5’末端修饰。
实施例13.根据实施例10-12中任一项所述的组合物,其中所述短sgRNA包含3’末端修饰。
实施例14.根据实施例10-13中任一项所述的组合物,其中所述短sgRNA包含5’末端修饰和3’末端修饰。
实施例15.根据实施例10-14中任一项所述的组合物,其中所述短sgRNA包含3’尾。
实施例16.根据实施例15所述的组合物,其中所述3’尾包含1、2、3、4、5、6、7、8、9或10个核苷酸。
实施例17.根据实施例15所述的组合物,其中所述3’尾包含约1-2、1-3、1-4、1-5、1-7、1-10、至少1-2、至少1-3、至少1-4、至少1-5、至少1-7或至少1-10个核苷酸。
实施例18.根据实施例10-17中任一项所述的组合物,其中所述短sgRNA不包含3’尾。
实施例19.根据实施例10-18中任一项所述的组合物,包含所述发夹区中的修饰。
实施例20.根据实施例10-19中任一项所述的组合物,包含3’末端修饰和所述发夹区中的修饰。
实施例21.根据实施例10-20中任一项所述的组合物,包含3’末端修饰、所述发夹区中的修饰和5’末端修饰。
实施例22.根据实施例10-21中任一项所述的组合物,包含5’末端修饰和所述发夹区中的修饰。
实施例23.根据实施例10-22中任一项所述的组合物,其中所述发夹区缺失至少5个连续核苷酸。
实施例24.根据实施例10-23中任一项所述的组合物,其中所述至少5-10个缺失核苷酸:
a.在发夹1内;
b.在发夹1和发夹1与发夹2之间的“N”内;
c.在发夹1和发夹1紧接3’的两个核苷酸内;
d.包括发夹1的至少一部分;
e.在发夹2内;
f.包括发夹2的至少一部分;
g.在发夹1和发夹2内;
h.包括发夹1的至少一部分并且包括发夹1与发夹2之间的所述“N”;
i.包括发夹2的至少一部分并且包括发夹1与发夹2之间的所述“N”;
j.包括发夹1的至少一部分,包括发夹1与发夹2之间的所述“N”,并且包括发夹2的至少一部分;
k.在发夹1或发夹2内,任选地包括发夹1与发夹2之间的所述“N”;
l.是连续的;
m.是连续的,并且包括发夹1与发夹2之间的所述“N”;
n.是连续的并且横跨发夹1的至少一部分和发夹2的一部分;
o.是连续的并且横跨发夹1的至少一部分以及发夹1与发夹2之间的所述“N”;
p.是连续的并且横跨发夹1的至少一部分和发夹1紧接3’的两个核苷酸;
q.由5-10个核苷酸组成;
r.由6-10个核苷酸组成;
s.由5-10个连续核苷酸组成;
t.由6-10个连续核苷酸组成;或者
u.由SEQ ID NO:400的核苷酸54-58组成。
实施例25.根据实施例10-24中任一项所述的组合物,包含有包含接合区的sgRNA的保守部分,其中所述接合区缺失至少一个核苷酸。
实施例26.根据实施例25所述的组合物,其中所述接合区中缺失的所述核苷酸包含以下任意一个或多个:
a.所述接合区中至少2、3、4、5、6、7、8、9或10个核苷酸;
b.所述接合区中至少或精确地1-2个核苷酸、1-3个核苷酸、1-4个核苷酸、1-5个核苷酸、1-6个核苷酸、1-10个核苷酸或1-15个核苷酸;和
c.所述接合区中的每个核苷酸。
实施例27.一种包含经修饰的单链引导RNA(sgRNA)的组合物,所述经修饰的单链引导RNA包含:
a.引导序列,包含:
i.选自SEQ ID NO:1-84和100-192的引导序列中的任一个;或者
ii.选自SEQ ID NO:1-84和100-192的引导序列中任一个的至少17、18、19或20个连续核苷酸;或者
iii.与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同;或者
iv.SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80中的任一个;或者
v.SEQ ID No:1,5,7,8,14,23,27,32,45和48中的任一个;或者
vi.SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个;或者
vii.SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个;并且进一步包含
b.选自以下的一种或多种修饰:
1.在一个或多个引导区YA位点处的YA修饰;
2.在一个或多个保守区YA位点处的YA修饰;
3.在一个或多个引导区YA位点和一个或多个保守区YA位点处的YA修饰;
4.i)在两个或更多个引导区YA位点处的YA修饰;
ii)在保守区YA位点2、3、4和10中的一个或多个处的YA修饰;和
iii)在保守区YA位点1和8中的一个或多个处的YA修饰;或者
5.i)在一个或多个引导区YA位点处的YA修饰,其中所述引导区YA位点在5’终端的5’末端的核苷酸8处或之后;
ii)在保守区YA位点2、3、4和10中的一个或多个处的YA修饰;和任选地
iii)在保守区YA位点1和8中的一个或多个处的YA修饰;或者
6.i)在一个或多个引导区YA位点处的YA修饰,其中所述引导区YA位点在所述引导区的3’终端核苷酸的13个核苷酸内;
ii)在保守区YA位点2、3、4和10中的一个或多个处的YA修饰;和
iii)在保守区YA位点1和8中的一个或多个处的YA修饰;或者
7.i)5’末端修饰和3’末端修饰;
ii)在保守区YA位点2、3、4和10中的一个或多个处的YA修饰;和
iii)在保守区YA位点1和8中的一个或多个处的YA修饰;或者
8.i)在引导区YA位点处的YA修饰,其中所述引导区YA位点的所述修饰包含位于所述引导区YA位点5’的至少一个核苷酸不包含的修饰;
ii)在保守区YA位点2、3、4和10中的一个或多个处的YA修饰;和
iii)在保守区YA位点1和8中的一个或多个处的YA修饰;或者
9.i)在保守区YA位点2、3、4和10中的一个或多个处的YA修饰;和
ii)在保守区YA位点1和8处的YA修饰;或者
10.i)在一个或多个引导区YA位点处的YA修饰,其中所述YA位点在5’终端的核苷酸8处或之后;
ii)在保守区YA位点2、3、4和10中的一个或多个处的YA修饰;和
iii)在H1-1和H2-1中的一个或多个处的修饰;或者
11.i)在保守区YA位点2、3、4和10中的一个或多个处的YA修饰;
ii)在保守区YA位点1、5、6、7、8和9中的一个或多个处的YA修饰;和
iii)在H1-1和H2-1中的一个或多个处的修饰;或者
12.i)位于所述5’终端的核苷酸6处或之后的一个或多个核苷酸处的修饰,例如YA修饰;
ii)在一个或多个引导序列YA位点处的YA修饰;
iii)在B3、B4和B5中的一个或多个处的修饰,其中B6不包含2’-OMe修饰或包含除2’-OMe以外的修饰;
iv)在LS10处的修饰,其中LS10包含除2’-氟以外的修饰;和/或
v)在N2、N3、N4、N5、N6、N7、N10或N11处的修饰;并且其中下列中的至少一项为真:
i.在一个或多个引导区YA位点处的YA修饰;
ii.在一个或多个保守区YA位点处的YA修饰;
iii.在一个或多个引导区YA位点和一个或多个保守区YA位点处的YA修饰;
iv.所述5’终端的所述5’末端的核苷酸8-11、13、14、17或18中的至少一个不包含2’-氟修饰;
v.所述5’终端的所述5’末端的核苷酸6-10中的至少一个不包含硫代磷酸酯键合;
vi.B2、B3、B4或B5中的至少一个不包含2’-OMe修饰;
vii.LS1、LS8或LS10中的至少一个不包含2’-OMe修饰;
viii.N2、N3、N4、N5、N6、N7、N10、N11、N16或N17中的至少一个不包含2’-OMe修饰;
ix.H1-1包含修饰;
x.H2-1包含修饰;或
xi.H1-2、H1-3、H1-4、H1-5、H1-6、H1-7、H1-8、H1-9、H1-10、H2-1、H2-2、H2-3、H2-4、H2-5、H2-6、H2-7、H2-8、H2-9、H2-10、H2-11、H2-12、H2-13、H2-14或H2-15中的至少一个不包含硫代磷酸酯键合。
实施例28.根据实施例27所述的组合物,包含SEQ ID NO:450。
实施例29.根据实施例9-28中任一项所述的组合物,用于诱导细胞或受试者中LDHA基因内的双链断裂(DSB)或单链断裂(SSB)。
实施例30.根据实施例9-28中任一项所述的组合物,用于减少细胞或受试者中LDHA基因的表达。
实施例31.根据实施例9-28中任一项所述的组合物,用于治疗或预防受试者中的高草酸尿症。
实施例32.根据实施例9-28中任一项所述的组合物,用于增加受试者中的血清和/或血浆乙醇酸盐浓度。
实施例33.根据实施例9-28中任一项所述的组合物,用于降低受试者中的尿草酸盐浓度。
实施例34.根据实施例9-28中任一项所述的组合物,用于治疗或预防草酸盐产生、器官中的草酸钙沉积、原发性高草酸尿症、草酸过多症(包括全身性草酸过多症)、血尿、终末期肾脏疾病(ESRD)和/或延迟或改善对肾脏或肝脏移植的需求。
实施例35.根据实施例1-8中任一项所述的方法,进一步包含:
a.诱导细胞或受试者中所述LDHA基因内的双链断裂(DSB);
b.减少细胞或受试者中所述LDHA基因的表达;
c.治疗或预防受试者中的高草酸尿症;
d.治疗或预防受试者中的原发性高草酸尿症;
e.治疗或预防受试者中的PH1、PH2和/或PH3;
f.治疗或预防受试者中的肠源性高草酸尿症;
g.治疗或预防受试者中与食用高草酸盐食物相关的高草酸尿症;
h.增加受试者中的血清和/或血浆乙醇酸盐浓度;
i.降低受试者中的尿草酸盐浓度;
j.减少草酸盐产生;
k.减少器官中的草酸钙沉积;
l.减少高草酸尿症;
m.治疗或预防草酸过多症,包括全身性草酸过多症;
n.治疗或预防血尿;
o.预防终末期肾脏疾病(ESRD);和/或
p.延迟或改善对肾脏或肝脏移植的需求。
实施例36.根据实施例1-8或29-35中任一项所述的供使用的方法或组合物,其中所述组合物增加血清和/或血浆乙醇酸盐水平。
实施例37.根据实施例1-8或29-35中任一项所述的供使用的方法或组合物,其中所述组合物导致所述LDHA基因的编辑。
实施例38.根据实施例37所述的供使用的方法或组合物,其中所述编辑被计算为被编辑的群体的百分比(编辑百分比)。
实施例39.根据实施例38所述的供使用的方法或组合物,其中所述编辑百分比为所述群体的30%至99%。
实施例40.根据实施例38所述的供使用的方法或组合物,其中所述编辑百分比为所述群体的30%至35%、35%至40%、40%至45%、45%至50%、50%至55%、55%至60%、60%至65%、65%至70%、70%至75%、75%至80%、80%至85%、85%至90%、90%至95%或95%至99%。
实施例41.根据实施例1-8或29-35中任一项所述的供使用的方法或组合物,其中所述组合物降低尿草酸盐浓度。
实施例42.根据实施例41所述的供使用的方法或组合物,其中尿草酸盐的减少导致肾脏、肝脏、膀胱、心脏、皮肤或眼睛中的肾结石和/或草酸钙沉积减少。
实施例43.根据前述实施例中任一项所述的方法或组合物,其中所述引导序列选自
a.SEQ ID NO:1-84和100-192;
b.SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80;
c.SEQ ID NO:1,5,7,8,14,23,27,32,45和48;
d.SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184;和
e.SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123。
实施例44.根据前述实施例中任一项所述的方法或组合物,其中所述组合物包含sgRNA,所述sgRNA包含
a.SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081中的任一个;或者
b.SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081中的任一个;或者
c.选自SEQ ID NO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78和80的引导序列;或者
d.选自SEQ ID NO:1,5,7,8,14,23,27,32,45和48的引导序列;
e.选自SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184的引导序列;和
f.选自SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123的引导序列。
实施例45.根据前述实施例中任一项所述的方法或组合物,其中靶序列在人LDHA基因的外显子1-8中的任一个中。
实施例46.根据实施例45所述的方法或组合物,其中所述靶序列在所述人LDHA基因的外显子1或2中。
实施例47.根据实施例45所述的方法或组合物,其中所述靶序列在所述人LDHA基因的外显子3中。
实施例48.根据实施例45所述的方法或组合物,其中所述靶序列在所述人LDHA基因的外显子4中。
实施例49.根据实施例45所述的方法或组合物,其中所述靶序列在所述人LDHA基因的外显子5或6中。
实施例50.根据实施例45所述的方法或组合物,其中所述靶序列在所述人LDHA基因的外显子7或8中。
实施例51.根据实施例1-50中任一项所述的方法或组合物,其中所述引导序列与LDHA的正链中的靶序列互补。
实施例52.根据实施例1-50中任一项所述的方法或组合物,其中所述引导序列与LDHA的负链中的靶序列互补。
实施例53.根据实施例1-50中任一项所述的方法或组合物,其中第一引导序列与所述LDHA基因的所述正链中的第一靶序列互补,并且其中所述组合物进一步包含与所述LDHA基因的所述负链中的第二靶序列互补的第二引导序列。
实施例54.根据前述实施例中任一项所述的方法或组合物,其中所述引导RNA包含选自SEQ ID NO:1-84和100-192中任一个的引导序列,并且进一步包含SEQ ID NO:200的核苷酸序列,其中SEQ ID NO:200的所述核苷酸在其3’末端处跟随所述引导序列。
实施例55.根据前述实施例中任一项所述的方法或组合物,其中所述引导RNA包含选自SEQ ID NO:1-84和100-192中任一个的引导序列,并且进一步包含SEQ ID NO:201、SEQID NO:202、SEQ ID NO:203或SEQ ID NO:400-450中的任一个的核苷酸序列,其中SEQ IDNO:201、SEQ ID NO:202或SEQ ID NO:203的所述核苷酸在其3’末端处跟随所述引导序列。
实施例56.根据前述实施例中任一项所述的方法或组合物,其中所述引导RNA是单链引导(sgRNA)。
实施例57.根据实施例56所述的方法或组合物,其中所述sgRNA包含引导序列,所述引导序列包含SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081中的任一个。
实施例58.根据实施例56所述的方法或组合物,其中所述sgRNA包含SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081中的任一个或其经修饰的版本,任选地其中所述经修饰的版本包含SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081。
实施例59.根据前述实施例中任一项所述的方法或组合物,其中所述引导RNA根据SEQ ID NO:300的模式进行修饰,其中N共同为表1的引导序列(SEQ ID NO 1-84和100-192)中的任一个。
实施例60.根据实施例59所述的方法或组合物,其中SEQ ID NO:300中的每个N是任何天然或非天然核苷酸,其中所述N形成所述引导序列,并且所述引导序列使Cas9靶向所述LDHA基因。
实施例61.根据前述实施例中任一项所述的方法或组合物,其中所述sgRNA包含SEQ ID NO:1-84和100-192的引导序列中的任一个以及SEQ ID NO:201、SEQ ID NO:202或SEQ ID NO:203的核苷酸。
实施例62.根据实施例56-61中任一项所述的方法或组合物,其中所述sgRNA包含与选自SEQ ID NO:1-84和100-192的序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列。
实施例63.根据实施例62所述的方法或组合物,其中所述sgRNA包含选自SEQ IDNO:1,5,7,8,14,23,27,32,45,48,62,66,68,70,73,75,76,77,78,80,1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079,1081,2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081的序列。
实施例64.根据前述实施例中任一项所述的方法或组合物,其中所述引导RNA包含至少一种修饰。
实施例65.根据实施例64所述的方法或组合物,其中所述至少一种修饰包括2’-O-甲基(2’-O-Me)修饰的核苷酸。
实施例66.根据实施例64或65所述的方法或组合物,包含核苷酸之间的硫代磷酸酯(PS)键。
实施例67.根据实施例64-66中任一项所述的方法或组合物,包含2’-氟(2’-F)修饰的核苷酸。
实施例68.根据实施例64-67中任一项所述的方法或组合物,包含在所述引导RNA的所述5’末端处的前五个核苷酸中的一个或多个处的修饰。
实施例69.根据实施例64-68中任一项所述的方法或组合物,包含在所述引导RNA的所述3’末端处的最后五个核苷酸中的一个或多个处的修饰。
实施例70.根据实施例64-69中任一项所述的方法或组合物,包含在所述引导RNA的前四个核苷酸之间的PS键。
实施例71.根据实施例64-70中任一项所述的方法或组合物,包含在所述引导RNA的最后四个核苷酸之间的PS键。
实施例72.根据实施例64-71中任一项所述的方法或组合物,包含在所述引导RNA的所述5’末端处的前三个核苷酸处2’-O-Me修饰的核苷酸。
实施例73.根据实施例64-72中任一项所述的方法或组合物,包含在所述引导RNA的所述3’末端处的最后三个核苷酸处2’-O-Me修饰的核苷酸。
实施例74.根据实施例64-73中任一项所述的方法或组合物,其中所述引导RNA包含SEQ ID NO:300的经修饰的核苷酸。
实施例75.根据实施例1-74中任一项所述的方法或组合物,其中所述组合物进一步包含药学上可接受的赋形剂。
实施例76.根据实施例1-75中任一项所述的方法或组合物,其中所述引导RNA与脂质纳米颗粒(LNP)相关。
实施例77.根据实施例76所述的方法或组合物,其中所述LNP包含阳离子脂质。
实施例78.根据实施例77所述的方法或组合物,其中所述阳离子脂质是(9Z,12Z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙基十八-9,12-二烯酸酯,也称为3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙基(9Z,12Z)-十八-9,12-二烯酸酯。
实施例79.根据实施例76-78中任一项所述的方法或组合物,其中所述LNP包含中性脂质。
实施例80.根据实施例79所述的方法或组合物,其中所述中性脂质是DSPC。
实施例81.根据实施例76-80中任一项所述的方法或组合物,其中所述LNP包含辅助脂质。
实施例82.根据实施例81所述的方法或组合物,其中所述辅助脂质是胆固醇。
实施例83.根据实施例76-82中任一项所述的方法或组合物,其中所述LNP包含隐形脂质。
实施例84.根据实施例83所述的方法或组合物,其中所述隐形脂质是PEG2k-DMG。
实施例85.根据前述实施例中任一项所述的方法或组合物,其中所述组合物进一步包含RNA引导的DNA结合剂。
实施例86.根据前述实施例中任一项所述的方法或组合物,其中所述组合物进一步包含编码RNA引导的DNA结合剂的mRNA。
实施例87.根据实施例85或86所述的方法或组合物,其中所述RNA引导的DNA结合剂是Cas9。
实施例88.根据前述实施例中任一项所述的方法或组合物,其中所述组合物是药物制剂并且进一步包含药学上可接受的载体。
实施例89.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:1。
实施例90.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:2。
实施例91.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:3。
实施例92.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:4。
实施例93.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:5。
实施例94.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:6。
实施例95.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:7。
实施例96.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:8。
实施例97.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:9。
实施例98.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:10。
实施例99.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:11。
实施例100.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:12。
实施例101.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:13。
实施例102.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:14。
实施例103.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:15。
实施例104.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:16。
实施例105.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:17。
实施例106.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:18。
实施例107.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:19。
实施例108.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:20。
实施例109.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:21。
实施例110.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:22。
实施例111.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:23。
实施例112.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:24。
实施例113.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:25。
实施例114.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:26。
实施例115.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:27。
实施例116.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:28。
实施例117.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:29。
实施例118.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:30。
实施例119.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:31。
实施例120.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:32。
实施例121.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:33。
实施例122.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:34。
实施例123.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:35。
实施例124.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:36。
实施例125.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:37。
实施例126.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:38。
实施例127.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:39。
实施例128.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:40。
实施例129.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:41。
实施例130.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:42。
实施例131.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:43。
实施例132.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:44。
实施例133.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:45。
实施例134.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:46。
实施例135.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:47。
实施例136.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:48。
实施例137.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:49。
实施例138.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:50。
实施例139.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:51。
实施例140.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:52。
实施例141.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:53。
实施例142.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:54。
实施例143.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:55。
实施例144.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:56。
实施例145.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:57。
实施例146.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:58。
实施例147.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:59。
实施例148.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:60。
实施例149.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:61。
实施例150.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:62。
实施例151.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:63。
实施例152.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:64。
实施例153.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:65。
实施例154.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:66。
实施例155.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:67。
实施例156.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:68。
实施例157.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:69。
实施例158.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:70。
实施例159.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:71。
实施例160.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:72。
实施例161.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:73。
实施例162.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:74。
实施例163.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:75。
实施例164.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:76。
实施例165.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:77。
实施例166.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:78。
实施例167.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:79。
实施例168.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:80。
实施例169.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:81。
实施例170.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:82。
实施例171.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:83。
实施例172.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:84。
实施例173.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:103。
实施例174.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:109。
实施例175.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:123。
实施例176.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:133。
实施例177.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:149。
实施例178.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:156。
实施例179.根据实施例1-88中任一项所述的方法或组合物,其中选自SEQ ID NO:1-84和100-192的所述序列是SEQ ID NO:166。
实施例180.根据实施例1-88中任一项所述的方法或组合物,其中所述引导序列包含SEQ ID NO:2,9,13,16,22,24,25,27,30,31,32,33,35,36,40,44,45,53,55,57,60,61-63,65,67,69,70,71,73,76,78,79,80,82-84,103,109,123,133,149,156和166中的任一个。
实施例181.根据实施例1-88中任一项所述的方法或组合物,其中所述引导序列包含SEQ ID NO:100-102,104-108,110-122,124-132,134-148,150-155,157-165和167-192中的任一个。
实施例182.根据实施例1-88中任一项所述的方法或组合物,其中所述引导序列包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,62,66,68,70,73,75,76,77,78,80,103,109,123,133,149,153,156和184中的任一个。
实施例183.根据实施例1-88中任一项所述的方法或组合物,其中所述引导序列包含SEQ ID NO:1,5,7,8,14,23,25,27,32,45,48,103和123中的任一个。
实施例184.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:86-90中任一个的sgRNA。
实施例185.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:89的sgRNA。
实施例186.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1001或2001的sgRNA。
实施例187.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1005或2005的sgRNA。
实施例188.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1007或2007的sgRNA。
实施例189.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1008或2008的sgRNA。
实施例190.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1014或2014的sgRNA。
实施例191.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1023或2023的sgRNA。
实施例192.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1027或2027的sgRNA。
实施例193.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1032或2032的sgRNA。
实施例194.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1045或2045的sgRNA。
实施例195.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1048或2048的sgRNA。
实施例196.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1063或2063的sgRNA。
实施例197.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1067或2067的sgRNA。
实施例198.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1069或2069的sgRNA。
实施例199.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1071或2071的sgRNA。
实施例200.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1074或2074的sgRNA。
实施例201.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1076或2076的sgRNA。
实施例202.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1077或2077的sgRNA。
实施例203.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1078或2078的sgRNA。
实施例204.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1079或2079的sgRNA。
实施例205.根据实施例1-88中任一项所述的方法或组合物,其中所述引导RNA是包含SEQ ID NO:1081或2081的sgRNA。
实施例206.根据实施例1-205中任一项所述的方法或组合物,其中所述组合物以单剂量施用。
实施例207.根据实施例1-206中任一项所述的方法或组合物,其中所述组合物被施用一次。
实施例208.根据实施例206或207中任一项所述的方法或组合物,其中所述单剂量或一次施用:
a.诱导DSB;和/或
b.减少LDHA基因的表达;和/或
c.治疗或预防高草酸尿症;和/或
d.治疗或预防高草酸尿症引起的ESRD;和/或
e.治疗或预防草酸钙产生和沉积;和/或
f.治疗或预防原发性高草酸尿症(包括PH1、PH2和PH3);和/或
g.治疗或预防草酸过多症;和/或
h.治疗或预防血尿;和/或
i.治疗或预防肠源性高草酸尿症;和/或
j.治疗或预防与食用高草酸盐食物相关的高草酸尿症;和/或
k.延迟或改善对肾脏或肝脏移植的需要;和/或
l.增加血清乙醇酸盐浓度;和/或
m.减少尿中的草酸盐。
实施例209.根据实施例208所述的方法或组合物,其中所述单剂量或一次施用实现a)-m)中的任一项或多项持续3,4,5,6,7,8,9,10,11,12,13,14或15周。
实施例210.根据实施例208所述的方法或组合物,其中所述单剂量或一次施用实现持久效果。
实施例211.根据实施例1-208中任一项所述的方法或组合物,进一步包含实现持久效果。
实施例212.根据实施例210或211所述的方法或组合物,其中所述持久效果持续至少1个月、至少3个月、至少6个月、至少1年或至少5年。
实施例213.根据实施例1-212中任一项所述的方法或组合物,其中施用所述组合物导致尿中草酸盐的治疗相关性减少。
实施例214.根据实施例1-213中任一项所述的方法或组合物,其中施用所述组合物导致尿草酸盐水平在治疗范围内。
实施例215.根据实施例1-214中任一项所述的方法或组合物,其中施用所述组合物导致草酸盐水平在正常范围的100%、120%或150%内。
实施例216.根据实施例9-215中任一项所述的组合物或制剂在制备用于治疗患有高草酸尿症的人类受试者的药物中的用途。
还公开任何前述实施例的组合物或制剂在制备用于治疗患有高草酸尿症的人类受试者的药物中的用途。还公开任何前述组合物或制剂,用于治疗高草酸尿症或用于修饰LDHA基因(例如,在LDHA基因中形成插入缺失(indel),或形成移码或无义突变)。
附图说明
图1显示靶向LDHA的某些sgRNA的脱靶分析。
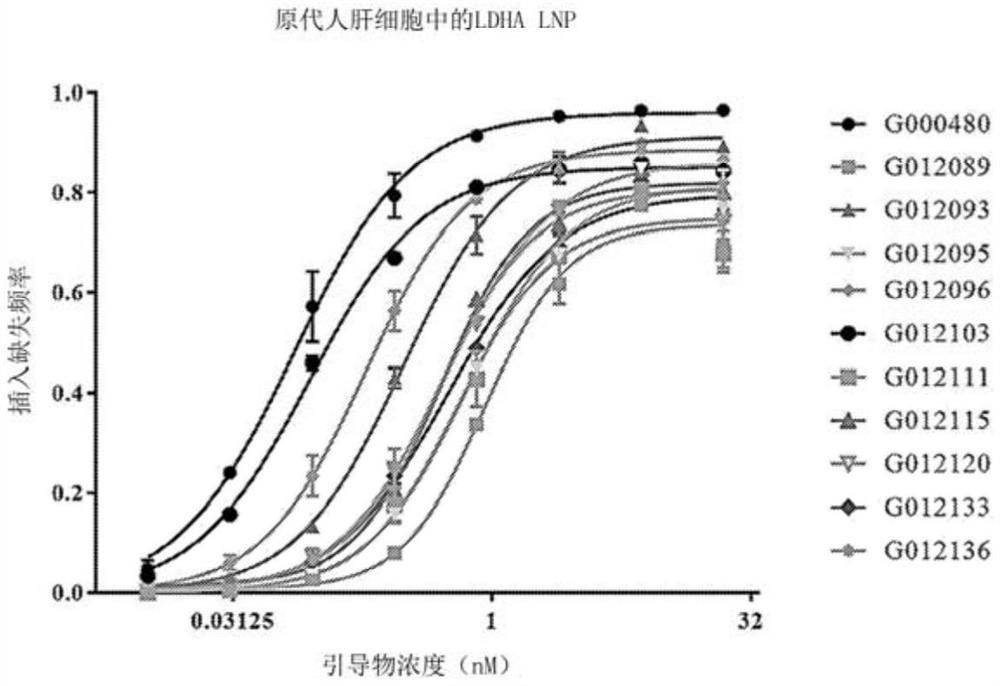
图2显示在PHH中靶向LDHA的某些sgRNA的编辑%的剂量反应曲线。
图3显示在PCH中靶向LDHA的某些sgRNA的编辑%的剂量反应曲线。
图4显示在PHH中进行的LDHA靶向修饰sgRNA(列于表2中)的蛋白质印迹分析。
图5显示在AGT缺陷小鼠体内用包含经修饰的sgRNA的LNP治疗后的尿草酸盐水平。
图6显示在15周的研究中,在AGT缺陷小鼠体内用包含经修饰的sgRNA的LNP治疗后的尿草酸盐水平。
图7显示在15周的研究中,在AGT缺陷小鼠体内用包含经修饰的sgRNA的LNP治疗后的蛋白质印迹分析。
图8显示AGT缺陷小鼠肝脏中体内LDHA蛋白的免疫组织化学染色。
图9显示表19中描绘的编辑和蛋白水平之间的相关性。
图10标记从1到10的示例性sgRNA序列中的10个保守区YA位点(SEQ ID NO:2082)。数字25、45、50、56、64、67和83表示sgRNA中YA位点1、5、6、7、8、9和10的嘧啶位置,引导区表示为(N)x,例如,其中x任选为20。
图11显示在可能的二级结构中示例性的sgRNA(SEQ ID NO:401;未显示所有的修饰),其具有表示sgRNA保守区的单个核苷酸的标记,sgRNA保守区包括下茎、隆突、上茎、接合区(其核苷酸可分别在5’至3’方向上称为N1至N18)、发夹1区和发夹2区。发夹1与发夹2之间的核苷酸被标记为n。sgRNA上可能存在引导区,并且在此图中表示为sgRNA保守区前面的“(N)x”。
图12A-12C显示原代食蟹猴肝细胞中靶向LDHA的某些sgRNA的编辑百分比的剂量反应曲线。
图13A-13B显示在原代人和食蟹猴肝细胞中包含某些sgRNA的脂质转染治疗后LDHA表达相对减少的剂量反应曲线。
图14A-14C分别显示在用包含某些sgRNA的LNP治疗后,AGT缺陷小鼠的剂量依赖性尿草酸盐水平、编辑百分比以及尿草酸盐水平与编辑百分比之间的相关性。
图15A-15B显示在如实例4所述的15周持久性研究中,用包含某些sgRNA的LNP处理后,AGT缺陷小鼠的肝脏和肌肉样品中的LDHA活性。
图16A-16B显示在如实例4所述的15周持久性研究中,用包含某些sgRNA的LNP处理后,AGT缺陷小鼠的肝脏和血浆样品中的丙酮酸盐水平。
图17显示在用包含某些sgRNA的LNP治疗后,接受了5/6肾切除术或假手术的小鼠中的平均血浆乳酸盐清除功能。
具体实施方式
现在将详细参考本发明的某些实施例,其实例在附图中示出。虽然结合图示的实施例描述本发明,但是应当理解,它们并不旨在将本发明限制于这些实施例。相反,本发明旨在覆盖所有替换、修改和等效形式,其可以包括在由所附权利要求和所包括的实施例限定的本发明内。
在详细描述本教导之前,应当理解,本公开不限于特定的组合物或工艺步骤,因为其可以变化。应当注意,除非上下文另有明确说明,否则如在本说明书和所附权利要求中所使用的单数形式“一(a)”、“一个(an)”和“所述”包括复数指称。因此,例如,提及“一种共轭物”包括多种共轭物,并且提及“一个细胞”包括多个细胞等。
数字范围包括定义范围的数字。考虑到有效数字和与测量相关的误差,测量值和可测量值应理解为近似值。此外,“包含(comprise、comprises、comprising)”、“含有(contain、contains、containing)”和“包括(include、includes、including)”的使用并不旨在进行限制。应当理解,前面的一般描述和详细描述都只是示例性和解释性的,而不是对教导的限制。
除非在说明书中特别指出,否则说明书中叙述“包含”各种组分的实施例也被认为是“由所述组分组成”或“基本上由所述组分组成”;说明书中叙述“由各种组分组成”的实施例也被认为是“包含”所述组分或“基本上由所述组分组成”;并且在说明书中叙述“基本上由各种组分组成”的实施例也被认为是“由所述组分组成”或“包含”所述组分(这种可互换性并不适用于权利要求中这些术语的使用)。除非上下文另有明确说明,否则术语“或”以包括性意义使用,即,等同于“和/或”。
此处使用的章节标题仅用于组织目的,并且不应被解释为以任何方式限制期望的主题。如果通过引用并入的任何材料与本说明书中定义的任何术语或本说明书的任何其他明确内容相矛盾,则以本说明书为准。虽然结合各种实施例描述了本教导,但是本教导并不旨在限于这些实施例。相反,如本领域技术人员将理解的,本教导涵盖各种替代、修改和等效形式。
I.定义
除非另有说明,否则本文使用的以下术语和短语旨在具有以下含义:
如本文所用,“多核苷酸”和“核酸”是指包含核苷或核苷类似物的多聚体化合物,所述核苷或核苷类似物具有沿骨架连接在一起的含氮杂环碱基或碱基类似物,包括常规的RNA、DNA、混合RNA-DNA和作为其类似物的聚合物。核酸“骨架”可以由多种键合构成,包括糖-磷酸二酯键合、肽-核酸键合(“肽核酸”或PNA;PCT第WO95/32305号)、硫代磷酸酯键合、甲基膦酸酯键合或其组合中的一种或多种。核酸的糖部分可以是核糖、脱氧核糖或具有取代(例如,2’-甲氧基取代和2’-卤化物取代)的类似化合物。含氮碱基可以是常规碱基(A、G、C、T、U)、其类似物(例如,经修饰的尿苷,例如5-甲氧尿苷、假尿苷或N1-甲基尿苷或其他);肌苷;嘌呤或嘧啶的衍生物(例如,N
“引导RNA”、“gRNA”和“引导物”在本文中可互换地用来指crRNA(也称为CRISPRRNA)或crRNA和trRNA的组合(也称为tracrRNA)。crRNA和trRNA可以联合为单个RNA分子(单链引导RNA,sgRNA)或联合在两个独立的RNA分子(双链引导RNA,dgRNA)中。“引导RNA”或“gRNA”指每种类型。trRNA可以是天然存在的序列,或者是与天然存在的序列相比具有修饰或变异的trRNA序列。
如本文所用,“引导序列”是指与靶序列互补的引导RNA内的序列,并且用于将引导RNA引至靶序列以通过RNA引导的DNA结合剂进行结合或修饰(例如,切割)。“引导序列”也可称为“靶向序列”或“间隔序列”。引导序列的长度可以是20个碱基对,例如,在酿脓链球菌(即,Spy Cas9)和相关的Cas9同系物/直向同源物的情况下。较短或较长的序列也可以用作引导物,例如长度为15-,16-,17-,18-,19-,21-,22-,23-,24-或25个核苷酸。例如,在一些实施例中,引导序列包含选自SEQ ID NO:1-84的序列的至少17、18、19或20个连续核苷酸。在一些实施例中,靶序列例如在基因中或在染色体上,并且与引导序列互补。在一些实施例中,引导序列与其相应的靶序列之间的互补或同一性程度可以是约75%,80%,85%,90%,95%,96%,97%,98%,99%或100%。例如,在一些实施例中,引导序列包含与选自SEQ IDNO:1-84的序列的至少17、18、19或20个连续核苷酸具有约75%,80%,85%,90%,95%,96%,97%,98%,99%或100%同一性的序列。在一些实施例中,引导序列和靶区可以100%互补或相同。在其他实施例中,引导序列和靶区可以含有至少一个错配。例如,引导序列和靶序列可能含有1、2、3或4个错配,其中靶序列的总长度为至少17、18、19、20或更多个碱基对。在一些实施例中,引导序列和靶区可以含有1-4个错配,其中引导序列包含至少17、18、19、20或更多个核苷酸。在一些实施例中,引导序列和靶区可以含有1、2、3或4个错配,其中引导序列包含20个核苷酸。
RNA引导的DNA结合剂的靶序列包括基因组DNA的正链和负链(即给出的序列和该序列的反向互补序列),因为RNA引导的DNA结合剂的核酸底物是双链核酸。因此,当引导序列被称为“与靶序列互补”时,应理解所述引导序列可将引导RNA指引成与靶序列的反向互补序列结合。因此,在一些实施例中,当引导序列结合靶序列的反向互补序列时,引导序列与靶序列(例如,不包括PAM的靶序列)的某些核苷酸相同,但在引导序列中用U代替T除外。
如本文所用,“YA位点”指5’-嘧啶-腺嘌呤-3’二核苷酸。sgRNA的保守区中存在“保守区YA位点”。sgRNA的引导区中存在“引导区YA位点”。sgRNA中未修饰的YA位点可能易被RNase-A样内切酶,例如,RNase A切割。在一些实施例中,sgRNA在其保守区中包含约10个YA位点。在一些实施例中,sgRNA在其保守区中包含1,2,3,4,5,6,7,8,9或10个YA位点。图10示出示例性保守区YA位点。图10中未显示示例性引导区YA位点,因为引导区可以是任何序列,包括任何数量的YA位点。在一些实施例中,sgRNA包含图10所示的1,2,3,4,5,6,7,8,9或10个YA位点。在一些实施例中,sgRNA包含下列位置或其子集的1,2,3,4,5,6,7,8,9或10个YA位点:LS5-LS6;US3-US4;US9-US10;US12-B3;LS7-LS8;LS12-N1;N6-N7;N14-N15;N17-N18;和H2-2至H2-3。在一些实施例中,YA位点包含修饰,意味着YA位点的至少一个核苷酸被修饰。在一些实施例中,YA位点的嘧啶(也称为嘧啶位置)包含修饰(其包括改变紧接嘧啶糖的3’的核苷间键合的修饰)。在一些实施例中,YA位点的腺嘌呤(也称为腺嘌呤位置)包含修饰(其包括改变紧接腺嘌呤糖的3’的核苷间键合的修饰)。在一些实施例中,YA位点的嘧啶位置和腺嘌呤位置包含修饰。
如本文所用,“RNA引导的DNA结合剂”是指具有RNA和DNA结合活性的多肽或多肽复合物,或此类复合物的DNA结合亚单位,其中DNA结合活性是序列特异性的并取决于RNA的序列。示例性的RNA引导的DNA结合剂包括Cas裂解酶/切口酶及其灭活形式(“dCas DNA结合剂”)。如本文所用,“Cas核酸酶”也称为“Cas蛋白”,囊括Cas裂解酶、Cas切口酶和dCas DNA结合剂。Cas裂解酶/切口酶和dCas DNA结合剂包括III型CRISPR系统的Csm或Cmr复合物、其Cas10、Csm1或Cmr2亚单位、I型CRISPR系统的级联复合物、其Cas3亚单位和2类Cas核酸酶。如本文所用,“2类Cas核酸酶”是具有RNA引导的DNA结合活性的单链多肽,例如Cas9核酸酶或Cpf1核酸酶。2类Cas核酸酶包括2类Cas裂解酶和2类Cas切口酶(例如,H840A、D10A或N863A变体),其进一步具有RNA引导的DNA裂解酶或切口酶活性;以及2类dCas DNA结合剂,其中裂解酶/切口酶活性被失活。2类Cas核酸酶包括,例如Cas9、Cpf1、C2c1、C2c2、C2c3、HFCas9(例如,N497A、R661A、Q695A、Q926A变体)、HypaCas9(例如,N692A、M694A、Q695A、H698A变体)、eSPCas9(1.0)(例如,K810A、K1003A、R1060A变体)和eSPCas9(1.1)(例如,K848A、K1003A、R1060A变体)蛋白及其修饰。Cpf1蛋白,Zetsche等人,《细胞(Cell)》,163:1-13(2015),与Cas9同源,并且含有RuvC样核酸酶结构域。Zetsche的Cpf1序列通过引用整体并入本文。参见例如Zetsche,表S1和S3(Tables S1 and S3)。“Cas9”囊括Spy Cas9、本文所列的Cas9变体及其等同物。参见例如Makarova等人,《自然微生物学综述(Nat RevMicrobiol)》,13(11):722-36(2015);Shmakov等人,《分子细胞(Molecular Cell)》,60:385-397(2015)。
如本文所用,“核糖核蛋白”(RNP)或“RNP复合物”是指引导RNA连同RNA引导的DNA结合剂,例如Cas核酸酶,例如Cas裂解酶、Cas切口酶或dCas DNA结合剂(例如,Cas9)。在一些实施例中,引导RNA将RNA引导的DNA结合剂例如Cas9引导至靶序列,并且引导RNA与靶序列杂交并且试剂与靶序列结合;在所述试剂是裂解酶或切口酶的情况下,结合之后可以是切割或刻痕。
如本文所用,如果第一序列与第二序列的比对显示第二序列整体的X%或更多的位置与第一序列匹配,则第一序列被认为“包含与第二序列具有至少X%同一性的序列”。例如,序列AAGA包含与序列AAG具有100%同一性的序列,因为比对将给出100%同一性,因为存在与第二序列的所有三个位置的匹配。RNA和DNA之间的差异(通常是尿苷与胸苷的交换,或反之亦然)和核苷类似物例如经修饰的尿苷的存在不会导致多核苷酸之间的同一性或互补性的差异,只要相关核苷酸(例如胸苷、尿苷或经修饰的尿苷)具有相同的互补序列(例如,腺苷用于所有胸苷、尿苷或经修饰的尿苷;另一个实例是胞嘧啶和5-甲基胞嘧啶,它们都具有鸟苷或经修饰的鸟苷作为互补序列)。因此,例如,序列5’-AXG(其中X是任何经修饰的尿苷,例如假尿苷、N1-甲基假尿苷或5-甲氧尿苷)被认为与AUG 100%相同,因为两者与同一序列(5’-CAU)完全互补。示例性比对算法是本领域众所周知的Smith-Waterman和Needleman-Wunsch算法。本领域技术人员将理解哪种算法选择和参数设置适合于待比对的给定序列对;对于长度大致相似且期望>50%的氨基酸同一性或>75%的核苷酸同一性的序列,通常采用带有由EBI在www.ebi.ac.uk web服务器上提供的Needleman-Wunsch算法界面默认设置的Needleman-Wunsch算法。
“mRNA”在本文中用于指多核苷酸,其为RNA或经修饰的RNA并包含可翻译成多肽(即可用作核糖体和氨基酰化tRNA翻译的底物)的开放阅读框。mRNA可以包含磷酸糖骨架,包括核糖残基或其类似物,例如2’-甲氧基核糖残基。在一些实施例中,mRNA磷酸糖骨架的糖基本上由核糖残基、2’-甲氧基核糖残基或其组合组成。
用于本文所述的引导RNA组合物和方法的引导序列示于表1和整个申请中。
如本文所用,“插入缺失”是指由靶核酸中双链断裂(DSB)位点插入或缺失的多个核苷酸组成的插入/缺失突变。
如本文所用,“敲除”是指特定基因产物(例如蛋白质、mRNA或两者)表达的减少。蛋白质的敲除可以通过检测目标组织或细胞群中蛋白质的总细胞量来测量。用于测量mRNA敲除的方法是已知的,并且包括对从目标组织或细胞群分离的mRNA进行测序。在一些实施例中,“敲除”可以指特定基因产物表达的一些损失,例如由细胞群(包括体内群,例如在组织中发现的那些)转录的mRNA的量的减少或表达的蛋白质的量的减少。
如本文所用,“敲除”是指细胞中特定蛋白表达的丧失。敲除可以通过检测细胞、组织或细胞群中蛋白质的总细胞量来测量。在一些实施例中,本公开的方法“敲除”一个或多个细胞中(例如,包括体内群例如在组织中发现的那些在内的细胞群中)的LDHA。在一些实施例中,敲除不是例如由插入缺失产生的突变LDHA蛋白的形成,而是细胞中LDH蛋白表达的完全丧失。如本文所用,“LDH”是指乳酸脱氢酶,它是LDHA基因的基因产物。人野生型LDHA序列可在NCBI基因ID:3939;Ensembl ENSG00000134333获得。
“高草酸尿症”是以尿中草酸盐过多为特征的病症。高草酸尿症的示例性类型包括原发性高草酸尿症(包括1型(PH1)、2型(PH2)和3型(PH3))、草酸过多症、肠源性高草酸尿症以及与食用高草酸盐食物相关的高草酸尿症。高草酸尿症可能是特发性的。高草酸盐水平会导致草酸钙结石形成和肾实质损伤,从而导致肾功能进行性恶化,并且最终导致终末期肾脏疾病。因此,高草酸尿症可能导致肾脏和尿路中草酸盐产生过多和草酸钙晶体沉积。草酸盐导致肾损害是由肾小管毒性、肾内草酸钙沉积和草酸钙结石导致的尿路梗阻共同引起的。肾功能受损会使疾病恶化,因为过量的草酸盐无法继续有效地排出体外,导致随后草酸盐在骨骼、眼睛、皮肤和心脏以及其他器官中积聚和结晶,从而导致严重疾病和死亡。可能出现肾功能衰竭和终末期肾脏疾病。目前尚无经批准的针对高草酸尿症的药物疗法。
“原发性1型高草酸尿症(PH1)”是由AGXT基因突变引起的常染色体隐性疾病,所述基因编码肝过氧化物酶体丙氨酸-乙醛酸盐转氨酶(AGT)酶。AGT将乙醛酸盐代谢为甘氨酸。AGT活性的缺乏或其错误地靶向线粒体,使得乙醛酸盐氧化为草酸盐,所述草酸盐只能通过尿排泄。
在通过肾脏排泄之前破坏将乙醛酸盐转化为草酸盐的肝脏过氧化物酶体酶,乳酸脱氢酶(LDH),是阻断患病肝脏中草酸盐合成的一种可能机制,从而潜在地预防高草酸尿症中发生的病理。乳酸脱氢酶基因(LDHA)编码的LDH催化乙醛酸盐转化为草酸盐。LDH活性的抑制应抑制草酸盐产生,从而导致尿草酸盐水平降低,同时导致可通过乙醛酸盐还原酶/羟基丙酮酸盐还原酶(GRHPR)转化为乙醇酸盐的乙醛酸盐的积聚。与草酸盐不同,乙醇酸盐是可溶的,并且容易通过尿排泄。目前尚无已知的乙醇酸盐水平升高的负面副作用。因此,在一些实施例中,提供抑制LDH活性的方法,其中一旦LDH活性被抑制,草酸盐产生将被抑制并且乙醇酸盐产生将增加。
草酸盐,乙醛酸盐的氧化产物,只能通过尿排泄。尿中高水平的草酸盐(“高草酸尿症”)是高草酸尿症的症状。因此,尿中草酸盐增加是高草酸尿症的症状。草酸盐可与钙结合形成草酸钙,草酸钙是肾脏和膀胱结石的主要成分。肾脏和其他组织中草酸钙的沉积可导致尿中带血(血尿)、尿路感染、肾脏损害、终末期肾脏疾病等。随着时间的推移,血液中的草酸盐水平可能升高,并且草酸钙可能沉积在身体的其他器官中(草酸过多症或全身性草酸过多症)。
如本文所用,“靶序列”是指靶基因中与gRNA的引导序列互补的核酸序列。靶序列和引导序列的相互作用指导RNA引导的DNA结合剂在靶序列内结合,并潜在地在靶序列内刻痕或切割(取决于试剂的活性)。
如本文所用,“治疗”是指对受试者中的疾病或障碍的治疗剂的任何施用或应用,并且包括抑制疾病、阻止其发展、缓解疾病的一种或多种症状、治愈疾病或预防疾病的一种或多种症状的复发。例如,高草酸尿症的治疗可包含减轻高草酸尿症的症状。
如本文所用,术语“草酸盐的治疗相关性减少”或“治疗范围内的草酸盐水平”是指与基线相比尿草酸盐排泄的减少大于30%。参见Leumann和Hoppe(1999)《肾脏病透析与移植》14:2556-2558at 2557,第二卷。例如,达到治疗范围内的草酸盐水平意味着将尿草酸盐水平从基线降低超过30%。在一些实施例中,“正常草酸盐水平”或“正常草酸盐范围”为约80至约122μg草酸盐/毫克肌酐。参见Li等人.(2016)《生物化学与生物物理学报(BiochimBiophys Acta)》1862(2):233-239。在一些实施例中,草酸盐的治疗相关性减少达到低于或在正常水平的200%,150%,125%,120%,115%,110%,105%或100%之内。
术语“约”或“近似”意指由本领域普通技术人员确定的特定值的可接受误差,其部分取决于测量或确定所述值的方式。
II.组合物
A.包含引导RNA(gRNA)的组合物
本文提供用于诱导LDHA基因内双链断裂(DSB)的组合物,例如使用具有RNA引导的DNA结合剂(例如,CRISPR/Cas系统)的引导RNA。所述组合物可对患有或疑似患有高草酸尿症的受试者施用。所述组合物可对具有增加的尿草酸盐输出或减少的血清乙醇酸盐输出的受试者施用。表1中以SEQ ID NO:1-84显示靶向LDHA基因的引导序列。
表1中以SEQ ID NO:1-84和100-192所示的每个引导序列可以进一步包含额外的核苷酸以形成crRNA,例如其中以下示例性核苷酸序列在其3’末端处跟随引导序列:在5’至3’取向上的GUUUUAGAGCUAUGCUGUUUUG(SEQ ID NO:200)。在sgRNA的情况下,上述引导序列可以进一步包含额外的核苷酸以形成sgRNA,例如,其中以下示例性核苷酸序列跟随引导序列的3’末端:在5’至3’取向上的GUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU(SEQ ID NO:201)或GUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC(SEQ ID NO:203,其是不具有四个终端U的SEQ ID NO:201)。在一些实施例中,不存在SEQ ID NO:201的四个终端U。在一些实施例中,SEQ ID NO:201的四个终端U中仅存在1、2或3个。
在一些实施例中,提供包含本文所述的引导序列和包含发夹区的“sgRNA的保守部分”的LDHA短单链引导RNA(LDHA短sgRNA),其中发夹区缺失至少5-10个核苷酸或6-10个核苷酸。在某些实施例中,相对于sgRNA的保守部分,LDHA短单链引导RNA的发夹区缺失5-10个核苷酸,例如表2B中的核苷酸H1-1至H2-15。在某些实施例中,相对于sgRNA的保守部分,LDHA短单链引导RNA的发夹1区缺失5-10个核苷酸,例如表2B中的核苷酸H1-1至H1-12。
表2A显示示例性“sgRNA的保守部分”,其显示酿脓链球菌Cas9(“spyCas9”(也被称为“spCas9”))sgRNA的“保守区”。第一行显示核苷酸的编号,第二行显示序列(SEQ ID NO:700);并且第三行显示“结构域”。Briner AE等人,《分子细胞》56:333-339(2014)描述sgRNA的功能结构域,在本文中被称为“结构域”,包括负责靶向的“间隔”结构域、“下茎”、“隆突”、“上茎”(其可包括四环)、“接合”以及“发夹1”和“发夹2”结构域。参见Briner等人第334页,图1A。
表2B提供本文所用sgRNA的结构域的示意图。在表2B中,区之间的“n”表示核苷酸的可变数量,例如,从0到1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20或更多。在一些实施例中,n等于0。在一些实施例中,n等于1。
在一些实施例中,LDHA sgRNA来自酿脓链球菌Cas9(“spyCas9”)或spyCas9等同物。在一些实施例中,sgRNA不是来自酿脓链球菌(“非spyCas9”)。在一些实施例中,5-10个核苷酸或6-10个核苷酸是连续的。
在一些实施例中,LDHA短sgRNA缺失酿脓链球菌Cas9(“spyCas9”)sgRNA的保守部分的至少核苷酸54-58(AAAAA),如表2A所示。在一些实施例中,LDHA短sgRNA是非spyCas9sgRNA,其缺失至少对应于spyCas9保守部分的核苷酸54-58(AAAAA)的核苷酸,例如例如通过成对或结构比对确定的。在一些实施例中,非spyCas9 sgRNA是金黄色酿脓葡萄球菌Cas9(“saCas9”)sgRNA。
在一些实施例中,LDHA短sgRNA缺失spyCas9 sgRNA的保守部分的至少核苷酸54-61(AAAAAGUG)。在一些实施例中,LDHA短sgRNA缺失spyCas9 sgRNA的保守部分的至少核苷酸53-60(GAAAAAGU)。在一些实施例中,LDHA短sgRNA缺失spyCas9 sgRNA保守部分的核苷酸53-60(GAAAAAGU)或核苷酸54-61(AAAAGUG)中的4、5、6、7或8个核苷酸,或非spyCas9 sgRNA保守部分的相应核苷酸,如通过例如成对或结构比对确定的。
在一些实施例中,sgRNA包含SEQ ID NO:1-146的引导序列中的任何一个和另外的核苷酸以形成crRNA,例如其中以下示例性核苷酸序列在其3’末端跟随引导序列:在5’至3’取向上的GUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGGCACCGAGUCGGUGC(SEQ ID NO:202)。相对于野生型引导RNA保守序列,SEQ ID NO:202缺失8个核苷酸:GUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC(SEQID NO:203)。
表1:人和食蟹猴的LDHA靶向引导序列和染色体坐标
表2:LDHA靶向的gRNA和sgRNA的命名和序列
表2A(spyCas9 sgRNA的保守部分;SEQ ID NO:400)
表2B
在一些实施例中,本发明提供包含一或多个引导RNA(gRNA)的组合物,所述引导RNA包含将RNA引导的DNA结合剂引至LDHA中的靶DNA序列的引导序列,所述RNA引导的DNA结合剂可以是核酸酶(例如,Cas核酸酶,例如Cas9)。gRNA可包含crRNA,crRNA包含表1所示的引导序列。gRNA可包含crRNA,crRNA包含表1所示引导序列的17、18、19或20个连续核苷酸。在一些实施例中,gRNA包含crRNA,crRNA包含与表1所示引导序列的至少17、18、19或20个连续核苷酸具有约75%,80%,85%,90%,95%,96%,97%,98%,99%或100%同一性的序列。在一些实施例中,gRNA包含crRNA,crRNA包含与表1所示引导序列具有约75%,80%,85%,90%,95%,96%,97%,98%,99%或100%同一性的序列。gRNA可进一步包含trRNA。在本文所述的每种组合物和方法实施例中,crRNA和trRNA可关联为单链RNA(sgRNA),或者可以位于单独的RNA(dgRNA)上。在sgRNA的情况下,crRNA和trRNA组分可以共价连接,例如,通过磷酸二酯键或其他共价键。
在本文所述的每一组合物、用途和方法实施例中,引导RNA可以包含两种RNA分子作为“双链引导RNA”或“dgRNA”。dgRNA包含第一RNA分子和第二RNA分子,所述第一RNA分子包含crRNA,所述crRNA包含例如表1所示的引导序列,并且所述第二RNA分子包含trRNA。第一RNA分子和第二RNA分子可能不是共价连接的,但可能通过crRNA与trRNA部分之间的碱基配对形成RNA双链体。
在本文所述的每一组合物、用途和方法实施例中,引导RNA可以包含单个RNA分子作为“单链引导RNA”或“sgRNA”。sgRNA可以包含crRNA(或其一部分),所述crRNA包含与trRNA共价连接的表1所示的引导序列。sgRNA可包含表1所示引导序列的17、18、19或20个连续核苷酸。在一些实施例中,crRNA和trRNA通过连接基共价连接。在一些实施例中,sgRNA通过crRNA与trRNA部分之间的碱基配对形成茎环结构。在一些实施例中,crRNA和trRNA通过一个或多个不是磷酸二酯键的键共价连接。
在一些实施例中,trRNA可以包含源自天然存在的CRISPR/Cas系统的全部或一部分trRNA序列。在一些实施例中,trRNA包含截短或经修饰的野生型trRNA。trRNA的长度取决于所用的CRISPR/Cas系统。在一些实施例中,trRNA包含5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,25,30,40,50,60,70,80,90,100或多于100个核苷酸或由其组成。在一些实施例中,trRNA可以包含某些二级结构,例如一个或多个发夹或茎环结构,或一个或多个隆突结构。
在一些实施例中,本发明提供包含一个或多个引导RNA的组合物,所述引导RNA包含SEQ ID NO:1-84中任一个的引导序列。
在一些实施例中,本发明提供包含一个或多个sgRNA的组合物,所述sgRNA包含SEQID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081中的任一个或者其经修饰的版本,如例如SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。
在一个方面,本发明提供一种包含gRNA的组合物,所述gRNA包含与SEQ ID NO:1-84的任何核酸至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列。
在其他实施例中,组合物包含至少一个,例如至少两个gRNA,gRNA包含选自SEQ IDNO:1-84的任意两个或更多个引导序列的引导序列。在一些实施例中,所述组合物包含至少两个gRNA,所述至少两个gRNA各自包含与SEQ ID NO:1-84的任何核酸至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同的引导序列。
本发明的引导RNA组合物被设计成识别LDHA基因中的靶序列(例如,与其杂交)。例如,LDHA靶序列可以被提供的包含引导RNA的Cas裂解酶识别和切割。在一些实施例中,可以通过引导RNA将RNA引导的DNA结合剂例如Cas裂解酶引至LDHA基因的靶序列,其中引导RNA的引导序列与靶序列杂交,并且RNA引导的DNA结合剂例如Cas裂解酶切割靶序列。
在一些实施例中,基于LDHA基因内的靶序列确定对所述一个或多个引导RNA的选择。
不受任何特定理论的限制,在基因的某些区中的突变(例如,由作为核酸酶介导的DSB的结果而发生的插入缺失引起的移码突变)可能比在基因的其他区中的突变更不可耐受,因此DSB的位置是可能导致的蛋白质敲除的量或类型的重要因素。在一些实施例中,使用与LDHA内的靶序列互补或具有互补性的gRNA将RNA引导的DNA结合剂引导至LDHA基因中的特定位置。在一些实施例中,gRNA被设计为具有与LDHA外显子1、外显子2、外显子3、外显子4、外显子5、外显子6、外显子7或外显子8中的靶序列互补或具有互补性的引导序列。
在一些实施例中,引导序列与人LDHA基因中存在的靶序列至少99%,98%,97%,96%,95%,94%,93%,92%,91%或90%相同。在一些实施例中,靶序列可以与引导RNA的引导序列互补。在一些实施例中,引导RNA的引导序列与其相应的靶序列之间的互补或同一性程度可以是至少80%、85%、90%、95%、96%、97%、98%、99%或100%。在一些实施例中,gRNA的靶序列和引导序列可以是100%互补或相同的。在其他实施例中,gRNA的靶序列和引导序列可以含有至少一个错配。例如,gRNA的靶序列和引导序列可含有1、2、3或4个错配,其中引导序列的总长度为20。在一些实施例中,gRNA的靶序列和引导序列可含有1-4个错配,其中引导序列是20个核苷酸。
在一些实施例中,本文公开的组合物或制剂包含mRNA,所述mRNA包含编码RNA引导的DNA结合剂(例如本文所述的Cas核酸酶)的开放阅读框(ORF)。在一些实施例中,提供、使用或施用包含编码RNA引导的DNA结合剂(例如Cas核酸酶)的ORF的mRNA。
B.经修饰的gRNA和mRNA
在一些实施例中,gRNA是化学修饰的。包含一种或多种经修饰的核苷或核苷酸的gRNA被称为“经修饰的”gRNA或“化学修饰的”gRNA,以描述一种或多种非天然和/或天然存在的组分或构象的存在,替代或除标准的A、G、C和U残基之外使用这些组分或构象。在一些实施例中,经修饰的gRNA是用非标准核苷或核苷酸合成的,在此处被称为“经修饰的”。经修饰的核苷和核苷酸可以包括以下中的一种或多种:(i)磷酸二酯骨架键中的一个或两个非连接磷酸氧和/或一个或多个连接磷酸氧的改变,例如取代(示例性骨架修饰);(ii)核糖糖成分,例如核糖糖上的2’羟基的改变,例如取代(示例性糖修饰);(iii)用“去磷”连接基大量替换磷酸盐部分(示例性骨架修饰);(iv)天然存在的核碱基,包括用非标准核碱基的修饰或取代(示例性碱基修饰);(v)核糖-磷酸骨架的取代或修饰(示例性骨架修饰);(vi)寡核苷酸的3’末端或5’末端的修饰,例如,终端磷酸基团的去除、修饰或替换或部分、帽或连接基的共轭(此类3’或5’帽修饰可以包含糖和/或骨架修饰);和(vii)糖的修饰或替换(示例性糖修饰)。
可将化学修饰(例如上文所列的那些)进行组合,以提供包含核苷和核苷酸(统称为“残基”)的经修饰的gRNA和/或mRNA,所述经修饰的gRNA和/或mRNA可具有两种、三种、四种或更多种修饰。例如,经修饰的残基可以具有经修饰的糖和经修饰的核碱基。在一些实施例中,gRNA的每个碱基都被修饰,例如所有的碱基都具有经修饰的磷酸酯基团,例如硫代磷酸酯基团。在某些实施例中,gRNA分子的所有或基本上所有的磷酸酯基团被硫代磷酸酯基团取代。在一些实施例中,经修饰的gRNA包含在RNA的5’末端处或附近的至少一个经修饰的残基。在一些实施例中,经修饰的gRNA包含在RNA的3’末端处或附近的至少一个经修饰的残基。
在一些实施例中,gRNA包含一个、两个、三个或更多个经修饰的残基。在一些实施例中,经修饰的gRNA中至少5%(例如,至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或100%)的位置是经修饰的核苷或核苷酸。
未修饰的核酸可能易于通过例如胞内核酸酶或在血清中发现的那些降解。例如,核酸酶可以水解核酸磷酸二酯键。因此,在一个方面,本文所述的gRNA可以含有一个或多个经修饰的核苷或核苷酸,例如,以引入对基于细胞内或血清的核酸酶的稳定性。在一些实施例中,本文所述的经修饰的gRNA分子在体内和体外引入细胞群时可表现出降低的先天免疫反应。术语“先天免疫反应”包括对外源核酸(包括单链核酸)的细胞反应,其涉及细胞因子表达和释放(特别是干扰素)的诱导以及细胞死亡。
在骨架修饰的一些实施例中,经修饰的残基的磷酸酯基团可以通过用不同的取代基取代一个或多个氧来修饰。此外,经修饰的残基,例如,存在于经修饰的核酸中的经修饰的残基可包括用本文所述的经修饰的磷酸酯基团来整体取代未修饰的磷酸酯部分。在一些实施例中,磷酸酯骨架的骨架修饰可以包括导致不带电连接基或具有不对称电荷分布的带电连接基的改变。
经修饰的磷酸酯基团的实例包括硫代磷酸酯、硒代磷酸酯、硼酸磷酸盐、硼酸磷酸酯、氢膦酸酯、氨基磷酸酯、烷基或芳基膦酸酯和磷酸三酯。未修饰的磷酸酯基团中的磷原子是非手性的。然而,用上述原子或原子组中的一个取代一个非桥接氧原子,可以使磷原子成为手性的。立体磷原子可以具有“R”构型(本文为Rp)或“S”构型(本文为Sp)。骨架也可以通过用氮(桥接的氨基磷酸酯)、硫(桥接的硫代磷酸酯)和碳(桥接的亚甲基膦酸酯)取代桥接氧(即,连接磷酸盐和核苷的氧)来修饰。取代可以发生在任一连接氧处或在两个连接氧处。
在某些骨架修饰中,磷酸酯基团可以被含非磷的连接体取代。在一些实施例中,带电磷酸酯基团可以被中性部分取代。可以取代磷酸酯基团的部分的实例可以包括但不限于,例如,甲基膦酸酯、羟氨基、硅氧烷、碳酸酯、羧甲基、氨基甲酸酯、酰胺、硫醚、环氧乙烷连接基、磺酸酯、磺酰胺、硫代甲缩醛、甲缩醛、肟、亚甲基亚氨基、亚甲基甲基亚氨基、亚甲基亚肼、亚甲基二甲基亚肼和亚甲基氧甲基亚氨基。
还可以构建可模拟核酸的支架,其中磷酸酯连接基和核糖糖被核酸酶抗性核苷或核苷酸替代物取代。此类修饰可以包含骨架修饰和糖修饰。在一些实施例中,核碱基可以被替代骨架拴系。实例可包括但不限于吗啉代、环丁基、吡咯烷和肽核酸(PNA)核苷替代物。
经修饰的核苷和经修饰的核苷酸可以包括对糖基团的一种或多种修饰,即为糖修饰。例如,2’羟基(OH)可以被修饰,例如被多种不同的“氧基”或“脱氧”取代基取代。在一些实施例中,对2’羟基的修饰可以增强核酸的稳定性,因为羟基可不再去质子化以形成2’-醇盐离子。
2’羟基修饰的实例可以包括烷氧基或芳氧基(OR,其中“R”可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖);聚乙二醇(PEG),O(CH
“脱氧”2’修饰可以包括氢(即脱氧核糖糖,例如,在部分dsRNA的突出部分);卤素(例如,溴、氯、氟或碘);氨基(其中氨基可以是例如NH
糖修饰可以包含糖基团,所述糖基团也可以含有一个或多个碳,这些碳具有与核糖中相应碳的立体化学构型相反的立体化学构型。因此,经修饰的核酸可以包括核苷酸,其含有例如阿拉伯糖,作为糖。经修饰的核酸还可以包括碱性糖。这些碱性糖也可以在一个或多个组成糖原子处被进一步修饰。经修饰的核酸还可以包括一种或多种L形式的糖,例如,L-核苷。
本文所述的经修饰的核苷和经修饰的核苷酸(其可并入经修饰的核酸中)可包括经修饰的碱基,也称为核碱基。核碱基的实例包括但不限于腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)和尿嘧啶(U)。这些核碱基可以被修饰或完全取代,以提供可掺入经修饰的核酸的经修饰的残基。核苷酸的核碱基可以独立地选自嘌呤、嘧啶、嘌呤类似物或嘧啶类似物。在一些实施例中,核碱基可以包括例如天然存在的和合成的碱基衍生物。
在采用双链引导RNA的实施例中,crRNA和tracr RNA中的每一者都可以含有修饰。此类修饰可以在crRNA和/或tracr RNA的一端或两端处。在包含sgRNA的实施例中,sgRNA的一端或两端处的一个或多个残基可以被化学修饰,和/或内部核苷可以被修饰,和/或整个sgRNA可以被化学修饰。某些实施例包含5’端修饰。某些实施例包含3’端修饰。
在一些实施例中,本文公开的引导RNA包含2017年12月8日提交的标题为“化学修饰的引导RNA(Chemically Modified Guide RNAs)”的WO2018/107028 A1中公开的修饰模式之一,其内容通过引用整体并入本文。在一些实施例中,本文公开的引导RNA包含US20170114334中公开的结构/修饰模式之一,其内容通过引用整体并入本文。在一些实施例中,本文公开的引导RNA包含WO2017/136794中公开的结构/修饰模式之一,其内容通过引用整体并入本文。
C.YA修饰
YA位点处的修饰(本文也称为“YA修饰”)可以是核苷间键合的修饰、碱基(嘧啶或腺嘌呤)的修饰,例如通过化学修饰、取代或其他方式,和/或糖的修饰(例如在2’位置,例如2’-O-烷基、2’-F、2’-moe、2’-F阿拉伯糖、2’-H(脱氧核糖)等)。在一些实施例中,“YA修饰”是改变二核苷酸基序结构以降低RNA内切酶活性的任何修饰,例如通过干扰RNase对YA位点的识别或切割和/或通过稳定降低切割位点对RNase的可及性的RNA结构(例如二级结构)。参见Peacock等人,《有机化学期刊(J Org Chem.)》76:7295-7300(2011);Behlke,《寡核苷酸(Oligonucleotides)》18:305-320(2008);Ku等人,《先进药物输送评论(Adv.DrugDelivery Reviews)》104:16-28(2016);Ghidini等人,《化学通信(Chem.Commun.)》,2013,49,9036。Peacock等人,Belhke,Ku,和Ghidini提供适合于YA修饰的示例性修饰。囊括本领域技术人员已知的减少内切核苷酸降解的修饰。影响RNase切割所涉及的2’羟基的示例性2’核糖修饰是2’-H和2’-O-烷基,包括2’-O-Me。例如双环核糖类似物、UNA和YA位点处残基的经修饰的核苷间键合等修饰可以是YA修饰。可稳定RNA结构的示例性碱基修饰是假尿苷和5-甲基胞嘧啶。在一些实施例中,YA位点的至少一个核苷酸被修饰。在一些实施例中,YA位点的嘧啶(也称为“嘧啶位置”)包含修饰(其包括改变嘧啶糖紧接3’的核苷间键合的修饰、嘧啶碱基的修饰和核糖的修饰,例如,在其2’位置)。在一些实施例中,YA位点的腺嘌呤(也称为“腺嘌呤位置”)包含修饰(其包括改变嘧啶糖紧接3’的核苷间键合的修饰、嘧啶碱基的修饰和核糖的修饰,例如,在其2’位置)。在一些实施例中,YA位点的嘧啶和腺嘌呤包含修饰。在一些实施例中,YA修饰降低RNA内切酶活性。
在一些实施例中,sgRNA包含1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16或更多YA位点处的修饰。在一些实施例中,YA位点的嘧啶包含修饰(其包括改变嘧啶糖紧接3’的核苷间键合的修饰)。在一些实施例中,YA位点的腺嘌呤包含修饰(其包括改变腺嘌呤糖紧接3’的核苷间键合的修饰)。在一些实施例中,YA位点的嘧啶和腺嘌呤包含修饰,例如糖、碱或核苷间键合修饰。YA修饰可以是本文所述的任何类型的修饰。在一些实施例中,YA修饰包含硫代磷酸酯、2’-OMe或2’-氟中的一种或多种。在一些实施例中,YA修饰包含有包含硫代磷酸酯、2’-OMe或2’-氟中的一种或多种的嘧啶修饰。在一些实施例中,YA修饰包含在含有一个或多个YA位点的RNA双链体区内的双环核糖类似物(例如,LNA、BNA或ENA)。在一些实施例中,YA修饰包含在含有YA位点的RNA双链体区内的双环核糖类似物(例如,LNA、BNA或ENA),其中YA修饰位于YA位点的远端。
在一些实施例中,sgRNA包含引导区YA位点修饰。在一些实施例中,引导区包含有可包含YA修饰的1、2、3、4、5或更多个YA位点(“引导区YA位点”)。在一些实施例中,位于5’终端的5’末端的5末端、6末端、7末端、8末端、9末端或10末端(其中“5末端”等指距引导区3’末端的5位,即引导区中的最3’核苷酸)的一个或多个YA位点包含YA修饰。在一些实施例中,位于5’终端的5’末端的5末端、6末端、7末端、8末端、9-末端或10末端的两个或更多个YA位点包含YA修饰。在一些实施例中,位于5’终端的5’末端的5末端、6末端、7末端、8末端、9末端或10末端的三个或更多个YA位点包含YA修饰。在一些实施例中,位于5’终端的5’末端的5末端、6末端、7末端、8末端、9末端或10末端的四个或更多个YA位点包含YA修饰。在一些实施例中,位于5’终端的5’末端的5末端、6末端、7末端、8末端、9末端或10末端的五个或更多个YA位点包含YA修饰。经修饰的引导区YA位点包含YA修饰。
在一些实施例中,经修饰的引导区YA位点位于引导区3’终端核苷酸的17、16、15、14、13、12、11、10或9个核苷酸之内。例如,如果经修饰的引导区YA位点位于引导区3’终端核苷酸的10个核苷酸之内,且引导区为20个核苷酸长,则经修饰的引导区YA位点的经修饰的核苷酸位于位置11-20中的任何一个处。在一些实施例中,YA修饰位于距引导区3’终端核苷酸为20,19,18,17,16,15,14,13,12,11,10,9,8,7,6,5,4,3,2或1个核苷酸的YA位点内。在一些实施例中,YA修饰位于距引导区3’终端核苷酸为20,19,18,17,16,15,14,13,12,11,10,9,8,7,6,5,4,3,2或1个核苷酸处。
在一些实施例中,经修饰的引导区YA位点位于5’终端的5’末端的核苷酸4、5、6、7、8、9、10或11处或之后。
在一些实施例中,经修饰的引导区YA位点不同于5’末端修饰。例如,sgRNA可以包含本文所述的5’末端修饰,并且进一步包含经修饰的引导区YA位点。可选地,sgRNA可以包含未修饰的5’末端和经修饰的引导区YA位点。可选地,sgRNA可以包含经修饰的5’末端和未修饰的引导区YA位点。
在一些实施例中,经修饰的引导区YA位点包含位于引导区YA位点5’的至少一个核苷酸不包含的修饰。例如,如果核苷酸1-3包含硫代磷酸酯,核苷酸4仅包含2’-OMe修饰,而核苷酸5是YA位点的嘧啶并且包含硫代磷酸酯,则经修饰的引导区YA位点包含位于引导区YA位点5’的至少一个核苷酸(核苷酸4)不包含的修饰(硫代磷酸酯)。在另一个实例中,如果核苷酸1-3包含硫代磷酸酯,并且核苷酸4是YA位点的嘧啶并包含2’-OMe,则经修饰的引导区YA位点包含位于引导区YA位点5’的至少一个核苷酸(核苷酸1-3中的任何一个)不包含的修饰(2’-OMe)。如果未修饰的核苷酸位于经修饰的引导区YA位点的5’处,也总是满足这一条件。
在一些实施例中,经修饰的引导区YA位点包含如上文针对YA位点所描述的修饰。
引导区YA位点修饰的其他实施例在以上发明内容中进行阐述。本公开中其他地方阐述的任何实施例可以在可行的程度上与任何前述实施例相结合。
在一些实施例中,sgRNA包含保守区YA位点修饰。保守区YA位点1-10如图10所示。在一些实施例中,1,2,3,4,5,6,7,8,9或10个保守区YA位点包含修饰。
在一些实施例中,保守区YA位点1、8或1和8包含YA修饰。在一些实施例中,保守区YA位点1、2、3、4和10包含YA修饰。在一些实施例中,YA位点2、3、4、8和10包含YA修饰。在一些实施例中,保守区YA位点1、2、3和10包含YA修饰。在一些实施例中,YA位点2、3、8和10包含YA修饰。在一些实施例中,YA位点1、2、3、4、8和10包含YA修饰。在一些实施例中,1,2,3,4,5,6,7或8个额外保守区YA位点包含YA修饰。
在一些实施例中,保守区YA位点2、3、4和10中的1、2、3或4个包含YA修饰。在一些实施例中,1,2,3,4,5,6,7或8个额外保守区YA位点包含YA修饰。
在一些实施例中,经修饰的保守区YA位点包含如上文针对YA位点所描述的修饰。
保守区YA位点修饰的其他实施例在以上发明内容中进行阐述。本公开中其他地方阐述的任何实施例可以在可行的程度上与任何前述实施例相结合。
在一些实施例中,sgRNA包含上文表2或下文表3中所示的任何修饰模式,其中N(如果存在)是任何天然或非天然核苷酸,并且其中N的全体包含如本文表1中所述的LDHA引导序列。表3未描绘sgRNA的引导序列部分。尽管用N取代引导物的核苷酸,修饰仍如表3所示。也就是说,尽管引导物的核苷酸取代“N”,但对核苷酸的修饰如表3所示。当引导序列被附加到5’末端时,引导序列的5’末端(或5’终端)可以被修饰。在一些实施例中,修饰包含2’-O-Me和/或PS键。在一些实施例中,2’-O-Me和/或PS键位于引导序列的5’末端的前1至7个、1至6个、1至5个、1至4个或1至3个核苷酸处。
表3:LDHA sgRNA修饰模式。引导序列未显示并且将在其5’末端附加所示序列。
在一些实施例中,经修饰的sgRNA包含以下序列:mN*mN*mN*NNNNNNNNNNNNNNNNNGUUUUAGAmGmCmUmAmGmAmAmAmUmAmGmCAAGUUAAAAUAAGGCUAGUCCGUUAUCAmAmCmUmUmGmAmAmAmAmAmGmUmGmGmCmAmCmCmGmAmGmUmCmGmGmUmGmCmU*mU*mU*mU(SEQ ID NO:300),其中“N”可以是任何天然或非天然核苷酸,并且其中N的总体包含如表1中所描述的LDHA引导序列。例如,本文囊括的是SEQ ID NO:300,其中N被本文表1中公开的任何引导序列(SEQ ID NO:1-84)取代。
下文所述的任何修饰可能存在于本文所述的gRNA和mRNA中。
术语“mA”、“mC”、“mU”或“mG”可用于表示经2’-O-Me修饰的核苷酸。
2’-O-甲基的修饰可描绘如下:
另一种已被证明会影响核苷酸糖环的化学修饰是卤素取代。例如,核苷酸糖环上的2’-氟(2’-F)取代可以增加寡核苷酸结合亲和力和核酸酶稳定性。
在本申请中,术语“fA”、“fC”、“fU”或“fG”可用于表示已被2’-F取代的核苷酸。
2’-F的取代可描绘如下:
硫代磷酸酯(PS)键合或键是指在磷酸二酯键合中,例如在核苷酸碱基之间的键中,硫取代一个非桥接磷酸氧的键。当使用硫代磷酸酯生成寡核苷酸时,经修饰的寡核苷酸也可称为S-寡核苷酸。
“*”可用于描绘PS修饰。在本申请中,术语A*、C*、U*或G*可用于表示利用PS键与下一个(例如,3’)核苷酸连接的核苷酸。
在本申请中,术语“mA*、“mC*、“mU*”或“mG*”可用于表示已被2’-O-Me取代并利用PS键与下一个(例如3’)核苷酸连接的核苷酸。
下图显示S-取代为非桥接磷酸氧,从而生成PS键代替磷酸二酯键:
脱碱基核苷酸是指那些缺乏含氮碱基的核苷酸。下图描绘具有缺乏碱基的脱碱基(也称为无嘌呤)位点的寡核苷酸。
反向碱基是指具有相对于正常5’至3’键合反向的键合的碱基(即5’至5’键合或3’至3’键合)。例如:
脱碱基核苷酸可以与反向键合附着。例如,脱碱基核苷酸可以通过5’至5’键合附着至终端5’核苷酸,或者脱碱基核苷酸可以通过3’至3’键合附着至终端3’核苷酸。终端5’或3’核苷酸上的反向脱碱基核苷酸也可称为反向脱碱基端帽。
在一些实施例中,5’终端的前三个、四个或五个核苷酸中的一个或多个,以及3’终端的最后三个、四个或五个核苷酸中的一个或多个被修饰。在一些实施例中,修饰是2’-O-Me、2’-F、反向脱碱基核苷酸、PS键、或本领域众所周知的其他核苷酸修饰,以增加稳定性和/或性能。
在一些实施例中,5’终端的前四个核苷酸和3’终端的最后四个核苷酸与硫代磷酸酯(PS)键连接。
在一些实施例中,5’终端的前三个核苷酸和3’终端的最后三个核苷酸包含2’-O-甲基(2’-O-Me)修饰的核苷酸。在一些实施例中,5’终端的前三个核苷酸和3’终端的最后三个核苷酸包含2’-氟(2’-F)修饰的核苷酸。在一些实施例中,5’终端的前三个核苷酸和3’终端的最后三个核苷酸包含反向脱碱基核苷酸。
在一些实施例中,引导RNA包含经修饰的sgRNA。在一些实施例中,sgRNA包含SEQID No:201、202或203中所示的修饰模式,其中N是任何天然或非天然核苷酸,并且其中N的全部包含将核酸酶引向LDHA中的靶序列的引导序列,例如,如表1所示。
在一些实施例中,引导RNA包含SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081中的任一个所示的sgRNA或者其经修饰的版本,如例如SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。在一些实施例中,引导RNA包含sgRNA,所述sgRNA包含SEQ ID No:1-84和100-192的引导序列中的任一个以及SEQ ID No:201、202或203的核苷酸,其中SEQ ID No:201、202或203的核苷酸位于引导序列的3’末端上,并且其中所述sgRNA可以如表3或SEQ ID NO:300所示被修饰。
如上所述,在一些实施例中,本文公开的组合物或制剂包含mRNA,所述mRNA包含编码RNA引导的DNA结合剂(例如本文所述的Cas核酸酶)的开放阅读框(ORF)。在一些实施例中,提供、使用或施用包含编码RNA引导的DNA结合剂(例如Cas核酸酶)的ORF的mRNA。在一些实施例中,编码RNA引导的DNA核酸酶的ORF是“经修饰的RNA引导的DNA结合剂ORF”或简单地是“经修饰的ORF”,其被用作指示ORF被修饰的简写。
在一些实施例中,经修饰的ORF可以在至少一个、多个或所有尿苷位置包含经修饰的尿苷。在一些实施例中,经修饰的尿苷是在5位修饰的尿苷,例如,以卤素、甲基或乙基修饰。在一些实施例中,经修饰的尿苷是在1位修饰的假尿苷,例如,以卤素、甲基或乙基修饰。经修饰的尿苷可以是例如假尿苷、N1-甲基-假尿苷、5-甲氧尿苷、5-碘尿苷或其组合。在一些实施例中,经修饰的尿苷是5-甲氧尿苷。在一些实施例中,经修饰的尿苷是5-碘尿苷。在一些实施例中,经修饰的尿苷是假尿苷。在一些实施例中,经修饰的尿苷是N1-甲基-假尿苷。在一些实施例中,经修饰的尿苷是假尿苷和N1-甲基-假尿苷的组合。在一些实施例中,经修饰的尿苷是假尿苷和5-甲氧尿苷的组合。在一些实施例中,经修饰的尿苷是N1-甲基假尿苷和5-甲氧尿苷的组合。在一些实施例中,经修饰的尿苷是5-碘尿苷和N1-甲基-假尿苷的组合。在一些实施例中,经修饰的尿苷是假尿苷和5-碘尿苷的组合。在一些实施例中,经修饰的尿苷是5-碘尿苷和5-甲氧尿苷的组合。
在一些实施例中,本文公开的mRNA包含5’帽,例如Cap0、Cap1或Cap2。5’帽通常是通过5’-三磷酸酯连接到mRNA的5’至3’链的第一核苷酸的5’位置,即,第一个帽近端核苷酸的7-甲基鸟嘌呤核糖核苷酸(其可以进一步修饰,如下所述,例如关于ARCA)。在Cap0中,mRNA的第一和第二帽近端核苷酸的核糖都包含2’-羟基。在Cap1中,mRNA的第一和第二转录核苷酸的核糖分别包含2’-甲氧基和2’-羟基。在Cap2中,mRNA的第一和第二帽近端核苷酸的核糖都包含2’-甲氧基。参见例如Katibah等人(2014)《美国科学院院报(Proc Natl AcadSci USA)》111(33):12025-30;Abbas等人.(2017)《美国科学院院报》114(11):E2106-E2115。大多数内源性高等真核mRNA,包括哺乳动物mRNA,例如人mRNA,均包含Cap1或Cap2。Cap0和与Cap1和Cap2不同的其他帽结构在哺乳动物(例如人)中可能具有免疫原性,这是由于先天免疫系统的组分(例如IFIT-1和IFIT-5)将其识别为“非自身”,这可能导致包括I型干扰素在内细胞因子水平升高。先天免疫系统的组分例如IFIT-1和IFIT-5,也可能与eIF4E竞争mRNA与帽(Cap1或Cap2除外)的结合,从而潜在地抑制mRNA的翻译。
帽可以共转录地包括在内。例如,ARCA(抗逆转帽类似物;赛默飞世尔科技(ThermoFisher Scientific)类别号AM8045)是帽类似物,其包含与鸟嘌呤核糖核苷酸的5’位连接的7-甲基鸟嘌呤3’-甲氧基-5’-三磷酸酯,其在体外启动时可掺入转录物中。ARCA导致Cap0帽,其中第一帽近端核苷酸的2’位是羟基。参见例如Stepinski等人,(2001)“含新型‘抗逆转’帽类似物7-甲基(3’-O-甲基)GpppG和7-甲基(3’-脱氧)GpppG的mRNA的合成和性质(Synthesis and properties of mRNAs containing the novel‘anti-reverse’capanalogs 7-methyl(3’-O-methyl)GpppG and 7-methyl(3’deoxy)GpppG),”RNA 7:1486–1495。ARCA的结构如下所示。
CleanCap
可选地,可以在转录后将帽添加到RNA中。例如,牛痘苗加帽酶是市售的(新英格兰生物实验室(New England Biolabs)类别号M2080S),并且具有由其D1亚单位提供的RNA三磷酸酶和鸟苷酸转移酶活性以及由其D12亚单位提供的鸟嘌呤甲基转移酶活性。因此,在存在S-腺苷基甲硫氨酸和GTP的情况下,可以将7-甲基鸟嘌呤添加到RNA中,从而得到Cap0。参见例如Guo,P.和Moss,B.(1990)《美国科学院院报》87,4023-4027;Mao,X.和Shuman,S.(1994)《生物化学杂志(J.Biol.Chem.)》269,24472-24479。
在一些实施例中,mRNA进一步包含聚腺苷酸化(聚-A)尾。在一些实施例中,聚-A尾包含至少20,30,40,50,60,70,80,90或100个腺嘌呤,任选地至多300个腺嘌呤。在一些实施例中,聚-A尾包含95,96,97,98,99或100个腺嘌呤核苷酸。
D.核糖核蛋白复合物
在一些实施例中,囊括一种组合物,所述组合物包含有包含表1中的一个或多个引导序列或表2中的一个或多个sgRNA的一个或多个gRNA和RNA引导的DNA结合剂,例如核酸酶,例如Cas核酸酶,例如Cas9。在一些实施例中,RNA引导的DNA结合剂具有裂解酶活性,这也可以称为双链核酸内切酶活性。在一些实施例中,RNA引导的DNA结合剂包含Cas核酸酶。Cas9核酸酶的实例包括酿脓链球菌、金黄色葡萄球菌和其他原核生物(参见例如下一段中的列表)的II型CRISPR系统的那些以及其经修饰的(例如工程化或突变)版本。参见例如US2016/0312198 A1;US 2016/0312199 A1。Cas核酸酶的其他实例包括III型CRISPR系统的Csm或Cmr复合物或其Cas10、Csm1或Cmr2亚单位;和I型CRISPR系统的级联复合物或其Cas3亚单位。在一些实施例中,Cas核酸酶可以来自IIA型、IIB型或IIC型系统。关于各种CRISPR系统和Cas核酸酶的讨论,参见,例如,Makarova等人,《自然微生物学综述(Nat.Rev.Microbiol.)》9:467-477(2011);Makarova等人,《自然微生物学综述》,13:722-36(2015);Shmakov等人,《分子细胞》,60:385-397(2015)。
Cas核酸酶可来源的非限制性示例性物种包括酿脓链球菌、嗜热链球菌、链球菌属、金黄色葡萄球菌、无害利斯特菌、加氏乳杆菌、新凶手弗朗西丝菌、产琥珀酸沃廉菌、华德萨特菌、伽马变形杆菌、脑膜炎奈瑟氏球菌、空肠弯曲杆菌、多杀性巴氏杆菌、琥珀酸丝状杆菌、深红红螺菌、达松维尔拟诺卡氏菌、始旋链霉菌、绿产色链霉菌、绿产色链霉菌、玫瑰链孢囊菌、玫瑰链孢囊菌、酸热脂环酸杆菌、假蕈状芽孢杆菌、硒还原芽孢杆菌、西伯利亚微小杆菌、德氏乳酸杆菌、唾液乳杆菌、布氏乳杆菌、齿垢密螺旋体、海洋微颤菌、伯克霍尔德菌细菌、萘降解极单胞菌、单胞菌属、瓦氏鳄球藻、蓝杆藻属、铜绿微囊藻、聚球藻属、阿拉伯糖醋盐杆菌、丹氏制氨菌、热解纤维素菌、脱硫菌候选种、肉毒杆菌、艰难梭菌、大芬戈尔德菌、嗜热钠杆菌、丙酸互营细菌、喜温嗜酸硫杆菌、嗜酸氧化亚铁硫杆菌、酒色着色菌、海洋杆菌属、嗜盐亚硝化球菌、瓦氏亚硝化球菌、假交替单胞菌、消旋纤线杆菌、调查甲烷盐菌、多变鱼腥藻、泡沫节球藻、念珠藻属、极大节旋藻、钝顶节旋藻、节螺藻属、林氏藻属、原型微鞘藻、颤藻属、运动石袍菌、非洲栖热腔菌、巴氏链球菌、灰色奈瑟氏球菌、红嘴鸥弯曲杆菌、食清洁剂细小棒菌、白喉棒状杆菌、氨基酸球菌属、毛螺旋菌科细菌ND2006和海洋无核氯菌。
在一些实施例中,Cas核酸酶是来自酿脓链球菌的Cas9核酸酶。在一些实施例中,Cas核酸酶是来自嗜热链球菌的Cas9核酸酶。在一些实施例中,Cas核酸酶是来自脑膜炎奈瑟菌的Cas9核酸酶。在一些实施例中,Cas核酸酶是来自金黄色葡萄球菌的Cas9核酸酶。在一些实施例中,Cas核酸酶是来自新凶手弗朗西丝氏菌的Cpf1核酸酶。在一些实施例中,Cas核酸酶是来自氨基酸球菌属的Cpf1核酸酶。在一些实施例中,Cas核酸酶是来自毛螺科菌细菌ND2006的Cpf1核酸酶。在进一步的实施例中,Cas核酸酶是来自土拉弗朗西斯菌、毛螺科菌细菌、解蛋白丁酸弧菌、异域菌门菌、帕库氏菌、史密斯氏菌、氨基酸球菌、候选白蚁甲烷支原体、挑剔真杆菌、牛眼莫拉氏菌、稻田钩端螺旋体、狗口腔卟啉单胞菌、解糖胨普雷沃菌或猕猴卟啉单胞菌的Cpf1核酸酶。在某些实施例中,Cas核酸酶是来自氨基酸球菌属或毛螺菌科的Cpf1核酸酶。
在一些实施例中,gRNA与RNA引导的DNA结合剂一起被称为核糖核蛋白复合物(RNP)。在一些实施例中,RNA引导的DNA结合剂是Cas核酸酶。在一些实施例中,gRNA与Cas核酸酶一起被称为Cas RNP。在一些实施例中,RNP包含I型、II型或III型组分。在一些实施例中,Cas核酸酶是来自II型CRISPR/Cas系统的Cas9蛋白。在一些实施例中,gRNA与Cas9一起被称为Cas9 RNP。
野生型Cas9具有两个核酸酶结构域:RuvC和HNH。RuvC结构域切割非靶DNA链,而HNH结构域切割DNA的靶链。在一些实施例中,Cas9蛋白包含多于一个RuvC结构域和/或多于一个NH结构域。在一些实施例中,Cas9蛋白是野生型Cas9。在每一组合物、用途和方法实施例中,Cas诱导靶DNA中的双链断裂。
在一些实施例中,使用嵌合Cas核酸酶,其中蛋白质的一个结构域或区被不同蛋白质的一部分取代。在一些实施例中,Cas核酸酶结构域可以被来自不同核酸酶例如Fok1的结构域取代。在一些实施例中,Cas核酸酶可以是经修饰的核酸酶。
在其他实施例中,Cas核酸酶可以来自I型CRISPR/Cas系统。在一些实施例中,Cas核酸酶可以是I型CRISPR/Cas系统的级联复合物的组分。在一些实施例中,Cas核酸酶可以是Cas3蛋白。在一些实施例中,Cas核酸酶可以来自I型CRISPR/Cas系统。在一些实施例中,Cas核酸酶可以具有RNA切割活性。
在一些实施例中,RNA引导的DNA结合剂具有单链切口酶活性,即可以切断一条DNA链,以产生单链断裂,也称为“切口”。在一些实施例中,RNA引导的DNA结合剂包含Cas切口酶。切口酶是在dsDNA中产生切口,即切断DNA双螺旋的一条链,但不切断另一条链的酶。在一些实施例中,Cas切口酶是Cas核酸酶的一种版本(例如,上述Cas核酸酶),其中内切核苷酸活性位点被失活,例如,通过催化结构域中的一个或多个改变(例如,点突变)。参见例如美国专利第8,889,356号对Cas切口酶和示例性催化结构域改变的讨论。在一些实施例中,Cas切口酶例如Cas9切口酶具有失活的RuvC或HNH结构域。
在一些实施例中,RNA引导的DNA结合剂被修饰以仅包含一个功能性核酸酶结构域。例如,可以修饰试剂蛋白,使得核酸酶结构域之一突变或完全或部分缺失,以降低其核酸切割活性。在一些实施例中,使用具有活性降低的RuvC结构域的切口酶。在一些实施例中,使用具有非活性RuvC结构域的切口酶。在一些实施例中,使用具有活性降低的HNH结构域的切口酶。在一些实施例中,使用具有非活性HNH结构域的切口酶。
在一些实施例中,Cas蛋白核酸酶结构域内的保守氨基酸被取代以降低或改变核酸酶活性。在一些实施例中,Cas核酸酶可以在RuvC或RuvC样核酸酶结构域中包含氨基酸取代。RuvC或RuvC样核酸酶结构域中的示例性氨基酸取代包括D10A(基于酿脓链球菌Cas9蛋白)。参见例如Zetsche等人(2015)《细胞》Oct 22:163(3):759-771。在一些实施例中,Cas核酸酶可以在HNH或HNH样核酸酶结构域中包含氨基酸取代。HNH或HNH样核酸酶结构域中的示例性氨基酸取代包括E762A、H840A、N863A、H983A和D986A(基于酿脓链球菌Cas9蛋白)。参见例如Zetsche等人(2015)。进一步的示例性氨基酸取代包括D917A、E1006A和D1255A(基于新凶手弗朗西丝氏菌U112 Cpf1(FnCpf1)序列(UniProtKB-A0Q7Q2(CPF1_FRATN))。
在一些实施例中,编码切口酶的mRNA与分别与靶序列的有义和反义链互补的一对引导RNA组合提供。在本实施例中,引导RNA将切口酶引向靶序列并通过在靶序列的相对链上产生切口(即,双刻痕)而引入DSB。在一些实施例中,使用双刻痕可提高特异性并减少脱靶效应。在一些实施例中,将一种切口酶与靶向DNA的相对链的两个分离的引导RNA一起使用,以在靶DNA中产生双切口。在一些实施例中,切口酶与两个分离的引导RNA一起使用,这两个引导RNA被选择为非常接近,以在靶DNA中产生双切口。
在一些实施例中,RNA引导的DNA结合剂缺乏裂解酶和切口酶活性。在一些实施例中,RNA引导的DNA结合剂包含dCas DNA结合多肽。dCas多肽具有DNA结合活性,但基本上缺乏催化(裂解酶/切口酶)活性。在一些实施例中,dCas多肽是dCas9多肽。在一些实施例中,缺乏裂解酶和切口酶活性的RNA引导的DNA结合剂或dCas DNA结合多肽是Cas核酸酶的一种版本(例如,上述Cas核酸酶),其中其内切核苷酸活性位点被失活,例如,通过其催化结构域中的一个或多个改变(例如,点突变)。参见例如US 2014/0186958 A1;US 2015/0166980A1。
在一些实施例中,RNA引导的DNA结合剂包含一个或多个异源功能结构域(例如,是或包含融合多肽)。
在一些实施例中,异源功能结构域可以促进RNA引导的DNA结合剂转运到细胞核中。例如,异源功能结构域可以是核定位信号(NLS)。在一些实施例中,RNA引导的DNA结合剂可以与1-10个NLS融合。在一些实施例中,RNA引导的DNA结合剂可以与1-5个NLS融合。在一些实施例中,RNA引导的DNA结合剂可以与一个NLS融合。当使用一个NLS时,NLS可能在RNA引导的DNA结合剂序列的N-终端或C-终端连接。它也可以插入到RNA引导的DNA结合剂序列中。在其他实施例中,RNA引导的DNA结合剂可以与多于一个NLS融合。在一些实施例中,RNA引导的DNA结合剂可以与2、3、4或5个NLS融合。在一些实施例中,RNA引导的DNA结合剂可以与两个NLS融合。在某些情况下,两个NLS可能相同(例如,两个SV40 NLS)或不同。在一些实施例中,RNA引导的DNA结合剂与在羧基终端连接的两个SV40 NLS序列融合。在一些实施例中,RNA引导的DNA结合剂可以与两个NLS融合,一个在N-终端连接,一个在C-终端连接。在一些实施例中,RNA引导的DNA结合剂可以与3个NLS融合。在一些实施例中,RNA引导的DNA结合剂可以不与任何NLS融合。在一些实施例中,NLS可以是单部分序列,例如SV40NLS,PKKKRKV(SEQ ID NO:600)或PKKKRRV(SEQ ID NO:601)。在一些实施例中,NLS可以是二分序列,例如核浆素的NLS,KRPAATKKAGQAKKKK(SEQ ID NO:602)。在具体的实施例中,单个PKKKRKV(SEQID NO:600)NLS可以在RNA引导的DNA结合剂的C-终端连接。一个或多个连接基任选地包括在融合位点。
在一些实施例中,异源功能结构域可以能够修饰RNA引导的DNA结合剂的细胞内半衰期。在一些实施例中,可以增加RNA引导的DNA结合剂的半衰期。在一些实施例中,可以减小RNA引导的DNA结合剂的半衰期。在一些实施例中,异源功能结构域可以能够增加RNA引导的DNA结合剂的稳定性。在一些实施例中,异源功能结构域可以能够降低RNA引导的DNA结合剂的稳定性。在一些实施例中,异源功能结构域可以作为蛋白质降解的信号肽。在一些实施例中,蛋白质降解可由蛋白水解酶介导,例如蛋白酶体、溶酶体蛋白酶或钙蛋白酶。在一些实施例中,异源功能结构域可以包含PEST序列。在一些实施例中,可以通过添加泛素或聚泛素链来修饰RNA引导的DNA结合剂。在一些实施例中,泛素可以是泛素样蛋白(UBL)。泛素样蛋白的非限制性实例包括小泛素样修饰物(SUMO)、泛素交叉反应蛋白(UCRP,也称为干扰素刺激基因-15(ISG15))、泛素相关修饰物-1(URM1)、神经元前体细胞表达的发育下调蛋白-8(NEDD8,在酿酒酵母中也称为Rub1)、人白细胞抗原F相关(FAT10)、自噬-8(ATG8)和-12(ATG12)、Fau泛素样蛋白(FUB1)、膜锚定UBL(MUB)、泛素折叠修饰物-1(UFM1)和泛素样蛋白-5(UBL5)。
在一些实施例中,异源功能结构域可以是标记结构域。标记结构域的非限制性实例包括荧光蛋白、纯化标签、表位标签和报告基因序列。在一些实施例中,标记结构域可以是荧光蛋白。合适的荧光蛋白的非限制性实例包括绿色荧光蛋白(例如,GFP、GFP-2、tagGFP、turboGFP、sfGFP、EGFP、祖母绿、Azami绿、单体Azami绿、CopGFP、AceGFP、ZsGreen1)、黄色荧光蛋白(例如,YFP、EYFP、柠檬黄、Venus、YPet、PhiYFP、ZsYellow1)、蓝色荧光蛋白(例如,EBFP、EBFP2、石青、mKalamal、GFPuv、宝石蓝、T-宝石蓝)、青色荧光蛋白(例如,ECFP、天蓝色、CyPet、AmCyan1、Midoriishi-Cyan)、红色荧光蛋白(例如,mKate、mKate2、mPlum、DsRed单体、mCherry、mRFP1、DsRed-Express、DsRed2、DsRed单体、HcRed-Tandem、HcRed1、AsRed2、eqFP611、mRasberry、mStrawberry、Jred)和橙色荧光蛋白(mOrange、mKO、Kusabira橙、Monomeric Kusabira橙、mTangerine、tdTomato)或任何其他合适的荧光蛋白。在其他实施例中,标记结构域可以是纯化标签和/或表位标签。非限制性示例性标签包括谷胱甘肽-S-转移酶(GST)、几丁质结合蛋白(CBP)、麦芽糖结合蛋白(MBP)、硫氧还蛋白(TRX)、聚(NANP)、串联亲和纯化(TAP)标签、myc、AcV5、AU1、AU5、E、ECS、E2、FLAG、HA、nus、Softag1、Softag 3、Strep、SBP、Glu-Glu、HSV、KT3、S、S1、T7、V5、VSV-G、6xHis、8xHis、生物素羧基载体蛋白(BCCP)、聚组氨酸和钙调蛋白。非限制性示例性报告基因包括谷胱甘肽-S-转移酶(GST)、辣根过氧化物酶(HRP)、氯霉素乙酰转移酶(CAT)、β-半乳糖苷酶、β-葡萄糖醛酸酶、荧光素酶或荧光蛋白。
在另外的实施例中,异源功能结构域可以将RNA引导的DNA结合剂靶向特定的细胞器、细胞类型、组织或器官。在一些实施例中,异源功能结构域可以将RNA引导的DNA结合剂靶向线粒体。
在进一步的实施例中,异源功能结构域可以是效应子结构域。当RNA引导的DNA结合剂被引向其靶序列时,例如,当Cas核酸酶通过gRNA被引向靶序列时,效应子结构域可以修饰或影响靶序列。在一些实施例中,效应子结构域可以选自核酸结合结构域、核酸酶结构域(例如,非Cas核酸酶结构域)、表观遗传修饰结构域、转录激活结构域或转录阻遏物结构域。在一些实施例中,异源功能结构域是核酸酶,例如FokI核酸酶。参见例如美国专利第9,023,649号。在一些实施例中,异源功能结构域是转录激活子或阻遏物。参见例如Qi等人,“将CRISPR重新定位为用于基因表达的序列特异性控制的RNA引导的平台(RepurposingCRISPR as an RNA-guided platform for sequence-specific control of geneexpression),”《细胞》152:1173-83(2013);Perez-Pinera等人,“基于CRISPR-Cas9转录因子的RNA引导的基因激活(RNA-guided gene activation by CRISPR-Cas9-basedtranscription factors),”《自然方法(Nat.Methods)》10:973-6(2013);Mali等人,“用于靶特异性筛选的CAS9转录激活因子和用于合作基因组工程的成对切口酶(CAS9transcriptional activators for target specificity screening and pairednickases for cooperative genome engineering),”《自然生物技术(Nat.Biotechnol.)》31:833-8(2013);Gilbert等人,“CRISPR介导的真核生物中模块化RNA引导的转录调节(CRISPR-mediated modular RNA-guided regulation of transcription ineukaryotes),”《细胞》154:442-51(2013)。因此,RNA引导的DNA结合剂实质上变成可以被指引成使用引导RNA结合所需靶序列的转录因子。
E.gRNA的功效确定
在一些实施例中,当与形成RNP的其他组分一起递送或表达时,确定gRNA的功效。在一些实施例中,gRNA与RNA引导的DNA结合剂例如Cas蛋白(例如,Cas9)一起表达。在一些实施例中,gRNA被递送至已经稳定表达RNA引导的DNA核酸酶例如Cas核酸酶或切口酶(例如,Cas9核酸酶或切口酶)的细胞系或在所述细胞系中表达。在一些实施例中,gRNA被递送到作为RNP的一部分的细胞。在一些实施例中,gRNA连同编码RNA引导的DNA核酸酶例如Cas核酸酶或切口酶(例如Cas9核酸酶或切口酶)的mRNA被递送至细胞。
如本文所述,使用本文公开的RNA引导的DNA核酸酶和引导RNA可导致DNA中的双链断裂,所述双链断裂可在通过细胞机制修复时以插入/缺失(插入缺失)突变的形式产生错误。许多因插入缺失引起的突变会改变阅读框或引入过早终止密码子,并且因此产生非功能性蛋白质。
在一些实施例中,基于体外模型确定特定gRNA的功效。在一些实施例中,体外模型是稳定表达Cas9的HEK293细胞(HEK293_Cas9)。在一些实施例中,体外模型是HUH7人肝癌细胞。在一些实施例中,体外模型是HepG2细胞。在一些实施例中,体外模型是原代人肝细胞。在一些实施例中,体外模型是原代食蟹猴肝细胞。关于使用原代人肝细胞,市售的原代人肝细胞可用于在实验之间提供更大的一致性。在一些实施例中,确定在体外模型中(例如在原代人肝细胞中)发生缺失或插入的脱靶位点的数目,例如通过分析体外转染Cas9 mRNA和引导RNA的原代人肝细胞的基因组DNA。在一些实施例中,此类确定包含分析来自体外转染Cas9 mRNA、引导RNA和供体寡核苷酸的原代人肝细胞的基因组DNA。以下工作实例中提供此类确定的示例性程序。
在一些实施例中,跨用于gRNA选择过程的多个体外细胞模型确定特定gRNA的功效。在一些实施例中,进行数据与选定gRNA的细胞系比较。在一些实施例中,在多个细胞模型中进行交叉筛选。
在一些实施例中,基于体内模型确定特定gRNA的功效。在一些实施例中,体内模型是啮齿动物模型。在一些实施例中,啮齿动物模型是表达LDHA基因的小鼠。在一些实施例中,啮齿动物模型是表达人LDHA基因的小鼠。在一些实施例中,体内模型是非人类灵长类动物,例如食蟹猴。
在一些实施例中,引导RNA的功效通过LDHA的编辑百分比来测量。在一些实施例中,将LDHA的编辑百分比与实现LDHA蛋白敲除所需的编辑百分比进行比较,例如在体外模型的情况下来自全细胞裂解物,或者在体内模型的情况下来自组织。
在一些实施例中,通过靶细胞类型的基因组内脱靶序列处的插入缺失的数量和/或频率来测量引导RNA的功效。在一些实施例中,提供有效的引导RNA,其以细胞群中和/或相对于靶位点插入缺失产生的频率非常低的频率(例如,<5%)在脱靶位点产生插入缺失。因此,本公开提供在靶细胞类型(例如,肝细胞)中不表现出脱靶插入缺失形成的引导RNA,或其在细胞群中和/或相对于靶位点处插入缺失产生频率产生<5%的脱靶插入缺失形成频率。在一些实施例中,本公开提供在靶细胞类型(例如,肝细胞)中不表现出任何脱靶插入缺失形成的引导RNA。在一些实施例中,提供在少于5个脱靶位点产生插入缺失的引导RNA,例如,通过本文所述的一种或多种方法评价的。在一些实施例中,提供在少于或等于4、3、2或1个脱靶位点产生插入缺失的引导RNA,例如,通过本文所述的一种或多种方法评价的。在一些实施例中,脱靶位点不出现在靶细胞(例如,肝细胞)基因组中的蛋白质编码区中。
在一些实施例中,利用以带标签引物的线性扩增检测基因编辑事件,例如靶DNA中插入/缺失(“插入缺失”)突变的形成和同源性定向修复(HDR)事件,并且分离带标签的扩增产物(以下称为“LAM-PCR”,或“线性扩增(LA)”方法)。
在一些实施例中,通过测量样品例如体液(例如血清、血浆、血液或尿)中的乙醇酸盐水平和/或草酸盐水平来测量引导RNA的功效。在一些实施例中,通过测量血清或血浆中的乙醇酸盐水平和/或尿中的草酸盐水平来测量引导RNA的功效。血清或血浆中的乙醇酸盐水平升高和/或尿中的草酸盐水平降低表明存在有效的引导RNA。在一些实施例中,尿草酸盐降低至0.7mmol/24hrs/1.73m
III.治疗方法
本文公开的gRNA和相关方法以及组合物可用于诱导LDHA基因内的双链断裂(DSB)和降低LDHA基因的表达。本文公开的gRNA和相关方法以及组合物可用于治疗和预防高草酸尿症和预防高草酸尿症的症状。在一些实施例中,本文公开的gRNA可用于治疗和预防草酸钙产生、器官中的草酸钙沉积、原发性高草酸尿症(包括PH1、PH2和PH3)、草酸过多症(包括全身性草酸过多症)和血尿。在一些实施例中,本文公开的gRNA可用于延迟或改善对肾脏或肝脏移植的需求。在一些实施例中,本文公开的gRNA可用于预防终末期肾脏疾病(ESRD)。施用本文公开的gRNA将增加血清或血浆乙醇酸盐,并减少草酸盐的产生或积聚,从而减少尿中草酸盐的排泄。因此,在一个方面,治疗/预防的有效性可以通过测量血清或血浆乙醇酸盐来评估,其中乙醇酸盐水平的增加指示有效性。在一些实施例中,治疗/预防的有效性可以通过测量样品中的草酸盐,例如尿草酸盐来评估,其中尿草酸盐的减少指示有效性。
健康受试者尿中的正常每日草酸盐排泄量低于约45mg,而每24小时超过约45mg的浓度被视为临床高草酸尿症(参见例如Bhasin等人,《世界肾脏学杂志(World J Nephrol)》2015May 6;4(2):235-244;和Cochat P.,Rumsby G.(2013).《新英格兰医学杂志(N Engl JMed)》369:649-658)。因此,在一些实施例中,施用本文公开的gRNA和组合物可用于降低草酸盐水平,使得受试者不再表现出与临床高草酸尿症相关的尿草酸盐水平。在一些实施例中,施用本文公开的gRNA和组合物在24小时内将受试者的尿草酸盐降低至小于约45或40mg。在一些实施例中,施用本文公开的gRNA和组合物在24小时内将受试者的尿草酸盐降低至小于约35、小于约30、小于约25、小于约20、小于约15或小于约10mg。
在一些实施例中,本文所述的gRNA、组合物或药物制剂中的任何一者或多者用于制备用于治疗或预防受试者疾病或障碍的药物。在一些实施例中,治疗和/或预防是用单剂量完成的,例如,药物/组合物的一次性治疗。在一些实施例中,所述疾病或障碍是高草酸尿症。
在一些实施例中,本发明包含一种治疗或预防受试者中疾病或障碍的方法,所述方法包含施用本文所述的gRNA、组合物或药物制剂中的任何一者或多者。在一些实施例中,所述疾病或障碍是高草酸尿症。在一些实施例中,本文所述的gRNA、组合物或药物制剂例如一次以单剂量施用。在一些实施例中,单剂量实现持久的治疗和/或预防。在一些实施例中,所述方法实现持久的治疗和/或预防。本文所用的持久治疗和/或预防包括持续至少i)3、4、5、6、7、8、9、10、11、12、13、14或15周;ii)1、2、3、4、5、6、7、8、9、10、11、12、18、24、30或36个月;或iii)1、2、3、4、5、6、7、8、9或10年的治疗和/或预防。在一些实施例中,单剂量的本文所述gRNA、组合物或药物制剂足以在受试者的生命持续期间治疗和/或预防本文所述的任何适应症。
在一些实施例中,本发明包含修饰(例如,产生双链断裂)靶DNA的方法或用途,所述靶DNA包含、施用或递送本文所述的gRNA、组合物或药物制剂中的任何一者或多者。在一些实施例中,靶DNA是LDHA基因。在一些实施例中,靶DNA位于LDHA基因的外显子中。在一些实施例中,靶DNA位于LDHA基因的外显子1、2、3、4、5、6、7或8中。
在一些实施例中,本发明包含用于调节靶基因的方法或用途,所述靶基因包含、施用或递送本文所述的gRNA、组合物或药物制剂中的任何一者或多者。在一些实施例中,所述调节是LDHA靶基因的编辑。在一些实施例中,所述调节是由LDHA靶基因编码的蛋白的表达变化。
在一些实施例中,所述方法或用途导致基因编辑。在一些实施例中,所述方法或用途导致靶LDHA基因内的双链断裂。在一些实施例中,所述方法或用途导致在DSB非同源末端连接期间形成插入缺失突变。在一些实施例中,所述方法或用途导致靶LDHA基因中核苷酸的插入或缺失。在一些实施例中,靶LDHA基因中核苷酸的插入或缺失导致移码突变或过早终止密码子,从而导致非功能性蛋白质。在一些实施例中,靶LDHA基因中核苷酸的插入或缺失导致靶基因表达的敲除或消除。在一些实施例中,所述方法或用途包含同源定向修复DSB。
在一些实施例中,所述方法或用途导致LDHA基因调节。在一些实施例中,LDHA基因调节是基因表达的降低。在一些实施例中,所述方法或用途导致靶基因编码的蛋白的表达降低。
在一些实施例中,提供一种诱导LDHA基因内双链断裂(DSB)的方法,包含施用包含引导RNA的组合物,所述引导RNA包含SEQ ID NO:1-84的任何一个或多个引导序列,或SEQID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。在一些实施例中,施用包含SEQ ID NO:1-84和100-192的引导序列中的任何一个或多个的gRNA以诱导LDHA基因中的DSB。引导RNA可以与RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)或编码RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)的mRNA或载体一起施用。
在一些实施例中,提供一种修饰LDHA基因的方法,包含施用包含引导RNA的组合物,所述引导RNA包含SEQ ID NO:1-84的引导序列中的任何一个或多个,或SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。在一些实施例中,施用gRNA以修饰LDHA基因,所述gRNA包含SEQ ID NO:1-84的引导序列中的任何一个或多个,或SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。引导RNA可以与RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)或编码RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)的mRNA或载体一起施用。
在一些实施例中,提供一种治疗或预防高草酸尿症的方法,包含施用包含引导RNA的组合物,所述引导RNA包含SEQ ID NO:1-84的引导序列中的任何一个或多个,或SEQ IDNO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。在一些实施例中,施用gRNA以治疗或预防高草酸尿症,所述gRNA包含SEQ ID NO:1-84的引导序列中的任何一个或多个,或SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。引导RNA可以与RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)或编码RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)的mRNA或载体一起施用。在一些实施例中,高草酸尿症是原发性高草酸尿症。在一些实施例中,原发性高草酸尿症为1型(PH1)、2型(PH2)或3型(PH3)。在一些实施例中,高草酸尿症是特发性的。
在一些实施例中,提供一种减少或消除草酸钙产生和/或沉积的方法,所述方法包含施用引导RNA,所述引导RNA包含SEQ ID NO:1-84的引导序列中的任何一个或多个,或SEQID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。引导RNA可以与RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)或编码RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)的mRNA或载体一起施用。
在一些实施例中,提供一种治疗或预防原发性高草酸尿症(包括PH1、PH2或PH3)的方法,所述方法包含施用引导RNA,所述引导RNA包含SEQ ID NO:1-84的引导序列中的任何一个或多个,或SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。引导RNA可以与RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)或编码RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)的mRNA或载体一起施用。
在一些实施例中,提供一种治疗或预防草酸过多症(包括全身性草酸过多症)的方法,所述方法包含施用引导RNA,所述引导RNA包含SEQ ID NO:1-84的引导序列中的任何一个或多个,或SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。引导RNA可以与RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)或编码RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)的mRNA或载体一起施用。
在一些实施例中,提供一种治疗或预防血尿的方法,所述方法包含施用引导RNA,所述引导RNA包含SEQ ID NO:1-84的引导序列中的任何一个或多个,或SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQ IDNO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。引导RNA可以与RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)或编码RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)的mRNA或载体一起施用。
在一些实施例中,施用gRNA以降低尿中的草酸盐水平,所述gRNA包含SEQ ID NO:1-84和100-192的引导序列中的任何一个或多个,或SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。gRNA可以与RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)或编码RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)的mRNA或载体一起施用。
在一些实施例中,施用gRNA以增加血清或血浆中的血清乙醇酸盐,所述gRNA包含SEQ ID NO:1-84和100-192的引导序列中的任何一个或多个,或SEQ ID NO:1001,1005,1007,1008,1014,1023,1027,1032,1045,1048,1063,1067,1069,1071,1074,1076,1077,1078,1079和1081的sgRNA中的任何一个或多个或其经修饰的版本,如例如SEQ ID NO:2001,2005,2007,2008,2014,2023,2027,2032,2045,2048,2063,2067,2069,2071,2074,2076,2077,2078,2079和2081所示。gRNA可以与RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)或编码RNA引导的DNA核酸酶例如Cas核酸酶(例如,Cas9)的mRNA或载体一起施用。
在一些实施例中,包含表1的引导序列的gRNA与RNA引导的DNA核酸酶例如Cas核酸酶一起诱导DSB,并且修复期间的非同源末端连接(NHEJ)导致LDHA基因中的突变。在一些实施例中,NHEJ导致核苷酸的缺失或插入,这在LDHA基因中诱导框架移位或无义突变。
在一些实施例中,施用本发明的引导RNA(例如在本文提供的组合物中)增加受试者中乙醇酸盐的水平(例如,血清或血浆水平),并且因此防止草酸盐积聚。
在一些实施例中,增加血清乙醇酸盐导致尿草酸盐减少。在一些实施例中,尿草酸盐的减少会减少或消除器官中草酸钙的形成和沉积。
在一些实施例中,受试者是哺乳动物。在一些实施例中,受试者是人。在一些实施例中,受试者是牛、猪、猴、羊、狗、猫、鱼或家禽。
在一些实施例中,提供包含表1中的引导序列中的任何一个或多个或表2中的一个或多个sgRNA的引导RNA(例如,在本文提供的组合物中)在制备用于治疗患有高草酸尿症的人类受试者的药物中的用途。
在一些实施例中,引导RNA、组合物和制剂通过静脉内施用。在一些实施例中,引导RNA、组合物和制剂被施用到肝循环中。
在一些实施例中,单次施用包含本文提供的引导RNA的组合物足以敲除突变蛋白的表达。在其他实施例中,包含本文提供的引导RNA的组合物的多于一次施用可有利于使治疗效果最大化。
在一些实施例中,治疗会减缓或停止高草酸尿症的进展。
在一些实施例中,治疗会减缓或停止终末期肾脏疾病(ESRD)的进展。在一些实施例中,治疗会减缓或停止对肾脏和/或肝脏移植的需求。在一些实施例中,治疗导致高草酸尿症症状的改善、稳定或变化减缓。
A.联合疗法
在一些实施例中,本发明包含联合疗法,所述联合疗法包含将gRNA中的任何一种与适合于减轻上述高草酸尿症及其症状的额外疗法一起使用,所述gRNA包含表1中公开的引导序列中的任何一种或多种(例如,在本文提供的组合物中)。
在一些实施例中,高草酸尿症的额外疗法是维生素B6、水化、肾透析或肝脏或肾脏移植。在一些实施例中,额外疗法是破坏LDHA基因的另一种试剂,例如针对LDHA基因的siRNA。在一些实施例中,针对LDHA基因的siRNA是DCR-PHXC。在一些实施例中,例如当高草酸尿症由PH1引起时,额外疗法是破坏HAO1基因的试剂,例如针对HAO1基因的siRNA。在一些实施例中,HAO1 siRNA是lumasiran(ALN-GO1;Alnylam)。
在一些实施例中,联合疗法包含gRNA中的任何一个以及靶向HAO1或LDHA的siRNA,所述gRNA包含表1中公开的引导序列中的任何一个或多个。在一些实施例中,siRNA是能够进一步减少或消除LDHA表达的任何siRNA。在一些实施例中,在包含表1中公开的引导序列中任何一个或多个的任何一个gRNA(例如,在本文提供的组合物中)之后施用siRNA。在一些实施例中,在用本文提供的任何gRNA组合物治疗后定期施用siRNA。
在一些实施例中,联合疗法包含gRNA中的任何一个以及靶向LDHA的反义核苷酸,所述gRNA包含表1中公开的引导序列中的任何一个或多个(例如在本文提供的组合物中)。在一些实施例中,反义核苷酸是能够进一步减少或消除LDHA表达的任何反义核苷酸。在一些实施例中,在包含表1中公开的引导序列中任何一个或多个的任何一个gRNA(例如,在本文提供的组合物中)之后施用反义核苷酸。在一些实施例中,在用本文提供的任何gRNA组合物治疗后定期施用反义核苷酸。
B.gRNA组合物的递送
脂质纳米颗粒(LNP)是众所周知的递送核苷酸和蛋白质货物的手段,并且可用于递送本文公开的引导RNA、组合物或药物制剂。在一些实施例中,LNP递送核酸、蛋白质或者将核酸和蛋白质一起递送。
在一些实施例中,本发明包含一种用于将本文公开的gRNA中的任何一个递送至受试者的方法,其中gRNA病与LNP相关。在一些实施例中,gRNA/LNP还与Cas9或编码Cas9的mRNA相关。
在一些实施例中,本发明包含一种包含公开的gRNA中的任何一个和LNP的组合物。在一些实施例中,所述组合物进一步包含Cas9或编码Cas9的mRNA。
在一些实施例中,LNP包含阳离子脂质。在一些实施例中,LNP包含(9Z,12Z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙基十八-9,12-二烯酸酯,也称为3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙基(9Z,12Z)-十八-9,12-二烯酸酯)或另一可电离脂质。参见例如WO/2017/173054和本文所述参考文献的脂质。在一些实施例中,LNP包含约4.5、5.0、5.5、6.0或6.5的阳离子脂质胺与RNA磷酸酯的摩尔比(N:P)。在一些实施例中,在LNP脂质的上下文中,术语阳离子的和可电离的是可互换的,例如,其中可电离脂质根据pH是阳离子的。
在一些实施例中,与本文公开的gRNA相关的LNP用于制备治疗疾病或障碍的药物。
电穿孔是众所周知的递送货物的方法,并且任何电穿孔方法都可用于递送本文公开的gRNA中的任何一个。在一些实施例中,电穿孔可用于递送本文公开的gRNA中的任一个和Cas9或编码Cas9的mRNA。
在一些实施例中,本发明包含一种用于将本文公开的gRNA中的任何一个递送至离体细胞的方法,其中gRNA与LNP相关或不与LNP相关。在一些实施例中,gRNA/LNP或gRNA还与Cas9或编码Cas9的mRNA相关。
在一些实施例中,单独或编码在一种或多种载体上的本文所述的引导RNA组合物被配制在脂质纳米颗粒中或通过脂质纳米颗粒施用;参见例如2017年3月30日提交且于2017年5月10日公开的标题为“用于CRISPR/CAS组分的脂质纳米颗粒制剂(LIPIDNANOPARTICLE FORMULATIONS FOR CRISPR/CAS COMPONENTS)”的WO/2017/173054,其内容通过引用整体并入本文。
在某些实施例中,本发明包含编码任何引导RNA的DNA或RNA载体,所述引导RNA包含本文所述的引导序列中的任何一个或多个。在一些实施例中,除了引导RNA序列之外,载体进一步包含不编码引导RNA的核酸。不编码引导RNA的核酸包括但不限于启动子、增强子、调节序列和编码RNA引导的DNA核酸酶的核酸,所述RNA引导的DNA核酸酶可以是诸如Cas9的核酸酶。在一些实施例中,载体包含编码crRNA、trRNA或crRNA和trRNA的一个或多个核苷酸序列。在一些实施例中,所述载体包含编码sgRNA的一个或多个核苷酸序列和编码RNA引导的DNA核酸酶的mRNA,所述RNA引导的DNA核酸酶可以是Cas核酸酶,例如Cas9或Cpf1。在一些实施例中,所述载体包含编码crRNA、trRNA的一个或多个核苷酸序列和编码RNA引导的DNA核酸酶的mRNA,所述RNA引导的DNA核酸酶可以是Cas蛋白,例如Cas9。在一个实施例中,Cas9来自酿脓链球菌(即,Spy Cas9)。在一些实施例中,编码crRNA、trRNA或crRNA和trRNA(其可以是sgRNA)的核苷酸序列包含侧翼为来自天然存在的CRISPR/Cas系统的重复序列的全部或一部分的引导序列或由其组成。包含crRNA、trRNA或crRNA和trRNA或由其组成的核酸可以进一步包含载体序列,其中载体序列包含非天然存在的核酸与crRNA、trRNA或crRNA和trRNA或由其组成。
本说明书和示例性实施例不应视为是限制性的。为了本说明书和所附权利要求的目的,除非另外指出,表示数量、百分数或比例的所有的数值,和本说明书和权利要求中使用的其他数值,在所有情况下应理解为被术语“约”修饰,至它们还未如此修饰的程度。因此,除非相反指出,在下面说明书和所附权利要求中阐释的数值参数是近似值,因为其可根据期望寻求获得的特性而改变。至少,并且不是试图将等同原则的应用限制到权利要求的范围,每个数值参数至少应该根据所报告的有效数字的数量并通过应用普通的舍入技术来解释。
注意,如在本说明书和所附的权利要求中所使用,单数形式“一个(a)”、“一种(an)”和“所述”和任何词语的任何单数使用,包括复数形式,除非明确和确切地限于一个指示物。如本文所使用,术语“包括”及其语法变型旨在是非限制性的,使得列表中项目的叙述不排除可替换或添加至所列项目的其他类似的项目。
实例
提供以下实例以说明某些公开的实施例,并且不应被解释为以任何方式限制本公开的范围。
实例1-材料和方法
核酸酶mRNA的体外转录(“IVT”)
使用线性化质粒DNA模板和T7 RNA聚合酶,通过体外转录产生含N1-甲基假U的加帽和聚腺苷酸化酿脓链球菌(“Spy”)Cas9 mRNA。含有T7启动子和转录序列的质粒DNA(用于产生包含本文所述mRNA的mRNA(示例性ORF参见下文表24中的SEQ ID NO:501-515)通过在37℃下孵育以在以下条件下用XbaI完全消化而线性化:200ng/μL质粒、2U/μL XbaI(NEB)和1x反应缓冲液。通过在65℃下加热反应20min,使XbaI失活。使用硅胶maxi旋转柱(时代生命科学(Epoch Life Sciences))从酶和缓冲盐中纯化线性化质粒,并通过琼脂糖凝胶分析以确认线性化。产生Cas9修饰的mRNA的IVT反应在以下条件下在37℃下孵育4小时:50ng/μL线性化质粒;GTP、ATP、CTP和N1-甲基假UTP(Trilink)各2mM;10mM ARCA(Trilink);5U/μL T7RNA聚合酶(NEB);1U/μL鼠RNase抑制剂(NEB);0.004U/μL无机大肠杆菌焦磷酸酶(NEB);和1x反应缓冲液。孵育4小时后,添加TURBO DNase(赛默飞世尔),使最终浓度达到0.01U/μL,并且将反应再孵育30分钟,以移除DNA模板。根据制造商方案(赛默飞世尔),使用MegaClear转录清除试剂盒从酶和核苷酸中纯化Cas9 mRNA。可选地,使用LiCl沉淀法纯化Cas9 mRNA,在某些情况下,其随后通过切向流过滤进行进一步纯化。通过测量260nm处的吸光度(Nanodrop)确定转录物浓度,并且使用Bioanlayzer(安捷伦(Agilent))通过毛细管电泳分析转录物。
实例中使用的Cas9 mRNA转录序列包含选自表24所示的SEQ ID NO:501-515的序列。
表24:示例性Cas9 mRNA序列
脂质纳米颗粒(LNP)制剂
通常,将脂质纳米颗粒组分以各种摩尔比溶解在100%乙醇中。RNA货物(例如,Cas9 mRNA和sgRNA)溶解在25mM柠檬酸盐、100mM NaCl、pH 5.0中,使得RNA货物浓度为约0.45mg/mL。实例2-4中使用的LNP分别以50:38:9:3的摩尔比含有可电离脂质((9Z,12Z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙基十八-9,12-二烯酸酯,也称为3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙基(9Z,12Z)-十八-9,12-二烯酸酯)、胆固醇、DSPC和PEG2k-DMG。将LNP配置成使脂质胺与RNA磷酸酯(N:P)的摩尔比为约6,并且gRNA与mRNA的重量比为1:1。
使用错流技术制备LNP,所述技术利用撞击流将乙醇中的脂质与两体积的RNA溶液和一体积的水混合。将乙醇中的脂质通过与两体积的RNA溶液混合交叉进行混合。第四股水流通过直列式三通管与交叉出口水流混合(参见WO2016010840图2)。将LNP在室温下放置1小时,并且用水(约1:1v/v)进一步稀释。使用平板筒(赛多利斯(Sartorius),100kD MWCO)上的切向流过滤将稀释的LNP浓缩,然后使用PD-10脱盐柱(GE)将缓冲液交换为50mM Tris、45mM NaCl、5%(w/v)蔗糖、pH 7.5(TSS)。然后用0.2μm无菌过滤器过滤所得混合物。最终LNP在4℃或-80℃下存储,直至进一步使用。
人LDHA引导物设计和具有食蟹猴同源性的人LDHA引导物设计
使用人参考基因组(例如,hg38)和用户定义的感兴趣的基因组区(例如,LDHA蛋白编码外显子)在计算机中进行初始引导物选择,以识别感兴趣区中的PAM。对于每种确定的PAM,均进行了分析并报告了统计数据。基于本领域已知的多种标准(例如,GC含量、预测的靶内活性和潜在的脱靶活性)来进一步选择gRNA分子并对其排序。
针对靶向蛋白质外显子编码区的人LDHA(ENSG00000134333),总共设计84个引导RNA。以上提供了引导物和相应的基因组坐标(表1)。其中40个引导RNA与食蟹猴LDHA具有100%同源性。
针对新的食蟹猴LDHA转录物设计了额外的引导物。原始数据来自雌性毛里求斯食蟹猴肝脏样本的已发表转录组测序(NCBI SRA ID:SRR1758956;Peng等人(2015),《核酸研究(Nucleic Acids Research)》,Volume 43,Issue D1,Pages D737–D742)。使用三位一体(Trinity)(v2.8.4;Grabherr等人(2011),《自然生物技术》,29:644–652)和SPAdes(v3.13.0;Bankevich等人(2012),《计算生物学杂志(Journal of ComputationalBiology)》,19:5)进行从头转录组组装。两种方法都能够组装LDHA转录物,通过将它们的序列与具有BLAST的LDHA蛋白(UniProt ID:Q9BE24)进行比较来确定(Altschul等人(1990),《分子生物学杂志(Journal of Molecular Biology)》,215:3,403-410)。Cas9(mRNA/蛋白质)和引导RNA体外递送
将原代人肝细胞(PHH)(Gibco,Lot#Hu8298或Hu8296)和原代食蟹猴肝细胞(PCH)(Gibco,Lot#Cy367或体外ADMET实验室公司,Lot#10281011)解冻并重新悬浮在含有补充剂的肝细胞解冻培养基中(Gibco,类别CM7500),然后离心分离。弃去上清液,并且将沉淀的细胞重新悬浮在肝细胞平板培养基加补充包装(英杰公司(Invitrogen),类别A1217601和CM3000)中。对细胞进行计数并在涂有生物包被胶原蛋白I的96孔板(赛默飞世尔,类别877272)上以对于PHH为33,000个细胞/孔和对于PCH为50,000个细胞/孔进行平板培养。让平板培养的细胞在37℃和5%CO
对于使用dgRNA的研究,通过混合等量的试剂并在95℃下孵育2分钟并且冷却至室温,对单个crRNA和trRNA进行预退火。将由预退火的crRNA和trRNA组成的双引导(dgRNA)与Spy Cas9蛋白一起孵育,以形成核糖核蛋白(RNP)复合物。根据制造商的方案用脂质体RNAiMAX(赛默飞世尔,类别13778150)转染细胞。用含有Spy Cas9(10nM)、单个引导物(10nM)、示踪RNA(10nM)、脂质体RNAiMAX(1.0μL/孔)和OptiMem的RNP转染细胞。
对于使用sgRNA的研究,将引导物与Spy Cas9蛋白一起孵育,以形成核糖核蛋白(RNP)复合物。在使用RNP转染的研究中,根据制造商的方案用脂质体RNAiMAX(赛默飞世尔,类别13778150)转染细胞。用含有Spy Cas9(10nM)、sgRNA(10nM)、脂质体RNAiMAX(1.0μL/孔)和OptiMem的RNP转染细胞。在利用电穿孔的研究中,使用含有Spy Cas9(2uM)和sgRNA(4uM)的RNP、利用Lonza 4D-核转染子核心单元(类别AAF-1002X)、96孔横梭装置(ShuttleDevice)(类别AAM 10015)和P3原代细胞试剂盒(类别V4XP-3960)电穿孔细胞。
原代人和食蟹猴肝细胞也用LNP治疗,如下文进一步描述。使用LNP治疗前,将细胞在37℃、5%CO
Cas9 mRNA和gRNA的脂质转染使用预混合脂质制剂,其中脂质组分在100%乙醇中以50%脂质A、9%DSPC、38%胆固醇和3%PEG2k-DMG的摩尔比重建。然后以约6.0的脂质胺对RNA磷酸盐(N:P)摩尔比将脂质混合物与RNA货物(例如,Cas9 mRNA和gRNA)混合。使用6%的食蟹猴血清和1:1的gRNA与mRNA重量比进行脂质转染。
基因组DNA分离
转染后72或96小时收获PHH和PCH转染的细胞。根据制造商的方案使用50μL/孔的BuccalAmp DNA提取溶液(Epicentre,类别QE09050)从96孔板的每孔中提取gDNA。如本文所述,对所有DNA样本进行PCR和随后的NGS分析。
下一代测序(“NGS”)和靶上切割效率分析
为了定量地确定基因组中靶位置的编辑效率,使用深度测序来确定是否存在通过基因编辑引入的插入和缺失。将PCR引物围绕感兴趣基因(例如,LDHA)内的靶位点设计,并且感兴趣的基因组区域被扩增。引物序列设计是按照本领域的标准进行的。
根据制造商的方案(依诺米那(Illumina))进行附加PCR,以添加用于测序的化学物质。将扩增子在依诺米那MiSeq仪器上测序。将读数与参考基因组(例如,hg38)在消除具有低质量分数的那些之后进行比对。将得到的含有这些读数的文件映射到参考基因组(BAM文件),其中选择与感兴趣靶区重叠的读数,并且计算野生型读数与含有插入或缺失(“插入缺失”)的读数的数量。
编辑百分比(例如,“编辑效率”或“编辑百分比”)被定义为超过序列读数的总数,包括野生型的具有插入或缺失(“插入缺失”)的序列读数的总数。
通过蛋白质印迹进行的乳酸脱氢酶A(LDHA)蛋白分析
用配制有来自表1的选择引导物的LNP治疗原代人肝细胞,如实例3中进一步所述。将LNP在含有3%食蟹猴血清的培养基(宝生物,类别Y20020)中在37℃下孵育10分钟。孵育后,将LNP加入人肝细胞中。转染后21天,取出培养基,并且用50μL/孔RIPA缓冲液(波士顿生物产品(Boston Bio Products),类别BP-115)加上新添加的蛋白酶抑制剂混合物裂解细胞,所述混合物由完整的蛋白酶抑制剂混合物(西格玛(Sigma),类别11697498001)、1mMDTT和250U/ml Benzonase(EMD密理博(EMD Millipore),类别71206-3)组成。将细胞在冰上保存30分钟,然后加入NaCl(最终浓度为1M)。将细胞裂解物充分混合,并且在冰上保留30分钟。将全细胞提取物(“WCE”)转移至PCR板并离心分离至沉淀碎片。使用Bradford测定(伯乐(Bio-Rad),类别500-0001)来评估裂解物的蛋白质含量。根据制造商的方案完成Bradford测定程序。使用前,将提取物在-20℃下存储。
用实例4中进一步描述的配制成具有选择引导物的LNP治疗AGT缺陷小鼠。从治疗后的小鼠获取肝脏,并且将60mg部份用于蛋白质提取。将样本置于珠管中(MP生物医药(MPBiomedical),类别6925-500)中,并用600μL/样本的RIPA缓冲液(波士顿生物产品,类别BP-115)加上新添加的蛋白酶抑制剂混合物裂解样本,所述混合物由完整的蛋白酶抑制剂混合物(西格玛,类别116974500)组成,并且以5.0m/sec的速度进行均质化。然后以14,000RPM将样本在4℃下离心分离10分钟,并且将液体转移到新的试管中。以14,000RPM进行最终离心分离10分钟,并且使用如上所述的Bradford测定对样本进行量化。
进行蛋白质印迹以评估LDHA蛋白水平。将溶胞产物与Laemmli缓冲液混合,并在95℃下变性10分钟。根据制造商的方案使用NuPage系统在10%Bis-Tris凝胶(赛默飞世尔科技,类别NP0302BOX)上进行印迹,然后将其湿转移到0.45μm的硝酸纤维素膜(伯乐,类别1620115)上。转移膜用水彻底冲洗并且用朱红S溶液(波士顿生物产品,类别ST-180)染色后,确认完全和均匀转移。在室温下,在实验室摇杆上用5%干牛奶在TBS中封闭印迹30分钟。用TBST冲洗印迹并在TBST中以1:1000用兔α-LDHA多克隆抗体(西格玛,类别SAB2108638用于细胞裂解物或Genetex,类别GTX101416用于小鼠肝脏裂解物)探查。对于含有体外细胞裂解物的印迹,在TBST中以1:1000使用β肌动蛋白作为加载对照(诺伟思(Novus),类别B600-501),并与LDHA一次抗体同时孵育。对于具有体内小鼠肝脏提取物的印迹,在TBST中以1:1000使用GAPDH作为加载对照(艾博抗(Abcam),ab8245),并与LDHA一次抗体同时孵育。将印迹密封在袋中,并在实验室摇杆上于4℃下保存过夜。孵育后,在TBST中冲洗印迹3次,每次5分钟,并且在TBST中用小鼠和兔的二次抗体(赛默飞世尔科技,类别PI35518和PISA535571)在室温下分别在TBST中以1:12,500探查30分钟。孵育后,在TBST中冲洗印迹3次,每次5分钟,并用PBS冲洗2次。使用Licor Odyssey系统对印迹进行可视化和分析。
通过免疫组织化学染色进行的乳酸脱氢酶A(LDHA)蛋白分析
对于小鼠肝脏的视觉LDHA蛋白分析,在Lecia Bond Rxm上进行标准免疫组织化学染色。对于抗原修复(HIER),将载玻片在pH 9的EDTA系缓冲液中在94℃下加热25分钟,然后以1:500进行30分钟的抗体孵育(艾博抗,类别Ab52488)。使用HRP共轭的二次聚合物检测抗体结合,然后使用二氨基联苯胺显色。
小鼠肌肉和肝脏的LDH活性的测量
对于乳酸脱氢酶活性,使用生物化学方法(例如Wood KD等人,《生物化学与生物物理学——疾病的分子基础(Biochim Biophys Acta Mol Basis Dis.)》2019Sep 1;1865(9):2203-2209;PMC6613992)。为了测量乳酸脱氢酶活性,在冰冻冷裂解缓冲液(25mMHEPES,pH 7.3,0.1%Triton-X-100)中用探针超声对组织进行均质化,得到10%wt/vol的裂解物。通过在340nm处吸光度的增加以及在乳酸盐存在下将NAD还原为NADH来测量LDH活性。使用20mM乳酸盐、100mM Tris-HCL、pH 9.0、2mM NAD+、0.01%肝脏裂解物测量LDG的乳酸盐至丙酮酸盐活性。使用以牛血清白蛋白(BSA)为标准的Cooomassie Plus蛋白测定试剂盒(皮尔斯,伊利诺斯州罗克福德)来确定组织裂解物中的蛋白浓度。
小鼠样本中草酸盐、肌酐、丙酮酸盐和乳酸盐的测量
对于草酸盐确定,在-80℃下存储前,用HCl将部分尿收集品酸化至pH值介于1和2之间,以防止冷藏时可能出现的任何可能的草酸盐结晶和/或与碱化相关的草酸生成。剩余的未酸化尿在-80℃下冷冻,用于测量肌酐。通过标称分子量限制为10,000的Nano-sep离心过滤器(VWR国际(VWR International),伊利诺伊州巴达维亚)过滤血浆制剂,以去除大分子,然后进行离子色谱-质谱联用或ICMS(赛默飞世尔科技有限公司,马塞诸塞州沃尔瑟姆)。在样本过滤前,用10mM HCl洗涤离心过滤器,以去除过滤装置中截留的任何污染性微量有机酸。用10%(wt/vol)三氯乙酸(TCA)提取肝组织,用于有机酸分析。通过在用等体积的1,1,2-三氯三氟乙烷(氟利昂)-三辛胺(3:1,vol/vol;奥德里奇(Aldrich),威斯康星州密尔沃基)剧烈涡旋去除TCA之后进行ICMS,在4℃下离心分离以促进相分离,并收集上层水层进行分析来测量有机酸。如前所述,在化学分析仪上测量尿肌酐,并且通过ICMS测量尿草酸盐。
使用下列质量/电荷比和锥体电压下的选定离子监测(SIM)将乳酸盐(SIM 89.0,35V)和13C3-乳酸盐(SIM 92.0,35V)量化。使用控制温度为30℃的AS11-HC 4μm、2×150mm阴离子交换柱和DionexTMERSTM500阴离子电解再生抑制器,通过IC/MS测量Pyruviate。使用0.5至80mM的KOH梯度在60min内以0.38ml/min的流速分离样本阴离子。质谱仪(MSQ-PLUS)在ESI负模式、针电压1.5V、500℃源温度下运行,并且在进入MSQ之前,使用零死体积混合三通将柱洗脱剂与50%乙腈以0.38ml/min的速度混合。对丙酮酸盐使用下列质量/电荷比和锥体电压下的选定离子监测(SIM)。
实例2–筛选和引导物鉴定
原代肝细胞中LDHA引导物的交叉筛选
如实例1所述,将靶向人LDHA的引导物和在食蟹猴中具有同源性的那些转染入原代人(通过RNP转染)和食蟹猴肝细胞(通过RNP电穿孔)。确定每种细胞类型中包含每个引导序列的sgRNA的编辑百分比。表1中两种细胞系中的引导序列的筛选数据如下所示(表4-5)。
表4显示对于作为RNP转染入原代人肝细胞的LDHA的编辑%、插入(Ins)%和缺失(Del)%,重复样本的平均值和标准偏差。N=2。
表5显示在原代食蟹猴肝细胞中用RNP电穿孔的测试LDHA sgRNA的编辑%、插入(Ins)%和缺失(Del)%的平均值和标准偏差。N=2。
表6显示在30nM sgRNA浓度下使用脂质转染在原代食蟹猴肝细胞中,测试LDHAsgRNA跨越多个染色体位置的编辑%的平均值和标准偏差。N=2。
基于原代人和原代食蟹猴肝细胞编辑数据,进一步评价了一子组引导序列。该子组在表7和表8中提供,并再现了来自原代肝细胞筛选的相应编辑数据。
LDHA引导物的脱靶分析
使用生物化学方法(参见例如Cameron等人,《自然方法》6,600-606;2017)来确定被靶向LDHA的Cas9切割的潜在脱靶基因组位点。在本实验中,使用分离的HEK293基因组DNA筛选10个经修饰的靶向人LDHA的sgRNA(以及两个具有已知脱靶廓线的对照引导物),并且潜在的脱靶结果绘制在图1中。所述测定确定了测试sgRNA的潜在脱靶位点。
用于验证潜在脱靶位点的靶向测序
在已知的脱靶检测测定中,例如上面使用的生物化学方法,通常通过设计回收大量潜在的脱靶位点,以便为可以在其他情况中,例如在感兴趣的原代细胞中验证的潜在位点“撒开宽网”。例如,生物化学方法通常会高估潜在脱靶位点的数量,因为所述测定利用不含细胞环境的纯化高分子量基因组DNA,并且取决于所用的Cas9RNP的剂量。因此,通过这些方法确定的潜在脱靶位点可以使用确定的潜在脱靶位点的靶向测序进行验证。
在一种方法中,用包含Cas9 mRNA和感兴趣sgRNA(例如具有潜在脱靶位点用于评价的sgRNA)的LNP治疗原代肝细胞。然后裂解原代肝细胞,并且使用潜在脱靶位点侧翼的引物产生用于NGS分析的扩增子。在某一水平确定插入缺失可验证潜在脱靶位点,而在潜在脱靶位点未发现插入缺失则可能表明所用的脱靶测定呈假阳性。
原代人和食蟹猴肝细胞中含有Spy Cas9 mRNA和sgRNA的脂质纳米颗粒(LNP)制剂的交叉筛选
在剂量反应测定中,在原代人肝细胞和原代食蟹猴肝细胞上测试靶向人LDHA的经修饰的sgRNA和在食蟹猴中同源的那些的脂质纳米粒颗(LNP)制剂。按照实例1所述配制LNP。原代人和食蟹猴肝细胞如实例1所述进行平板培养。使用LNP治疗前,将两种细胞系在37℃、5%CO
表9显示在原代人肝细胞中使用Spy Cas9经LNP递送的22nM的测试LDHA sgRNA的编辑%、插入(Ins)%和缺失(Del)%的平均值和标准偏差。这些样本一式两份生成。
表10显示在原代食蟹猴肝细胞中使用Spy Cas9经LNP递送的22nM的测试LDHAsgRNA的编辑%、插入(Ins)%和缺失(Del)%的平均值和标准偏差。这些样本一式三份生成。
使用脂质转染交叉筛选原代食蟹猴肝细胞中的Spy Cas9 mRNA和sgRNA。在剂量反应测定中,在原代食蟹猴肝细胞上测试靶向LDHA的经修饰的sgRNA。如实例1所述制备脂质转染样本。原代食蟹猴肝细胞如实例1所述进行平板培养。在脂质转染前,将细胞在37℃、5%CO
实例3.表型分析
细胞内乳酸脱氢酶A的蛋白质印迹分析
将靶向人LDHA的经修饰的sgRNA的脂质纳米颗粒(LNP)制剂施用于原代人肝细胞,以生成用于蛋白质印迹的样品。按照实例1所述配制LNP。原代人肝细胞如实例1所述进行平板培养。使用LNP治疗前,将细胞在37℃、5%CO
表12提供这些细胞的编辑数据。
对于LDHA蛋白的减少通过蛋白质印迹来分析WCE。全长LDHA蛋白具有332个氨基酸,并且预测分子量为36.6kD。在对照泳道(未治疗的细胞)中观察到该分子量的条带,但在任何治疗的泳道中未观察到(图4)。
乳酸脱氢酶A的转录物分析
将选定靶向LDHA的经修饰的sgRNA通过脂质转染施用于原代人和食蟹猴肝细胞,以生成用于qPCR的样本。如实例1所述制备脂质转染样本。原代肝细胞如实例1所述进行平板培养。使用脂质包治疗前,将细胞在37℃、5%CO
实例4.PH1小鼠模型中Ldha的体内编辑
本研究中使用野生型和AGT缺陷小鼠(Agxt1
在配制LNP之前,与实例2中所述的靶向人和食蟹猴LDHA的gRNA类似,筛选包含靶向小鼠Ldha的dgRNA的RNP的编辑效率。从dgRNA筛选中确定出活性gRNA后,合成一较小组的基于这些gRNA的经修饰的sgRNA,用于进一步的体内评价。
对动物基线称重,并且根据体重分组,以制备基于组平均重量的给药溶液。含有靶向小鼠Ldha的经修饰的sgRNA的LNP(见下表14)通过尾侧静脉以每只动物0.2mL的体积(约10mL/kg体重)给药。按照实例1所述配制LNP。治疗后一周,对野生型小鼠实施安乐死,并且收集肝组织用于DNA提取和小鼠Ldha编辑分析。
如下表14所示,在治疗的小鼠中观察到剂量依赖性编辑水平。
在确定LNP可以在体内编辑小鼠Ldha基因后,以相对于总mRNA货物的剂量响应(0、0.25、0.5、1和2mpk)向AGT缺陷小鼠施用含G009439的LNP。将这些小鼠容置在代谢笼中,并且在不同时间点收集尿以确定草酸盐水平,例如Liebow等人,《美国肾脏病学会杂志(J AmSoc Nephrol.)》2017Feb;28(2):494-503所述。随着LNP剂量的增加,Ldha基因编辑和草酸盐分泌被显示为分别增加和减少。排泄的编辑%和ug尿草酸盐/mg肌酐包含在下表15中,并展示在图14A-14C中。
在确定LNP可减少体内草酸盐分泌后,以相对于总mRNA货物的2mpk(n=4)的剂量对AGT缺陷小鼠施用含G009439的LNP。如图5所示,治疗后一周尿草酸盐水平降低,并且这种水平的降低持续到给药后至少5周,此时研究终止。在对照(注射PBS的)动物(n=4)中未观察到减少。表16中报告每只治疗动物中的编辑百分比,并且表18中显示治疗后每周尿草酸盐的减少%。
在同一研究中,AGT缺陷小鼠还被给药了含有靶向小鼠Hao1的sgRNA(G000723)的LNP(剂量为2mpk(n=4))。同样如图5和表17所示,在用包含此gRNA的LNP治疗一周后,草酸盐水平降低,并且这种水平的降低持续到给药后至少5周。
G000723:mC*mA*mC*GUGAGCCAUGCACUGCAGUUUUAGAmGmCmUmAm GmAmAmAmUmAmGmCAAGUUAAAAUAAGGCUAGUCCGUUAUCAmAmCmUm UmGmAmAmAmAmAmGmUmGmGmCmAmCmCmGmAmGmUmCmGmGmUmGmC mU*mU*mU*mU(SEQ ID NO:85)*=PS键合;'m'=2’-O-Me核苷酸
在LNP治疗后至多5周在AGT缺陷小鼠中证明了持续的尿草酸盐减少后,进行了另一项研究以跟踪给药后至多15周的尿草酸盐。以0.3mpk(n=4)和1mpk(n=4)的剂量对AGT缺陷小鼠施用含有G009439的LNP。将这些小鼠容置在代谢笼中,并且在不同时间点收集尿以确定草酸盐水平,如上所述。表19显示AGT缺陷小鼠的编辑结果。在0.3mpk剂量下实现的平均编辑%是33.42,标准偏差是11.95。在1mpk剂量下实现的平均编辑%是75.68,标准偏差是7.35。如图6所示,治疗后尿草酸盐水平降低,并且这种水平的降低持续到给药后至多15周,此时研究终止。图6所示的数据在表20中示出。在对照(注射PBS的)动物(n=3)中未观察到减少(数据未显示)。
如实例1所述,处理来自治疗小鼠的肝样本并在蛋白质印迹上运行。使用LicorOdyssey Image Studio Ver 5.2软件计算LDHA蛋白的减少百分比。使用GAPDH作为负荷对照,并且与LDHA同时进行探查。计算每份样本中GAPDH的光密度测定值与包含LDHA条带的总区的比率。将比率归一化至阴性对照泳道后,确定LDHA蛋白的减少百分比。结果在表19中示出并在图7中描绘。
如实例1所述和图8所描绘,通过免疫组织化学染色另外表征了治疗和未治疗小鼠中的LDHA蛋白。与对照组小鼠相比,在0.3mpk给药的小鼠和1mpk给药的小鼠中观察到LDHA染色的渐进性减少。图9显示表19中编辑和蛋白质水平之间的R
如实例1所述,针对LDH活性,处理来自治疗小鼠的肝和肌肉样本。在用1mpk LdhaLNP治疗的小鼠的肝样本中观察到LDH活性降低。来自治疗小鼠和对照小鼠的比活性(μmol/min/mg蛋白)包含在下表21中,并且数据在图15A-15B中示出。
如实例1所述,对于丙酮酸盐,还分析来自治疗小鼠的肝脏和血浆样品。丙酮酸盐是由乳酸脱氢酶转化为乳酸的代谢产物(Urbańska K等人,《国际分子科学杂志(Int J MolSci.2019)》Apr 27;20(9))。在1mpk治疗小鼠的肝脏样品中,丙酮酸盐浓度被证明升高,但在治疗小鼠和对照小鼠之间观察到血浆丙酮酸盐浓度的差异很小。这些数据包含在表22中,如图16A-16B所示。
在LNP治疗后至多15周在AGT缺陷小鼠中证明了持续的尿草酸盐减少后,进行了另一项研究,以确定肾功能受损小鼠在LDHA击倒后清除乳酸的能力。接受5/6肾切除术或假手术的C51Bl6雄性小鼠得自杰克逊实验室(Jackson Laboratory)(缅因州巴尔港)。术后一周,如实例1所述,对动物进行基线乳酸盐水平放血。然后以2mpk(n=6)的剂量对动物给药含G009439的LNP。给药后两周,对动物进行乳酸盐攻击,包含腹膜内递送的溶解在pH 7.4的磷酸盐缓冲盐水(浓度200mg/mL,约18mM)中的2g/kg乳酸钠。在攻击前以及攻击后15、30、60和180分钟对动物进行了尾部放血。如实例1所述,分析血液样品的乳酸盐水平。与假手术和载体治疗小鼠相比,在接受肾切除手术和LDHA LNP的小鼠中未观察到乳酸盐清除率的显著差异。下表23详细列出各组动物的平均血浆丙酮酸盐,也在图17中示出。
- 用于乳酸脱氢酶(LDHA)基因编辑的组合物和方法
- 用于使用乳酸脱氢酶转化体从C1化合物以生物方式产生乳酸的组合物和方法
