一种微生物裂解方法及其试剂盒
文献发布时间:2023-06-19 12:11:54
技术领域
本发明涉及微生物基因组检测技术领域,具体涉及一种微生物裂解方法及其试剂盒。
背景技术
现有的微生物细胞壁破碎方法主要有物理法和化学法两种。物理法主要包括超声法、玻璃珠研磨法、液氮冻融法;化学法主要包括生物酶解法和化学试剂法。
物理法中超声法主要是基于超声波对细胞壁的剪切力作用进行破壁,但对丝状真菌等破壁效果不佳,而且通量较小,无法满足现样本量的使用需求。玻璃珠研磨法使用广泛,可以有效裂解细胞壁,但是病原体类型不同,所需研磨条件不同。液氮冻融法更适合植物材料或动物组织的研磨和匀浆,对不同类型临床样本以及该技术流程的临床使用,不具有普适性。
化学法中生物酶解法比较温和,但是对于部分丝状真菌以及细胞壁坚韧的微生物,效果不佳,再者,如果单独使用酶解法进行裂解,时间较长,不满足临床样本及时交付的需求。化学试剂法指用异硫氰酸胍、碱裂解或SDS等进行细胞壁裂解,但是对厚壁或者坚韧细胞壁裂解效果不佳。
随着二代测序技术的发展,基于宏基因组二代测序技术(mNGS)的病原微生物检测在临床应用范围越来越广,以其快速、全面、准确的特性为临床感染患者提供精准诊断,造福患者。但是面对临床样本中未知的微生物,且部分微生物细胞壁外包裹荚膜层,导致细胞壁较厚;丝状真菌等微生物的细胞壁含有大量几丁质(亦称壳多糖,为N-乙酰葡糖胺通过β连接聚合而成的结构同多糖),导致细胞壁坚韧,现有的提取方法不能有效裂解其细胞壁,导致微生物核酸提取效率低,从而易出现病原体漏检。
对于以DNA提取为目的的微生物裂解,现有方法的裂解效果欠佳。
发明内容
根据第一方面,在一实施例中,提供一种微生物裂解方法,包括:
酶解步骤,包括使用真菌细胞壁溶解酶对待测微生物样本进行裂解;
物理裂解步骤,包括使用不同粒径的裂解介质的混合物对酶解步骤裂解得到的待测微生物样本进行研磨裂解,得到裂解液。
根据第二方面,在一实施例中,提供一种试剂盒,所述试剂盒包含真菌细胞壁溶解酶、裂解介质,所述裂解介质为不同粒径的裂解介质的混合物。
依据上述实施例的微生物裂解方法及其试剂盒,由于将酶解和物理研磨裂解相结合,采用混合粒径的裂解介质进行物理裂解,有效提高破壁效率,从而有效提高样本中病原体的检出效率,适用于不同样本类型的微生物细胞破壁,临床普适性高。
附图说明
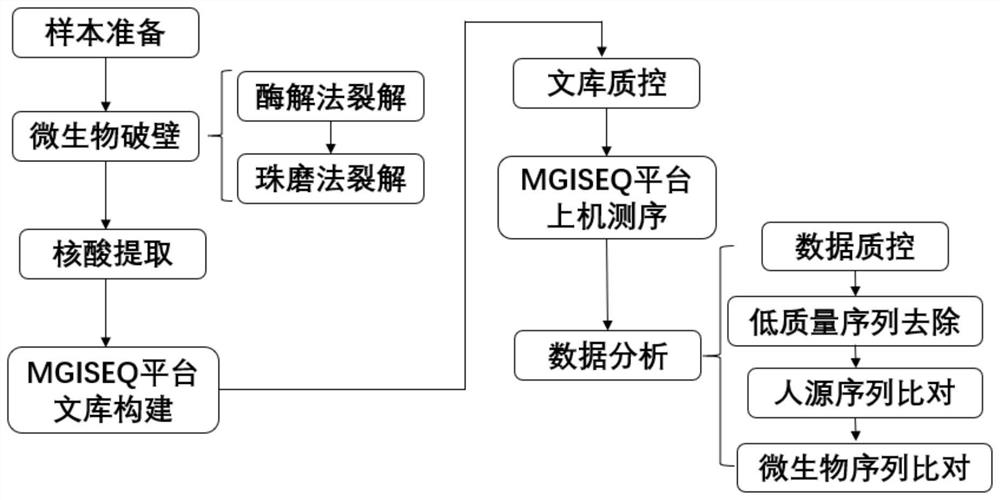
图1为一种实施例的微生物破壁及数据分析流程图;
图2为实施例1的文库质量检测合格的文库Agilent 2100结果图;
图3为实施例1的病原体检测对比结果图;
图4为实施例2的文库质量检测合格的文库Agilent 2100结果图;
图5为实施例2的烟曲霉检出结果图。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。在以下的实施方式中,很多细节描述是为了使得本申请能被更好的理解。然而,本领域技术人员可以毫不费力的认识到,其中部分特征在不同情况下是可以省略的,或者可以由其他材料、方法所替代。在某些情况下,本申请相关的一些操作并没有在说明书中显示或者描述,这是为了避免本申请的核心部分被过多的描述所淹没,而对于本领域技术人员而言,详细描述这些相关操作并不是必要的,他们根据说明书中的描述以及本领域的一般技术知识即可完整了解相关操作。
另外,说明书中所描述的特点、操作或者特征可以以任意适当的方式结合形成各种实施方式。同时,方法描述中的各步骤或者动作也可以按照本领域技术人员所能显而易见的方式进行顺序调换或调整。因此,说明书和附图中的各种顺序只是为了清楚描述某一个实施例,并不意味着是必须的顺序,除非另有说明其中某个顺序是必须遵循的。
本文中为部件所编序号本身,例如“第一”、“第二”等,仅用于区分所描述的对象,不具有任何顺序或技术含义。而本申请所说“连接”、“联接”,如无特别说明,均包括直接和间接连接(联接)。
基于宏基因组新一代测序技术(metagenomics next generation sequencing,mNGS)不依赖于传统的微生物培养,直接对临床样本中的核酸进行高通量测序,能够快速、准确地检测临床样本中的多种病原微生物(包括病毒、细菌、真菌、寄生虫),尤其适用于急危重症和疑难感染的诊断。但是对于一些胞内菌以及真菌,由于细胞壁外包裹荚膜或细胞壁坚韧,使用常规提取方法裂解效率不佳,易造成病原体漏检,在一实施例中,本发明在样本提取前增加破壁流程,可有效提高细菌、胞内菌以及真菌的检出效率。
根据第一方面,在一实施例中,提供一种微生物裂解方法,包括:
酶解步骤,包括使用真菌细胞壁溶解酶对待测微生物样本进行裂解;
物理裂解步骤,包括使用不同粒径的裂解介质的混合物对酶解步骤裂解得到的待测微生物样本进行研磨裂解,得到裂解液,即为可用于核酸提取的裂解液。
在一实施例中,所述待测微生物样本是指含有待测微生物的样本,通常可以是实验室自配的模拟样本或从待测生物体上通过穿刺、灌洗等方式取得的样本,例如,实验室自配的样本可以是微生物与细胞(例如,可以是Hela细胞等等)的混合液,还可以进一步含有稀释液(例如,可以是生理盐水等等)。再例如,待测微生物样本可以是使用生理盐水从待测生物体的组织中灌洗得到的样本,如肺泡灌洗液样本等等。对于哺乳类动物,生理盐水通常是质量浓度为0.9%的氯化钠水溶液。
在一实施例中,所述待测微生物样本中含有至少一种待测微生物,此处的“种”是指分类系统中最基本的分类单位,即界(Kingdom)、门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)、种(Species)中最末位的分类单元种(Species)。待测微生物样本中的微生物种类数不受限制,可以是1种、2种、3种或者更多。
在一实施例中,所述裂解液是用于DNA提取的裂解液。
在一实施例中,所述裂解介质的粒径为0.1~1mm。裂解介质粒径和微生物大小不同,研磨时碰撞几率不同,会直接影响破壁效果。裂解介质的粒径包括但不限于0.1mm、0.2mm、0.3mm、0.4mm、0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1mm等等。
在一实施例中,加入的裂解介质的总体积为待测微生物样本体积的0.2~1倍,优选为0.2~0.9倍,更优选为0.4~0.6倍,包括但不限于0.2倍、0.3倍、0.4倍、0.5倍、0.6倍、0.7倍、0.8倍、0.9倍、1倍等等。裂解介质过少会造成研磨效果不佳,过多会造成浪费,且最后吸取到的样本较少,导致核酸提取体积不足。
在一实施例中,所述不同粒径的裂解介质的混合物为至少两种不同粒径的裂解介质的混合物。具体可以是两种、三种或更多种不同粒径的裂解介质的混合物。由于三种及以上粒径的裂解介质混合操作难度较高和时间较长,因此,优选为两种不同粒径的裂解介质混合。
在一实施例中,所述裂解介质优选为球形裂解介质,可提高微生物裂解效率。
在一实施例中,所述裂解介质包括但不限于玻璃珠、陶瓷珠、钢珠中的至少一种。此处仅仅是示例性列举,其他具有较高硬度的裂解介质也适用于本发明。
在一实施例中,所述裂解介质包括第一粒径的裂解介质、第二粒径的裂解介质,第一粒径为0.1~0.5mm,第二粒径为0.5~1.0mm。第一粒径包括但不限于0.1mm、0.2mm、0.3mm、0.4mm、0.5mm等等,第二粒径包括但不限于0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1.0mm等等。
在一实施例中,第一粒径的裂解介质与第二粒径的裂解介质的体积比为(1~4):1。第一粒径的裂解介质与第二粒径的裂解介质的体积比包括但不限于1:1、1.5:1、2:1、2.5:1、3:1、3.5:1、4:1等等。
在一实施例中,所述第一粒径为0.5mm,所述第二粒径为1mm。
在一实施例中,第一粒径的裂解介质与第二粒径的裂解介质的体积比为1:1。
在一实施例中,将真菌细胞壁溶解酶、待测微生物样本加入预先加有裂解介质的容器中进行酶解,酶解结束后,无需将待测微生物样本转移出所述容器,直接将所述容器置于研磨设备中,对所述容器中的待测微生物样本进行物理裂解。本发明在酶解后无需转管,即可进行物理裂解,简化了操作步骤,缩短操作时长。
真菌细胞壁溶解酶亦称溶壁酶、Lyticase,真菌细胞壁溶解酶可以从市场上购买得到,示例但非限制性的,真菌细胞壁溶解酶可以购自天根生化科技(北京)有限公司、上海翊圣生物科技有限公司、sigma、索莱宝等等。在一实施例中,用于宏基因组样本检测时,对真菌细胞壁溶解酶的要求主要包括酶活性和不引入杂菌。
在一实施例中,所述研磨设备为匀浆仪,有的设备生产商也将其称为研磨机、研磨仪等等。通过裂解介质撞击样品,达到破碎细胞组织的目的的匀浆仪均适用于本发明。
研磨设备可从市场上购买获得,在一实施例中,可以使用FastPrep-24
在一实施例中,物理裂解步骤中,使用裂解介质对待测微生物样本进行循环研磨,研磨循环数为2~4,具体可以为2、3、4个循环,优选为2。
在一实施例中,物理裂解步骤中,循环研磨时,每次研磨时间为45s~60s,包括但不限于45s、50s、55s、60s等等,优选为45s。
在一实施例中,物理裂解步骤中,循环研磨时,相邻两次研磨的间隔时间为120s~300s,包括但不限于120s、130s、140s、150s、160s、170s、180s、190s、200s、210s、220s、230s、240s、250s、260s、270s、280s、290s、300s等等,优选为120s。
在一实施例中,物理裂解步骤中,研磨裂解时,振荡速度为4~10m/s,包括但不限于4m/s、5m/s、6m/s、7m/s、8m/s、9m/s、10m/s等等,优选为6m/s,该振荡速度是指研磨设备的振荡速度,开机后,振荡速度通常以0.5m/s的速度增加至设定值。
在一实施例中,所述酶解步骤中,向待测微生物样本中加入溶壁酶后,温浴处理,所述温浴处理是指在25℃~35℃下保持10min~120min,然后进入物理裂解步骤。温浴的作用主要是提高酶解效果,温浴时间过短,则酶解效果不佳,温浴时间过长,则会增加实验时长。温浴的温度包括但不限于25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃,温浴的时间包括但不限于10min、11min、12min、13min、14min、15min、16min、17min、18min、19min、20min、30min、40min、50min、60min、70min、80min、90min、100min、110min、120min等等。
在一实施例中,所述酶解步骤中,向待测微生物样本中加入溶壁酶后,先进行漩涡振荡混匀,再依次进行离心处理、温浴。
在一实施例中,温浴前的离心条件包括:离心力为2000~8000×g,时间为30~60s。此处离心的作用主要是将样本和溶壁酶离心到管中央,使得样本和溶壁酶不挂壁,避免影响酶解效率,实验中简短离心即可。
在一实施例中,温浴结束后,直接对待测微生物样本进行物理裂解,无需再进行离心。
在一实施例中,以待测微生物样本的体积计,所述真菌细胞壁溶解酶的加入量为0.1~3U/μL,即每微升待测微生物样本液中,加入0.1~3U真菌细胞壁溶解酶,优选为0.12~2.5U/μL,更优选为0.12~2U/μL,更优选为0.12~0.3U/μL。真菌细胞壁溶解酶加入量过少,会导致裂解效果不足,加入量过多,会由于添加过量导致成本增加。真菌细胞壁溶解酶的加入量包括但不限于0.1U/μL、0.11U/μL、0.12U/μL、0.13U/μL、0.14U/μL、0.15U/μL、0.16U/μL、0.17U/μL、0.18U/μL、0.19U/μL、0.2U/μL、0.21U/μL、0.22U/μL、0.23U/μL、0.24U/μL、0.25U/μL、0.26U/μL、0.27U/μL、0.28U/μL、0.29U/μL、0.3U/μL、0.4U/μL、0.5U/μL、0.6U/μL、0.7U/μL、0.8U/μL、0.9U/μL、1U/μL、1.5U/μL、2U/μL、2.5U/μL、3U/μL等等。
在一实施例中,所述微生物包括但不限于细菌、放线菌、真菌、病毒、立克次氏体、支原体、衣原体、螺旋体原生动物、单细胞藻类中的至少一种。通常可以是细菌、真菌。
在一实施例中,所述细菌包括革兰氏阳性菌、革兰氏阴性菌中的至少一种。
根据第二方面,在一实施例中,提供一种试剂盒,所述试剂盒包含真菌细胞壁溶解酶、裂解介质,所述裂解介质为不同粒径的裂解介质的混合物。真菌细胞壁溶解酶、裂解介质可以存放于不同的容器中并进行包装,使用时再打开并与微生物样品混合。
在一实施例中,所述不同粒径的裂解介质的混合物为至少两种不同粒径的裂解介质的混合物。
在一实施例中,所述裂解介质为球形裂解介质。
在一实施例中,所述裂解介质选自玻璃珠、陶瓷珠、钢珠中的至少一种;
在一实施例中,所述裂解介质包括第一粒径的裂解介质、第二粒径的裂解介质,第一粒径为0.1~0.5mm,第二粒径为0.5~1.0mm。
在一实施例中,第一粒径的裂解介质与第二粒径的裂解介质的体积比为(1~4):1。
在一实施例中,所述第一粒径为0.5mm,所述第二粒径为1mm。
在一实施例中,第一粒径的裂解介质与第二粒径的裂解介质的体积比为1:1。
在一实施例中,所述试剂盒中真菌细胞壁溶解酶的浓度为0.1~3U/μL,优选为0.12~2.5U/μL,更优选为0.12~2U/μL,更优选为0.12~0.3U/μL。
在一实施例中,所述试剂盒通常是用于微生物裂解的试剂盒。
在一实施例中,所述试剂盒还包含核酸提取试剂、文库构建试剂、测序试剂中的至少一种。核酸提取试剂、文库构建试剂、测序试剂通常可以是购买得到或者自行配制得到。在一实施例中,所述试剂盒可以是用于微生物宏基因组检测的试剂盒。真菌细胞壁溶解酶、裂解介质用于裂解微生物,使其细胞壁破裂。提高宏基因组样本中细菌、真菌的检出效率。核酸提取试剂用于从样本中提取核酸,通常是提取DNA,文库构建试剂则用于构建可上机测序的文库,测序试剂则是在上机测序时使用的试剂。
在一实施例中,所述试剂盒还包括用于独立存放真菌细胞壁溶解酶、裂解介质的容器,真菌细胞壁溶解酶、裂解介质可以存放于不同的容器中,也可以独立存放于同一容器的不同腔室中,使用时再将二者混合。
在一实施例中,所述试剂盒还包含使用说明书,用于指导用户根据本发明第一方面所述的方法对微生物样本进行裂解。
在一实施例中,所述试剂盒还可以包含第一方面所述微生物裂解方法中所使用到的其他试剂。试剂盒中的各个组分可以从市场上购买得到,也可以自行制备并组装。
根据第三方面,在一实施例中,提供一种核酸提取方法,包括对使用第一方面所述方法获得的裂解液进行核酸提取,得到可用于文库构建的核酸。
在一实施例中,所述核酸为DNA。
在一实施例中,物理裂解后,先对待测微生物样本进行离心,然后取上清液进行核酸提取。
在一实施例中,物理裂解后,对待测微生物样本进行离心时,离心条件包括:离心力为2000~8000×g,时间为30~60s。此处离心目的主要是将样本离心下来,简短离心即可。
根据第四方面,在一实施例中,提供一种测序方法,包括对使用第三方面所述核酸提取方法提取得到的核酸进行文库构建、上机测序、数据分析,得到测序结果。文库构建的方法通常可参照测序平台的说明书进行。
在一实施例中,所述测序包括但不限于宏基因组测序、扩增子测序等等。
在一实施例中,所述扩增子测序包括但不限于16S rDNA测序、18S rDNA测序、ITS测序、靶向扩增测序等等。
宏基因组(Metagenome,也称微生物环境基因组Microbial EnvironmentalGenome,或元基因组)是指样本中全部微小生物遗传物质的总和(the genomes of thetotal microbiota found in nature)。它包含了可培养的和未可培养的微生物的基因,通常主要指样本中的细菌和真菌的基因组总和。宏基因组学(或元基因组学,metagenomics)是一种以样本中的微生物群体基因组为研究对象,以功能基因筛选和/或测序分析为研究手段,以微生物多样性、种群结构、进化关系、功能活性、相互协作关系及与环境之间的关系为研究目的的微生物研究方法。宏基因组测序一般包括从样本中提取基因组DNA,进行高通量测序分析等工作。
扩增子测序(又称微生物多样性测序)是利用二代和/或三代测序平台,对16SrDNA、18S rDNA、ITS或功能基因等特定区段PCR产物进行高通量测序,突破传统微生物不可培养的缺点,将得到的序列与特定数据库比对,确认物种,获得样本中的微生物群落结构、进化关系以及微生物与环境相关性等信息。扩增子测序主要包括细菌16S rDNA区、真菌ITS1区/真菌ITS2区/真菌18SrDNA区测序以及后续的数据分析工作。
16S rDNA测序:16SrRNA为核糖体的RNA的一个亚基,16SrDNA就是编码该亚基的基因,存在于所有细菌基因组。16S rDNA大小适中,约1.5Kb左右,同时具有高度的保守性和特异性。16S rDNA既能体现不同菌属之间的差异,又能利用测序技术较容易地得到其序列,目前已被广泛用于病原菌的检测和鉴定。
18S rDNA测序:18S rDNA为编码真核生物核糖体小亚基rRNA的DNA序列。在结构上分为保守区和高变区,保守区反映生物物种间的亲缘关系,高变区反映物种间的差异,18SrDNA在进化速率上相对于ITS更加保守。
ITS测序:在真核生物中,18S rDNA和28S rDNA转录间隔序列称为ITS区。ITS分为两个区域:ITS1、ITS2,ITS1位于18S和5.8S之间,ITS2位于5.8S和28S之间。ITS由于是非转录区,承受的选择压力较小,变异强。
靶向扩增测序是指使用特异性靶向引物扩增目标片段,测序后得到靶向扩增测序序列。
在一实施例中,本发明提供一种宏基因组样本检测的微生物裂解方法,包括将酶解法和珠磨法结合对样本中的微生物细胞壁进行高效裂解。具体包括:1、酶解法裂解:添加高效裂解真菌细胞壁的溶壁酶进行微生物细胞壁的裂解;2、珠磨法裂解:通过测试玻璃珠直径与FastPrep-24
在一实施例中,本发明的方法可以实现对样本中的微生物进行高效破壁,有效提高宏基因组样本检测中细菌、真菌的检出,而且时间短,成本低,通量高,有效提高样本中病原体检出值,适用于不同样本类型的微生物细胞破壁,临床普适性高。
现有的破壁方法中,对于以DNA提取为目的的裂解,裂解效果欠佳,酶解时间较长,研磨参数设计不合理,且酶解后进行玻璃珠研磨需要转管,增加实验时长。
在一实施例中,本发明将酶解法与珠磨法进行结合,在样本提取前进行微生物细胞壁破碎,能够有效提高厚壁微生物以及坚韧细胞壁微生物等的检出效率,比如结核和曲霉,提供了一种有效的宏基因组样本检测的微生物破壁方法。本方法能够对不同类型的临床样本进行破壁前处理,包括脑脊液、肺泡灌洗液、痰液、胸腹水等,而且反应时间较短,酶解与物理破解步骤所需总时间仅约14min(酶解10min,玻璃珠研磨45s*2循环+120s停顿),且反应通量可以达到24个(实施例中使用的fastprep研磨仪的通量为24),满足临床样本检测的交付需求。
实施例1
本实施例分别用实验组1的方法与未破壁处理方法(实验组2)、单独酶解法(实验组3)、单独珠磨法(实验组4)、实验组5的方法(酶添加量为4.5μL)、实验组6的方法(酶添加量为12μL)、实验组7的方法(玻璃珠直径1mm)、实验组8的方法(玻璃珠体积100μL)、实验组9的方法(玻璃珠体积400μL)对同一份样本进行平行测试。本实施例使用模拟样本,为了测试检测流程对微生物检测的全面性,模拟样本配置时,同时将金黄色葡萄球菌(G+)、溶血葡萄球菌(G+)、大肠杆菌(G-)、铜绿假单胞菌(G-)、肺炎克雷伯菌(G-)、嗜麦芽窄食单胞菌(G-)、白色念珠菌(真菌)以及新生隐球菌(真菌)添加到Hela细胞中,使用生理盐水(质量浓度为0.9%的氯化钠水溶液)作为稀释液,得到模拟样本混合液,本实施例配制的模拟样本中Hela细胞以及各微生物的浓度如下表所示。Hela细胞购自北京全式金生物技术有限公司,8种微生物菌株取自北京协和医院,该样本的组成如下表1所示。
表1
实验组1的检测流程如图1所示,具体方法包括以下步骤:
1.酶解法裂解:取450μL样本(按表1将微生物与Hela细胞充分溶解并混匀得到的样本)加入装有250μL玻璃珠(由粒径为0.5mm的玻璃珠与1mm的玻璃珠按照体积比1:1混合得到)的单独旋盖螺帽管中;向样本中加入7.2μL tiangen溶壁酶(加入样本前的原始浓度为10U/μL,购自天根生化科技(北京)有限公司,原始产品名称为Lyticase溶壁酶,货号RT410),涡旋振荡15s后,短暂离心,离心力为8000×g,离心时间为30s。然后置于温浴仪器中,30℃保持10min。将螺帽管从温浴仪中取出,直接进入裂解步骤。
2.珠磨法裂解:将螺帽管放入FastPrep-24
3.核酸提取:将珠磨法裂解后的样本以8000×g的离心力离心30s,取300μL进行核酸(DNA)提取。使用华大生物科技(武汉)有限公司生产的“核酸纯化试剂”(医疗器械备案凭证编号:鄂汉械备20150086号)进行核酸(DNA)提取。
4.MGISEQ平台文库构建:按照MGISEQ-2000平台文库构建说明书进行文库构建。
5.文库质量质控:采用Agilent 2100Bioanalyzer检测仪,操作流程按照Agilent2100Bioanalyzer说明书进行,Agilent 2100检测结果如图2所示。图2中,横坐标表示片段大小,纵坐标表示荧光值。从图2可以看出,文库片段集中且主峰位于200bp~300bp,无小片段接头污染以及大片段拖尾,文库质控合格。
6.MGISEQ平台测序:按照MGISEQ-2000平台测序说明书进行测序。
7.数据分析:下机数据经过数据质控去除低质量序列后,与人源序列库进行对比去除人源序列,剩余序列与参考病原数据库进行对比,生成比对结果。
单独酶解法不进行实验组1的步骤2,其它步骤及实验条件同实验组1。
单独珠磨法不进行实验组1的步骤1,其它步骤及实验条件同实验组1。
实验组2至实验组6均参照实验组1进行,只是个别参数进行了调整。例如,对于实验组2,既不进行酶解,也不进行珠磨,直接进行核酸提取,核酸提取方法同实验组1;对于实验组3,只进行酶解,不进行珠磨,酶添加量为4.5μL,其它操作均同实验组1。实验组4至实验组9同理。
各实验组的说明如下:实验组2为未破壁处理法,实验组3为单独酶解法;实验组4为单独珠磨法;实验组5至实验组9为酶解与珠磨联合,实验组5中,酶的添加量为4.5μL;实验组6中,酶的添加量为12μL;实验组7中,玻璃珠的直径为1mm;实验组8中,玻璃珠体积为100μL;实验组9中,玻璃珠体积为400μL。
添加病原体检出对比结果如图3所示。图3中,纵坐标lg(SDSMRN)是指标准化后严格比对到参考基因组上的测定序列数(standardized stringently mapped readsnumber)取对数。从图3可以看出,相比于实验组1的检测结果,实验组2中未进行破壁处理,病原体检出最少;实验组3或4中,单独酶解法或者单独珠磨法处理后,病原体检出会增加,但是没有酶解法和珠磨法联合检出效果好;实验组5和6中,当酶解法和珠磨法联合,如果酶添加量过少,例如为4.5μL时,会降低病原体的检出,如果酶添加量过多,例如为12μL时,病原体检出也不会增加;实验组7中,使用的是直径为1mm的玻璃珠,从8种微生物的综合检出结果来看,低于实验组1;实验组8和9中,当玻璃珠体积过少或过多时,病原体检出均不佳,因为当玻璃珠过少时,研磨效果不佳,当玻璃珠过多时,相对于450μL样本的反应体系,最后回收的样本会比较少,提取体积减少造成病原体的损失,从而导致检出降低。
实施例2
本实施例使用的核酸提取试剂同实施例1。
本实施例对烟曲霉进行裂解检测,烟曲霉(拉丁名为Aspergillus fumigatus)是一种重要的致病菌,肺曲霉病主要由烟曲霉感染引起。
取1例肺泡灌洗液样本(体积为450μL)进行实验,该样本是使用生理盐水(质量浓度为0.9%的氯化钠水溶液)从人的肺泡中灌洗得到。本实施例参照实施例1的方法,分别用实验组1的方法与未破壁处理方法(实验组2)、单独酶解法(实验组3)、单独珠磨法(实验组4)、实验组5的方法(酶添加量为4.5μL)、实验组6的方法(酶添加量为12μL)、实验组7的方法(玻璃珠直径1mm)、实验组8的方法(玻璃珠体积100μL)、实验组9的方法(玻璃珠体积400μL)对同一份样本进行平行测试。Agilent 2100检测结果如图4所示,可见,文库片段集中且主峰位于200bp~300bp,无小片段接头污染以及大片段拖尾,文库质控合格。病原体检出对比结果如图5所示,从图5可以看出,实验组2未进行破壁处理,曲霉检出最少;实验组3或4中,单独酶解法或者珠磨法处理后,曲霉检出有所增加,但是没有酶解法和珠磨法联合检出效果好;实验组5和6中,当酶解法和珠磨法联合时,如果酶添加量过少,例如为4.5μL时,会降低曲霉的检出,如果酶添加量过多,例如为12μL时,曲霉检出也不会增加;实验组7中,玻璃珠粒径为1mm,病原体检出条数低于实验组1;实验组8和9中,当玻璃珠体积过少或过多,曲霉检出均不佳,因为当玻璃珠过少时,研磨效果不佳,当玻璃珠过多时,相对于450μL样本的反应体系,最后回收的样本会比较少,提取体积减少造成曲霉的损失,从而导致检出降低。
在一实施例中,本发明在样本提取前增加破壁流程,将酶解法和珠磨法进行结合,能够有效破坏微生物细胞壁,从而提高核酸提取效率和病原体检出效率。
在一实施例中,本发明将酶解法和珠磨法结合进行联合裂解,能够有效提高厚壁以及坚韧细胞壁微生物的裂解效果,从而提高核酸提取效率,并提高微生物的检出效率。
以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。对于本发明所属技术领域的技术人员,依据本发明的思想,还可以做出若干简单推演、变形或替换。
- 一种微生物裂解方法及其试剂盒
- 一种宫颈细胞裂解试剂盒及裂解方法
