色氨酸和亮氨酸跨链交互作用β-发卡抗菌肽WLF及制备方法和应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明属于生物技术领域,具体涉及一种色氨酸和亮氨酸跨链交互作用β-发卡抗菌肽WLF及制备方法和应用。
背景技术
由于人们对抗生素的过度使用,逐渐引发耐药细菌的出现,因此开发具有新模式的抗生素替代物至关重要。抗菌肽(Antimicrobial peptides,AMPs)作为传统抗生素代替物引起广泛的关注,抗菌肽的作用机制已经被证实与传统抗生素不同。抗菌肽的两亲结构可以促使它们进入膜内,然后在膜内组装从而使其产生缺陷,释放胞内物质,从而杀死细菌。基于以上特性,使得抗菌肽不易产生耐药性。因此抗菌肽被认为是最有潜力的抗生素替代物之一。
抗菌肽具有多种二级结构,具有高阳离子性和疏水性的α-螺旋抗菌肽研究的十分广泛,但最近研究表明,α-螺旋抗菌肽常常导致其抗菌活性和生物毒性同时增加。而对于另一种主要的二级结构β-折叠抗菌肽的研究却相对较少。主要是由于短肽难以形成稳定的β-发夹结构。许多天然的β-折叠抗菌肽通过半胱氨酸残基形成二硫键从而稳定其结构,但化学合成富含二硫键的β-折叠抗菌肽程序复杂且成本昂贵,二硫键的存在也会增加抗菌肽的毒性。而且,二硫键可以通过与游离的硫醇基团反应在体内裂解,导致抗菌肽的稳定性和生物学活性降低或丧失。不符合抗菌肽廉价、安全、稳定的制备。
发明内容
基于以上不足,本发明提供了一种色氨酸和亮氨酸跨链交互作用β-发卡抗菌肽WLF,采用色氨酸和亮氨酸之间的跨链交互作用代替二硫键,稳定β-发卡抗菌肽的结构,从而解决抗菌肽稳定性差、合成困难、毒性较大的问题。
本发明所采用的技术方案如下:一种色氨酸和亮氨酸跨链交互作用β-发卡抗菌肽WLF,所述的抗菌肽WLF以PG为转角单元,通过色氨酸和亮氨酸之间的跨链交互作用从而稳定β-发卡抗菌肽结构,所述的抗菌肽WLF的C端采用-NH
本发明的另一目的是提供如上所述的一种色氨酸和苯丙氨酸跨链交互作用β-发卡抗菌肽WLF的制备方法,如下:在序列的N端和C端各放置一个苯丙氨酸增加多肽的疏水性,基于β-发卡两亲肽的排布,通过色氨酸和亮氨酸之间的跨链交互作用来辅助PG转角单元形成的β-发卡结构的力,设计出了含有色氨酸和亮氨酸跨链交互作用的β-发卡的多肽模板XWRYRPGRWRYX-NH
本发明的另一目的是提供如上所述的一种色氨酸和亮氨酸跨链交互作用β-发卡抗菌肽WLF在制备治疗由革兰氏阴性菌或/和革兰氏阳性菌引起的感染性疾病的药物中应用。
本发明的原理如下:由于色氨酸具有疏水性,它可以在蛋白质的疏水核心内提供较大的范德华作用。因此,其芳香族部分与带有较长支链的亮氨酸残基具有较高的色氨酸相互作用倾向,取代传统β-发卡抗菌肽中半胱氨酸残基形成的二硫键,从而稳定β-发卡抗菌肽的结构。在带正电荷的氨基酸残基中,精氨酸与色氨酸之间的相互作用比赖氨酸更加频繁,由于精氨酸比赖氨酸更容易参与多肽分子内跨链的cation-π作用,并增加抗菌肽的阳离子性,增大抗菌肽与细菌作用的几率,提高其抑菌活性。
本发明具有以下优点和有益效果:本发明的抗菌肽通过色氨酸和亮氨酸之间的跨链交互作用取代传统二硫键,合成成本较低,序列长度较短,具有较高的抑菌活性同时也具有较高的生物安全性。对抗菌肽进行抑菌活性和溶血活性测定时,发现WLF对大肠杆菌、铜假绿单胞菌、鼠伤寒沙门菌、金黄色葡萄球菌、表皮葡萄球菌、粪肠球菌等多种菌株都具有较强的抑制作用,并且在测定范围内没有发现溶血现象,其治疗指数高达137.27。综上所述,抗菌肽WLF具有成为抗生素替代物的潜力。
附图说明
图1为抗菌肽WLF的高效液相色谱图;
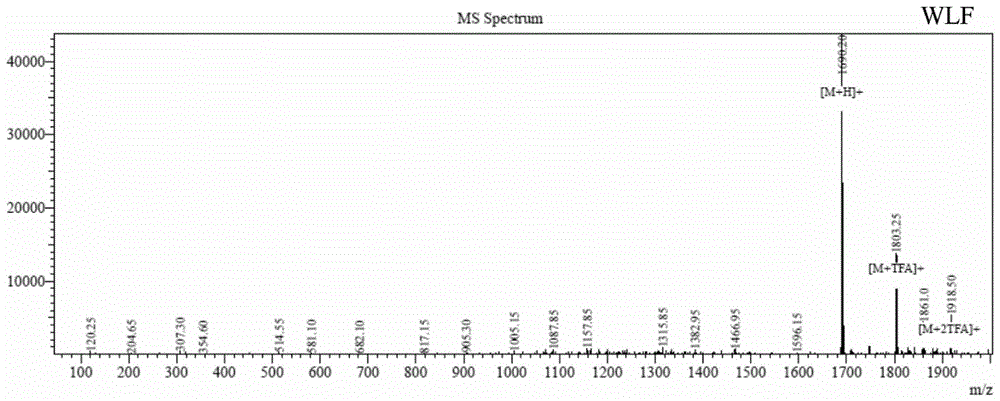
图2为抗菌肽WLF的质谱图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1
多肽WLF的设计
多肽WLF的氨基酸序列如下:
在序列的N端和C端各放置一个苯丙氨酸增加抗菌肽的疏水性,基于β-发卡两亲肽的排布,通过色氨酸和亮氨酸之间的跨链交互作用来辅助PG转角单元形成的β-发卡抗菌肽的结构的力,设计出了含有色氨酸和亮氨酸跨链交互作用的β-发卡抗菌肽模板XWRYRPGRWRYX-NH
表1 多肽的氨基酸序列
其分子式如式(Ⅰ)所示:
多肽WLF的长度为12个氨基酸,两个色氨酸和两个苯丙氨酸提供疏水性,四个精氨酸提供正电荷,将肽的C端酰胺化以提高一个正电荷,总电荷数为+5。该方法设计的抗菌肽具有较高的抑菌活性的同时也具有较低的溶血。
实施例2
固相化学合成法合成多肽WLF
1.抗菌肽的合成是从C端到N端逐一进行的,通过多肽合成仪完成。第一步是将Fmoc-X(X是抗菌肽C端的第一个氨基酸)接入到Wang树脂上,接下来脱去Fmoc基团后得到X-Wang树脂;再将Fmoc-Y-Trt-OH(9-芴甲氧羧基-三甲基-Y,Y为每个抗菌肽C端第二个氨基酸);按照这个流程依次从C端合成到N端,直到合成结束,得到脱去Fmoc基团的侧链保护的树脂;
2.在上述得到的抗菌肽树脂中,加入切割试剂,避光条件下,20℃反应2小时,过滤;得到的沉淀用TFA(三氯乙酸)洗涤,然后将洗液与滤液混合,使用旋转蒸发仪进行浓缩,再加入10倍左右体积的预先冷却的无水乙醚,在-20℃条件下沉淀3小时,析出白色粉末,以2500g离心10min,收集沉淀,再次使用无水乙醚冲洗沉淀,真空干燥,最终得到多肽。其中切割试剂由TFA、H
3.使用0.2mol/L硫酸钠(磷酸pH=7.4)进行柱平衡30min,使用90%的乙腈水溶液溶解多肽,过滤,C18反相常压柱,进行梯度洗脱(洗脱剂为甲醇溶液和硫酸钠水溶液按照体积比为30:70~70:30混合),其流速为1mL/min,检测波长为220nm,收集主峰,冻干;
4.抗菌肽的鉴定:将上述得到的多肽进行电喷雾质谱法分析,质谱图中显示的分子量(如图1所示)与表1中的理论分子量基本一致,且多肽的纯度大于95%(如图2所示)。
实施例3
抗菌肽WLF的生物活性测定
1.抑菌活性测定
(1)菌液的准备:配置MHB培养基,并将其放入高温高压灭菌锅中进行灭菌,用移液枪吸取100μL的菌液加入到灭好的MHB培养基中,在37℃的摇床中培养一夜,次日,从培养的菌液中抽取200μL加入到新的MHB培养基中,放在37℃摇床中培养约3-4h到对数生长期,将二次培养后的菌液用新鲜的MHB培养基校正至光密度OD
(2)稀释液的添加:准备BSA:在100mL的去离子水中加入0.2g BSA和10μL冰醋酸。向圆底透明的聚丙烯96孔板除第一列以外其余各列加入50μL BSA,第一列各孔中加入95μLBSA;
(3)抗菌肽WLF的添加与倍比稀释:向96孔板的第一列加入5μL抗菌肽母液(2.56mM),与BSA混合均匀,用移液枪吸取50μL到第二列再混合。重复此操作直到第10列结束,吸取50μL稀释液弃去;
(4)阳性对照(11列)与阴性对照(12列)的添加:第11列为阳性对照,第12列为阴性对照,加入50μL的MHB;
(5)菌液的接种:将校正好的菌液用MHB稀释1000倍。在前11列加入50μL菌液,用封口膜将96孔板封好后放入37℃恒温培养箱孵育18-24h;
(6)测定结果:通过肉眼观察和酶标仪在OD
表2 抗菌肽WLF的抑菌活性(μM)
通过表2可以看出抗菌肽WLF对革兰氏阴性菌和革兰氏阳性菌均具有较好的抑菌活性。
2.溶血活性的测定
(1)血液的处理:抽取健康志愿者血液于肝素钠抗凝管中,将新鲜血液在4℃、3000-3500g下离心5-10min,用移液枪将上清液抽出,收取红细胞。用过滤好的PBS冲洗红细胞2-3次,离心,收取红细胞。使用约10倍体系重悬红细胞,备用;
(2)稀释液的添加:向圆底透明的聚丙烯96孔板除第一列以外其余各列加入50μLPBS,第一列各孔中加入80μL PBS
(3)抗菌肽的添加与倍比稀释:向96孔板的第一列加入20μL抗菌肽(母液2.56mM),与BSA混合均匀,混匀后吸取50μL加入下一列再混合。以此类推直至到第10列混匀后弃去50μL稀释液;
(4)阴性对照(11列)与阳性对照(12列)的添加:第11列为阴性对照,第12列为阳性对照,加入50μL的0.2% TritanX-100;
(5)红细胞的添加:将50μL制好的红细胞悬液加入到1-12列的各孔中,放置到37℃培养箱静置孵育1h;
(6)将孵育好的96孔板在3000-3500g、4℃离心5-10min,吸取50μL的上清液到一个全新的96孔板中各个对应的圆孔中,测定OD
溶血率(%)=[(样品OD
最小溶血浓度是抗菌肽引起5%溶血率时的浓度。结果见表3。
表3 抗菌肽WLF溶血活性及治疗指数
通过表3表明抗菌肽WLF在检测范围内并未发现溶血活性。使用最小溶血浓度和最小抑菌浓度的几何平均数的比值算为治疗指数,治疗指数为137.27。
