偶联前药、纳米粒、药物组合物及制备方法和应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及一种基于紫杉烷-青蒿素衍生物结构的偶联前药、纳米粒、药物组合物及制备方法和应用,尤其涉及一种溶解性、生物安全性及疗效均显著提升的偶联前药、纳米粒、药物组合物及制备方法和应用。
背景技术
紫杉烷类药物是从红豆杉中分离得到的一种广谱的化疗药物,通过刺激微管蛋白聚合而起作用,从而导致G1或G2/M细胞周期停滞和凋亡,现已广泛用于临床治疗人类多种癌症。其中,最具代表性的紫杉醇(PTX)具有良好的治疗性能,但由于其在水中溶解度差,仅为0.006mg/mL。为了改善紫杉醇的水溶性、常需额外的增溶策略,包括增溶剂和载体的使用。临床使用的紫杉醇注射剂
青蒿素类药物是从植物黄花蒿茎叶中提取的含有过氧化物桥的倍半萜内酯药物,青蒿素类药物被广泛用于治疗疟疾。近年来青蒿素类药物还显示出强大而广泛的抗癌特性,对多种肿瘤都有抗癌作用。青蒿素类药物临床应用的主要障碍是水溶性差、半衰期短和组织分布受限,导致常需要大剂量的青蒿素类化合物才能发挥更大的抗肿瘤作用。
为解决以上药物单一应用的不足,Construction and anti-tumor activitiesof disulfide-linked docetaxel-dihydroartemisinin nanoconjugates(Colloids andSurfaces B:Biointerfaces,191(2020):111018.)公开一种以二硫键偶联的多西他赛-双氢青蒿素前药,具体以3,3'-二硫代二丙酸为6碳连接臂偶联多烯紫杉醇和双氢青蒿素。该药物分子疏水性仍较强,水中溶解性低、分子自组装能力弱,仍需使用高达20%含量的维生素E聚乙二醇琥珀酸酯(TPGS)作为增溶剂和稳定剂,具潜在生物安全性风险。此外,PEGylated-Paclitaxel and Dihydroartemisinin Nanoparticles for SimultaneouslyDelivering Paclitaxel and Dihydroartemisinin to Colorectal Cancer(Pharm Res,(2020)37:129.)还公开一种以PEG偶联的紫杉醇-双氢青蒿素前药,该药物以PEG作为连接臂偶联羧基紫杉醇和青蒿琥酯,合成工艺复杂繁琐;随后将PTX、DHA、卵磷脂和PTX-PEG-DHA通过O/W乳液-溶剂蒸发法制备成纳米脂质体,处方设计和制剂工艺复杂,非纯药分子形式给药,载药量低(<15%),亦仍存在生物安全性风险。因此,现有前药分子虽然在一定程度克服了单一用药的缺陷,但是其应用仍受限于溶解性、安全性及可制备性。
发明内容
发明目的:针对现有紫杉烷-青蒿素衍生物前药存在的药物水溶性差、自组装能力低、制备工艺复杂、生物安全性问题等不足,本发明旨在提供一种能够显著改善水溶性、生物安全性及有效性、制备便捷的紫杉烷-青蒿素衍生物前药、纳米粒、药物组合物及制备方法和应用。
技术方案:作为本发明涉及的第一方面,本发明的偶联前药,具体如下结构
P-L
其中:
P为紫杉烷类化合物去除一个羟基的结构片段,所述紫杉烷类化合物选自紫杉醇、多烯紫杉醇、三尖杉宁碱或10-去乙酰紫杉醇;
A为青蒿素类化合物去除一个羟基的结构片段,所述青蒿素类化合物选自为双氢青蒿素、青蒿琥酯;
X选自-C-C-、-S-、-Se-、-S-S-或-Se-Se-;
m、n选自0或1;
L
优选,上述结构中:n、m之和选自0、1或2,特别是0或2。
更优选地,具体为以下任一化合物:
前药又称前体药物,可基于对药物分子的结构改造改变其水溶性、稳定性等关键的物理性质,同时可经生物体内靶组织转化后恢复药理活性。前体药物递送策略可实现非载体材料依赖的药物增溶、增效减毒。同时,以药物分子作为修饰基团而衍生的前药设计策略,可进一步整合协同增效的联合用药优势。
本发明基于紫杉烷、青蒿素衍生物,通过不同化学连接臂将二者相连,合成工艺简单,易于产业化。经目标连接臂偶联的前药分子水中分散性好、自组装能力强,可通过纳米沉淀法于水相自组装形成稳定的纳米药物,“绿色”解决两类药物水溶性差的缺陷,无需额外的增溶策略,如无须使用增溶剂或载体,避免溶剂和载体材料带来的生物相容性、复杂性、安全性问题。前药纳米粒纳米尺寸适宜、分散均一性好,且具有可控的释药行为,可实现不同药物的时空协同转运,通过多种药理机制协同增效,具有极佳的肿瘤治疗效果和临床转化前景。
上述偶联前药的制备方法如下:
方法一:
A-OH+P-O-CO-(CH
方法二:
P-OH+COCI-(CH
A-OH+P-O-CO-(CH
方法三:
P-OH+COOH-(CH
A-OH+P-O-CO-(CH
方法四:
P-OH+COCI-(CH
A-OH+P-O-CO-(CH
A-OH+COCI-(CH
或
P-OH+A-O-CO-(CH
其中,P、A、X、m、n的定义如前所述。
本发明采用TEA或DIPEA或吡啶作为缚酸剂,催化酸酐、酰氯与羟基之间的亲核取代反应得到酯键,或EDC和4-二甲氨基吡啶(DMAP)作为强亲核催化剂进攻羧基生成稳定的活性中间酯,再与羟基进行缩合反应,得到酯键,从而实现连接臂与两类小分子之间的成功偶联。
制备方法具体如下:
方法一:以酸酐作为连接臂反应
将一定量的含羟基的紫杉烷类化合物溶于反应溶剂中,加入三乙胺作为催化剂,再加入过量的含有-C-C-、-S-、-Se-、-S-S-或-Se-Se-的酸酐作为连接臂,搅拌反应12h。通过柱层析分离得到单端接枝的中间产物;将一定量的中间产物溶于反应溶剂中,冰水浴下加入活化剂EDC、DMAP。活化一段时间后,再加入一定量的含羟基的青蒿素类化合物,搅拌反应24h。通过柱层析分离,即得紫杉烷类-青蒿素类前药分子。
方法二:与两端为酰氯的连接臂反应
将一定量的含羟基的紫杉烷类化合物溶于反应溶剂中,加入三乙胺作为缚酸剂,再加入过量的含有-C-C-、-S-、-Se-、-S-S-或-Se-Se-且两端为酰氯的连接臂,搅拌反应12h。通过柱层析分离得到单端接枝的中间产物;将一定量的含羟基的青蒿素类化合物溶于反应溶剂中,加入三乙胺作为缚酸剂,再加入一定量的中间产物,搅拌反应12h。通过柱层析分离,即得紫杉烷类-青蒿素类前药分子。
方法三:与两端为羧基的连接臂反应
将过量的含有-C-C-、-S-、-Se-、-S-S-或-Se-Se-且两端为羧基的连接臂溶于反应溶剂中,冰水浴下加入活化剂1-乙基-(3-二甲基氨基丙基)碳二亚胺(EDC)和4-二甲氨基吡啶(DMAP)。活化一段时间后,再加入一定量的含羟基的紫杉烷类化合物,搅拌反应24h,通过柱层析分离得到单端接枝的中间产物;将过量的含有一端羧基的中间产物溶于反应溶剂中,冰水浴下加入活化剂EDC、DMAP。活化一段时间后,再加入一定量的含羟基的青蒿素类化合物,搅拌反应24h。通过柱层析分离,即得紫杉烷类-青蒿素类前药分子。
方法四:与一端反应基团为羧基另一端反应基团为酰氯的连接臂反应
将一定量的含羟基的紫杉烷类化合物溶于反应溶剂中,加入三乙胺作为缚酸剂,再加入过量的含有-C-C-、-S-、-Se-、-S-S-或-Se-Se-且一端反应基团为羧基另一端反应基团为酰氯的连接臂,搅拌反应12h。通过柱层析分离得到中间产物;将过量的含有一端羧基的中间产物溶于反应溶剂中,冰水浴下加入活化剂EDC、DMAP。活化一段时间后,再加入一定量的含羟基的青蒿素类化合物,搅拌反应24h。或将一定量的含羟基的青蒿素类化合物溶于反应溶剂中,加入三乙胺作为缚酸剂,再加入过量的含有-C-C-、-S-、-Se-、-S-S-或-Se-Se-且一端反应基团为羧基另一端反应基团为酰氯的连接臂,搅拌反应12h。通过柱层析分离得到中间产物;将过量的含有一端羧基的中间产物溶于反应溶剂中,冰水浴下加入活化剂EDC、DMAP。活化一段时间后,再加入一定量的含羟基的紫杉烷类化合物,搅拌反应24h。通过柱层析分离,即得紫杉烷类-青蒿素类前药分子。
上述制备方法采用的反应溶剂为二氯甲烷、丙酮、甲醇、乙醇、N,N-二甲基甲酰胺、二甲基亚砜溶剂。
作为本发明涉及的第二方面,由上述偶联前药自组装而成纳米粒,其粒径为10~900nm,多分散系数小于0.3,稳定性好。
上述偶联前药溶解后与水混合,去除溶剂,即得所述纳米粒。
制备方法具体如下:
称取适量紫杉烷类-青蒿素类前药分子,溶解到良溶剂得到分子溶液,将该溶液与水相混合,以常规反溶剂沉淀法、溶剂蒸发法、微流控技术、或超声法制备自组装前药纳米粒。采用透析、超滤或蒸发除去溶剂,即制得高效稳定化的自组装前药纳米粒溶液。
更具体地,所述混合时间为1-24h;所述超声频率为80-600W,超声时间是1-1h;所述均质通过高压均质机或微射流均质机实现的,均质压力为200-1200Pa,均质次数为1-30次;所述匀浆是通过匀浆机实现的,转速为1000-9000rpm,匀浆时间为30-300s;所述介质研磨机器转速为400-800rpm,研磨时间为1-10h。所述的药学上可接受的溶剂为二甲亚砜、N,N-二甲基甲酰胺、乙醇、丙酮、甲醇、四氢呋喃、二氯甲烷、三氯甲烷、乙酸乙酯中的一种或多种。
作为本发明涉及的第三方面,上述偶联前药或者其药学上可接受的盐、异构体、溶剂化物或同位素标记物以及药学上可接受的载体形成药物组合物。该药物组合物可以注射剂、片剂、胶囊剂、颗粒剂、粉剂、栓剂、丸剂、乳膏剂、糊剂、凝胶剂、散剂、口服溶液、吸入剂、混悬剂、干悬剂、贴剂、洗剂中的任一种形式存在。
作为本发明涉及的第四方面,上述偶联药物应用于经口服、吸入、注射、眼用、透皮或黏膜给药的预防或/和治疗肿瘤的药物的制备,尤其是应用于预防或/和治疗乳腺癌、肝癌、卵巢癌、结肠癌、肺癌、黑色素瘤、头颈部癌、淋巴瘤、胰腺癌、脑瘤或血癌的药物的制备。
有益效果:与现有技术相比,本发明具有如下显著优点:
(1)实现不同药物的时空协同转运,且具有可控的释药行为,提升肿瘤治疗效果;
(2)提升药物溶解性,无需额外增溶,解决了因溶剂和载体材料导致的生物相容性、制备方法复杂性及安全性问题;
(3)制备方法简单,易于规模化。
附图说明
图1为实施例9制备的紫杉醇-双氢青蒿素前药分子自组装纳米粒(PTX-C-C-DHA)冻干前后的粒径分布及稀释稳定性;
图2为实施例9制备的紫杉醇-双氢青蒿素前药分子自组装纳米粒(PTX-C-C-DHA)冻干前后的胶体稳定性;
图3为实施例9制备的紫杉醇-双氢青蒿素前药分子自组装纳米粒(PTX-C-C-DHA)在空白介质、含酯酶条件下的释放行为;
图4为实施例9制备的紫杉醇-双氢青蒿素前药分子自组装纳米粒(PTX-C-C-DHA)的细胞毒性;
图5为实施例9制备的紫杉醇-双氢青蒿素前药分子自组装纳米粒(PTX-C-C-DHA)的体内药效的瘤重曲线;
图6为实施例9制备的紫杉醇-双氢青蒿素前药分子自组装纳米粒(PTX-C-C-DHA)的在体肿瘤小鼠体重变化。
具体实施方式
下面结合实施例对本发明的技术方案作进一步说明。
实施例1:丁二酸酐相连的紫杉醇-双氢青蒿素前药分子的合成
精密称取过量的丁二酸酐于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入3倍摩尔量TEA,随后逐滴加入二氯甲烷溶解的紫杉醇,室温下搅拌反应12h。随后通过柱层析分离得到中间产物。将所得中间产物溶于无水二氯甲烷中,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的双氢青蒿素,搅拌反应24h。所得目标产物,紫杉醇-双氢青蒿素前药分子同上进行分离纯化,即得酯酶敏感型化学键偶联的紫杉醇-双氢青蒿素前药分子。上述反应全程都在N
合成路线图解如下:
由于青蒿琥酯还是双氢青蒿素与丁二酸酐反应后产物,故实施例1还可以紫杉醇与青蒿琥酯的直接酯化实现。
精密称取一定量的青蒿琥酯于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的紫杉醇,室温下搅拌反应24h。随后通过柱层析分离得到中间产物。即得酯酶敏感型化学键偶联的紫杉醇-双氢青蒿素前药分子。上述反应全程都在N
合成路线图解如下:
实施例2:丁二酰氯相连的多烯紫杉醇-双氢青蒿素前药分子的合成
精密称取适量多烯紫杉醇于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入3倍摩尔量三乙胺。随后逐滴加入过量的无水二氯甲烷溶解的丁二酰氯,室温下搅拌反应24h。随后通过柱层析分离得到单端接枝的中间产物。将所得一定量的双氢青蒿素溶于无水二氯甲烷中,加入3倍摩尔量三乙胺。随后逐滴加入二氯甲烷溶解的中间产物,搅拌反应12h。所得目标产物,多烯紫杉醇-双氢青蒿素前药分子同上进行分离纯化,即得酯酶敏感型化学键偶联的多烯紫杉醇-双氢青蒿素前药分子。上述反应全程都在N
合成路线图解如下:
实施例3:硫代二乙酸相连的多烯紫杉醇-双氢青蒿前药分子的合成
精密称取过量的硫代二乙酸于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的多烯紫杉醇,室温下搅拌反应24h。随后通过柱层析分离得到中间产物。精密称取一定量的中间产物于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的双氢青蒿素,搅拌反应24h。所得目标产物,多烯紫杉醇-双氢青蒿素前药分子同上进行分离纯化,即得氧化还原敏感型化学键偶联的多烯紫杉醇-双氢青蒿素前药分子。上述反应全程都在N
合成路线图解如下:
实施例4:硫代二乙酸相连的三尖杉宁碱-双氢青蒿前药分子的合成
精密称取过量的硫代二乙酸于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的三尖杉宁碱,室温下搅拌反应24h。随后通过柱层析分离得到中间产物。精密称取一定量的中间产物于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的双氢青蒿素,搅拌反应24h。所得目标产物,三尖杉宁碱-双氢青蒿素前药分子同上进行分离纯化,即得氧化还原敏感型化学键偶联的三尖杉宁碱-双氢青蒿素前药分子。上述反应全程都在N
合成路线图解如下:
实施例5:硒基二乙酸相连的多烯紫杉醇-双氢青蒿素前药分子的合成
精密称取过量的硒基二乙酸于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的多烯紫杉醇,室温下搅拌反应24h。随后通过柱层析分离得到中间产物。将所得中间产物溶于无水二氯甲烷中,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的双氢青蒿素,搅拌反应24h。所得目标产物,紫杉醇-双氢青蒿素前药分子同上进行分离纯化,即得酯酶敏感型化学键偶联的紫杉醇-双氢青蒿素前药分子。上述反应全程都在N
合成路线图解如下:
实施例6:硒基二乙酸相连的三尖杉宁碱-双氢青蒿前药分子的合成
精密称取过量的硒基二乙酸于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的三尖杉宁碱,室温下搅拌反应24h。随后通过柱层析分离得到中间产物。精密称取一定量的中间产物于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的双氢青蒿素,搅拌反应24h。所得目标产物,三尖杉宁碱-双氢青蒿素前药分子同上进行分离纯化,即得氧化还原敏感型化学键偶联的三尖杉宁碱-双氢青蒿素前药分子。上述反应全程都在N
合成路线图解如下:
实施例7:2,2'-二硫代二乙酸相连的多烯紫杉醇-双氢青蒿前药分子的合成
精密称取过量的2,2'-二硫代二乙酸于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的多烯紫杉醇,室温下搅拌反应24h。随后通过柱层析分离得到中间产物。精密称取一定量的中间产物于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的双氢青蒿素,搅拌反应24h。所得目标产物,多烯紫杉醇-双氢青蒿素前药分子同上进行分离纯化,即得氧化还原敏感型化学键偶联的多烯紫杉醇-双氢青蒿素前药分子。上述反应全程都在N
合成路线图解如下:
实施例8:2,2'-二硒代二乙酸相连的多烯紫杉醇-双氢青蒿前药分子的合成
精密称取过量的2,2'-二硒代二乙酸于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的多烯紫杉醇,室温下搅拌反应24h。随后通过柱层析分离得到中间产物。精密称取一定量的中间产物于50mL圆底烧瓶中,加入无水二氯甲烷溶解,加入1.5倍摩尔量EDC和等量DMAP,冰浴1-2小时搅拌活化。随后逐滴加入二氯甲烷溶解的双氢青蒿素,搅拌反应24h。所得目标产物,多烯紫杉醇-双氢青蒿素前药分子同上进行分离纯化,即得氧化还原敏感化学键型偶联的多烯紫杉醇-双氢青蒿素前药分子。上述反应全程都在N
合成路线图解如下:
经注射后,易于通过EPR效应富集于肿瘤部位。
实施例12:紫杉醇-双氢青蒿素小分子前药分子自组装纳米粒的体外释放试验
在水浴恒温振动器下,使用pH 7.4的含0.1%Tween-80的PBS缓冲液作为释放介质,将1mL将实施例9紫杉醇-双氢青蒿素前药分子自组装纳米粒(PTX-C-C-DHA)移至空白、含一定量酯酶的20mL释放介质中孵育,在一定时间间隔(0、0.5、1、2、4、6、12、24、36、48h)取0.5mL释放介质并补充新鲜释放介质,考察前药分子自组装纳米粒的药物释放行为,测定药物释放量。
结果如图3所示,通过连接臂两端酯键相连,形成紫杉醇-双氢青蒿素前药分子自组装纳米粒,并不会影响两类药物的释放行为,可以基于肿瘤微环境中酯酶表达高于正常组织,通过酯键水解断裂形式游离释放活性药物,并不因结合而受到限制。
实施例13:紫杉醇-双氢青蒿素前药分子自组装纳米粒的细胞毒性实验
采用MTT法考察实施例9紫杉醇-双氢青蒿素前药分子自组装纳米粒(PTX-C-C-DHA)和紫杉醇注射剂
结果如图4所示,与市售制剂紫杉醇注射剂
实施例14:紫杉醇-双氢青蒿素前药分子自组装纳米粒的体内药效
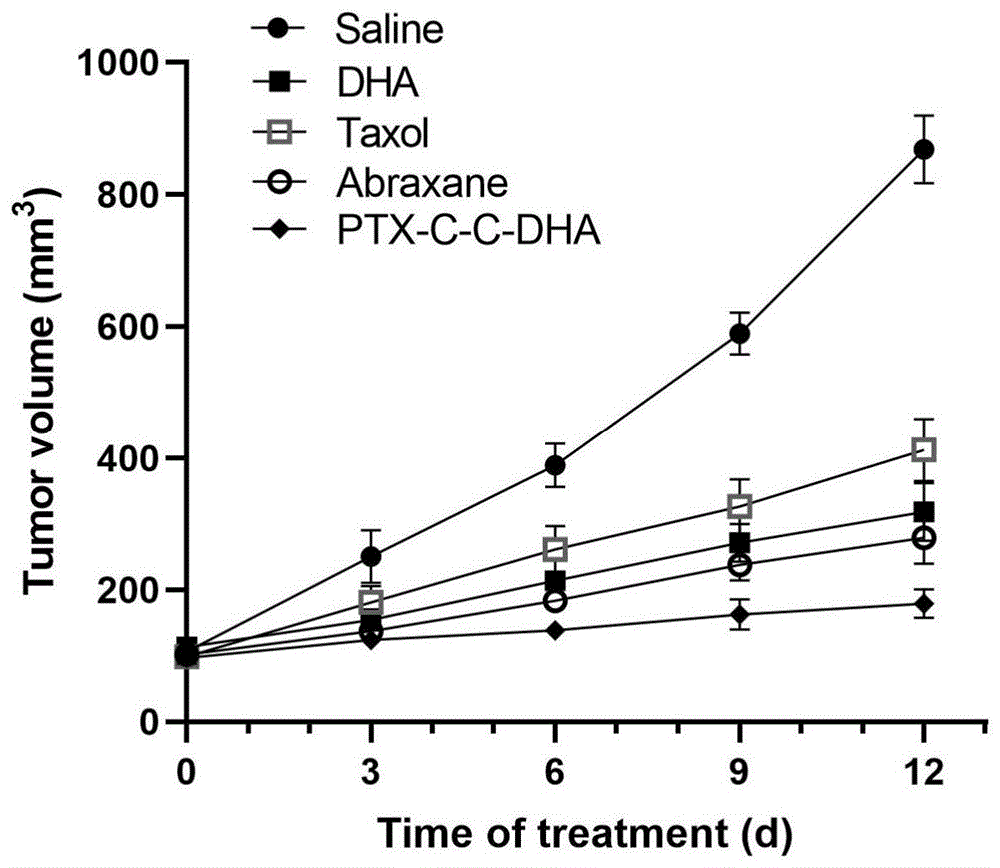
Balb/c小鼠(18-20g)随机分为6组(n=6),原位接种4T1细胞,当肿瘤大小达到100mm
结果如图5所示,实施例9中的前药分子自组装纳米粒的体内抗肿瘤效果与预期效果一致:PTX-C-C-DHA>Taxol>Abraxane>DHA。
结果如图6所示,各组小鼠体重没有明显变化,说明本发明提出的紫杉醇-双氢青蒿素前药纳米粒实现增效减毒的效果;载药量高,水溶性好,避免了毒性较大的增溶剂的使用,有利于减小因辅料和生物材料而引发的不良反应;在具有明显的抗肿瘤效果的同时,没有对机体造成显著的非特异性毒性,是安全有效的抗癌药物传递系统,具有极佳的肿瘤治疗效果和临床转化前景。
- 一种原酸酯5-氟尿嘧啶前药分子、其制备方法及其酸敏感纳米粒和应用
- 一种具有pH响应性的席夫碱共聚物包覆的介孔二氧化硅载药纳米粒子及其制备方法和应用
- 一种基于阿魏酸聚合物的载药纳米粒及其制备方法和应用
- 靶向胎盘样硫酸软骨素A的多肽药物偶联物及其制备方法和应用
- 4’-硫代核苷的新型化合物及其制备方法、药物组合物和应用
- 一种抗厌氧菌化合物的酯类前药、药物组合物及其制备方法和应用
- 多功能前药及其衍生物,制备方法、药物组合物和应用
