一种四氧化三锰预嵌锂中间体及其制备方法和应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于锂离子电池正极材料技术领域,具体涉及锰酸锂正极材料前驱体及制备方法和应用。
背景技术
用四氧化三锰作前驱体合成的锂离子电池正极材料锰酸锂具有容量高、循环与高温性能好、磁性异物低、安全性能好等特点,是制作低成本动力与储能锂离子电池的理想原料。
目前,用四氧化三锰作前驱体合成锰酸锂的工艺路线与三元正极材料一样,均是采用高温固相法,即将四氧化三锰与碳酸锂或氢氧化锂先进行充分的机械混合,然后将混合料装入匣钵中,在空气中置于700℃~850℃的连续炉窑中先进行第一次焙烧10~15小时,冷却与破碎后再进行第二次焙烧10小时左右,再冷却后经粉碎、除铁、过筛等工序制得产品。
高温固相法合成正极材料的优点是:产品理化指标上继承了前驱体的杂质含量低、形貌规整可控等优势,电性能指标上兼顾了克容量高与循环性能好的平衡,而且压实密度高有利于提高电池的能量密度。
用四氧化三锰合成锰酸锂的高温固相法其缺点也比较突出:一是对均混效果的要求高。将四氧化三锰粉末与碳酸锂或氢氧化锂粉末进行机械混合,由于粉体物料在投入量、颗粒大小、比表面积、松装与振实密度等方面的差异,达到微观上的均混效果很难,易于出现局部富锂/贫锂问题。二是工艺流程长。在第一次焙烧完成后再进行第二次焙烧,期间需要进行冷却、粉碎、过筛、重新装钵与投料等操作。三是能耗高。一方面由于保温焙烧温度高于碳酸锂或氢氧化锂的熔融温度,工艺上需要有缓慢的升温程序,避免微观上出现锂源的流挂现象而导致结块与嵌锂不均匀问题,另一方面在达到保温温度后需要足够的时间让锂离子与环境气氛中的氧气迁移到微粉颗粒的内部从而形成均匀稳定的晶体结构。四是质量稳定性差。由于均混效果、升温控制、保温温度与时间等因素的宏观与微观差异,往往同一匣钵的产品,在匣钵的上层与下层之间、匣钵的边缘与中间之间,性能存在明显的差异。
目前,也有很多水热合成锰酸锂的文献报导,主要是将可溶性锰盐与可溶性锂源及可溶性氧化剂混合后置于压力反应器中,经100℃以上的高温带压反应得到纳米级或亚微米级的沉淀物,再经分离与干燥等后处理得到产品。所得产品尽管在容量、循环等部分性能指标上有特色,但颗粒尺寸、形貌、比表面积等指标不可控,且产品大多夹杂有反应原料所带来的阴离子或阳离子杂质,影响产品品质与电性能,没有形成实际应用。
发明内容
本发明所要解决的技术问题是,克服以上背景技术中提到的不足和缺陷(例如工艺流程长、能耗高、产品均匀性控制难度大等),提供一种四氧化三锰预嵌锂中间体及其制备方法,通过湿法过程完成锰元素的部分氧化与锂离子在前驱体中的预嵌,还提供该四氧化三锰预嵌锂中间体的应用,将中间体在高温氧化性气氛中短时间内完成晶体结构转化,从而制得嵌锂均匀、性能优异的锰酸锂正极材料。
为解决上述技术问题,本发明提出的技术方案为一种四氧化三锰预嵌锂中间体,所述预嵌锂中间体包括四氧化三锰相和预嵌的锂元素,所述锂元素是以锂锰氧化物相包覆或嵌入到四氧化三锰相中,所述预嵌锂中间体中预嵌的锂元素与其中的锰元素的摩尔比与基于该预嵌锂中间体制备的目标锰酸锂材料中的锂元素与锰元素化学计量比保持一致。本发明提出的预嵌锂中间体经过一次焙烧即可实现结构转化,得到结构稳定的尖晶石型锰酸锂正极材料。
上述的四氧化三锰预嵌锂中间体,所述锂锰氧化物可能为一种或多种,我们将该预嵌锂中间体样品在氮气环境下进行差热扫描后发现,在420℃以前失重不到2%,说明结构水含量低;而将其在氧气环境中进行差热扫描,在250℃~613℃之间,质量增加约2%,说明中间体有吸氧的过程,这也表明在预嵌锂中间体合成过程中通入了氧气,使锂锰氧化物相中锰的价态高于四氧化三锰中的锰的平均价态。更优选的,所述锂锰氧化物主要包含Li
上述的四氧化三锰预嵌锂中间体,虽然我们可以基本测定其中的物相,但考虑不同工艺条件下锂锰氧化物生成的复杂性以及不同XRD图峰位的可能差异性,我们认为优选的,所述预嵌锂中间体的XRD衍射图谱满足以下条件可视为符合本发明的优选要求:2θ在18.5°±0.5°处有一强度大于600cps的衍射峰;2θ在44.5°±0.5°处有一强度大于200cps(优选大于400cps)的衍射峰,2θ在58°~66°范围内至少有三个(优选3-4个)强度在80-260cps范围内的衍射峰。
上述的四氧化三锰预嵌锂中间体,优选的,所述预嵌锂中间体是四氧化三锰与锂源在通氧条件下经过水热反应后制备得到。该优选的方案是先在通氧的情况下进行四氧化三锰与锂源(例如氢氧化锂)的水热反应得到预嵌锂的中间体,然后对预嵌锂中间体进行焙烧从而实现结构转化,得到结构稳定的尖晶石型锰酸锂正极材料。
作为一个总的技术构思,本发明还提供一种四氧化三锰预嵌锂中间体的制备方法,包括以下步骤:
将四氧化三锰、锂源、水投入压力反应釜中,在通氧条件下(不限于纯氧气),控制釜内温度在100℃以上,釜内表压在0.1MPa以上,搅拌条件下反应充分完全,得到预嵌锂中间体;
所述锂源的投入量是根据该预嵌锂中间体制备的目标锰酸锂材料中锂元素与锰元素化学计量比来确定。
本发明的上述制备方法对四氧化三锰进行水热反应嵌锂,且以通氧(例如持续通入氧气)作为必要条件,使四氧化三锰中的锰元素被氧化为更高价态进而实现嵌锂。经过本发明的水热反应,几乎所有的四氧化三锰微观颗粒都能实现锂离子的预嵌,且彻底解决了固相法合成时易出现的嵌锂不均匀现象。
上述的制备方法,优选的,所述锂源为氢氧化锂。选择氢氧化锂是因为其碱性较强,有利于增进四氧化三锰的氧化,且不会引入其它新的杂质或生成新的气体产物,避免反应气氛的变化或反应压力的不可控。更优选的,所述氢氧化锂选用粒径小于10mm(更优选小于5mm)的颗粒料。氢氧化锂原料投入量基本上是根据目标锰酸锂材料的化学计量比来确定,特别是根据投入压力反应釜的四氧化三锰质量与目标锰酸锂中的锂锰比,基本可以确定氢氧化锂的投入量。由于本发明采用湿法水热反应,所用氢氧化锂不必使用粒度很细的微粉,用粒径小于10mm的颗粒料即可达到预嵌锂效果,同时减小了球磨、粉碎等操作步骤及降低了能耗。
上述的制备方法,优选的,所述四氧化三锰与水的质量比控制在1∶0.3~10。本发明制备方法的反应体系浓度,以四氧化三锰与水的质量比例来进行控制,如果太浓稠,则不利进行搅拌,如果太稀薄,则需要更高的反应温度和更长的反应时间,我们反复的实验表明,前述优选的质量比范围达到的效果较佳。
上述的制备方法,优选的,所述釜内温度控制在110℃~250℃,反应时间控制在4~12小时。优选是选定前述温度范围内的某个温度值进行恒温反应,一般地,温度选取的越高,反应所需的时间越短;但我们的试验表明,如果温度过高,则会因反应过快而出现颗粒表层产生絮状物现象,会影响最终的预嵌锂效果。生产上尽管优选控制为恒温,但温度值在一定范围内波动也是允许的,波动范围大小主要取决于温控设备的调控精度。
上述的制备方法,优选的,所述压力釜内表压控制在0.2~5.0MPa,且通入氧气后釜内压力超过相应釜内温度下水蒸汽的饱和蒸气压。本发明控制的预嵌锂釜内反应温度超过了100℃,而考虑水的蒸气压原因,压力反应釜内本是有压力存在,因此优选通入氧气后釜内压力超过相应釜内温度下水蒸汽的饱和蒸气压,否则,通氧效果难以得到保障。至于通氧后釜内压力高出反应温度下水蒸汽的饱和蒸气压多少程度,我们不作特别要求,以能确保氧气能顺利进入釜内即可,但也无需保持过高压力氛围以避免安全风险。
上述的制备方法,优选的,向所述压力反应釜内通氧气是连续进行,且从反应物料开始升温时就进行通氧,通氧前对压力反应釜内进行排空气操作。我们的试验表明,在完成投料后、升温至目标反应温度前,最好先进行排空气操作,否则,压力反应釜内上部的空气会随反应釜内温度的上升而产生较大的压力,影响对通氧压力的调控。而排空气的操作可以采用先抽真空再通氧气的方式,优选通过连续通氧气来排空气。连续通氧可通过调节氧气的稳压阀实现,操作时,使压力反应釜内的压力高于反应温度下的水蒸汽的饱和蒸气压,直至反应时间结束。
为了得到较好的循环性能,通常添加过量的锂使部分锰离子位置被锂离子替代,形成非化学计量比的锰酸锂,其化学通式可以表述为Li
其中,预嵌锂的锂锰氧化物优选主要以分子式Li
作为一个总的技术构思,本发明还提供一种上述本发明的四氧化三锰预嵌锂中间体的应用,将所述预嵌锂中间体的干料或湿料在有氧气氛(所述的有氧气氛可以是空气、氧气或二者的混合)下进行焙烧,焙烧完全并完成晶体结构转化后,得到尖晶石型锰酸锂正极材料。
在以上的整个技术路线中,先在压力反应釜内反应生成预嵌锂中间体浆料,再对浆料进行固液分离(固液分离的方式可以为抽滤、压滤或离心分离),即可得到预嵌锂中间体。我们的试验表明,可以将预嵌锂中间体先进行干燥然后再进行焙烧,也可以将预嵌锂中间体的湿料直接进行焙烧,都可制得晶体结构完好的尖晶石型锰酸锂产品。
无论是使用预嵌锂中间体的干料或湿料,其反应式为:
上述本发明的焙烧过程需要从环境气氛中补充氧气,才能进行相变得到结构稳定的尖晶石型锰酸锂。由于在预嵌锂中间体中,已经完成了锰元素的部分氧化,需要从环境气氛中吸收的氧气较固相法合成会少很多,因此焙烧工艺的条件可以进一步简化。
上述的应用,优选的,选择所述预嵌锂中间体的湿料进行焙烧,所述湿料的含水率在30%以下。一般而言,湿料的含水率跟物料特性(包括粒度、比表面积、颗粒密实性等)及分离方式等有关,但考虑到本发明工艺路线的特点,通过适当控制含水率,以湿料不成泥、易松散、易扒平为宜,采用简单的抽滤、压滤或离心分离操作控制含水率在30%以下即可实现焙烧,30%的含水率湿料在现有工艺路线中是难以进行直接焙烧的,因为会严重影响锰酸锂产品的品质,但在本发明特定的工艺路线下,焙烧合成的升温阶段水分会被蒸发,且基于预嵌锂中间体的特性,该湿料的直接焙烧也不会对锰酸锂产品有负面影响,相比先干燥后焙烧的两步操作,直接焙烧湿料可能更简化操作和节省能耗。
上述的应用,优选的,所述焙烧的焙烧温度为700℃~850℃,焙烧的时间为3~10小时。由于锂离子已经预嵌到中间体中,本发明较常规固相法合成,焙烧时间可以缩短一半以上。
上述的应用,优选的,通过以大于5℃/分钟的升温速率快速升温至所述的焙烧温度范围。由于锂离子已经预嵌到微观颗粒内部,不存在固相法合成时易产生锂源的流挂问题,所以本发明的工艺路线可以省去缓慢升温的过程,以较快的升温速率是可以接受的。工业生产时,一般固相法焙烧控制的升温速率为3℃~5℃/分钟,而本发明方法的升温速率可不受此限制,在生产设备允许的情况下,升温速率可优选大于10℃/分钟。
与现有技术相比,本发明的有益效果为:
1)采用本发明的四氧化三锰预嵌锂中间体制得的锰酸锂正极材料,从XRD图上可以看出,衍射峰均很尖锐、信噪比高,表明结晶度好、无杂相,为纯相尖晶石型晶体结构。
2)经本发明的四氧化三锰预嵌锂中间体制得的锰酸锂正极材料,其微观颗粒保持了前驱体的形貌,粒度分布上也保持了前驱体的分布特性,实现了物料颗粒的均匀嵌锂,避免了已有常规固相法合成时存在的局部富锂/贫锂与结块问题,保证了产品质量的一致性,提高了产品的克容量与循环性能。
3)由于本发明已经在预嵌锂中间体中实现了锂离子的嵌入,不存在锂源物质的流挂而导致的结块现象,焙烧完成后,物料颜色均匀、蓬松易碎,不需要进行破碎,适合直接进行过筛处理。
综上,本发明方法制得的正极材料产品保留了前驱体的形貌与粒度特征,实现了物料颗粒的均匀嵌锂,避免了固相法合成时存在的局部富锂/贫锂与结块问题,保证了质量一致性,提高了产品的克容量与循环性能。同时,与固相法合成工艺比较,本方法简化了混合与二次焙烧工艺,缩短了高温焙烧时间,降低了能源消耗,提高了焙烧设备的产能。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
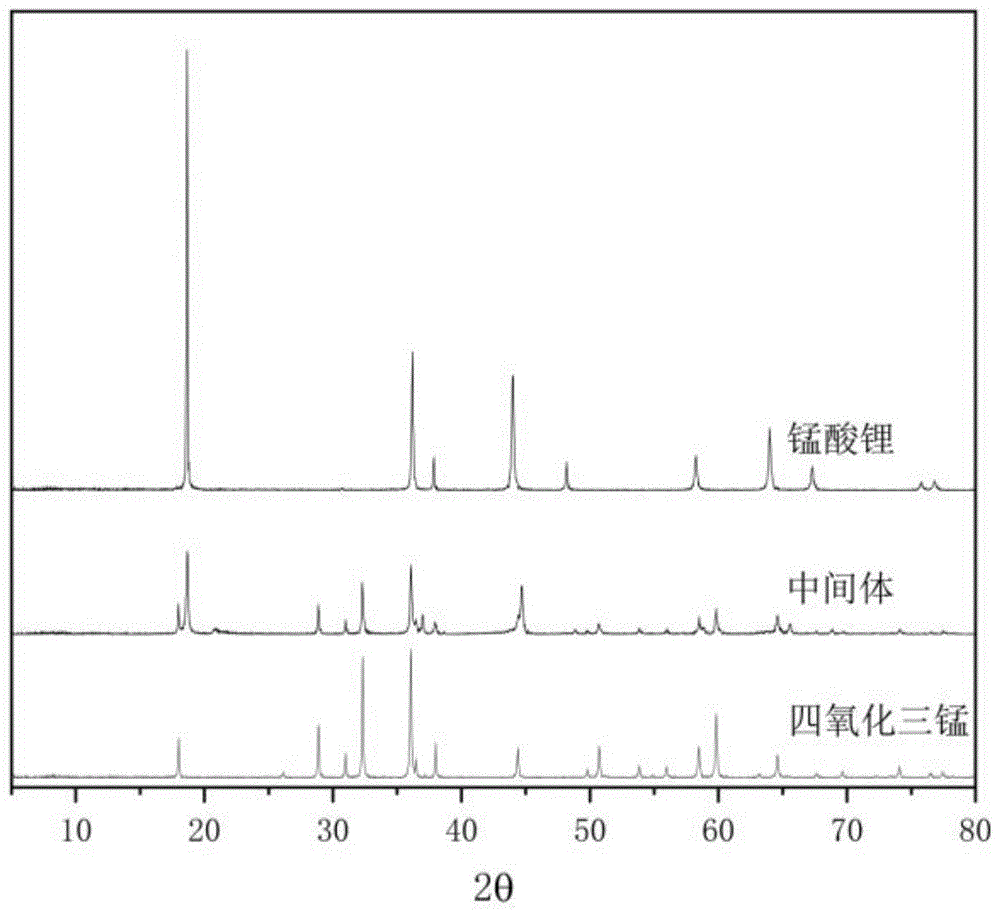
图1为本发明实施例1中四氧化三锰原材料、预嵌锂中间体与锰酸锂产品的XRD比较图。
图2为本发明实施例1中四氧化三锰原材料的微观形貌SEM图。
图3为本发明实施例1中预嵌锂中间体的微观形貌SEM图。
图4为本发明实施例1中锰酸锂产品的微观形貌SEM图。
图5为本发明实施例2的预嵌锂中间体在氮气中的TG-DSC图。
图6为本发明实施例2的预嵌锂中间体在氧气中的TG-DSC图。
图7为本发明实施例3中四氧化三锰原材料的粒度分布图。
图8为本发明实施例3中预嵌锂中间体的粒度分布图。
图9为本发明实施例3中锰酸锂产品的粒度分布图。
图10为本发明实施例1中预嵌锂中间体的XRD图。
图11为本发明实施例2中预嵌锂中间体的XRD图。
图12为本发明实施例3中预嵌锂中间体的XRD图。
图13为本发明实施例4中预嵌锂中间体的XRD图。
图14为本发明实施例2中前驱体四氧化三锰材料颗粒剖切SEM图。
图15为本发明实施例2中预嵌锂中间体的微观形貌SEM图。
图16为本发明实施例2中预嵌锂中间体材料颗粒剖切SEM图。
图17为本发明实施例2中锰酸锂产品颗粒剖切SEM图。
图18为现有固相法制备的锰酸锂产品颗粒剖切SEM图。
图19为本发明各实施例的预嵌锂中间体的XRD对比图。
具体实施方式
为了便于理解本发明,下文将结合说明书附图和较佳的实施例对本发明做更全面、细致地描述,但本发明的保护范围并不限于以下具体实施例。
除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。
以下实施例中:锂元素含量的检测采用ICP-AES方法,锰元素含量的检测采用硫酸亚铁铵滴定法(见GB/T21836-2008附录A)。
以下实施例中,扣电性能的检测方法可以为:按锰酸锂:PVDF:石墨:乙炔黑=9:0.6:0.2:0.2配比,以金属锂片作为负极制作成CR2016扣式电池,在25℃温度环境、3.0V~4.3V充放电区间进行电性能测试,先检测0.2C首次、再进行1C(设定锰酸锂材料1C=120mA/g)循环。
实施例1:
一种本发明的四氧化三锰预嵌锂中间体的制备方法,包括以下步骤:
按四氧化三锰∶水的固液质量比1:5的比例,将1000g锰含量为69.2%、粒度D50为11.4μm的球形四氧化三锰与310g粒径小于1mm、含量为56.5%的氢氧化锂(单水氢氧化锂)及5L纯水,加入到10L容积的衬镍压力反应釜中,接入高压氧气,向压力反应釜内通氧气是连续进行,且从反应物料开始升温时就进行通氧,通氧前对压力反应釜内进行排空气操作;在釜内温度210℃、釜内表压为2.5MPa压力下搅拌反应5小时,然后冷却降温至80℃以下后,移出反应产物,进行抽滤得到预嵌锂中间体。
经检测,预嵌锂中间体湿料的含水率为21%,其粒度D50为11.6μm,将滤饼于120℃下干燥24小时,干燥后的干料的锂含量为4.46%、锰含量为61.5%。
将300g上述制备的预嵌锂中间体干料(或湿料)平铺于刚玉匣钵内,置于空气气氛炉中,以大于5℃/min的升温速度升温至750℃后保温5小时,然后断电冷却至100℃以下后出炉,将物料过120目筛得到304g(选用湿料则为240g)锰酸锂正极材料。经检测,锰酸锂正极材料的粒度D50为12.1μm,锂含量为4.35%,锰含量为60.1%,锂锰摩尔比为0.57:1。
通过XRD图比较本实施例中四氧化三锰原材料、制备的预嵌锂中间体产品和最终制备的锰酸锂产品,其XRD图如图1、图10所示。该图1的锰酸锂产品的XRD表明,产物为纯锰酸锂,无杂相,该图10的XRD表明,预嵌锂中间体产品是由Mn
通过粒度分布图比较,本实施例中四氧化三锰原材料、制备的预嵌锂中间体产品和最终制备的锰酸锂产品发现,预嵌锂中间体产品(其粒度D50为11.6μm)和四氧化三锰原材料(其粒度D50为11.4μm)的粒度分布基本一致,而最终制备得到的锰酸锂正极材料也基本沿袭了预嵌锂中间体产品和四氧化三锰原材料的粒度分布,其粒度D50为12.1μm。
通过微观形貌的SEM图比较本实施例中四氧化三锰原材料、制备的预嵌锂中间体产品和最终制备的锰酸锂产品,如图2~图4所示,四氧化三锰原材料、预嵌锂中间体产品和最终制备的锰酸锂产品的形貌均为规则的球形颗粒,微观形貌良好,产品均匀性和一致性好。
基于以上的检测及分析,我们认为上述实施例制备得到了一种四氧化三锰预嵌锂中间体,其包括四氧化三锰相和预嵌的锂元素,锂元素是以锂锰氧化物(Li
表1:本实施例中前驱体、中间体及锰酸锂的产品组分配比变化
/>
本实施例最终制备得到的锰酸锂产品的化学式为Li
将上述制备得到的锰酸锂进行扣电检测:
检测结果如下:
0.2C克容量113mAh/g,1C容量112mAh/g,25℃循环50次,容量保持率95%,循环100次,容量保持率92%。
实施例2:
一种本发明的四氧化三锰预嵌锂中间体的制备方法,包括以下步骤:
按四氧化三锰∶水的固液质量比1:2的比例,将3000g锰含量约为69.8%、粒度D50为8.1μm的球形四氧化三锰与899g粒径小于1mm、含量为56.5%的氢氧化锂及6L纯水,加入到10L容积的衬镍压力反应釜中,接入高压氧气,向压力反应釜内通氧气是连续进行,且从反应物料开始升温时就进行通氧,通氧前对压力反应釜内进行排空气操作;在釜内温度160℃、釜内表压为0.6MPa压力下搅拌反应10小时,然后冷却降温至80℃以下后,移出反应产物,进行抽滤得到预嵌锂中间体湿料。
经检测,预嵌锂中间体湿料的含水率为20.5%,其粒度D50为9.4μm,将其干燥后的干料的锂含量为4.49%、锰含量为60.9%。
将300g上述制备的预嵌锂中间体干料(或湿料)平铺于刚玉匣钵内,置于空气气氛炉中,以大于5℃/min的升温速度升温至790℃后保温5小时,然后断电冷却至100℃以下后出炉,将物料过120目筛得到307g(选择湿料时为244g)锰酸锂正极材料。经检测,锰酸锂正极材料的粒度D50为9.5μm,锂含量为4.40%,锰含量为59.6%,锂锰摩尔比为0.58:1。
图11是本实施例预嵌锂中间体的XRD图,其表明预嵌锂中间体产品是由Mn
通过粒度分布图比较本实施例中四氧化三锰原材料、制备的预嵌锂中间体产品和最终制备的锰酸锂产品发现,预嵌锂中间体产品(其粒度D50为9.4μm)和四氧化三锰原材料(其粒度D50为8.1μm)的粒度分布基本一致,而最终制备得到的锰酸锂正极材料也基本沿袭了预嵌锂中间体产品和四氧化三锰原材料的粒度分布,其粒度D50为9.5μm。
通过微观形貌的SEM图比较本实施例中四氧化三锰原材料、制备的预嵌锂中间体产品和最终制备的锰酸锂产品,四氧化三锰原材料、预嵌锂中间体产品和最终制备的锰酸锂产品的形貌均为规则的球形颗粒,微观形貌良好,产品均匀性和一致性好。
基于以上的检测及分析,我们将本实施例的预嵌锂中间体样品在氮气环境下进行差热扫描后发现,在420℃以前失重不到2%,说明结构水含量低(参见图5);而将其在氧气环境中进行差热扫描,在250℃~613℃之间,质量增加约2%(参见图6),说明中间体吸氧的结果,这表明尽管在预嵌锂中间体合成过程中通入了氧气,但氧元素并没有足量到位,需要在后续的晶体结构转化过程中进行补充。
我们认为上述实施例制备得到了一种四氧化三锰预嵌锂中间体,其包括四氧化三锰相和预嵌的锂元素,锂元素是以锂锰氧化物(Li
另外,通过对比本实施例制备得到的四氧化三锰预嵌锂中间体和四氧化三锰的剖切电镜图(参见图14-图16),我们发现预嵌锂中间体的外层明显生成了不同于内核层的晶体状物质(即锂锰氧化物相),而内核层则与四氧化三锰相基本一致,这进一步证实了本实施例预嵌锂中间体包覆型结构的形成。
本实施例最终制备得到的锰酸锂产品的化学式为Li
表2:本实施例中前驱体、中间体及锰酸锂的产品组分配比变化
将上述制备得到的锰酸锂进行扣电检测:
检测结果如下:
0.2C克容量110mAh/g,1C容量109mAh/g,25℃循环50次,容量保持率98%,100次容量保持率97%。
实施例3:
一种本发明的四氧化三锰预嵌锂中间体的制备方法,包括以下步骤:
按四氧化三锰∶水的固液质量比1:3的比例,将1000g锰含量为70.1%、粒度D50为9.7μm的球形四氧化三锰与310g粒径小于1mm、含量为56.5%的氢氧化锂及3L纯水,加入到5L容积的衬镍压力反应釜中,接入高压氧气,向压力反应釜内通氧气是连续进行,且从反应物料开始升温时就进行通氧,通氧前对压力反应釜内进行排空气操作;在釜内温度180℃、釜内表压为2.0MPa压力下搅拌反应7小时,然后冷却降温至80℃以下后,移出反应产物,进行抽滤得到预嵌锂中间体湿料,并将滤饼于120℃干燥24小时得到预嵌锂中间体干料。
经检测,预嵌锂中间体的粒度D50为10.2μm,将其干燥后的干料的锂含量为4.32%、锰含量为61.8%。
将500g上述制备的预嵌锂中间体干料平铺于莫来石匣钵内,置于空气气氛炉中,以大于5℃/min的升温速度升温至750℃后保温5小时,然后断电冷却至100℃以下后出炉,将物料过120目筛得到503g锰酸锂正极材料。经检测,锰酸锂正极材料的粒度D50为11.1μm,锂含量为4.21%,锰含量为59.9%,锂锰摩尔比为0.55:1。
图12是本实施例的预嵌锂中间体的XRD图,其表明预嵌锂中间体产品是由Mn
通过粒度分布图比较本实施例中四氧化三锰原材料、制备的预嵌锂中间体产品和最终制备的锰酸锂产品发现(参见图7、图8和图9),预嵌锂中间体产品(其粒度D50为10.2μm)和四氧化三锰原材料(其粒度D50为9.7μm)的粒度分布基本一致,而最终制备得到的锰酸锂正极材料也基本沿袭了预嵌锂中间体产品和四氧化三锰原材料的粒度分布,其粒度D50为11.1μm。
通过微观形貌的SEM图比较本实施例中四氧化三锰原材料、制备的预嵌锂中间体产品和最终制备的锰酸锂产品,四氧化三锰原材料、预嵌锂中间体产品和最终制备的锰酸锂产品的形貌均为规则的球形颗粒,微观形貌良好,产品均匀性和一致性好。
基于以上的检测及分析,我们认为上述实施例制备得到了一种四氧化三锰预嵌锂中间体,其包括四氧化三锰相和预嵌的锂元素,锂元素是以锂锰氧化物(Li
表3:本实施例中前驱体、中间体及锰酸锂的产品组分配比变化
本实施例最终制备得到的锰酸锂产品的化学式为Li
将上述制备得到的锰酸锂进行扣电检测:
检测结果如下:
0.2C克容量115mAh/g,1C容量114mAh/g,25℃循环50次,容量保持率95%,100次容量保持率91%。
实施例4:
一种本发明的四氧化三锰预嵌锂中间体的制备方法,包括以下步骤:
按四氧化三锰∶水的固液质量比1:2.5的比例,将2000g锰含量为70.1%、粒度D50为10.4μm的球形四氧化三锰与606g粒径小于1mm、含量为56.5%的氢氧化锂及5L纯水,加入到10L容积的衬镍压力反应釜中,接入高压氧气,向压力反应釜内通氧气是连续进行,且从反应物料开始升温时就进行通氧,通氧前对压力反应釜内进行排空气操作;在釜内温度180℃、釜内表压为2.0MPa压力下搅拌反应6小时,然后冷却降温至80℃以下后,移出反应产物,进行抽滤得到预嵌锂中间体湿料,并将滤饼于120℃干燥24小时得到预嵌锂中间体干料。
经检测,预嵌锂中间体的粒度D50为9.9μm,锂含量为4.27%、锰含量为62.0%。
将500g上述制备的预嵌锂中间体干料平铺于莫来石匣钵内,置于空气气氛炉中,以大于5℃/min的升温速度升温至790℃后保温5小时,然后断电冷却至100℃以下后出炉,将物料过120目筛得到515g锰酸锂正极材料。经检测,锰酸锂正极材料的粒度D50为10.9μm,锂含量为4.16%,锰含量为60.2%,锂锰摩尔比为0.54:1。
图13是本实施例的预嵌锂中间体的XRD图,其表明预嵌锂中间体产品是由Mn
通过粒度分布图比较本实施例中四氧化三锰原材料、制备的预嵌锂中间体产品和最终制备的锰酸锂产品发现,预嵌锂中间体产品(其粒度D50为9.9μm)和四氧化三锰原材料(其粒度D50为10.4μm)的粒度分布基本一致,而最终制备得到的锰酸锂正极材料也基本沿袭了预嵌锂中间体产品和四氧化三锰原材料的粒度分布,其粒度D50为10.9μm。
通过微观形貌的SEM图比较本实施例中四氧化三锰原材料、制备的预嵌锂中间体产品和最终制备的锰酸锂产品,四氧化三锰原材料、预嵌锂中间体产品和最终制备的锰酸锂产品的形貌均为规则的球形颗粒,微观形貌良好,产品均匀性和一致性好。
基于以上的检测及分析,我们认为上述实施例制备得到了一种四氧化三锰预嵌锂中间体,其包括四氧化三锰相和预嵌的锂元素,锂元素是以锂锰氧化物(Li
表4:本实施例中前驱体、中间体及锰酸锂的产品组分配比变化
本实施例最终制备得到的锰酸锂产品的化学式为Li
将上述制备得到的锰酸锂进行扣电检测:
检测结果如下:
0.2C克容量121mAh/g,1C容量120mAh/g,25℃循环50次,容量保持率94%,100次容量保持率91%。
如图19所示,为以上各实施例的预嵌锂中间体的XRD对比图,由图19可见,尽管预嵌锂的量有所不同,但各中间体的XRD图均具有共同的特征峰,均含有Mn
