GIS型沸石
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及GIS型沸石。
背景技术
沸石能够用作吸附剂、干燥剂、分离剂、催化剂、催化剂用载体、洗涤剂助剂、离子交换剂、废水处理剂、肥料、食品添加剂、化妆品添加剂等,其中作为气体分离用途是有用的。
沸石中,以IZA(国际沸石协会,International Zeolite Association)制定的用于规定沸石结构的代码来表示为GIS结构的物质被称为GIS型沸石。GIS型沸石是由氧8元环构成的具有细孔的沸石。该GIS型沸石例如记载于专利文献1~4和非专利文献1~6中。
专利文献1中记载了为了有效利用煤燃烧灰的灰渣而合成GIS型沸石的内容,专利文献2中记载了在铝板的表面形成沸石覆膜(GIS型沸石)而提高导热性的内容。
另外,专利文献3中,通过优化GIS型沸石的晶体结构而得到了二氧化碳的吸附量最大为52.4cc/g的GIS型沸石。此外,专利文献4中,通过改变X射线衍射的峰位置、即改变晶体结构,而得到了二氧化碳的吸附量最大为67.5cc/g的GIS型沸石。
其次,非专利文献1、2和3中示出了氧化硅-氧化铝的GIS型沸石。非专利文献4中示出了包含磷酸的硅铝磷酸盐的GIS型沸石,观察到其吸附二氧化碳并且吸附氧、氮、甲烷。非专利文献5和6示出了氧化硅-氧化铝比(SAR:SiO
现有技术文献
专利文献
专利文献1:日本特开平06-340417号公报
专利文献2:日本特表2012-519148号公报
专利文献3:国际公开第2018/110559号
专利文献4:国际公开第2019/202933号
非专利文献
非专利文献1:Matthew D.Oleksiak,Arian Ghorbanpour,Marlon T.Conato,B.Peter McGrail,Lars C.Grabow,Radha Kishan Motkuri,Jeffrey D.Rimer“SynthesisStrategies for Ultrastable Zeolite GIS Polymorphs as Sorbents for SelectiveSeparations”Chem.Eur.J.2016,22,16078-16088.
非专利文献2:Pankaj Sharma,Jeong-gu Yeo,Moon Hee Han,Churl Hee Cho“Knobby surfaced,mesoporous,single-phase GIS-NaP1 zeolite microspheresynthesis and characterization for H2 gas adsorption”J.Mater.Chem.A,2013,1,2602-2612.
非专利文献3:Pankaj Sharma,Jeong-gu Yeo,Moon Hee Han,Churl Hee Cho“GIS-NaP1 zeolite microspheres as potentialwater adsorption material:Influence of initialsilicaconcentration on adsorptive and physical/topologicalproperties”Sci.Rep.2016,6,1-26.
非专利文献4:Arturo J.Hernandez-Maldonado,Ralph T.Yang,DanielChinn,Curtis L.Munson.“Partially Calcined Gismondine Type SilicoaluminophosphateSAPO-43:Isopropylamine Elimination and Separation of Carbon Dioxide,HydrogenSulfide,and Water”Langmuir 2003,19,2193-2200.
非专利文献5:Johann Kecht,B.Mihailova,K.Karaghiosoff,S.Mintova,andThomas Bein.“Nanosized Gismondine Grown in ColloidalPrecursor Solutions”Langmuir2004,20,5271-5276.
非专利文献6:Ulf Hakansson,Lars Falth,Staffan Hansen“Structure ofaHigh-Silica Variety of Zeolite Na-P”ActaCryst.(1990).C46,1363-1364.
发明内容
发明所要解决的课题
若着眼于GIS型沸石的二氧化碳吸附能力,例如若能够从发电厂、炼钢厂的废气中除去二氧化碳,则也能够削减二氧化碳排放量。
另一方面,专利文献1~2中并未提及利用沸石吸附二氧化碳的内容,根据这些文献中示出的结构分析结果,不能说清晰地形成了用于吸附二氧化碳所需要的晶体结构。即,可认为专利文献1~2所述的沸石的二氧化碳吸附能力不充分。
非专利文献1~2所记载的沸石中,几乎未观察到二氧化碳的吸附,不能基于二氧化碳的吸附或气体透过进行分离。作为其主要原因,据认为是由于,GIS型沸石的8元环发生变形,形成长轴为
非专利文献3中记载了硅铝磷酸盐的GIS型沸石,由于键距、键角与氧化硅-氧化铝的情况不同,因此8元环细孔稍大,虽观察到了二氧化碳的吸附,但该吸附量还不能说足够高。
非专利文献4记载的沸石在二氧化碳的吸附量方面也不能说是处于足够的水平。
非专利文献5和6中并未提及二氧化碳等的吸附性能,本发明人对于根据这些文献的记载合成出的沸石进行了分析,结果表明,在X射线衍射中不能形成适合于二氧化碳的吸附的结构,不能发挥出GIS型沸石的二氧化碳吸收性能。
另外,专利文献3~4得到了二氧化碳的吸附量在一定程度上较多的GIS型沸石,但对于高温下的吸附量并未进行充分研究。此处,在通过使用吸附剂的变压式吸附分离法、变温式吸附分离法、或者变压-变温式吸附分离法进行二氧化碳的分离、回收的情况下,除了最大吸附量以外,还需要通过对吸附剂进行加热或进行抽真空而使二氧化碳脱附并再生,再生时的二氧化碳的脱附量多这一点也是重要的。
如上文所述,通过使用在从废气等中进行二氧化碳分离时(小于100℃、例如在常温程度的温度气氛下)二氧化碳的最大吸附量多、并且再生时(100℃以上的高温下)二氧化碳的脱附量多的吸附剂,在通过变压式吸附分离法、变温式吸附分离法或者变压-变温式吸附分离法进行二氧化碳的分离、回收的情况下,具有能够减少吸附剂的需要量的倾向,能够实现吸附塔的小型化等,被认为在经济上具有优越性,但在专利文献1~4和非专利文献1~6等现有技术中,并未发现具有这样的性能的吸附剂(沸石)。
本发明是鉴于上述情况而完成的,其目的在于提供室温附近的二氧化碳(CO
用于解决课题的手段
本发明人为了解决上述课题反复进行了深入研究,结果发现,在GIS型沸石的碳浓度和氧化硅-氧化铝比处于规定的范围、并且在供于X射线衍射测定而得到的衍射图谱中特定衍射峰的高度比处于规定值的范围的情况下,能够解决该课题,从而实现了本发明。
即,本发明如下所述。
[1]
一种GIS型沸石,其碳原子的含量为4质量%以下、并且氧化硅-氧化铝比为4.23以上,其中,
在通过X射线衍射得到的图谱中,满足下述条件(i)和(ii)中的至少一者。
(i)将2θ=12.45°附近和2θ=28.07°附近的峰值高度分别设为A和B时,0.62≤A/B;
(ii)将2θ=28.07°附近和2θ=46.04°附近的峰值高度分别设为B和C时,11.5≤B/C。
[2]
如[1]中所述的GIS型沸石,其包含氧化硅-氧化铝。
[3]
如[1]或[2]所述的GIS型沸石,其包含H和碱金属元素作为抗衡阳离子。
[4]
一种吸附剂,其包含[1]~[3]中任一项所述的GIS型沸石。
[5]
一种分离方法,其中,使用[4]中所述的吸附剂,从包含选自由H
[6]
如[5]中所述的分离方法,其中,通过变压式吸附分离法、变温式吸附分离法或者变压-变温式吸附分离法进行上述气体的分离。
[7]
一种精制气体的制造方法,其中,使用[4]中所述的吸附剂,从包含选自由H
[8]
一种GIS型沸石的制造方法,其包括下述工序:
混合凝胶的制备工序,该混合凝胶含有包含硅的氧化硅源、包含铝的铝源、包含选自碱金属(M1)和碱土金属(M2)中的至少一种的碱源、包含磷的磷源、以及水;以及
水热合成工序,将上述混合凝胶在80℃~145℃的温度进行水热合成,
上述制备工序中得到的上述混合凝胶中,SiO
上述GIS型沸石中,碳原子的含量为4质量%以下,并且氧化硅-氧化铝比为4.23以上。
发明的效果
根据本发明,能够提供室温附近的二氧化碳(CO
附图说明
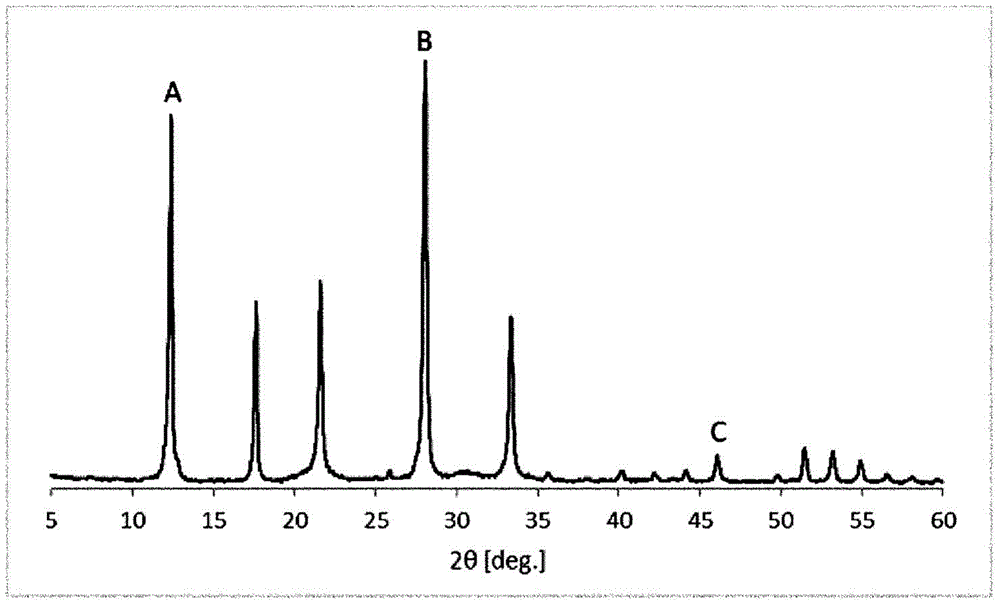
图1是实施例1中得到的GIS型沸石的X射线衍射(XRD)图。
图2是例示出本发明的一个实施方式的吸附剂的图。
具体实施方式
以下对本发明的具体实施方式(下文中称为“本实施方式”)进行详细说明。本发明并不限于以下的记载,可在其要点的范围内进行各种变形来实施。
本实施方式的第1方式的GIS型沸石(下文中也称为“第一GIS型沸石”)是碳原子的含量为4质量%以下、氧化硅-氧化铝比为4.23以上的GIS型沸石,其中,在通过X射线衍射得到的图谱中满足下述条件(i):
(i)将2θ=12.45°附近和28.07°附近的峰值高度分别设为A和B时,0.62≤A/B。
另外,本实施方式的第2方式的GIS型沸石(下文中也称为“第二GIS型沸石”)是碳原子的含量为4质量%以下、氧化硅-氧化铝比为4.23以上的GIS型沸石,其中,在通过X射线衍射得到的图谱中满足下述条件(ii):
(ii)将2θ=28.07°附近和46.04°附近的峰值高度分别设为B和C时,11.5≤B/C。
下文中,只要不特别声明,在称为“本实施方式的GIS型沸石”时,包括第一GIS型沸石和第二GIS型沸石。
即,本实施方式的GIS型沸石是碳原子的含量为4质量%以下、氧化硅-氧化铝比为4.23以上的GIS型沸石,在通过X射线衍射得到的图谱中满足下述条件(i)和(ii)中的至少一方:
(i)将2θ=12.45°附近和28.07°附近的峰值高度分别设为A和B时,0.62≤A/B;
(ii)将2θ=28.07°附近和46.04°附近的峰值高度分别设为B和C时,11.5≤B/C。
本实施方式的GIS型沸石由于按上述构成,因此室温附近的二氧化碳的吸附量多,并且加热时的二氧化碳的吸附量少。在具有这样的特性的GIS型沸石中,在二氧化碳吸附后进行加热再生时发生脱附的二氧化碳量多,能够有效地回收二氧化碳。
需要说明的是,本实施方式的GIS型沸石中,清晰地形成了8元环结构,能够充分吸附二氧化碳,并且通过成为适当的氧化硅-氧化铝比,亲水性即极性降低,二氧化碳的吸附力也适度地降低,因此认为加热再生时发生脱附的二氧化碳增加。
本实施方式的GIS型沸石中的氧化硅-氧化铝比(为由SiO
另外,上述SAR可以通过后述实施例中记载的方法进行测定。另外,例如可以通过将GIS型沸石的合成中使用的混合凝胶的组成比等调整为后述的优选范围等而将上述SAR调整为上述的范围。
本实施方式的GIS型沸石中,在合成时可以使用有机结构导向剂,由于有机结构导向剂会留在细孔内、填埋二氧化碳所进入的空间,因此二氧化碳的吸附量会减少,因而优选对用量进行调整。有机结构导向剂或者其改性而得到的物质的定量可以通过测定碳原子量来进行。从上述方面出发,碳原子的含量为4质量%以下、优选为3质量%以下、更优选为2质量%以下。
另外,上述碳原子的含量可以通过后述实施例中记载的方法进行测定。另外,例如可以通过将GIS型沸石的合成中使用的混合凝胶的组成比等调整为后述的优选范围等而将上述碳原子的含量调整为上述范围。
本实施方式中,从进一步提高二氧化碳的选择性吸附能力的方面出发,GIS型沸石优选包含氧化硅-氧化铝。
需要说明的是,本实施方式的GIS型沸石中,优选氧化硅和氧化铝为主成分(80质量%以上)。主成分是指占80质量%以上的成分。
本实施方式的GIS型沸石中的铝的含量优选为1质量%以上、更优选为3质量%以上、进一步优选为5质量%以上。作为铝的含量的上限,只要SAR满足上述的规定范围就没有特别限定,通过氧化硅含量和SAR的值来确定。
本实施方式的GIS型沸石中的硅的含量优选为3质量%以上、更优选为5质量%以上。作为硅的含量的上限,只要SAR满足上述的规定范围就没有特别限定,根据氧化铝含量和SAR的值来确定。
本实施方式的GIS型沸石中的磷的含量优选为4质量%以下。作为磷的含量的下限没有特别限定,可以为0质量%以上。
本实施方式的GIS型沸石中的Zr的含量优选为8质量%以下。作为Zr的含量的下限没有特别限定,可以为0质量%以上。
本实施方式的GIS型沸石中的Ti的含量优选为8质量%以下。作为Ti的含量的下限没有特别限定,可以为0质量%以上。
从进一步提高二氧化碳的选择性吸附能力的方面出发,本实施方式的GIS型沸石中的磷原子的含量更优选为1.5质量%以下、特别优选为0质量%。
另外,关于上述铝、硅、磷、Zr和Ti的含量,可以通过后述实施例中记载的方法进行测定。另外,关于上述铝、硅、磷、Zr和Ti的含量,例如可以通过将GIS型沸石的合成中使用的混合凝胶的组成比等调整为后述的优选范围等而将该含量调整为上述的范围。
(X射线衍射峰)
关于第一GIS型沸石,在通过X射线衍射得到的图谱中,(i)将2θ=12.45°附近和28.07°附近的峰值高度分别设为A和B时,满足0.62≤A/B。2θ=12.45°附近的峰代表性地在12.30°以上且小于12.55°的范围进行观测,2θ=28.07°附近的峰代表性地在2θ=27.82°以上且小于28.32°的范围进行观测。
本实施方式的GIS型沸石在25℃的X射线衍射峰中,2θ=12.45°附近和28.07°附近的峰分别为(1 0 1)和(3 0 1)的衍射峰。(1 0 1)的衍射峰是反映GIS型沸石的氧8元环的周期结构的衍射,(3 0 1)的衍射峰是反映0.3176nm的周期结构的衍射,该周期相当于由沸石中的氧化硅的单元结构即O-Si-O形成的周期。将(1 0 1)和(3 0 1)的衍射峰的高度分别设为A、B时,A/B大的情况表示,以沸石中的氧化硅基本结构为基准的情况下,更大的周期结构、即包含8元环结构的结构是清晰的。通过清晰地形成了8元环结构,能够形成具有可内包气体分子的空间的细孔结构,并且可得到只有小于二氧化碳的分子进入到细孔内的分子筛效果。即,可认为,即使为高SAR的GIS型沸石,也具有大量的能够在室温附近包藏二氧化碳的空间,能够在室温附近具有高的二氧化碳吸附量。
从上述的方面出发,A/B的值优选为0.63以上、更优选为0.68以上。A/B的值的上限没有特别限定,例如可以为2.00以下。
另外,从与上述同样的方面出发,后述的第二GIS型沸石可以进一步满足上述范围。
关于第二GIS型沸石,在通过X射线衍射得到的图谱中,(ii)将2θ=28.07°附近和46.04°附近的峰值高度分别设为B和C时,满足11.5≤B/C。2θ=46.04°附近的峰代表性地为在45.64°以上且小于46.46°的范围观测到的(5 0 1)的衍射峰,反映了比(3 0 1)的峰更微细的结构。
B/C大的情况下,表示沸石中的作为氧化硅的单元结构的O-Si-O在以比其更微细的周期结构为基准的情况下形成而无缺损,表示由8元环结构形成的能够内包二氧化碳的空间的壁上的二氧化碳会发生逸出的孔少,即使在为高SAR、二氧化碳的吸附力降低的情况下,也可留住吸附在细孔内的二氧化碳,认为能够维持二氧化碳的吸附量。
从上述的方面出发,B/C的值优选为12.8以上、更优选为15.7以上。B/C的值的上限没有特别限定,例如可以为35.0以下。
从与上述同样的方面出发,第一GIS型沸石可以进一步满足上述范围。
需要说明的是,上述A/B和B/C的值可以通过后述实施例中记载的方法进行测定,均可通过将混合凝胶的组成比、混合凝胶的熟化时间、水热合成时的条件(加热温度、加热时间)等调整为后述的优选范围的方法等将它们调整为上述范围。
关于GIS型沸石,在通过X射线衍射得到的图谱中,通过在2θ=12.45°附近、28.07°附近以及46.04°附近具有峰,CO
本实施方式中的有效吸附容量越大,越能够减少例如在CO
从上述的方面出发,本实施方式中的有效吸附容量优选为42cc/g以上、更优选为45cc/g以上、进一步优选为48cc/g以上。本实施方式中的有效吸附容量的上限没有特别限定,例如可以为180cc/g以下。需要说明的是,有效吸附容量的测定方法基于实施例中记载的方法。
通过X射线衍射得到的峰半峰宽表示发生该衍射的晶格面的结晶性,优选该半峰宽狭窄。本实施方式的GIS型沸石在通过X射线衍射得到的图谱中,2θ=12.45°附近的峰半峰宽优选为0.45deg以下、更优选为0.40deg以下、进一步优选为0.35deg以下。另外,从同样的方面出发,本实施方式的GIS型沸石在通过X射线衍射得到的图谱中,在2θ=28.07°附近的峰半峰宽优选为0.80deg以下、更优选为0.70deg以下、进一步优选为0.60deg以下。此外,从同样的方面出发,本实施方式的GIS型沸石在通过X射线衍射得到的图谱中,2θ=46.04°附近的峰半峰宽优选为0.95deg以下、更优选为0.85deg以下、进一步优选为0.75deg以下。
根据通过具有上述这样的峰半峰宽而暗示出的GIS型沸石的结构可以推定,不会发生二氧化碳的吸附位点的缺损,并且可减少因细孔壁的缺损所致的二氧化碳的脱附,由此能够较高地维持二氧化碳的吸附量。
需要说明的是,关于上述峰半峰宽的值,均可以通过将混合凝胶的组成比、混合凝胶的熟化时间、水热合成时的条件(加热温度、加热时间)等调整为后述的优选范围的方法等而将其调整为上述范围。
本实施方式的GIS型沸石可以包含H以及碱金属元素作为抗衡阳离子。作为碱金属元素,例如可以举出锂、钠、钾、铷、铯。这些之中,优选碱金属元素。
本实施方式的GIS型沸石中,从维持GIS型沸石的8元环椭圆结构的方面出发,GIS型沸石中的碱金属元素的含量相对于GIS型沸石总量优选为0.1质量%以上、更优选为0.3质量%以上、进一步优选为0.6质量%以上。另一方面,从防止杂质的生成、防止GIS型沸石的结晶性降低的方面出发,GIS型沸石中的碱金属元素的含量优选为35质量%以下、更优选为34质量%以下、进一步优选为33质量%以下。
上述抗衡阳离子的含量可以通过后述实施例中记载的方法进行测定,可以通过将混合凝胶的组成比调整为后述的优选范围的方法等而将其调整为上述范围。
上述碱金属元素中,更优选钠。
本实施方式中,从维持GIS型沸石的8元环椭圆结构的方面出发,GIS型沸石中的钠的含量相对于GIS型沸石总量优选为0.1质量%以上、更优选为0.3质量%以上、进一步优选为0.6质量%以上。另一方面,从防止杂质的生成、防止GIS型沸石的结晶性降低的方面出发,GIS型沸石中的钠的含量优选为35质量%以下、更优选为34质量%以下、进一步优选为33质量%以下。
(制造方法)
本实施方式的GIS型沸石的制造方法没有特别限定,例如可以包括混合凝胶的制备工序,该混合凝胶含有包含硅的氧化硅源、包含铝的铝源、包含选自碱金属(M1)和碱土金属(M2)中的至少一种的碱源、包含磷的磷源、以及水。本实施方式的GIS型沸石的制造方法更具体地说包括下述工序:混合凝胶的制备工序,该混合凝胶含有包含硅的氧化硅源、包含铝的铝源、包含选自碱金属(M1)和碱土金属(M2)中的至少一种的碱源、包含磷的磷源、以及水;以及水热合成工序,将上述混合凝胶在80℃~145℃的温度进行水热合成,上述制备工序中得到的上述混合凝胶中,SiO
以下首先对混合凝胶及其中包含的各成分进行说明。
[混合凝胶]
本实施方式中的混合凝胶是包含氧化硅源、铝源、碱源以及水作为成分的混合物。混合凝胶也可以包含磷源、有机结构导向剂,但优选为尽可能少量。
氧化硅源是指构成由该混合凝胶制造出的沸石中所包含的硅的原料的、该混合凝胶中的成分,铝源是指构成由该混合凝胶制造出的沸石中所包含的铝的原料的、该混合凝胶中的成分,碱源是指构成由该混合凝胶制造的沸石中所包含的碱金属和/或碱土金属的原料的、该混合凝胶中的成分,磷源是指构成由该混合凝胶制造出的沸石中所包含的磷的原料的、该混合凝胶中的成分。
[氧化硅源]
作为氧化硅源,只要是通常使用的氧化硅源就没有特别限定,作为具体例,可以举出硅酸钠、无定形氧化硅、胶态氧化硅、湿式法氧化硅、干式法氧化硅、硅胶、无定形硅酸铝凝胶、四乙氧基硅烷(TEOS)、三甲基乙氧基硅烷等。这些化合物可以单独使用,也可以将复数种组合使用。此处,无定形硅酸铝凝胶是氧化硅源、同时也是铝源。
这些之中,由于倾向于得到结晶度高的沸石的原因,优选硅酸钠。
[铝源]
作为铝源,只要是通常使用的铝源就没有特别限定,作为具体例,可以举出铝酸钠、硫酸铝、硝酸铝、乙酸铝、氢氧化铝、氧化铝、氯化铝、铝醇盐、金属铝、无定形硅酸铝凝胶等。这些化合物可以单独使用,也可以将复数种组合使用。
这些之中,由于倾向于得到结晶度高的沸石的原因,优选铝酸钠、硫酸铝、硝酸铝、乙酸铝、氢氧化铝、氯化铝、铝醇盐。从同样的方面出发,更优选铝酸钠、氢氧化铝,进一步优选铝酸钠。
[碱源]
碱源中的碱的种类没有特别限定,可以使用任意的碱金属化合物和/或任意的碱土金属化合物。
碱源可以举出但不限于例如碱金属或碱土金属的氢氧化物、碳酸氢盐、碳酸盐、乙酸盐、硫酸盐、硝酸盐等。这些化合物可以单独使用、也可以将复数种组合使用。
作为碱源使用的碱金属和碱土金属通常可以使用Li、Na、K、Rb、Cs、Ca、Mg、Sr、Ba等。从GIS型骨架的结晶形成变得更容易的方面出发,优选Na、K,更优选Na。另外,作为碱源使用的碱金属和碱土金属可以单独使用、也可以将复数种组合使用。
具体地说,作为碱源,可以举出但不限于例如氢氧化钠、乙酸钠、硫酸钠、硝酸钠、碳酸钠、碳酸氢钠、氢氧化钾、乙酸钾、硫酸钾、硝酸钾、碳酸钾、碳酸氢钾、氢氧化锂、乙酸锂、硫酸锂、硝酸锂、碳酸锂、碳酸氢锂、氢氧化铷、乙酸铷、硫酸铷、硝酸铷、碳酸铷、碳酸氢铷、氢氧化铯、乙酸铯、硫酸铯、硝酸铯、碳酸铯、碳酸氢铯、氢氧化钙、乙酸钙、硫酸钙、硝酸钙、碳酸钙、碳酸氢钙、氢氧化镁、乙酸镁、硫酸镁、硝酸镁、碳酸镁、碳酸氢镁、氢氧化锶、乙酸锶、硫酸锶、硝酸锶、碳酸锶、碳酸氢锶、氢氧化钡、乙酸钡、硫酸钡、硝酸钡、碳酸钡、碳酸氢钡等。
这些之中,优选氢氧化钠、氢氧化钾、氢氧化锂、氢氧化铷、氢氧化铯、氢氧化钙、氢氧化镁、氢氧化锶、氢氧化钡,更优选氢氧化钠、氢氧化钾、氢氧化锂、氢氧化铷、氢氧化铯,进一步优选氢氧化钠。
[磷源]
作为磷源,只要是通常使用的磷源就没有特别限定,作为具体例,可以举出磷酸水溶液、磷酸钠、磷酸铝、磷酸钾、磷酸锂、磷酸钙、磷酸钡等。这些化合物可以单独使用,也可以将复数种组合使用。
这些之中,由于倾向于得到结晶度高的沸石的原因,优选磷酸水溶液、磷酸钠、磷酸铝。从同样的方面出发,更优选磷酸水溶液、磷酸钠,进一步优选磷酸水溶液。
[有机结构导向剂]
在将混合凝胶通过水热合成来制造沸石的情况下,有机结构导向剂为对于结晶化成沸石结构起到促进作用的化合物。在沸石的结晶化中,可以根据需要使用有机结构导向剂。
有机结构导向剂只要可形成所期望的GIS型沸石,无论任何种类均可。另外,有机结构导向剂可以单独使用、也可以将复数种组合使用。
作为有机结构导向剂,可以使用但不限于例如胺类、季铵盐类、醇类、醚类、酰胺类、烷基脲类、烷基硫脲类、氰基烷烃类、包含氮作为杂原子的脂环式杂环化合物类,优选使用烷基胺类,更优选使用异丙胺。
这样的盐伴随有阴离子。作为这样的阴离子的代表,包括但不限于例如Cl
[混合凝胶的组成比]
本实施方式中,为了合成具有适当的SAR、并且具有适当的结构的GIS型沸石,混合凝胶中的铝源与水之比、以及OH
上述OH
若水比(H
从上述的方面出发,H
混合凝胶中的氧化硅源与铝源之比以各元素的氧化物的摩尔比、即SiO
该混合凝胶中的SiO
混合凝胶中的铝源与碱源之比以M1
从能够抑制具有与GIS型骨架不同的骨架的沸石形成的方面出发,(M1
混合凝胶中的磷源与铝源之比以各元素的氧化物的摩尔比、即P
该P
混合凝胶中包含有机结构导向剂的情况下,混合凝胶中的铝源与有机结构导向剂之比以有机结构导向剂相对于Al
如上所述,本实施方式的GIS型沸石的制造方法包括混合凝胶的制备工序,该混合凝胶含有包含硅的氧化硅源、包含铝的铝源、包含选自碱金属(M1)和碱土金属(M2)中的至少一种的碱源、磷源、以及水,针对上述硅、铝、碱金属(M1)和碱土金属(M2)、磷源以各元素的氧化物的形式计算出上述混合凝胶中的各成分的摩尔比时,优选下式(1)、(2)、(3)、(4)和(5)所表示的摩尔比α、β、γ、δ、ε满足3.0≤α≤70.0、1.5≤β≤15.0、0≤γ<1.0、250≤δ≤780和95≤ε≤480,更优选满足3.5≤α≤65.0、1.6≤β≤12.0、0≤γ<0.6、260≤δ≤778和98≤ε≤475,进一步优选满足4.0≤α≤60.0、1.65≤β≤10.0、0≤γ<0.4、270≤δ≤775和100≤ε≤472。本实施方式的GIS型沸石特别优选通过上述的制造方法得到。
α=SiO
β=(M1
γ=P
δ=H
ε=H
此外,本实施方式的GIS型沸石的制造方法中,优选摩尔比α、β、γ、δ、ε满足上述范围,并且在混合凝胶进一步包含有机结构导向剂R的情况下,下式(6)所表示的摩尔比ε满足ζ≤4。
ζ=R/Al
在混合凝胶中并非必须存在晶种,但也可以将预先制造的GIS型沸石作为晶种添加到混合凝胶中,得到本实施方式的GIS型沸石。
[混合凝胶的制备工序]
混合凝胶的制备工序没有特别限定,例如可以包括将氧化硅源、铝源、碱源、水、以及必要时的有机结构导向剂一次性混合或以多阶段进行混合的混合工序;以及该混合工序中所得到的混合物的熟化工序。
混合工序中,可以将包含氧化硅源、铝源、碱源、水、以及必要时的有机结构导向剂的这些成分一次性混合或以多阶段进行混合。
以多阶段进行混合时的顺序没有限定,可以根据所使用的条件适宜地选择。在以多阶段进行混合时,在搅拌或无搅拌下均可进行。
进行搅拌时,只要是通常使用的搅拌方法就没有特别限定,作为具体例,可以举出使用桨搅拌、振动搅拌、摆动搅拌、离心式搅拌等的方法。
搅拌的旋转速度只要是通常使用的搅拌速度就没有特别限定,例如可以举出1rpm以上且小于2000rpm。
混合工序的温度只要是通常使用的温度就没有特别限定,例如可以举出-20℃以上且小于80℃。
混合工序的时间没有特别限定,可以根据混合工序的温度适宜地选择,例如可以举出大于0分钟且为1000小时以下。
熟化工序在静置或者搅拌下均可进行。
在熟化工序中进行搅拌时,只要是通常使用的搅拌方法就没有特别限定,作为具体例,可以举出使用桨搅拌、振动搅拌、摆动搅拌、离心式搅拌等的方法。
搅拌的旋转速度只要是通常使用的搅拌速度就没有特别限定,例如可以举出1rpm以上且小于2000rpm。
熟化工序的温度只要是通常使用的温度就没有特别限定,例如可以举出-20℃以上且小于80℃。
熟化工序的时间没有特别限定,可以根据熟化工序的温度适宜地选择,例如可以举出大于0分钟且为1000小时以下。
据认为,沸石在原料的混合工序、熟化工序中产生了原料的溶解、以及沸石前体的生成和再溶解。为了形成包含8元环的大周期结构而不产生缺陷,优选不过度地进行沸石前体的形成。另外,在过度地进行了沸石的前体的形成的情况下,作为更稳定的结构的ANA型沸石的生成趋于增加,因此也优选不进行过度熟化。另一方面,优选将原料充分混合,原料凝胶呈均匀的状态。关于混合工序与熟化工序合在一起的时间,只要基于原料的组成等适宜地调整以得到适当结构的沸石即可,没有特别限定。上述时间代表性地优选为1分钟以上且小于24小时,更优选为3分钟以上且小于23小时,进一步优选为10分钟以上18小时以下、更进一步优选为12分钟以上15小时以下、再优选为20分钟以上6小时以下。
[水热合成工序]
本实施方式的GIS型沸石的制造方法中,优选进一步包括水热合成温度为80℃~145℃的水热合成工序,该水热合成温度更优选为80℃~140℃。即,优选将通过制备工序得到的混合凝胶在规定的温度下以搅拌或静置状态保持规定的时间来进行水热合成。
水热合成的温度只要是通常使用的温度就没有特别限定,从合成时间缩短、沸石制造时的经济性优异的方面出发,优选为80℃以上。从能够抑制具有与GIS型骨架不同的骨架的沸石的形成的方面出发,更优选为90℃以上、进一步优选为100℃以上。
从能够抑制具有与GIS型骨架不同的骨架的沸石的形成的方面出发,更优选为145℃以下、进一步优选为140℃以下、进一步优选为135℃以下。
水热合成的温度可以恒定,也可以阶段性地变化。
水热合成的时间只要是通常使用的时间就没有特别限定,可以根据水热合成的温度适宜地选择。
关于水热合成的时间,从形成GIS骨架的方面出发,优选为3小时以上、更优选为10小时以上。从得到高结晶性的GIS型沸石的方面出发,进一步优选为24小时以上。
从沸石制造时的经济性优异的方面出发,水热合成的时间优选为30天以下、更优选为20天以下、进一步优选为10天以下。
水热合成工序中,装入混合凝胶的容器只要是通常使用的容器就没有特别限定,但在规定温度下容器内的压力升高的情况下、或者为不阻碍结晶化的气体加压下的情况下,优选装入耐压容器中进行水热合成。
耐压容器没有特别限定,例如可以使用球状、纵长状、横长状等各种形状。
在对耐压容器内的混合凝胶进行搅拌时,使耐压容器沿上下方向和/或左右方向旋转,优选沿上下方向旋转。
使耐压容器沿上下方向旋转的情况下,其旋转速度只要为通常使用的范围就没有特别限定,优选为1~50rpm、更优选为10~40rpm。
在水热合成工序中,对混合凝胶进行优选的搅拌时,可以举出使用纵长的容器作为耐压容器并使其沿上下方向旋转的方法。
[分离/干燥工序]
在水热合成工序后,将作为生成物的固体和包含水的液体进行分离,该分离方法只要为通常的方法就没有特别限定,可以使用过滤、倾滗、喷雾干燥法(旋转喷雾、喷嘴喷雾和超声波喷雾等)、使用旋转蒸发器的干燥法、真空干燥法、冷冻干燥法或自然干燥法等,通常可以通过过滤或倾滗进行分离。
分离物可以直接使用,也可以用水或规定的溶剂进行清洗。必要时可以对分离物进行干燥。
对分离物进行干燥的温度只要为通常进行干燥的温度就没有特别限定,通常为室温至150℃以下。
干燥时的气氛只要为通常使用的气氛就没有特别限定,通常使用空气气氛、加入有氮、氩等惰性气体或氧的气氛。
[烧制工序]
可以根据需要对GIS型沸石进行烧制来使用。烧制的温度只要为通常使用的温度就没有特别限定,在希望除去有机结构导向剂的情况下处于能够减少其残留比例的原因,优选为300℃以上、更优选为350℃以上。从烧制的时间缩短、制造沸石时的经济性优异的方面出发,进一步优选为360℃以上。
出于存在保持沸石的结晶性的倾向的原因,优选小于450℃、更优选为420℃以下、进一步优选为400℃以下。
进行烧制的时间只要为可充分除去有机结构导向剂的时间就没有特别限定,可以根据烧制的温度适宜地选择,出于存在能够减少有机结构导向剂的残留比例的倾向的原因,优选为0.5小时以上、更优选为1小时以上、进一步优选为3小时以上。
出于存在可保持沸石的结晶性的倾向的原因,优选为10天以下、更优选为7天以下、进一步优选为5天以下。
烧制的气氛只要为通常使用的气氛就没有特别限定,通常使用空气气氛、加入有氮、氩等惰性气体或氧的气氛。
[阳离子交换]
可以根据需要对GIS型沸石进行成为所期望的阳离子型的阳离子交换。阳离子交换可以使用但不限于例如NH
阳离子交换的温度只要为通常的阳离子交换的温度就没有特别限定,通常为室温至100℃以下。
在对阳离子交换后的沸石进行分离时,其分离方法只要为通常的方法就没有特别限定,可以使用过滤、倾滗、喷雾干燥法(旋转喷雾、喷嘴喷雾和超声波喷雾等)、使用旋转蒸发器的干燥法、真空干燥法、冷冻干燥法、或者自然干燥法等,通常可以通过过滤或倾滗进行分离。
分离物可以直接使用,也可以用水或规定的溶剂进行清洗。必要时可以对分离物进行干燥。
对分离物进行干燥的温度只要为通常进行干燥的温度就没有特别限定,通常为室温至150℃以下。
干燥时的气氛只要为通常使用的气氛就没有特别限定,通常使用空气气氛、加入有氮、氩等惰性气体或氧的气氛。
此外,铵型沸石还可以通过对该沸石进行烧制而转换成质子型沸石。
作为经阳离子交换得到的本实施方式的GIS型沸石所具有的抗衡阳离子,如上所述,例如从调整作为抗衡阳离子的钠量的方面出发,也可以适当地实施阳离子交换。
本实施方式的GIS型沸石的用途没有特别限定,例如可以用作各种气体和液体等的分离剂或分离膜、燃料电池等的电解质膜、各种树脂成型体的填料、膜反应器、或者氢裂解、烷化作用等的催化剂、金属、金属氧化物等的负载用催化剂载体、吸附剂、干燥剂、洗涤剂助剂、离子交换剂、废水处理剂、肥料、食品添加剂、化妆品添加剂等。
上述之中,本实施方式的GIS型沸石可以适当地用作吸附剂。即,本实施方式的吸附剂具备本实施方式的GIS型沸石。本实施方式的吸附剂由于像这样构成,因此能够充分吸附二氧化碳、并且相对于甲烷的吸附量,二氧化碳吸附的选择性更高。因此,可以特别优选地用于从例如天然气中选择性地除去二氧化碳等目的。
本实施方式的吸附剂只要具备本实施方式的GIS型沸石,作为其构成就没有特别限定,作为代表性的构成,可以举出图2所示的示例。图2中例示出的本实施方式的吸附剂1在容器2的内部具备配置在入口侧和出口侧这两处的过滤器3、以及配置在2个过滤器3之间的复数个沸石颗粒4(本实施方式的GIS型沸石)。作为过滤器3,例如可以使用由石英构成的过滤器。例如,在为了从天然气中除去二氧化碳而使用吸附剂1的情况下,可以从上方的管线导入天然气,利用过滤器3除去杂质后,进一步利用沸石颗粒4选择性地吸附除去二氧化碳,从下方的管线取出富含甲烷的气体。其中,供给至吸附剂中的对象并不限于天然气,关于吸附剂的内部结构也不限于图2所示的示例。
(分离方法)
本实施方式的分离方法中,使用本实施方式的吸附剂,从包含选自由H
本实施方式的GIS型沸石中,CO
需要说明的是,上述本实施方式的分离方法可以作为精制气体的制造方法来实施。即,本实施方式的精制气体的制造方法中,使用包含本实施方式的GIS型沸石的吸附剂,从包含选自由H
实施例
以下举出实施例等对本实施方式更详细地进行说明,但这些实施例为例示,本实施方式并不限于以下实施例。本领域技术人员可以对以下所示的实施例加以各种变更并作为本实施方式进行实施,该变更只要满足本实施方式的特定条件即包含在本发明的范围中。
[X射线衍射;晶体结构分析]
X射线衍射按以下顺序进行。
(1)将各实施例和比较例中得到的干燥物作为试样,用玛瑙研钵粉碎。进一步加入10质量%的结晶性硅(株式会社rare metallic制造),利用玛瑙研钵混合至达到均匀为止,作为结构分析的试样。
(2)将上述(1)的试样均匀地固定在粉末用无反射试样板上,在下述条件下利用X射线衍射进行晶体结构分析。
X射线衍射装置(XRD):Rigaku公司制造的粉末X射线衍射装置“RINT2500型”(商品名)
X射线源:Cu管球(40kV、200mA)
测定温度:25℃
测定范围:5~60°(0.02°/步长)
测定速度:0.2°/分钟
狭缝宽度(散射、发散、受光):1°、1°、0.15mm
(3)将所得到的X射线衍射光谱使用结晶性硅的衍射峰进行2θ的偏移的校正后,使用XRD数据分析软件“PDXL2”(软件名、Rigaku公司制造)将分析软件内的设定值“α截止值”设为3.00进行数据分析,测量峰的2θ的值及其高度。
[CO
气体吸附等温线测定按以下顺序进行。
(1)将各实施例和比较例中得到的干燥物作为试样,向12mm试样池(MicroMeritics公司制造)中加入0.2g。
(2)将上述(1)的加入到试样池中的试样设置在Micro Meritics公司制造的气体吸附测定装置“3-Flex”(商品名)中,在250℃、0.001mmHg以下进行12小时加热真空脱气处理。
(3)将上述(2)的处理后的加入到试样池中的试样放入25℃的恒温循环水中,在试样的温度达到25±0.2℃后,使用液化二氧化碳(住友精化株式会社制造、纯度99.9质量%以上)以绝对压为0.25~最高760mmHg进行测定。需要说明的是,在上述测定中,对压力进行经时性测定,在其压力变动为0.001%/10sec以下时判定为达到了饱和吸附量,将其作为25℃的CO
(4)设想吸附剂的加热再生时,为了测定180℃的二氧化碳吸附量,将上述(2)的处理后的加入到试样池中的试样置入环状炉中,在试样的温度达到180±0.2℃后,使用液化二氧化碳(住友精化株式会社制造、纯度99.9质量%以上)在绝对压0.25~最高760mmHg下进行测定。需要说明的是,上述测定中,对压力进行经时性测定,在其压力变动为0.001%/10sec以下时判定为达到了饱和吸附量,将其作为180℃的CO
[硅、铝、磷、钛、锆的原子数浓度以及SAR的测定]
将沸石在氢氧化钠水溶液或王水中进行热溶解,使用适当稀释的液体通过ICP-发光分光分析(下文中也称为“ICP-AES”,Seiko Instruments株式会社制造的SPS3520UV-DD:装置名)对沸石中的硅、铝、磷、钛和锆的浓度进行测定。根据所得到的硅和铝的原子数浓度均换算为氧化硅和氧化铝,计算出SAR。
[碳原子含量的测定]
称量约2mg的该GIS型沸石的粉体试样,通过CHN元素分析(Yanaco分析工业株式会社公司制造的MT-6:装置名)测定沸石中的碳原子的含量。对于吸附CO
[实施例1]
将水123.60g、氢氧化钠(NaOH、和光纯药工业株式会社制造)1.44g、铝酸钠(NaAlO
将所得到的沸石的XRD光谱示于图1。由光谱确认到所得到的沸石为GIS型沸石。此外未观察到源自其他沸石或非晶态氧化硅-氧化铝等的峰,因此将其评价为高纯度的GIS型沸石。关于由XRD图案得到的峰强度比,A/B=0.89、B/C=16.8。
利用ICP-AES对铝、硅、磷、钛、锆、钠浓度进行测定,计算出氧化硅-氧化铝比,结果为SAR=6.40。未检测到磷、钛、锆。钠为7.4质量%。通过CHN分析测定了碳原子浓度,但未检测到碳原子。
对所得到的GIS型沸石的CO
[实施例2]
除了使水为126.16g、氢氧化钠为3.08g、铝酸钠为3.84g、以及胶态氧化硅为21.68g以外,利用与实施例1相同的方法合成沸石。混合凝胶的组成为α=SiO
对所得到的GIS型沸石的CO
[实施例3]
使水为124.0g、氢氧化钠为0.88g、铝酸钠为3.28g、以及胶态氧化硅为21.64g,加入35质量%四乙基氢氧化铵水溶液(Aldrich公司制造)6.0g,使水热合成温度为130℃,除此以外利用与实施例1相同的方法合成沸石。混合凝胶的组成为α=SiO
对所得到的GIS型沸石的CO
[实施例4]
将水125.86g、氢氧化钠0.86g、铝酸钠1.65g和水玻璃3号(Kishida Chemical公司制造)24.80g进行混合,搅拌30分钟,由此制备混合凝胶。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=1.16、B/C=17.0,SAR为4.25,未检测到磷、钛、锆和碳原子。钠为8.3质量%。
对所得到的GIS型沸石的CO
[实施例5]
使水为125.66g、氢氧化钠为0.66g、铝酸钠为1.65g、以及水玻璃3号为24.80g,除此以外利用与实施例1相同的方法合成沸石。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=1.05、B/C=11.5,SAR为4.60,未检测到磷、钛、锆和碳原子。钠为8.1质量%。
对所得到的GIS型沸石的CO
[实施例6]
使水为115.76g、氢氧化钠为0.62g、铝酸钠为1.65g、以及水玻璃3号为20.16g,除此以外利用与实施例1相同的方法合成沸石。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=0.98、B/C=11.2,SAR为4.45,未检测到磷、钛、锆和碳原子。钠为8.1质量%。
对所得到的GIS型沸石的CO
[实施例7]
将水120.00g、氢氧化钠1.01g、铝酸钠2.30g和四乙氧基硅烷(和光纯药工业株式会社制造)21.05g进行混合,搅拌60分钟,由此制备混合凝胶。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=0.63、B/C=15.9,SAR为7.20,未检测到磷、钛、锆和碳原子。钠为7.1质量%。
对所得到的GIS型沸石的CO
[实施例8]
除了使四乙氧基硅烷为17.52g、使水热合成温度为135℃以外,利用与实施例7相同的方法合成沸石。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=0.61、B/C=13.3,SAR为6.04,未检测到磷、钛、锆和碳原子。钠为7.7质量%。
对所得到的GIS型沸石的CO
[实施例9]
除了使水为140.56g、氢氧化钠为1.71g、铝酸钠为2.30g、以及四乙氧基硅烷为40.85g以外,利用与实施例7相同的方法合成沸石。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=1.21、B/C=24.8,SAR为10.10,未检测到磷、钛、锆和碳原子。钠为6.8质量%。
对所得到的GIS型沸石的CO
[比较例1]
基于专利文献3的内容,将水207.30g、氢氧化钠8.78g、铝酸钠16.4g和水玻璃3号248.3g进行混合,搅拌15分钟,由此制备混合凝胶。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=0.67、B/C=15.6,SAR为4.10,未检测到磷、钛、锆和碳原子。钠为8.0质量%。
对所得到的GIS型沸石的CO
[比较例2]
基于非专利文献1的内容,将水132.86g、氢氧化钠15.66g、铝酸钠(Alfa Aesar公司制造)7.2g和胶态氧化硅(Ludox AS-40、固体成分浓度40质量%)25.56g进行混合,在室温下搅拌24小时,由此制备混合凝胶。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=1.13、B/C=11.3,SAR为2.60,未检测到磷、钛、锆和碳原子。钠为8.6质量%。
对所得到的GIS型沸石的CO
[比较例3]
基于非专利文献3的内容,将水102.57g、氢氧化钠(纯正化学公司制造)2.45g、铝酸钠(昭和化学公司制造)1.15g和水玻璃(富士胶片和光纯药公司制造)24.07g进行混合,在N
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=0.61、B/C=11.4,SAR为4.68,未检测到磷、钛、锆和碳原子。钠为8.0质量%。
对所得到的GIS型沸石的CO
[比较例4]
基于非专利文献3的内容,将水101.49g、氢氧化钠1.90g、铝酸钠1.15g和水玻璃26.48g进行混合,除此以外利用与比较例3相同的方法合成沸石。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=0.62、B/C=11.3,SAR为4.22,未检测到磷、钛、锆和碳原子。钠为7.9质量%。
对所得到的GIS型沸石的CO
[比较例5]
基于专利文献1的内容,将氧化硅(SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=0.65、B/C=10.2,SAR为3.33,检测到磷为0.12wt%、钛为0.03wt%,未检测到锆和碳原子。钠为8.2质量%。
对所得到的GIS型沸石的CO
[比较例6]
基于非专利文献6的内容,将铝酸钠0.55g、偏硅酸钠(Na2SiO3、富士胶片-和光纯药公司制造)0.35g和气相法氧化硅(Aerosil300、NIPPONAEROSIL公司制造)1.43g与0.1mol/L的氢氧化钠水溶液10cc进行混合,得到混合凝胶。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=0.60、B/C=11.0,SAR为6.94,未检测到磷、钛、锆和碳原子。钠为7.2质量%。
对所得到的GIS型沸石的CO
[比较例7]
基于专利文献2的内容,将偏硅酸钠五水合物(Na
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=0.75、B/C=5.10,SAR为4.60,未检测到磷、钛、锆,碳原子为13.5质量%。钠为3.5质量%。
对所得到的GIS型沸石的CO
[比较例8]
基于非专利文献5的内容,将水189.90g、异丙醇铝8.17g、原硅酸四乙酯(Aldrich制)17.37g和作为有机结构导向剂的四甲基氢氧化铵五水合物(Aldrich制)176.85g进行混合,搅拌30分钟。将该搅拌液在0℃保持1小时后,用旋转振荡器搅拌20小时,在120℃加热33分钟后,在0℃冷却15分钟,由此制备混合凝胶。混合凝胶的组成为α=SiO
利用与实施例1相同的方法对各值进行测定,结果由XRD图案得到的峰强度比为A/B=0.84、B/C=6.15,SAR为5.00,未检测到磷、钛、锆、钠,碳原子为13.21质量%。
对所得到的GIS型沸石的CO
[比较例9]
基于专利文献4的内容,将水259.10g、氢氧化钠0.98g、铝酸钠20.50g和水玻璃3号310.4g进行混合,搅拌45分钟,由此制备混合凝胶。混合凝胶的组成为α=SiO
将所得到的沸石1g加入到0.1N的硝酸钾水溶液500mL中,在60℃以400rpm搅拌3小时。过滤出生成物,在120℃进行干燥后,得到阳离子的一部分被交换成钾的粉末状的沸石。(1 0 1)的衍射峰为12.74°、(3 0 1)的衍射峰为28.52°、(5 0 1)的衍射峰为47.08°。均并非为本技术中的由GIS得到的衍射峰的合适范围,晶体结构不同。由这些衍射峰求出衍射峰值高度之比时,(1 0 1)/(3 0 1)=0.67、(3 0 1)/(5 0 1)=15.0。
SAR为4.10,未检测到磷、钛、锆和碳原子。钠为0.3质量%。
对所得到的GIS型沸石的CO
[表1]
表1中的α~ε表示下述摩尔比。
α=SiO
β=(M1
γ=P
δ=H
ε=H
ζ=R/Al
本申请基于2020年7月31日提交的日本专利申请(日本特愿2020-130309号),以参考的形式将其内容引入本说明书。
工业实用性
本发明的GIS型沸石作为各种气体和液体等的分离剂和分离膜、燃料电池等的电解质膜、各种树脂成型体的填料、膜反应器、或者氢裂解、烷化作用等的催化剂、金属、金属氧化物等的负载用催化剂载体、吸附剂、干燥剂、洗涤剂助剂、离子交换剂、废水处理剂、肥料、食品添加剂、化妆品添加剂等具有工业实用性。
符号的说明
1吸附剂
2容器
3过滤器
4沸石颗粒
