神经肽Y在制备罗非鱼抗无乳链球菌感染和防治罗非鱼无乳链球菌相关疾病的制剂中的应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及多肽功能研究技术领域,具体地,涉及神经肽Y在制备罗非鱼抗无乳链球菌感染和防治罗非鱼无乳链球菌相关疾病的制剂中的应用。
背景技术
近年来鱼类养殖业在我国经济发展中的地位越来越高。在众多经济鱼类中,罗非鱼因其优越的生长性能和较强的适应能力,受到世界各国养殖者的欢迎,成为世界性的主要养殖鱼类。罗非鱼俗称非洲鲫鱼,隶属于鲈形目、鲈形亚目、丽鱼科、罗非鱼属(Oreochromis),具有生长快、耐低氧,食性广、饵料要求低、养殖周期短等优点,而且适合池塘养殖、海水养殖、流水及网箱等集约化养殖模式。但随着养殖密度和养殖规模的不断增大,罗非鱼养殖环境日趋恶化,细菌性病害频发,阻碍了罗非鱼养殖业的健康发展。
在无抗养殖时代背景下,抗生素替代物的研发和应用已成为了水产养殖业的重要课题之一。在“无抗养殖”的大背景下,为保障水产养殖的绿色和可持续发展,许多学者对水产动物饲料抗生素替代物进行了大量的理论和应用研究,主要包括微生态制剂、抗菌肽、中草药、植物提取物、寡糖和多糖以及腐殖酸等饲用添加剂。不同于多肽类抗生素,抗菌肽无毒副作用、无残留,具有广谱抗细菌、抗病毒、抗真菌、抗寄生虫、抗肿瘤和免疫增强功能。浸泡浴是水产养殖中施用激素、肽、免疫刺激剂和疫苗的常见做法,这种方法不仅不需要复杂的肽纯化程序,而且在处理过程中对鱼的应激压力最小。
目前已知鱼类的神经肽Y可以促进鱼类的生长发育,例如专利CN101824435A一种罗非鱼神经肽Y重组蛋白的表达系统,公开了将罗非鱼神经肽Y重组蛋白制备成鱼苗促生长剂或添加剂,促进鱼类生长。但并不清楚神经肽Y与鱼类其他生理机能的关系,神经肽Y的功能也有待进一步挖掘。
发明内容
本发明的目的是克服现有技术的上述不足,提供神经肽Y在制备罗非鱼抗无乳链球菌感染和防治罗非鱼无乳链球菌相关疾病的制剂中的应用。
本发明的第一个目的是提供一种多肽在制备增强罗非鱼抗无乳链球菌感染能力的制剂中的应用。
本发明的第二个目的是提供一种多肽在制备治疗罗非鱼感染无乳链球菌的疾病的制剂中的应用。
本发明的第三个目的是提供一种多肽在制备增强罗非鱼免疫水平和/或免疫调节能力的制剂中的应用。
为了实现上述目的,本发明是通过以下方案予以实现的:
一种多肽在制备增强罗非鱼抗无乳链球菌感染能力的制剂中的应用,所述多肽的氨基酸序列如SEQ ID NO:1所示。
更优选地,所述增强罗非鱼抗无乳链球菌感染能力的制剂为增强罗非鱼的端脑、下丘脑、头肾和/或脾脏抗无乳链球菌感染能力的制剂。
一种多肽在制备治疗罗非鱼感染无乳链球菌的疾病的制剂中的应用,所述多肽的氨基酸序列如SEQ ID NO:1所示。
更优选地,所述治疗罗非鱼感染无乳链球菌的疾病的制剂为治疗罗非鱼感染无乳链球菌引起的头肾细胞坏死,恢复头肾中黑色素巨噬细胞数量和/或头肾中淋巴细胞数量的制剂。
更优选地,所述治疗罗非鱼感染无乳链球菌的疾病的制剂为治疗罗非鱼感染无乳链球菌引起的罗非鱼的脾脏组织的血细胞肿大和/或组织充血的制剂。
更优选地,所述治疗罗非鱼感染无乳链球菌的疾病的制剂为降低罗非鱼感染无乳链球菌引起的促炎因子升高和/或提高罗非鱼感染无乳链球菌引起的抗炎因子降低的制剂。
更优选地,所述治疗罗非鱼感染无乳链球菌的疾病的制剂为降低罗非鱼感染无乳链球菌引起的促炎因子IL-1β和/或TNF-α升高的制剂。
更优选地,所述治疗罗非鱼感染无乳链球菌的疾病的制剂为提高罗非鱼感染无乳链球菌引起的抗炎因子IL-10和/或TGF-β降低的制剂。
更优选地,所述治疗罗非鱼感染无乳链球菌的疾病的制剂为提高罗非鱼感染无乳链球菌引起的碱性磷酸酶和/或溶菌酶降低的制剂。
更优选地,所述治疗罗非鱼感染无乳链球菌的疾病的制剂为降低罗非鱼感染无乳链球菌引起的血糖和/或超氧化物歧化酶升高的制剂。
一种多肽在制备增强罗非鱼免疫水平和/或免疫调节能力的制剂中的应用,所述多肽的氨基酸序列如SEQ ID NO:1所示。
更优选地,所述增强罗非鱼免疫水平和/或免疫调节能力的制剂为增强罗非鱼端脑、下丘脑、头肾和/或脾脏免疫水平和/或增强罗非鱼端脑、下丘脑、头肾和/或脾脏免疫调节能力的制剂。
更优选地,所述增强罗非鱼免疫水平和/或免疫调节能力的制剂为提高罗非鱼感染无乳链球菌引起的碱性磷酸酶和/或溶菌酶降低的制剂。
更优选地,所述增强罗非鱼免疫水平和/或免疫调节能力的制剂为降低罗非鱼感染无乳链球菌引起的血糖和/或超氧化物歧化酶升高的制剂。
与现有技术相比,本发明具有以下有益效果:
本发明公开了神经肽Y在制备罗非鱼抗无乳链球菌感染和防治罗非鱼无乳链球菌相关疾病的制剂中的应用。本发明将氨基酸序列如SEQ ID NO:1所示的神经肽Y添加到饲养罗非鱼的水中,提高了罗非鱼端脑、下丘脑、头肾和脾脏中抗炎因子的表达,减少了促炎因子的表达,降低了罗非鱼血清中葡萄糖、超氧化物歧化酶的表达水平,增加了碱性磷酸酶和溶菌酶的表达水平,提高罗非鱼的免疫能力,从而预防罗非鱼感染无乳链球菌,缓解罗非鱼感染无乳链球菌引起的头肾细胞坏死,恢复头肾中黑色素巨噬细胞数量和头肾中淋巴细胞数量,治疗罗非鱼感染无乳链球菌引起的罗非鱼的脾脏组织的血细胞肿大和/或组织充血。神经肽Y提高了罗非鱼自身的先天免疫水平和抗氧化防御能力,从而达到预防细菌性疾病和抵抗病原菌引起的机体损伤的效果。具有免疫保护作用的神经肽Y作为一种抗菌肽,浸泡罗非鱼鱼苗,通过对罗非鱼鱼苗免疫系统的调控起到抗菌反应,促进罗非鱼鱼苗的生长,提高其免疫功能和抗病力。神经肽Y对于提高罗非鱼苗种阶段养殖提高存活率,促进罗非鱼绿色养殖具有良好的应用前景。
附图说明
图1为用200μg/L神经肽Y浸泡罗非鱼鱼苗不同次数后,不同组织中NPY和Y8b的mRNA表达水平变化。其中A为端脑,B为下丘脑,C为头肾,D为脾脏。数据均表示为平均值±标准误(n=15),独立样本T检验分析,*p<0.05。
图2为用200μg/L神经肽Y浸泡罗非鱼鱼苗不同次数后,不同组织中IL-1β、IL-10、TNF-α和TGF-β的mRNA表达水平变化。其中A为端脑,B为下丘脑,C为头肾,D为脾脏。数据均表示为平均值±标准误(n=15),独立样本T检验分析,*p<0.05。
图3为不同浓度神经肽Y浸泡罗非鱼鱼苗后,鱼苗不同组织中NPY和Y8b的mRNA表达水平变化。其中A为端脑,B为下丘脑,C为头肾,D为脾脏。数据均表示为平均值±标准误(n=15),使用单因素方差分析,邓肯复极差法进行多重比较,同一行不同字母表示组间有显著性差异(p<0.05)。
图4为不同浓度神经肽Y浸泡罗非鱼鱼苗后,鱼苗不同组织中IL-1β、IL-10、TNF-α和TGF-β的mRNA水平的变化。其中A为端脑,B为下丘脑,C为头肾,D为脾脏。数据均表示为平均值±标准误(n=15),使用单因素方差分析,邓肯复极差法进行多重比较,同一行不同字母表示组间有显著性差异(p<0.05)。
图5为用200μg/L神经肽Y浸泡罗非鱼鱼苗后感染无乳链球菌对罗非鱼鱼苗不同组织中IL-1β、IL-10、TNF-α和TGF-β的mRNA表达水平的影响。其中A为端脑,B为下丘脑,C为头肾,D为脾脏。所有数据表示为平均值±标准误(n=12),使用单因素方差分析,LSD法进行多重比较,*p<0.05。
图6为用200μg/L神经肽Y浸泡罗非鱼鱼苗后感染无乳链球菌对罗非鱼鱼苗血清中免疫相关指标的影响。其中A为超氧化物歧化酶活力,B为碱性磷酸酶水平,C为溶菌酶水平。所有数据表示为平均值±标准误(n=12),使用单因素方差分析,LSD法进行多重比较,*p<0.05。
图7为罗非鱼鱼苗感染无乳链球菌24h后,被不同浓度神经肽Y浸泡,对罗非鱼鱼苗不同组织中IL-1β、IL-10、TNF-α和TGF-β的mRNA水平的变化。其中A为端脑,B为下丘脑,C为头肾,D为脾脏。数据均表示为平均值±标准误(n=12),使用单因素方差分析,邓肯复极差法进行多重比较,同一行不同字母表示组间有显著性差异(p<0.05)。
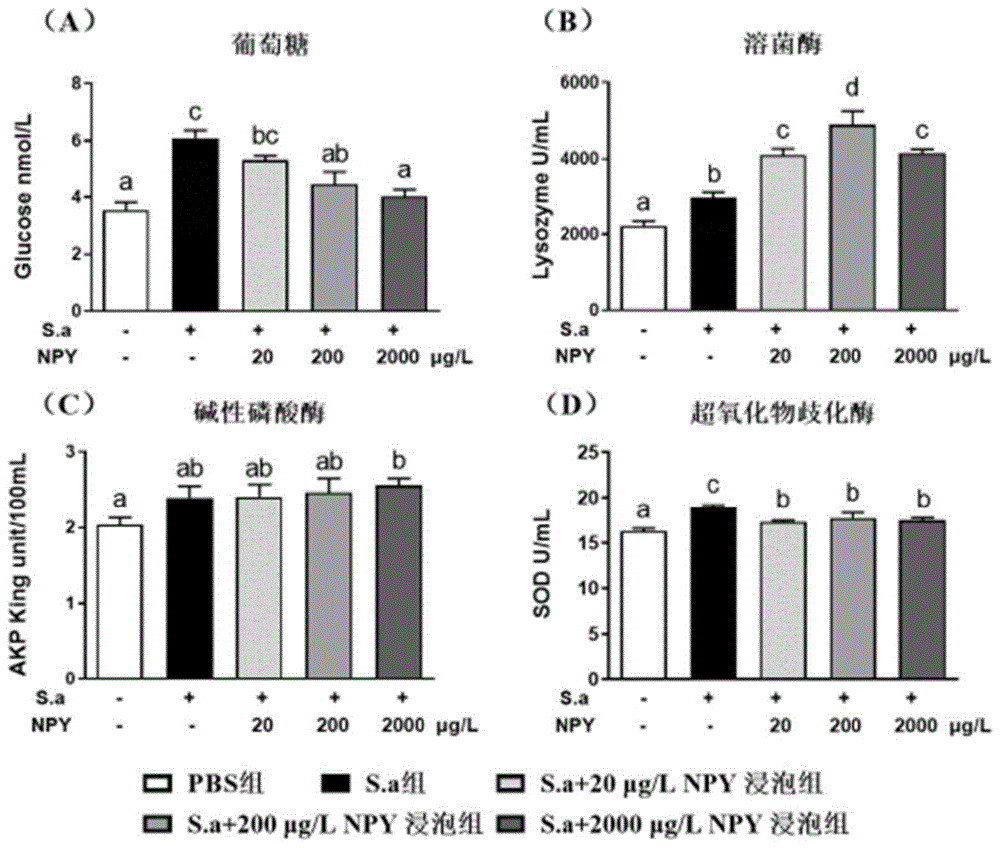
图8为罗非鱼感染无乳链球菌24h后,被不同浓度神经肽Y浸泡,罗非鱼鱼苗中血清指标的变化。其中A为葡萄糖,B为溶菌酶,C为碱性磷酸酶,D为超氧化物歧化酶。数据均表示为平均值±标准误(n=12),使用单因素方差分析,邓肯复极差法进行多重比较,同一行不同字母表示组间有显著性差异(p<0.05)。
图9为罗非鱼感染无乳链球菌24h后,被不同浓度神经肽Y浸泡,罗非鱼鱼苗的组织形态的变化。其中A为头肾,B为脾脏。黄色标识表示淋巴细胞,红色标识表示黑色素巨噬细胞中心,圆圈表示细胞坏死区。标尺:20μm。
具体实施方式
下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1神经肽Y(多肽NPY)的浸泡浓度和浸泡次数对罗非鱼鱼苗的影响
一、实验方法
1、对罗非鱼鱼苗进行驯养:罗非鱼鱼苗体质量为5~7g/尾,驯养水温为28~29℃,12h光照和12h黑暗条件下驯养2周以上后进行实验。
2、实验用神经肽Y纯度大于95%,其C末端进行酰胺化修饰,所述神经肽Y从N端到C端的氨基酸序列为SEQ ID NO:1(YPVKPENPGEDAPAEELAKYYSALRHYINLITRQRY)所示。
3、用浸泡的方式将神经肽Y添加到养殖水体中,配制浸泡液的方法如下:
(1)从-80℃冰箱取10mg神经肽Y蛋白干粉,小型离心机离心3min,待干粉完全置于管底后沿着管壁缓慢加入1mL的双蒸水,充分涡旋离心三次,配制成为浓度为10mg/mL的神经肽Y原液,-20℃保存。
(2)稀释本实施例步骤(1)的神经肽Y原液至10倍和100倍,得到神经肽Y 10倍稀释液和神经肽Y 100倍稀释液。进行浸泡实验时,分为4组,将每组缸内水位降至5L,分别加入1mL神经肽Y原液、神经肽Y10倍稀释液和神经肽Y 100倍稀释液,以加入1mL去离子水的分组为对照组,使每组缸内神经肽Y水溶液中神经肽Y的浸泡浓度分别为2000μg/L、200μg/L、20μg/L和0μg/L。
(3)用不同浸泡浓度的神经肽Y水溶液,浸泡本实施例步骤1驯养好的罗非鱼鱼苗,每组15尾罗非鱼鱼苗,每次浸泡均在浸泡当日的12:30p.m.~2:00p.m.进行。每组浸泡90min后补水至30L,不去除水中剩余NPY,每次浸泡间隔一天,分别在浸泡1次、3次、6次时,检测罗非鱼鱼苗端脑、下丘脑、脾脏及头肾NPY及其受体以及炎症相关基因的表达情况。
二、实验结果
如图1所示,神经肽Y的浸泡浓度为200μg/L时,在浸泡1次和3次时,头肾中NPYmRNA表达水平显著上调,浸泡6次的NPY mRNA表达水平无明显变化(图1C);浸泡3次时脾脏中NPY mRNA表达水平显著上调,浸泡1次和6次的NPY mRNA表达水平无明显变化(图1D);端脑和下丘脑的所有浸泡次数中,NPY mRNA表达水平均无显著变化(图1A、图1B)。
在浸泡6次时,下丘脑中NPY高表达受体Y8b的表达水平显著减少,浸泡1次和3次的Y8b的表达水平无明显变化(图1B);浸泡3次时,脾脏中Y8b的表达水平显著减少,浸泡1次和6次的Y8b的表达水平无明显变化(图1D);浸泡3次和6次时头肾中Y8b的表达水平水平增加,但未达到显著性(图1C);端脑中所有浸泡次数下Y8b表达水平均无显著变化(图1A)。
如图2所示,在端脑中IL-1βmRNA表达水平无显著变化;TNF-α和IL-10在浸泡1次时表达水平显著增加,浸泡3次和6次时无显著性变化;TGF-β在浸泡1次和3次数表达水平都显著增加,浸泡6次时无显著性变化(图2A)。
在下丘脑中仅TNF-αmRNA在浸泡3次时表达水平显著上调,其他基因和次数均无显著变化(图2B)。
在头肾组织中,IL-1βmRNA表达水平在浸泡3次表达减少,但未达到显著性;TNF-αmRNA表达水平在浸泡6次时显著下调;其他基因和次数均无显著变化(图2C)。
在脾脏组织中,IL-1βmRNA表达水平在浸泡1、3和6次时均表达减少,3次和6次时达到显著性;IL-10mRNA表达水平在浸泡1次时表达显著增加,3次和6次时恢复对照组水平;TNF-αmRNA表达水平在浸泡6次时显著下调,其他次数中无变化;TGF-βmRNA表达水平在浸泡1次时表达显著减少,3次和6次时表达水平和对照组一致(图2D)。
神经肽Y的浸泡浓度为200μg/L时,浸泡罗非鱼鱼苗3次,增加罗非鱼鱼苗脑组织(端脑和下丘脑)中炎症基因的表达。同时,免疫组织(头肾和脾脏)中促炎症细胞因子(IL-1β和TNF-α)的表达减少,而抗炎症细胞因子(IL-10)的mRNA表达水平增加。另外脾脏和头肾中NPY mRNA表达水平显著增加,Y8bmRNA水平在脾脏中表达显著减少。因此综合确定最合适的浸泡次数为3次。
如图3所示,神经肽Y的浸泡浓度为20μg/L、200μg/L和2000μg/L时,罗非鱼鱼苗端脑、下丘脑、头肾和脾脏的NPY及其受体Y8b的表达情况。
NPY mRNA表达水平在端脑中没有变化(图3A);
NPY mRNA表达水平在下丘脑中表达减少,200μg/L NPY浸泡下达到显著性(图3B);
在头肾中表达增加,在2000μg/L NPY浸泡出现显著性(图3C);
在脾脏中20和200μg/L NPY浸泡导致NPY mRNA表达减少,在2000μg/L时又显著上调(图3D)。
Y8b mRNA表达在端脑、头肾和脾脏中均表达上调,仅在端脑的200μg/LNPY浸泡下出现显著性(图3A);Y8b mRNA表达水平在下丘脑中并无显著变化(图3B)。
如图4所示,是炎症相关基因的表达情况。
端脑中IL-10、TNF-α和TGF-β的mRNA的表达水平在200μg/L和2000μg/LNPY的剂量下显著增加,IL-1β的mRNA表达无明显变化(图4A)。
下丘脑中IL-10、TNF-α和TGF-β的mRNA的表趋势与端脑中一致,但未出现显著性,IL-1β的表达无明显变化(图4B)。
在头肾中IL-1βmRNA表达水平在200μg/L和2000μg/L NPY的剂量下表达水平减少,IL-10、TNF-α和TGF-β的mRNA的表达量在20μg/L的NPY浸泡下表达增加,又随浸泡浓度增加逐渐恢复正常水平(图4C)。
而在脾脏中,IL-1β、IL-10、TNF-α和TGF-β的mRNA表达水平在浸泡NPY后表达均有减少的趋势,仅IL-1β随剂量增加显著性降低,其它基因均无显著性变化(图4D)。
实施例2神经肽Y(多肽NPY)浸泡对预防罗非鱼鱼苗感染无乳链球菌的免疫保护效果
一、实验方法
1、罗非鱼鱼苗驯养方法与实施例1相同。
2、神经肽Y的浸泡浓度为200μg/L,浸泡罗非鱼鱼苗的次数为3次。浸泡方法与实施例1相同。
3、浸泡神经肽Y后立即对罗非鱼鱼苗进行无乳链球菌腹腔注射攻毒,无乳链球菌的注射剂量为每尾100μL 1×10
检测4组罗非鱼鱼苗端脑、下丘脑、脾脏及头肾炎症相关基因的表达情况,抽取4组罗非鱼鱼的血清样本,检测其免疫相关指标,研究神经肽Y浸泡对鱼苗的免疫保护效果。
二、实验结果
如图5A所示,端脑中,3h时间点,浸泡攻毒组的罗非鱼鱼苗的端脑中的IL-1β和TGF-β的mRNA表达水平都明显下降,其它处理组和基因均无显著变化。
6h时间点,NPY浸泡组TNF-αmRNA表达水平显著增加,浸泡攻毒组的TNF-α和TGF-β表达水平减少,IL-1β和IL-10的mRNA表达水平均无显著变化。
24h时间点,浸泡攻毒组IL-1β和TNF-α的mRNA表达水平显著上调,其它处理组和基因的表达水平均无显著变化。
如图5B所示,下丘脑中,3h后时间点,浸泡攻毒组的IL-1β和TGF-β的mRNA表达水平显著减少,但TNF-α和IL-10无显著变化。
6h时间点,NPY浸泡组和攻毒组的TGF-βmRNA表达水平减少,其中攻毒组达到显著性;浸泡攻毒组的TNF-α、IL-10和TGF-β的mRNA表达水平均显著减少,IL-1βmRNA表达水平减少但未达到显著性,其他组别无显著变化。
24h时间点,攻毒组IL-1βmRNA表达水平显著增加,浸泡攻毒组的IL-1βmRNA表达水平减少但未恢复正常水平,各组TNF-α、IL-10和TGF-β的mRNA表达水平均无显著变化。
如图5C所示,头肾中,3h时间点,攻毒组中的IL-1β和IL-10的mRNA表达水平显著增加,浸泡攻毒组的IL-1β和IL-10的mRNA表达水平减少,IL-1βmRNA表达水平达到显著性,浸泡攻毒组的TNF-α和TGF-β的mRNA表达水平也显著减少,其它处理组变化不显著;
6h时间点,攻毒组中的TNF-α和TGF-β的mRNA表达水平也显著减少,IL-1β和IL-10的mRNA的表达水平显著增加;浸泡攻毒组中TNF-α和TGF-β的mRNA表达水平增加,IL-1β和IL-10的mRNA表达水平减少,但都不能完全恢复正常表达水平;
24h时间点,攻毒组仅IL-1βmRNA表达水平显著增加,浸泡攻毒组使IL-1βmRNA表达水平减少并且显著性降低,同时促进TGF-βmRNA表达水平显著减少,TNF-α和IL-10的mRNA表达水平无显著变化。
如图5D所示,脾脏中,3h时间点,攻毒组中的IL-1β、TNF-α和TGF-β的mRNA表达水平显著增加,IL-10mRNA表达水平增加但未达到显著性。浸泡攻毒组的IL-1β、IL-10、TNF-α和TGF-β的mRNA表达水平均较少并且显著性降低;
6h时间点,仅浸泡攻毒组IL-1βmRNA表达水平显著增加,其他基因均无显著变化;
24h时间点,攻毒组IL-1βmRNA表达水平仍显著增加,但浸泡攻毒组促使IL-1βmRNA表达水平进一步上调。攻毒组TGF-βmRNA表达水平显著减少,浸泡攻毒组使TGF-βmRNA表达水平恢复正常水平,其他基因无显著变化。
如图6A所示,24h时间点,攻毒组血清中超氧化物歧化酶水平明显增加,NPY浸泡组也可以增加其水平,但浸泡攻毒组不能促进由无乳链球菌引起的超氧化物歧化酶水平的上调,3h和6h的处理组均无显著变化。
浸泡攻毒组与攻毒组比较,NPY浸泡感染无乳链球菌的罗非鱼鱼苗,减少无乳链球菌感染罗非鱼鱼苗引起的碱性磷酸酶水平(图6B),在6h时出现显著性,3h和24h无显著变化。
攻毒组溶菌酶水平在3、6h和24h时间点均显著增加,这3个时间点浸泡攻毒组均能够使溶菌酶显著性下降(图6C)。
实施例3神经肽Y(多肽NPY)浸泡对感染无乳链球菌的罗非鱼鱼苗的免疫治疗效果
一、实验方法
1、罗非鱼鱼苗驯养方法与实施例1相同。
2、对罗非鱼鱼苗进行腹腔注射无乳链球菌,无乳链球菌剂量为每尾100μL 1×10
检测罗非鱼鱼苗端脑、下丘脑、脾脏及头肾炎症相关基因,抽取血清样本检测免疫相关指标,观察免疫组织形态变化,研究神经肽Y浸泡对罗非鱼鱼苗抵抗无乳链球菌的免疫治疗效果。
二、实验结果
如图7A所示,在端脑中,促炎因子IL-1β和TNF-α的mRNA表达水平在无乳链球菌感染后表达显著增加(S.a注射组);浸泡NPY后出现显著性下调(S.a+20μg/LNPY组、S.a+200μg/L NPY组和S.a+2000μg/L NPY组)。抑炎因子IL-10和TGF-β的mRNA表达水平随NPY浸泡浓度的上升而升高(S.a+20μg/LNPY组、S.a+200μg/L NPY组和S.a+2000μg/L NPY组),仅TGF-βmRNA表达水平在最高剂量下达到显著性。
如图7B所示,在下丘脑中,与S.a注射组相比,浸泡NPY会引起罗非鱼鱼苗的IL-1β和TNF-α的mRNA表达水平下调,IL-10mRNA表达水平略上调但不显著;TGF-βmRNA表达水平则是随着浸泡浓度增加表达增加。以上这些变化在2000μg/L的NPY浸泡下效果最明显。
如图7C所示,在头肾组织中,IL-1β和TNF-α的mRNA表达水平在无乳链球菌感染后显著上调(S.a注射组),IL-1βmRNA表达水平随NPY浸泡浓度的上升逐渐下降(S.a+20μg/LNPY组、S.a+200μg/L NPY组和S.a+2000μg/L NPY组)。NPY浸泡会降低TNF-α的mRNA表达水平,但是差异不显著。IL-10和TGF-β的mRNA表达水平则相反,无乳链球菌会引起IL-10mRNA表达水平显著增加(S.a注射组),NPY浸泡会促进IL-10mRNA表达水平的提高,在S.a+2000μg/L NPY组达到峰值(S.a+200μg/L NPY组和S.a+2000μg/L NPY组);TGF-βmRNA表达水平在无乳链球菌感染后表达显著降低,在NPY浸泡后表达量开始增加,S.a+200μg/L NPY组恢复至正常水平,S.a+2000μg/L NPY组表达量高于对照组,但不具有显著性。
如图7D所示,在脾脏中,IL-1β和TNF-α的mRNA表达水平随NPY浸泡浓度增加表达量减少,与感染无乳链球菌组(S.a注射组)间未达到显著性;IL-10mRNA表达水平则随NPY浸泡浓度表达显著上调;TGF-βmRNA表达水平在无乳链球菌感染后显著降低(S.a注射组),不同浓度NPY浸泡后均无显著效果。
如图8所示,无乳链球菌感染会使罗非鱼鱼苗血糖水平显著提高(图8A,S.a注射组),但浸泡NPY下调罗非鱼鱼苗血糖水平,并在最高剂量NPY浸泡下使其恢复至正常水平。
无乳链球菌处理会提高鱼体溶菌酶、碱性磷酸酶和超氧化物歧化酶水平(S.a注射组),浸泡2000μg/L NPY显著促进罗非鱼鱼苗碱性磷酸酶的表达(图8C),浸泡各浓度NPY(S.a+20μg/LNPY组、S.a+200μg/L NPY组和S.a+2000μg/L NPY组)都显著促进罗非鱼鱼苗溶菌酶的表达(图8B),浸泡各浓度NPY(S.a+20μg/LNPY组、S.a+200μg/L NPY组和S.a+2000μg/L NPY组)显著抑制超氧化物歧化酶(图8D)水平增加。
如图9所示,使用不同浓度NPY浸泡受感染罗非鱼,从组织形态上能观察到明显的治疗效果。
如图9A所示,在无乳链球菌感染后(S.a注射组),头肾出现明显的细胞坏死,黑色素巨噬细胞中心(MMCs)着色变浅,结构松散,面积和数量大量减少。同时无乳链球菌感染会造成淋巴细胞数量减少,粒细胞数量增加。
在头肾组织中,浸泡三种浓度的NPY都增大了MMCs面积,增加淋巴细胞数量,减小细胞坏死区域(S.a+20μg/LNPY组、S.a+200μg/L NPY组和S.a+2000μg/L NPY组),其中S.a+2000μg/L NPY组效果最明显。
如图9B所示,在无乳链球菌感染后(S.a注射组),脾脏的细胞情况与头肾相同。此外,无乳链球菌感染会造成脾脏中血细胞肿大和组织充血,浸泡NPY能够缓解血细胞的肿大和组织充血情况。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 池塘种植鱼腥草修复无乳链球菌感染引起罗非鱼肝脏损伤的方法
- 一种罗非鱼肝脏组织多肽组提取和无乳链球菌感染的早期诊断方法
