CMTM6作为干眼的生物标志物及其应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物医疗技术领域,特别涉及CMTM6作为干眼的生物标志物及其应用。
背景技术
干眼(dry eye disease, DED)是临床最常见的影响视觉与生活质量的眼表疾病,主要表现为眼干涩感和异物感,若治疗不及时可发展成严重的眼表损伤甚至失明。随着视频终端的广泛应用、环境污染和人口老龄化等,干眼的发病率呈显著上升趋势。流行病学调查结果显示,全球范围干眼发病率为5%~50%;我国干眼的发病率达到21%~30%,干眼患者3.6亿人左右。干眼逐渐成为一个倍受关注的公众健康问题。干眼作为一种慢性、进展性疾病,发展至中、重度后常迁延不愈,对患者造成沉重经济负担。此外,干眼患者长时间伴有眼红、畏光、刺痛和视物模糊等症状,不仅影响生活质量,还会降低工作效率,给社会经济发展造成不容忽视的负担。因此,深入探究干眼的诊断指标和有效治疗靶点对国民健康意义重大,迫在眉睫。
传统的干眼诊断是针对干眼体征进行检查,检查项目包括泪液分泌试验(Schermier试验)、泪膜破裂时间(breakup time,BUT)、角膜荧光素染色等。然而这些项目准确性有限、可重复性差、主观性强、数据变异较大,难以获得正确诊断。干眼治疗中,人工泪液的应用是最常规的治疗手段。尤其是在没有明确病因的情况下,人工泪液通常作为首选。然而,干眼是一个多因素疾病,明确发病原因、明确干眼严重程度对采取正确合理的精准靶向治疗至关重要。
因此,需要寻找一种生物标志物来用于诊断干眼并判断干眼严重程度。
发明内容
本发明所要解决的技术问题是提供一种CMTM6作为干眼的生物标志物及其应用,其解决了现有干眼的诊断存在主观性强、准确性差、可重复性差等问题。
本发明所要解决的技术问题是通过以下技术方案来实现的:
本申请的第一目的在于提供一种生物标志物或检测生物标志物的试剂在制备用于诊断干眼和/或判断干眼严重程度的产品中的应用,所述生物标志物为膜分子CMTM6。
优选地,所述生物标志物为CMTM6基因或CMTM6蛋白,所述检测生物标志物的试剂为检测CMTM6的mRNA表达水平和/或CMTM6蛋白表达水平的试剂。
优选地,所述判断干眼严重程度的方法包括检测CMTM6的mRNA水平或蛋白表达水平。
本申请的第二目的在于提供一种生物标志物或检测生物标志物的试剂在制备治疗干眼的产品中的应用,所述生物标志物为结膜印记细胞或泪液中的CMTM6。
优选地,所述检测生物标志物的试剂为检测CMTM6的mRNA表达水平和/或CMTM6蛋白表达水平的试剂。
本申请的第三目的在于提供一种检测生物标志物的试剂,所述试剂用于检测CMTM6的mRNA或蛋白表达水平,所述的试剂包括PCR所需试剂、Western blot所需试剂、免疫组化所需试剂。
本申请的第四目的在于提供一种干眼炎症反应程度的生物标志物,所述生物标志物为CMTM6。
优选地,炎症反应的指标包括IL-1β、TNF-α和IL-6。
本申请的第五目的在于提供一种区分干眼严重程度的方法,所述方法包括检测CMTM6的mRNA水平或蛋白表达水平。
本申请的第六目的在于提供CMTM6作为靶基因在制备抑制炎性因子表达、抑制紧密连接蛋白被破坏的产品中的应用。
本发明上述技术方案,具有如下有益效果:
本申请以膜分子CMTM6作为干眼诊断的生物标志物,从多角度证实CMTM6与干眼的负相关性。与正常对照组相比,CMTM6在干眼患者的结膜印记细胞及干眼小鼠的角膜上皮细胞表达降低。而且,与轻度干眼患者相比,中重度干眼患者的结膜印记细胞中CMTM6表达降低。且敲除CMTM6基因的干眼小鼠显示出干眼症状加重。以上均表明CMTM6可以作为干眼的有效生物标志物。本申请的生物标志物可高效、精准、快捷的诊断干眼,并区分干眼严重程度。
附图说明
被结合在说明书中并构成说明书的一部分的附图示出了本发明的实施例,并且连同其说明一起用于解释本发明的原理。
图1为免疫组化实验检测CMTM6在角膜组织中的表达;
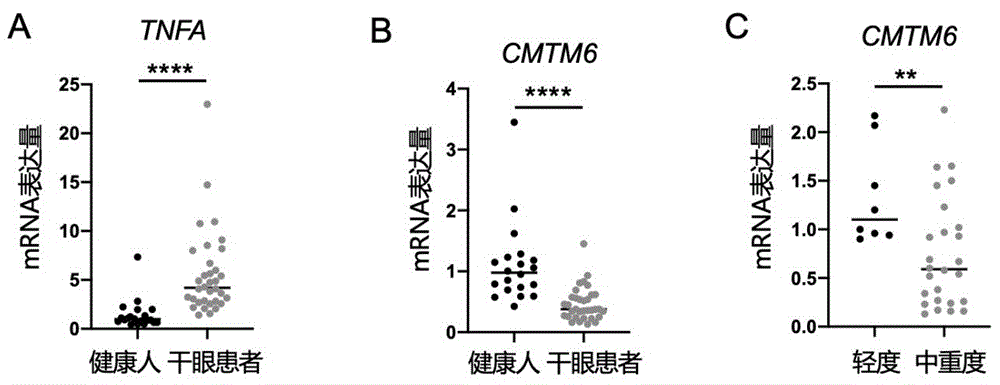
图2为RT-PCR实验检测CMTM6基因在健康人及干眼患者结膜印记细胞中的表达差异,其中,A、B、C均为相对表达定量图,****表示P<0.0001,**表示P<0.01;
图3为RT-PCR实验和Western blot实验检测CMTM6基因及蛋白在正常对照及干眼小鼠角膜组织中的表达变化,其中,A为CMTM6基因(小鼠CMTM6基因写法为Cmtm6)相对表达定量柱状图,B左侧为CMTM6蛋白凝胶电泳图,右侧为定量柱形图,***表示P<0.001;
图4为CMTM6基因敲除后,正常稳态及干眼发生后小鼠眼表损伤情况,其中,A、C为裂隙灯钴蓝光下小鼠眼表荧光素钠点染情况,及荧光素钠点染评分统计图,B、D为小鼠泪液分泌量统计图,WT表示野生型对照组,Cmtm6
图5为CMTM6基因敲除后,干眼小鼠角膜组织炎性因子基因表达情况及泪液中炎性因子蛋白表达情况,其中,A、B、C为基因相对定量柱形图,C为蛋白浓度定量柱形图,WT DE表示野生型干眼小鼠对照组,Cmtm6
图6为CMTM6基因敲除后,正常稳态及干眼发生后小鼠角膜中紧密连接蛋白ZO-1形态变化情况,其中,WT表示野生型对照组,Cmtm6
图7为角膜上皮细胞系中,使用慢病毒系统敲减CMTM6表达后炎性因子基因及蛋白表达情况,其中,Vector表示空载体对照组,shRNA表示敲减CMTM6实验组,310mOsM表示正常细胞培养基渗透压,500mOsM表示模拟干眼的高渗刺激,*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.0001。
具体实施方式
现在来详细描述本发明的各种示例性实施例。应注意到:除非另外具体说明,否则在这些实施例中阐述的部件和步骤的相对布置、数字表达式和数值不限制本发明的范围。
本发明实施例中所用到的C57BL/6J干眼小鼠模型制作方法如下:
选用8-10周龄雌性C57BL/6J小鼠,置于干燥环境(湿度15±3%、风速3-5m/s、温度21-23℃)中。每日早晚各皮下注射1次东莨菪碱(0.5mg/0.1mL、0.2 mL/只),间隔12h,饲养14天作为混合型干眼小鼠模型。对照组饲养在正常环境中(湿度60-80%、温度21-23℃)。
除另外说明外,本实施例中基因表达采用相对定量分析。将各样品目的基因表达量分别除以内参β-actin,得到的数值即为内参校正后各样品中目的基因相对表达量,设定对照组为1,其他组相比对照组的值即为目的基因相对表达量。
本申请中简写与全称对照:
CMTM6: Chemokine-like factor-like MARVEL transmembrane domain-containing family member 6 (CMTM6);
IL-1β: Interleukin-1β,白细胞介素-1β;
TNF-α: tumor necrosis factor-α, 肿瘤坏死因子;
IL-6: Interleukin-6,白细胞介素6;
ZO-1: zonula occludens 1, 闭锁小带蛋白1。
除另外说明外,本实施例中蛋白表达采用相对定量分析。将各样品目的蛋白表达面积分别除以内参β-actin表达面积,得到的数值即为内参校正后各样品中目的蛋白相对表达量,设定对照组为1,其他组相比对照组的值即为目的蛋白相对表达量。目的蛋白表达面积=使用IamgeJ软件分析目的蛋白条带面积/内参蛋白条带面积×100%。
实施例1 CMTM6在正常小鼠角膜上皮高表达的研究
1、实验步骤:选取体重在18-20g范围内的雌性C57BL/6J小鼠,使用CO
2、实验结果:免疫组化染色结果显示(图1),CMTM6主要分布在角膜组织的角膜上皮,在角膜上皮表达量比角膜基质高,提示CMTM6参与维持角膜上皮稳态。
实施例2 健康人与干眼患者的结膜印记细胞中CMTM6表达差异研究
1、实验步骤:收取北京大学第三医院眼科就诊的健康对照组(20例)与干眼患者(38例),干眼诊断标准参考2020年中华医学会眼科学分会《中国干眼专家共识:诊断》:患者主诉有眼部干涩感、异物感、烧灼感、疲 劳感、不适感、眼红、视力波动等主观症状之一,中国干眼问卷量表≥7分或眼表疾病指数(ocular surface disease index,OSDI)≥13分;同时,患者FBUT≤5 s或NIBUT<10 s或Schirmer I试验(无麻醉)≤5 mm/5 min,可诊断干眼。
并依据2020年中华医学会眼科学分会《中国干眼专家共识:诊断》对干眼分级的标准,将38例干眼患者分为轻度干眼组(8例)和中重度干眼组(30例)。
本研究需要收集患者的临床资料和眼科检查的相关结果,包括:临床信息(年龄、性别、既往史),眼部一般检查(视力、眼压、验光)和干眼相关检查(OSDI评分、TBUT、角膜荧光素钠染色评分、泪液分泌功能、泪河高度、CMTM6 mRNA水平检测)的结果。
CMTM6 mRNA 水平:将醋酸纤维膜制备成半圆形小纸片,环氧乙烷灭菌后待用。让患者取半坐位或平卧位,检查前用盐酸丙美卡因进行眼表表面麻醉,3 ~ 5min后,消毒无镊夹住醋酸纤维膜一角将其贴于球结膜表面,用消毒玻棒轻轻加压5 ~ 10 s后撕下,置于裂解液中。随后按照试剂盒说明书提取结膜组织RNA,并将总RNA逆转录合成单链互补脱氧核糖核酸(complementary DNA,cDNA)。以上述得到的cDNA作为模板,检测目标基因CMTM6的表达,使用Real-time PCR仪进行扩增,采用2-
2、实验结果:RT-PCR实验结果显示,与正常对照组相比,干眼患者结膜印记细胞中TNF-α基因表达水平升高(图2 -A),CMTM6基因表达水平降低(图2-B),提示干眼患者炎症反应增强,结膜稳态的CMTM6表达降低,CMTM6参与干眼发生发展。与轻度干眼患者相比,中重度干眼患者结膜印记细胞中CMTM6表达降低(图2-C),提示CMTM6可以作为干眼分级的生物标志物,检测CMTM6基因表达水平可精确区分轻度干眼与中重度干眼。
实施例3 干眼小鼠角膜组织CMTM6表达变化差异研究
本实施例通过建立干眼小鼠模型,通过RT-PCR、Western blot实验,验证CMTM6在干眼小鼠角膜组织中的表达。
1、实验步骤:选取体重在18-20g范围内的雌性C57BL/6J小鼠,随机分为正常对照组(NC)及干眼组(DE),造模。置于干燥环境(湿度15±3%、风速3-5m/s、温度21-23℃)中。每日早晚各皮下注射1次东莨菪碱(0.5mg/0.1mL、0.2 mL/只),间隔12h,饲养14天作为混合型干眼小鼠模型。对照组饲养在正常环境中(湿度60-80%、温度21-23℃)。14天后,取角膜,通过RT-PCR检测CMTM6基因表达,通过Western blot检测CMTM6蛋白表达。
2、实验结果:RT-PCR结果显示,与正常对照组相比,干眼小鼠角膜组织CMTM6基因表达显著降低(图3-A);Western blot结果显示,与正常对照组相比,干眼小鼠角膜组织CMTM6蛋白表达显著降低(图3-B)。
以上结果提示,干眼小鼠模型中CMTM6表达显著低于对照组,与炎症反应呈负相关趋势。
实施例4 CMTM6基因敲除后对小鼠干眼的眼表损伤及疾病严重程度的影响
本实施例使用野生型小鼠(WT)和CMTM6基因敲除小鼠(Cmtm6
1、实验步骤:将WT小鼠和Cmtm6
2、实验结果:CMTM6基因敲除后,正常稳态条件下,野生型小鼠与CMTM6基因敲除小鼠的眼表损伤情况(图4-A)和泪液分泌情况(图4-B)没有明显差异。将野生型小鼠与CMTM6基因敲除小鼠制作干眼模型,干眼发生后,CMTM6基因敲除小鼠的干眼病情更重,表现为荧光素钠染色评分更高(图4-C)、泪液分泌量更少(图4-D)。
以上结果提示,CMTM6敲除后,干眼更加严重,CMTM6在干眼发生过程中发挥保护作用。
实施例5 CMTM6基因敲除后干眼小鼠角膜组织及泪液中炎性因子表达情况
本实施例使用野生型小鼠(WT)和CMTM6基因敲除小鼠(Cmtm6
1、实验步骤:(1)Trizol法提取角膜组织总RNA后分光光度计确定 RNA浓度及纯度,取2 μg RNA反转录,构建相应目的基因引物,RT-PCR检测角膜、结膜组织中Il1b、Tnfa、Il6表达水平。(2)稀释上清:使用移液枪取小鼠泪液,每眼2μl,离心后吸取上层液体于新离心管中。取BD Cytometric Bead Array Mouse Inflammation试剂盒中的dilutionbuffer,按1:5稀释上清5~8倍;混合微球:取出微球,涡旋振荡< 1000 rpm,5~6 s,使微球充分混匀。每种微球各取出5 μL于离心管中,涡旋振荡使其充分混合。每个流式管中加入50 μL稀释后的组织匀浆上清,涡旋振荡 4~5 s,室温、避光孵育2 h;加检测抗体:取出Detection reagents并充分混匀,室温、避光孵育2 h;清洗微球:加入1 mL wash buffer于离心管中,室温200 g,离心5 min。弃掉上清后用400 μL wash buffer重悬微球,待上机。
2、实验结果:与野生型干眼小鼠相比,CMTM6敲除小鼠干眼发生后,角膜组织炎性因子Il1b、Tnfa、Il6表达升高(图5-A、B、C),泪液中TNF-α分泌增加(图5-D)。
以上结果提示,干眼发生后,CMTM6可抑制炎性因子表达分泌。
实施例6 CMTM6基因敲除后干眼小鼠紧密连接蛋白ZO-1表达情况分析
本实施例使用野生型小鼠(WT)和CMTM6基因敲除小鼠(Cmtm6
1、实验步骤:取下角膜后,4%多聚甲醛固定10分钟,丙酮3分钟,封闭1小时,一抗4℃孵育过夜,二抗室温孵育1小时,封片后使用共聚焦显微镜拍摄图片。
2、实验结果:正常稳态下,野生型小鼠与CMTM6基因敲除小鼠的角膜紧密连接蛋白ZO-1表达和分布均形成致密网状结构,结构与表达量没有明显差异。干眼发生后,野生型小鼠ZO-1网状结构被破坏,表达量降低,而CMTM6基因敲除小鼠的ZO-1结构破坏更加严重,表达量进一步减少(图6)。
以上结果提示,敲减后,紧密连接蛋白ZO-1破坏更严重,CMTM6可通过保护紧密连接蛋白ZO-1从而在干眼中发挥保护作用。
实施例7 CMTM6基因敲减后,高渗刺激人永生化角膜上皮细胞(HCE-T)后炎性因子表达情况
本实施例使用慢病毒载体系统,在人永生化角膜上皮细胞中敲减CMTM6表达,使用高渗刺激HCE-T后,行RT-PCR及CBA检测炎性因子基因水平和蛋白水平表达差异。
1、实验步骤:shRNA 慢病毒主质粒为GIPZ Lentiviral shRNAmir(购自Thermo公司)。该载体为CMV 启动子,具有 Turbo-GFP 筛选标记,嘌呤霉素(Puromycin)真核抗性,以及氨苄西林(Ampicillin)原核抗性。
慢病毒包装:采用的敲减CMTM6的主质粒分别为shN(对照)、shCMTM6-150和shCMTM6-406,辅助质粒为psPAX2和pmD2G,各质粒之间的比例为3:2:1,总量为20µg,分别为10.02μg,6.68μg和3.34μg。将HEK-293T细胞提前铺于10 cm细胞培养皿中,细胞贴壁并且密度达到60%~80%时进行转染。取20μg总量的质粒加入PBS中至总体积500μl,涡旋混匀后室温放置。取10μl VigoFect转染试剂加入PBS中至总体积500μl,涡旋混匀后,逐滴加入稀释的DNA溶液中,轻轻混匀后,转染工作液在室温放置15min。将转染混合物均匀滴加入培养孔中。十字型轻柔的晃动培养板,使转染混合物更加均匀分布,放入培养箱继续培养。培养6 h后更换新鲜培养液,继续培养至48 h后收集培养液上清,2000 rpm,离心5 min,重复离心一次去除细胞碎片。放置于-80℃保存备用。
慢病毒感染:将待转染的细胞提前铺于六孔板中,使细胞在感染时密度达到 30%~50%。加入含20μg/mL Polybrene的1ml完全培养基,对待转染的细胞换液。在病毒专用超净台中,向细胞加入1ml含有慢病毒的培养上清,并十字摇动六孔板,以使病毒均匀分布在培养皿中。把细胞重新放入病毒专用培养箱中,继续培养。培养48小时或72小时后荧光显微镜下观察感染效率。并加嘌呤霉素筛选扩增或流式分选GFP阳性的细胞。
将细胞铺于十二孔板或六孔板中,待细胞密度长到70%~80%左右时,使用高渗溶液刺激细胞,刺激8小时后收细胞行RT-PCR实验,刺激24小时后收细胞上清行CBA实验。
2、实验结果:RT-PCR结果及Western blot实验显示(图7-A、B),CMTM6基因水平及蛋白水平均敲减成功。使用高渗溶液刺激HCE-T后,空载对照组炎性因子Il1b、Tnfa、Il6基因表达水平升高,而敲减CMTM6后,这些炎性因子的表达水平进一步升高(图7-C、D、E);CBA结果显示,空载对照组IL-6蛋白分泌水平升高,而CMTM6敲减后,IL-6分泌水平进一步升高(图7-F)。
以上结果提示,在高渗刺激的HCE-T中,CMTM6可发挥抑制促炎因子表达的保护作用。
虽然本发明已以实施例公开如上,然其并非用于限定本发明,任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种不同的选择和修改,因此本发明的保护范围由权利要求书及其等同形式所限定。
- 一种血清外泌体miR-3614-3p作为眼肌型重症肌无力诊断性生物标志物的应用
- 一种血清外泌体miR-320d作为眼肌型重症肌无力诊断性生物标志物的应用
