PD-L1抑制剂在制备治疗肿瘤放疗药物中的应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及放疗药物技术领域,具体涉及PD-L1抑制剂在制备治疗肿瘤放疗药物中的应用。
背景技术
头颈部鳞状细胞癌(head and neck squamous cell carcinoma, HNSCC)是全球范围内排名第6的恶性肿瘤,口咽鳞状细胞癌(oropharyngeal squamous cell carcinoma,OPSCC)是HNSCC重要组成类型,主要起源于舌根、扁桃体、软腭和咽后壁的黏膜上皮。由于解剖结构限制,手术难于实施,放射治疗成为OPSCC患者的主要治疗方式。放射治疗主要通过使用直线加速器产生的高能光子和放射性核素衰变产生的射线来治疗肿瘤。一方面,X线或电子线所携带的能量沉积在DNA上直接引起DNA的单链断裂和双链断裂(double-strandbreaks, DSBs),另一方面,射线使水分子发生电离,并通过线粒体途径和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide Adenine Dinucleotide Phosphate, NADPH)氧化酶途径产生大量活性氧引起氧化应激,进而杀伤肿瘤细胞。调强放疗(IMRT)作为一种新型放射治疗手段,已被广泛应用于OPSCC的放射治疗,其可通过减少周围正常器官组织的非必要辐射暴露来最大限度地减轻并发症。根据2022版《CSCO头颈肿瘤诊疗指南》,早期OPSCC患者可选择手术治疗或单纯放射治疗;而对于局部晚期患者,手术治疗后通常需要联合术后放疗或同步放化疗;对于不能手术或有保喉意愿的患者,同步放化疗或诱导化疗联合同步/单纯放射治疗是更好的非手术选择。
EGFR是一种酪氨酸激酶型受体,与肿瘤血管生成、细胞增殖、侵袭、转移及细胞凋亡的抑制密切相关。EGFR在超过90% HNSCC中呈高表达,且与肿瘤患者的不良预后密切相关。目前,EGFR的单克隆抗体西妥昔单抗已被FDA批准用于复发/转移OPSCC的一线治疗。对于不适宜使用顺铂的局部晚期OPSCC患者,可给予放疗联合西妥昔单抗治疗。EGFR通过与其配体EGF结合,诱导下游信号通路激活,如Ras/Raf/MAPK/ERK、PI3K/Akt/mTOR、JAK/STAT信号通路等,进而促进细胞增殖及肿瘤细胞辐射抵抗。西妥昔单抗能够通过阻断EGFR与其配体的结合抑制其下游信号通路激活,促进肿瘤细胞死亡及辐射敏感性的增加。DNA损伤能够诱导组蛋白H2A家族成员X(H2A histone family member X, H2AX)的磷酸化,产生γH2AX,γH2AX 被认为是评估DNA损伤程度和修复能力的准确生物标志物。西妥昔单抗能够抑制辐照诱导的DNA损伤修复,这一点已经从γH2AX 的积累中证明。在HNSCC中,西妥昔单抗不仅能增强外照射的辐射敏感性,当与放射性核素结合时,西妥昔单抗也能够将照射源靶向定位至EGFR表达丰富的HNSCC细胞,进一步增强肿瘤细胞的辐射敏感性。因此,放疗联合西妥昔单抗已经成为目前临床治疗HNSCC患者的常用手段。相比于单纯放射治疗,接受放射治疗联合西妥昔单抗治疗的HNSCC患者的5年总生存率仅提高10%~25%,限制其疗效的分子机制仍不明确。因此,解析放疗联合西妥昔单抗治疗疗效受限的潜在分子机制,开发增强放疗联合西妥昔单抗的疗效的新方案迫在眉睫。
抗肿瘤免疫取决于STING的激活,然而,STING激活也能够促进PD-L1的表达。STING下游活化的IRF3可以直接与PD-L1的上游启动子结合,促进PD-L1的表达。此外,TME中激活的免疫杀伤细胞能够分泌大量的IFN-γ,IFN-α、IFN-β和IFN-γ能够分别通过IFN受体IFNAR和IFNGR激活肿瘤细胞JAK/STAT1/IRF1信号,促进PD-L1的表达。IL-6被报道能够通过JAK2/STAT3信号通路的激活直接作用于PD-L1的上游启动子诱导多种肿瘤细胞中PD-L1的转录,也能够通过STAT3激活IRF1,从而促进PD-L1转录。在三阴性乳腺癌患者中,DNA损伤诱导的STING活化提高了IL-6的表达,IL-6通过其受体激活STAT3,从而诱导了PD-L1的表达,使用STAT3抑制剂能够显著降低PD-L1并提高免疫细胞介导的癌细胞死亡。然而,放疗联合西妥昔单抗是否共同调控STING介导免疫细胞浸润及PD-L1表达未见报道。
发明内容
为解决上述问题,本发明提供了PD-L1抑制剂在制备治疗肿瘤放疗药物中的应用。
为实现上述目的,本发明采取的技术方案为:
PD-L1抑制剂在制备治疗肿瘤放疗药物中的应用。
PD-L1抑制剂联合西妥昔单抗在制备肿瘤放疗药物中的应用。
进一步地,所述肿瘤为咽鳞状细胞癌。
进一步地,所述肿瘤放疗药物用于抑制STING信号激活上调的PD-L1表达。
上述方案中,提供了一种新的联合用药组合,达到了提高肿瘤治疗效果的目的。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1 Western Blot方法检测梯度辐照后Fadu中PD-L1的表达,其中,量化数据用X± SD(n = 3)表示,* P<0.05 vs. IR = 0 Gy。
图2 Western Blot方法检测西妥昔单抗处理后Fadu中EGFR的磷酸化水平和PD-L1表达;其中,量化数据用X ± SD(n = 3)表示,* P<0.05 vs. CTX = 0 μg/ml。
图3 辐照联合西妥昔单抗增加PD-L1蛋白的表达;
图中:A:Western Blot方法检测PD-L1蛋白的表达;B:流式细胞术检测细胞表面PD-L1蛋白表达;其中,量化数据用X ± SD(n = 3)表示,*P<0.05 vs. con,&P<0.05 vs.CTX,#P<0.05 vs. IR。
图4 辐照联合西妥昔单抗增加PD-L1的转录;
图中:A:RT-qPCR方法检测PD-L1 mRNA表达;B:Western Blot方法检测处理24 h和48 h后PD-L1蛋白的表达;其中,量化数据用X ± SD(n = 3)表示,*P<0.05 vs. con,&P<0.05 vs. CTX,#P<0.05 vs. IR。
图5 辐照联合西妥昔单抗诱导DNA损伤(Western Blot方法检测γH2AX和cGAS蛋白的表达,量化数据用X ± SD(n = 3)表示,* P<0.05 vs. con,&P<0.05 vs. CTX,# P<0.05 vs. IR)。
图6 辐照联合西妥昔单抗诱导STING激活(Western Blot方法检测STING和IRF3蛋白的磷酸化,量化数据用X ± SD(n = 3)表示,* P<0.05 vs. con,&P<0.05 vs. CTX,# P<0.05 vs. IR)。
图7 抑制STING降低辐照联合西妥昔单抗诱导的STING激活(Western Blot方法检测加入STING抑制剂时辐照联合西妥昔单抗处理后pSTING、pIRF3的表达;量化数据用X ±SD(n = 3)表示,* P<0.05 vs. con,&P<0.05 vs. CTX,# P<0.05 vs. IR,## P<0.05 vs.CTX+IR)。
图8 抑制STING降低辐照联合西妥昔单抗诱导的PD-L1表达
图中:A:Western Blot方法检测加入STING抑制剂时辐照联合西妥昔单抗处理后PD-L1蛋白的表达;B:RT-qPCR方法检测PD-L1 mRNA表达,其中,量化数据用X ± SD(n = 3)表示,* P<0.05 vs. con,&P<0.05 vs. CTX,# P<0.05 vs. IR,## P<0.05 vs. CTX+IR。
图9 构建Fadu-shPD-L1细胞系
图中:A:成功转染PD-L1-shRNA及空载质粒的Fadu细胞,荧光显微镜下表达绿色荧光蛋白GFP;B:Western Blot方法检测PD-L1蛋白的表达,RT-qPCR方法检测PD-L1 mRNA表达;其中,量化数据用X ± SD(n = 3)表示,* P<0.05 vs. con。
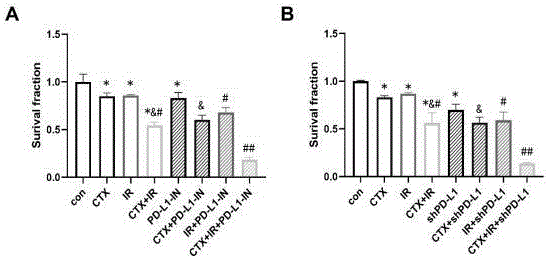
图10 PD-L1敲低和抑制增强辐照联合西妥昔单抗的细胞毒性;图中:A:CCK-8方法检测使用PD-L1抑制剂的Fadu细胞在辐照和西妥昔单抗处理后的细胞存活分数;B:CCK-8方法检测Fadu-shPD-L1细胞在辐照和西妥昔单抗处理后的细胞存活分数。量化数据用X ±SD(n = 3)表示,* P<0.05 vs. con,&P<0.05 vs. CTX,# P<0.05 vs. IR,## P<0.05 vs.CTX+IR。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
1 证实辐照联合西妥昔单抗促进口咽鳞状细胞癌PD-L1表达
Fadu细胞培养至70~80%,使用西妥昔单抗(0、5、10 μg/ml)孵育24 h,或者接受0、2、4、6 Gy X射线照射后再培养24 h,收取细胞。检测pEGFR、EGFR的表达,确认西妥昔单抗能够抑制EGFR的磷酸化;检测肿瘤细胞PD-L1的表达。明确放疗和西妥昔单抗均能够诱导Fadu细胞PD-L1表达上调。
选取能够明显诱导PD-L1表达上调的西妥昔单抗浓度和辐照剂量,将Fadu分为四组:对照组(con),照射组(IR),西妥昔单抗组(CTX),照射联合西妥昔单抗组(CTX+IR),分别检测PD-L1的mRNA、总蛋白和细胞表面PD-L1的表达。证实辐照联合西妥昔单抗诱导OPSCC细胞PD-L1的高表达。
2 明确辐照联合西妥昔单抗诱导STING激活上调PD-L1表达
根据上述实验选取的西妥昔单抗浓度和辐照剂量,仍将Fadu分为四组:对照组(con),照射组(IR),西妥昔单抗组(CTX),照射联合西妥昔单抗组(CTX+IR),分别检测四组细胞中γH2AX、cGAS、pSTING、pIRF3、STING、IRF3等的表达,证明辐照联合西妥昔单抗诱导STING信号的激活。然后在四组中分别应用STING抑制剂,再检测各组pSTING、pIRF3、STING、IRF3、PD-L1的表达。明确辐照联合西妥昔单抗通过诱导STING信号激活上调PD-L1表达。
3 证明阻断PD-L1能够增强辐照联合西妥昔单抗的细胞毒性
利用携带PD-L1-shRNA的慢病毒感染Fadu细胞,筛选单克隆传代培养鉴定后获得稳定敲低PD-L1的Fadu-shPD-L1细胞系。按照实验1所筛选的条件处理Fadu细胞,然后与PBMC按照1:3的比例共培养24 h,同时给予PD-L1抑制剂,使用CCK-8检测Fadu细胞的存活。使用稳定敲低PD-L1的Fadu-shPD-L1细胞系代替PD-L1抑制剂重复上述实验。证明阻断PD-L1能够增强辐照联合西妥昔单抗的细胞毒性。
结果
1 )辐照和西妥昔单抗上调PD-L1的表达
使用OPSCC细胞系Fadu,分别采用0、2、4、6 Gy X射线进行照射,继续培养24 h后检测PD-L1的表达情况,结果显示,与对照组相比,辐照以剂量依赖性增加PD-L1的表达(P<0.05,图 1)。
使用0、5、10 μg/ml 西妥昔单抗处理细胞后,pEGFR的表达在5、10 μg/ml时均被抑制,伴随着PD-L1的表达的上调(P<0.05,图 2)
2 )辐照联合西妥昔单抗增加PD-L1的表达
采用0、4 Gy和0、5 μg/ml 西妥昔单抗联合处理Fadu细胞,结果显示,相比于辐照或西妥昔单抗单独处理组,联合处理组中PD-L1的蛋白表达更高,差异具有统计学意义(P<0.05,图 3 A)。使用流式细胞术检测了细胞表面PD-L1的改变,结果显示联合处理组相较于单独处理组提高了PD-L1在细胞表面的表达水平(P<0.05,图 3B)。
为了检测PD-L1的转录水平改变,我们使用RT-qPCR检测PD-L1 mRNA的表达。结果显示,辐照或西妥昔单抗单独处理均能够增加PD-L1的转录,联合处理组相较于单独处理组提高了PD-L1的mRNA表达水平(P<0.05,图 4 A)。检测辐照和西妥昔单抗联合处理后不同时间点PD-L1的表达,结果提示,与对照组相比,在联合处理后24 h和48 h均能够观察到PD-L1的上调(P<0.05,图 4B),但24 h组和48 h组之间没有统计学差异。因此我们选择24h为我们的差异时间点。
3) 辐照联合西妥昔单抗诱导STING的激活
采用0、4 Gy和0、5 μg/ml 西妥昔单抗分别或联合处理Fadu细胞,首先检测了细胞内DNA损伤指标γH2AX和cGAS表达改变,结果显示,与对照组相比,西妥昔单抗和辐照单独处理后,DNA双链断裂的标志物γH2AX明显增多,联合处理进一步促进了γH2AX的增加,同样的,cGAS也显示出相似的变化,西妥昔单抗和辐照分别处理后cGAS的表达较对照组上调,联合处理组cGAS的表达与单独处理组相比出现了更高的上调水平,差异具有统计学差异(P<0.05,图 5)。
我们进一步检测了cGAS下游STING和IRF3的磷酸化水平,结果显示,相比于对照组,pSTING和pIRF3的水平在西妥昔单抗和辐照分别处理后显著上调,联合处理组STING和IRF3的磷酸化进一步增加(P<0.05,图 6)。
4 )抑制STING降低辐照联合西妥昔单抗诱导的PD-L1表达
为了验证STING信号介导了辐照联合西妥昔单抗诱导的PD-L1的高表达,我们使用了STING抑制剂C170处理Fadu细胞。结果显示,与对照组相比,STING抑制剂能够明显抑制STING和IRF3的磷酸化,同样的,应用STING抑制剂后,西妥昔单抗和辐照诱导的STING和IRF3的磷酸化也被显著抑制(P<0.05,图7)
接下来我们检测了使用STING抑制剂后PD-L1的表达水平。给予STING抑制剂处理后,西妥昔单抗和辐照所诱导的PD-L1 mRNA及蛋白表达均降低(P<0.05,图8 A和B)。
5 )阻断PD-L1能够增强辐照联合西妥昔单抗的细胞毒性
采用慢病毒感染法,将包含PD-L1-shRNA的质粒转染至Fadu细胞中,shPD-L1-NC组转入空载质粒。转染后48 h,可见shPD-L1-NC组和shPD-L1组细胞均有绿色荧光蛋白GFP的表达(图 9 A);嘌呤霉素筛选后,Western Blot及RT-qPCR鉴定PD-L1蛋白和mRNA的表达(P<0.05,图 9 B),获得稳定的PD-L1敲低Fadu-shPD-L1细胞。shPD-L1-NC组Fadu细胞PD-L1蛋白表达和正常对照组没有差异(P<0.05,图 9 B)。
为了验证PD-L1抑制能否增加辐照联合西妥昔单抗的细胞毒性作用,我们将辐照和西妥昔单抗处理后的细胞与PBMC按照1:3的比例共培养24 h,同时给予PD-L1抑制剂,使用CCK-8检测Fadu细胞的存活。结果提示单独辐照和西妥昔单抗轻度减少了Fadu细胞的存活分数,二者联用进一步降低了细胞的存活,而使用PD-L1抑制剂后,辐照联合西妥昔单抗的细胞毒性作用显著增强,细胞存活进一步减少(P<0.05,图 10 A)。此外,我们使用PD-L1敲低的Fadu-shPD-L1细胞来进行验证,Fdau细胞中PD-L1敲低显示出了与PD-L1抑制剂相似的结果(P<0.05,图 10 B)。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- DPCPX抑制剂在制备PD-L1/PD-1单抗肿瘤免疫治疗药物中的应用
- DPCPX抑制剂在制备PD-L1/PD-1单抗肿瘤免疫治疗药物中的应用
