一种氢化镁基储氢材料的制备方法及其产品
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及储氢材料的技术领域,尤其涉及一种原位引入氢泵和氢通道催化物质的氢化镁基储氢材料的制备方法及其产品。
背景技术
随着工业革命的开始和技术的日益革新,人类对于能源的需求越来越大。而高新技术不断发展并且得以应用的必要条件之一是找到一种绿色可再生能源。可再生能源包括地热能、潮汐能、光能、风能、氢能等,其中氢能具有高达142MJ/Kg的能量热值,反应产物是水,清洁无污染。而且氢能可以充当二次能源与其他形式的能源进行互相转换。氢能的应用环节包括制氢、储氢和用氢,而储氢是制约其大规模应用的瓶颈。储氢方式按氢气的物理状态可分为气态储氢、液态储氢和固态储氢,气态储氢的体积储氢密度较低,液态储氢在低温液化过程需要消耗较多的能量,固态储氢由于其高质量/体积储氢密度和储氢方便的特点成为了氢能领域研究的热点。
固态储氢中的MgH
部分氧化物充当稳定的催化剂降低MgH
XRD和红外光谱证实了掺杂ZrO
在申请人以前的工作中(K.Xian,M.Wu,M.Gao,S.Wang,Z.Li,P.Gao,Z.Yao,Y.Liu,W.Sun and H.Pan,A Unique Nanoflake-Shape Bimetallic Ti-Nb Oxide of SuperiorCatalytic Effect for Hydrogen Storage of MgH
因此,寻找制备方法简单、低成本、高产量并且具有高活性的催化剂是MgH
发明内容
针对现有技术中存在的上述问题,本发明公开了一种原位引入氢泵和氢通道催化物质的氢化镁基储氢材料的制备方法,简单可控,成本低、适合大规模工业化生产,更为重要的是制备得到的复合储氢材料大大提高了MgH
具体技术方案如下:
一种氢化镁基储氢材料的制备方法,将包括氢化镁和钒酸镧的原料进行球磨混合,经一次循环活化后得到氢化镁基储氢材料。
优选的,所述钒酸镧的制备方法如下:
将镧源、钒源、络合剂与去离子水混合,经喷雾干燥法制备得到粉末,再经高温烧结后得到所述钒酸镧;
所述高温烧结的温度为200~600℃,时间为3~12h。
本发明公开了一种通过喷雾干燥法制备的钒酸镧作为添加剂,通过与氢化镁在氢压下球磨共混并且进行一次放吸氢活化后得到复合储氢材料的方法。经试验发现,该方法制备得到的钒酸镧中含有氧空位,并且与氢化镁共混活化后原位转化为VH
经试验发现,若将氢化镁与上述两种活性物质直接共混后球磨再活化,而非采用本申请中的原位转化的方式获得,则制备得到的复合储氢材料性能会出现劣化,尤其是循环稳定性会变差。
相对于向氢化镁中单独添加氢化镧或单独添加VH
经试验还发现,当采用喷雾干燥法制备钒酸镧时,后续的高温烧结温度对于制备得到的钒酸镧的微观形貌有着至关重要的影响,且进一步影响其对于氢化镁的活化性能。
当高温烧结的温度较低(200℃)时,产物仅为光滑球形结构,仅具有一级结构,且为非晶态;当温度升高至300~400℃时,产物也具有球形结构,但球形表面相对粗糙;当温度升高至500~600℃时,制备的LaVO
优选的,所述高温烧结的温度为500~600℃;更优选,所述高温烧结的温度为500℃。经试验发现,采用上述不断优选的高温烧结的温度制备钒酸镧,最终制备的添加钒酸镧的复合储氢材料的储氢性能不断提高。
所述的喷雾干燥法采用本领域常规的工艺流程即可。
所述络合剂选自柠檬酸、乙二胺四乙酸、六偏磷酸钠等本领域常见种类。原料液中络合剂的浓度为0.2~0.4mol/L。
优选的,氢化镁和钒酸镧的质量比为(80~95):(5~20);进一步优选为85:15。
经试验发现,随着两者质量比的不断优化,最终制备的复合储氢材料的储氢性能不断提高;尤其是当两者质量比为85:15时,最终制备的复合储氢材料体系具有更低的放氢温度和相对更高的放氢容量。
所述球磨,转速为300~500转/分,球料比为120~180:1,时间为6~18h,气氛选自氢气。
所述一次循环活化,将反应器抽真空,升温至不低于400℃,再降至室温;向反应器内充氢气至压力为3~10MPa,升温至200~400℃,保温至少1小时后得到氢化镁基储氢材料。
本发明还公开了根据上述方法制备的氢化镁基储氢材料,起始放氢温度为185~212℃,起始吸氢温度为室温(一般情况下的室温视为25℃,当夏季温度较高时视为30℃),300℃时放氢量不低于4.7wt%。在最优条件下,制备的氢化镁基储氢材料,起始放氢温度为185℃;加热到250℃以后再保温3分钟即可释放5.7wt%H
与现有技术相比,本发明具有如下优点:
本发明公开了一种原位引入氢泵和氢通道催化物质的氢化镁基储氢材料的制备方法,简单可控,成本低、适合大规模工业化生产。本发明制备得到的复合储氢材料体系原位引入了可以作为氢泵和氢通道的两种活性催化剂,大大提高了MgH
附图说明
图1为实施例1~5分别制备的LaVO
图2为实施例1制备的LaVO
图3为实施例1~5分别制备的LaVO
图4为实施例1制备的LaVO
图5为实施例1制备的LaVO
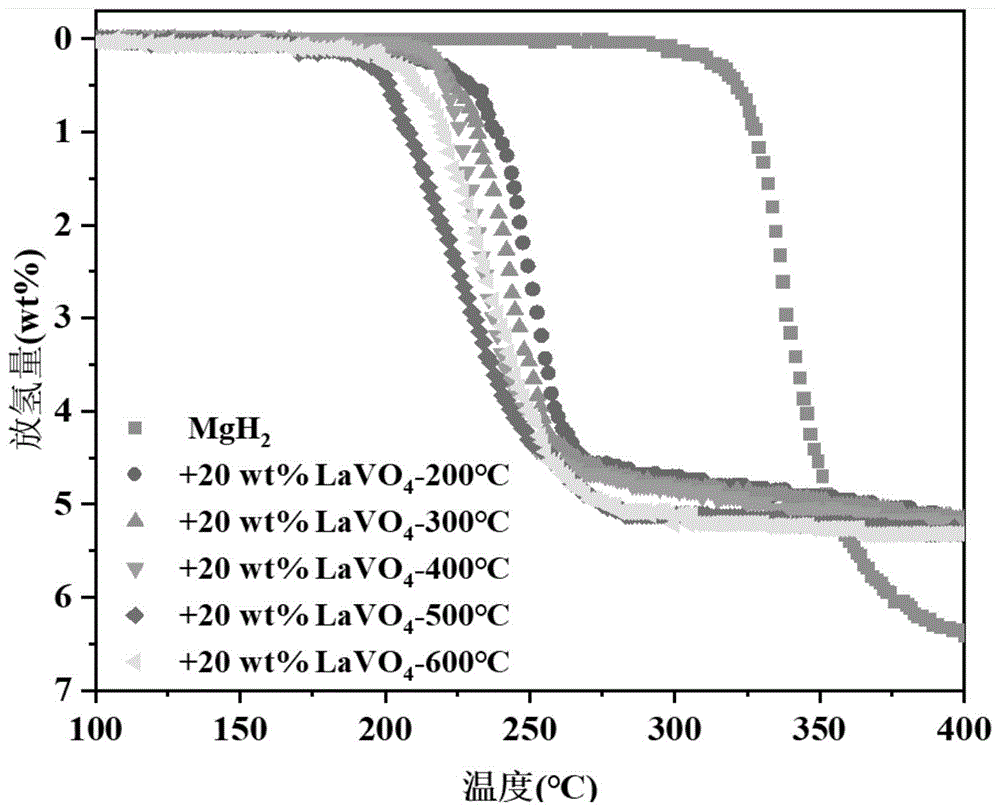
图6为对比例1、实施例1~5分别制备产物的随温放氢性能曲线;
图7为对比例1、实施例1和实施例6~8分别制备产物的随温放氢性能曲线和随温吸氢曲线;
图8为实施例8制备的复合储氢材料分别在210℃、230℃、250℃的等温放氢曲线(a),并给出对比例1制备的产物的放氢曲线进行对比;实施例8制备的复合储氢材料分别在50℃、100℃、150℃的吸氢曲线(b),并给出对比例1制备的产物的吸氢曲线进行对比;
图9为实施例8制备的复合储氢材料随温放氢循环曲线;
图10为实施例8制备的球磨产物、球磨产物分别加热到250℃、300℃、350℃、400℃后的样品,以及最终制备的复合储氢材料及经五十次吸氢后样品的XRD图谱;
图11为实施例8制备的球磨产物、最终产物及对该最终产物进行五十次吸氢后样品中V元素的XPS图谱;
图12为实施例8和对比例2分别制备的产物的随温放氢图。
具体实施方式
以下结合实例对本发明的具体实施方法进一步进行说明,在这里需要说明的是,此处所描述的具体实施方法只是为了说明和解释本发明,并不用于限制本发明的保护范围。
下列实施例中未注明具体条件的操作方法,通常按照常规条件,或按照制造厂商所建议的条件。
实施例1
将23.7g乙酸镧、8.8g醋酸钒、31.5g柠檬酸添加到0.5L去离子水中,在室温下将溶液机械搅拌1h使其充分均匀,然后连接到喷雾干燥机中,用蠕动泵将溶液送到喷嘴,在高温高压的气体作用下喷雾热解得到前驱体,喷雾干燥过程中进出口温度分别设置为230℃和100℃,蠕动泵速度为1L/h。将得到的前驱体收集在刚玉坩埚中,放入箱式炉在500℃下烧结处理5h得到钒酸镧(LaVO
将80wt%的MgH
实施例2
制备工艺与实施例1基本相同,区别仅在于制备LaVO
实施例3
制备工艺与实施例1基本相同,区别仅在于制备LaVO
实施例4
制备工艺与实施例1基本相同,区别仅在于制备LaVO
实施例5
制备工艺与实施例1基本相同,区别仅在于制备LaVO
图1为实施例1~5分别制备的LaVO
图2为实施例1制备的LaVO
图3为实施例1~5分别制备的LaVO
图4为实施例1制备的LaVO
图5为实施例1制备的LaVO
对比例1
将MgH
实施例6
制备工艺与实施例1中基本相同,区别仅在于将MgH
实施例7
制备工艺与实施例1中基本相同,区别仅在于将MgH
实施例8
制备工艺与实施例1中基本相同,区别仅在于将MgH
对比例2
镧粉在450℃/5.0MPa H
按照1:3的摩尔比称取原料VCl
将85wt%的MgH
性能测试:
1、随温放氢采用体积放氢法测试材料的放氢性能,在初始真空度为1×10
图6为对比例1、实施例1~5分别制备产物的随温放氢性能曲线。可以看出,起始放氢温度的高低排序为:实施例1<实施例5<实施例4<实施例3<实施例2<对比例1。可以看出,实施例1中作为添加剂的钒酸镧(500℃烧结)的催化活性最高,之后进行的调整添加剂含量的测试中都添加500℃烧结制备的钒酸镧。总体规律而言,烧结温度越高,催化活性越高,这可能是由于随着烧结温度增加制备得到的钒酸镧结晶性提高。然而实施例1的催化活性却高于实施例5,可能是因为实施例1制备的钒酸镧二级球体尺寸更小,结构更为致密,从而获得更多催化活性位点,使得实施例1的性能优于实施例5。实施例1具有最低的起始放氢温度和结束放氢温度,分别为185℃和280℃,相比之下,对比例1的起始放氢温度为290℃,远高于实施例1。对比例1、实施例1~5分别制备产物的随温放氢性能数据列于下表1中。
表1
图7为对比例1、实施例1和实施例6~8分别制备产物的随温放氢性能曲线和随温吸氢曲线。随着钒酸镧添加量从5wt%增加到15wt%,起始放氢温度从197℃下降到185℃,添加量进一步增加到20wt%时起始放氢温度不变而放氢量下降。对于吸氢而言,对比例1的起始吸氢温度为140℃,而有添加钒酸镧的体系都从室温就开始吸氢了,其中实施例1制备的复合储氢材料在250℃保温1小时以后的吸氢量最高,为5.7wt%,与图7a中该材料加热到400℃的放氢量相近,表现出高度可逆性。由吸放氢曲线图可以分析得到钒酸镧的最优添加量为15wt%。对比例1、实施例1和实施例6~8分别制备产物的随温放氢、吸氢性能数据列于下表2中。
表2
2、采用体积放氢法测试材料在不同温度下的放氢性能和吸氢性能。放氢测试条件为在初始真空度为1×10
图8中(a)为实施例8制备的复合储氢材料分别在210℃、230℃、250℃的等温放氢曲线,并给出对比例1制备的产物的放氢曲线进行对比。如图8所示,MgH
对于吸氢而言(图8中(b)),MgH
3、采用体积放氢法测试储氢材料的循环性能。放氢过程为:在初始真空度为1×10
图9为实施例8制备的复合储氢材料随温循环放氢曲线,在50个循环后放氢量为5.2wt%H
图10为实施例8制备的球磨产物分别加热到250℃、300℃、350℃、400℃,以及最终制备的复合储氢材料及经五十次吸氢后样品的XRD图谱。观察发现,球磨后的样品仅观察到MgH
图11为实施例8制备的球磨产物、最终产物及对该最终产物进行五十次吸氢后样品中V元素的XPS图谱。观察发现,球磨产物中V位于525.1eV和517.2eV的自旋轨道峰对应于LaVO
图12为实施例8和对比例2分别制备的产物随温放氢图。可以看出实施例8制备的复合储氢材料的起始放氢温度明显低于外添11.5wt%的LaH
MgH
以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,以上应用了具体实例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。本发明所属技术领域的技术人员依据本发明的构思,还可以做出若干简单推演、变形、替换或结合。这些推演、变形、替换或结合方案也落入本发明的权利要求范围内。
