抗B7-H3抗体及其用途
文献发布时间:2023-06-19 09:24:30
发明背景
技术领域
提供了抗B7-H3抗体或其抗原结合片段及其用途。
背景技术
B7-H3(CD276)是B7家族的成员,并且是包含胞外结构域、跨膜结构域和胞内结构域的跨膜蛋白。由于外显子复制,B7-H3的两个胞外结构域由一对免疫球蛋白可变结构域和免疫球蛋白恒定结构域(2Ig B7-H3)或相同的两对免疫球蛋白可变结构域和免疫球蛋白恒定结构域(4Ig B7-H3)组成。这两种形式之间的功能差异未得到确认。B7-H3的胞内结构域是短的,并且没有已知的基序((Chapoval AI,Ni J,Lau JS,Wilcox RA,Flies DB,Liu D等人.NatImmunol 2001;2:269-74)。
B7-H3与B7家族的其他成员具有20至27%的氨基酸同一性。人B7-H3与小鼠B7-H3具有88%的氨基酸同一性。小鼠B7-H3具有一种亚型(2IgB7-H3),而人B7-H3具有两种亚型(2Ig B7-H3、4Ig B7-H3)。确认了在人体组织中4Ig B7-H3处于优势。
发现小鼠B7-H3与CD8+ T细胞的TLT1结合,从而增强了T细胞的增殖、细胞因子产生和细胞毒作用,因此提示TLT2可以充当B7-H3受体。但是,后来,在小鼠和人体内均未发现这种相互作用的证据(M.Loos,D.M.Hedderich和D.M.Hedderich等人.BMC癌症(BMCCancer),第9卷,文章463,2009)。
B7-H3蛋白并不总是在正常组织的自然杀伤细胞(NK细胞)和抗原呈递细胞(APC)中表达,但是其表达可以被诱导。尽管B7-1和B7-2的表达主要限于免疫细胞,例如抗原呈递细胞,但是B7-H3蛋白不仅存在于成骨细胞、成纤维细胞、成纤维细胞样滑膜细胞和上皮细胞中,而且还存在于人的肝脏、肺、膀胱、睾丸、前列腺、乳房、胎盘和淋巴管器官中。这种广泛的表达模式提示B7-H3,尤其是外周组织中的B7-H3具有更多样化的免疫功能和非免疫功能。
近年来,已在诸如非小细胞肺癌、肾细胞癌、神经母细胞瘤、结直肠癌、胰腺癌、胃癌、肺癌、前列腺癌、子宫内膜癌、肝细胞癌、乳腺癌、宫颈癌、骨肉瘤、口腔癌、膀胱癌、胶质瘤、黑色素瘤等多种实体癌中确认了B7-H3表达,并且据报道,它在诸如急性白血病,多发性骨髓瘤,各种淋巴瘤的血液系统恶性肿瘤中表达(Zhimeng Yea,Zhuojun Zhengb等人,CellPhysiol Biochem(2016);Elodie Picarda,Kim C.Ohaegbulam和Xingxing Zang,临床癌症研究(clinical cancer research)(2016),Wei Zhang,Yanfang Wang,Jing Wang等人,国际肿瘤学杂志(international journal of oncology)(2015))。
B7-H3在各种癌症类型中过表达,但在正常组织中的表达非常低。在许多研究中,在大多数癌症类型中,都显示出B7-H3的异常表达,并且显示在肿瘤相关的血管系统以及癌细胞的细胞质或细胞核中都发现了B7-H3的异常表达。当估计诸如肿瘤大小、转移、癌症阶段、存活率和复发率等各种临床病理指标时,B7-H3的过表达与不良预后和不良临床结果相关。根据对前列腺癌患者的一项研究,B7-H3表达强的嗜酸瘤细胞患者(oncocyticpatient)在手术时具有显著高的疾病传播风险、临床癌症复发和与癌症相关的死亡风险。B7-H3在肺癌中的表达与肿瘤浸润性淋巴细胞(TIL)的减少和淋巴结转移有关,并提示B7-H3在免疫逃逸和肿瘤形成中的作用(Elodie Picarda,Kim C.Ohaegbulam和XingxingZang,Clin Cancer Res,2017Jul 12;22)。
B7-H3除了具有控制肿瘤免疫的作用外,还具有控制肿瘤侵袭的非免疫功能。结果显示,其通过Jak2/Stat3/MMP-9信号传导通路控制了向纤连蛋白的迁移,各种癌细胞的侵袭和请求(Elodie Picarda,Kim C.Ohaegbulam和Xingxing Zang,Clin Cancer Res,2017Jul 12;22)。通过用siRNA进行下调,肿瘤相关抗原B7-H3降低与纤连蛋白的细胞粘附,并使黑素瘤和乳腺癌细胞的迁移和浸润降低70%或更多(Chen YW,Tekle C,Fodstad O,Curr Cancer Drug Targets2008;8)。这些结果提示,B7-H3可以成为癌症治疗的有用靶标。
B7-H3是属于免疫检查点配体的蛋白质。免疫检查点蛋白用于控制人体中的免疫细胞,以防止所述免疫细胞产生错误的异常行为。当免疫检查点蛋白在癌细胞中过表达时,免疫细胞将癌细胞所发送的异常信号作为正常信号而接收,并将癌细胞识别为健康细胞。免疫检查点抑制剂是抗癌免疫治疗剂,其阻断癌细胞的这样的异常信号,从而通过患者自身的免疫功能来治疗癌症。作为免疫检查点配体之一的B7-H3与T细胞表面上的B7-H3受体结合并诱导对T细胞的免疫反应的抑制,但仍未揭示B7-H3与什么受体结合。
可以阻断这种免疫检查点配体的抗体通过部分或完全地中和免疫检查点配体与免疫检查点受体的相互作用并抑制免疫检查点,从而重新激活免疫细胞的降解活性,显示出抗癌免疫治疗作用。尚未发现与B7-H3结合的受体,但是与B7-H3结合的抗B7-H3抗体可通过阻断免疫检查点受体与B7-H3之间的结合并抑制这样的免疫检查点,从而重新激活免疫细胞的降解活性,显示出抗癌免疫治疗作用。换句话说,阻断与B7-H3受体结合的抗B7-H3单克隆抗体可能预期具有抗癌治疗作用(Elodie Picarda,Kim C.Ohaegbulam and XingxingZang,Clin Cancer Res,2017Jul 12;22)。美国专利第8,802,091号和第9,371,395号公开了针对B7-H3的抗体。
由于可以根据每种抗体的特性或用途将针对相同B7-H3抗原的抗体开发为各种抗癌抗体,考虑到B7-H3的癌症特异性表达、其在各种癌症中的表达以及其作为免疫检查点配体的功能,有必要开发各种可以替代或补充现有抗体的各种抗体。
发明内容
本发明提供了能够特异性识别B7-H3的蛋白质,例如抗体或其抗原结合片段。
一种实施方式提供了与B7-H3的胞外结构域特异性结合的分离的抗体或其抗原结合片段及其用途。特别地,该抗体可以特异性识别人B7-H3,并显示出与猴和小鼠B7-H3的交叉反应性。
在一种实施方式中,抗体或抗原结合片段可以是包含以下的多肽:(i)CDRH1、CDRH2和CDRH3的重链互补决定区,和(ii)CDRL1、CDRL2和CDRL3的轻链互补决定区,其中CDRH1可以包含选自SEQ ID NO:1至4中的任一个或基本上由选自SEQ ID NO:1至4中的任一个组成;CDRH2可以包含选自SEQ ID NO:5至9和68中的任一个或基本上由选自SEQ ID NO:5至9和68中的任一个组成;CDRH3可以包含SEQ ID NO:10至14中的任一个或基本上由选自SEQ ID NO:10至14中的任一个组成;CDRL1可以包含选自SEQ ID NO:15至19中的任一个或基本上由选自SEQ ID NO:15至19中的任一个组成;CDRL2可以包含选自SEQ ID NO:20至24和69中的任一个或基本上由选自SEQ ID NO:20至24和69中的任一个组成;以及CDRH3可以包含SEQ ID NO:25至29中的任一个或基本上由选自SEQ ID NO:25至29中的任一个组成。术语“CDRH”表示重链可变区中所包含的CDR,术语“CDRL”表示轻链可变区中所包含的CDR。
在另一种实施方式中,抗体或抗原结合片段可以包含:(i)重链可变区,其包含CDRH1、CDRH2和CDRH3的互补决定区,和/或(ii)轻链可变区,其包含CDRL1、CDRL2和CDRL3的互补决定区,其中CDRH1可以包含选自SEQ ID NO:1至4中的任一个或基本上由选自SEQ IDNO:1至4中的任一个组成;CDRH2可以包含选自SEQ ID NO:5至9和68中的任一个或基本上由选自SEQ ID NO:5至9和68中的任一个组成;CDRH3可以包含SEQ ID NO:10至14中的任一个或基本上由选自SEQ ID NO:10至14中的任一个组成;CDRL1可以包含选自SEQ ID NO:15至19中的任一个或基本上由选自SEQ ID NO:15至19中的任一个组成;CDRL2可以包含选自SEQID NO:20至24和69中的任一个或基本上由选自SEQ ID NO:20至24和69中的任一个组成;以及CDRH3可以包含SEQ ID NO:25至29中的任一个或基本上由选自SEQ ID NO:25至29中的任一个组成。
在其他实施方式中,CDRH1、CDRH2和CDRH3可以是选自以下的组合:分别为SEQ IDNO:1、5和10;分别为SEQ ID NO:2、6和11;分别为SEQ ID NO:3、7和12;分别为SEQ ID NO:1、8和13;或分别为SEQ ID NO:4、9和14,或分别为SEQ ID NO:3、68和12。
在其他实施方式中,CDRL1、CDRL2和CDRL3可以是选自以下的组合:分别为SEQ IDNO:15、20和25;分别为SEQ ID NO:16、21和26;分别为SEQ ID NO:17、22和27;分别为SEQ IDNO:18、23和28;分别为SEQ ID NO:19、24和29,或分别为SEQ ID NO:17、69和27。
在其他实施方式中,抗体或抗原结合片段可以是包含以下的多肽:(i)CDRH1、CDRH2和CDRH3的重链互补决定区,和/或(ii)CDRL1、CDRL2和CDRL3的轻链互补决定区,和
CDRH1、CDRH2和CDRH3是以下组合之一:分别为SEQ ID NO:1、5和10;分别为SEQ IDNO:2、6和11;分别为SEQ ID NO:3、7和12;分别为SEQ ID NO:1、8和13;分别为SEQ ID NO:4、9和14;或分别为SEQ ID NO:3、68和12;和
CDRL1、CDRL2和CDRL3是以下组合之一:分别为15、20和25;分别为SEQ ID NO:16、21和26;分别为SEQ ID NO:17、22和27;分别为SEQ ID NO:18、23和28;分别为SEQ ID NO:19、24和29;分别为SEQ ID NO:17、69和27。
来源于重链可变区的CDR的组合之一和来源于轻链可变区的CDR的组合之一可以自由地组合。
在另一种实施方式中,CDRH1、CDRH2和CDRH3的序列;以及CDRL1、CDRL2和CDRL3的序列可以是以下任一项的组合:
(a)CDRH1、CDRH2和CDRH3分别为SEQ ID NO:1、5和10,并且CDRL1、CDRL2和CDRL3分别为SEQ ID NO:15、20和25;
(b)CDRH1、CDRH2和CDRH3分别为SEQ ID NO:2、6和11,并且CDRL1、CDRL2和CDRL3分别为SEQ ID NO:16、21和26;
(c)CDRH1、CDRH2和CDRH3分别为SEQ ID NO:3、7和12,并且CDRL1、CDRL2和CDRL3分别为SEQ ID NO:17、22和27;
(d)CDRH1、CDRH2和CDRH3分别为SEQ ID NO:1、8和13,并且CDRL1、CDRL2和CDRL3分别为SEQ ID NO:18、23和28;
(e)CDRH1、CDRH2和CDRH3分别为SEQ ID NO:4、9和14,并且CDRL1、CDRL2和CDRL3分别为SEQ ID NO:19、24和29;
(f)CDRH1、CDRH2和CDRH3分别为SEQ ID NO:3、68和12,并且CDRL1、CDRL2和CDRL3分别为SEQ ID NO:17、22和27;或
(g)CDRH1、CDRH2和CDRH3分别为SEQ ID NO:3、68和12,并且CDRL1、CDRL2和CDRL3分别为SEQ ID NO:17、69和27。
在其他实施方式中,抗体或抗原结合片段可以包含重链可变区,该重链可变区由选自由SEQ ID NO:30至34和70的氨基酸序列组成的组中的任一个表示。
在其他实施方式中,抗体或抗原结合片段可以包含轻链可变区,该轻链可变区由选自由SEQ ID NO:35至39和71的氨基酸序列组成的组中的任一个表示。
重链可变区和轻链可变区中的每一个可以彼此联合。
在一种实施方式中,抗体或抗原结合片段可以包含重链可变区和轻链可变区,其中重链可变区和轻链可变区可以是以下序列的组合:SEQ ID NO:30和35;SEQ ID NO:31和36;SEQ ID NO:32和37;SEQ ID NO:33和38;SEQ ID NO:34和39;SEQ ID NO:70和37;或SEQID NO:70和71。
在其他实施方式中,抗体可以是IgG类型,例如人、猴或小鼠的IgG1、IgG2、IgG3或IgG4型。
在其他实施方式中,抗体或抗原结合片段提供由SEQ ID NO:60表示的重链恒定区和/或由SEQ ID NO:64表示的轻链恒定区。例如,包含SEQ ID NO:60的重链恒定区的重链可以由SEQ ID NO:40至44和72中的任一个表示。例如,包含SEQ ID NO:64的轻链恒定区的轻链可以由SEQ ID NO:45至49和73中的任一个表示。
在其他实施方式中,抗体可以包含重链和轻链的组合或基本上由重链和轻链的组合组成,所述重链和轻链的组合由以下序列表示:SEQ ID NO:40和45;SEQ ID NO:41和46;SEQ ID NO:42和47;SEQ ID NO:43和48;SEQ ID NO:44和49;SEQ ID NO:72和47,或SEQ IDNO:72和73。
在其他实施方式中,抗体或抗原结合片段可以是人源化抗体、人抗体(例如全人抗体)或抗原结合片段,并且可以与猴和小鼠的B7-H3具有交叉反应性。抗体或抗原结合片段可以是非天然存在的;例如,它可以是合成的或重组的,但不限于此。
在其他实施方式中,抗体可以是单克隆抗体,特别是人单克隆抗体。在实施方式中,抗体可以与猴B7-H3和小鼠B7-H3具有交叉反应性。
在其他实施方式中,抗体或抗原结合片段特异性识别人B7-H3、猴B7-H3和/或小鼠B7-H3。
在其他实施方式中,抗体或抗原结合片段包括Fab、Fab'、F(ab')2、scFab、Fv、dsFv、scFV、scFV-Fc、微抗体、双抗体、scAb、dAb、二价抗体或多价抗体,但不限于此。
在其他实施方式中,抗体或抗原结合片段可以抑制或阻断B7-H3免疫检查点,从而重新激活活性被B7-H3免疫检查点降解或抑制的T细胞。因此,抗体或抗原结合片段可以通过这样的B7-H3免疫检查点抑制来有效地用于被B7-H3免疫检查点抑制的T细胞的重新激活和需要重新激活的各种疾病的治疗。
另一方面,本发明还提供了编码抗体或抗原结合片段的分离的多核苷酸。
在一种实施方式中,多核苷酸可以是编码选自由重链CDR和轻链CDR组成的组中的至少一种的多核苷酸,例如,所述重链CDR包含如本文公开的CDRH1、CDRH2和CDRH3,和/或所述轻链CDR包含如本文公开的CDRL1、CDRL2和CDRL3。
在其他实施方式中,多核苷酸可以是编码本文公开的重链可变区和/或轻链可变区的多核苷酸。
在其他实施方式中,多核苷酸可以是编码本文公开的重链和/或轻链的多核苷酸。
在另一方面,提供了包含多核苷酸的载体。在一种实施方式中,载体可以包含用于产生抗体的表达载体或用于CAR-T细胞(嵌合抗原受体重定向T细胞)或CAR-NK(自然杀伤)细胞的载体。
在另一方面,提供了通过载体转化的细胞系。
另一种实施方式提供了制备与B7-H3特异性结合的分离的抗体或其抗原结合片段的方法,该方法包括从细胞系中分离抗体或其抗原结合片段的步骤。
另一种实施方式提供了包含抗体或其抗原结合片段和药学上可接受的赋形剂的组合物或药物组合物。
在一种实施方式中,药物组合物是用于治疗和/或预防疾病(例如癌症)的药物组合物。
另一种实施方式提供了检测生物样品中的B7-H3的方法,该方法包括使如本文所述的抗体或其抗原结合片段与需要检测B7-H3表达的生物样品接触的步骤。该方法还可以包括在接触步骤之后测量用抗体或其抗原结合片段处理(接触)的生物样品中的抗原-抗体应答的步骤。
在一种实施方式中,该方法可以在体外或体内进行。
在其他实施方式中,提供了试剂盒或组合物,该试剂盒包含抗体或其抗原结合片段,该组合物包含抗体或抗原结合片段。试剂盒可以作为用于B7-H3检测的试剂盒或用于针对癌症治疗而施用的试剂盒来提供,这取决于使用试剂盒的具体目的,并且取决于其具体目的,还可以包含另外的组分。例如,对于用于检测或诊断的试剂盒,还可以包含用于免疫分析的组分(例如缓冲液)和说明书,或者对于用于抗体施用或癌症治疗的试剂盒,还可以包括用于施用的器械和说明书。
抗体或其抗原结合片段可以(1)特异性识别或结合在来源于人、小鼠或猴的细胞表面上表达的B7-H3,或(2)特异性识别或结合在细胞表面上不存在的B7-H3的胞外结构域。
本发明的单克隆抗体显示出抗体依赖性细胞介导的细胞毒作用(ADCC)诱导能力和免疫细胞激活诱导能力,因此可以通过至少两种机制有效地抑制癌细胞的死亡或癌症的生长。因此,与常规抗B7-H3抗体相比,显示出对B7-H3具有高ADCC特异性的抗体可有效用于通过癌细胞特异性死亡来治疗癌症,并且显示出更高的抗体依赖性细胞介导的细胞毒作用,因此,它可以代替常规抗体而有效地用于治疗癌细胞。
另外,本发明的单克隆抗体显示出作为免疫检查点抑制剂起作用,其激活了活性被免疫检查点配体B7-H3蛋白降解的T细胞,从而可通过激活免疫细胞而有效地用于癌症治疗。
此外,该抗体可以用于例如将药物递送至特定癌症等或通过特异性结合进行检测、诊断和/或靶向癌症。
另外,本文公开的单克隆抗体具有与人、猴和小鼠B7-H3具有结合亲和力的种内交叉反应性。与未显示与小鼠或猴B7-H3的结合亲和力的其他人抗体相比,该抗体对于药物等的开发非常有用。例如,单克隆抗体或使用该抗体的各种形式的治疗剂可以通过在进行高成本的基于猴的实验之前以低成本的小鼠模型获得初步结果,从而更经济有效地进行药物开发。
附图说明
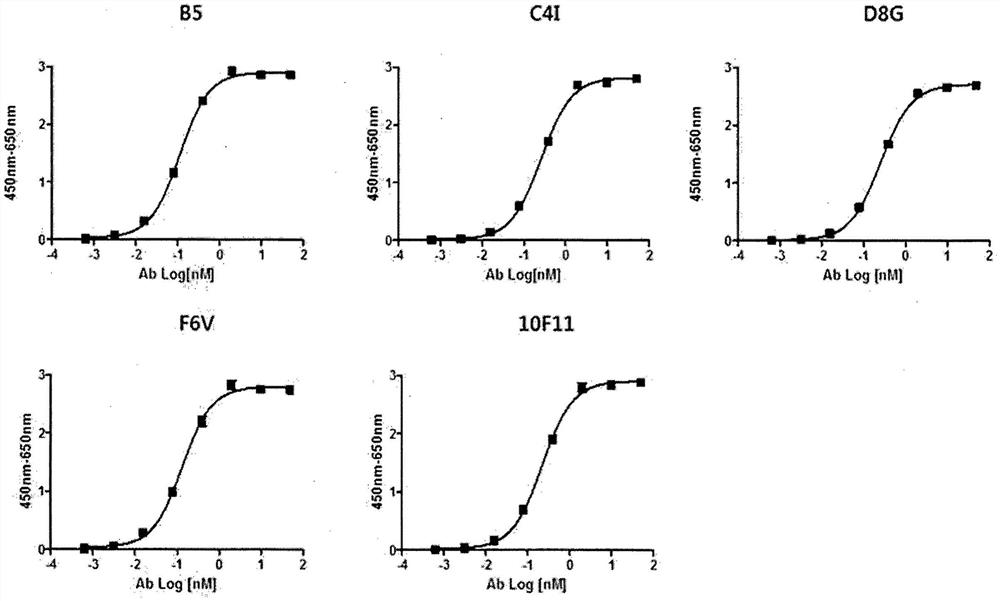
图1a和1b是根据本发明的一种实施方式制备的抗B7-H3抗体与B7-H3蛋白的胞外结构域(ECD)的结合能力的分析(ELISA)结果。该结果显示,每种抗体均以浓度依赖的方式与人B7-H3蛋白的胞外结构域结合。
图2是根据本发明的一种实施方式制备的抗B7-H3抗体与属于B7家族的其他蛋白质的ECD的结合能力的分析(ELISA)结果。该结果显示,根据本发明的一种实施方式制备的每种抗体均不与其他蛋白质结合并且仅特异性识别B7-H3蛋白。
图3是通过ELISA分析根据本发明的一种实施方式制备的抗B7-H3抗体的种内交叉反应性的结果。该结果显示,每种抗体均以浓度依赖的方式与猴(食蟹猴)B7-H3和小鼠B7-H3结合。
图4是通过ELISA比较根据本发明的一种实施方式制备的各种抗B7-H3抗体与小鼠B7-H3蛋白的结合能力程度的结果。该结果显示,抗体与小鼠B7-H3的结合程度是不同的,但是每种抗体均以浓度依赖的方式与小鼠B7-H3蛋白结合。通过对比,用作比较组抗体的84D抗体不与小鼠B7-H3蛋白结合。
图5是对根据本发明的一种实施方式制备的抗B7-H3抗体与细胞表面表达B7-H3抗原的结合能力的测量结果(FACS)。MCF-7细胞系是过表达B7-H3的细胞系,而Jurkat是不表达B7-H3的细胞系。该结果显示,本发明的抗B7-H3抗体与过表达B7-H3的细胞系MCF-7特异性结合,但不结合不表达B7-H3的细胞系Jurkat。
图6是针对不同抗体浓度,对根据本发明的一种实施方式制备的抗B7-H3抗体与在细胞表面上表达的B7-H3抗原的结合能力的测量结果(FACS)。该结果显示,每种抗体均以浓度依赖的方式与表达B7-H3的癌细胞系(MCF-7、DLD-1、HCC1954和HCT116)结合。表5中描述了抗体与在其他各种癌细胞系中表达的B7-H3的结合能力。
为了在体内使用针对特定抗原的抗体作为用于治疗等的抗体,与细胞表面表达抗原结合是必要的因素。对于一些抗体的情况,它们与纯化的抗原结合,但不与在细胞表面上表达的抗原结合。在这种情况下,向身体内施用的抗体不能与身体内的细胞结合,因此不可能在体内充当用于治疗等的抗体。因此,该结果显示,本发明的抗B7-H3抗体可以与细胞表面B7-H3结合并在体内显示活性,从而有效地用作用于治疗的抗体。
图7是对抗B7-H3抗体与小鼠来源的癌细胞系(CT26、B16F10和TC-1)的结合能力的测量结果(FACS)。该结果显示,每种B7-H3单克隆抗体也特异性识别在小鼠来源的癌细胞系表面上表达的B7-H3。
图8是对根据本发明的一种实施方式制备的抗B7-H3抗体的ADCC诱导能力的测量结果。根据本发明的一种实施方式制备的抗体仅显示出对包括MCF-7、Calu-6、DLD-1和Mino的人B7-H3阳性细胞系特异的ADCC诱导作用。在人B7-H3阴性细胞系Jurkat中未观察到ADCC。这显示,该抗体可以有效地用于癌细胞死亡,因为它仅与表达B7-H3的癌细胞特异性结合并诱导抗体依赖性细胞介导的细胞毒作用。特别地,它显示,由于与比较抗体84D相比,本发明的抗B7-H3抗体具有更低的EC50和更强的抗体依赖性细胞介导的细胞毒作用的信号强度,因此可以更有效地用于癌症治疗。
图9a显示了被B7-H3蛋白抑制的T细胞活性,以及因此被抑制的干扰素γ的产生。该结果显示,B7-H3蛋白以浓度依赖的方式抑制干扰素γ的产生。
图9b显示了根据本发明的一种实施方式制备的抗B7-H3抗体可以重新激活如图9a中的被B7-H3蛋白抑制的T细胞活性,这通过干扰素γ的产生来测量。图9a和图9b的结果意味着,本发明的抗B7-H3单克隆抗体可以中和或阻断B7-H3蛋白对T细胞的免疫抑制。换句话说,本发明的B7-H3抗体可以通过重新激活活性被抑制的T细胞而由T细胞诱导癌细胞的死亡,这显示本发明的B7-H3抗体可以有效地用于癌症治疗。
图10显示了根据本发明的一种实施方式制备的抗B7-H3抗体在与抗PD-1抗体一起使用时对干扰素激活的T细胞的影响,这通过γ的产生来测量。该结果显示,抗B7-H3抗体单独或与抗癌免疫抗体一起通过激活T细胞而有效地促进干扰素γ的产生。这表明抗体可以通过单独或与其他抗癌免疫抗体联合来激活T细胞而有效地用于治疗癌症。
图11是当将根据本发明的一种实施方式制备的抗B7-H3抗体与抗PD-1抗体在移植了小鼠B7-H3阳性癌细胞系CT26的同基因型肿瘤移植模型中共同施用时,确认肿瘤生长被抑制以及存活率改善的结果。抗PD-L1抗体通过免疫检查点抑制起作用。该结果显示,抗B7-H3抗体在与抗PD-1抗体共同施用时可以有效地用于治疗癌症,从而改善了存活率。
图12是当将根据本发明的一种实施方式制备的抗B7-H3抗体与抗PD-a抗体在移植了小鼠B7-H3阳性癌细胞系CT26的同基因型肿瘤移植模型中共同施用时,分析肿瘤中的肿瘤浸润性淋巴细胞流动的结果。该结果显示,通过共同施用抗B7-H3抗体和抗PD-1抗体,CD8+ T细胞的活性增加并且调节性T细胞的增殖被抑制。这意味着,通过CD8+ T细胞和调节性T细胞的改变,表现出通过共同施用抗B7-H3抗体和免疫检查点抑制剂抗PD-1抗体的抗癌作用。
具体实施方式
本发明基于可以特异性识别B7-H3的胞外结构域的抗体的开发。
本部分中使用的标题仅是为了方便说明,并不限制本发明。
除非本文另外定义,否则本文所使用的科学和技术术语具有与本领域技术人员通常理解的相同含义。此外,除非上下文特别要求,否则单数包括复数,并且复数包括单数。
由特定SEQ ID NO表示的本文所述的所有氨基酸序列和核苷酸序列可以包含以下,基本上由以下组成,或由以下组成:不仅有特定SEQ ID NO的序列,还有与特定SEQ IDNO的序列具有至少90%、至少92%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的同一性,只要它们维持其作为抗B7-H3抗体的活性。
定义
在本文中,“多核苷酸”或“核酸”包括单链或双链核苷酸聚合物。包含这样的多核苷酸的核苷酸可以是核糖核苷酸或脱氧核糖核苷酸或其修饰形式。
除非本文另外说明,否则本文所述的多核苷酸的左端为5'端,其右端为3'端。
在本文中,“分离的核酸分子”是指基因组来源的DNA或RNA或mRNA、合成来源的cDNA或它们的组合,其与如下的多核苷酸相关,所述多核苷酸的全部或部分与自然界中存在的多核苷酸无关或者在自然界中未观察到。为了本发明的目的,包含特定核酸序列的核酸分子不包括完整染色体。相反,包含特定核酸序列的分离的核酸分子除了其特定序列之外,还可以包含至少数个其他蛋白质编码序列,或者还可以包含用于表达特定核酸序列的调节序列和/或载体。
在本文中,术语“调节序列”是指通过可操作地连接至编码序列而可影响编码序列的表达和加工的多核苷酸序列。调节序列的这种特性可能受到宿主种类的影响。例如,适用于原核细胞的调节序列可以包括启动子,有时包括操纵子、核糖体结合位点和转录终止序列。在真核细胞中,调节序列可以包括含有多个识别位点的启动子、转录增强子、聚腺苷酸化序列和转录终止序列。调节序列还可以包括阅读序列(reader sequence)和/或融合伴侣序列。
在本文中,“载体”是指用于将编码蛋白质的核酸分子递送至宿主细胞的任何分子,包括例如核酸、质粒、噬菌体或病毒。
在本文中,“表达载体”是指适于转化宿主细胞并且包含以下核酸序列的载体,该核酸序列可操作连接至表达载体并调节编码靶蛋白的异源序列的表达。该表达载体也可以可操作地连接至编码序列,并且在转录、翻译并且存在内含子的情况下,它可以包含调节RNA剪接或影响其的序列。
在本文中,“可操作地连接”是指待连接的核酸序列被定位以便在适当条件下执行目标功能。例如,如果在包含编码序列和调节序列的载体中在适当条件下编码序列的转录受到调节序列的影响,则其是可操作地连接的。
在本文中,“宿主细胞”是指可以表达通过靶核酸序列转化或待通过靶核酸序列转化的靶基因的细胞。该术语包括宿主细胞的后代,只要表达靶基因即可,无论宿主细胞的身份和形式以及遗传构成。
在本文中,“转导”通常是指通过噬菌体将核酸从一种细菌移动到另一种细菌。例如,它包括使用不能复制的逆转录病毒将核酸移动到真核细胞。
在本文中,“转染”是指细胞摄取外来或外源DNA,在这种情况下,DNA通过细胞膜被引入细胞中。这可以指本领域中已知的方法,例如,Sambrook等人,分子克隆:实验手册(Molecular Cloning:A Laboratory Manual),第4版,冷泉港实验室出版社,纽约,冷泉港(2012);Ausubel等人,分子生物学通用方案(Current Protocols in MolecularBiology),格林出版协会。
在本文中,“转化”是指细胞的遗传特性的改变,所述细胞被修饰以使得细胞包含新的DNA或RNA。例如,通过经转导、转染或其他技术引入新的遗传物质,可以转化细胞同时改变细胞的遗传特性。通过包括转导或转染等的方法转化的DNA可以通过物理整合在细胞的染色体中而存在,或者可以以不复制或不具有可复制质粒的游离体形式暂时存在。当转化的DNA通过宿主细胞的分裂而复制时,则被认为是稳定转化的。
在本文中,“氨基酸”包括本领域中理解的通常含义。二十种天然存在的氨基酸及其缩写如本领域中常用的那些(免疫学-A合成(Immunology-A Synthesis),第2版,E.S.Golub和D.R.Green编,Sinauer Associates:Sunderland,Mass.1991)。氨基酸包括典型的氨基酸、典型的20种氨基酸的立体异构体(D-氨基酸)、非天然氨基酸,例如α-,α-二取代氨基酸、N-烷基氨基酸和其他非典型氨基酸。作为非典型氨基酸的实例、4-羟基脯氨酸、γ-羧基谷氨酸、ε-N,N,N-三甲基赖氨酸、ε-N-乙酰赖氨酸、O-磷酸丝氨酸、N-乙酰丝氨酸、N-甲酰基甲硫氨酸、3-甲基组氨酸、5-羟基赖氨酸、σ-N-甲基精氨酸和其他类似的氨基酸和亚氨基酸(例如4-羟基脯氨酸)。本文使用的多肽的标志物中,如本领域中常用的,序列的左端是氨基末端,而右端表示羧基末端。
在本文中,“多肽”或“蛋白质”是指氨基酸残基的聚合物,其在本文中可互换使用。这不仅包括天然存在的氨基酸残基的聚合物,还包括其类似物或模拟物的聚合物。另外,多肽或蛋白质可包含修饰,如添加用于磷酸化或糖基化的碳水化合物等。此外,多肽或蛋白质可以在重组细胞或天然发现的细胞中产生。此外,多肽或蛋白质可以包括野生型序列或氨基酸序列的一部分缺失、添加和/或被取代的多肽或蛋白质。另外,多肽或蛋白质包括抗体,例如抗B7-H3抗体(或称为B7-H3抗体)、B7-H3结合蛋白或抗原结合片段,或缺失、添加和/或取代一种或多种氨基酸的序列。此外,“多肽片段”是指与全长蛋白质相比,具有氨基末端的氨基酸序列缺失、羧基末端的氨基酸序列缺失和/或内部缺失的多肽。与全长蛋白质相比,该片段还可以包含修饰的氨基酸。在一种实施方式中,该片段的长度可以是约5至900个氨基酸,例如,长度为至少5、6、8、10、14、20、50、70、100、110、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850或更多个氨基酸。考虑到本发明的目的,有用的多肽片段包括含有抗原结合结构域的抗体的免疫功能片段。在B7-H3结合抗体的情况下,这样的有用的片段包括含有重链或轻链中的1、2或3个的CDR序列,或含有重链或轻链的可变区或恒定区的抗体链的全部或部分,但不限于此。
在本文中,“分离的多肽、抗体或蛋白质”是指通常没有与其一起存在的任何其他蛋白质,并且去除至少约50%或更多的与它们天然连接的脂质、碳水化合物和多核苷酸。通常,分离的蛋白质、多肽或抗体在某种组合物中包含至少约5%、至少约10%、至少约25%或至少约50%。该多肽可由合成来源的基因组DNA、cDNA、mRNA或其他RNA或其任何组合编码。特别地,分离的蛋白质、多肽或抗体基本上不含其他蛋白质或其他多肽的污染物,所述污染物干扰所述分离的蛋白质、多肽或抗体的治疗、诊断和预防研究或用于其他用途的应用。
在本文中,诸如例如多肽的“变体”,抗原结合片段,蛋白质或抗体是相比于另一种多肽序列,其中一种或多种氨基酸残基被插入,缺失,添加和/或取代的多肽,并且包括融合多肽。另外,蛋白质变体包括通过蛋白质酶切割、磷酸化或其他翻译后修饰来修饰,但维持本文公开的抗体的生物学活性(例如与B7-H3的特异性结合和生物学活性)的蛋白质变体。变体可以与本文公开的抗体或其抗原结合片段的序列具有约99%、98%、97%、96%、95%、94%、93%、92%、91%、90%、89%、88%、87%、86%、85%、84%、83%、82%、81%或80%的同一性。可以参考以下描述计算同一性或同源性百分比(%)。
在一种实施方式中,同源性或同一性百分比可以以100×[(相同的位置)/min(TG
在本文中,保守氨基酸取代是指基本上不影响多肽的活性或抗原性的取代。多肽可以包括一种或多种保守取代。下表3中公开了非限制性实例,
本文中的多肽的“衍生物”是指通过与其他化学部分缀合而被化学修饰的多肽,其不同于插入、缺失、添加或取代的变体。
在本文中,关于多肽、核酸、宿主细胞等而使用的术语“天然发现”是指天然存在的物质。
被本文所述的抗体或其抗原结合片段识别的B7-H3(B7同系物3,CD276)可以指属于免疫球蛋白(Ig)超家族的B7家族的跨膜蛋白,并且包含胞外结构域、跨膜结构域和胞内结构域。抗体识别的B7-H3可以是存在于细胞膜中或不存在于细胞膜中的胞外结构域。人B7-H3蛋白由534个氨基酸组成,并公开为NCBI参考序列:NP_001019907.1。除非从本文所用的上下文中显而易见,否则B7-H3指人B7-H3,但是该抗体具有与猴和小鼠B7-H3特异性结合的能力。猴B7-H3蛋白由534个氨基酸组成,并公开为NCBI参考序列:XP_005560056.1。小鼠B7-H3蛋白由316个氨基酸组成,并公开为NCBI参考序列:NP_598744.1。
本文中的“同一性”或同源性是指两个或更多个多肽或两个或更多个多核苷酸的序列相似性,这通过排列和比较两个或更多个多肽或两个或更多个多核苷酸来确定。序列之间的这种同一性通常用“同一性百分比”来表示,这是指待比较的分子之间相同的氨基酸或核苷酸的比率,并且它基于待比较的分子中分子的最小大小来计算。可以参考以下文献中用于通过排列核酸或多肽来计算许多分子之间的同一性的方法:计算分子生物学(Computational Molecular Biology),(Lesk,A.M.编),1988,纽约:牛津大学出版社;生物计算信息学和基因组计划(Biocomputing Informatics and Genome Projects),(Smith,D.W.编),1993,纽约:学术出版社;序列数据的计算机分析,第一部分(Computer Analysisof Sequence Data,Part I),(Griffin,A.M.和Griffin,H.G.编),1994,新泽西州:Humana出版社;von Heinje,G.,1987,分子生物学中的序列分析(Sequence Analysis inMolecular Biology),纽约:学术出版社;序列分析入门(Sequence Analysis Primer),(Gribskov,M.和Devereux,J.编),1991,纽约:M.Stockton出版社;和Carillo等人,1988,SIAM J.应用数学(SIAM J.Applied Math).48:1073。
当计算同一性百分比时,将待比较的序列以提供序列之间最大匹配的方式进行排列,并且在排列的序列中,可能会出现空位、匹配和不匹配,这通过特定的数学模型或计算机算法来处理。在一种实施方式中,可以使用包括GAP程序的GCG程序包来确定该同一性百分比,所述GAP程序使用Needlman和Wunsch算法以使待比较序列之间的匹配最大化并使缺口数目最小化的方式来排列两个序列(Devereux等人,1984,Nucl.Acid Res.12:387;遗传学计算机组(Genetics Computer Group),威斯康星大学,麦迪逊,WI,美国)。计算机算法GAP通过以使两个序列之间的匹配最大化并使待比较的两个多肽或多核苷酸中的空位数目最小化的方式排列两个序列来确定“匹配跨度(matching span)”。该算法还使用了空位开放罚分[计算为3x平均对角线,其中“平均对角线”是待使用的比较矩阵对角线的平均值;“对角线”是通过特定的比较矩阵为每个完整氨基酸匹配分配的得分或数字]和空位延伸罚分(通常是空位开放罚分的1/10倍)和比较矩阵(例如PAM 250或BLOSUM 62)一起。在一个特定的实施方式中,使用标准比较矩阵(关于PAM 250比较矩阵,参见Dayhoff等人,1978,蛋白质序列和结构图集(Atlas of Protein Sequence and Structure)5:345-352;关于BLOSUM62比较矩阵,参见Henikoff等人,1992,Proc.Natl.Acad.Sci.U.S.A.89:10915-10919)。在一种实施方式中,使用GAP程序的推荐用于确定多肽或多核苷酸的同一性百分比的参数如下:算法:Needleman等人,1970,J.Mol.Biol.48:443-453;比较矩阵:BLOSUM 62(Henikoff等人,1992,同上);空位罚分:12(末端空位不罚分);空位长度罚分:4;相似度阈值:0。
当使用特定参数排列两个序列时,尽管两个序列之间没有显著关系,但可以得出它们在短序列区以高度同一性匹配的结果。在这种情况下,为了通过至少50个连续氨基酸排列两个序列,可以校正作为GAP程序使用的算法的参数。
本文所用的“基本上纯的”是靶分子作为主要物质存在。换句话说,这意味着基于摩尔,该浓度高于同一混合物中的任何其他的单个物质。在一种实施方式中,在组合物中包含的所有聚合物中,基本上纯的分子占至少约50%(基于摩尔)、至少约80%、约85%、至少约90%或至少约99%。在其他实施方式中,将靶分子基本上同质地纯化,直到通过使用常规方法检测不到任何更多的污染物,因此该组合物包含一种同质的聚合物材料。
在一方面,本发明涉及与B7-H3蛋白特异性结合的重组抗体或其抗原结合片段。在这方面,“重组蛋白”是使用重组技术即通过表达本发明中所述的重组核酸而制备的蛋白。产生重组蛋白的方法和技术是本领域众所周知的。
在本文中,“亲和力”是抗体或其抗原结合片段与抗原之间相互作用的强度,并且它由抗原的特性(例如抗原的大小、形状和/或电荷)以及抗体或抗原结合片段的CDR序列来确定。确定亲和力的方法是本领域已知的,并且可以参考以下内容。
当解离常数(KD)≤10
在本文中,“抗原结合区或位点”是指与特定抗原特异性结合的蛋白质或蛋白质的部分。例如,抗体的包含通过与抗原相互作用而为抗体提供对抗原的特异性和亲和力的氨基酸残基的部分。该抗原结合区通常包含一个或多个“互补决定区(CDR)”。特异性抗原结合区还包含一个或多个“框架”区。框架区有助于维持这些CDR的适当构象,从而促进抗原结合区与抗原之间的结合。
在本文中,“抗体”是指可以与完整抗体竞争结合任何同种型的完整免疫球蛋白或靶抗原的抗原结合片段。例如,它包括嵌合抗体、人源化抗体、全人抗体和多特异性抗体或其抗原结合片段。抗体本身就是一种抗原结合蛋白。完整的抗体通常包含至少2条全长重链和2条全长轻链,但在一些情况下(如骆驼科动物中天然发现的),抗体可以仅包含重链。抗体或其抗原结合片段可以仅来源于一种来源或嵌合体。嵌合抗体包含衍生自两种不同抗体的部分,并且在下文中更详细地描述嵌合抗体。抗体或其抗原结合片段可通过杂交瘤、重组DNA技术或对完整抗体的酶促切割或化学切割来产生。除非另有说明,否则本文中的术语抗体包括含有2条全长重链和2条全长轻链的抗体及其衍生物、变体、片段和突变体,其实例如下所述。
在本文中,“轻链”包括具有足以提供与抗原或表位的结合特异性的可变区序列的全长轻链及其片段。全长轻链包含可变区结构域VL和恒定区结构域CL。轻链的可变区结构域存在于轻链多肽的氨基末端。轻链的种类包括κ链和λ链。
在本文中,“重链”包括具有足以提供与抗原或表位的结合特异性的可变区序列的全长重链及其片段。全长重链包含可变区结构域VH和3个恒定区结构域CH1、CH2和CH3。VH结构域存在于重链多肽的氨基末端,CH结构域存在于羧基末端,并且CH3的位置最接近于羧基末端。重链包含IgG(包含IgG1、IgG2、IgG3和IgG4亚型)、IgA(包含IgA1和IgA2亚型)以及IgM和IgE的同种型。
本文中使用的抗体或免疫球蛋白的链(重链或轻链)的“抗原结合片段”包括抗体的与全长链相比缺少一些氨基酸但可以与抗原特异性结合的部分。该片段可以被认为具有生物学活性,在这方面该片段可以与靶抗原特异性结合或可以与其他抗体或抗原结合片段竞争结合特定表位。一方面,该片段包含存在于全长轻链或重链中的至少一个CDR,并且在一些实施方式中,该片段包含短链重链和/或轻链或其部分。该生物活性片段可以通过重组DNA技术来产生,或者可以例如通过酶促切割或化学切割完整抗体来产生。具有免疫功能的免疫球蛋白片段包括Fab、Fab’、F(ab’)2、scFab、dsFv、Fv、scFV、scFV-Fc、双抗体、微抗体、scAb和dAb,但不限于此。另外,它可以来源于包括人、小鼠、大鼠、骆驼科动物或兔子的任何哺乳动物,但不限于此。抗体的功能部分如本文所述的一个或多个CDR,可以通过共价键与二级蛋白质或小分子化合物连接,从而用作特定靶标的靶治疗剂。
在本文中,“Fc”区包括含有抗体的CH2和CH3结构域的两个重链片段。这两个重链片段通过两个或更多个二硫键与CH3结构域的疏水相互作用而彼此联合。
在本文中,“Fab片段”由1条轻链和1条仅包含CH1和可变区的重链组成。Fab分子的重链不能与其他重链分子形成二硫键。
在本文中,“Fab'片段”除了Fab片段之外还包括重链的CH1和CH2结构域之间的区域,并且它可以在两个Fab'片段分子的两个重链之间形成二硫键,从而形成F(ab')2分子。
在本文中,“F(ab')2片段”包括两条轻链和两条包含可变区、CH1和恒定区在CH1和CH2结构域之间的部分的重链,如上所述,并由此形成在2条重链之间的链内二硫键。因此,F(ab')2片段由两个Fab'片段组成,并且两个Fab'片段通过它们之间的二硫键彼此结合。
在本文中,“Fv区”是包含重链和轻链的每个可变区但不包含恒定区的抗体。scFc是Fv通过柔性接头连接的那种。scFv-Fc是Fc与scFV连接的那种。微抗体是CH3与scFV连接的那种。双抗体包含两个scFV分子。
在本文中,“短链抗体(scAb)”是包含一个重链或轻链可变区的单条多肽链,其中重链和轻链可变区通过柔性接头连接。短链抗体可以参考例如美国专利第5,260,203号,其通过引用在本文中公开。
在本文中,“结构域抗体(dAb)”是仅包含重链的可变区或轻链的可变区的免疫功能性免疫球蛋白片段。在一种实施方式中,两个或更多个VH区通过肽接头由共价键连接,以形成二价结构域抗体。该二价结构域抗体的两个VH区可以靶向相同或不同的抗原。
在本文中,“二价抗原结合蛋白”或“二价抗体”包含2个抗原结合位点。该二价抗体中包含的两个抗原结合位点可以具有相同的抗原特异性,或者可以是分别与不同抗原结合的双特异性抗体。
在本文中,“多特异性抗原结合蛋白”或“多特异性抗体”靶向两种或更多种抗原或表位。
在本文中,“双特异性”、“双重特异性”抗原结合蛋白或抗体是具有两个不同抗原结合位点的杂种抗原结合蛋白或抗体。该双特异性抗体是一种多特异性抗原结合蛋白或多特异性抗体,并且可以通过已知的各种方法(例如杂交瘤融合或Fab'片段连接)来产生。例如,可以参考Songsivilai和Lachmann,1990,Clin.Exp.Immunol.79:315-321;Kostelny等人,1992,J.Immunol.148:1547-1553等。双特异性抗原结合蛋白或抗体的2个抗原结合位点所结合的彼此不同的2个表位可以位于相同或不同的蛋白质靶标上。
在本文中,术语“抗原”或“免疫原”是指例如抗原结合蛋白(例如抗体或其免疫功能性抗原结合片段)可以结合的并且可以用于在动物中产生可以与抗原结合的抗体的分子或分子的一部分。抗原可以包含一个或多个可以与不同抗体或其片段相互作用的表位。在一种实施方式中,抗原是B7-H3蛋白的胞外结构域。在其他实施方式中,抗体可以识别B7-H3的在细胞表面上不存在的所有胞外结构域,或在细胞膜上存在形式的B7-H3。
在本文中,“表位”是分子的与抗原结合蛋白或抗体结合或被抗原结合蛋白或抗体识别的部分,并且包含可以与抗原结合蛋白(例如抗体或T细胞受体)特异性结合的任何决定因子。表位可以是顺序的或非顺序的,例如,在多肽序列中,表位彼此不是顺序的,但是在分子的方面,如构象表位,它可能是由一个抗原结合蛋白结合但不是顺序且彼此隔开的氨基酸残基。在一种实施方式中,表位包含类似于用于抗体产生的抗原的三维结构,但是表位可以是模拟物,在这方面它可以不包含在表位中发现的残基或可以仅包含一些残基。通常,表位是蛋白质,但也可以是其他种类的物质,例如核酸。表位决定因子可以是在表面上由诸如氨基酸、糖侧链、磷酰基或磺酰基的分子形成的化学活性基团,或者可以具有特定的三维结构特性和/或特定的电荷特性。通常,对特定靶抗原具有特异性的抗体识别存在于蛋白质和/或聚合物的复合物中的靶抗原的表位。
在本文中,“治疗剂”是指为了靶向治疗作用而施用至受试者的分子。受试者包括非人哺乳动物,例如灵长类动物或人。治疗剂的实例包括含有肽和多肽的蛋白质、核酸、抗体或小分子化合物。在另一方面,治疗剂可以通过与抗体结合而用作相关疾病(例如癌症)的治疗剂,或可以是抗体。
在本文中,术语“治疗”是指减轻或治疗损伤、疾病,或包括任何客观或主观参数的疾病或病态病症的症状,包括减少、缓解、减轻损伤、疾病或疾病或病态病症的症状,或使患者能够更好地承受损伤、疾病,或疾病或病态病症的症状,减慢损伤、疾病、或疾病或病态病症的症状的恶化速率,或改善患者精神或身体上的生活质量。可以基于身体检查、与疾病有关的各种指标的检查和图像检查的结果来判断这种损伤、疾病、或疾病或病态病症的症状的治疗或改善。
在本文中,“有效剂量”通常是指足以减少由于疾病(特别是与B7-H3有关的疾病)而引起的症状的严重性和/或发生频率的量,足以去除由于疾病(特别是与B7-H3有关的疾病)和/或疾病发生的根本原因而引起的症状的量,或足以预防由于疾病(特别是与B7-H3有关的疾病)和/或根本原因而引起的症状的发生的量,和/或足以改善或纠正由于疾病(特别是与B7-H3有关的疾病)而引起的损害的量。在一些实施方式中,有效剂量是治疗有效剂量或预防有效剂量。“治疗有效剂量”是足以治疗疾病(特别是与B7-H3有关的症状或病症)或预防、延迟疾病(特别是与B7-H3有关的症状或病状)或逆转其进展的量。“预防有效剂量”是用于预防或延迟疾病(特别是与B7-H3有关的疾病)或与疾病(特别是与B7-H3有关的疾病)有关的症状的发生或复发和降低其可能性的量。完全的治疗或预防作用可以由于数次施用剂量而非单次施用剂量引起。因此,可以通过一次或多次施用来递送治疗有效剂量或预防有效剂量。
抗体或抗原结合片段
本发明公开了与B7-H3蛋白的胞外结构域特异性结合的抗体或其抗原结合片段。该抗体或抗原结合片段与小鼠和猴B7-H3蛋白的胞外结构域具有交叉反应性。
本文公开的抗体是包含本文公开的一个或多个互补决定区或位点(CDR)的多肽。
在一些实施方式中,CDR被包含在“框架”区中,并且框架朝向CDR使得该CDR可以具有适当的抗原结合特性。
抗体与人、猴和小鼠来源的B7-H3的胞外结构域特异性结合,并且该抗体可以与分离形式的胞外结构域或在细胞表面上表达的B7-H3的胞外结构域特异性结合。
在一种实施方式中,该抗体包括单克隆抗体、双特异性抗体、双重抗(doubleantibody)、多特异性抗体、多抗体,微抗体,结构域抗体,抗体模拟物(或合成抗体),嵌合抗体,人源化抗体或抗体融合物(或抗体缀合物)及其片段,但不限于此,并且包括本文公开的抗体的各种形式。
在一种实施方式中,本文公开的抗体的抗体片段可以是Fab、Fab'、F(ab')2、scFab、Fv、dsFv、scFV、scFV-Fc、微抗体、双抗体、scab或dAb。
在其他实施方式中,本文公开的抗体可以由包含表2a和表2b中公开的可变区的仅轻链或仅重链的多肽组成。
本文公开的一种抗体与本文公开的另一种抗体共享特定区域或序列。在一种实施方式中,它可以共享抗体或抗原结合片段的恒定区。在另一种实施方式中,它可以共享Fc区。在另一种实施方式中,它可以共享可变区的框架。
在一种实施方式中,该抗体具有自然界中发现的抗体的典型结构。骆驼科动物产生由单条重链组成的抗体,但是该抗体的结构单元通常包含四聚体多肽,并且该四聚体包含一对由不同的2条多肽链组成的多肽链体中的两个。在典型的抗体中,一对多肽链体包含一条全长轻链(约25kDa)和一条全长重链(约50至70kDa)。每条链显示出特征性的折叠模式,并且由数个免疫球蛋白结构域组成,该免疫球蛋白结构域由大约90至110个氨基酸组成。这些结构域是由抗体多肽组成的基本单元。每条链的氨基末端部分通常包含称为可变区或V区的部分,该部分是识别抗原的部分。羧基末端部分在进化上比氨基末端更保守,它包含称为恒定区或C区的部分。人轻链通常分类为κ和λ轻链,这些各自包含一个可变区和一个恒定区。重链通常分为μ、δ、γ、α或ε链,它们分别定义为IgM、IgD、IgG、IgA和IgE同种型。IgG包括IgG1、IgG2、IgG3和IgG4,但是具有无数个亚型。IgM亚型包括IgM和IgM2。IgA亚型包括IgA1和IgA2。在人类中,IgA和IgD同种型包含4条重链和4条轻链;IgG和IgE同种型包含2条重链和2条轻链,而IgM同种型包含5条重链和5条轻链。重链恒定区通常显示效应子功能,但是包含一个或多个结构域。重链恒定区结构域的数目取决于同种型而不同。IgG重链例如包含3个C区结构域,分别称为C
重链可变区和轻链可变区可以与人恒定区的至少一部分连接。恒定区的选择可以通过是否部分地需要抗体依赖性细胞介导的细胞毒作用,抗体依赖性细胞吞噬作用和/或补体依赖性细胞毒作用来确定。例如,人同种型IgG1和IgG3具有补体依赖性细胞毒作用,而人同种型IgG2和IgG4不具有这种细胞毒作用。另外,人IgG1和IgG3诱导比人IgG2和IgG4更强的细胞介导的效应子功能。轻链恒定区可以是λ或κ。
在其他实施方式中,本发明提供的抗体可以是人抗体,并且重链恒定区可以是IgG1型、IgG2型、IgG3型或IgG4型。在又一种实施方式中,本发明的抗体是IgG1或IgG2型。
在其他实施方式中,本发明提供的抗体是与小鼠和猴具有交叉反应性的人抗体。
在全长轻链和重链中,可变区和恒定区通过长度为约12个或更多个氨基酸的“J”区连接,并且重链还包含约10个或更多个氨基酸的“D”区。例如,可以参考基础免疫学(Fundamental Immunology),第二版,Ch.7(Paul,W.编)1989,纽约:Raven出版社。通常,抗体的轻链/重链对的可变区形成抗原结合位点。
免疫球蛋白链的可变区通常具有相同的总体结构,并包含相对保守的框架区(FR),该框架区由称为“互补决定位点或区或结构域”或CDR(互补决定区)的3个高变区连接。来源于重链/轻链对的每条链的可变区的CDR通常由框架区排列,从而形成与靶蛋白的特定表位特异性结合的结构。天然存在的轻链和重链区域的这些因子通常从N末端到C末端按以下顺序组成:FR1,CDR1,FR2,CDR2,FR3,CDR3和FR4。对应于它们中的每一个的氨基酸序列在可变区中的位置可以通过Kabat(Kabat等人,(1983)美国卫生与公众服务部,“具有免疫学意义的蛋白质序列(Sequences of Proteins of Immunological Interest)”)、Chothia(Chothia和Lesk,J.Mol.Biol.196:901-917(1987))或与OPAL文库相关的方法(HyeYoung Yang等人,2009Mol.Cells 27:225)来确定。当彼此比较时,由每个定义确定的CDR可以是重叠的子集或一个包含另一个的子集。然而,本文中,每种方法定义的所有CDR均被包括在本发明的范围内。当提供抗体的可变区的序列时,本领域技术人员将通过它们中的每个定义容易地选择CDR序列。
表1a至表1f中分别公开了根据本发明的一种实施方式的要在抗体或抗原结合片段的重链和轻链可变区中包含的CDR序列。
[表1a]
[表1b]
[表1c]
[表1d]
[表1e]
[表1f]
在一种实施方式中,可以在下表2a和表2b中分别举例说明包含轻链CDR序列和重链CDR序列的抗体或抗原结合片段的重链可变区和轻链可变区。
[表2a]
[表2b]
在一种实施方式中,表1a至表1f中公开的轻链的每个可变区的CDR和重链的每个可变区的CDR可以自由组合。
在其他实施方式中,表2a和表2b中公开的重链和轻链的可变区可自由组合以制备各种形式的抗体,例如,可以形成单一抗体,例如scFV或结构域抗体。
本文公开的重链和轻链可变区中的每一个可以与各种靶重链恒定区和靶轻链恒定区结合,以分别形成完整抗体的重链和轻链。另外,像这样与恒定区结合的重链和轻链序列中的每一个也可以联合以形成完整的抗体结构。
抗体的重链和轻链的任何可变区可以与恒定区的至少一部分连接。可以根据是否需要抗体依赖性细胞介导的细胞毒作用,抗体依赖性细胞吞噬作用和/或补体依赖性细胞毒作用等来选择恒定区。例如,人同种型IgG1和IgG3具有补体依赖性细胞毒作用,而人同种型IgG2和IgG4不具有该细胞毒作用。人IgG1和IgG3还诱导比人IgG2和IgG4更强的细胞介导的效应子功能。例如,重链可变区可以与IgG,例如IgG1、IgG2、IgG2a、IgG2b、IgG3和IgG4的恒定区结合,而轻链可变区可以与κ或λ恒定区结合。对于恒定区,可以根据需要使用适当的恒定区,例如,可以使用人或小鼠来源的恒定区。在一种实施方式中,使用人重链恒定区IgG1,其可以由SEQ ID NO:60的序列表示。在另一种实施方式中,使用人λ区作为轻链恒定区,其可以由SEQ ID NO:64表示。
本文公开的任何可变区可以与恒定区结合,从而形成重链和轻链序列。在一种实施方式中,本文公开的重链可变区可以与人IgG1恒定区结合,以形成包含选自SEQ ID NO:40至44和72的氨基酸序列或基本上由选自SEQ ID NO:40至44和72的氨基酸序列组成的重链(全长)。在一种实施方式中,本文公开的轻链可变区可以与人λ恒定区结合,以形成包含选自SEQ ID NO:45至49和73的氨基酸序列或基本上由选自SEQ ID NO:45至49和73的氨基酸序列组成的轻链(全长)。轻链和重链可以组合成各种组合,从而形成由两条轻链和两条重链组成的完整抗体。
然而,与本文公开的可变区组合的这样的恒定区序列是示例性的,并且本领域技术人员将知晓,也可以使用其他恒定区,所述其他恒定区包括IgG1重链恒定区、IgG3或IgG4重链恒定区、任何κ或λ轻链恒定区、针对稳定性、表达、可制造性或其他靶向特性而修饰的恒定区等。
本发明包括与本文公开的一个或多个氨基酸序列具有基本序列同一性的一个或多个氨基酸序列。基本同一性是指在存在序列变异的情况下维持本文公开的作用。在一种实施方式中,它与表2a中公开的重链可变区具有约90%、95%或99%的同一性。在其他实施方式中,它与表2b中公开的轻链可变区具有约90%、95%或99%的同一性。例如,在变体显示与本文公开的抗体或抗原结合片段具有90%、95%或99%同一性的情况下,任何变异都发生在可变区的框架中而非CDR中。
在本文中,公开了编码本文公开的抗体或其部分的核酸。核酸包括用于多核苷酸的扩增、研究、分析或突变体诱导的PCR引物或序列分析引物,所述多核苷酸为:编码抗体的每条链或抗体的片段、其突变体、衍生物或变体的多核苷酸,编码轻链可变区或重链可变区或仅CDR的多核苷酸,足以用作杂交探针的多核苷酸以及编码多肽的多核苷酸。核酸可以为任何长度。这些长度可以为例如5、10、15、20、25、30、35、40、45、50、75、100、125、150、175、200、250、300、350、400、450、500、750、1000、1500、2000或2500个或更多个的多核苷酸,和/或可以包含一个或多个另外的序列(例如调节序列),和/或可以是更大的核酸(例如载体的一部分)。核酸可以为单链或双链,并且可以包含RNA多核苷酸和/或DNA多核苷酸及其人工变体(例如肽核酸)。
在一种实施方式中,编码本文公开的抗体或其片段的核酸是编码本文公开的CDR、包含CDR的可变区、包含可变区和恒定区的全长抗体的核酸。当确定氨基酸序列时,可以考虑已知的逆转录程序和密码子使用等而有效地确定核酸序列。编码人IgG1的重链恒定区的示例性核酸序列可以由SEQ ID NO:61至63表示。编码人λ的轻链恒定区的示例性核酸序列可以由SEQ ID NO:65至67表示。包含恒定区的核酸序列的全长重链的示例性核酸序列可以选自SEQ ID NO:50至54和74(包含人IgG1恒定区的重链),并且示例性核酸序列可以选自SEQ ID NO:60至59和75(包含人λ恒定区的轻链)。
另外,包括了编码表1a至表1f的CDR序列以及表2a和表2b的可变区的核酸序列。由于该核酸序列被包括在上述编码全长抗体的核酸序列中,因此没有单独公开,并且本领域技术人员将容易地基于本文公开的CDR和可变区的蛋白质序列而从核酸SEQ ID NO:50至59中确认该核酸序列。
本发明还包括与本文公开的一个或多个核酸序列具有基本序列同一性的一个或多个核酸序列。基本同一性是指即使在引起核酸变异不伴随氨基酸取代的保守性取代或氨基酸变异的情况下,核酸编码的抗体或抗原结合片段仍维持本文公开的作用。
抗体对抗原的特异性和亲和力
抗体或抗原结合片段特别具有对B7-H3抗原的特异性和适当的亲和力以用作抗体治疗剂/诊断剂。在一种实施方式中,根据表5,对聚集体的亲和力为KD<1.0×10
抗体的可变区
本发明涉及表2a和表2b中所示的抗体轻链可变区或抗体重链可变区以及包括免疫功能片段、衍生物、突变体蛋白和轻链可变区和重链可变区的变体在内的抗体(及相应的核酸序列)。重链和轻链可变区被不同地组合的抗体可以由“VHx/VLy”来表示,其中“x”对应于重链可变区SEQ ID NO,“y”对应于轻链可变区SEQ ID NO。在一种实施方式中,可变区可包含以下组合,但不限于此:VH30/VL35、VH30/VL36、VH30/VL37、VH30/VL38、VH30/VL39、VH30/VL71、VH31/VL35、VH31/VL36、VH31/VL37、VH31/VL38、VH31/VL39、VH31/VL71、VH32/VL35、VH32/VL36、VH32/VL37、VH32/VL38、VH32/VL39、VH32/VL71、VH33/VL35、VH33/VL36、VH33/VL37、VH33/VL38、VH33/VL39、VH33/VL71、VH34/VL35、VH34/VL36、VH34/VL37、VH34/VL38、VH34/VL39、VH34/VL71、VH70/VL35、VH70/VL36、VH70/VL37、VH70/VL38、VH70/VL39或VH70/VL71。
如上所述的可变区的各种组合可以用作完整抗体和包括scFV等的各种形式的抗体。
CDR
本文公开的抗体是其中移植、插入和/或连接一个或多个CDR的多肽。在一种实施方式中,抗体可以具有1个、2个、3个、4个、5个或6个CDR。因此,抗体可以具有例如一个重链CDR1(“CDRH1”)和/或一个重链CDR2(“CDRH2”)和/或一个重链CDR3(“CDRH3”)和/或一个轻链CDR1(“CDRL1”)和/或一个轻链CDR2(“CDRL2”)和/或一个轻链CDR3(“CDRL3”)。
可变区中对应于抗体的互补决定区(CDR)和框架区(FR)的氨基酸序列的位置可以通过Kabat(Kabat等人,(1983)美国卫生与公众服务部,“具有免疫学意义的蛋白质序列(Sequences of Proteins of Immunological Interest)”)、Chothia(Chothia和Lesk,J.Mol.Biol.196:901-917(1987))或与OPAL文库相关的方法(Hye Young Yang等人,2009Mol.Cells 27:225)来确定。当彼此比较时,由每个定义确定的CDR可以是重叠的子集或一个包含另一个的子集。然而,本文中,每种方法定义的所有CDR均被包括在本发明的范围内。当提供抗体的可变区的序列时,本领域技术人员将通过它们中的每个定义容易地选择CDR序列。
在一种实施方式中,表1a至1f中公开了要在抗体的重链和轻链中包含的CDR(或者重链CDRH1由选自SEQ ID NO:1至4中的任一个表示,以及CDRH2由选自SEQ ID NO:5至9和68中的任一个表示,以及CDRH3由选自SEQ ID NO:10至14中的任一个表示,以及CDRL1由选自SEQ ID NO:15至19中的任何一个表示,以及CDRL2由选自SEQ ID NO:20至24和69中的任一个表示,以及CDRL3由选自SEQ ID NO:25至29中的任一个表示)。
一种实施方式还包括与表1a至表1f中公开的一个或多个CDR的氨基酸序列具有基本序列同一性的一个或多个氨基酸序列。基本同一性是指在存在序列变异的情况下维持本文公开的作用。
天然或非天然存在的抗体的CDR的结构和特性如上所述。简而言之,在典型的抗体中,CDR被包含在由参与抗原结合和识别的区域组成的重链和轻链可变区的框架中。可变区包含框架区中的3个重链CDR和/或3个轻链CDR。根据Kabat定义(Kabat等人,(1983)美国卫生与公众服务部,“具有免疫学意义的蛋白质序列(Sequences of Proteins ofImmunological Interest)”)、Chothia(Chothia和Lesk,J.Mol.Biol.196:901-917(1987))或OPAL库相关方法(Hye Young Yang等人,2009Mol.Cells 27:225),可以确定CDR并且可以在重链和轻链或其可变区中对氨基酸残基进行编号。然而,本文公开的CDR用于定义抗原结合结构域的典型抗体结构,并且此外,如本文公开的,它可以被包含在其他各种多肽结构中来使用。
本领域技术人员将理解,当抗体包含本文公开的CDR中的一个或多个时,可以彼此独立地选择和组合公开的每个CDR。因此,抗体具有1、2、3、4、5或6个独立选择的CDR。此外,本领域的技术人员可以知晓,当选择CDR用于组合时,不重复使用相同类型的CDR,并且例如,通常不将抗体制备为包含两个CDRH2区。
单克隆抗体
本文公开的抗体可以包括与B7-H3结合的单克隆抗体。特别地,抗体包括特异性识别B7-H3胞外结构域的人单克隆抗体,并显示与小鼠和猴B7-H3的交叉反应性。
可以通过使用本领域已知的任何技术来制备单克隆抗体。例如,此外,还已知制备具有不同特性的抗体(例如对抗原具有各种亲和力的抗体)的技术。该技术是,例如通过在细丝噬菌体表面上展示免疫球蛋白可变结构域基因库来进行的链改组(chainshuffling),这被称为噬菌体展示。例如,参考本文的实施例中公开的内容,或者作为另外的技术,可以参考Marks等人.1991,J.Mol.Bio.222:581-597;Marks等人,1992,生物技术(BioTechnology)10:779-783。
另外,可以通过使用本领域已知的任何技术来制备单克隆抗体。例如,它可以通过使从免疫的转化的动物中收集的脾细胞永生化来产生。可以通过使用本领域已知的任何技术来使脾细胞永生化,例如通过将皮细胞与骨髓瘤细胞融合以产生杂交瘤。要用于杂交瘤产生融合过程的骨髓瘤细胞优选是非抗体产生性的,具有高融合效率,并且使骨髓瘤细胞不能在缺乏某些酶并仅支持靶融合细胞(杂交瘤)生长的特定选择性培养基中生长。要用于小鼠融合的适当细胞系的实例包括Sp-20、P3-X63/Ag8、P3-X63-Ag8.653、NS1/1.Ag 4 1、Sp210-Ag14、FO、NSO/U、MPC-11、MPC11-X45-GTG 1.7和S194/5XXO Bul,用于大鼠融合的细胞系的实例包括R210.RCY3、Y3-Ag 1.2.3、IR983F和4B210。用于细胞融合的其他细胞系可以是U-266、GM1500-GRG2、LICR-LON-HMy2和UC729-6。在某些情况下,通过以下步骤产生杂交瘤细胞系:从动物(例如,具有人免疫球蛋白序列的转化的动物、通过B7-H3免疫原免疫的动物)中收集脾细胞;将收集的脾细胞融合到骨髓瘤细胞以产生杂交瘤细胞;从杂交瘤细胞中建立杂交瘤细胞系,并鉴定产生与B7-H3结合的抗体的杂交瘤细胞系。可以通过使用本领域已知的技术来纯化杂交瘤细胞系分泌的单克隆抗体。
嵌合抗体
抗体也可以通过用于各种目的的各种方法进行修饰。嵌合抗体是通过由共价键连接来源于不同抗体的多肽片段而形成具有免疫学功能的轻链、重链或其片段的抗体。通常,嵌合抗体的轻链和/或重链的一部分是属于某个物种或某个类或亚型的序列,其余序列属于其他物种或其他类或亚型。对于嵌合抗体的制备方法,可以参考例如美国专利第4,816,567号;美国专利第4,816,567号;和Morrison等人,1985,Proc.Natl.Acad.Sci.USA 81:6851-6855。对于CDR移植,可以参考例如美国专利第6,180,370号、第5,693,762号、第5,693,761号、第5,585,089号和第5,530,101号。
通常,制备嵌合抗体的目的是使在使用抗体的生物体中发现的氨基酸数目最大化。一个实例是“CDR移植”抗体,其中该抗体包含来源于某个物种、某个类或亚型的CDR中的一个或多个,其余部分来源于其他物种或其他类或亚型抗体。例如,为了将该抗体用于人,可以通过将啮齿动物抗体的可变区或选择的CDR移植到人抗体中而替换人抗体的天然出现的可变区或CDR,反之亦然。
另外,在一种实施方式中,对于来源于人以外的物种的恒定区,可以使用与来源于人的可变区结合的杂合抗体。
全人抗体
还公开了全人抗体。可以在不使人暴露于抗原的情况下制备对某些抗原特异的全人抗体。
全人抗体也可以来源于噬菌体展示文库(Hoogenboom等人,1991,J.Mol.Biol.227:381;和Marks等人,1991,J.Mol.Biol.222:581)。噬菌体展示技术是模仿一种免疫选择的方法,该免疫选择在丝状噬菌体的表面上展示抗体库,并从中筛选与靶抗原结合的噬菌体。该种技术可以参考本文的实施例或PCT特开公开第WO 99/10494号。在一种实施方式中,通过噬菌体展示方法来分选本发明的全人B7-H3抗体。该技术可以参考例如本文的实施例或PCT特开第WO 2005/012359号。
产生全人抗体的另一种方法是“人源化”小鼠体液免疫系统。内源性Ig基因可以将人免疫球蛋白(Ig)基因座引入未激活的小鼠,从而在小鼠中产生全人单克隆抗体(mAb)。如果使用全人抗体,则可以使因将小鼠或小鼠来源的单克隆抗体施用至人而可能引起的免疫原性反应和变态反应最小化。该全人抗体可以通过免疫转化的动物(通常是小鼠)来产生,所述转化的动物可以通过缺乏内源性免疫球蛋白的产生而产生人抗体。为此目的的抗原通常具有6个或更多个连续氨基酸,并且随机地与载体(例如半抗原)缀合。例如,可以参考以下内容:Jakobovits等人,1993,Proc.Natl.Acad.Sci.USA 90:2551-2555;Jakobovits等人,1993,自然(Nature)362:255-258;和Bruggermann等人,1993,Year in Immunol.7:33。作为一个实例,在该方法中,通过使编码小鼠重链和轻链免疫球蛋白链的内源性小鼠免疫球蛋白基因座丧失能力并插入包含编码人重链和轻链蛋白的人基因组DNA的基因座片段,来生产转化的动物。通过杂交部分包含人免疫球蛋白基因座的部分修饰的小鼠,产生了其中引入全人免疫球蛋白基因的小鼠。当将免疫原施用至动物时,对免疫原具有免疫特异性而包含可变区的抗体具有人氨基酸序列而不是鼠类氨基酸序列。该方法是指例如WO96/33735和WO94/02602。与转化的小鼠相关的制备人抗体的方法可以参考美国专利第5,545,807号;第6,713,610号;第6,673,986号;第6,162,963号;第5,545,807号;第6,300,129号;第6,255,458号;第5,877,397号;第5,874,299号;第5,545,806号;WO91/10741,WO90/04036和EP第546073B1号。
然后,使用杂交瘤技术,可以产生并从转基因小鼠(例如上述的小鼠)中选择具有靶向特异性的抗原特异性人mAb。可以使用适当的载体和宿主细胞克隆并表达抗体,或者可以从培养的杂交瘤细胞中收集抗体。
抗体的各种形式
本文公开的抗体还是本文公开的抗体的变体。例如,抗原的一部分包含上文公开的重链或轻链、可变区或CDR序列的一个或多个残基中的保守氨基酸取代。保守氨基酸取代是指基本上不影响多肽的活性或抗原性的取代。在一种实施方式中,保守氨基酸取代是指取代为以下氨基酸分类中属于相同分类的其他残基。天然存在的氨基酸可以基于如下侧链特性的共同特性而进行分类:1)疏水性:正亮氨酸、Met、Ala、Val、Leu、Ile;2)中性,亲水性:Cys、Ser、Thr、Asn、Gln;3)酸性:Asp、Glu;4)碱性:His、Lys、Arg;5)残基影响链方向:Gly、Pro;和6)芳香族:Trp、Tyr、Phe。
保守氨基酸取代是指取代为该分类中属于相同分类的其他残基。保守氨基酸取代还可以包含非天然存在的氨基酸残基(例如肽模拟物),并且该残基通常通过化学合成引入,而不是细胞。
表3显示了保守氨基酸取代的非限制性的示例性实例。
[表3]保守氨基酸取代
非保守取代包括取代为属于上述分类以外的其它分类的残基。可以将这种取代引入与人抗体同源的抗体的区域或非同源区域。
在一种实施方式中,为了引入该取代,可以考虑显示氨基酸的疏水性或亲水性的指数(亲水指数)。通过针对每个氨基酸指定指数,然后重复对这些值求平均值,可以计算出蛋白质的指数分布(亲水性分布(hydropathic profile))。每种氨基酸的指数是根据疏水性和电荷特性指定的,如下所示:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸/胱氨酸(+2.5);甲硫氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸(-3.5);谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);和精氨酸(-4.5)。
对于为蛋白质赋予相互作用的生物学功能,指数分布的重要性在本领域中是已知的(Kyte等人,1982,J.Mol.Biol.157:105-131)。已知特定氨基酸可以被具有相似数值指数或分数的其他氨基酸取代,并且可以维持相似的生物活性。在一种实施方式中,对于基于指数的改变,包括其中指数在±2、±1或±0.5内的取代。
另外,特别是当通过取代产生的蛋白质是具有如本文所述的免疫活性的蛋白质时,可以基于亲水性进行相似氨基酸之间的取代。在一种实施方式中,由接近的氨基酸的亲水性确定的蛋白质的最大局部平均亲水性值与蛋白质的生物学特性(例如免疫原性和抗原结合特性)有关。
氨基酸残基的亲水性值如下:精氨酸(+3.0);赖氨酸(+3.0);天冬氨酸(+3.0±1);谷氨酸(+3.0±1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);苏氨酸(-0.4);脯氨酸(-0.5±1);丙氨酸(-0.5);组氨酸(-0.5);半胱氨酸(-1.0);甲硫氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5)和色氨酸(-3.4)。在基于相似的亲水性值进行取代的情况下,在一种实施方式中,包括其中亲水性值在±2、±1或±0.5内的氨基酸的取代。另外,可以基于亲水性从一级氨基酸序列中鉴定表位。另外,这些区域被称为“表位核心区”。
本领域技术人员将使用已知技术确定本文公开的多肽的适当变体。通过靶向多肽中被认为对于活性不重要的区域,本领域技术人员将找到可以在不破坏活性的情况下改变蛋白质的位点。本领域技术人员还将鉴定相似多肽之间保守的残基或部分。另外,在其他实施方式中,对于被认为对生物活性或结构重要的部分,在不破坏生物活性或不负面影响多肽结构的情况下,可以进行保守氨基酸取代。
而且,本领域技术人员可以进行结构功能分析,以鉴定相似多肽中对活性或结构重要的残基。通过该分析,可以通过在一种蛋白质中找到如下那样的残基来预测靶蛋白质中的重要氨基酸残基,所述残基对应于对与该靶蛋白质相似的蛋白质的活性或结构来说重要的氨基酸残基。本领域技术人员可以将以这种方式预测的重要氨基酸残基取代为化学上与其相似的氨基酸。
另外,基于相似多肽的三维结构和与该三维结构相关的氨基酸序列分析,本领域技术人员可以预测与抗体的三维结构相关的氨基酸残基。本领域技术人员不会引入快速改变,因为预测存在于蛋白质表面上的氨基酸残基可能与另一个分子发生重要相互作用。而且,本领域技术人员可以产生在每个靶氨基酸残基中包含单个氨基酸取代的测试变体。然后,通过使用与抗原的结合能力来筛选这些变体,从而收集有关哪种氨基酸取代符合目的的信息。使用该信息,本领域技术人员可以容易地确定待取代的位置或待避开的位置。
另外,可以基于蛋白质的二级结构来确定待取代的位置。例如,预测二级结构的一种方法是基于同源性建模(homology modeling)。例如,具有大于30%序列同一性或大于40%相似性的2种多肽或蛋白质可以具有相似的结构相(Holm等人,1999,Nucl.Acid.Res.27:244-247)。对于预测二级结构的其他方法,包括“串线(threading)”(Jones,1977,Curr.Opin.Struct.Biol.7:377-387;Sippl等人,1996,结构(Structure)4:15-19)、“分布分析(profile analysis)”(Bowie等人,1991,科学(Science)253:164-170;Gribskov等人,1990,Meth.Enzym.183:146-159;Gribskov等人,1987,Proc.Nat.Acad.Sci.84:4355-4358)和“进化链接(evolutionary linkage)”(Holm,1999,同上;和Brenner,1997,同上)。
在一些实施方式中,氨基酸取代执行(1)降低对蛋白质分解的敏感性,(2)降低对氧化的敏感性,(3)更改对于形成蛋白质复合物的结合亲和力,(4)更改抗原结合亲和力,和/或(5)更改以提供具有其他理化特性或功能特性的蛋白质。例如,包括保守性取代的单个或多个氨基酸的取代可以不在分子间接触所涉及的结构域中进行取代,而是在其他部分中进行取代。在该实施方式中,可以使用基本上不改变亲本序列的结构特性的保守氨基酸取代,例如,不改变抗体的二级结构的对一个或多个氨基酸的取代。本领域已知的多肽的二级结构和三级结构的实例可以参考蛋白质、结构和分子原理(Proteins,Structures andMolecular Principles)(Creighton编),1984,W.H.纽约:弗里曼和公司;蛋白质结构概论(Introduction to Protein Structure)(Branden和Tooze编),1991年,纽约:加兰出版;和Thornton等人,1991,自然354:105)。
在另外的优选抗体变体中,包括亲本序列中一个或多个半胱氨酸残基缺失,或者半胱氨酸残基被取代为其他氨基酸(例如丝氨酸)的变体。半胱氨酸变体特别是其中抗体具有生物学活性的结构,并且其在需要再折叠时是有用的。与亲本抗体相比,半胱氨酸变体可以具有少量半胱氨酸残基,并且通常含量可以为偶数,以使由于未成对的半胱氨酸引起的相互作用最小化。
本文公开的重链和轻链、可变区结构域和CDR可以用于制备包含可与B7-H3特异性结合的抗原结合区的多肽。例如,表4中公开的CDR中的一个或多个可以与如多肽的分子非共价地或共价地结合,因此它们可以用作免疫原性粘附分子。该免疫原性粘附分子可以是CDR整合在大分子聚合物中,或者CDR与另一个多肽连接。该免疫原性粘附分子允许与靶向与该免疫原性粘附分子连接的多肽或其他物质,例如B7-H3或表位的抗原特异性结合。
还提供了基于本文公开的可变区和CDR的肽模拟物。该模拟物可以是肽、非肽或肽与非肽的组合,并且可以参考以下内容:Fauchere,1986,Adv.Drug Res.15:29;Veber和Freidinger,1985,TINS p.392;和Evans等人,1987,J.Med.Chem.30:1229。与一种有用多肽在结构上相似的肽模拟物具有与原始多肽相似的作用。可以通过使用计算机化分子建模来开发该化合物。通常,肽模拟物与显示对本文的B7-H3特异性结合能力的抗体在结构上相似,但是,可以通过本领域广泛已知的方法将肽键中的一个或多个替换为选自-CH2NH-、-CH2S-、-CH2-CH2-、-CH-CH-(顺式和反式)、-COCH2-、-CH(OH)CH2-和CH2SO-的键。为了产生更稳定的蛋白质,可以将保守序列的残基中的一个或多个取代为相同类型的D-氨基酸(例如,用D-赖氨酸代替L-赖氨酸)。另外,可以使肽环化的分子可以在内部引入形成交联的半胱氨酸残基,从而产生在结构上对保守序列施加限制的肽(Rizo和Gierasch,1992,Ann.Rev.Biochem.61:387)。
本发明还提供了本文公开的抗体的衍生物。衍生的抗体可包含提供靶向特性的任何分子或材料,例如,在某些用途中对抗体或其片段具有增加的半衰期。衍生抗体可以包含可检测的(或标记的)残基(例如:与放射性分子、比色分子、抗原分子或酶分子结合的分子、可检测珠子(例如:磁珠或电子致密(例如:金)珠子)或其他分子(例如:生物素或链霉亲和素)、治疗性或诊断性残基(例如:放射性残基、细胞毒性残基或药物活性残基)或增加抗体对特殊用途(例如,施用至受试者(例如人受试者)或其他体内或体外用途)的适用性的分子。对于用于衍生抗体的分子的实例,包括白蛋白(例如人血清白蛋白)和聚乙二醇(PEG)。可以通过使用本领域广泛已知的技术来制备抗体的白蛋白连接的和聚乙二醇化的衍生物。在一种实施方式中,包含聚乙二醇化的单链多肽。在另一种实施方式中,抗体可以与运甲状腺素蛋白(TTR)或TTR变体缀合或连接。TTR或TTR变体可以通过选自由例如右旋糖酐,聚(正乙烯基吡咯烷酮),聚乙二醇,丙二醇均聚物,聚环氧丙烷/环氧乙烷共聚物,聚氧乙烯化多元醇和聚乙烯醇组成的组中的化学材料进行化学修饰。
其他衍生物包括B7-H3结合蛋白与其他蛋白或多肽的共价或团聚缀合物,所述共价或团聚缀合物可以例如通过表达包含在B7-H3蛋白的N末端或C末端融合的异源多肽的重组融合蛋白来制备。例如,缀合的肽可以是异源信号(或阅读器)多肽,例如酵母α因子阅读器,或肽,例如表位标签。包含B7-H3抗体的融合蛋白可以包含添加的肽以使纯化或鉴定B7-H3结合蛋白(例如:聚-His)变得容易。B7-H3结合蛋白也可以与FLAG肽连接,如Hopp等人,1988,Bio/Technology 6:1204和美国专利第5,011,912号中所述。FLAG肽具有优异的抗原性,因此可以充当抗原表位以与特定的单克隆抗体(mAb)可逆地结合,从而允许快速确认并容易地纯化重组蛋白。
在一种实施方式中,它涉及包含通过与B7-H3结合蛋白融合的肽残基之间的共价或非共价相互作用而结合的多个B7-H3结合多肽的寡聚物。该结合的肽可以是具有促进寡聚化的特性的肽,例如肽接头(间隔区)或亮氨酸拉链。在一种实施方式中,该寡聚物包含2或4个B7-H3结合蛋白。寡聚物的B7-H3结合蛋白残基可以是上述的任何形式,例如变体或片段。优选地,寡聚物包含具有B7-H3结合活性的B7-H3结合蛋白。
在一种实施方式中,通过使用来源于免疫球蛋白的多肽来制备寡聚物。制备包含与抗体来源的多肽的各个位点(包括Fc结构域)融合的异源多肽的融合蛋白可以参考,例如,Ashkenazi等人.,1991,Proc.Natl.Acad.Sci.USA88:10535;Byrn等人.,1990,自然344:677;和Hollenbaugh等人,1992"免疫球蛋白融合蛋白的构建(Construction ofImmunoglobulin Fusion Proteins)",免疫学通用方案(Current Protocols inImmunology),Suppl.4,第10.19.1-10.19.11页。
其他实施方式涉及包含2个融合蛋白的二聚体,其中B7-H3结合蛋白与抗体的Fc区融合。可通过以下步骤来制备二聚体:将编码融合蛋白的基因融合物插入适当的表达载体中,在由重组表达载体转化的宿主细胞中表达该基因融合物,并使表达的融合蛋白类似于抗体分子地组合,在这方面,在Fc残基之间形成了链之间的二硫键以收集二聚体。
本文使用的术语“Fc多肽”是来源于抗体的Fc区的多肽,并且包括野生型或突变体形式。还包括含有促进二聚化的铰链区的切割形式的多肽。包含Fc残基的融合蛋白或由其形成的寡聚物可以具有易于通过使用蛋白A柱子或蛋白G柱子的亲和色谱分离的优点。
对于适当的Fc多肽的实例,在美国专利号第5,426,048号和第5,262,522号、第5,457,035号和Baum等人,1994,EMBO J.13:3992-4001中进行了描述。在该突变蛋白的氨基酸序列中,野生型第19位氨基酸残基由Leu被取代为Ala,第20位氨基酸残基由Leu被取代为Glu,第22位氨基酸残基由Gly被取代为Ala。在突变蛋白中,对Fc受体的亲和力降低。
在其他实施方式中,本文公开的B7-H3结合蛋白的重链和/或轻链的可变区可以被取代并进入另一种抗体的重链和/或轻链的可变区。
标记物和效应基团
在一些实施方式中,抗体或抗原结合片段可包含一种或多种标记物。“标记物”是指任何可检测的物质。对于适当的标记基团的实例,包括放射性同位素或放射性核素(例如:3H、14C、15N、35S、90Y、99Tc、111In、125I、131I),荧光基团(例如:FITC、若丹明、镧系元素荧光物质)、酶基团(例如:辣根过氧化物酶,β-半乳糖苷酶,荧光素酶,碱性磷酸酶)、化学发光基团、生物素基团或被二级报告分子(例如亮氨酸拉链对序列、二级抗体结合位点、金属结合结构域、表位标签)识别的某些多肽表位,但不限于此。在一些实施方式中,标记基团通过各种长度的间隔区臂与抗体偶联以减少潜在的空间位阻。标记蛋白质的各种方法是本领域已知的,并且本领域技术人员将针对特定目的而选择适当的标记和合适的方法。
术语“效应基团”是与抗体或合成物质偶联或缀合的物质。在一种实施方式中,合成物质是指起治疗作用的任何物质。在一种实施方式中,适当的用于治疗的物质的实例包括用于治疗的放射性物质,例如放射性同位素或放射性核素(例如:3H、14C、15N、35S、90Y、99Tc、111In、125I、131I)。作为其他合适的实例,包括细胞毒性剂或抗癌剂,并且例如,包括紫杉醇、多西他赛、澳瑞他汀、格尔德霉素、澳瑞他汀、格尔德霉素、美登素、蒽环类衍生物、卡奇霉素、倍癌霉素、喜树碱、鹅膏蕈碱、吡咯并苯并二氮杂卓(PBD)二聚体、1-(氯甲基)-2,3-二氢-1H-苯并[e]吲哚(CBI)二聚体和CBI-PBD异质二聚体,但不限于此。在一些实施方式中,效应基团通过各种长度的间隔区臂与抗体偶联以减少潜在的空间位阻。
通常,标记物可以根据检测方法来分类:a)放射性标记或同位素标记;b)磁性标记(例如:磁性颗粒);c)氧化还原活性残基;d)光学染料;酶基团(例如辣根过氧化物酶,β-半乳糖苷酶,萤光素酶,碱性磷酸酶);e)生物素基团;f)被二级报告分子(例如亮氨酸拉链对序列、二级抗体结合位点、金属结合结构域、表位标签)识别的某些多肽表位。在一些实施方式中,标记基团通过各种长度的间隔区臂与抗体偶联以减少潜在的空间位阻。标记蛋白质的各种方法是本领域已知的。
在一种实施方式中,标记物包括光学染料,该光学染料包括生色团、磷光体和荧光物质,但不限于此。荧光物质可以是小分子荧光通过物质或蛋白质荧光通过物质。
“荧光标记物”是指通过物质具有的荧光特性检测的任何分子。对于荧光标记物的实例,包括荧光素、若丹明、四甲基若丹明、曙红、赤藓红、香豆素、甲基香豆素、芘、孔雀石绿、对称二苯代乙烯、荧光素黄、级联蓝J、得克萨斯红、IAEDANS、EDANS、BODIPY FL、LC红640、Cy 5、Cy 5.5、LC红705、俄勒冈绿、alexa-fluor染料(alexa-fluor 350、alexa-fluor430、alexa-fluor 488、alexa-fluor 546、alexa-fluor 568、alexa-fluor 594、alexa-fluor 633、alexa-fluor 647、alexa-fluor 660、alexa-fluor 680)、级联蓝、级联黄和R-藻红蛋白(FITC)、Cy5、Cy5.5和Cy7等,但不限于此。各种光学染料可参考分子探针手册(Molecular Probes Handbook),Richard P.Haugland。
蛋白质荧光标记物质包括绿色荧光蛋白,所述绿色荧光蛋白包括海肾(Renilla)、海笔(Ptilosarcus)或多管水母(Aequorea)物种的GFP(Chalfie等人,1994,科学263:802-805)、EGFP(Clontech Labs公司,Genbank登录号U55762)、蓝色荧光蛋白(BFP,QuantumBiotechnologies公司,魁北克,加拿大;Stauber,1998生物技术24:462-471;Heim等人,1996,Curr.Biol.6:178-182)、增强型黄色荧光蛋白(EYFP,Clontech Labs公司)、荧光素酶(Ichiki等人,1993,J.Immunol.150:5408-5417)、β-半乳糖苷酶(Nolan等人,1988,Proc.Natl.Acad.Sci.U.S.A.85:2603-2607),但不限于此。
核酸
在一方面,本发明涉及在特定杂交条件下与本文公开的核酸混淆的核酸。核酸的杂交方法是本领域众所周知的。例如,可以参考分子生物学通用方案(Current Protocolsin Molecular Biology),John Wiley&Sons,N.Y.(1989),6.3.1-6.3.6。在本文中,严格的杂交条件使用:包含5x氯化钠/柠檬酸钠(SSC)、0.5%SDS、1.0mM EDTA(pH 8.0)的预洗涤溶液;约50%甲酰胺,6x SSC的杂交缓冲液和55℃的杂交温度(或其他类似的杂交溶液,例如约50%甲酰胺的溶液,杂交温度为42℃),以及在0.5x SSC,0.1%SDS中的60℃的洗涤条件。严格的杂交条件是在45℃下先用6x SSC杂交,然后在68℃下再用0.1x SSC杂交,然后在0.2%SDS中洗涤一次或多次。进一步地,本领域技术人员将选择所需的合适的杂交条件,以使得包含序列之间至少65%、70%、75%、80%、85%、90%、95%、98%或99%同一性核苷酸序列的核酸通常维持彼此杂交的状态。
影响杂交条件和适当条件选择的基本参数可参考例如Sambrook,Fritsch和Maniatis,2001,分子克隆:实验指南,冷泉港实验室出版社,冷泉港,纽约和分子生物学通用方案,1995,Ausubel等人编,John Wiley&Sons公司,第2.10节和第6.3-6.4节。基于例如核酸的长度和/或碱基组成(A、G、C和T(U)的配置)等,本领域技术人员可以容易地确定这些条件。
本文公开的核酸还包括突变变体。可以通过核酸的突变来诱导核酸编码的多肽(抗体或抗体衍生物)的氨基酸序列的改变。可以通过使用本领域已知的任何技术来引入突变体。例如,可以使用定点诱变方法、随机诱变方法。分选同样制备的核酸突变体以得到具有靶向特性的多肽。
在不显著改变核酸编码的多肽的生物学活性的情况下,可以将突变体引入核酸中。例如,可以进行在非必需氨基酸残基中引起氨基酸取代的核苷酸取代。可替代地,可以将选择性改变核酸编码的多肽的生物学活性的一种或多种突变体引入核酸中。例如,突变体可以定量或定性地改变生物活性。定量改变的实例包括提高、降低或去除活性。定性改变的实例包括改变抗体对抗原的特异性。
另外,例如,在不改变核酸编码的多肽的氨基酸序列的情况下,可以将用于针对胞内表达进行密码子优化的变异引入核酸中。在这种情况下,由于密码子的简并性,可以制备许多编码相同多肽的核酸。
通过使用本领域众所周知的分子生物学技术,可以使编码本文公开的任何抗体或其片段的核酸突变,使得氨基酸序列被修饰。
另外,在另一方面,本发明涉及适合用作引物或杂交探针以检测本文公开的核酸序列的核酸分子。该核酸可以包含用作探针或引物的全长核酸序列的一部分,例如,编码全长多肽的核酸的片段或编码多肽的活性部分(B7-H3结合部分)的核酸的片段。
基于核酸序列制备的引物和探针可以用于检测编码本文公开的核酸或类似核酸或多肽的转录组。在一种实施方式中,该探针可用于鉴定表达多肽的细胞。引物或探针可以用标记物质标记,所述标记物质例如放射性同位素、荧光化合物、酶或酶的辅因子。
另一方面,本发明另外提供了包含编码所述多肽或其部分(例如,包含一个或多个CDR或一个或多个可变区结构域的片段)的核酸的载体。载体的实例包括质粒、病毒载体、非附加体哺乳动物载体和(重组)表达载体、用于CAR-T细胞或CAR-NK细胞治疗剂的载体等,但不限于此。重组表达载体可以包含用于宿主细胞中表达核酸的合适形式的核酸。重组表达载体包含基于待用于表达的宿主细胞的一个或多个调节序列,并且这些调节序列可操作地连接至待表达的核酸序列。在调节序列中,包括:例如,SV40初始基因增强子、可以控制各种宿主细胞中的核苷酸序列表达的启动子(例如劳斯肉瘤病毒启动子和巨细胞病毒启动子);或例如,仅控制特定宿主细胞中的核苷酸序列表达的组织特异性调节序列(Voss等人,1986,Trends Biochem.Sci.11:287;Maniatis等人.,1987,科学236:1237),以及在哺乳动物细胞中起作用的金属硫蛋白启动子和通过响应特殊处理或条件而指示核苷酸序列的诱导型表达的在原核生物和真核生物系统中均起作用的tet反应性和/或链霉素反应性启动子。考虑到诸如待转化的宿主细胞的种类、靶蛋白的表达程度的因素,本领域技术人员将选择适当的载体和调节序列。可以在宿主细胞中递送选择的表达载体,并且所述选择的表达载体可以用于产生由本文公开的核酸编码的蛋白质。
在其他方面,本发明提供了其中引入了重组载体的宿主细胞。宿主细胞可以是任何原核生物(例如大肠杆菌(E.coli))或真核生物(例如酵母、昆虫或哺乳动物细胞)。可通过已知的转化或转染技术将载体DNA引入原核细胞或真核细胞中。已知在哺乳动物细胞中稳定转染的情况下,取决于所使用的表达载体的种类和转化技术,只有少数细胞可以将通过转染递送的DNA整合到该细胞的基因组中。因此,为了鉴定和选择转染的细胞,通常将编码选择性标志物(例如抗生素抗性标志物)的基因与靶基因一起引入宿主细胞。对于优选的选择性标志物,包括药物,例如,对例如G418、潮霉素和甲氨蝶呤具有抗性的药物。可以通过仅通过药物处理来选择存活的细胞,实现对其中稳定引入了靶核酸的细胞的分选。
还提供了使用抗体的治疗方法。在一种实施方式中,将抗体提供给患者。在一种实施方式中,抗体与在癌细胞表面、癌症血管生成性血管或抗原呈递细胞上表达的人B7-H3结合,从而抑制T细胞的免疫检查点,从而激活T细胞。抗体与在癌细胞表面或癌症血管生成性血管上表达的人B7-H3结合,从而抑制癌细胞的生长。在一种实施方式中,抗体在诸如CAR-T或CAR-NK等细胞治疗剂的表面上表达,并且抗体与人B7-H3结合,从而将细胞治疗剂特异性地递送至癌细胞,从而诱导癌细胞死亡。在一种实施方式中,抗体可以与抗癌免疫抗体联合使用,从而通过激活T细胞来抑制癌症。
还提供了药物组合物,所述药物组合物包含治疗有效剂量的抗体和药学上可接受的稀释剂、溶媒(carrier)、增溶剂、乳化剂、防腐剂和/或补充剂。另外,例如,包括通过施用这样的药物组合物来治疗癌症患者的方法。在此,受试者或患者包括人患者。
可接受的制剂材料在使用的容量和浓度上对接受者无毒。在一个具体的实施方式中,提供了包含治疗有效剂量的人B7-H3抗体的药物组合物。
在下文中,给出了期望的实施例以促进对本发明的理解。然而,提供以下实施例以更好地理解本发明,并且本发明的范围不受以下实施例的限制。
实施例
实施例1:抗体的制备
实施例1-1:抗原的制备
购买并使用了用于针对制备抗B7-H3抗体而进行噬菌体展示的抗原。在人B7-H3的情况下,包含NP_001019907.1的氨基酸序列的第1至461位,并且使用了其中组氨酸标签(His标签)连接至C末端的重组B7-H3蛋白(2318-B3/CF,R&D Systems公司)。
购买并如下使用了以下实施例的用于ELISA分析、SPR分析或T细胞活性分析的抗原。在人B7-H3的情况下,包含NP_001019907.1的氨基酸序列的第1至461位,并且使用了其中组氨酸标签(His标签)连接至C末端的重组B7-H3蛋白和其中人IgG1的Fc区连接至C末端的蛋白(Sino Biological公司,11188-H02H)。
实施例1-2:通过噬菌体文库筛选进行抗体分选制备
文库噬菌体的制备
将具有与多种抗原具有结合多样性的人来源的scFv(单链可变片段)文库(Mol.Cells OT,225-235,2009年2月28日)基因的2×10
为了分选与人B7-H3蛋白结合的抗体,使用实施例1-1的与组氨酸标签(His标签)连接的重组B7-H3蛋白,总共进行3次如下的淘选。
具体地,通过将2μg/ml浓度的1ml重组人B7-H3蛋白添加到免疫管(maxisorp444202)中,在37℃,200rpm的条件下在试管表面上吸附蛋白质1小时。然后,去除上清液,并将包含3%脱脂乳的溶液加入试管中,使其在室温下反应1小时。尽管这样,脱脂乳吸附在未吸附重组人B7-H3蛋白的免疫管表面上,从而阻断了非特异性结合。去除上清液后,将10
然后,将非特异性结合的噬菌体用PBS-T(磷酸盐缓冲盐水-0.05%吐温20)溶液洗涤并去除,并通过添加1ml的100mM三乙胺溶液来收集剩余的抗原特异性噬菌体抗体。三乙胺溶液的pH值较低时用1M Tris缓冲液(pH 7.4)中和收集的噬菌体之后,在37℃,120rpm的条件下,用收集的噬菌体感染生长到OD600为0.8至1的ER2537大肠杆菌1小时30分钟。将培养液在4℃,4500rpm的条件下离心15分钟,去除上清液,通过将受感染的大肠杆菌涂布在含有氨苄青霉素的2×YT琼脂培养基上,在37℃下培养沉降的细胞16小时或更久。第二天,将所有培养的大肠杆菌刮下并在5ml 2×YT氨苄青霉素培养液中悬浮,添加505甘油,一部分在-80℃下保存,另一部分用于制备用于下次实验的噬菌体。在包含氨苄青霉素的2×TB中接种20μl培养的大肠杆菌并使其生长后,感染辅助噬菌体,并将实施例2-1和2-2重复两次以上,从而扩增和浓缩人B7-H3蛋白特异性噬菌体池。
单克隆筛选
为了从通过淘选获得的噬菌体池中分选与人B7-H3蛋白特异性结合的单克隆抗体,进行了如下实验。
为了从浓缩池中分离出单克隆,在将噬菌体池涂布在LB-氨苄青霉素琼脂培养基上并培养后,确保了单个菌落。然后,将单克隆接种到每孔中置有200μl超级肉汤(SB)培养基的96孔深孔板上,并培养过夜,然后将一部分转移到其他板上制成细胞储备液。将1mMIPTG置于剩余的细胞培养液中,并在30℃下培养16小时,以诱导产生scFv。将培养的培养液在4℃、6000rpm的条件下离心后,弃去上清液,仅获得细胞,然后用TES溶液裂解细胞,然后再次离心,从而仅获得上清液以供使用。
然后,通过如下所述的ELISA方法选择表达与B7-H3-His抗原(2318-B3/CF,R&DSystems公司)结合的可溶性单克隆scFv的克隆(Steinberger.Rader and BarbasIII.2000.噬菌体展示载体.在噬菌体展示实验手册中(Phage display vectors.In:PhageDisplay Laboratory Manual).第一版.冷泉港实验室出版社,美国纽约.pp.11.9-11.12。)具体地,将实施例1中制备的重组人B7-H3-his蛋白以每孔100ng置于96孔板(Nunc-ImmunoPlates,NUNC,Rochester,NY,USA)上,并在4℃下吸附过夜。第二天,用PBST(磷酸盐缓冲盐水-0.05%吐温20)洗涤蛋白质后,为防止非特异性结合,每孔放入含200μL的3%BSA的PBS缓冲溶液,并在37℃下反应2小时。然后,再次用PBST洗涤后,每孔放入100μl的预先离心制备的包含噬菌体的上清液,在37℃下反应约1小时。然后,在用PBST洗涤后,为了检测与人B7-H3结合的噬菌体,将抗HA HRP(辣根过氧化物酶)结合抗体(Roche公司,12013819001)在含有1%BSA的PBS中以1:5000稀释,每孔放入100μl,并在37℃反应约1小时。再次用PBST洗涤后,放入100μl的TMB(四甲基联苯胺,Thermo公司,34028)以显色。在室温下反应5-10分钟后,放入50ml 1N H
从其中,分选出与重组人B7-H3蛋白结合的7种抗体克隆(B5、C41、D8G、F6V、10F11、D8G M1和D8G M3),并且每种抗体的重链可变区和轻链可变区的氨基酸序列和CDR序列如下表。
[表4]
[表5]
编码可变区和CDR序列的核酸序列被包含在以下全长核酸序列中,按B5、C41、D8G、F6V、10F11、D8G M1和D8G M3的顺序分别为:SEQ ID NO:50(重链)和55(轻链);SEQ ID NO:51(重链)和56(轻链);SEQ ID NO:52(重链)和57(轻链);SEQ ID NO:53(重链)和58(轻链);SEQ ID NO:54(重链)和59(轻链);SEQ ID NO:74(重链)和57(轻链);以及SEQ ID NO:74(重链)和75(轻链)。在核酸序列中,编码恒定区的核酸序列为SEQ ID NO:61至63(重链)和SEQID NO:65至67(轻链)。
实施例2:抗B7-H3 scFv到完整的IgG形式的转化及其生产
实施例2-1:抗B7-H3 scFv到完整的IgG形式的克隆
为了将实施例1中确保的每种人B7-H3特异性单克隆噬菌体抗体转化为完整的IgG形式,合成了编码实施例1中确保的每种克隆的重链可变区和轻链可变区的核酸(Genotech公司,韩国)。合成编码人IgG1亚型的重链和轻链恒定区(分别为SEQ ID No:60和64)的基因(重链恒定区SEQ ID NO:61(C41、D8G、10F11、D8G M1、D8G M3克隆)、62(B5克隆)、63(F6V克隆)和轻链恒定区SEQ ID NO:65(C41、D8G、10F11、D8G M1、D8G M3克隆)、66(B5克隆)和67(F6V克隆))并与编码每种重链和轻链可变区的核酸连接。将编码每种抗体的轻链和重链的核酸分别克隆到基于pcDNA 3.1的表达载体中,并确保了在CHO-S等哺乳动物细胞系中编码抗体核酸的载体。另外,为了使用常规的抗B7-H3抗体恩必利珠单抗(Enoblituzumab)作为比较组抗体,从专利(US 8,802,091)中获得了该抗体的可变区序列,并获得了该基因,并且将其与上述方法相同地克隆并命名为84D以供使用。
抗体的IgG形式作为以下重链和轻链全长序列公开,按B5、C41、D8G、F6V、10F11、D8G M1和D8G M3的顺序分别为:SEQ ID NO:50(重链)和55(轻链);SEQ ID NO:51(重链)和56(轻链);SEQ ID NO:52(重链)和57(轻链);SEQ ID NO:53(重链)和58(轻链);SEQ ID NO:54(重链)和59(轻链);SEQ ID NO:74(重链)和57(轻链);以及SEQ ID NO:74(重链)和75(轻链)。
实施例2-2:抗B7-H3抗体的表达
为了表达抗B7-H3抗体,使用由Theremo公司开发的ExpiCHO-S
简要地描述制备方法,在8%CO
然后,将表达来自实施例2-1的重链和轻链的每种载体分别在OptiPRO
培养后,将细胞培养液在4℃,6000rpm的条件下离心30分钟,然后将上清液分离并冷冻。
实施例2-3:抗B7-H3抗体的分离和纯化
使平衡缓冲液(50mM Tris-HCl,pH7.5,100mM NaCl)通过Mab selectsure(GEHealthcare公司,5ml)以使其平衡后,使实施例2-2的培养液通过柱子(Mab selectsure(GEHealthcare公司,5ml)),以使表达的抗体与柱子结合。然后,用50mM柠檬酸钠(pH 3.4)、100mM NaCl溶液洗脱后,通过使用1M Tris-HCl(pH 9.0)进行中和,使得最终pH为7.2。用PBS(磷酸盐缓冲盐水,pH 7.4)交换缓冲溶液。
实施例3:抗B7-H3抗体与B7-H3的结合特异性分析
实施例3-1:抗B7-H3 IgG抗体与重组B7-H3抗原的结合特异性分析(ELISA)
为了确认在实施例1和2中选择和制备的抗B7-H3 IgG抗体对B7-H3抗原的特异性结合能力,进行了基于ELISA的溶液结合测试。
具体地,将重组人B7-H3蛋白以1μg/ml的浓度稀释后,将其以每孔100μl置于96孔板(Nunc-Immuno Plates,NUNC)中,将其在4℃下反应16小时以进行包被。在此使用实施例1中使用的重组人B7-H3蛋白。
然后,去除蛋白质并用PBST洗涤后,将包含1%BSA(牛血清白蛋白)的PBS缓冲液以每孔200μl放置,并在37℃下反应2小时以阻断非特异性结合。然后,在96孔板上将实施例2中制备的抗B7-H3抗体以10μg/ml的浓度稀释后,将100μl置于每个孔中,并在37℃下反应1小时。然后用PBST洗涤。为了检测与人B7-H3结合的抗体,将HRP连接的抗人IgG F(ab')2抗体(山羊抗人IgG F(ab')2交叉吸附的二抗,HRP,Pierce公司,31414)在包含1%牛血清白蛋白(BSA)的PBS中以1:10,000的比例稀释,然后每孔中放入100μl,使其在37℃下反应约1小时。再次用PBST洗涤后,放入100μl的TMB(四甲基联苯胺,Sigma公司,T0440)以显色。在室温下反应5-10分钟后,放入50μl 1N H
图1a和1b中描述了结果。作为使用ELISA方法测量结合能力的结果,确认了抗B7-1H3抗体以浓度依赖的方式与人B7-H3的胞外结构域结合。
实施例3-2:抗B7-H3抗体与B7家族的其他蛋白质的结合能力分析
B7家族蛋白彼此共享20至40%的相同氨基酸,并且具有结构相关性,例如免疫球蛋白结构域的可重复性。因此,如下分析了本发明的抗B7-H3抗体是否特异性结合B7-H3蛋白而不结合其他B7家族蛋白。
为了确认免疫特异性结合能力,购买并使用具有结构相似性的B7家族组分蛋白:B7-1(Sino Biological公司,目录号:10698-H08H)、B7-2(Sino Biological公司,目录号:10699-H08H)、B7-DC(Sino Biological公司,目录号:10292-H08H)、B7-H1(SinoBiological公司,目录号:10084-H08H),B7-H2(Sino Biological公司,目录号:11559-H08H)、B7-H4(Sino Biological公司,目录号:10738-H08H)、B7-H5(Sino Biological公司,目录号:13482-H08H)、B7-H6(Sino Biological公司,目录号:16140-H08H)、B7-H7(SinoBiological公司,目录号:16139-H02H)。
具体地,将重组人B7家族蛋白以1μg/ml的浓度稀释后,将其以每孔100μl置于96孔板(Nunc-Immuno Plates,NUNC)中,将其在4℃下反应16小时以进行包被。使用实施例1中使用的重组蛋白。
然后,去除蛋白质并用PBST洗涤后,每孔放200μl的包含1%BSA(牛血清白蛋白)的PBS缓冲液,并在37℃下反应2小时以阻断非特异性结合。然后,在96孔板上将实施例2中制备的抗B7-H3抗体以10μg/ml稀释后,每孔中放100μl,并在37℃下反应1小时。然后用PBST洗涤。为了检测与抗原结合的抗体,将HRP连接的抗人IgG F(ab')2抗体(山羊抗人IgG F(ab')2交叉吸附的二抗,HRP,Pierce公司,31414)在包含1%牛血清白蛋白(BSA)的PBS中以1:10,000稀释。每孔放100μl,并在37℃下反应1小时。再次用PBST洗涤后,放入100μl的TMB(四甲基联苯胺,Sigma公司,T0440)以显色。在室温下反应5-10分钟后,放入50μl的H
图2中描述了结果。作为使用ELISA方法测量结合能力的结果,确认了抗B7-H3抗体仅与B7-H3特异性结合,而不与其他B7家族蛋白特异性结合。
实施例3-3:抗B7-H3抗体与人、猴和小鼠B7-H3的种内交叉反应性分析
为了在临床发展到人之前评估抗B7-H3抗体的抗体功效和免疫调节活性,在啮齿动物或灵长类动物模型中进行评估是重要的。人B7-H3的序列在猴和小鼠中具有90%或更高的同一性。通过如下的ELISA分析方法分析了实施例2中制备的本发明的抗B7-H3抗体与小鼠或猴B7-H3的交叉反应性。
为了确认种内交叉反应性,购买并使用组氨酸标签(His标签)连接至C末端的重组小鼠B7-H3蛋白(Sino Biological公司,目录号:50973-M08H)和人IgG1的Fc区连接至C末端的重组猴B7-H3蛋白(Sino Biological,目录号:90806-CO2H)的抗原。
具体地,将重组人B7-H3、小鼠B7-H3和猴B7-H3蛋白以1μg/ml的浓度稀释后,将其以每孔100μl置于96孔板(Nunc-Immuno Plates,NUNC)中,将其在4℃下反应16小时并进行包被。对于使用的重组蛋白,使用在实施例1中购买用于分析的产物。
然后,去除蛋白质并用PBST洗涤后,每孔放200μl的包含1%BSA(牛血清白蛋白)的PBS缓冲液,并在37℃下反应2小时以阻断非特异性结合。然后,在96孔板上将实施例2中制备的抗B7-H3抗体以10μg/ml范围内的某些浓度稀释后,每孔中放100μl,并在37℃下反应1小时。然后用PBST洗涤后,为了检测与人B7-H3、小鼠B7-H3和猴B7-H3结合的抗体,将HRP连接的抗人IgG F(ab')2抗体(山羊抗人IgG F(ab')2交叉吸附的二抗,HRP,Pierce公司,31414)在包含1%牛血清白蛋白(BSA)的PBS中以1:10,000稀释,每孔放100μl,并在37℃下反应1小时。再次用PBST洗涤后,放入100μl的TMB(四甲基联苯胺,Sigma公司,T0440)以显色。在室温下反应5-10分钟后,放入50μl的H
图3和4中描述了结果。作为使用ELISA方法测量结合能力的结果,确认了抗B7-H3抗体与人、猴和小鼠B7-H3特异性结合。本发明的抗B7-H3抗体与人和猴B7-H3的结合程度显示出是相似的,但是与小鼠B7-H3的结合程度相对较低(图3)。观察到在克隆之间抗B7-H3抗体与小鼠B7-H3的结合程度是不同的,并且用作比较抗体的84D抗体不与小鼠B7-H3蛋白结合(图4)。
实施例3-4:抗-B7-H3抗体与细胞表面表达B7-H3抗原的结合能力的测量
然后,通过FACS分析,测量在实施例2中制备的本发明的抗B7-H3抗体结合细胞表面上表达的人B7-H3的能力。
在实验中,使用了表达人B7-H3的癌细胞系:MCF-7(人乳腺腺癌细胞系,ATCC HTB-22
具体地,在解离每种细胞系并用PBS缓冲液洗涤后,对细胞数目进行计数并调整至每孔2×10
将处理每种B7-H3单克隆抗体的实验组中的人B7-H3单克隆抗体-FITC结合的峰位移的结果与阴性对照组结合进行比较。结果用B7-H3单克隆抗体处理的实验组中的峰位移值除以阴性对照组中的峰位移值(平均荧光强度比)来表示,并在图5和图6中描述该结果。作为使用FACS方法测量结合能力的结果,确认了抗B7-H3抗体以浓度依赖的方式特异性结合细胞表面上表达的人B7-H3。
实施例3-5:在各种癌症中抗-B7-H3抗体与细胞表面表达B7-H3抗原的结合能力的测量
然后,通过FACS分析,确认了本发明的抗B7-H3抗体在各种癌细胞系中是否与细胞表面表达B7-H3结合。
使用各种癌细胞:A2780(人卵巢癌,ECACC,93112519)、SKOV-3(人卵巢腺癌,
在解离每种细胞系并用PBS缓冲液洗涤后,对细胞数目进行计数并调整至每200μlPBS有2×10
[表6]
(MFI比:抗B7-H3的MFI/第二抗体的MFI)
(N/D:未确定)
作为使用FACS方法测量结合能力的结果,确认了本发明的抗B7-H3抗体与来源于卵巢癌、结直肠癌、非小细胞肺癌、乳腺癌、肾癌、胰腺癌、胃癌、宫颈癌和淋巴瘤的各种癌细胞系结合。另外,确认了与相同浓度的用作比较组的抗体84D相比,本发明的抗B7-H3抗体显示出更高的结合能力,因此,与细胞表面上表达的B7-H3的结合程度更高。
实施例3-6:抗-B7-H3抗体与小鼠来源的癌细胞的小鼠B7-H3抗原的结合能力的测量(FACS)
然后,通过FACS分析,测量了本发明的抗B7-H3抗体与细胞表面表达小鼠B7-H3的结合能力。通过实施例3-3中的ELISA方法,确认了抗B7-H3抗体与人B7-H3和小鼠B7-H3重组蛋白两者的结合。为确认本发明的抗B7-H3抗体是否与小鼠癌细胞系的细胞表面上表达的小鼠B7-H3结合,使用了小鼠来源的癌细胞系CT26(小家鼠(Mus mesculus)结肠癌、
对于每种细胞系,将细胞解离并用PBS缓冲液洗涤。对细胞数目进行计数并调整至每孔2×10
使用PBS缓冲液洗涤细胞后,将以1:500稀释的FITC标记的抗人Fc FITC(Sigma公司,F9512)每孔添加100μl,并使反应在4℃下进行1小时。对于对照组,仅处理了FITC标记的抗人Fc FITC。再次使用PBS缓冲液洗涤两次后,使用FACSCalibur装置测量抗B7-H3 IgG抗体的结合程度。
将用B7-H3单克隆抗体处理的实验组中的峰位移值与阴性对照组中的峰位移值进行比较。图7中描述了结果。作为使用FACS方法测量的结果,确认了本发明的抗B7-H3抗体与细胞表面上表达的小鼠B7-H3特异性结合。
实施例4:抗B7-H3抗体对B7-H3的亲和力的测量
通过SPR法测定了抗原B7-H3与抗B7-H3抗体的结合亲和力。首先,以50RU在蛋白A芯片(GE Healthcare公司,目录号29127556)上以60秒的接触时间、60秒的稳定时间和30μl/分钟的流速来捕获通过1×HBS-EP缓冲液稀释的抗B7-H3抗体。使用1×HBS-EP缓冲液,将抗原B7-H3(R&D systems公司,2318-B3-050/CF)从100nM到3.125nM进行系列两倍稀释。此时,另外制备1×HBS-EP缓冲液作为空白。使在捕获有抗B7-H3抗体的芯片上制备的B7-H3抗原以30μl/分钟的流速流动60秒的缔合时间和180秒的解离时间。用10mM甘氨酸-HCl pH1.5(GE Healthcare公司,目录号BR100354)以30μl/分钟的流动时间和30秒的接触时间进行再生。表7中描述了结果。
[表7]抗B7-H3抗体对B7-H3的亲和力的测定结果
实施例5:抗B7-H3抗体的抗体依赖性细胞介导的细胞毒作用的测量
通过使用ADCC报告分子生物测定(Promega,G7018)试剂盒确认了抗B7-H3抗体的抗体依赖性细胞介导的细胞毒作用的能力。根据制造商的方案执行实验方法。
为了分析抗体依赖性细胞介导的细胞毒作用的能力,使用了MCF-7乳腺癌细胞系、Calu-6肺癌细胞系和DLD-1结肠直肠癌细胞系作为B7-H3表达程度相对较高的细胞系,以及使用了Mino套细胞淋巴瘤细胞系作为B7-H3表达程度相对较低的细胞系。使用Jurkat成年T细胞白血病细胞系作为不表达B7-H3的阴性对照组。具体而言,在实验前一天使贴壁培养细胞系MCF-7、Calu-6和DLD-1细胞系解离,然后在4℃,1200rpm的条件下离心5分钟,将细胞悬浮在包含10%胎牛血清(FBS)的RPMI 1640培养基中,每孔接种并培养5×10
在制备实施例2中制备的本发明的抗B7-H3抗体和比较抗体(84D)之后,通过分别在RPMI 1640(4%低IgG血清)培养基中以一定比例分别从10μg/ml或15μg/ml或18μg/ml的浓度将其稀释,每孔添加25μl。然后,将ADCC报告分子生物测定中包含的Jurkat/NFAT-FcγRIIIa细胞放入37℃水浴中并将其溶解后,添加并混合3.6mL RPMI 1640培养基(4%低IgG血清)。每孔加入25μlJurkat/NFAT-FcγRIIIa细胞后,将其在37℃下反应6小时。然后,在溶解包含在Bio-Glo荧光素酶测定(Promega,G7941)中的底物,每孔添加75μl并且使其反应5分钟至10分钟之后,测量荧光。
图8中描述了抗B7-H3抗体的抗体依赖性细胞介导的细胞毒作用。确认了在不表达B7-H3的Jurkat细胞系的阴性对照组中未观察到抗体依赖性细胞介导的细胞毒作用,但是在表达B7-H3的MCF-7、Calu-6、DLD-1和Mino细胞系中,对抗B7-H3抗体特异性地显示了抗体依赖性细胞介导的细胞毒作用。这显示,该抗体可以有效地用于癌细胞的死亡,因为它通过与表达B7-H3的癌细胞特异性结合而诱导抗体依赖性细胞介导的细胞毒作用。特别地,显示了本发明的抗B7-H3抗体可以更有效地用于癌症治疗,因为与比较抗体84D相比,半数最大有效浓度(EC50)较低并且抗体依赖性细胞介导的细胞毒作用信号的强度较强。
实施例6:抗B7-H3抗体的T细胞激活的诱导能力的测量
实施例6-1.人外周血单核细胞(PBMC)中B7-H3蛋白对T细胞活性的抑制作用的测量
B7-H3是属于免疫检查点配体的蛋白质,并且已知通过与T细胞表面上的B7-H3受体结合来诱导抑制T细胞的免疫反应。因此,为了确认B7-H3蛋白是否抑制预先激活的T细胞释放的细胞因子(干扰素γ),在PBMC上处理B7-H3蛋白后,测量人T细胞的细胞因子的释放量。
具体地,为了激活人T细胞,通过在PBS中将抗CD3抗体(UCHT1,Biolegend公司)稀释至5μg/ml来制备抗CD3抗体,并且将B7-H3蛋白(Sino Biological公司,11188-H08H)或阴性对照组IgG1(BioXCell公司,BP0297,标记为IgG1或Cont.Ab)添加到以5μg/ml稀释的抗CD3抗体中,从而通过从40μg/ml进行4倍顺序稀释来制备。将通过稀释制备的抗CD3抗体和B7-H3蛋白或通过稀释制备的抗CD3抗体和阴性对照组以50μl/孔等分到96孔细胞培养板(Corning公司)上,并在4℃下反应过夜或在37℃下反应2小时,然后用PBS洗涤一次。将通过购买制备的人外周血单核细胞(CTL)悬浮在含10%FBS(胎牛血清)的RPMI 1640培养液中,并且将其在通过处理抗CD3抗体和B7-H3蛋白或抗CD3抗体和阴性对照组而包被的板上等分为1×10
实施例6-2.人外周血单核细胞(PBMC)中抗B7-H3抗体的T细胞激活诱导能力的测量
然后,使用人外周血单个核细胞(PBMC)进行了实验,以研究抗B7-H3抗体是否可以重新激活被B7-H3蛋白抑制的T细胞的活性。可以阻断B7-H3蛋白与T细胞表面上的B7-H3受体之间结合的抗B7-H3抗体可以重新激活被B7-H3抑制的T细胞的免疫反应。这意味着如上激活的T细胞可以显示出免疫抗癌治疗作用。
进行了实验以确认本发明中制备的抗B7-H3抗体是否可以阻断B7-H3对激活的T细胞释放细胞因子(干扰素γ)的抑制。
将PBMC置于用B7-H3蛋白包被的板中,然后用本发明的抗B7-H3抗体处理该板。进行对人T细胞的细胞因子释放量的测量。
为了激活人T细胞,可通过以5μg/ml在PBS中稀释来制备抗CD3抗体(UCHT1,Biolegend公司),并且为了通过B7-H3蛋白抑制T细胞激活,将B7-H3蛋白以10μg/ml的浓度添加至制备的抗CD3抗体中。将上述制备的B7-H3蛋白以每孔50μl等分到96孔细胞培养板(Corning公司)上,并在4℃下反应过夜或在37℃下反应2小时,然后用PBS洗涤一次。将抗B7-H3抗体和阴性对照组IgG1(BioXCell公司,BP0297,标记为IgG1或Cont.Ab)添加到含10%FBS(胎牛血清)的RPMI-1640培养液(Invitrogen公司)中,从而通过从16μg/ml开始进行4倍顺序稀释来制备。
将通过购买制备的人外周血单核细胞(PBMC,CTL)悬浮在含10%FBS(胎牛血清)的RPMI 1640培养液中,然后将其以1×10
在放有PBMC的板上,添加通过连续4倍稀释制备的抗B7-H3抗体和阴性对照组IgG1(50μl/孔)。然后,以每孔100μl添加含10%FBS的RPMI 1640培养液,使得处理到细胞的抗体的最高浓度下的最终浓度为4μg/ml(27nM)。在以单一浓度处理抗B7-H3抗体的情况下,抗体的最终浓度为10μg/ml。培养后3天,根据分析仪制造商的说明,使用培养上清液用ELISA分析仪(R&D system公司)进行人T细胞的干扰素γ释放量的分析。
图9b中描述了结果。作为测量人T细胞的干扰素γ释放量的结果,确认了本发明中制备的抗B7-H3抗体使被B7-H3蛋白抑制的T细胞重新激活,从而促进了干扰素γ的产生。该结果提示,可以将本发明的抗B7-H3抗体开发为免疫检查点抑制剂。
实施例6-3:人外周血单核细胞(PBMC)中抗-B7-H3抗体和免疫抗癌治疗剂的共同处理作用的分析
研究了抗B7-H3抗体和免疫抗癌治疗剂的共同处理是否增加了T细胞释放细胞因子(干扰素γ)。通过基于WO2008-156712中公开的序列基因合成和产生Merck公司的派姆单抗(Pembrolizumab)来使用抗PD-1抗体。
具体地,将抗CD3抗体(UCHT1,Biolegend公司)以5μg/ml在PBS中稀释,将B7-H3蛋白添加到制备的抗CD3抗体中。将添加到抗CD3抗体中的制备的B7-H3蛋白以每孔50μl置于96孔细胞培养板(Corning公司)上,并在4℃下反应过夜或在37℃下反应2小时,然后用PBS洗涤一次。
通过以添加含10%FBS(胎牛血清,Invitrogen公司)的RPMI-1640培养液(Invitrogen公司)而连续4倍稀释来制备本发明的抗B7-H3抗体、阴性对照组IgG1(BioXCell公司,BP0297,标记为IgG1或Cont.Ab)和如上制备的抗PD-1抗体。
将通过购买制备的人外周血单核细胞(CTL)悬浮在含10%FBS(胎牛血清)的RPMI1640培养液中,然后将其以每孔1×10
在放有PBMC的板上,添加通过连续4倍稀释制备的抗B7-H3抗体和阴性对照组IgG1(50μl/孔)。然后,以每孔100μl添加含10%FBS的RPMI 1640培养液。
在以单一浓度处理抗B7-H3抗体的情况下,抗体的最终浓度为10μg/ml。在以不同浓度处理抗B7-H3抗体的情况下,从20nM的最高浓度开始的最终浓度,应用连续4倍稀释的浓度。培养后3天,根据分析仪制造商的说明,使用培养上清液用ELISA分析仪(R&D system公司)进行人T细胞的干扰素γ释放量的分析。
图10中描述了结果。作为测量人T细胞的干扰素γ释放量的结果,确认了与每种抗体的单一处理相比,当抗B7-H3抗体与抗PD-1抗体共同处理时,通过强烈激活T细胞,更促进了干扰素γ的产生。
实施例7:在小鼠同基因型肿瘤移植模型中通过共同施用抗B7-H3抗体和抗PD-1抗体的抗癌功效的分析
为了证实在动物模型中抗体的免疫检查点抑制的功效,当抗体在人和小鼠之间具有种内交叉反应性时,可以使用小鼠同基因型肿瘤移植模型。
如实施例3-3和3-6所证实,本发明的抗B7-H3抗体与小鼠B7-H3抗原具有种内交叉反应性。在如下的小鼠同基因型肿瘤模型中,通过将本发明的抗B7-H3抗体与抗小鼠PD-1抗体RMP1-14(BioXCell公司,BE0146)共同处理,确认了本发明的抗B7-H3抗体对肿瘤增殖的抑制作用。
CT26是来源于小鼠(BALB/c)的结肠癌和过表达小鼠B7-H3的细胞系。确认了实施例2中制备的抗B7-H3抗体与实施例3-6中的CT26小鼠癌细胞系表面上表达的小鼠B7-H3结合(图7)。
为了详细地解释实验方法,在解离CT26(BALB/c来源)细胞系并用PBS缓冲液洗涤后,对细胞的数目进行计数并调整为每孔5×10
当肿瘤大小大于2000mm
图11中显示了结果。结果,与抗PD-1(RMP1-14)抗体单独处理的组相比,在共同施用抗PD-1和抗PD-1和抗B7-H3抗体的组中证实了肿瘤增殖抑制作用和存活率提高。结果意味着,当本发明的抗B7-H3抗体显示出免疫检查点抑制功效并且抗PD-1抗体通过作为另一种免疫抑制剂的不同机制激活免疫细胞时,强化了抗癌治疗作用。如实施例3-3中所证实的,本发明的抗B7-H3抗体与小鼠B7-H3的结合能力相比于人B7-H3而言相对较低。尽管与小鼠B7-H3的结合能力低,但是与单一施用抗PD-1抗体相比,本发明的抗B7-H3抗体与抗PD-1抗体在同基因型肿瘤移植模型中共同施用显示出明显的癌症生长抑制功效和存活率的提高。本发明的抗B7-H3抗体由于与人B7-H3的结合更强,预期与在小鼠同基因型肿瘤移植模型中的结果相比,本发明的抗B7-H3抗体对人具有更强的免疫检查点抑制作用。
实施例8:通过在小鼠同基因型肿瘤移植模型中共同施用抗B7-H3抗体和抗PD-1抗体的肿瘤浸润性淋巴细胞(TIL)改变的分析
肿瘤浸润性淋巴细胞(TIL)是指离开血液并向肿瘤移动的白细胞。肿瘤浸润性淋巴细胞可以包括T细胞和B细胞,并且包括单核细胞和多形核免疫细胞,取决于肿瘤的类型和阶段而变化,并且与疾病预后有关。特别地,可以通过分析肿瘤浸润性淋巴细胞来研究免疫抗癌抗体的机制。
为了分析通过共同施用(组合)抗B7-H3抗体(F6V)和抗PD-1抗体(RMP-14-1)的抗癌作用机制,分析了肿瘤浸润性淋巴细胞。通过与实施例8相同的方法进行实验。在完成每种抗体的3次施用之后,从小鼠中分离出肿瘤,以获得肿瘤浸润性淋巴细胞。
将收获的肿瘤浸润性细胞用50ng/ml的PMA和1μM罗奴霉素(lonomycine)重新刺激,并分析免疫细胞的变化(图12)。在抗癌免疫反应中起主要作用的代表性免疫细胞是细胞毒性T细胞和调节性T细胞。作为实验的结果,在从共同施用了本发明的抗B7-H3抗体和抗PD-1抗体的小鼠中分离的肿瘤浸润性淋巴细胞中,清楚地观察到细胞毒性T细胞的激活和调节性T细胞的增殖抑制。
在从共同施用了本发明的抗B7-H3抗体和抗PD-1抗体的小鼠中分离的肿瘤浸润性淋巴细胞中,CD8+ T细胞中IFNγ+颗粒酶B+的水平显著增加,并且观察到CD8+ T细胞中颗粒酶B的释放增加。
在从共同施用了本发明的抗B7-H3抗体和抗PD-1抗体的小鼠中分离的肿瘤浸润性淋巴细胞中,通过使用抗Foxp3抗体(eBioscience公司,FJK-16s)确认了调节性T细胞的频率和细胞数目,并通过使用抗Ki67(BD公司,B56)抗体确认了调节性T细胞的增殖能力。
图12中描述了结果。作为实验结果,确认了在共同施用抗B7-H3抗体和抗PD-1的组中,不仅调节性T细胞的数量减少,而且Ki67+频率显示调节性T细胞的增殖能力降低。这样的结果意味着,抗B7-H3抗体和抗PD-1抗体的共同施用诱导了细胞毒性T细胞的活性的增加,同时调节性T细胞的抑制,从而显示出通过免疫激活的抗癌作用。
前述描述旨在是说明性的,并且本领域技术人员将理解,在不改变技术精神或必要特性的情况下,可以容易地做出改变成为其他具体形式。
- 抗B7-H3抗体及其用途
- 抗B7-H3抗体、其抗原结合片段及其医药用途
