基于AS-PCR检测MYD88 L265P突变的试剂盒及其应用
文献发布时间:2023-06-19 11:05:16
技术领域
本发明涉及基因突变检测技术领域,具体涉及一种基于AS-PCR检测MYD88 L265P突变的试剂盒及其应用。
背景技术
MYD88是Toll样受体和白细胞介素-1受体信号通路的连接分子。MYD88 L265P体细胞突变可导致NF-κB信号通路异常激活,促进细胞增殖、抑制凋亡。MYD88 L265P突变在华氏巨球蛋白血症(Waldenstrom macro-globulinemia,WM)中的发生率高达90%以上,是WM诊断和鉴别诊断的重要标志。MYD88突变状态也是WM的预后因素。有研究表明,MYD88 L265P突变者预后更好。此外,新型小分子抗肿瘤药物伊布替尼是治疗复发难治WM的首选方案,其疗效与MYD88突变状态密切相关。因此,对于MYD88 L265P突变的检测具有十分重要的意义。
MYD88 L265P突变为体细胞突变,仅存在于患者的肿瘤细胞中,而在正常细胞中不存在,因此,需要一个高灵敏度的检测方法,将极为少量的突变型靶序列从大量的野生型背景中富集出来并实现精确检测。现有检测MYD88 L265P的方法主要有一代测序和等位基因特异性PCR(AS-PCR)。一代测序灵敏度有限,且不能定量。2018年NCCN指南明确指出AS-PCR为推荐的检测方法。
目前已有一些利用AS-PCR检测MYD88 L265P突变的报道。例如:专利CN110982898A公开了一种基于ARMS-PCR的MyD88基因L265P突变的检测试剂盒及检测方法,其在特异性引物的3’端人为的引入了一个错配,以提高其特异性,同时控制反应中DNA模板、引物的浓度均在一个较低的水平以保证反应的特异性;该方法能检测到的突变比例的下限为2%。专利CN111593126A公开了一种检测MYD88基因L265P突变的引物和探针及高灵敏度检测方法,其利用AS-PCR荧光法再配合利用筛选得到的引物及探针,提高了检测的特异性和灵敏度,能够检测异常细胞含量低至2.6%的骨髓样本。
上述报道虽然利用AS-PCR实现了MYD88 L265P突变的灵敏检测,但是,随着新药的不断开发和治疗的进步,对于MYD88 L265P突变的检测要求也会越来越高。而现有普通AS-PCR技术的检测灵敏度最高在1%左右。当样本的突变率进一步降低至1%以下时,利用现有AS-PCR体系检测的Ct值会与阴性样本Ct值接近,其体系不稳定,存在一定程度的非特异性扩增,易导致弱阳性样本与阴性样本混淆。因此,如何进一步提高AS-PCR对于MYD88 L265P突变的检测灵敏度是目前本领域的技术难点所在。
发明内容
针对上述现有技术,本发明的目的是提供一种基于AS-PCR检测MYD88 L265P突变的试剂盒及其应用。本发明采用AS-PCR技术,通过优化扩增体系,最大程度地抑制了非特异性扩增,使得检测灵敏度达到75copies/μl,最低可检出0.12%的突变。且操作简便,报告周期短,适用于常规检测。
为实现上述目的,本发明采用如下技术方案:
本发明的第一方面,提供一种检测MYD88 L265P突变的引物-探针组合,包括:检测MYD88 L265P突变型的引物-探针组合A和检测MYD88 L265P野生型的引物-探针组合B;
所述引物-探针组合A包含:SEQ ID NO.1所示的MYD88野生封闭引物、SEQ ID NO.3所示的MYD88突变上游引物、SEQ ID NO.5所示的MYD88下游引物和SEQ ID NO.6所示的MYD88探针;
所述引物-探针组合B包含:SEQ ID NO.2所示的MYD88突变封闭引物、SEQ ID NO.4所示的MYD88野生上游引物、SEQ ID NO.5所示的MYD88下游引物和SEQ ID NO.6所示的MYD88探针。
本发明的第二方面,提供上述引物-探针组合在制备检测MYD88 L265P突变的试剂和/或试剂盒中的用途。
本发明的第三方面,提供一种检测MYD88 L265P突变的试剂盒,所述试剂盒中含有上述的引物-探针组合。
进一步的,所述试剂盒中还包括:SEQ ID NO.7所示的NADPH上游引物、SEQ IDNO.8所示的NADPH下游引物和SEQ ID NO.9所示的NADPH探针。
进一步的,所述试剂盒中还包括:突变质粒标准品和野生质粒标准品;所述突变质粒标准品的核苷酸序列如SEQ ID NO.10所示,所述野生质粒标准品的核苷酸序列如SEQ IDNO.11所示。
优选的,所述试剂盒中,引物-探针组合A、SEQ ID NO.7所示的NADPH上游引物、SEQID NO.8所示的NADPH下游引物和SEQ ID NO.9所示的NADPH探针预先混合于一个PCR反应管内;引物-探针组合B、SEQ ID NO.7所示的NADPH上游引物、SEQ ID NO.8所示的NADPH下游引物和SEQ ID NO.9所示的NADPH探针预先混合于另一个PCR反应管内。
本发明的第四方面,提供上述引物-探针组合或试剂盒在华氏巨球蛋白血症治疗药物的疗效预测中的应用。
本发明的第五方面,提供一种非诊断目的的检测MYD88 L265P突变的方法,包括以下步骤:
以待测样本的DNA为模板,采用上述试剂盒分别构建野生型扩增体系和突变型扩增体系,分别利用野生型扩增体系和突变型扩增体系进行PCR扩增;利用突变质粒标准品定量出待测样本的突变拷贝数,利用野生质粒标准品定量出待测样本的野生拷贝数,计算得到MYD88 L265P突变率。
优选的,所述野生型扩增体系包括:MYD88野生上游引物0.8μL、MYD88下游引物0.8μL、MYD88探针0.4μL、MYD88突变封闭引物0.8μL、NAPDH上游引物0.3μL、NAPDH下游引物0.3μL、NADPH探针0.2μL、AceQ U+Probe Master Mix 12μL、ddH
所述突变型扩增体系包括:MYD88突变上游引物0.8μL、MYD88下游引物0.8μL、MYD88探针0.4μL、MYD88野生封闭引物0.8μL、NAPDH上游引物0.3μL、NAPDH下游引物0.3μL、NADPH探针0.2μL、AceQ U+Probe Master Mix 12μL、ddH
优选的,所述PCR扩增的条件为:95℃10min;95℃30s,62℃1min,35个循环。
本发明的有益效果:
(1)灵敏度高:可检测到低至0.12%的突变。
(2)操作简便,加入模板即可。试剂中包含dUTP/UNG酶防污染体系,且是闭管检测。
(3)可对MYD88 L265P突变率进行定量检测。
附图说明
图1:引物探针比例1:1时的扩增曲线。
图2:引物探针比例1:2时的扩增曲线。
图3:引物探针比例1:4时的扩增曲线。
图4:突变质粒标准品的线性考察。
图5:野生质粒标准品的线性考察。
图6:重复不精密度——29%。
图7:重复不精密度——2%。
图8:检测范围。
图9:最低检出限。
图10:样本线性。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
正如背景技术部分所介绍的,MYD88 L265P突变在华氏巨球蛋白血症(Waldenstrom macro-globulinemia,WM)中的发生率高达90%以上,是WM诊断和鉴别诊断的重要标志。因此,对于MYD88 L265P突变的检测具有十分重要的意义。
基于此,本发明的目的是提供一种定量检测MYD88 L265P突变率的试剂盒。
本发明提供的定量检测MYD88 L265P突变率的试剂盒包括用于制作标准曲线的标准品、MYD88 L265P野生型PCR体系和MYD88 L265P突变型PCR体系。
MYD88 L265P野生型PCR体系包括MYD88野生上游引物、MYD88下游引物、MYD88探针、MYD88突变封闭引物、内参基因的上下游引物和Taqman探针;MYD88突变型PCR体系包括MYD88突变上游引物、MYD88下游引物、MYD88探针、MYD88野生封闭引物、内参基因的上下游引物和Taqman探针。
本发明优选NADPH作为内参,用于监测DNA模板的质量,判断扩增是否顺利进行。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。未注明详细条件的实验方法是按照常规试验方法或按照供应商所建议的操作说明书进行的。
实施例1:扩增体系优化
由于AS-PCR技术特点,在高浓度样本下其非特异性扩增较强,为抑制非特异性扩增,体系中引入了封闭引物和探针。使用不同探针和封闭引物比例(1:1、1:2、1:4,摩尔比),加入MYD88 L265P突变阴性样本进行扩增,发现探针和封闭引物的摩尔比为1:2时,突变体系非特异扩减少,且野生体系扩增不受影响(图1-图3)。
实施例2:构建突变、野生质粒标准品
根据所设计的上下游引物,选取扩增片段和扩增片段上下游约100bp分别构建突变质粒和野生质粒。突变质粒和野生质粒的序列分别如SEQ ID NO.10和SEQ ID NO.11所示。根据质粒质量计算出拷贝数,分别将突变质粒和野生质粒配制为5×10
实施例3:试剂盒组成及使用方法
一、本发明的试剂盒组成成分如下:
表1:试剂盒组分
MYD88 L265P突变预混液和MYD88 L265P野生预混液中各引物探针的序列如下:
表2:引物探针序列
二、使用方法:
1.检测样本
经参比方法测定的20例阴性临床样本,20例阳性临床样本。
2.样本DNA的提取
用全血核酸提取试剂盒(凯杰)进行提取人基因组DNA,通过分光光度计检测核酸浓度和纯度(DNA浓度≥10ng/μl,OD260/OD280比值介于1.8-2.0之间),后将实验用DNA模板稀释至75ng/μl。具体如下:
(1)取足量1.5ml的离心管并做好标记,分别加入20μl Protease(或Protease K)溶液到管底。
(2)混匀样本后,每管加入200μl样本,如样本不足200μl,加入PBS补齐200μl。
(3)加入200μl缓冲液AL,漩涡振荡混匀15s。
(4)56℃温浴10分钟。
(5)短暂离心以将管壁及盖上溶液甩下。
(6)加入200μl乙醇(96~100%)到每管,漩涡振荡15s后短暂离心。
(7)小心将液体转移到QIAamp Mini spin column(放置于2ml收集管中)中。8,000rpm或以上速度离心1min,将QIAamp Mini spin column放置到一干净的2ml的收集管中,弃原管。
(8)加入500μl漂洗液AW1(不能弄湿管的边缘),8,000rpm离心1min,将QIAampMini spin column放置到一干净的2ml的收集管中,弃原管。
(9)加入500μl漂洗液AW2(不能弄湿管的边缘),最高速(13,200rpm)离心3min,将QIAamp Mini spin column放置到一干净的2ml的收集管中,弃原管。
(10)将QIAamp Mini spin column放置于另一新管(需自行提供),最高速(13,200rpm)离心1min。
(11)将QIAamp Mini spin column转入一新的1.5ml的EP管,向吸附膜中央悬空加入50~200μl洗脱缓冲液AE或蒸馏水,室温(15~25℃)放置5分钟,8,000rpm(~13,400×g)离心1min。
(12)使用Nanodrop仪器测得DNA浓度和OD260/OD280比值,并用AE将模板DNA稀释为浓度为75ng/μl。
3.PCR扩增
(1)从试剂盒中取出MYD88 L265P突变预混液、MYD88 L265P野生预混液、突变标准品、野生标准品及阴、阳性质控,室温融化并混匀后,2000rpm离心10s。
(2)所需试剂份数为:n(样本数)+2(质控)+4(标准品),突变预混液与野生预混液各20μl按照表3进行分装。
表3:试剂分装表格
(3)加样:将混合好的标准品、质控品及样本加入分装好的试剂中,每个PCR管加入样本5μl。每个反应体系总体积为25μl,其中,突变型扩增的反应体系如表4所示,野生型扩增的反应体系如表5所示。盖好管盖,2000rpm离心10s,移至扩增区进行扩增。推荐使用仪器为ABI 7500,扩增使用FAM和HEX通道,程序如表6所示。
表4:MYD88突变预混液体系
表5:MYD88野生预混液体系
表6:PCR扩增程序
4.结果判读
(1)确定基线和阈值:
选择荧光曲线波动较小、较稳定的那段作为基线,可自行酌情调整。阈值应设在扩增曲线的拐点并覆盖未扩增曲线的最高点且阴性对照未检出为原则。
(2)有效性判定:
阴性质控在FAM和HEX通道均无扩增或Ct>34;阳性质控FAM通道C
(3)结果阴阳性判定
FAM通道下,所有野生和突变参考品最低浓度的FAM信号C
(4)定量和计算突变率:
使用突变质粒参考品定出样本的突变拷贝数,使用野生质粒参考品定出样本的野生拷贝数。
突变率=样本的突变拷贝数/(样本的突变拷贝数+样本的野生拷贝数)*100%。
实施例4:方法学验证
1.正确度
采用上述试剂盒,选择经过数字PCR MYD88 L265P突变阴性的20例健康体检人群样本,MYD88 L265P突变阳性患者样本20例进行检测,结果如表7所示,两种方法100%一致。
表7:正确度比对
2.精密度验证
(1)重复性不精密度:将突变质粒与阴性临床样本混合,混合方法如表8所示,最终得到MYD88 L265P突变率约为29%和2%的样本,重复测定20次。结果如下表9和表10,以及图6和图7所示,MYD88 L265P突变率为29%和2%两个样本的突变和野生C
表8:样本配制方式
表9:重复不精密度——突变率29%
表10:重复不精密度——突变率2%
(2)中间不精密度:使用上述突变率约为29%和2%的样本。每天检测一次,每个浓度重复5个测试,连续检测4天。结果如下表11和表12所示,在连续4天的测试中,MYD88BL265P突变率为29%和2%样本的突变和野生C
表11:中间不精密度——29%
表12:中间不精密度——2%
2.检测范围与最低检出限
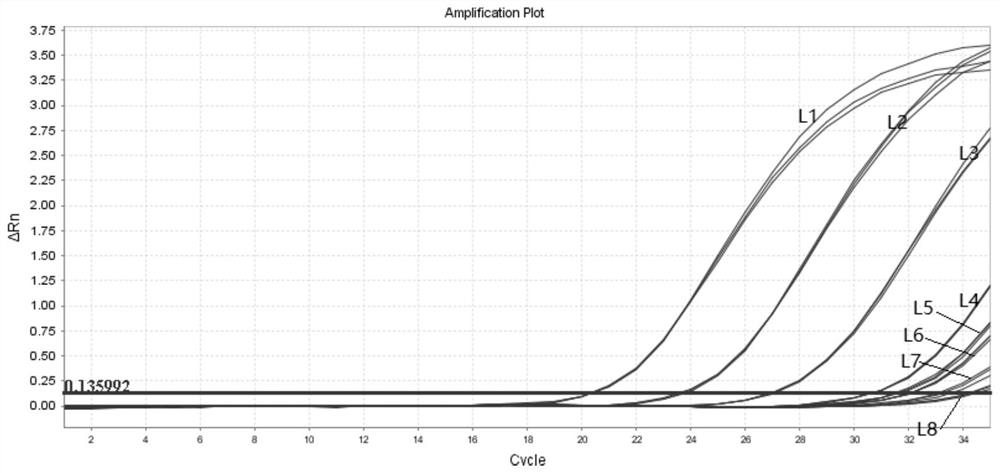
将倍比稀释的突变质粒分别与MYD88 L265P阴性样本按比例混合,得到一系列突变率不同的样本L1-L8,配制方式如表13所示。每个样本重复检测3次,检测结果见表14、图8,L1-L8样本3次检测突变率均可稳定检出,且拷贝数对数值在允许范围内。配制样本,使样本中MYD88 L265P的突变拷贝数终浓度为75copies/μl,突变率为0.12%,重复检测20次。结果如图9,表15所示,20次均能稳定检出。
表13:样本配制方式
表14:检测范围
表15:最低检出限
3.线性
使用检测范围验证中倍比稀释的样本L1-L6,每个样本重复测定3次,以拷贝数对数值的平均值与C
表16:样本线性
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
SEQUENCE LISTING
<110> 济南金域医学检验中心有限公司
<120> 基于AS-PCR检测MYD88 L265P突变的试剂盒及其应用
<130> 2020
<160> 11
<170> PatentIn version 3.5
<210> 1
<211> 24
<212> DNA
<213> 人工序列
<400> 1
ttgccttgta cttgatgggg atta 24
<210> 2
<211> 24
<212> DNA
<213> 人工序列
<400> 2
ttgccttgta cttgatgggg attg 24
<210> 3
<211> 24
<212> DNA
<213> 人工序列
<400> 3
ttgccttgta cttgatgggg attg 24
<210> 4
<211> 24
<212> DNA
<213> 人工序列
<400> 4
ttgccttgta cttgatgggg atta 24
<210> 5
<211> 21
<212> DNA
<213> 人工序列
<400> 5
gggttgaaga ctgggcttgt c 21
<210> 6
<211> 24
<212> DNA
<213> 人工序列
<400> 6
gcatcaggcc cttgccccat ggtg 24
<210> 7
<211> 20
<212> DNA
<213> 人工序列
<400> 7
cccactcctc cacctttgac 20
<210> 8
<211> 18
<212> DNA
<213> 人工序列
<400> 8
ctggccccag ccacatac 18
<210> 9
<211> 29
<212> DNA
<213> 人工序列
<400> 9
cattgccctc aacgaccact ttgtcaagc 29
<210> 10
<211> 360
<212> DNA
<213> 突变质粒
<400> 10
tttgtgtgag tgaatgtgtg ccaggggtac ttagatgggg gatggctgtt gttaaccctg 60
gggttgaaga ctgggcttgt cccaccatgg ggcaagggcc tgatgccagc atggcacccc 120
ttggcttgca ggtgcccatc agaagcgacc gatccccatc aagtacaagg caatgaagaa 180
agagttcccc agcatcctga ggttcatcac tgtctgcgac tacaccaacc cctgcaccaa 240
atcttggttc tggactcgcc ttgccaaggc cttgtccctg ccctgaagac tgttctgagg 300
ccctgggtgt gtgtgtatct gtctgcctgt ccatgtactt ctgccctgcc tcctcctttc 360
<210> 11
<211> 360
<212> DNA
<213> 野生质粒
<400> 11
tttgtgtgag tgaatgtgtg ccaggggtac ttagatgggg gatggctgtt gttaaccctg 60
gggttgaaga ctgggcttgt cccaccatgg ggcaagggcc tgatgccagc atggcacccc 120
ttggcttgca ggtgcccatc agaagcgact gatccccatc aagtacaagg caatgaagaa 180
agagttcccc agcatcctga ggttcatcac tgtctgcgac tacaccaacc cctgcaccaa 240
atcttggttc tggactcgcc ttgccaaggc cttgtccctg ccctgaagac tgttctgagg 300
ccctgggtgt gtgtgtatct gtctgcctgt ccatgtactt ctgccctgcc tcctcctttc 360
- 基于AS-PCR检测MYD88 L265P突变的试剂盒及其应用
- 一种ddPCR检测MYD88基因L265P突变的样本处理方法及检测试剂盒
