一种同时检测OYA病毒、LNV和泰纳病毒的核酸组合物、试剂盒及方法
文献发布时间:2023-06-19 11:34:14
技术领域
本申请涉及体外分子诊断技术领域,更具体地说,它涉及一种同时检测OYA病毒、LNV和泰纳病毒的核酸组合物、试剂盒及方法。
背景技术
近年来,我国从蚊虫标本、人畜标本中分离到多种虫媒病毒,包括OYA病毒、LNV 和泰纳病毒等病毒。由于分离毒株的标本来自于吸血昆虫或患者、病畜的血清等,与人畜关系密切,很可能是我国传染病的新病原,有着重要的流行病学意义。
OYA病毒属于泛布尼亚病毒科,正布尼亚病毒属。布尼亚目病毒为单股负链RNA病毒,基因组由L、M和S三个RNA片段构成,病毒颗粒呈球形,直径大小在80-140nm之间。1943年,第一株布尼亚病毒在乌干达的伊蚊中分离到,此后,大量的布尼亚病毒被相继发现和鉴定。OYA病毒可引起动物疾病。
LNV属于呼肠孤病毒科Seadornavirus属,为十二节段双链RNA无包膜病毒。LNV 首次分离自我国东北地区采集的蚊虫标本,为Seadornavirus属中唯一可以引起哺乳动物细胞系发生病变的重要成员。据文献显示,我国东北地区人群和许多种鼠类中LNV抗体阳性率很高,提示LNV可能是人类及动物的重要病原体。
泰纳病毒(Tahyna virus,TAHV)属布尼亚病毒属(Bunyavirus),是一种蚊媒传播病毒。我国2006年在新疆喀什地区伽师县进行了系统的虫媒病毒调查研究,并且分离了我国第一株泰纳病毒。泰纳病毒感染人类后可引起人类似急性发热流感样疾病,偶尔引起不典型肺炎及脑膜炎。
OYA病毒、LNV和泰纳病毒的分离鉴定,不仅提示我国存在这些病毒,同时由于有了病毒分离株,还可以对病毒分子特征、病毒的分子遗传、我国毒株与国外毒株的分子差异进行研究等,明确分类地位,对我国病毒传染病预防与控制具有重要意义,因此亟需开发出一种能够高效检测上述病毒的检测体系。
发明内容
为了能够高效检测OYA病毒、LNV和泰纳病毒,本申请提供一种同时检测OYA病毒、LNV和泰纳病毒的核酸组合物、试剂盒及方法。
第一方面,本申请提供一种同时检测OYA病毒、LNV和泰纳病毒的核酸组合物,采用如下的技术方案:
一种同时检测OYA病毒、LNV和泰纳病毒的核酸组合物,包括以下引物和探针序列:
OYA病毒正向引物序列SEQ ID No.1;
OYA病毒反向引物序列SEQ ID No.2;
OYA病毒探针序列SEQ ID No.3;
LNV正向引物序列SEQ ID No.4;
LNV反向引物序列SEQ ID No.5;
LNV探针序列SEQ ID No.6;
泰纳病毒正向引物序列SEQ ID No.7;
泰纳病毒反向引物序列SEQ ID No.8;
泰纳病毒探针序列SEQ ID No.9。
通过采用上述技术方案,本申请针对OYA病毒、LNV和泰纳病毒三种病毒设计了三种不同荧光标记的Taq-Man探针以及三对正向引物和反向引物,并筛选出最佳引物探针组合,通过三重荧光定量PCR即能够同时检测OYA病毒、LNV和泰纳病毒,实现多靶标检测,达到高效检测三种病毒的目的,解决了现有的体外诊断试剂盒无法同时检测OYA病毒、LNV和泰纳病毒的问题。
优选的,所述OYA病毒、LNV和泰纳病毒的探针序列的5’端均采用荧光报告基团修饰,3’端均采用荧光淬灭基团修饰。
优选的,所述荧光报告基团包括FAM、HEX、ROX、JOE、CY3、VIC、TET、 TAXAS RED、NED、ALEXA、TAMRA或CY5,所述荧光淬灭基团包括BHQ1、BHQ2、 BHQ3或MGB。
第二方面,本申请提供一种同时检测OYA病毒、LNV和泰纳病毒的试剂盒,采用如下的技术方案:
一种同时检测OYA病毒、LNV和泰纳病毒的试剂盒,包括上述方案中所述的一种同时检测 OYA病毒、LNV和泰纳病毒的核酸组合物。
通过采用上述技术方案,本申请的试剂盒能够对病毒进行扩增,实现病毒的检测。经过测试表明,采用本申请的核酸组合物进行检测OYA病毒、LNV和泰纳病毒,具有灵敏度高、特异性强、重复性好的优点。
优选的,所述试剂盒还包括PCR反应试剂和酶混合液。
第三方面,本申请提供一种同时检测OYA病毒、LNV和泰纳病毒的方法,采用如下的技术方案:
一种同时检测OYA病毒、LNV和泰纳病毒的方法,采用上述方案中所述的一种同时检测 OYA病毒、LNV和泰纳病毒的试剂盒,并采用荧光定量PCR法,包括以下步骤:
S1.提取样本的核酸;
S2.采用试剂盒对样本的核酸进行扩增反应;
S3.根据荧光信号强度判断检测样本的阴阳性。
通过采用上述技术方案,本申请的方法操作方便、快速,结果准确性高,克服了分光光度法只能逐一检测单个样品的缺点,并省略了普通PCR反应后电泳的步骤,为病毒的体外诊断提供了一种简便、快速、有效的技术手段,有助于上述方案中所述的试剂盒很好的在医疗上应用于大规模筛查,为社会创造价值,促进社会进步。
优选的,扩增体系为:
PCR反应试剂 12.5μL;
50pmol/μL OYA病毒正向引物序列SEQ ID No.1 0.2μL;
50pmol/μL OYA病毒反向引物序列SEQ ID No.2 0.2μL;
50pmol/μL OYA病毒探针序列SEQ ID No.3 0.1μL;
50pmol/μL LNV正向引物序列SEQ ID No.4 0.2μL;
50pmol/μL LNV反向引物序列SEQ ID No.5 0.2μL;
50pmol/μL LNV探针序列SEQ ID No.6 0.1μL;
50pmol/μL泰纳病毒正向引物序列SEQ ID No.7 0.2μL;
50pmol/μL泰纳病毒反向引物序列SEQ ID No.8 0.2μL;
50pmol/μL泰纳病毒探针序列SEQ ID No.9 0.1μL;
酶混合液 1μL;
核酸模板 5μL;
ddH
优选的,扩增程序为:
42-50℃,10-30min,1个循环;
93-95℃,5-15min,1个循环;
93-95℃,5-15s;55-60℃,30-60s;40-45个循环。
综上所述,本申请具有以下有益效果:
1、本申请针对OYA病毒、LNV和泰纳病毒三种病毒设计了三种不同荧光标记的Taq-Man 探针以及三对正向引物和反向引物,并筛选出最佳引物探针组合,通过三重荧光定量PCR 即能够同时检测OYA病毒、LNV和泰纳病毒,实现多靶标检测,达到高效检测三种病毒的目的,解决了现有的体外诊断试剂盒无法同时检测OYA病毒、LNV和泰纳病毒的问题。
2、本申请的试剂盒能够对病毒进行扩增,实现病毒的检测。经过测试表明,采用本申请的核酸组合物进行检测OYA病毒、LNV和泰纳病毒,具有灵敏度高、特异性强、重复性好的优点。
3、本申请的方法操作方便、快速,结果准确性高,克服了分光光度法只能逐一检测单个样品的缺点,并省略了普通PCR反应后电泳的步骤,为病毒的体外诊断提供了一种简便、快速、有效的技术手段,有助于上述方案中所述的试剂盒很好的在医疗上应用于大规模筛查,为社会创造价值,促进社会进步。
附图说明
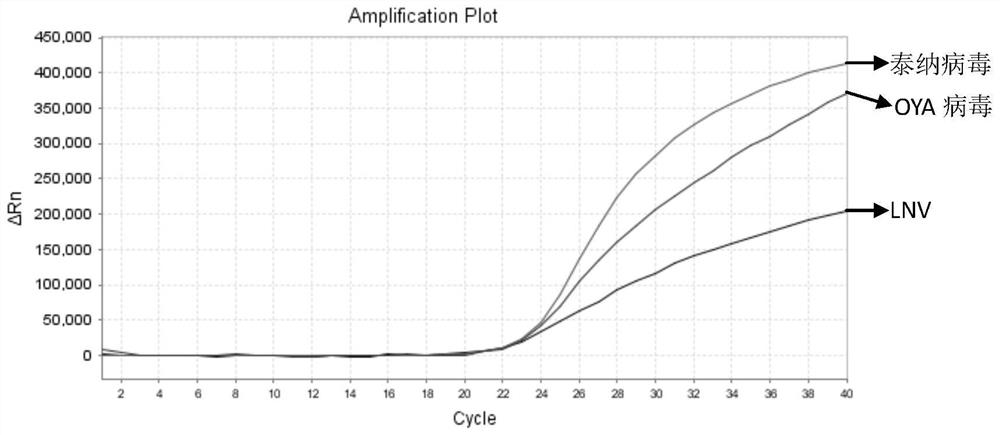
图1是有效性试验中实施例3的OYA病毒、LNV和泰纳病毒的扩增结果图;
图2是有效性试验中对比例1的OYA病毒、LNV和泰纳病毒的扩增结果图;
图3是有效性试验中对比例2的OYA病毒、LNV和泰纳病毒的扩增结果图;
图4是灵敏度试验中OYA病毒的浓度梯度扩增结果图;
图5是灵敏度试验中LNV的浓度梯度扩增结果图;
图6是灵敏度试验中泰纳病毒的浓度梯度扩增结果图;
图7是特异性试验中流感病毒、肠道病毒和黄热病毒的扩增结果图;
图8是精密度试验中OYA病毒10个复孔的扩增结果图;
图9是精密度试验中LNV10个复孔的扩增结果图;
图10是精密度试验中泰纳病毒10个复孔的扩增结果图;
图11是临床试验中OYA病毒、LNV和泰纳病毒阳性对照、阴性对照和阴性样本的扩增结果图;
图12是临床试验中OYA病毒、LNV和泰纳病毒阳性样本的扩增结果图。
具体实施方式
以下结合附图和实施例对本申请作进一步详细说明。
虫媒病毒是指经过蚊虫、蜱等媒介昆虫携带并传播的一组病毒,包括OYA病毒、LNV和泰纳病毒等病毒,其能够引起发热、脑炎、孕畜流产等人畜共患性疾病。OYA病毒、LNV和泰纳病毒的分离鉴定对我国病毒传染病预防与控制具有重要意义。然而,目前没有针对OYA病毒、LNV和泰纳病毒进行同时检测的检测体系。
为了解决该问题,本申请人对OYA病毒、LNV和泰纳病毒在荧光定量PCR上的应用进行了大量研究,以图找到能够同时检测以上三种病毒的方法。结果,本申请人通过设计并筛选出灵敏度高、特异性强的引物和探针序列,就能够一次性检测上述三种病毒,从而成功解决了本申请所要解决的技术问题。
以下实施例中,各引物和探针由生工生物工程(上海)股份有限公司合成;
OYA病毒、LNV和泰纳病毒样本来源于深圳市疾病预防控制中心;
提取试剂盒购自QIAGEN,QIAamp Viral RNA Mini Kit(52906);
PCR反应试剂购自珠海宝锐生物科技有限公司;
酶混合液购自珠海宝锐生物科技有限公司;
荧光定量PCR仪选用ABI-9700。
实施例
实施例1
实施例1公开一种检测OYA病毒、LNV和泰纳病毒的核酸组合物,包括以下引物和探 针序列:
OYA病毒、LNV和泰纳病毒的探针序列的5’端均采用荧光报告基团修饰,3’端均采用荧光淬灭基团修饰。其中:
OYA病毒探针序列的5’端选用FAM,3’端选用BHQ1;
LNV探针序列的5’端选用JOE,3’端选用BHQ1;
泰纳病毒探针序列的5’端选用ROX,3’端选用BHQ1。
应当指出,在其他实施例中OYA病毒、LNV和泰纳病毒的探针序列的5’端还可以采用以下荧光报告基团修饰:HEX、CY3、VIC、TET、TAXAS RED、NED、ALEXA、 TAMRA或CY5,3’端还可以采用以下荧光报告基团修饰:BHQ2、BHQ3或MGB。
实施例2
实施例2公开一种检测OYA病毒、LNV和泰纳病毒的试剂盒,包括实施例1所述的一种检测OYA病毒、LNV和泰纳病毒的核酸组合物,还包括950μL PCR反应试剂和50μL酶混合液。其中,PCR反应试剂包括RT-PCR buffer、dNTP、tris-base、MnCl2和甘油;酶混合液包括6.25μL逆转录酶、12.5μL热启动Taq DNA聚合酶、12.5μL RNA酶抑制剂和 18.75μL酶稀释液。
实施例3
实施例3公开一种同时检测OYA病毒、LNV和泰纳病毒的方法,采用实施例2所述的一种检测OYA病毒、LNV和泰纳病毒的试剂盒,并采用荧光定量PCR法,包括以下步骤:
S1.采用提取试剂盒提取OYA病毒、LNV和泰纳病毒样本的RNA;
S2.采用试剂盒对OYA病毒、LNV和泰纳病毒样本的RNA在荧光定量PCR仪上进行扩增反应;
S3.根据荧光信号强度判断检测样本的阴阳性。
扩增体系为:
扩增程序为:
其中:
实施例4
实施例4公开一种同时检测OYA病毒、LNV和泰纳病毒的方法,与实施例3的不同之处在于,扩增程序为:
实施例5
实施例5公开一种同时检测OYA病毒、LNV和泰纳病毒的方法,与实施例3的不同之处在于,扩增程序为:
对比例
对比例1
对比例1公开一种检测OYA病毒、LNV和泰纳病毒的核酸组合物,与实施例1的不同之处在于,将OYA病毒的正向引物序列SEQ ID No.1替换为SEQ ID No.13:GTGCACTTCCTTGGGCAAGA。
对比例2
对比例2公开一种检测OYA病毒、LNV和泰纳病毒的核酸组合物,与实施例1的不同之处在于,将泰纳病毒的反向引物序列SEQ ID No.8替换为SEQ ID No.14:CCACCGGTGCAAATGGAT。
检测标准
质量控制:试验结果须达到以下要求,否则试验视为无效。
注:以上要求需在同一试验中同时满足,否则本次试验无效。
结果判断
阳性对照和阴性对照均正常的情况下进行结果分析。
阳性:样本检测结果Ct≤35且曲线有明显扩增期,结果测定有效,可直接判断样本为阳性。
阴性:样本检测结果Ct>38,可直接判断样本为阴性。
可疑:样本检测结果35<Ct≤38,需重复一次,若此时Ct值仍≤38,且曲线有明显的扩增期,可判断样本为阳性,否则为阴性。
有效性试验
将浓度均为10
从图1可以看出,实施例3-5均能够扩出三条清晰的基本为S形的曲线(图中仅示出实施例3的扩增曲线),曲线的拐点清楚,基线平而无上扬现象,Ct值基本在22左右,表明实施例3-5的扩增效果正常且优异,试验结果有效。
从图2可以看出,与实施例3-5对比,对比例1中OYA病毒对应的扩增曲线出现延后起跳的现象,Ct值明显增大,表明对比例1的OYA病毒的正向引物序列SEQ ID No.13 对OYA病毒的检测较为不灵敏,检测效果较差。
从图3可以看出,与实施例3-5对比,对比例2中泰纳病毒对应的扩增曲线出现延后起跳的现象,Ct值明显增大,表明对比例2的泰纳病毒的反向引物序列SEQ ID No.14对泰纳病毒的检测较为不灵敏,检测效果较差。
灵敏度试验
将OYA病毒、LNV和泰纳病毒进行10倍梯度稀释,获得三种病毒浓度分别为5×10
从图4-6可以看出,对于不同浓度的三种病毒,其对应的引物和探针均能够扩增得到成型的曲线。如图所示,随着病毒核酸浓度的增大,Ct值减小。本申请的试剂盒的最低检测限为5×10
特异性试验
将与OYA病毒、LNV和泰纳病毒感染部位相同或感染症状相似且常见的其他病原体,包括流感病毒、肠道病毒和黄热病毒的核酸溶液,分别作为模板,采用实施例3的方法进行检测。其中,流感病毒选用FAM通道,肠道病毒选用JOE通道,黄热病毒选用CY5通道。同时,将等体积且浓度均为10
从图7可以看出,在阳性对照和阴性对照均正常的情况下,流感病毒、肠道病毒和黄热病毒均没有出现扩增曲线,代表流感病毒、肠道病毒和黄热病毒的核酸均没有复制,表明本申请的扩增试剂盒具有较强的特异性,其针对OYA病毒、LNV和泰纳病毒感染以外的病毒核酸没有复制能力。
精密度试验
将浓度均为5×10
从图8-10可以看出,以最低检测限的浓度为模板浓度,各通道均能够扩出正常曲线,各曲线的重复性和再现性良好,经过计算,各通道Ct值之间的变异系数均小于5%,表明本申请的试剂盒具有较高的精密度和稳定性,有助于减小人为因素对试验造成的干扰。
临床试验
准备12例临床样品,6例为单一病毒阳性的阳性样本,包括2例OYA病毒样本,2例LNV 样本,2例泰纳病毒样本;6例为三种病毒均为阴性的阴性样本。将各病毒的核酸溶液分别作为模板,采用实施例3的方法进行检测。同时,将等体积且浓度均为10
从图11-12可以看出,6例阳性样本的检测结果均呈相应病毒的单一阳性,分别对应图12中6条起跳的曲线,曲线清晰、平滑,结果容易判断,6例阴性样本的检测结果均呈阴性。可见,检测结果完全准确,表明本申请的试剂盒针对临床样本同样具有很好的检测能力,为本申请试剂盒在临床上的应用提供了有力证据。
本具体实施例仅仅是对本申请的解释,其并不是对本申请的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本申请的权利要求范围内都受到专利法的保护。
- 一种同时检测OYA病毒、LNV和泰纳病毒的核酸组合物、试剂盒及方法
- 一种同时检测辛德毕斯病毒、盖塔病毒和云南环状病毒的核酸组合物、试剂盒及检测方法
