PLK4小分子抑制剂的化合物及其应用
文献发布时间:2023-06-19 11:34:14
技术领域
本发明属于药学和肿瘤诊断治疗领域,具体涉及一类作为Polo样蛋白激酶4(PLK4)抑制剂的化合物筛选以及化合物用于治疗增殖性疾病如癌症如结直肠癌、乳腺癌、卵巢癌和神经胶质瘤等的用途。
背景技术
中心体是一种古老的细胞器,形成中心体,是动物细胞的主要微管组织中心。具有多个中心体是癌细胞的一个常见特征。进入有丝分裂的细胞有两个中心体,催化微管的产生,以组装有丝分裂纺锤体。每个中心体的核心都有一个中心粒,它可以吸收一种蛋白质基质,称为中心粒物质,它可以成核和锚定微管。中心在细胞周期耦合过程中重复,该过程由Polo家族激酶PLK4控制。
PLK4是PLKs家族的重要成员。PLK4是调节中心粒扩增以及有丝分裂的关键因子。在正常增殖的细胞中,PLK4是一种处于低水平表达的丝/苏氨酸蛋白激酶,而在对种肿瘤中,PLK4的活性明显异常。PLK4蛋白的异常表达可能导致中心粒数目及结构的异常,从而导致肿瘤细胞有丝分裂能力的改变。根据已有研究,PLK4在肝癌、卵巢癌、肺癌、乳腺癌、结直肠癌和胶质瘤等多种肿瘤中活性异常,抑制PLK4的活性可以有效的抑制肿瘤细胞的增殖、转移,促进肿瘤细胞的凋亡。
现有技术中PLK4小分子抑制剂并不太多,CFI-400945和Centrinone被开发出来,体内体外实验均已证明其对多种肿瘤具有抑制作用。但是目前依然没有PLK4小分子抑制剂应用于临床,因此,研究开发新的PLK4的小分子抑制剂是亟需解决的问题。
发明内容
为了解决现有技术中仍缺少可用于临床的PLK4抑制剂的药物,本发明的目的在于提供对PLK4具有高抑制性和高抗肿瘤活性的PLK4小分子抑制剂的化合物及其用途。
为了实现上述目的,本发明采用如下技术方案。
一种PLK4小分子抑制剂,所述的抑制剂为具有如下结构通式(I)-(XII)的化合物、其立体异构体、或其药学上可接受的盐、溶剂化物、水合物、多晶型物、共结晶物、互变异构体、同位素标记的衍生物以及前药,
其中:
m代表0、1、2或3;
R1为母核环上的任一位置的任选单或多取代的取代基,R2为母核环上任意碳原子上的取代基,所取代的取代基为选自C1–6烷基、卤素或羟基或羧基或氰基取代的C1–6烷基、卤素或羟基或羧基或氰基取代的C3–6环烷基、C1–6烷氧基、卤素或羟基或羧基或氰基取代的C1–6烷氧基、C2–6烯基、卤素或羟基或羧基或氰基取代的C2–6烯基、硝基、氨基、C1–6烷基取代的氨基、卤素、氰基、磺基、羟基、羧基、苯基、杂环基之一或多个,并且相邻的两个取代基团与连接原子可形成三元、四元、五元或多元环状结构。
优选的,R1、R2任选自氢、甲基、乙基、丙基、异丙基、正丁基、氰基、–COOH、–CONHNHR、–OCH3、–NHCOR、-Br、-Cl、-F、
进一步地,所述结构通式(I)–(XII)的化合物选自下述任意一种:
N~1~-[4-(3,4-二丙氧基苯基)-1,2,5-恶二唑-3-基]-2-甲氧基苯甲酰胺;
4-[3-(2-氯苯基)-1,2,4-恶二唑-5-基]-N-(3-异丙氧基丙基)丁酰胺;
N-(3-{[(5-溴-2-甲氧基苄基)氨基]羰基}苯基)-5-丙基-1,3,4-噻二唑-2-甲酰胺;
N-(3-甲氧基丙基)-2-{2-[4-(丙酰氨基)苯基]乙基}-1H-苯并咪唑-5-甲酰胺;
N-[2-[[3-(3-甲氧基苯基)-[1,2,4]三唑并[4,3-b]哒嗪-6-基]氧基]乙基]-1-苯基甲烷磺酰胺;
1-[3-(3-氟苯基)-[1,2,4]三唑并[4,3-b]哒嗪-6-基]-N-甲基-N-[(3-丙-2-基-1,2,4-恶二唑-5-基)甲基]氮杂环丁胺;
1-[3-(4-甲氧基苯基)异恶唑并[5,4-D]嘧啶-4-基]-N-[3-(4-甲基哌嗪-1-基)丙基]哌啶-4-甲酰胺;
N-(4-氯-2-氟苯基)-3-[3-({[5-(3-甲基苯基)-1,3,4-恶二唑-2-基]硫代}甲基)-1,2,4-恶二唑-5-基]丙胺;
N-甲硫基-3-[3-({[5-(3-甲基苯基)-4H-1,2,4-三唑-3-基]硫代}甲基)-1,2,4-恶二唑-5-基]丙胺;
(2Z)-N-(2-乙氧基苯基)-2-[(4-乙氧基苯基)亚氨基]-5-(羟甲基)-8-甲基-2H-吡喃并[2,3-C]吡啶-3-甲酰胺;
(3-{3-[2-(环丙基甲氧基)乙基]-1,2,4-恶二唑-5-基}-1-氮杂酰基)(1-乙基-1H-吡唑-5-基)甲酮;
4-[6-(3,4-二甲氧基苯基)[1,2,4]三唑并[1,5-A]嘧啶-7-基]四氢-1-吡嗪基(2-萘基)砜;
或其立体异构体、或其药学上可接受的盐、溶剂化物、水合物、多晶型物、共结晶物、互变异构体、同位素标记的衍生物以及前药。
一种药物组合物,所述药物组合物包含至少一种活性组分以及一种或多种药学上可接受的载体或赋形剂,所述的活性组分是结构通式(I)–(XII)的化合物、其立体异构体、或其药学上可接受的盐、溶剂化物、水合物、多晶型物、共结晶物、互变异构体、同位素标记的衍生物以及前药中的任意一种或任意多种。
以上所述的各种化合物、所述化合物在药学上可接受的盐、所述化合物的溶剂合物、所述的药物组合物在制备治疗增殖性疾病的药物中的用途。
进一步地,所述的增殖性疾病包括癌症。
进一步地,所述的癌症包括结直肠癌、乳腺癌、卵巢癌和神经胶质瘤等。
进一步地,所述药物的剂型为任何药物治疗学上可接受的剂型。
进一步地,所述药物的剂量为任何药物治疗学上可接受的剂量。
一种或多种有用的化合物,如具有结构通式(I)-(XII)的化合物的方法,用以以下疾病的治疗:主要包括结直肠癌、乳腺癌、卵巢癌和胶质瘤等,在抑制激酶(如PLK4)方面,在抑制肿瘤细胞生长方面,和/或在抑制转录方面进行了应用验证。
在生物样品或受试者中通过使用根据结构通式(I)-(XII)或化学结构式(Ia)-(Il)的化合物调控肿瘤细胞生物过程,例如:细胞增殖的方法。
本发明所述的“卤素”或“卤代”是指作为取代基的氟、氯、溴或碘。当卤原子作为取代基的时候,其取代的数目为一个以上,包括一个、两个或三个等。
本发明所述的“C1–6烷基”是指含有1-6个碳原子的烷烃上去除一个氢原子衍生的直链或支链的烷基。
本发明所述的“C2–6烯基”是指含有碳碳双键的碳原子数为2–6的直链或支链或环状的烯基。
本发明所述的“C2–6炔基”是指含有碳碳叁键的碳原子数为2–6的直链或支链的炔基。
本发明所述的“C3–6环烷基”是指环上原子全部为碳原子,去除碳原子所连一个氢原子衍生的环状烷基基团。
本发明所述的“C1–6烷氧基”是指“C1–6烷基”通过–O–与其它部分相连接所衍生的基团,C1–6烷基如前文所定义。
本发明所述的“杂环”是指稳定的4-至7-元单环,这些杂环可以是饱和的或不饱和的,并由碳原子和任选自N、O、和S的1至4个杂原子组成,其中的氮和硫杂原子可被选择性地氧化,且氮杂原子可被选择性地季铵化,优选5元和6元杂环,例如呋喃、咪唑、噻唑、噻二唑、吡啶、哌啶、吡嗪、哌嗪等。
通式化合物还可以以其它被保护的形式或衍生物存在,这些形式对本领域技术人员而言是显而易见的,均应包含于本发明的范围内。
本发明提供了药物组合物,这些药物组合物包含具有结构通式(I)—式(XII)和结构式(Ia)-(Il)的化合物,或其药学上可接受的盐、溶剂物、水合物、多晶型物、共结晶物、互变异构体、立体异构体、同位素标记的衍生物或前药,以及任选地药学上可接受的赋形剂或载体。
该药物组合物以本发明的化合物作为活性成份,可根据本领域公知的方法制备。可通过将本发明化合物与一种或多种药学上可接受的固体或液体赋形剂和/或辅料结合,制成适于人或动物使用的任何剂型。
所述药物组合物可以用于治疗增殖性疾病包括癌症,例如:结直肠癌、乳腺癌、卵巢癌和神经胶质瘤等。
本发明化合物或含有它的药物组合物可以单位剂量形式给药,给药途径可为肠道或非肠道,如口服、静脉注射、肌肉注射、皮下注射、鼻腔、口腔粘膜、眼、肺和呼吸道、皮肤、阴道、注射剂等。
本发明化合物可以制成普通制剂,也可制成缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。
为了将本发明化合物制成片剂,可以广泛使用本领域公知的各种赋形剂,包括稀释剂、润湿剂、黏合剂、崩解剂、润滑剂、助流剂。稀释剂可以是淀粉、糊精、蔗糖、葡萄糖、乳糖、甘露醇、山梨醇、木糖醇、微晶纤维素、硫酸钙、磷酸氢钙、碳酸钙等;湿润剂可以是水、乙醇、异丙醇等;黏合剂可以是淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、微晶纤维素、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙基纤维素、丙烯酸树脂、卡波姆、聚乙烯吡咯烷酮、聚乙二醇等;崩解剂可以是干淀粉、微晶纤维素、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮、交联羧甲基纤维素钠、羧甲基淀粉钠、碳酸氢钠与枸橼酸、聚氧乙烯山梨糖醇脂肪酸酯、十二烷基磺酸钠等;润滑剂和助流剂可以是滑石粉、二氧化硅、硬脂酸盐、酒石酸、液体石蜡、聚乙二醇等。还可以将片剂进一步制成包衣片,例如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。
为了将本发明化合物制成胶囊剂,可以将有效成分本发明化合物与稀释剂、助流剂混合,将混合物直接置于硬胶囊或软胶囊中。也可将有效成分本发明化合物先与稀释剂、黏合剂、崩解剂制成颗粒或微丸,再置于硬胶囊或软胶囊中。用于制备本发明化合物片剂的各稀释剂、润湿剂、黏合剂、崩解剂、助流剂品种也可用于制备本发明化合物的胶囊剂。
为了将本发明化合物制成注射剂,可以用水、乙醇、异丙醇、丙二醇或它们的混合物作溶剂并加入适量本领域常用的增溶剂、助溶剂、pH调剂剂、渗透压调节剂。增溶剂或助溶剂可以是泊洛沙姆、卵磷脂、羟丙基-β-环糊精等;pH调剂剂可以是磷酸盐、醋酸盐、盐酸、氢氧化钠等;渗透压调节剂可以是氯化钠、甘露醇、葡萄糖、磷酸盐、醋酸盐等。如制备冻干粉针剂,还可加入甘露醇、葡萄糖等作为支撑剂。
此外,如需要,也可以向药物制剂中添加着色剂、防腐剂、香料、矫味剂或其它添加剂。
为达到用药目的,增强治疗效果,本发明的药物或药物组合物可用任何公知的给药方法给药。
本发明的化合物或组合物可单独服用,或与其他治疗药物或对症药物合并使用。当本发明的化合物与其它治疗药物存在协同作用时,应根据实际情况调整它的剂量。
本发明所使用的术语“前药”,代表一个化合物在体内转化为结构通式(I)-式(XII)或结构式(Ia)-(Il)所示的化合物。这样的转化受前体药物在血液中水解或在血液或组织中经酶转化为母体结构的影响。
本发明所用的术语“药学上可接受的盐”指的是那些在合理的医学判断的范围内适用于与人类和低等动物的组织接触而没有不适当的毒性、刺激性、过敏反应等并且与合理的效益/风险比相称的盐。药学上可接受的盐是本领域公知的。本发明的化合物的药学上可接受的盐包括由合适的无机和有机酸和碱所产生的那些。药学上可接受的无毒酸加成盐的实例是与无机酸,如盐酸、氢溴酸、磷酸、硫酸以及高氯酸,或与有机酸,如乙酸、草酸、顺丁烯二酸、酒石酸、柠檬酸、丁二酸或丙二酸,或通过使用本领域已知的其它方法(如离子交换法)形成的氨基盐。其它药学上可接受的盐包括己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、反丁烯二酸盐、葡庚糖酸盐、甘油磷酸盐、葡萄糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖醛酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、顺丁烯二酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、特戊酸盐、丙酸盐、硬脂酸盐、丁二酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一烷酸盐、戊酸盐等。由适当的碱产生的盐包括碱金属盐、碱土金属盐、铵盐以及N+(C1-4烷基)4-盐。代表性的碱金属盐或碱土金属盐包括钠盐、锂盐、钾盐、钙盐、镁盐等。在适当时,另外的药学上可接受的盐包括使用诸如卤离子、氢氧根、羧酸根、硫酸根、磷酸根、硝酸根、低级烷基磺酸根以及芳基磺酸根之类的抗衡离子形成的无毒铵、季铵以及胺阳离子。
本发明的“溶剂化物”是指一个或多个溶剂分子与本发明的化合物所形成的缔合物。常规的溶剂包括水、甲醇、乙醇、乙酸、DMSO、THF、乙醚等。
术语“水合物”是指溶剂分子是水所形成的缔合物。当所述溶剂为水时,可以使用术语“水合物”。通常,化合物的水合物中所含的水分子的数目与水合物中化合物分子的数目呈确定的比率。给定的化合物可以形成超过一种类型的水合物,包括例如一水合物、低水合物(例如半水合物)以及多水合物。应注意,本发明所述的水合物保留有非水合形式的所述化合物的生物有效性。
术语“立体异构体”指化合物的原子在空间中的排列方面有所不同的异构体。异构体指具有相同的分子式,但是在它们的原子键合的性质或序列或它们的原子在空间中的排列方面有所不同的化合物。
术语“互变异构体”指的是如下的化合物,所述化合物是特定的化合物结构的可互换形式,并且不同之处在于氢原子和电子的转移。因此,两种结构可以经由π电子和原子(通常是H)的移动而保持平衡。互变异构形式可能与所关注的化合物达到最佳的化学反应性和生物活性有关。
术语“治疗”在其中一些实施例中指改善疾病或病症(即减缓或阻止或减轻疾病或其至少一种临床症状的发展)。在另一些实施例中,“治疗”指缓和或改善至少一种身体参数,包括可能不为患者所察觉的身体参数。在另一些实施例中,“治疗”指从身体上(例如稳定可察觉的症状)或生理学上(例如稳定身体的参数)或上述两方面调节疾病或病症。在另一些实施例中,“治疗”指预防或延迟疾病或病症的发作、发生或恶化。
与现有技术相比,本发明具有以下有益效果。
本发明通过构建双重药效团及对接模型,以多层虚拟筛选方式得到的小分子化合物抑制剂,主要通过展开其对肿瘤细胞生长抑制的实验验证其具有良好的抑制肿瘤细胞的增殖能力。该类小分子抑制剂有可能作为治疗增殖性疾病包括癌症(例如结直肠癌、乳腺癌、卵巢癌和神经胶质瘤等)的新型药物。
本发明提供的小分子抑制剂抗癌谱较广,对多种癌症细胞如结直肠癌、乳腺癌、卵巢癌和神经胶质瘤等具有良好的生长抑制作用。
本发明提供的小分子抑制剂的化合物在结构和作用机制上,为预防或治疗增殖性疾病特别是癌症方面提供了有效的药物,具有较良好的应用前景。
附图说明
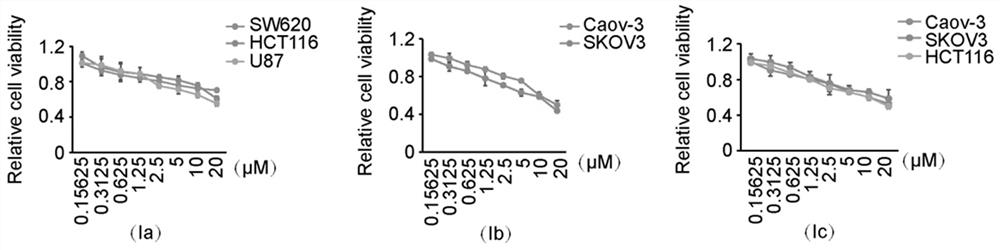
图1是本发明中结构式为(Ia)-(Ic)的PLK4小分子抑制剂的化合物抑制多种肿瘤细胞如结直肠癌、乳腺癌、卵巢癌和神经胶质瘤细胞增殖变化的情况。
图2是本发明中结构式为(Id)-(If)的PLK4小分子抑制剂的化合物抑制多种肿瘤细胞如结直肠癌、乳腺癌、卵巢癌和神经胶质瘤细胞增殖变化的情况。
图3是本发明中结构式为(Ig)-(Ii)的PLK4小分子抑制剂的化合物抑制多种肿瘤细胞如结直肠癌、乳腺癌、卵巢癌和神经胶质瘤细胞增殖变化的情况。
图4是本发明中结构式为(Ij)-(Il)的PLK4小分子抑制剂的化合物抑制多种肿瘤细胞如结直肠癌、乳腺癌、卵巢癌和神经胶质瘤细胞增殖变化的情况。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。以下代表性实施例是通过其具体实施方式进一步更好阐述本发明,而非本发明的保护范围受限于以下实施例。凡基于以上所述本发明的内容而实现的技术与实验,均属于本发明保护的范围。以下实施例所使用的材料无特殊说明均为商购获得。
实施例1PLK4抑制剂的筛选与结构。
1.药效团的构建和PLK4小分子抑制剂的初步筛选。
应用计算机辅助药物设计的方法通过多层虚拟筛选得到与靶蛋白具有高亲和性和结合稳定性的PLK4抑制剂。利用分子模拟药物设计软件MOE构建药效团筛选与分子对接。从来源于ChemDiv,Life Chemicals数据库中2041920个无已知报道具有PLK4抑制活性的小分子化合物中筛选的到12个优势结构进行实验验证,得到本发明的PLK4抑制剂。
通过Protein Data Bank(PDB)数据库,搜索得到PLK4抑制剂阳性药与PLK4蛋白结合的结构“4YUR”。根据阳性药与PLK4蛋白的结合位点设置药效团,根据受体配体结合口袋设置排除体积半径为
2.分子对接得到优势构象的PLK4抑制剂化合物。
利利用MOE软件中Dock对4320个高度匹配的化合物与PLK4蛋白质的三级结构进行分子对接,选择其中打分值较高(S<-8)的78个化合物,去掉具有基因毒性和脂水分配系数大于5的小分子,按照其结构相似性进行分类,得到12类化合物,选择每一类中打分值最高的化合物,最终筛选得到与PLK4蛋白具有较好亲和力的优势构象,作为潜在PLK4小分子抑制剂,该PLK4小分子抑制剂的结构式见表1。
表1.PLK4小分子抑制剂的结构式。
实施例2PLK4小分子抑制剂化合物的抗肿瘤活性研究。
1.实验材料。
1.1细胞与试剂。
人乳腺癌细胞系SKBR3、MCF-7、T47D、BT549;人结直肠癌细胞系HCT116、SW620、HT29、SW480、RKO,LoVo;人卵巢癌细胞系SKOV3、Caov-3;人神经胶质瘤细胞系U87、U251。DMEM培养基、L-15培养基、1640培养基、McCOY's5A培养基、DMEM/F12培养基、胰酶、胎牛血清(FBS)、二甲基亚砜(DMSO)、MTT(噻唑蓝)。
2.实验方法与结论。
2.1细胞培养。
将细胞从-80℃深度冰箱或者液氮储存罐中取出,迅速将其置于37℃水浴锅中融化后将细胞移至2mL离心管中,以1200rmp的转速离心5min后,弃掉包含冻存液的上清,加入含有10%胎牛血清的1mL相应的培养基完全重悬细胞,将细胞悬液转移至25cm2培养瓶中,补加入4ml含有10%胎牛血清的完全培养基,放置在37℃、5%CO
2.2MTT法检测细胞增殖。
将状态良好的细胞消化后离心,配置成100μL的细胞悬液,重悬后计数接种于96孔板中。将培养板在培养箱预培养24h(37℃,5%CO
3.实验结果及结论。
结构式(Ia)-式(Il)的化合物具有抗肿瘤活性,MTT增殖结果如图1-4所示,结构式(a)-式(l)的化合物对多种肿瘤细胞的增殖具有明显的抑制作用。从以上实验可以看出,本发明提供的PLK4小分子抑制剂的化合物对多种肿瘤细胞均表现出了良好的增殖抑制作用,非常有希望成为新型的肿瘤治疗药物。
- PLK4小分子抑制剂的化合物及其应用
- 化合物在制备小分子抑制剂或治疗癌症的药物中的应用及小分子抑制剂和治疗癌症的药物
