一种脱细胞基质支架的制备方法及通过该方法获得的脱细胞基质支架
文献发布时间:2023-06-19 11:49:09
技术领域
本发明涉及一种脱细胞基质支架的制备方法及通过该方法获得的脱细胞基质支架,属于生物材料技术领域。
背景技术
软骨组织是由胶原组织、少许细胞、以及60-80%的水份等成份所构成,成人的软骨组织中并没有血管或神经,因此软骨组织受伤后自行修补的能力有限。
软骨组织工程的出现使人类可以通过人工手段在体内外建造出透明软骨,为关节软骨缺损的修复提供了一条颇具前途的方法。关节软骨损伤修复方式有通过一些天然材料和合成材料制备成各种支架而用于软骨组织修复中,但是天然材料的生物力学强度低,合成材料生物相容性差。进一步地,更偏向于使用异种脱细胞基质支架,其制备主要是利用化学法进行脱细胞后再成型,但该方法脱细胞效果一般、且对胶原提取程度不高、制备的支架对于软骨分化、维持其结构和透明软骨表型稳定的微环境方面仍表现欠缺。
发明内容
为了克服现有技术的不足,本发明的第一个目的在于提供一种脱细胞基质支架的制备方法,该方法以紫外交联结合EDC和NHS的混合溶液的双交联方式,配合冻干工艺,提高了支架表面孔隙的均匀和致密性,能提升细胞在材料表面的附着、生长情况。
本发明的第二个目的在于提供通过上述制备方法所获得的脱细胞基质支架,脱细胞基质支架具有良好的空间仿生结构,能够很好地促进细胞生长。
实现本发明的第一个目的可以通过采取如下技术方案达到:一种脱细胞基质支架的制备方法,包括:
交联步骤:将经脱细胞处理的天然软骨基质注入模具中冷冻干燥后进行紫外交联4-8h,然后加入EDC和NHS的混合溶液再进行交联20-24h,清洗并冷冻干燥、灭菌,得到脱细胞基质支架。
进一步地,交联步骤中,两次冷冻干燥的条件均为温度-60℃,时间24-48h。
进一步地,交联步骤中,EDC和NHS的混合溶液以95vt%乙醇溶液作为溶剂,EDC和NHS的浓度为2mol/L。
进一步地,交联步骤中,灭菌为以钴60进行辐照灭菌。
进一步地,交联步骤前还包括脱细胞步骤:
将天然关节软骨粉碎,加入HCl溶液并在温度为4-26℃的条件下震荡混匀后取沉淀,将沉淀清洗;在沉淀中加入蛋白酶溶液,温度为4-26℃的条件下搅拌96-120h,然后加入NaOH溶液调节至中性,离心取上清;在上清中加入NaCl溶液,进行差速离心,每一次离心后除去部分上清液,最后一次离心后除去全部上清液,取沉淀物;将沉淀物进行透析,得到经脱细胞处理的天然软骨基质。
进一步地,脱细胞步骤中,HCl溶液的浓度为2-4mol/L;震荡混匀的时间为24-48h;蛋白酶溶液的浓度为1-3g/L;NaOH溶液的浓度为1mol/L;NaCl溶液的浓度为1-4mol/L。
进一步地,脱细胞步骤中,差速离心为第一次离心的转速为2000-3000r/min,离心后除去50%上清液;第二次离心的转速为4000-5000r/min,离心后除去50%上清液;第三次离心的转速为6000-7000r/min,离心后除去50%上清液;第四次离心的转速为9000-12000r/min,离心后除去全部上清液。
进一步地,脱细胞步骤中,透析为将沉淀物装入截留分子量8000-14000d的透析袋中进行透析,放入20-30倍的注射用水透析48-96h,每12-24h更换一次水,得到经脱细胞处理的天然软骨基质。
实现本发明的第二个目的可以通过采取如下技术方案达到:一种脱细胞基质支架,脱细胞基质支架通过如上所述的制备方法得到。
进一步地,脱细胞基质支架为圆形或多边形;支架为多孔结构,孔径30-300μm,最大厚度为2-3mm。
相比现有技术,本发明的有益效果在于:
1、本发明的制备方法通过紫外交联结合EDC和NHS的混合溶液的双交联方式,配合冻干工艺,提高了支架表面孔隙的均匀和致密性,具有良好的空间仿生结构,细胞相容性好,能提升细胞在材料表面的附着、生长情况;
2、本发明的制备方法对于单纯的紫外交联,避免了支架材料外观过于偏黄,物理性能较脆的问题,同时也解决了紫外交联对材料内部交联不彻底的问题,提升了支架的整体性能;
3、本发明的制备方法生产效率高,产量高,对胶原结构伤害小,胶原总量的保留量得到了提高;
4、通过本发明制备方法得到的脱细胞基质支架具有良好的空间仿生结构,能够很好地促进细胞生长。
附图说明
图1为对比例1基质半成品表面电镜图放大50倍;
图2为对比例1紫外交联后的基质支架表面电镜图放大50倍;
图3为对比例1基质半成品截面图放大50倍;
图4为对比例1紫外交联后的基质支架截面图放大50倍;
图5为对比例2活细胞染色视图;
图6为对比例2死细胞染色视图;
图7-8为实施例1脱细胞基质支架成品视图;
图9为实施例1基质支架表面电镜图放大50倍;
图10为实施例1基质支架表面电镜图放大100倍;
图11为实施例1基质支架截面图放大20倍;
图12为实施例2脱细胞基质支架成品视图;
图13为实施例2基质支架表面电镜图放大100倍;
图14为实施例2基质支架截面图放大50倍;
图15为实施例3脱细胞基质支架成品视图;
图16为实施例3基质支架表面电镜图放大50倍;
图17为实施例3基质支架截面图放大50倍;
图18为实施例1-3的圆二色光谱图谱;
图19为DNA含量检测图;
图20为实施例1培养活细胞染色视图;
图21为实施例1培养死细胞染色视图;
图22为实施例2培养活细胞染色视图;
图23为实施例2培养死细胞染色视图;
图24为实施例3培养活细胞染色视图;
图25为实施例3培养死细胞染色视图;
图26为阴性细胞放大100倍视图;
图27为阳性细胞放大100倍视图;
图28-30为实施例1-3培养细胞视图。
具体实施方式
下面,结合附图以及具体实施方式,对本发明做进一步描述:
一种脱细胞基质支架的制备方法,包括:
脱细胞步骤:将新鲜天然关节软骨清洗后粉碎,加入2-4mol/L HCl溶液并在温度为4-26℃的条件下震荡混匀24-48h后取沉淀,将沉淀用注射用水清洗;在沉淀中加入1-3g/L蛋白酶溶液,温度为4-26℃的条件下搅拌96-120h,然后加入1mol/L NaOH溶液调节至中性,1000-2000r/min离心取上清,该浓度的NaOH溶液有利于对胶原的保留,避免高浓度NaOH溶液对胶原的侵蚀作用;在上清中加入1-4mol/L NaCl溶液,该浓度下的NaCl溶液其盐析效率最高,盐浓度过高会导致局部盐析效果差,胶原变性等问题;进行差速离心,差速离心为第一次离心的转速为2000-3000r/min,离心后除去50%上清液;第二次离心的转速为4000-5000r/min,离心后除去50%上清液;第三次离心的转速为6000-7000r/min,离心后除去50%上清液;第四次离心的转速为9000-12000r/min,离心后除去全部上清液,取沉淀物;将沉淀物进行透析,透析为将沉淀物装入截留分子量8000-14000d的透析袋中进行透析,放入20-30倍的注射用水透析48-96h,每12-24h更换一次水,得到经脱细胞处理的天然软骨基质;
通过脱细胞步骤,大大提高了胶原的提取度,缩短了生产时间,胶原纯度高;
交联步骤:将经脱细胞处理的天然软骨基质用注射用水稀释后注入模具中,在温度-60℃,时间24-48h的条件下冷冻干燥后进行紫外交联4-8h,然后加入EDC和NHS的混合溶液再进行交联20-24h,交联时间控制在20-24h能够避免交联过度导致的孔隙封闭情况;清洗并在温度-60℃,时间24-48h的条件下冷冻干燥、以钴60进行辐照灭菌,得到脱细胞基质支架。
其中,天然关节软骨为哺乳类动物关节软骨,优选为猪关节软骨。
其中,EDC和NHS的混合溶液以95vt%乙醇溶液作为溶剂,EDC和NHS的浓度为2mol/L,该浓度下配合紫外交联,得到的材料性能适中,在保证了物理性能的情况下具有较好的孔隙;
通过上述方法得到的脱细胞基质支架为圆形或多边形;支架为多孔结构,孔径30-300μm,最大厚度为2-3mm,DNA残留量小于100ng/mg,无细胞毒性,细胞外基质主要成分二型胶原结构保留完整。
本申请紫外交联结合EDC和NHS的混合溶液的双交联方式能够改善的孔隙不均匀问题,其中紫外交联确保了材料的基本物理性能,弥补了低剂量EDC和NHS的混合溶液化学交联无法提供足够物理性能的缺陷,低剂量EDC和NHS的混合溶液弥补了紫外交联无法作用于内部的缺点,确保了基质支架内部能够得到纵横交错的孔隙结构,同时不会降低材料本身的生物相容性;总的来说,联用这两项交联方式,能够在降低了这两项交联方式的剂量的同时,保证交联的质量。
对比例1:
常规的基质支架只进行一次紫外交联,若使用的剂量过大,则存在烧蚀胶原纤维上绝大多数酸性或碱性侧链,可能导致促炎肽释放引发炎症和潜在胶原变性,材料会偏黄且变脆;而高剂量的EDC和NHS的混合溶液进行交联虽然能够做到不使胶原变性,带来较好的物理性能,但是由于化学交联对胶原的基团产生影响,而也会降低细胞在材料表面的附着。
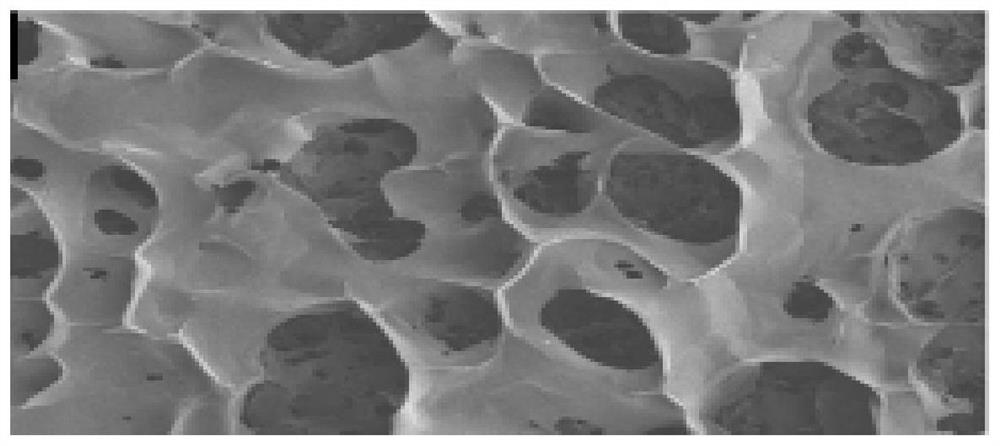
图1为经模具冷冻干燥后的基质半成品表面电镜图放大50倍,图2为只进行一次紫外交联后的基质支架表面电镜图放大50倍,图中可得知在经过紫外交联后,有构成不均匀的孔隙结构;图3为经模具冷冻干燥后的基质半成品截面图放大50倍,图4为只进行一次紫外交联后的基质支架截面图放大50倍,图3-4可以看出基质支架的中间部分并没有得到很好地交联,这是由于基质支架较厚,紫外交联仅仅影响了表面,对于内部结构,紫外交联无法很好地作用。
对比例2:
单一EDC和NHS的混合溶液交联48h后,在基质支架表面种植细胞72h后进行细胞活死染色观察,其中绿色为活细胞染色,红色死细胞染色,从图5-6可以得知对比例2处理的基质支架表面几乎没有活细胞存在,大部分细胞均已经死亡,从而得知仅使用EDC和NHS的混合溶液的交联,会导致材料的生物相容性下降。
实施例1:
一种脱细胞基质支架的制备方法,包括:
脱细胞步骤:将新鲜猪关节软骨清洗后粉碎,加入3mol/L HCl溶液并在温度为5℃的条件下震荡混匀25h后取沉淀,将沉淀用注射用水清洗;在沉淀中加入2g/L蛋白酶溶液,温度为5℃的条件下搅拌97h,然后加入1mol/L NaOH溶液调节至中性,1500r/min离心取上清;在上清中加入2mol/L NaCl溶液;进行差速离心,差速离心为第一次离心的转速为2500r/min,离心后除去50%上清液;第二次离心的转速为4500r/min,离心后除去50%上清液;第三次离心的转速为6500r/min,离心后除去50%上清液;第四次离心的转速为9500r/min,离心后除去全部上清液,取沉淀物;将沉淀物进行透析,透析为将沉淀物装入截留分子量8500d的透析袋中进行透析,放入25倍的注射用水透析90h,每12h更换一次水,得到经脱细胞处理的天然软骨基质;
交联步骤:将经脱细胞处理的天然软骨基质用注射用水稀释后注入模具中,在温度-60℃,时间40h的条件下冷冻干燥后进行紫外交联8h(正反面各进行紫外交联4h),然后加入EDC和NHS的混合溶液再进行交联20h(正反面各进行交联10h);清洗并在温度-60℃,时间40h的条件下冷冻干燥、以钴60进行辐照灭菌,得到脱细胞基质支架。
经实施例1得到的脱细胞基质支架如图7-8所示可制备为方形、圆形,图中可以看出其色泽较白,没有发黄现象;图9-10分别为基质支架表面电镜图放大50倍、100倍;图11为基质支架截面图放大20倍,基质支架的孔隙分布及孔径均匀。
实施例2:
一种脱细胞基质支架的制备方法,包括:
脱细胞步骤:将新鲜猪关节软骨清洗后粉碎,加入3mol/L HCl溶液并在温度为15℃的条件下震荡混匀25h后取沉淀,将沉淀用注射用水清洗;在沉淀中加入2g/L蛋白酶溶液,温度为15℃的条件下搅拌96-120h,然后加入1mol/L NaOH溶液调节至中性,1950r/min离心取上清;在上清中加入2mol/L NaCl溶液;进行差速离心,差速离心为第一次离心的转速为2950r/min,离心后除去50%上清液;第二次离心的转速为4950r/min,离心后除去50%上清液;第三次离心的转速为6950r/min,离心后除去50%上清液;第四次离心的转速为10000r/min,离心后除去全部上清液,取沉淀物;将沉淀物进行透析,透析为将沉淀物装入截留分子量8500d的透析袋中进行透析,放入20-30倍的注射用水透析48h,每12-24h更换一次水,得到经脱细胞处理的天然软骨基质;
交联步骤:将经脱细胞处理的天然软骨基质用注射用水稀释后注入模具中,在温度-60℃,时间45h的条件下冷冻干燥后进行紫外交联8h(正反面各进行紫外交联4h),然后加入EDC和NHS的混合溶液再进行交联22h(正反面各进行交联11h);清洗并在温度-60℃,时间30h的条件下冷冻干燥、以钴60进行辐照灭菌,得到脱细胞基质支架。
经实施例2得到的脱细胞基质支架如图12所示,图中可以看出其色泽较白,没有发黄现象;图13为基质支架表面电镜图放大100倍;图14为基质支架截面图放大50倍,基质支架的孔隙分布及孔径均匀。
实施例3:
一种脱细胞基质支架的制备方法,包括:
脱细胞步骤:将新鲜猪关节软骨清洗后粉碎,加入3mol/L HCl溶液并在25℃的条件下震荡混匀46h后取沉淀,将沉淀用注射用水清洗;在沉淀中加入2g/L蛋白酶溶液,25℃的条件下搅拌115h,然后加入1mol/L NaOH溶液调节至中性,1950r/min离心取上清;在上清中加入2mol/L NaCl溶液;进行差速离心,差速离心为第一次离心的转速为2050r/min,离心后除去50%上清液;第二次离心的转速为4950r/min,离心后除去50%上清液;第三次离心的转速为6950r/min,离心后除去50%上清液;第四次离心的转速为11500r/min,离心后除去全部上清液,取沉淀物;将沉淀物进行透析,透析为将沉淀物装入截留分子量13000d的透析袋中进行透析,放入20-30倍的注射用水透析95h,每24h更换一次水,得到经脱细胞处理的天然软骨基质;
交联步骤:将经脱细胞处理的天然软骨基质用注射用水稀释后注入模具中,在温度-60℃,时间46h的条件下冷冻干燥后进行紫外交联8h(正反面各进行紫外交联4h),然后加入EDC和NHS的混合溶液再进行交联22h(正反面各进行交联11h);清洗并在温度-60℃,时间48h的条件下冷冻干燥、以钴60进行辐照灭菌,得到脱细胞基质支架。
经实施例3得到的脱细胞基质支架如图15所示,图中可以看出其色泽较白,没有发黄现象;图16为基质支架表面电镜图放大50倍;图17为基质支架截面图放大50倍,基质支架的孔隙分布及孔径均匀。
实施例1-3显示出同样的圆二色光谱结果,如图18所示,圆二色谱图显示基质支架中二型胶原的二级结构保留完整,从而说明实施例1-3对二型胶原没有影响。
图19为原材料与实施例1-3的基质支架DNA含量检测图,实施例1-3均很好地去除了原材料中的DNA。(**表示P<0.01)
将细胞分别在实施例1-3的基质支架上培养72h后进行染色,其中绿色为活细胞染色,红色死细胞染色;图20-21为实施例1上培养的细胞染色,图22-23为实施例2上培养的细胞染色,图24-25为实施例3上培养的细胞染色;细胞在材料上形态均呈现正常生长繁殖的梭形或椭圆形,少有死细胞。
将实施例1-3的基质支架采用完全培养基按3cm
对于本领域的技术人员来说,可根据以上描述的技术方案以及构思,做出其它各种相应的改变以及变形,而所有的这些改变以及变形都应该属于本发明权利要求的保护范围之内。
- 一种脱细胞基质支架的制备方法及通过该方法获得的脱细胞基质支架
- 一种3D打印脱细胞基质预防外耳道狭窄支架及制备方法
