1,2-二氢吡啶化合物的水基药物制剂
文献发布时间:2023-06-19 12:07:15
相关申请的交换引用
本申请要求2018年12月14日提交的美国临时专利申请号62/779,620的权益。该申请通过援引并入,如同在本文完整重写一样。
背景技术
本文描述了可用作非NMDA受体、尤其是AMPA受体的抑制剂的吡啶酮化合物的水基药物制剂。
谷氨酸和天冬氨酸是神经功能中的重要氨基酸。这些神经功能包括认识、记忆、运动、呼吸、心血管调节和感觉。谷氨酸和天冬氨酸由于其能够增加靶细胞在受体结合后激发动作电位的可能性而常常被称为兴奋性神经递质。已知两种类型的受体:离子通道型和G蛋白偶联型。前者进一步分类为N-甲基-D-天冬氨酸(NMDA)受体、α-氨基-3-羟基-5-甲基-4-异噁唑丙酸(AMPA)受体、红藻氨酸受体和其他受体。
已知兴奋性神经递质通过例如中枢神经的异常兴奋来诱导神经毒性,该过程称为兴奋性中毒。已经注意到,兴奋性中毒常常与由各种神经疾病引起的神经细胞死亡有关。这些神经疾病包括脑缺血、颅脑损伤、脊髓损伤、阿尔茨海默氏病(Alzheimer's disease)、帕金森氏病(Parkinson's disease)、肌萎缩性侧索硬化症(ALS)、亨廷顿舞蹈病(Huntington's chorea)、AIDS神经障碍、癫痫、缺氧状态后观察到的神经退行性变、精神病、运动性失调、疼痛、强直、食物中毒引起的神经障碍、各种神经退行性疾病、各种精神疾病、慢性疼痛、偏头痛、癌痛和糖尿病性神经障碍引起的疼痛。这些是严重的疾病,其中许多发病机制尚未阐明且有效的治疗药物依然未知。
许多神经系统疾病与兴奋性神经递质的过度释放或积累和/或受体表达方式的变化密切有关。例如,在中风、脑缺血、颅脑损伤和脊髓损伤中脑脊液和血浆中的谷氨酸浓度增加(Castillo,J.,Dazalos,A.和Noya,M.,346Lancet[柳叶刀],79-83(1997))。谷氨酸、NMDA、AMPA、红藻氨酸(kainite)等在过度施加于神经细胞时会引起神经病变(Meldrum,B.,18Brain Res.Reviews[大脑研究综述],293(1993))。在阿尔茨海默氏病中,β-淀粉样蛋白增强谷氨酸的神经毒性并促进谷氨酸的释放(Arias,C.,Arrieta,I.和Tapia,R.,41J.Neurosci.Res.[神经科学研究杂志]561-566(1995))。在帕金森氏病中,L-DOPA氢氧化物激活AMPA受体(Cha,J.J.等人,132Neurosci.Lett.[神经科学通讯]55-58(1991))并增强神经毒性(Olney,J.等人,108(3)Exp.Neurol.[实验神经学]269-272(1990);Rosenberg,P.A.等人,88Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]4865-4869(1991))。L-DOPA还促进自由基的产生,从而导致氧化应激的升高(Smith,T.S.等人,5Neuroreport[神经受体],1009-1011(1994))。在亨廷顿舞蹈病中,据报道,一种抑制谷氨酸释放的物质有效改善了症状。在ALS中,许多报道显示谷氨酸参与其病理过程。存在AIDS患者患有认知神经功能缺陷且提示谷氨酸参与的一些情况。例如,已证实HIV病毒包膜中的一种糖蛋白gp120阻遏星形细胞对谷氨酸的摄取(Dreyer,E.B.,7Eur.J.Neurosci.[欧洲神经科学杂志]2502-2507(1995);Ushijima,H.等人,7Eur.J.Neurosci.[欧洲神经科学杂志]1353-1359(1995)),而抑制谷氨酸释放的物质则阻遏gp120引起的神经退行性变(Sindou,P.等人,126J.Neurosci.[神经科学杂志]133-137(1994);Muller,W.E.G.等人,226Eur.J.Pharmacal.Molec.Pharmacal.[欧洲药物分子学杂志]209-214(1992);Lipton,S.A.,42Neurology[神经学],1403-1405(1992))。
在变应性脑脊髓炎中,在表现出炎症的小鼠中,分解来自细胞外的谷氨酸的酶不足(Hardin-Pouzet,H.,20Glia.[胶质细胞]79-85(1997))。橄榄体脑桥小脑萎缩(OPCA)是一种有时与帕金森氏病合并的疾病。在患病个体中发现的针对GluR2(AMPA受体的亚基)的自身抗体提示OPCA与AMPA受体之间存在联系(Gahring,L.C.,48(2)Neurology[神经学]494-500(1997))。关于癫痫,无法构建AMPA受体的GluR2亚基的小鼠显示AMPA受体的Ca
对兴奋性神经递质受体显示出拮抗作用的物质可用于治疗上述神经疾病。针对非NMDA受体(诸如AMPA受体或红藻氨酸受体)的拮抗剂特别引人关注。例如,国际专利申请公开号WO 00/01376报道称谷氨酸与AMPA和/或红藻氨酸受体复合物的相互作用的抑制剂可用于治疗脱髓鞘病症(诸如脑炎)、急性播散性脑脊髓炎、急性脱髓鞘性多发性神经病(格林-巴利综合征)、慢性炎性脱髓鞘性多发性神经病、多发性硬化、Marchiafava-Bignami病、脑桥中央髓鞘溶解、德维克氏综合征(Devic syndrome)、巴洛病(Balo disease)、HIV或HTLV脊髓病、进行性多灶性白质脑病、继发性脱髓鞘疾病;例如,中枢神经系统红斑狼疮、结节性多动脉炎、干燥综合征(Sjogren syndrome)、结节病和孤立大脑血管炎。
在美国专利号6,949,571中报道了竞争性AMPA受体抑制化合物和非竞争性AMPA受体抑制化合物。在国际专利申请公开号WO94/25469和WO 96/10023以及美国专利号5,356,902中报道了具有喹喔啉二酮骨架的竞争性AMPA受体抑制化合物。在国际专利申请公开号WO 95/01357、WO 97/28135、WO 97/18163、WO 97/43276、WO 97/34878、WO 98/38173以及欧洲专利号EP 802195和德国专利号DE 19643037中有关于非竞争性AMPA受体抑制化合物的报道。
已显示出优异的AMPA受体和/或红藻氨酸受体抑制活性的化合物包括1,2-二氢吡啶化合物。国际专利申请公开号WO 98/55480鉴定了由式(a)表示的作为GABA
在式(I)中,R为氢原子、C
在式(b)中,n为0、1、2、3、4或5;X为氢原子、C
发明内容
我们报道了一种药物制剂,该药物制剂包含增溶剂和治疗有效量的由下式(I)表示的化合物:
其中Q为O,R
合适的增溶剂可以是环糊精或多于一种环糊精的组合。合适的环糊精包括例如α-环糊精、β-环糊精和羟丙基β-环糊精以及磺丁基醚β-环糊精。在一个实施例中,该化合物是吡仑帕奈(perampanel),它是一种抗癫痫药。吡仑帕奈在化学上被描述为2-(6’-氧代-1’-苯基-1’,6’-二氢[2,3’-联吡啶]-5’-基)苄腈。吡仑帕奈水合物的一种来源是FYCOMPA
也存在吡仑帕奈多晶型物(参见例如美国专利号8,304,548,作为美国专利申请公开号2010/0324297公布,其披露内容特此通过援引以其全文并入)。该化合物可以呈无定形相(参见例如美国专利号7,803,818,其披露内容特此通过援引以其全文并入)。该化合物可以呈溶液。该溶液可以是水溶液。该制剂可以是冻干的。在一些实施例中,将制剂以低于化合物过饱和所需水平的浓度冻干,然后以达到过饱和的浓度在水溶液中重构。
实施例还可提供用于静脉内施用的储存稳定的水性药物制剂,该水性药物制剂包含过饱和的吡仑帕奈水溶液和磺基丁基醚β-环糊精。吡仑帕奈和所述磺基丁基醚β-环糊精可以例如以介于60与110之间的摩尔磺基丁基醚β-环糊精与摩尔吡仑帕奈的摩尔比存在。水性介质的pH可以介于2.5与9之间,并且在一些实施例中介于6与8之间。增溶剂的量,按重量/体积计,可以介于0.005%与60%之间。在一些实施例中,该量介于3%与9.5%之间。
其他实施例可以提供一种在水性介质中制备药物制剂的方法,该药物制剂包含增溶剂和治疗有效量的由下式表示的化合物:
其中Q表示O,R
a)在酸性pH下使该化合物在增溶剂中增溶,以及
b)添加稀释剂将pH调节到介于6与8之间。
增溶剂可以是环糊精。例如,它可以是α-环糊精、β-环糊精和羟丙基β-环糊精以及磺丁基醚β-环糊精。增溶剂也可以是环糊精混合物。该化合物可以是吡仑帕奈。
其他实施例提供了用在水性介质中的药物制剂治疗神经退行性疾病的方法,该药物制剂包含增溶剂和治疗有效量的由下式表示的化合物,
其中Q表示O,R
a)鉴定有此需要的患者,以及
b)施用治疗有效量的在水性介质中的所述药物制剂。
增溶剂可以是例如α-环糊精、β-环糊精、羟丙基β-环糊精和磺丁基醚β-环糊精中的一种。该化合物可以是吡仑帕奈。在一些实施例中,使用不是由聚氯乙烯(PVC)制成的材料进行施用。药物制剂的pH可以例如介于6与8之间。
附图说明
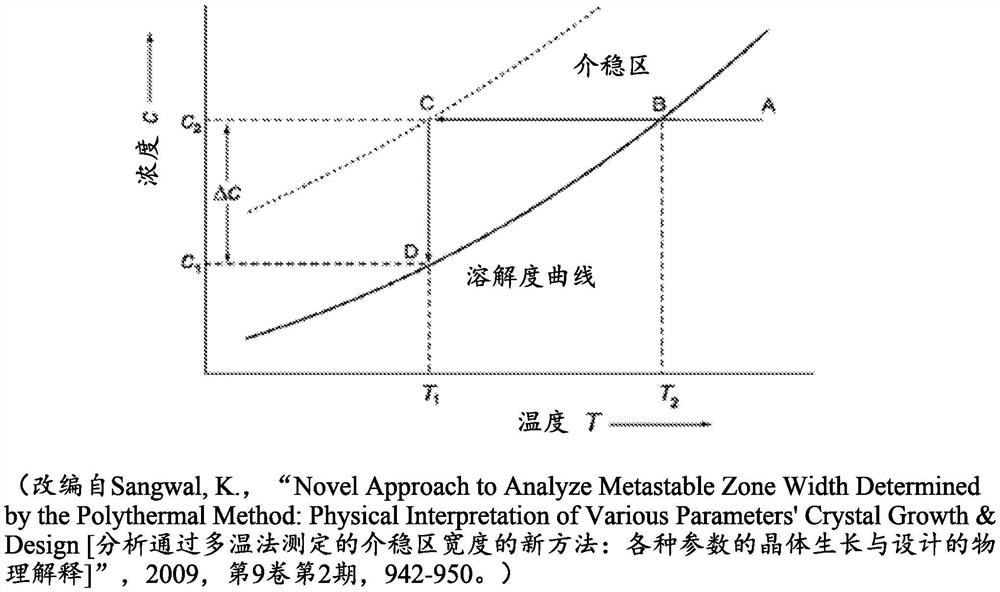
图1是在介稳区宽度的多温法中最大过冷ΔT
图2是说明了在5℃下,在没有任何增溶剂而含有5%磺丁基醚β环糊精(SBE-β-CD)、5%羟丙基β环糊精(HPBCD)、5%烟酰胺和5%聚山梨醇酯80的情况下,吡仑帕奈的pH溶解度的图表。
图3是说明了在22℃下在浓度在20%至50%之间变化的SBE-β-CD溶液中吡仑帕奈的pH溶解度的图表。
图4示出了在注射用水和7.5%碳酸氢钠注射液中稀释至0.12mg/mL之后,在30%和40%SBE-β-CD中0.48mg/mL吡仑帕奈制剂的HPLC含量结果。
图5示出了在五种不同的稀释剂中稀释至0.12mg/mL之后,在40%SBE-β-CD中0.8mg/mL吡仑帕奈制剂的pH和外观。
图6示出了在室温下于5mL体积中,不同浓度的吡仑帕奈在40%SBE-β-CD下的测量和预测诱导时间。
图7示出了1.75mg/mL溶液(40%SBE-β-CD)的随冷却速率而变化的沉淀温度,表明应使用以<0.5度/小时进行的实验数据进行对零冷却速率的线性外推。
图8示出了来自40%SBE-β-CD、pH7溶液的样品随药物浓度和冷却速率而变化的沉淀温度。
图9示出了随浓度(mg/mL)和冷却速率(℃/h)而变化的沉淀温度(℃)的等高线图,示出了各个数据点和数据拟合为等高线。
图10是说明了冷却速率(度/小时)、吡仑帕奈浓度(mg/mL)与沉淀温度(℃)之间的关系的3-D图。该图是图9中提供的相同数据的另一种表示形式。从这些数据外推出零冷却速率下的降水温度,以提供介稳区边界。这些点表示在不同冷却速率下发生沉淀的各个数据点。网格是拟合数据的表面。
图11示出了在40%SBE-β-CD、pH 7溶液中的样品的介稳区边界(具有95%的置信区间)。将样品的溶解度曲线和所提出的药品(DP)浓度添加到图中以供参考
具体实施方式
如本文报道的实施例包括用于静脉内施用的储存稳定的水性药物制剂。实施例包括治疗有效量的由下式(I)表示的化合物:
其中Q为O,R
在一些实施例中,式(I)的化合物在水性制剂中过饱和;也就是说,其存在的浓度高于其溶解度极限。在一些实施例中,这发生在重构(如果冻干)并稀释到水性介质中之后。当过饱和时,该化合物处于介稳状态,在介稳状态下除非添加晶种引起成核和沉淀,否则该化合物不会从溶液中沉淀出来。溶解度和介稳区宽度曲线汇总并以图形方式表示了晶体所生长的条件的范围和将导致初级成核的那些条件的范围。图1描绘了随温度而变化的溶解度曲线的实例和相应的介稳区。在图1中,温度在图的横轴上,而材料的浓度在图的纵轴上。图1中的粗线是溶解度曲线。溶解度曲线表示物质在溶剂体系中随温度而变化的固液热力学平衡浓度。它也称为澄清点曲线,因为它可以在实验上通过以下方式获得:在溶剂体系中加热材料的浆料直至获得完全溶解,从而得到澄清溶液(澄清点)。晶体将以高于溶解度曲线的浓度生长。
图1中的虚线是介稳区边界。介稳区边界表示某物质在溶剂体系中随温度而变化的浓度,高于该浓度会发生初级成核。这也称为“浊点曲线”,因为它可以在实验上通过以下方式获得:以固定速率冷却饱和溶液直至发生成核并且溶液变得浑浊(浊点)。在高于介稳区边界的浓度下,将会发生自发结晶,即初级成核。
实施例可包括适量的式(I)化合物,以将所需量的化合物递送给需要治疗的患者。例如,在一个实施例中,一种制剂能够在单次施用过程中将约0.5至约24毫克化合物经肠胃外,例如静脉内递送至人体内。
水基制剂还包含增溶剂。在一些实施例中,增溶剂是磺丁基醚β环糊精(SBE-β-CD)。一种有用的SBE-β-CD品牌是可从加利福尼亚的配体制药公司(Ligand Pharm.,Inc.)获得的
制剂可包含另外的组分。一种任选组分是缓冲剂。合适的缓冲剂包括例如但不限于pH介于2至11之间的可接受供肠胃外使用的缓冲剂。合适的缓冲剂包括乙酸盐、铵、抗坏血酸盐、苯甲酸盐、碳酸氢盐、柠檬酸盐、磷酸盐、二乙醇胺、甘氨酸乳酸盐、琥珀酸盐、酒石酸盐、氨丁三醇等。当要将制剂冻干时,可以添加一种或多种缓冲剂,其量达到按稀释前组合物的总重量计,将会抑制冻干制剂的适当冷冻。
合成式(I)化合物的方法在美国专利号6,949,571中有报道,该专利的披露内容特此通过援引以其全文并入。式(I)化合物的代表性实例是2-(6’-氧代-1’-苯基-1’,6’-二氢[2,3’-联吡啶]-5’-基)苄腈。这也称为“吡仑帕奈”。例如,吡仑帕奈可从东京卫材株式会社以FYCOMPA的形式获得。FYCOMPA牌吡仑帕奈是2-(2-氧代-1-苯基-5-吡啶-2-基-1,2-二氢吡啶-3-基)苄腈水合物(4:3)。FYCOMPA吡仑帕奈的分子式为C
吡仑帕奈的水溶性特别差。在环境室温下,吡仑帕奈在pH 7下的水溶解度为约0.001mg/mL。使吡仑帕奈在水中增溶的许多尝试均失败。本文所述的制剂展现出出乎意料介稳的过饱和状态。
如本文所用,“急性神经退行性疾病”可以是例如急性期的脑血管病(蛛网膜下腔出血、脑梗塞等)、头部损伤、脊髓损伤和由于缺氧或低血糖引起的神经病变。“慢性神经退行性疾病”例如可以是阿尔茨海默氏病、帕金森氏病、亨廷顿舞蹈病、肌萎缩性侧索硬化、脊髓小脑变性、癫痫、癫痫持续状态等。“感染性脑脊髓炎”可以是例如HIV脑脊髓炎,并且“脱髓鞘疾病”可以是脑炎、急性播散性脑脊髓炎、多发性硬化、急性多发性神经根神经炎、格林-巴利综合征、炎性脱髓鞘性多发性神经病、Marchifava-Bignami病、脑桥中央髓鞘溶解、视神经脊髓炎、德维克病、巴洛病、HIV脊髓病、HTLV脊髓病、进行性多灶性白质脑病、继发性脱髓鞘疾病等。“继发性脱髓鞘疾病”可以是中枢神经系统红斑狼疮、结节性多动脉炎、干燥综合征、结节病、孤立大脑血管炎等。
如本文所用,术语“治疗有效量”是指在有需要的受试者中用于修复由于神经退行性疾病引起的神经退行性变并恢复神经功能的量。对于本领域技术人员而言,可以根据他们的知识和常规实验的标准方法来确定治疗有效量以及施用的剂量和频率。如本文所用的术语“和/或”意指在“和”的情况下和在“或”的情况下的两种情况。
顺便提及,尽管为了方便起见,化合物的结构式可以表示某一异构体,但是本披露内容涵盖所有异构体,诸如由该化合物的结构产生的几何异构体、由于不对称碳产生的旋光异构体、旋转异构体、立体异构体和互变异构体,以及异构体的混合物,并且不限于为方便起见而给出的式的描述,而是可以是另一种异构体或者可以是混合物。因此,尽管分子中可能存在不对称碳原子,并且可能存在旋光性物质和外消旋物质,但是本披露不限于此,而是涵盖它们中的任何一种。此外,可以存在晶体多形性,但是同样,对于任何单晶形式或形式的混合物而言没有限制。化合物(I)或其盐可以是酸酐或水合物,并且可以设想它们中的任一种。还设想了通过体内分解与本发明有关的化合物(I)而产生的代谢物和与本发明有关的化合物(I)的前药或其盐。尽管在本申请中讨论了吡仑帕奈的具体水合物,但是除非另有说明,否则不应将实施例解释为限于任何特定的水合物。
在本申请的说明书中对“盐”没有特定限制,只要它与本发明的化合物形成盐并且是药理学上可接受的盐即可。实施例包括与卤化氢形成的盐(诸如氢氟酸盐、盐酸盐、氢溴酸盐或氢碘酸盐),与无机酸形成的盐(诸如硫酸盐、硝酸盐、高氯酸盐、磷酸盐、碳酸盐或碳酸氢盐),与有机羧酸形成的盐(诸如乙酸盐、三氟乙酸盐、草酸盐、马来酸盐、酒石酸盐、富马酸盐或柠檬酸盐),与有机磺酸形成的盐(诸如甲磺酸盐、三氟甲磺酸盐、乙磺酸盐、苯磺酸盐、甲苯磺酸盐或樟脑磺酸盐),与氨基酸形成的盐(诸如天冬氨酸盐或谷氨酸盐),与季胺形成的盐,与碱金属形成的盐(诸如钠盐或钾盐)和与碱土金属形成的盐(诸如镁盐或钙盐)。另外的实施例包括“药学上可接受的盐”的实例,诸如盐酸盐、草酸盐、甲磺酸盐等,以及本领域已知的其他盐。参见例如Gibson,M.编辑(2004).PharmaceuticalPreformulation and Formulation A Practical Guide from Candidate DrugSelection to Commercial Dosage Form[药物预配制和配制:从候选药物选择到商业剂型的实用指南].纽约国际药品公司/CRC.(New York,Interpharm/CRC.),其关于药学上可接受的盐的披露内容特此通过援引以其全文并入。
如本文所用,术语“卤素原子”表示氟、氯、溴、碘等。术语“C
术语“C
术语“C
术语“C
术语“C
术语“C
术语“C
术语“5至14元非芳族杂环基”意指单环型、二环型或三环型5至14元非芳族杂环基,其含有一个或多个选自由氮原子、硫原子和氧原子组成的组的杂原子。该组中的具体实例包括例如吡咯烷基、吡咯基、哌啶基、哌嗪基、咪唑基、吡唑烷基、咪唑烷基、吗啉基、四氢呋喃基、四氢吡喃基、吡咯啉基、二氢呋喃基、二氢吡喃基、咪唑啉基、噁唑啉基等。此外,在非芳族杂环基中还包括衍生自吡啶酮环和非芳族稠环的基团(例如,衍生自邻苯二甲酰亚胺环、琥珀酰亚胺环等的基团)。
术语“C
术语“5至14元芳族杂环基”和“杂芳基”意指单环型、二环型或三环型5至14元芳族杂环基,其含有一个或多个选自由氮原子、硫原子和氧原子组成的组的杂原子。例如,该组中的具体实例包括1)含氮的芳族杂环基,诸如吡咯基、吡啶基、哒嗪基、嘧啶基、吡嗪基、三唑基、四唑基、苯并三唑基、吡唑基、咪唑基、苯并咪唑基、吲哚基、异吲哚基、吲哚嗪基、异戊二烯基、吲唑基、喹啉基、异喹啉基、喹唑啉基、邻苯二甲酰基、萘啶基、喹喔啉基、喹唑啉基、噌啉基、蝶啶基、咪唑并三嗪基、吡嗪并哒嗪基、吖啶基、菲啶基、咔唑基、咔唑啉基、
术语“储存稳定的”意指在20℃下储存至少一天后在没有引晶的情况下制剂不会沉淀。术语“诱导时间”意指在出现沉淀之前流体经过的时间。
制剂中式(I)化合物的相对量可以在很宽的范围内变化。它可取决于多种因素,包括但不限于化合物的特性、化合物对所治疗的特定疾病的活性以及预期的施用模式。
在一个实施例中,制剂中式(I)化合物的量的最常见范围是将约0.5至24mg稀释到介于50与100mL之间的体积中。在许多实施例中,制剂中化合物的量相对于也在该制剂中的增溶剂的量。
在制剂中可以使用任何药学上可接受的水性介质,诸如纯度足够高的水。这包括使用无菌、无热源的蒸馏水或注射用水。在一种制备方法中,将SBE-β-CD溶解在注射用水中。然后将溶液的pH值降低至酸性水平,并将吡仑帕奈溶解在溶液中。可以在此时进行酸性吡仑帕奈溶液的过滤以去除成核位点。然后将溶液的pH值升高至中性pH,并添加注射用水以达到最终体积。在一个实施例中,用磷酸将溶液的pH降低至酸性水平。在另一个实施例中,用氢氧化钠将pH升高至中性pH。
通常,将最终溶液过滤并干燥。过滤可以例如通过0.22μm的过滤器进行。通过过滤该制剂,可以避免存在核,在制剂被重构并稀释至中性(或近似中性)的pH时核会引晶使晶体形成。在重构并用水性介质稀释之前,可以将制剂干燥以消除制剂制备中使用的任何溶剂。溶剂可以是任何已知的增溶剂,包括叔丁醇。
干燥可以通过任何已知的方法进行,诸如喷雾干燥、无菌喷雾干燥、流化床造粒、冷冻干燥、冻干、托盘干燥等,并且可以使用一种方法或多种方法的组合,但是这些实例不是限制性的。在无菌喷雾干燥的情况下,可以通过用喷雾干燥器等对细粒分散液进行喷雾干燥来获得含细粒的组合物。
在流化床造粒的情况下,通过将本发明的细粒分散液喷雾在环糊精、乳糖、淀粉或其他粉末上并造粒而获得含细粒的组合物。在冷冻干燥(也称为冻干)的情况下,通过向细粒分散液中添加糖或其他张度剂,然后使用冷冻干燥器,通常在-20℃至-60℃下冷冻去除溶剂而获得含细粒的组合物。在托盘干燥的情况下,通过将细粒分散液原样或在溶剂被赋形剂吸附后,通常在50℃至80℃下干燥来获得含细粒的组合物。干燥后,可以将含细粒的组合物粉末灌装到小瓶中,或者可以在水中重构并从结晶态转变为无定形态。
制剂的pH在稀释后可以维持,以提供制剂在室温下的长期稳定性。根据一方面,该化合物与高浓度的增溶剂组合在酸性pH下增溶。这使得可以溶解大量的化合物。然后将该制剂与增溶剂组合稀释至中性pH。制剂的pH范围可在1.5至8.0之间变化,并且增溶剂的范围可在20%至50%之间变化。包括水性稀释剂的典型实施例的pH介于1至10之间,增溶剂的范围为3%至9.5%。其他实施例的pH可以介于6与8之间。施用的制剂还显示出静脉内输注可接受的张度和pH。
制剂可以包装并经由任何合适的肠胃外施用途径施用。用于静脉内注射的制剂可以例如包装在玻璃小瓶、预先填充的注射器或安瓿中。在一个实施例中,制剂不用由聚氯乙烯(PVC)制成的组件包装或施用,而是用具有聚乙烯(PE)或玻璃表面的组件包装或施用。这些制剂可以与标准静脉(I.V.)稀释剂溶液(例如D5W)、生理盐水、定制稀释剂或乳酸林格氏液(Lactated Ringer’s solution)一起施用。
可以根据诸如化合物的特性和所治疗病症的类型等因素来确定合适的剂量。正如对本领域技术人员显而易见的那样,药剂的剂量根据症状的程度、年龄、性别、体重、剂型、对药物的敏感性等变化。在成人的情况下,每日剂量通常为约30μg至1g,但也可以是100μg至500mg,或100μg至30mg。这可以每天施用一次或一天分几份服用。医师可以酌情确定使用其他剂量方案来治疗特定病症。当前FYCOMPA产品具有FDA批准的2mg、4mg、6mg、8mg、10mg和12mg的日剂量。特此将FDA批准的标签和包装说明书通过援引以其全文并入,尤其是有关“剂量和施用”以及“剂型和强度”的信息。在一个实施例中,肠胃外制剂将含有足够量的活性成分,例如吡仑帕奈,以在治疗特定病症中实现相同或相似的体内功效。
实例
提供以下实例仅仅是为了说明目的,而不应解释为限制所附权利要求的范围。
实例1:溶解度研究
吡仑帕奈是水溶解性较差的基础药物。吡仑帕奈的一个来源是从东京卫材株式会社获得的FYCOMPA。22℃时的水溶解度从pH 2时的30μg/mL降到pH 7时的约1μg/mL。溶解度研究调查了许多不同的增溶剂,范围包括有机助溶剂、表面活性剂、氨基酸、络合剂和环糊精。用四种选定的增溶剂,在2至6的pH范围内,根据pH进行进一步的溶解度研究。当pH从2增加到6时,所有四种增溶剂的溶解度均降低。(参见图2)
进行研究以确定磺基丁基醚β环糊精(SBE-β-CD)的浓度和pH对吡仑帕奈溶解度的影响。在一个实施例中,该药物在酸性pH下在高浓度SBE-β-CD溶液中增溶,然后在稀释后在中性pH下于低浓度SBE-β-CD溶液中施用。对于制剂研究的pH范围为1.5至8.0,SBE-β-CD浓度范围为20%至50%。对于稀释的施用溶液,所研究的pH范围为6至8,SBE-β-CD的浓度范围为3%至9.5%。
通常,吡仑帕奈的溶解度随着pH降低和SBE-β-CD浓度增加而增加。图3示出了吡仑帕奈在不同的SBE-β-CD浓度下的增溶。
在一个实施例中,药品在用IV流体稀释后施用。在中性pH范围内在稀释条件下,测定吡仑帕奈在SBE-β-CD中的溶解度。稀释后的吡仑帕奈浓度可低至0.08mg/mL(100mL中为8mg)和高达0.24mg/mL(50mL中为12mg)。表1显示,在中性pH范围内,吡仑帕奈在稀SBE-β-CD溶液中的溶解度低于吡仑帕奈的预期浓度,表明药品在中性pH下会过饱和。
表1:吡仑帕奈在从3%至9.5%变化的SBE-β-CD浓度下的pH-溶解度
实例2:稀释制剂的研究
制备了pH为2的具有30%和40%SBE-β-CD的吡仑帕奈(0.48mg/mL)的制剂,并用注射用水(WFI)或7.5%碳酸氢钠注射液稀释。稀释制剂中的吡仑帕奈浓度为0.12mg/mL。图4示出了在室温下储存29小时后的稀释溶液的定时HPLC含量结果。在该时间段内含量值没有变化,并且5天后稀释溶液的视觉澄明度没有变化,表明该溶液具有充分的物理稳定性用于施用。
图5示出了在五种不同的稀释剂中稀释至0.12mg/mL之后,在40%SBE-β-CD中0.8mg/mL吡仑帕奈制剂的pH和外观。WFI、D5W和生理盐水无法将所施用溶液的pH增加到大于4。碳酸氢钠和乳酸林格氏液能够分别将pH增加到8.63和4.74;然而,它们在医院环境中不像盐水和D5W那样常用。与图4中的结果类似,当储存至少4天后在丁达尔光束下检查时,稀释溶液在视觉上是澄清的(参见图5)。
对稀释制剂的这些研究显示,吡仑帕奈的酸性40%SBE-β-CD溶液避免使用常用的稀释剂,诸如生理盐水和D5W,因为这些稀释剂没有缓冲能力,无法将所施用溶液的pH增加到可接受的限值。因此,在与盐水或D5W混合之前,需要将酸性制剂与药学上可接受的稀释剂混合以促进pH的增加。
研究还显示,在中性pH下吡仑帕奈在SBE-β-CD中的稀释制剂会稳定几天,没有药物沉淀的迹象。
实例3:SBE-β-CD与吡仑帕奈比率的测定
制备pH 2制剂的一般方法是使药物在酸性SBE-β-CD溶液(pH1.8-2.0)中增溶,添加注射用水(WFI)以达到批量,并通过0.22μm过滤器进行过滤。制备pH 7制剂的方法是使药物在酸性SBE-β-CD溶液中增溶,将pH调节至7,添加WFI以达到批量,并通过0.22μm过滤器进行过滤。
设计研究以达到可接受的SBE-β-CD与吡仑帕奈的摩尔比。将吡仑帕奈在酸性SBE-β-CD溶液中过夜混合后,通过在pH 2下溶液的澄明度来评估制剂可行性。还在调节至pH 7后评估溶液的澄明度。随着SBE-β-CD:吡仑帕奈比率增加,药物的溶解速率增加,整体可制造性得到改善并且提供给患者的SBE-β-CD剂量增加。发现SBE-β-CD:吡仑帕奈的摩尔比为28至108的制剂是可行的,因为它们提供了pH为7的过饱和溶液,该溶液保持澄清并且至少六小时内无沉淀。较高的比率允许增加SBE-β-CD的增溶能力,从而增加pH为2时的溶解速率,并且在将pH调至7时更好地保持过饱和状态。选择SBE-β-CD:吡仑帕奈比率为81的制剂作进一步考虑。
有两种满足该SBE-β-CD:吡仑帕奈比率的制剂;
(A)在40%SBE-β-CD中的0.8mg/mL吡仑帕奈溶液
(B)在30%SBE-β-CD中的0.6mg/mL吡仑帕奈溶液
这两种制剂的可制造性相似,递送相同的SBE-β-CD剂量,并且在pH 7下在静脉内流体稀释之后就过饱和度而论相同。4mg/小瓶的药品呈现被认为便于在8mg至12mg范围内给药。在10mL小瓶中灌装5mL的0.8mg/mL吡仑帕奈溶液或在合适大小的小瓶中灌装10mL在20%SBE-β-CD中的0.4mg/mL吡仑帕奈溶液,可以方便地实现这种呈现。
实例4:冻干可行性
评估冻干在pH 2和pH 7下的在40%SBE-β-CD中的0.8至1.0mg/mL吡仑帕奈溶液的可行性。冻干是在10mL 1型玻璃小瓶中进行的,每个小瓶中含4mg吡仑帕奈。冻干的饼状物具有良好的结构,并且在不搅动的情况下的重构时间为15至20分钟。pH 2和pH 7的重构溶液是澄清的且不含微粒。pH 7的重构溶液随时间的推移显示出良好的物理稳定性。即使在2-8℃下储存三个月,在pH为7的1mg/mL重构制剂中也未观察到药物沉淀。
已经证实,在pH 7的过饱和重构溶液中的药物沉淀只能通过添加提供成核位点并随着时间的推移引起药物沉淀的吡仑帕奈晶种来实现。在制造过程中,可以通过0.22μm过滤器对pH 7的药品进行无菌过滤,该过滤器可以有效去除任何可引起沉淀的核。
实例5:制剂稳定性
制造了具有40%SBE-β-CD基质的原型制剂。制剂的pH在2.0、4.5和7.0间变化。在pH 2下,制造具有0.8mg/mL吡仑帕奈的液体制剂和冻干制剂。在pH 4.5下,制造0.8mg/mL的冻干制剂。在pH 7下,制造0.8mg/mL(SBE-β-CD:吡仑帕奈比例=81)和1.0mg/ml(SBE-β-CD:吡仑帕奈比率=65)的冻干制剂,以了解比率对吡仑帕奈的物理和化学稳定性的影响。在表2中提供了对这五种制剂的组分的描述。
表2:出于稳定性的基于SBE-β-CD的吡仑帕奈制剂的组成
对表2中列出的原型制剂启动稳定性研究。将制剂在5℃、25℃/60%相对湿度(RH)和40℃/75%RH下储存1个月,并测试其物理稳定性(外观、pH、USP微粒、重构时间、重构溶液的外观)和化学稳定性(含量和杂质)。下面提供了原型制剂稳定性结果的汇总,并提供了相应的数据。
外观:
液体:溶液澄清、无色,并且测试长达1个月的样品未观察到可见微粒。
冻干的:饼状物外观长达1个月没有变化。
重构时间:
测试的冻干样品的重构时间为11分钟至23分钟。
重构溶液的外观:
所有重构溶液均是澄清无色的。测试长达1个月的样品未观察到可见微粒。结果示于表3中。
表3:储存一个月后的重构时间
pH:
长达1个月,制剂的pH均无明显变化(≤0.2pH单位)。结果示于表4中。
表4:初始时间点和储存一个月后的pH
微粒物:
初始时间点制剂中的微粒物在颗粒数/容器的USP<788>限值以内。结果示于表5中。
表5:制剂中的微粒物
≥10μm:NMT 6000个颗粒/容器
≥25μm:NMT 600个颗粒/容器
水分含量:
冻干制剂中的水分含量的范围为0.6%至2.1%。对于pH 7冻干制剂,在40℃/75%RH下,储存1个月后,水分含量最多增加为1%。结果示于表6中。
表6:冻干制剂在初始时间点和一个月后的水分含量
含量:
长达1个月,在制剂的含量无明显变化。对于pH 2液体制剂,在40℃/75%RH下,看到的最大效力损失为1.1%。结果示于表7中。
表7:初始时间点和存储一个月后的效力
杂质:
在任何储存条件下在1个月后,冻干制剂的总杂质(0.06%-0.07%)均没有变化。唯一看到杂质增加的是pH 2液体制剂,在40℃/75%RH下储存1个月后,杂质从0.06%达到0.17%。表8中示出了1个月储存测量的结果。
表8:初始时间点和储存1个月后的杂质测量
在一项单独的试验中,对于1.0mg/mL和0.8mg/mL的冻干制剂,在一年的时间段内对杂质进行测量。这些结果分别示于表9A和表9B以及表10A和表10B中。
实例6:施用期间的药品稳定性
在一个实施例中,冻干的药品将进行重构,稀释到静脉流体袋中,并穿过输液装置和导管系统。
在2-8℃下长达三个月,pH 7的重构溶液在视觉上保持澄清,无5沉淀(在丁达尔光束下)。进行研究以测试是否可以使用分析性微粒测试方法检测到任何沉淀。使用USP<788>测试和光散射强度测量,对pH 7的1mg/mL吡仑帕奈制剂,随时间的变化测定重构溶液的物理稳定性。USP<788>测试检测到微米尺寸范围内的微粒物。光散射强度可以用作亚可见颗粒增加的早期指示,这可能潜在地是药物沉淀0的前兆。表11中的结果显示,直至重构后72小时,重构溶液中的微粒物或光散射强度没有变化。该结果证实即使在亚可见微粒水平下,在重构溶液中也没有发生沉淀。
表11:重构后pH 7的1mg/mL吡仑帕奈冻干制剂的物理稳定性
≥10μm-NMT 6000个颗粒/容器
≥25μm-NMT 600个颗粒/容器
实例7:相容性研究
在施用期间,可以在与静脉流体混合之前将重构药品拉入注射器中。因此,评估重构药品与聚丙烯(PE)注射器的物理稳定性和相容性。将制剂连同玻璃小瓶中容纳的对照溶液一起在室温下保持与注射器接触24小时。表12显示在注射器与对照样品之间吡仑帕奈含量没有差异,表明当与注射器接触长达24小时时,药品是物理稳定且相容的。
表12:吡仑帕奈制剂(pH 7冻干)与聚丙烯注射器的相容性。
所示的浓度和外观是在室温下储存24小时后的。
在装在聚乙烯(PE)共聚物静脉注射袋中的生理盐水中评估pH 7冻干制剂的物理稳定性和相容性。所研究的吡仑帕奈浓度为0.08mg/mL和0.24mg/mL。在直至72小时的不同时间点从袋中取出样品,并分析其含量、pH和不可见微粒。在容纳于PE袋的生理盐水中72小时后,溶液看上去澄清并且显示pH、光散射强度和含量均无变化(表13)。这些数据得出结论,在PE制成的静脉输液袋中长达72小时,吡仑帕奈没有表现出物理不稳定性或不相容性。
表13:吡仑帕奈制剂在装在聚乙烯(PE)共聚物袋中的生理盐水中的相容性。在72小时内测量pH、光散射强度和吡仑帕奈含量。
还在用装在聚乙烯(PE)共聚物静脉注射袋中的5%右旋糖稀释吡仑帕奈制剂后,重复了相容性研究。在直至76小时的不同时间点从袋中取出样品,并通过HPLC分析。表14显示在76小时内吡仑帕奈浓度没有损失。
表14:吡仑帕奈制剂在装在聚乙烯(PE)共聚物袋中的5%右旋糖中的相容性。在72小时内测量吡仑帕奈含量。
还在聚氯乙烯(PVC)静脉注射袋中的生理盐水中评估了pH 7冻干制剂的物理稳定性和相容性。所研究的吡仑帕奈浓度为0.12mg/mL。在直至11小时的不同时间点从袋中取出样品,并测定吡仑帕奈含量。表15显示PVC袋在11小时内显示出约18%的吸附损失。
表15:吡仑帕奈制剂在聚氯乙烯(PVC)袋中的生理盐水中的相容性。在11小时内测量吡仑帕奈含量。
研究药物与输液装置和导管系统的相容性。对两种施用装置进行评价;一种含有聚乙烯涂层管材的装置和一种含有聚氯乙烯管材的装置。用吡仑帕奈在生理盐水中对这些施用装置进行评价。
输液装置一端连接至生理盐水袋,另一端连接至静脉导管。经稀释的药品保持与所有组分接触72小时。在不同时间点,从导管中收集25mL溶液并分析吡仑帕奈含量。与PVC施用装置接触的溶液在前2小时内显示出42%的药物效力损失。效果变差的溶液的外观是澄清的且不含沉淀;因此效力损失归因于药物吸附到PVC管材上。与带聚乙烯涂层的施用装置接触的溶液在72小时内未显示药物损失。另外,与PE施用装置接触的溶液的pH和光散射强度测量值没有变化。
实例8诱导时间研究
进行诱导时间研究以确定在室温和5mL体积中在40%SBE-β-CD、pH 7下不同浓度的吡仑帕奈,晶体形成之前将要经过的时间段。测得的研究溶液浓度为1.16、1.64和1.97(mg/mL)。根据Zaitseva等人在J.Crystal Growth[晶体生长杂志],148(1995)276-282中使用的方法,分析沉淀时间数据。根据这些数据,预计0.8mg/mL溶液的诱导时间(相当于x=0.599,ln时间(秒)对比1/Ln(S)^2的图表)为3.3年(95%置信区间下限为1.3年而上限为7.9年)。图6中提供了用于进行该预测的数据分析,其中S对应于过饱和度且S=X/Xo,其中Xo是溶解度。由于一瓶重构药品仅需要保持无微粒长达几天,因此预计的诱导时间支持40%SBE-β-CD、pH 7制剂的活力。
实例9介稳区宽度研究
对含有不同浓度的吡仑帕奈的基于SBE-β-CD的吡仑帕奈制剂进行介稳区宽度研究,以估计pH 7的含有40%SBE-β-CD的制剂的介稳区。冻干可长期储存,但在使用前需要重构。当冻干制剂重构时,溶液处于介稳的过饱和状态。介稳区宽度分析提供了对制剂与介稳态边界的接近程度的估计。
在40%SBE-β-CD中在pH 7下制备不同浓度的吡仑帕奈溶液,并且将其置于带有
然后通过将100mg除以(1-[吡仑帕奈的水分含量/100])和(吡仑帕奈的无水纯度/100)的乘积,计算出用于制备所需浓度的吡仑帕奈的重量。在一些实例中,水分含量为3.7%且无水纯度为99.9%。将计算量的吡仑帕奈添加到pH 1.75的溶液中,然后在40℃下混合过夜。在40℃下将溶液通过20μm过滤器过滤,然后温热至40℃。在该温度下,将pH调节至7。用水将体积调节至50mL并混合。
将溶液以限定速率冷却并记录发生沉淀时的温度。通过HPLC分析测量每份样品的效力。根据Sangwal,K.在Crystal Growth and Design[晶体生长和设计],9,2(2009)942-950中描述的方法来分析沉淀温度数据。
对最初收集的数据的分析表明,外推介稳区边界的最佳方法是对从小于或等于0.5度/小时的冷却速率收集的数据进行线性外推至零冷却速率,如图7所示。最初收集的数据汇总在表15中。
表15:介稳区宽度研究数据汇总。NP=未观察到沉淀。
在图8中提供了吡仑帕奈从40%SBE-β-CD、pH 7溶液中随药物浓度(mg/mL)和冷却速率(℃/h)而变化的沉淀温度的图。使用
使用该外推数据制备图11,预测在pH 7的40%SBE-β-CD制剂中吡仑帕奈的介稳区边界。从理论上讲,如果药物浓度保持在介稳区边界或以下,则在限定温度下药物应该不会从溶液中沉淀出来。这些数据表明,在低至0℃的温度下储存期间,0.8 mg/mL应该不会沉淀;然而,由于结果的可变性,在较低的药物浓度下95%的置信区间较大。
这项研究的结果表明,0.8 mg/mL制剂在介稳区内,低至零℃。由于数据的可变性(尤其是在较低的药物浓度下),介稳区的下95%置信区间在10℃左右经过0℃。因此,建议在重构后,将溶液储存在受控的室温下,并且对冷藏和冷冻储存加以限制,以确保药品保持在介稳区内且不会发生沉淀。
实例10
如本文所披露的吡仑帕奈的制剂经静脉内施用给需要此类治疗的患者。根据需要且主治医生认为适当时,重复治疗。
虽然已经描述和说明了特定的实施例,但是应该理解,这些实施例不以任何方式进行限制,因为本领域技术人员可以进行修改。本申请考虑了落入如本文披露和要求保护的1,2-二氢吡啶化合物的水基药物制剂的精神和范围内的任何及所有修改。
编号的实施例
1.一种药物制剂,该药物制剂包含增溶剂和治疗有效量的由下式表示的化合物或化合物的水合物,
其中Q表示O,R
其中所述化合物和所述增溶剂以一定比率存在,由此将所述制剂稀释在水性介质中提供呈过饱和水溶液的该化合物。
2.如权利要求1所述的药物制剂,其中该化合物与该增溶剂以介于60至110之间的摩尔增溶剂与摩尔化合物的摩尔比存在。
3.如权利要求1所述的药物制剂,其中所述增溶剂是环糊精。
4.如权利要求3所述的药物制剂,其中所述增溶剂选自由α-环糊精、β-环糊精、羟丙基β-环糊精、和两种或更多种不同环糊精的混合物组成的组。
5.如权利要求4所述的药物制剂,其中所述增溶剂为磺丁基醚β-环糊精。
6.如权利要求5所述的药物制剂,其中所述增溶剂为磺丁基醚β-环糊精钠。
7.如权利要求5所述的药物制剂,其中所述化合物是吡仑帕奈或其水合物。
8.如权利要求7所述的药物制剂,其中该磺基丁基醚β-环糊精与吡仑帕奈的摩尔比介于28与108之间。
9.如权利要求1所述的药物制剂,其中该化合物呈无定形相。
10.如权利要求1所述的药物制剂,其中该制剂呈溶液。
11.如权利要求10所述的药物制剂,其中所述溶液是水溶液。
12.如权利要求9所述的药物制剂,其中该制剂是冻干的。
13.一种用于静脉内施用的储存稳定的水性药物制剂,该药物制剂包含过饱和的吡仑帕奈水溶液和磺基丁基醚β-环糊精。
14.如权利要求13所述的药物制剂,其中所述吡仑帕奈和所述磺基丁基醚β-环糊精以介于60与110之间的摩尔磺基丁基醚β-环糊精与摩尔吡仑帕奈的摩尔比存在。
15.如权利要求14所述的药物制剂,其中所述过饱和的吡仑帕奈水溶液的pH介于2.5与9之间。
16.如权利要求15所述的药物制剂,其中所述过饱和的吡仑帕奈水溶液的pH介于6与8之间。
17.如权利要求13所述的药物制剂,其中增溶剂的量按重量计介于0.005%与60%之间。
18.如权利要求13所述的药物制剂,其中增溶剂的量按重量计介于3%与9.5%之间。
19.如权利要求13所述的药物制剂,其中该药物制剂处于高于或等于0℃的温度下。
20.如权利要求13所述的药物制剂,其中该药物制剂处于高于或等于10℃的温度下。
21.一种在水性介质中制备药物制剂的方法,该药物制剂包含增溶剂和治疗有效量的由下式表示的化合物:
其中Q表示O,R
a)在酸性pH下使该化合物在增溶剂中增溶,以及
b)添加稀释剂将pH调节到介于6与8之间。
22.如权利要求21所述的方法,其中所述增溶剂选自由α-环糊精、β-环糊精和羟丙基β-环糊精组成的组。
23.如权利要求21所述的方法,其中所述增溶剂为磺丁基醚β-环糊精钠。
24.如权利要求23所述的方法,其中所述化合物是吡仑帕奈或其水合物。
25.如权利要求23所述的方法,该方法进一步包括将所述药物制剂冻干。
26.如权利要求25所述的方法,其中所述冻干步骤在化合物的浓度低于该化合物在该水性介质中过饱和时的浓度的情况下进行。
27.一种用在水性介质中的药物制剂治疗神经退行性疾病的方法,该药物制剂包含增溶剂和治疗有效量的由下式表示的化合物或其水合物,
其中Q表示O,R
a)鉴定有此需要的患者,以及
b)施用治疗有效量的在水性介质中的所述药物制剂。
28.如权利要求27所述的方法,其中所述增溶剂选自由α-环糊精、β-环糊精、羟丙基β-环糊精、和/或两种或更多种不同环糊精的混合物组成的组。
29.如权利要求27所述的方法,其中所述增溶剂包含磺丁基醚β-环糊精钠。
30.如权利要求29所述的方法,其中所述化合物是吡仑帕奈或其水合物。
31.如权利要求27所述的方法,其中该施用步骤在不是由聚氯乙烯(PVC)制成的材料中进行。
32.如权利要求27所述的方法,其中该药物制剂的pH介于6与8之间。
33.如权利要求29所述的方法,其中所述化合物是在冻干基质中的吡仑帕奈,含有2-6mg的吡仑帕奈和1500-2500mg的SBE-β-CD,当用水重构时,提供pH为5至9的溶液。
34.如权利要求33所述的方法,其中所述化合物是在冻干基质中的吡仑帕奈,含有2-6mg的吡仑帕奈和1500-2500mg的SBE-β-CD,当用水重构时,提供pH为6至8的溶液。
35.如权利要求34所述的方法,其中所述化合物是在冻干基质中的吡仑帕奈,含有3-5mg的吡仑帕奈和1900-2100mg的SBE-β-CD,当用水重构时,提供pH为6至8的溶液。
36.如权利要求35所述的方法,其中所述化合物是在冻干基质中的吡仑帕奈,含有4mg的吡仑帕奈和2000mg的SBE-β-CD,当用水重构时,提供pH为6至8的溶液。
- 1,2-二氢吡啶化合物的水基药物制剂
- N-CF2H-1,2-二氢吡啶-2-酮化合物的合成方法
