一种醛缩酶基因ltp及其在构建高产4-HBC基因工程菌中的应用
文献发布时间:2023-06-19 19:28:50
(一)技术领域
本发明涉及一种醛缩酶基因ltp及其在构建高产4-HBC基因工程菌中的应用,以及高产4-HBC的分枝杆菌基因工程菌及其构建与其在微生物发酵制备22-羟基-23,24-双降胆甾-4-烯-3-酮中的应用。
(二)背景技术
甾体类药物已批准上市的有300多种,是人类用于治疗疾病最重要的药品之一。仅制药行业来说,每年全球对类固醇物质的需求就超过1500吨,2015年所生产的类固醇药物市场超过1000亿美元,仅次于抗生素。类固醇的药物有肾上腺皮质激素、性激素、黄体酮、盐皮质激素和非激素类固醇等,用于各种领域,包括医药、兽药、水产养殖、农业、食品工业。
化学合成的方法曾经在这一领域中拥有绝对的统治力,薯蓣植物来源的薯蓣皂素与甾体药物具有十分相似的结构,可以通过化学的方式合成多种甾体药物。但其原料来源不稳定,且提取成本高,难以满足日益扩大的市场需求。植物甾醇的微生物转化成为当前生产各类甾体的主要方式之一,已逐步取代传统的化学合成路线,可生产多种用于制备甾体类药物的中间体,如4-雄烯-3,17-二酮(AD)、1,4-雄二烯-3,17-二酮(ADD)、9-羟基-4-雄烯-3,17-二酮(9-OH-AD)、22-羟基-23,24-双降胆甾-4-烯-3-酮(4-HBC)、22-羟基-23,24-双降胆甾-1,4-二烯-3-酮(1,4-HBC)等。
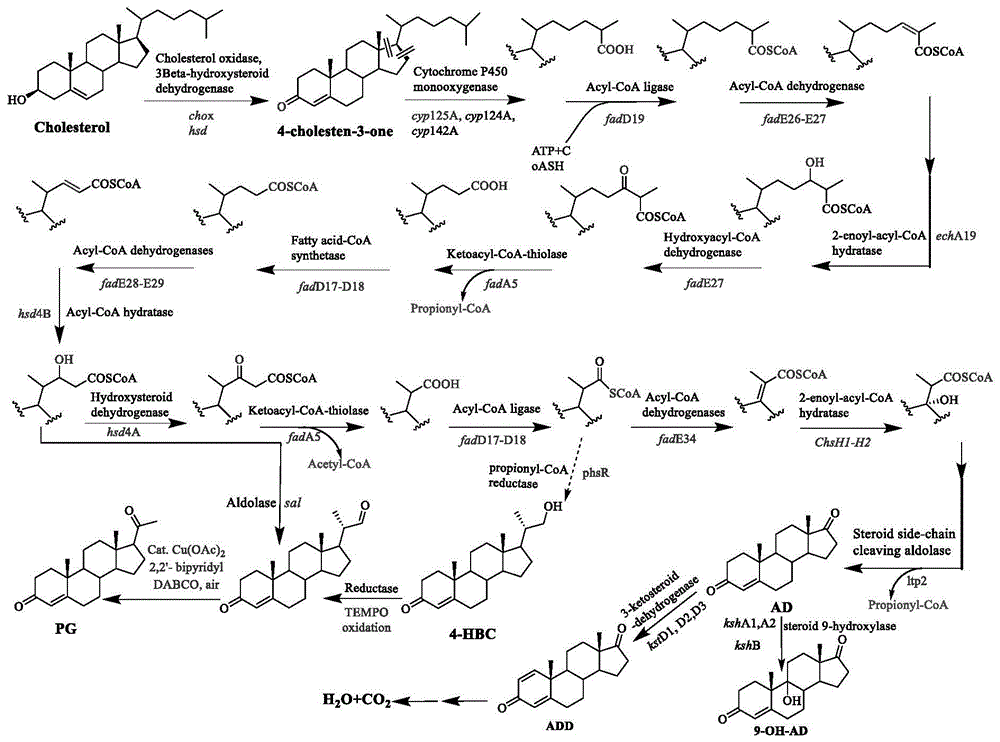
随着生物信息学的发展,甾醇分解代谢途径有关的功能基因的奥秘逐渐揭开。如图1所示,胆固醇首先通过胆固醇氧化酶(chox,ChOx)或3β-羟基类固醇氧化酶(hsd,3β-HSD)转化为4-胆甾烯-3-酮。侧链降解过程被证实与脂肪酸氧化途径一致,类固醇C26单加氧酶(cyp125、cyp142)主要催化侧链形成末端羧基。C-27末端酰化后,胆固醇侧链被末端CoA硫代酯化激活,然后C-27的羧酰基CoA进入β-氧化反应。侧链被完全降解可以生成AD、ADD和9-OH-AD,其旁支代谢路径可以在醛缩酶和丙酰辅酶A还原酶作用下生成4-HBC。由于胆固醇与植物甾醇在侧链结构上略有不同,导致代谢路径中的基因有所不同,例如fadA5所编码的硫解酶,无法完成C24存在支链结构底物的转化,因此存在着其他参与该反应的基因和酶元件。
Hotse等报道了通过靶向失活红球菌(Rhodococcus rhodochrous)ltp3和ltp4,导致谷甾醇和菜籽醇的侧链降解受阻,结果表明Ltp3和Ltp4在C24分支的去除中具有特异性的作用,与硫酶酶具有较高的相似性,参与甾醇侧链的β-氧化反应(如图2)。(Hotse M,Wilbrink,Robert,et al.Molecular characterization of ltp3 and ltp4,essentialfor C24-branched chain sterol-side-chain degradation in Rhodococcusrhodochrous DSM43269.Microbiology,2012)。
Xu等报道了利用遗传改造的分枝杆菌以植物甾醇为底物生产4-HBC的方法,在40g/L底物浓度,转化144h的条件下,静息细胞的摩尔产率不足50%,且存在AD,1,4-HBC等副产物,该技术难以应用在工业生产中(Xu LQ,Liu YJ,Yao K,et al.Unraveling andengineering the production of 23,24-bisnorcholenicsteroids in sterolmetabolism,Scientific Repots,2016,6:21928)。专利CN 112029701报道了出发菌中的3-甾酮-Δ
高产量专一地制备4-HBC对甾体类药物的工业生产具有极为重要的意义。有关于分枝杆菌通过降解甾醇获得4-HBC的报道逐年增多,其降解机制逐渐被披露揭示,与诺卡氏菌和红球菌等可降解甾醇的细菌相比,相关的代谢基因和酶保守度较高,但由于底物不同,代谢途径依旧存在着许多变化,而这些不同蕴含了提高菌株生产能力的潜力。
(三)发明内容
本发明目的是提供一种醛缩酶基因ltp及其在构建高产4-HBC基因工程菌中的应用,以及高产4-HBC的分枝杆菌基因工程菌及其构建与其在微生物发酵制备22-羟基-23,24-双降胆甾-4-烯-3-酮中的应用。
本发明采用的技术方案是:
一种醛缩酶基因ltp,由ltp3和ltp4组成,其特征在于:所述ltp3基因核苷酸序列如SEQIDNO.1所示,所述ltp4基因核苷酸序列如SEQIDNO.3所示。
本发明还涉及所述醛缩酶基因ltp在构建高产4-HBC基因工程菌中的应用。发明人经实验发现,过表达所述醛缩酶基因ltp,对工程菌转化产4-HBC能力有较大提升。
一种高产4-HBC的分枝杆菌基因工程菌,由如下方法构建获得:
(1)以分枝杆菌为底盘菌,依次敲除kshA1、kshA2、kstD1、kstD2、kstD3基因,得到产AD的工程菌Mn-AD;
(2)以工程菌Mn-AD为底盘菌,进一步敲除hsd4A基因,得到产4-HBC的工程菌Mn-HBC;
(3)以工程菌Mn-HBC为底盘菌,过表达ltp3、ltp4基因,得到所述高产4-HBC的分枝杆菌基因工程菌。
具体的,所述ltp3基因核苷酸序列如SEQIDNO.1所示,所述ltp4基因核苷酸序列如SEQIDNO.3所示。
本发明还涉及构建所述基因工程菌的方法,所述方法包括:
(1)以底盘菌分枝杆菌基因组为模板,分别扩增kshA1、kshA2、kstD1、kstD2、kstD3、hsd4A基因的上、下游片段,与pacI和NotI酶切线性化的pNS质粒相连接,构建得到敲除质粒pNS-kshA1H、pNS-kshA2H、pNS-kstD1H、pNS-kstD2H、pNS-kstD3H和pNS-hsd4AH;以底盘菌分枝杆菌基因组为模板,扩增-ltp3-ltp4基因,将扩增出的片段与BamHI和HindIII酶切线性化的pMV261质粒相连接,构建得到pMV261-ltp3-ltp4过表达质粒;
(2)以分枝杆菌为底盘菌,采用敲除质粒pNS-kshA1H、pNS-kshA2H、pNS-kstD1H、pNS-kstD2H和pNS-kstD3H,利用同源重组双交换的方法,依次敲除kshA1、kshA2、kstD1、kstD2、kstD3基因,得到产AD的工程菌Mn-AD;
(3)以工程菌Mn-AD为底盘菌,采用敲除质粒pNS-hsd4AH,敲除hsd4A基因,,得到产4-HBC的工程菌Mn-HBC;
(4)以工程菌Mn-HBC为底盘菌,利用pMV261-ltp3-ltp4过表达质粒,过表达ltp3、ltp4基因,得到工程菌Mn-HBC pMV261-ltp3,4,即所述高产4-HBC的分枝杆菌基因工程菌。
优选的,所述分枝杆菌为Mycobacterium neoaurum ATCC 25795。本发明同样适用于同种属的分枝杆菌。
所述ltp3基因核苷酸序列如SEQIDNO.1所示,所述ltp4基因核苷酸序列如SEQIDNO.3所示。
本发明还涉及所述基因工程菌在微生物发酵制备22-羟基-23,24-双降胆甾-4-烯-3-酮中的应用。
具体的,所述应用为:将所述基因工程菌接种至含有甾醇的发酵培养基中,25~40℃、100~300rpm震荡培养48~120h,于发酵液中获得所述22-羟基-23,24-双降胆甾-4-烯-3-酮;所述甾醇为下列之一:胆固醇、豆甾醇、谷甾醇、植物甾醇,优选为植物甾醇。
本发明的有益效果主要体现在:本发明所提供的基因工程菌株可以生产4-HBC,大大提高甾体药物的生产效率,有助于提高底物的转化率,降低生产成本,且反应条件温和、环境友好,适合于大力推广应用,具有较高的经济效益和社会效益。
(四)附图说明
图1为胆固醇在微生物中代谢途径;
图2为植物甾醇与胆固醇的LTP参与的代谢途径;
图3为敲除质粒示意图;
图4为ltp3,4敲除电泳图;
图5为过表达质粒示意图。
(五)具体实施方式
下面结合具体实施例对本发明做进一步详细地说明,但本发明并不限于以下实施例:
实施例1:敲除质粒的构建与转化筛选
(1)按照以下的方法分别构建敲除kshA1,kshA2,kstD1,kstD2,kstD3,hsd4A和ltp3,ltp4的质粒。
以出发菌株Mycobacterium neoaurum ATCC 25795的基因组为模板进行PCR扩增。PCR片段扩增体系:上下游引物各2μL,模板50-100ng,dNTP 1μL,2×Buffer25μL,DNA聚合酶1μL,ddH
表1:构建各基因的敲除质粒所需引物
采用一步克隆酶将扩增出的上、下游片段与pacI和NotI酶切线性化的pNS质粒相连接(如图3),其中pNS质粒是p2NIL载体插入pGOAL19中的片段(hsp60-sacB)构成。将连接产物转化到DH5α感受态细胞中,涂Kan抗性LB平板上(胰蛋白胨:10g/L,酵母提取物:5g/L,氯化钠:10g/L,Kan:50μg/ml琼脂:2%),37℃倒置培养16h,挑取单菌落,PCR和测序验证是否构建正确,分别构建得到敲除质粒pNS-kshA1H,pNS-kshA2H,pNS-kstD1H,pNS-kstD2H,pNS-kstD3H,pNS-hsd4AH和pNS-ltp34H。
(2)转化与筛选
所获得的敲除质粒,经过碱处理后,将敲除质粒加入分枝杆菌感受态(已于冰上溶解)中,4℃静置20min;设定电压2.5kV,电击杯孔径选择2mm,电击2次;确认电击频率为4-5ms范围,加入600μL新鲜LB培养基,充分悬浮底部菌体后,转移至无菌离心管;37℃-180rpm振荡温育4h,5000rpm离心3min,弃去上清,100μL重悬,30℃倒置培养3-5d。
筛选得到的转化子,用sacB基因上的引物SCO-F:5'-cgccaagcttcctgctgaacatcaaagg-3'和目的基因下游同源臂外侧的引物SCO-R,通过菌落PCR验证单交换是否成功;电泳和测序验证正确的转化子,转接至LB液体培养基中,37℃-180rpm振荡12h;取50μL转涂在蔗糖平板上(LB无NaCl含5%蔗糖)筛选双交换转化子,30℃倒置培养3-5d;挑取转化子同时影印在Kan抗性和无抗平板上,并用目的基因的上下游引物菌落PCR;电泳验证目的条带符合要求的,对照两个平板中在无抗中生长,卡纳抗性平板未生长的即为敲除菌株,PCR产物测序验证。
实施例2:产AD菌株和产4-HBC菌株的构建
以Mycobacterium neoaurum ATCC 25795为出发菌株,采用实施例1所构建的敲除质粒,利用同源重组双交换的方法,依次敲除kshA1,kshA2,kstD1,kstD2,kstD3基因,通过PCR产物的测序,并以2g/L植物甾醇为底物,LB作培养基进行发酵验证,得到产AD的工程菌Mn-AD。以Mn-AD为出发菌株,采用实施例1所构建的敲除质粒,利用同源重组双交换的方法,进一步敲除hsd4A基因,通过PCR产物的测序,并以2g/L植物甾醇为底物,LB作培养基进行发酵验证,得到产4-HBC的工程菌Mn-HBC。
实施例3:敲除ltp3和ltp4菌株的构建
在Mn-AD和Mn-HBC菌株的基础上,采用实施例1所构建的敲除质粒pNS-ltp34H,利用同源重组双交换的方法,同时敲除ltp3和ltp4基因,经过单交换和双交换的筛选,得到转化子进行菌落PCR验证,其产物凝胶电泳(如图4)显示与未敲除相比缺少了2000bp,目的基因缺失约90%,测序结果显示敲除成功,得到Mn-AD△ltp3,4和Mn-HBC△ltp3,4菌株。
实施例4:不同底物的转化研究
从甘油管中取一环菌液,在LB固体培养基上划线,30℃培养48h;挑取单克隆于5mLLB液体中,30℃振荡培养36h;2%转接到90mL M3培养基中,30℃振荡培养12h,加入羟丙基环糊精乳化的甾醇100g/L溶液10mL,30℃-180rpm振荡培养;反应96h和120h取样,1mL样品加入5mL乙酸乙酯萃取,振荡混匀30min,取上层有机相200μL于EP管中挥发,加入0.8mL甲醇复溶,液相检测,其转化结果如表2。
表2:ltp3,4敲除菌株在不同底物中的转化结果
实施列5:pMV261-ltp3-ltp4过表达质粒的构建与转化
(1)pMV261-ltp3-ltp4过表达质粒的构建
以出发菌株Mycobacterium neoaurum ATCC 25795的基因组为模板进行PCR扩增。PCR片段扩增体系:上下游引物各2μL,模板50-100ng,dNTP 1μL,2×Buffer25μL,DNA聚合酶1μL,ddH
其中所用引物序列如下:
ltp-F:GGCCAAGACAATTGCGGATCCatgacagatatcgcagtggtgggct,
ltp-R:CTACGTCGACATCGATAAGCTTtcacctgctcggcttgtccgc;
采用一步克隆酶将扩增出的片段与BamHI和HindIII酶切线性化的pMV261质粒相连接(如图5),将连接产物转化到DH5α感受态细胞中,涂Kan抗性LB平板上,37℃倒置培养16h,挑取单菌落,PCR和测序验证无误,构建得到pMV261-ltp3-ltp4过表达质粒。
(2)转化与筛选
将构建的过表达质粒加入分枝杆菌感受态(已于冰上溶解)中,4℃静置20min;设定电压2.5kV,电击杯孔径选择2mm,电击2次;确认电击频率为4-5ms范围,加入600μL新鲜LB培养基,充分悬浮底部菌体后,转移至无菌离心管;37℃-180rpm振荡温育4h,5000rpm离心3min,弃去上清,100μL重悬,30℃倒置培养3~5d。通过菌落PCR验证转化子,电泳和测序验证正确的转化子,得到Mn-AD pMV261-ltp3,4和Mn-HBC pMV261-ltp3,4菌株。
实施例6:过表达菌株的转化反应
从甘油管中取一环菌液,在LB固体培养基上划线,30℃培养48h;挑取单克隆于5mLLB液体中,30℃振荡培养36h;5%转接到50mL M3培养基中,30℃振荡培养6h,加入羟丙基环糊精乳化的甾醇200g/L溶液10mL,30℃、180rpm振荡培养;反应120h取样,1mL样品加入5mL乙酸乙酯萃取,振荡混匀30min,取上层有机相100μL于EP管中挥发,加入0.8mL甲醇复溶,液相检测,其转化结果如表3。
表3:过表达菌株的转化能力
最后应当说明的是,以上内容仅用以说明本发明的技术方案,而非对本发明保护范围的限制,本领域的普通技术人员对本发明的技术方案进行的简单修改或者等同替换,均不脱离本发明技术方案的实质和范围。
