硅氧碳复合材料及其制备方法、负极原料、负极极片、锂离子电池
文献发布时间:2023-06-19 19:30:30
技术领域
本公开涉及电极材料领域,特别涉及硅氧碳复合材料及其制备方法、负极原料、负极极片、锂离子电池。
背景技术
硅具有高达4200mAh/g的理论比容量,基于硅的硅基负极材料对于开发高能量密度的锂离子电池具有重要的意义。然而,硅基负极材料具有较大的体积膨胀系数,在锂化/去锂化过程中,硅基负极材料的体积变化量高达300%,这使得在充放电循环过程中,硅基负极材料因上述体积变化引起粉化和粉碎,这制约了锂离子电池的可逆容量、库伦效率和循环稳定性。
硅氧材料属于硅基负极材料的一种,硅氧材料中氧含量较高,所以在首次嵌锂过程中会产生较多不可逆容量和较低的库伦效率。相关技术使用碳源在硅氧材料的外部构建碳包覆层,形成碳包覆硅基负极材料,通过碳包覆层来缓解硅的体积效应,以及减少硅与电解液的直接界面接触和副反应,并增加硅的表面电导率,从而减小硅体积膨胀并增加硅基负极材料首效和容量。碳包覆层的构建方法包括:固/液相混合碳化法(例如碳源为沥青、树脂)、气相裂解法(例如碳源为乙炔、甲烷)、乳液聚合法(例如碳源为聚丙烯腈)、高温热解法(例如碳源为聚乙烯醇、聚偏氟乙烯)等。
然而,相关技术提供的碳包覆硅基负极材料,对硅基负极材料的可逆容量、首次库伦效率、倍率性能和循环稳定性的改进效果有限。
公开内容
鉴于此,本公开提供了硅氧碳复合材料及其制备方法、负极原料、负极极片、锂离子电池,能够解决上述技术问题。
具体而言,包括以下的技术方案:
一方面,提供了一种硅氧碳复合材料,所述硅氧碳复合材料包括:内核和外层,所述外层包括:碳包覆层和多个碳凸起;
所述内核为掺杂有金属的硅氧材料;
所述碳包覆层包覆于所述内核外部,所述多个碳凸起形成于所述碳包覆层的外表面上。
本公开实施例提供的硅氧碳复合材料,内核为掺杂有金属的硅氧材料,金属向硅氧材料中的掺杂,使得硅氧材料金属化,利于提高内核的导电性和倍率性能,同时部分掺杂金属能够与硅氧材料中的氧稳定结合,避免氧元素在硅基负极材料电化学嵌锂过程中对锂离子的不可逆损耗,进而提高硅基锂离子电池的可逆容量、首效和循环稳定性。
本公开实施例提供的硅氧碳复合材料,外层包括碳包覆层以及形成于碳包覆层外部的多个碳凸起,该多个碳凸起通过增加外层的比表面积来提高外层与电解液的浸润性,促进硅基负极材料表面的锂离子扩散和电荷转移性能,使得硅氧碳复合材料的界面传荷能力得以增强,这利于提高锂离子电池的倍率性能和循环稳定性。
本公开实施例提供的硅氧碳复合材料同时包括碳元素和金属元素,这样,在制备硅氧碳复合材料时,可以使碳源和金属源以金属-碳源络合物的形式与硅氧材料混合,金属源中的金属原子能与硅氧材料反应以形成掺杂有金属的硅氧材料,碳源能够以金属原子为活性位吸附并沉积于硅氧材料的表面以形成碳包覆层。碳源在硅氧材料表面的这种强沉积吸附作用,利于使碳包覆层均匀地沉积于硅氧材料的表面,形成厚度均匀且致密的碳包覆层。碳包覆层的均匀包覆,能够避免因包覆不均匀而导致的硅在电解液中暴露而发生副反应,提升硅基负极材料的循环稳定性。当用于锂离子电池中时,该厚度均匀的碳包覆层不仅能够有效避免电解液与硅氧材料接触,还能够确保均匀嵌锂,这也利于提高锂离子电池的可逆容量、首效、倍率性能和循环稳定性。
可见,本公开实施例提供的硅氧碳复合材料,基于金属化内核、厚度均匀的碳包覆层、以及分布于碳包覆层外部的多个碳凸起的协同作用,能够显著提高锂离子电池的可逆容量、首效、倍率性能和循环稳定性。
在一些可能的实现方式中,所述碳凸起的尺寸为5nm-50nm;
其中,所述碳凸起的尺寸为所述碳凸起的平行于所述内核表面的方向上的尺寸。
在一些可能的实现方式中,任意相邻的两个碳凸起之间的距离平均差MD<20%;
其中,
在一些可能的实现方式中,所述硅氧碳复合材料的平均粒径D50小于或等于10um;
所述碳包覆层的厚度为1nm-100nm。
对于硅氧碳复合材料,上述各部分尺寸的限定,使得硅氧碳复合材料兼具良好的电学性能和良好的机械性能,且适用于作为负极材料用于负极极片的制作。
在一些可能的实现方式中,所述硅氧材料的化学式为SiO
在一些可能的实现方式中,所述金属包括Li、Na、K、Mg、Cu、Ag、Al中的至少一种。
当金属M选自Li、Na、K、Mg中的至少一种时,该类金属M与部分硅氧材料反应形成硅酸盐,这就使得内核1的材质呈现为硅酸盐/SiO
上述的金属元素M与硅氧材料中的氧结合形成硅酸盐,提前消耗硅氧中的氧,避免在锂离子电池的电化学嵌锂过程中不可逆消耗锂,这对于提升硅基负极材料的可逆容量和首效具有积极的作用。另外,所形成的硅酸盐还具有丰富的锂离子通道,这有利于锂离子的迁移和扩散,对于提升硅基负极材料的倍率性能具有积极的作用。
当金属M选自Cu、Ag、Al中的至少一种时,该类金属M自身以金属络合物的形式与部分硅氧材料反应形成金属M-硅合金,这就使得内核1的材质呈现为金属M-硅合金/SiO
上述的金属元素M与硅氧材料反应形成金属M-硅合金,该金属M-硅合金的电子电导较好,这对于提升硅基负极材料的电子电导率和倍率性能具有重要的意义。
上述各种金属均能够达到提高内核导电性和倍率性能的目的,还能够提高活性锂在内核内部的扩散深度,进而达到提高锂离子电池的可逆容量、首效、倍率性能和循环稳定性的目的。
另一方面,本公开实施例还提供了一种硅氧碳复合材料的制备方法,所述硅氧碳复合材料如上述所示;
所述硅氧碳复合材料的制备方法包括:
使碳源、金属源和硅氧材料在分散溶剂中搅拌第一设定时间,然后进行固液分离处理,得到硅氧碳复合材料的前驱体;其中,所述固液分离处理包括:挥发干燥处理或者蒸馏处理;
在保护气氛下,对所述硅氧碳复合材料的前驱体进行煅烧处理,得到所述硅氧碳复合材料。
本公开实施例提供的硅氧碳复合材料的制备方法,使碳源、金属源和硅氧材料在分散溶剂中充分搅拌均匀,在该过程中,碳源与金属源能够相互络合,形成金属源-碳源络合物,该金属源-碳源络合物均匀地游离于分散溶剂中。
在搅拌完毕后,通过挥发干燥处理或者蒸馏处理来进行固液分离,在该种固液分离方式下,随着分散溶剂的逐渐减少,能够促进分散溶剂中游离的金属源-碳源络合物在硅氧材料表面的逐层堆积,形成结晶团簇,最终形成硅氧碳复合材料的前驱体。该硅氧碳复合材料的前驱体中,金属源-碳源络合物中的金属源能够吸附于硅氧材料的表面,使得该硅氧碳复合材料的前驱体呈现为硅氧材料-金属源-碳源由内至外依次分布的形态。
通过在保护气氛下对硅氧碳复合材料的前驱体进行煅烧处理,金属源会自发地进入硅氧材料内部与其反应并在硅氧材料表面留下空位,而余留的碳源以硅氧材料为内核为中心发生坍塌收缩并进入上述空位内,这样能够形成表面具有凸起的碳层结构。经煅烧处理后,硅氧材料与金属源反应形成硅氧材料金属化的内核,同时,碳层结构碳化形成具有碳包覆层和多个碳凸起的外层。
在一些可能的实现方式中,在持续搅拌的条件下,进行所述固液分离处理,以防止硅氧碳复合材料的前驱体在分散溶剂中沉积,利于提高硅氧碳复合材料的前驱体的分散度,防止发生团簇现象。
在一些可能的实现方式中,所述使碳源、金属源和硅氧材料于分散溶剂中搅拌第一设定时间,包括:
使所述碳源和所述金属源在所述分散溶剂中进行络合反应,以形成含有金属源-碳源络合物的原料体系;
将所述硅氧材料加入至所述原料体系中,搅拌所述第一设定时间。
在一些可能的实现方式中,所述金属源包括Li单质、Na单质、K单质、Mg单质中的至少一种。
在一些可能的实现方式中,所述金属源为含碳的金属络合物。
在一些可能的实现方式中,所述含碳的金属络合物包括甲基锂、酞菁铜、乙酰丙酮铝中的至少一种。
在一些可能的实现方式中,所述分散溶剂包括碳酸二甲酯、四氢呋喃、甲苯、苯、乙醚、环氧丙烷、酮类、乙二醇二甲醚中的至少一种。
在一些可能的实现方式中,所述第一设定时间为3小时~24小时。
在一些可能的实现方式中,所述煅烧处理包括:
在升温速率大于或等于5℃/min的条件下,使所述硅氧碳复合材料的前驱体升温至煅烧温度,在所述煅烧温度下对所述硅氧碳复合材料煅烧第二设定时间。
通过控制煅烧时的升温速率≥5℃/min,能够避免因碳化升温过程过长而导致的硅氧碳复合材料的前驱体中的表面具有凸起的碳层结构在热运动驱动下随机连成一片,进而避免形成非规则的、非均一性的、大小不一的、破碎的碳层,确保形成的外层具有致密的碳包覆层和均匀分布的多个碳凸起,保证外层所带来的优异电化学性能。
在一些可能的实现方式中,所述煅烧温度为400℃~1200℃,所述第二设定时间为0.5h~10h,以确保硅氧材料能够被充分金属化,且确保外层获得期望的形貌结构。
再一方面,还提供了一种负极原料,所述负极原料包括:硅基负极材料、导电剂、粘结剂;
其中,所述硅基负极材料为上述所示的任一种硅氧碳复合材料。
再一方面,还提供了一种负极极片,所述负极极片采用上述的负极原料制备得到。
示例性地,该负极极片的制备方法如下所示:将粘结剂溶解于极性溶剂中,得到胶液;将胶液与硅基负极材料、导电剂混合,并搅拌均匀,得到负极浆料;将负极浆料涂覆在集流体的相对的两个表面,依次经烘干和辊压处理,得到负极极片。
再一方面,还提供了一种锂离子电池,所述锂离子电池包括上述的负极极片。
本公开实施例提供的锂离子电池除了上述负极极片,还包括正极极片、电解液、隔膜、封装层。
其中,电解液填充于负极极片和正极极片之间的空间内,隔膜位于电解液中,用于使负极极片和正极极片相隔离。封装层用于将负极极片、正极极片、电解液、隔膜进行整体封装。
锂离子电池通过锂离子在负极极片和正极极片之间的脱嵌来实现能量的存储和释放,电解液是锂离子在负极极片和正极极片之间传输的载体,隔膜是离子导通但电子绝缘的,利用隔膜来保证锂离子迁移的同时将负极极片和正极极片隔开以防止短路。
附图说明
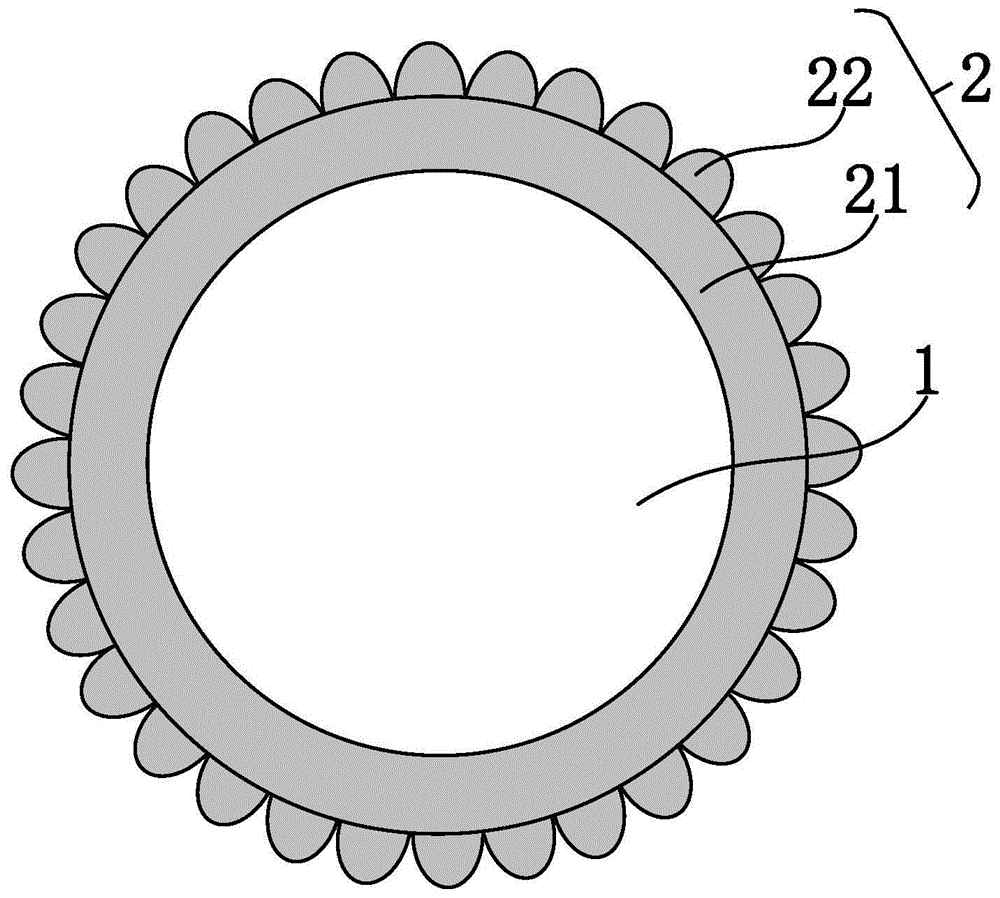
图1为本公开实施例提供的一示例性硅氧碳复合材料的结构示意图;
图2为本公开实施例提供的用于示意硅氧碳复合材料的结构合成机理的第一过程示意图;
图3为本公开实施例提供的用于示意硅氧碳复合材料的结构合成机理的第二过程示意图;
图4为本公开实施例提供的用于示意硅氧碳复合材料的结构合成机理的第三过程示意图;
图5为本公开实施例提供的用于示意硅氧碳复合材料的结构合成机理的第四过程示意图;
图6为本公开实施例提供的用于示意硅氧碳复合材料的结构合成机理的第五过程示意图;
图7为本公开实施例提供的一示例性锂离子电池的结构示意图;
图8为本公开实施例1提供的硅氧碳复合材料的EDS图;
图9为本公开对比例2提供的硅氧碳复合材料的EDS图;
图10为本公开实施例提供的基于常规碳包覆得到的硅氧碳复合材料的在不同放大倍数下的SEM图;
图11为本公开实施例提供的基于常规碳包覆+预锂化得到的硅氧碳复合材料的在不同放大倍数下的SEM图;
图12为本公开实施例提供的基于本公开得到的硅氧碳复合材料的在不同放大倍数下的SEM图。
其中,图10-图12中涉及的SEM图中,S4800指的是扫描电镜的型号,3.0kv指的是扫描电镜的加速电压,8.1mm指的是焦距,10k和50k分别指的是不同的放大倍数,1.00μm和5.00μm分别指的是不同的标尺。
附图标记分别表示:
1-内核,
2-外层,
21-碳包覆层,
22-碳凸起,
100-负极极片,
200-正极极片,
300-电解液,
400-隔膜,
500-封装层。
具体实施方式
为使本公开的技术方案和优点更加清楚,下面将结合附图对本公开实施方式作进一步地详细描述。
硅具有高达4200mAh/g的理论比容量,基于硅的硅基负极材料对于开发高能量密度的锂离子电池具有重要的意义。然而,硅基负极材料具有较大的体积膨胀系数,在锂化/去锂化过程中,硅基负极材料的体积变化量高达300%,这使得在充放电循环过程中,硅基负极材料因上述体积变化引起粉化和粉碎,这制约了锂离子电池的可逆容量、库伦效率和循环稳定性。
举例来说,氧化亚硅材料是一种常见的硅基负极材料,对于开发超大容量锂离子电池具有重要的意义,然而,如上所述,由于硅基负极材料具有较大的体积膨胀系数,另外,硅氧材料中氧含量较高,所以在首次嵌锂过程中会产生较多不可逆容量和较低的库伦效率,该天然劣势造成以氧化亚硅为代表的硅基负极材料目前仍未能得到大规模应用。
相关技术使用碳源在硅氧材料的外部构建碳包覆层,形成碳包覆硅基负极材料,通过碳包覆层来缓解硅的体积效应,以及减少硅与电解液的直接界面接触和副反应,并增加硅的表面电导率,从而减小硅体积膨胀并增加硅基负极材料首效和容量。碳包覆层的构建方法包括:固/液相混合碳化法(例如碳源为沥青、树脂)、气相裂解法(例如碳源为乙炔、甲烷)、乳液聚合法(例如碳源为聚丙烯腈)、高温热解法(例如碳源为聚乙烯醇、聚偏氟乙烯)等。
然而,相关技术在构建碳包覆层时,碳源在硅氧负极材料表面的吸附性较弱,仅有范德华力弱相互作用力,无法实现在硅氧负极材料表面的均一沉积,要么难以获得稳定吸附的碳包覆层,要么使得碳包覆层的厚度不均匀,例如,部分区域较厚,部分区域较薄。这样,相关技术提供的硅氧负极材料用于锂离子电池中时,薄厚不均的碳包覆层容易导致电解液与硅基负极材料接触,造成界面副反应和电解液不断消耗,引起锂离子电池的首次库伦效率(简称首效)较低、循环衰减较快等问题。另外,薄厚不均的碳包覆层还会导致局部嵌锂后应力释放不一致,进而导致硅基负极材料颗粒局部膨胀引起的内应力失衡和颗粒粉化,引起锂离子电池容量较低、首效较低且循环衰减较快等问题。另外,相关技术设计的碳包覆层与电解液的浸润效果较差,导致锂离子电池的界面传荷能力降低和倍率性能较差。
可见,相关技术提供的碳包覆硅基负极材料对锂离子电池的可逆容量、首次库伦效率和循环稳定性的改进效果有限。
根据本公开实施例的一个方面,提供了一种硅氧碳复合材料,如附图1所示,该硅氧碳复合材料包括:内核1和外层2,外层2包括:碳包覆层21和多个碳凸起22。其中,内核1为掺杂有金属的硅氧材料,碳包覆层21包覆于内核1外部,多个碳凸起22形成于碳包覆层21的外表面上。
本公开实施例提供的硅氧碳复合材料,内核1为掺杂有金属的硅氧材料,金属向硅氧材料中的掺杂,使得硅氧材料金属化,利于提高内核1的导电性和倍率性能,同时部分掺杂的金属与硅氧材料中的氧稳定结合,避免氧元素在硅基负极材料电化学嵌锂过程中对锂离子的不可逆损耗,进而提高硅基锂离子电池的可逆容量、首效和循环稳定性。
本公开实施例提供的硅氧碳复合材料,外层2包括碳包覆层21以及形成于碳包覆层21外部的多个碳凸起22,该多个碳凸起22通过增加外层2的比表面积来提高外层2与电解液的浸润性,促进硅基负极材料表面的锂离子扩散和电荷转移性能,使得硅氧碳复合材料的界面传荷能力得以增强,这利于提高锂离子电池的倍率性能和循环稳定性。
本公开实施例提供的硅氧碳复合材料同时包括碳元素和金属元素,这样,在制备硅氧碳复合材料时,可以使碳源和金属源以金属-碳源络合物的形式与硅氧材料混合,金属源中的金属原子能与硅氧材料反应以形成掺杂有金属的硅氧材料,碳源能够以金属原子为活性位吸附并沉积于硅氧材料的表面以形成碳包覆层21。碳源在硅氧材料表面的这种强沉积吸附作用,利于使碳包覆层21均匀地沉积于硅氧材料的表面,形成厚度均匀且致密的碳包覆层21。碳包覆层21的均匀包覆,能够避免因包覆不均匀而导致的硅在电解液中暴露而发生副反应,提升硅基负极材料的循环稳定性。当用于锂离子电池中时,该厚度均匀的碳包覆层21不仅能够有效避免电解液与硅氧材料接触,还能够确保均匀嵌锂,这也利于提高锂离子电池的容量、首效、倍率性能和循环稳定性。
可见,本公开实施例提供的硅氧碳复合材料,基于金属化内核1、厚度均匀的碳包覆层21、以及分布于碳包覆层21外部的多个碳凸起22的协同作用,能够显著提高锂离子电池的可逆容量、首效、倍率性能和循环稳定性。
本公开实施例中,硅氧碳复合材料的平均粒径D50小于或等于10um,其中,硅氧碳复合材料的平均粒径D50是通过在电子显微镜下对硅氧碳复合材料整体进行观察后得到的尺寸,该平均粒径D50指的是粒度分布曲线中累积分布为50%时的最大颗粒的等效直径。举例来说,硅氧碳复合材料的平均粒径D50为1um-10um,进一步举例来说,该硅氧碳复合材料的平均粒径D50包括但不限于:1um、2um、3um、4um、5um、6um、7um、8um、9um、10um等。
在一些示例中,碳包覆层21的厚度为1nm-100nm,其中,碳包覆层21的厚度为碳包覆层21的沿内核1的直径方向上的尺寸。举例来说,该碳包覆层21的厚度包括但不限于:1nm、10nm、15nm、20nm、25nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm、100nm等。
多个碳凸起22均匀分布于碳包覆层21的外部,使得碳包覆层21的外部表面呈现凹凸不平状,示例性地,碳凸起22的结构包括但不限于:弧形凸块状、圆锥或棱锥等锥形凸块状、圆柱或棱柱等柱形凸块状等多种几何形状。碳凸起22的在碳包覆层21上的结构布置,能够改善硅氧碳复合材料与电解液的接触面积,且利于深层嵌锂。
在一些示例中,碳凸起22的尺寸为5nm-50nm;其中,该碳凸起22的尺寸为碳凸起22的沿内核1的表面的方向上的尺寸。
在内核1的直径方向上,碳凸起22上各位置处的上述尺寸可能会发生改变,但是仍然会保持在上述5nm-50nm范围内。举例来说,碳凸起22的尺寸为10nm-50nm、20nm-50nm、30nm-50nm、40nm-50nm、10nm-20nm、10nm-30nm、10nm-40nm、20nm-30nm、20nm-40nm等,进一步地,碳凸起22的尺寸包括但不限于5nm、10nm、10nm、15nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm等。
进一步地,任意相邻的两个碳凸起22之间的距离平均差MD<20%,其中,
对于硅氧碳复合材料,上述各部分尺寸的限定,使得硅氧碳复合材料兼具良好的电学性能和良好的机械性能,且适用于作为负极材料用于负极极片的制作。
本公开实施例中,碳包覆层21均匀分布于内核1的外表面,且碳包覆层21至少具有以下优点:
碳包覆层21具有一定的机械强度,能够保证在活性硅脱嵌锂过程中硅氧颗粒的完整性,抑制硅氧颗粒粉化,提升结构稳定性,从整体上改善锂离子电池的循环性能。碳包覆层21足够致密,使得电解液无法通过该碳包覆层21而与硅氧材料相接触,抑制电解液与硅氧材料副反应的发生。碳包覆层21具有良好的导电性,能极大地改善活性硅氧得失电子的能力,提升硅氧材料脱嵌锂效率,促进容量发挥以及深层嵌锂,提升锂离子电池的可逆容量和首效。
对于包括碳包覆层21和碳凸起22的外层2,其材质为碳质,也就是说,该外层2的制备原料至少包括碳元素,进一步地,该外层2的制备原料还可以进一步包括掺杂元素,以进一步提高外层2的导电性和稳定性。
在一些示例中,外层2的制备原料包括:碳和掺杂元素,其中,掺杂元素的重量百分比小于或等于5%。举例来说,该掺杂元素包括但不限于N元素、P元素、F元素等,上述掺杂元素不仅能够提高外层2的导电性,还能够降低内核1表面锂离子迁移能垒,提高锂离子的迁移效率。
对于内核1,其为掺杂有金属的硅氧材料,根据具体金属种类的不同,金属与硅氧材料之间可以有不同配合形式,例如存在一些金属,其更倾向于与二氧化硅反应生成硅酸盐;例如,还存在这么一些金属,其更倾向于与硅单质反应生成合金。
在一些示例中,金属包括Li、Na、K、Mg、Cu、Ag、Al中的至少一种。
其中,当金属M选自Li、Na、K、Mg、Al中的至少一种时,该类金属M与至少部分硅氧材料反应形成硅酸盐,这就使得内核1的材质呈现为硅酸盐/SiO
上述的金属元素M与硅氧材料中的氧结合形成硅酸盐,提前消耗硅氧中的氧,避免在锂离子电池的电化学嵌锂过程中不可逆消耗锂,这对于提升硅基负极材料的可逆容量和首效具有积极的作用。另外,所形成的硅酸盐还具有丰富的锂离子通道,这有利于锂离子的迁移和扩散,对于提升硅基负极材料的倍率性能具有积极的作用。
当金属M选自Cu、Ag中的至少一种时,该类金属M自身以金属络合物的形式与部分硅氧材料反应形成金属M-硅合金,这就使得内核1的材质呈现为金属M-硅合金/SiO
上述的金属元素M与硅氧材料反应形成金属M-硅合金,该金属M-硅合金的电子电导较好,这对于提升硅基负极材料的电子电导率和倍率性能具有重要的意义。
上述各种金属均能够达到提高内核1导电性和倍率性能的目的,还能够提高活性锂在内核1内部的扩散深度,进而达到提高锂离子电池的可逆容量、首效、倍率性能和循环稳定性的目的。
关于上述各种金属能提高活性锂在内核1内部的扩散深度,这是因为活性锂在内核1内部的扩散深度与内核1的锂离子扩散系数有关,锂离子的扩散系数越高,在同样的驱动力下,锂离子的扩散深度越高。在本公开中,如若金属与硅氧材料形成硅酸盐,硅酸盐具有多维锂离子扩散通道,进而能达到提高锂离子扩散系数的目的;如若金属与硅氧材料形成合金,则合金的电导率增加,电荷传递阻抗减小,锂离子扩散阻力减小,也能够达到提高锂离子扩散系数的目的。
本公开实施例中,所涉及的硅氧材料的化学式为SiO
在一些示例中,本公开实施例提供的硅氧材料为粉末状,硅氧材料的平均粒径D50小于或等于10μm,这包括但不限于:小于或等于9.5μm、小于或等于9μm、小于或等于8μm、小于或等于7μm、小于或等于6μm、小于或等于5μm等。
根据本公开实施例的另一个方面,还提供了一种硅氧碳复合材料的制备方法,该硅氧碳复合材料的制备方法包括:
步骤1:使碳源、金属源和硅氧材料在分散溶剂中搅拌第一设定时间,然后进行固液分离处理,得到硅氧碳复合材料的前驱体。其中,该固液分离处理包括:挥发干燥处理或者蒸馏处理。
步骤2:在保护气氛下,对硅氧碳复合材料的前驱体进行煅烧处理,得到硅氧碳复合材料。
在一些示例中,硅氧材料(例如氧化亚硅)与金属源的摩尔比为1:0.05~1:1(例如,1:0.05、1:0.1、1:0.2、1:0.3、1:0.4、1:0.5、1:0.6、1:0.7、1:0.8、1:0.9、1:1等);
在一些示例中,硅氧材料(例如氧化亚硅)与碳源的摩尔比为1:0.05~1:0.5(例如,1:0.05、1:0.1、1:0.2、1:0.3、1:0.4、1:0.5等);
在一些示例中,硅氧材料(例如氧化亚硅)与分散溶剂的质量比为1:0.5~1:1(例如,1:0.05、1:0.1、1:0.2、1:0.3、1:0.4、1:0.5、1:0.6、1:0.7、1:0.8、1:0.9、1:1等)。
以上各原料的配比在上述范围内,利于获得合适厚度尺寸的碳质外层。
本公开实施例提供的硅氧碳复合材料的制备方法,使碳源、金属源和硅氧材料在分散溶剂中充分搅拌均匀,在该过程中,碳源与金属源能够相互络合,形成金属源-碳源络合物,该金属源-碳源络合物均匀地游离于分散溶剂中。
在搅拌完毕后,通过挥发干燥处理或者蒸馏处理来进行固液分离,在该种固液分离方式下,随着分散溶剂的逐渐减少(即,分散溶剂缓慢地减少),能够促进分散溶剂中游离的金属源-碳源络合物在硅氧材料表面的逐层堆积,形成结晶团簇,最终形成硅氧碳复合材料的前驱体。该硅氧碳复合材料的前驱体中,金属源-碳源络合物中的金属源能够吸附于硅氧材料的表面,使得该硅氧碳复合材料的前驱体呈现为硅氧材料-金属源-碳源由内至外依次分布的形态。
通过在保护气氛下对硅氧碳复合材料的前驱体进行煅烧处理,金属源会自发地进入硅氧材料内部与其反应并在硅氧材料表面留下空位,而余留的碳源以硅氧材料为内核为中心发生坍塌收缩并进入上述空位内,这样能够形成表面具有凸起的碳层结构。经煅烧处理后,硅氧材料与金属源反应形成硅氧材料金属化的内核,同时,碳层结构碳化形成具有碳包覆层和多个碳凸起的外层。
本公开实施例中,使碳源、金属源和硅氧材料在分散溶剂中搅拌第一设定时间,示例性地,该第一设定时间为3小时~24小时,例如,这包括但不限于3小时、5小时、7小时、8小时、10小时、13小时、15小时、17小时、20小时、22小时、24小时等。在该时间范围内,碳源与金属源充分络合,形成期望的金属源-碳源络合物,并且,使硅氧材料的表面充分吸附金属源-碳源络合物,形成高分散度的硅氧碳复合材料的前驱体。
在一些示例中,碳源、金属源和硅氧材料在分散溶剂中进行搅拌时的温度在室温至60℃,例如室温为20℃-28℃。
本公开实施例中,挥发干燥或者蒸馏处理可以采用多种方式进行,只要确保分散溶剂在去除过程中,不会将吸附于硅氧材料的碳源携带出去即可。例如,在常温下自然挥发干燥、或者,在一定温度下鼓风辅助挥发干燥,或者,在一定温度下抽真空辅助挥发干燥等。
进一步地,本公开实施例中,该固液分离还包括:抽滤处理或者烘干处理,该抽滤处理或者烘干处理被配置为用于提高固液分离的效率,且不会影响碳源在硅氧材料表面上的堆叠吸附。
在一些示例中,可以在挥发干燥或者蒸馏处理之前,先进行一定时间的抽滤处理或者烘干处理,以除去大部分的富裕的溶剂,然后利用挥发干燥或者蒸馏处理来对剩余部分的分散溶剂进行去除,例如,当溶剂的量被分离为剩余一半时,再进行挥发干燥或者蒸馏处理。
在另一些示例中,可以在挥发干燥或者蒸馏处理之后,确保碳源已经完全堆叠吸附于硅氧材料表面后,再利用抽滤处理或者烘干处理将残余的分散溶剂进行去除。
可见,上述抽滤处理或者烘干处理,首先确保了碳源在硅氧材料表面上充分堆叠吸附,其次提高了固液分离的效率。
本公开实施例在进行固液分离时,通过挥发干燥处理或者蒸馏处理步骤来辅助及促进碳源在硅氧材料表面的堆叠,而不是完全地通过常规的过滤手段(例如,减压过滤、抽吸过滤、热过滤等)来进行固液分离,这是因为,研究发现,如若固液分离全程使用上述常规的过滤手段,则不会在碳包覆层上形成凸起雏形(即碳凸起)。当采用常规过滤手段时,分散溶剂由初始的充足状态在短时间内达到去除状态,在分散溶剂的快速流失过程中,将导致完全分散于分散溶剂中的碳源随着分散溶剂的流动而流动,例如,芳香族化合物等碳源在初始状态下完全分散溶解于分散溶剂中,随着分散溶剂的快速去除,碳源随之流动而不会自发性地形成π-π共轭结晶堆积并从分散溶剂中析出,因此,无法在硅氧材料的表面形成堆叠的结晶团簇,进而无法在煅烧处理后在碳包覆层合成碳凸起这种特殊形貌。而采用本公开实施例上述的固液分离手段,则有效避免了上述技术问题,有效促进了碳凸起的形成。
在一些可能的实现方式中,在持续搅拌的条件下,进行上述的固液分离处理,以防止硅氧碳复合材料的前驱体在分散溶剂中沉积,利于提高硅氧碳复合材料的前驱体的分散度,防止发生团簇现象。
本公开实施例中,所涉及的所有搅拌过程的实现方式包括但不限于:磁力搅拌、搅拌桨搅拌等。
在一些可能的实现方式中,使碳源、金属源和硅氧材料于分散溶剂中搅拌第一设定时间,包括:使碳源和金属源在分散溶剂中进行络合反应,以形成含有金属源-碳源络合物的原料体系;将硅氧材料加入至原料体系中,搅拌第一设定时间。
金属源和碳源采用金属源-碳源络合物的形式和硅氧材料混合,当它们加入至分散溶剂中并搅拌一定时间后,金属源-碳源络合物中的金属源能够吸附于硅氧材料的表面,使得硅氧碳复合材料的前驱体呈现为硅氧材料-金属源-碳源由内至外依次分布的形态。
本公开实施例中,碳源包括但不限于:醚类、醇类、羧酸类、酮类、芳香族化合物、聚合物等,例如,聚合物包括但不限于:聚乙二醇、聚丙烯酸等。举例来说,芳香族化合物包括但不限于:联苯、三联苯、萘、蒽、菲、芘、并四苯及它们的支链修饰产物衍生物,例如,这些修饰产物为被以下基团所修饰的芳香族类化合物:烷烃基团、醇类基团、氮化物基团、硫化物基团、醚类基团、酮类基团、酯类基团等。
(1)在一些实现方式中,金属源包括Li单质、Na单质、K单质、Mg单质中的至少一种。
上述金属是能够实现“金属溶剂化”的金属元素,该类金属源和碳源均能够充分溶解于分散溶剂中,在分散溶剂提供的溶剂环境中,碳源中的活性基团能够与金属源中的金属发生络合作用,形成金属源-碳源络合物。
以下以金属源为Li单质,碳源为芳香族化合物,硅氧材料为氧化亚硅(SiO)为例,来说明硅氧碳复合材料的结构的形成机理:
如附图2所示,在分散溶剂提供的溶剂环境中,芳香族化合物与金属锂接触并发生络合反应,形成具有金属锂端与芳香族碳端的金属源-碳源络合物,其中,金属锂作为内核的掺杂元素,芳香族碳端作为碳源。
如附图3所示,金属源-碳源络合物在分散溶剂中与SiO材料接触后,其金属锂端吸附于SiO材料的表面,形成硅氧碳复合材料的前驱体并且使其呈现为SiO-Li-芳香族化合物由内至外依次分布的形态。在该硅氧碳复合材料的前驱体中,各分子间的相互作用根据分子间取向不同而发生改变,其中,金属锂端吸附于SiO材料的表面之后,芳香族化合物分子的取向一致,并且不同的芳香族化合物分子相互之间互为侧面方向,使得不同的芳香族化合物分子相互排斥,使得在SiO材料的表面形成各自相对独立的吸附结构,有效防止芳香族化合物在SiO材料的表面发生团簇,使其均匀分布于SiO材料的表面,这利于后续获得厚度均匀的碳包覆层。
如附图4所示,以吸附于SiO材料表面的金属源-碳源络合物作为基层,其余的金属源-碳源络合物在基层的表面进行吸附堆叠,以此类推,金属源-碳源络合物依次堆叠,形成“SiO-Li-芳香族-Li-芳香族-Li-芳香族…”的堆叠结构。由于芳香族化合物分子相对于SiO材料体积较小,使得其堆叠方向多变且不规则,实现随机堆叠生长。
如附图5所示,受电位差影响,金属源-碳源络合物(即,Li-芳香族络合物)的电位介于金属锂与SiO材料之间,因此,金属源-碳源络合物的金属锂端的锂会自发地进入SiO材料内部,锂进入SiO材料内部后在SiO材料的表面留下空位,这样,剩余芳香族化合物作为碳源进入空位,使得芳香族化合物以基层中心发生坍塌收缩,形成表面具有凸起的碳层结构。
如附图6所示,在煅烧过程(即高温碳化过程)中,SiO材料与锂反应形成硅酸锂盐,形成掺杂有金属的硅氧材料材质的内核(该内核的材质呈现为硅酸锂盐/SiO/Si/SiO
(2)在另一些实现方式中,金属源为含碳的金属络合物,例如,该含碳的金属络合物包括甲基锂、酞菁铜、乙酰丙酮铝中的至少一种。以甲基锂举例来说,其具有锂元素作为金属源,以甲基基团作为碳源。
在该种实现方式中,直接筛选含碳的金属络合物成品作为金属源,不仅能够提供金属源,还能够提供碳源。该类含碳的金属络合物中的金属与硅氧材料反应,能够形成金属-硅合金。在一些示例中,本申请所使用的碳源也为上述含碳的金属络合物,也就是说,利用含碳的金属络合物同时提供金属源和碳源。
本公开实施例利用分散溶剂来提供溶剂环境,在一些可能的实现方式中,该分散溶剂包括碳酸二甲酯、四氢呋喃、甲苯、苯、乙醚、环氧丙烷、酮类、乙二醇二甲醚中的至少一种。例如,酮类包括但不限于丙酮等。
本公开实施例中,可以通过以下反应条件中的至少一种可以控制碳包覆层的径向厚度:金属源和碳源的浓度、碳源与硅氧材料的比例、反应时间等;
可以通过以下反应条件中的至少一种可以控制碳凸起的径向尺寸:金属源和碳源的种类(这是因为不同的金属源和碳源影响其分子电荷和相互作用力,进而影响碳源在硅氧材料表面的堆积形貌)、反应时间、反应温度等。
对于步骤2,在保护气氛下,对硅氧碳复合材料的前驱体进行煅烧处理,得到硅氧碳复合材料。在一些示例中,该煅烧处理包括:在升温速率大于或等于5℃/min的条件下,使硅氧碳复合材料的前驱体升温至煅烧温度,在煅烧温度下对硅氧碳复合材料煅烧第二设定时间。
举例来说,升温速率为5℃/min-10℃/min,进一步举例来说,这包括但不限于:5.2℃/min、5.5℃/min、5.8℃/min、6℃/min、6.5℃/min、7℃/min、8℃/min、9℃/min、10℃/min等。
通过控制煅烧时的升温速率≥5℃/min,能够避免因碳化升温过程过长而导致的硅氧碳复合材料的前驱体中的表面具有凸起的碳层结构在热运动驱动下随机连成一片,进而避免形成非规则的、非均一性的、大小不一的、破碎的碳层,确保形成的外层具有致密的碳包覆层和均匀分布的多个碳凸起,保证外层所带来的优异电化学性能。另外,为了提高煅烧过程的安全性,在升温过程中可以布置一些防止飞温的措施。
为了确保硅氧材料能够被充分金属化,且确保外层获得期望的形貌结构,本公开实施例使煅烧温度为400℃~1200℃,第二设定时间,也就是煅烧时间为0.5h~10h。
举例来说,煅烧温度包括但不限于:400℃、500℃、600℃、700℃、800℃、900℃、1000℃、1100℃、1200℃等,煅烧时间包括但不限于:0.5h、1h、2h、3h、4h、5h、6h、7h、8h、9h、10h等。
上述煅烧过程在保护气氛下进行,该保护气氛所使用的惰性气体只要不与金属源和碳源发生反应即可,例如,该惰性气体包括但不限于:氩气、氮气等。对于该保护气氛,要求其中的O
在一些示例中,在提供有上述保护气氛的烧成炉中进行上述煅烧过程。
根据本公开实施例的又一个方面,本公开实施例还提供了一种负极原料,该负极原料包括硅基负极材料、导电剂、粘结剂;其中,硅基负极材料为本公开实施例上述所示的任一种硅氧碳复合材料。
在一些示例中,导电剂在负极原料中的重量百分比为0.02%-2%,例如这包括但不限于:0.05%、0.08%、0.1%、0.15%、0.2%、0.25%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、1.5%等。适用的导电剂只要不提供额外的可逆容量,不会引起额外的化学反应,且具有电子传导性则即可,在一些示例中,导电剂包括但不限于:导电石墨、导电炭黑、乙炔黑、碳纳米管、石墨烯中的至少一种。使用上述导电剂,能够达到降低负极极片阻抗,提高倍率性能的目的。
粘结剂能够保证粘接性且能够抑制硅活性材料的膨胀,同时降低负极极片的内阻,在一些示例中,粘结剂包括但不限于:聚酰亚胺类、聚醚酰亚胺类、聚丙烯酸类、聚乙烯醇类、聚丙烯腈类等。在一些示例中,粘结剂在负极原料中的重量百分比为0.05%-5%,例如这包括但不限于:0.05%、0.1%、0.5%、0.6%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、等;
硅基负极材料为余量,即,硅基负极材料的量使得粘结剂、硅基负极材料、导电剂的总重量百分比为100%。
根据本公开实施例的再一个方面,本公开实施例还提供了一种负极极片,该负极极片采用上述的负极原料制备得到。
示例性地,该负极极片的制备方法如下所示:将粘结剂溶解于极性溶剂中,得到胶液;将胶液与硅基负极材料、导电剂混合,并搅拌均匀,得到负极浆料;将负极浆料涂覆在集流体的相对的两个表面,依次经烘干和辊压处理,得到负极极片。
为了提高负极极片的质量,可以对负极浆料进行脱泡过筛,然后再将负极浆料涂覆在集流体的相对的两个表面。
示例性地,集流体包括但不限于:铜箔、铜网、涂碳铜箔、不锈钢箔、不锈钢网、涂碳不锈钢箔、镍箔的至少一种。
示例性地,极性溶剂包括但不限于:N-甲基吡咯烷酮、二甲基乙酰胺、N,N-二甲基甲酰胺、二甲基亚砜、环己酮中的至少一种。
根据本公开实施例的再一个方面,本公开实施例还提供了一种锂离子电池,该锂离子电池包括上述的负极极片。
基于使用了本公开实施例提供的上述负极极片,使得锂离子电池具有较高的可逆容量、首效、倍率性能和较强的循环稳定性。
本公开实施例提供的锂离子电池,如附图7所示,该锂离子电池除了包括上述负极极片100,还包括正极极片200、电解液300、隔膜400、封装层500。
其中,电解液300填充于负极极片100和正极极片200之间的空间内,隔膜400位于电解液300中,用于使负极极片100和正极极片200相隔离。封装层500用于将负极极片100,还包括正极极片200、电解液300、隔膜400进行整体封装。
锂离子电池通过锂离子在负极极片100和正极极片200之间的脱嵌来实现能量的存储和释放,电解液300是锂离子在负极极片100和正极极片200之间传输的载体,隔膜400是离子导通但电子绝缘的,利用隔膜400来保证锂离子迁移的同时将负极极片100和正极极片200隔开以防止短路。
正极极片包括正极活性材料、导电剂、集流体和正极粘结剂,其中,正极活性材料可选自含锂的层状金属氧化物、含锂的尖晶石结构金属氧化物、锂金属磷酸盐、锂金属氟化硫酸盐以及锂金属钒酸盐中的至少一种。
举例来说,含锂的层状金属氧化物包括但不限于:钴酸锂(LiCoO
正极极片所使用的导电剂包括但不限于:导电石墨、导电炭黑、乙炔黑、碳纳米管、石墨烯中的至少一种。
下面将通过更具体的实施例进一步地描述本公开,虽然下面描述了一些具体的实施方式,然而应该理解,可以以各种形式实现本公开而不应被这里阐述的实施例所限制。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行,所用试剂或仪器未注明生产厂商者,均可以为可以通过市购获得的常规产品。以下各实施例涉及的硅氧材料均为SiO原料。
实施例1
本实施例1提供了一种硅氧碳复合材料,该硅氧碳复合材料通过以下方法制备得到:
使1g的金属锂和5g的联苯均匀分散于10g的乙二醇二甲醚中,磁力搅拌均匀后,在乙二醇二甲醚中形成锂-联苯络合物。继续向原料体系中加入10g的SiO原料,磁力搅拌12小时,然后在室温下通过挥发干燥方式去除乙二醇二甲醚,得到硅氧碳复合材料的前驱体。
在氩气气氛下,对硅氧碳复合材料的前驱体进行煅烧处理,得到实施例1期望的硅氧碳复合材料。其中,该煅烧处理包括:在升温速率为5℃/min的条件下,使硅氧碳复合材料的前驱体升温至900℃,在900℃下对硅氧碳复合材料煅烧2小时。
实施例2
本实施例2提供了一种硅氧碳复合材料,该硅氧碳复合材料通过以下方法制备得到:
使1g的金属锂和5g的4,4'-二甲基联苯均匀分散于10g的乙二醇二甲醚中,磁力搅拌均匀后,在乙二醇二甲醚中形成锂-二甲基联苯络合物。继续向原料体系中加入10g的SiO原料,磁力搅拌15小时,然后在室温下通过挥发干燥方式去除乙二醇二甲醚,得到硅氧碳复合材料的前驱体。
在氩气气氛下,对硅氧碳复合材料的前驱体进行煅烧处理,得到实施例2期望的硅氧碳复合材料。其中,该煅烧处理包括:在升温速率为5.5℃/min的条件下,使硅氧碳复合材料的前驱体升温至900℃,在900℃下对硅氧碳复合材料煅烧2小时。
实施例3
本实施例3提供了一种硅氧碳复合材料,该硅氧碳复合材料通过以下方法制备得到:
使1g的金属锂和3g的联苯均匀分散于10g的四氢呋喃中,磁力搅拌均匀后,在乙二醇二甲醚中形成锂-联苯络合物。继续向原料体系中加入10g的SiO原料,磁力搅拌12小时,然后在室温下通过蒸馏方式去除乙二醇二甲醚,得到硅氧碳复合材料的前驱体。
在氩气气氛下,对硅氧碳复合材料的前驱体进行煅烧处理,得到实施例3期望的硅氧碳复合材料。其中,该煅烧处理包括:在升温速率为6℃/min的条件下,使硅氧碳复合材料的前驱体升温至950℃,在950℃下对硅氧碳复合材料煅烧2小时。
实施例4
本实施例4提供了一种硅氧碳复合材料,该硅氧碳复合材料通过以下方法制备得到:
使1g的金属锂和5g的联苯均匀分散于10g的乙二醇二甲醚中,磁力搅拌均匀后,在乙二醇二甲醚中形成锂-联苯络合物。继续向原料体系中加入10g的SiO原料,磁力搅拌13小时,然后在室温下通过挥发干燥方式去除乙二醇二甲醚,得到硅氧碳复合材料的前驱体。
在氩气气氛下,对硅氧碳复合材料的前驱体进行煅烧处理,得到实施例4期望的硅氧碳复合材料。其中,该煅烧处理包括:在升温速率为5.8℃/min的条件下,使硅氧碳复合材料的前驱体升温至500℃,在500℃下对硅氧碳复合材料煅烧6小时。
实施例5
本实施例5提供了一种硅氧碳复合材料,该硅氧碳复合材料通过以下方法制备得到:
使1g的金属钠和5g的联苯均匀分散于10g的乙二醇二甲醚中,磁力搅拌均匀后,在乙二醇二甲醚中形成钠-联苯络合物。继续向原料体系中加入10g的SiO原料,磁力搅拌13小时,然后在室温下通过挥发干燥方式去除乙二醇二甲醚,得到硅氧碳复合材料的前驱体。
在氩气气氛下,对硅氧碳复合材料的前驱体进行煅烧处理,得到实施例5期望的硅氧碳复合材料。其中,该煅烧处理包括:在升温速率为5.5℃/min的条件下,使硅氧碳复合材料的前驱体升温至900℃,在900℃下对硅氧碳复合材料煅烧3小时。
实施例6
本实施例6提供了一种硅氧碳复合材料,该硅氧碳复合材料通过以下方法制备得到:
使1g的酞菁铜和5g的联苯均匀分散于10g的乙二醇二甲醚中,磁力搅拌均匀后,在乙二醇二甲醚中形成酞菁铜-联苯络合物。继续向原料体系中加入10g的SiO原料,磁力搅拌12小时,然后在室温下通过蒸馏方式去除乙二醇二甲醚,得到硅氧碳复合材料的前驱体。
在氩气气氛下,对硅氧碳复合材料的前驱体进行煅烧处理,得到实施例6期望的硅氧碳复合材料。其中,该煅烧处理包括:在升温速率为7℃/min的条件下,使硅氧碳复合材料的前驱体升温至1000℃,在1000℃下对硅氧碳复合材料煅烧2小时。
实施例7
本实施例7提供了一种硅氧碳复合材料,该硅氧碳复合材料通过以下方法制备得到:
使1g的乙酰丙酮铝和5g的联苯均匀分散于10g的乙二醇二甲醚中,磁力搅拌均匀后,在乙二醇二甲醚中形成乙酰丙酮铝-联苯络合物。继续向原料体系中加入10g的SiO原料,磁力搅拌12小时,然后在室温下通过挥发干燥方式去除乙二醇二甲醚,得到硅氧碳复合材料的前驱体。
在氩气气氛下,对硅氧碳复合材料的前驱体进行煅烧处理,得到实施例7期望的硅氧碳复合材料。其中,该煅烧处理包括:在升温速率为8℃/min的条件下,使硅氧碳复合材料的前驱体升温至1100℃,在1100℃下对硅氧碳复合材料煅烧1小时。
对比例1
本对比例1提供了SiO原料,该SiO原料未作任何处理。
对比例2
本对比例2提供了一种无任何金属掺杂的硅氧碳复合材料,其通过以下方法制备得到:
将5g的联苯溶解于10g的乙二醇二甲醚中,待联苯完全溶解后,向原料体系中加入10g的SiO原料,磁力搅拌12h后,常温挥发干燥后,在Ar气气氛下,于900℃温度下煅烧处理后2h,得到硅氧碳复合材料。
对比例3
本对比例3提供了一种采用化学气相沉积法获得碳包覆层的硅氧碳复合材料,其通过以下方法制备得到:
将SiO原料置于管式炉中,抽真空置换管内空气为惰性气体N
测试例
本测试例通过扣电测试来测试上述硅氧碳复合材料和SiO原料对于扣式电池的首效和可逆容量的提升效果,通过微量碳、扫描电子显微镜(Scanning ElectronMicroscope,SEM)和能谱仪(Energy Dispersive Spectrometer,EDS)来获取各硅氧碳复合材料的碳层包覆及均一性。其中,扣电测试中所涉及的充放电制度如下所示:以0.05C恒流放电至10mV,然后以0.02C恒流放电至5mV;以0.05C恒流充电至1.5V;其中1C的标准为1500mAh/g。
测试结果参见表1:
表1
表1中,Rate@0.1C、Rate@0.2C、Rate@0.5C指的是在不同恒流放电测试下的对应的倍率,取相应的0.1C,0.2C,0.5C恒流放电段的可逆容量与第一次0.05C恒流放电段的可逆容量相比,得到百分比数值即为上述倍率数据。
由表1可知,对比例1和对比例2提供的材料的碳含量均在0.45%左右,碳含量较低,且从SEM电镜图和EDS元素分布中也没有发现碳层。这是因为对比例2中,有机碳源无法有效沉积于SiO的表面,因而无法形成稳定的碳包覆层。
而实施例1-实施例7提供的硅氧碳复合材料,通过本公开实施例提供的方法制备得到,使得硅氧碳复合材料的碳含量得以有效提升,结合EDS元素分布结构,证实实施例1-实施例7提供的硅氧碳复合材料的硅氧材料表面均已经覆盖了碳质外层。
附图8示例了实施例1提供的硅氧碳复合材料的EDS图,其表征了碳元素、氧元素和硅元素在硅氧碳复合材料中的分布状态,由图8中的C kαl-2图像可知,其中的碳元素即为其中均匀分布的白色亮点,可见,在同样的碳源含量下,金属源和碳源络合后在硅氧材料表面的沉积量和成炭率更高,并且,金属碳源形成的碳包覆层更加均匀。
附图9示例了对比例2提供的硅氧碳复合材料的EDS图,其表征了碳元素、氧元素和硅元素在硅氧碳复合材料中的分布状态,由图9中的C kαl-2图像可知,其中的碳元素信号不明显,这表明对比例2中的碳源在硅氧材料的沉积量较低,也不能形成均匀的碳包覆层。
附图10示例了基于常规碳包覆得到的硅氧碳复合材料的在不同放大倍数下的SEM图,其中,该硅氧碳复合材料为对比例3提供的硅氧碳复合材料。
附图11示例了基于常规碳包覆+预锂化得到的硅氧碳复合材料的在不同放大倍数下的SEM图,其中,该硅氧碳复合材料为市购的硅氧碳复合材料商品。
附图12示例了基于本公开实施例得到的硅氧碳复合材料的在不同放大倍数下的SEM图,其中,该硅氧碳复合材料为实施例1提供的硅氧碳复合材料。
由图10-图12所示,常规碳包覆和常规碳包覆+预锂化对应的硅氧碳复合材料中,部分硅氧材料的表面并未得到完整的碳包覆层,使得部分硅氧材料的表面裸露(这容易暴露在电解液中从而发生较多副反应),而本公开实施例提供的硅氧碳复合材料得到了完整且致密的碳包覆层,另外,本公开实施例提供的硅氧碳复合材料还能够观察到明显的突触形貌状的碳凸起。
由表1可知,实施例1-实施例7提供的硅氧碳复合材料的首效相比对比例1-3也得以有效提升,这表明基于本公开实施例提供的方法制备得到的硅氧碳复合材料,使得金属源与碳源均发挥了积极作用。
实施例2与实施例1相比改变了有机碳源种类,可见,通过改变碳源的种类也利于提高硅氧碳复合材料的碳含量,这也暗示了有机碳源与有机溶剂之间存在优化的可能性,通过对同类有机物进行选择和搭配,利于获得综合性能更佳的硅氧碳复合材料。
实施例3与实施例1相比减少有机碳源的使用量,然而实施例3提供的硅氧碳复合材料的碳含量并没有显著的下降,这说明同种有机碳源的沉积量具有极限值,多余的碳源部分还分散在分散溶剂中,可以通过诸如过滤等方式收集残留的碳源进行循环利用,降低物耗成本。
实施例4与实施例1相比,其煅烧温度降低,虽然会对硅氧碳复合材料的综合性能有一定的影响,这是由于不同温度造成歧化程度不同引起的,但是,硅氧碳复合材料的碳含量差异并不大,这证实了下相对低温下进行煅烧也是可行的。
利用实施例5证实了利用同类碱金属钠作为金属源也能实现基本相同的效果,因为钠的原子量和锂的原子量的不同,金属钠在对于硅氧碳复合材料的可逆容量和首效提升效果上略低于金属锂,但是,硅氧碳复合材料的碳含量依然有显著的提升。
实施例6和实施例7均采用含碳的金属络合物来合成硅氧碳复合材料,含碳的金属络合物对于碳含量的提升同样起到积极的作用,这表明含碳的金属络合物的直接利用是可行的,并且还能够解决一些金属的难以分散的问题,例如,Cu、Al等金属无法通过溶解块体金属的方式合成金属源-碳源络合物。
针对对比例3和实施例1的不同倍率下的嵌锂性能测试,结果表明,即使在相似碳包覆量条件下,实施例1提供的硅氧碳复合材料的倍率性能相对于对比例3提供的硅氧碳复合材料的倍率性能得以明显提升。这是因为实施例1提供的硅氧碳复合材料中,外层不仅包括碳包覆层,还进一步地具有形成于碳包覆层表面的碳凸起,这能够增加硅氧碳复合材料的碳质外层和电解液的浸润性,促进锂离子的界面传输。
对于本公开实施例所使用的术语“每个”、“多个”及“任一”等,多个包括两个或两个以上,每个是指对应的多个中的每一个,任一是指对应的多个中的任意一个。
以上所述仅是为了便于本领域的技术人员理解本公开的技术方案,并不用以限制本公开。凡在本公开的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本公开的保护范围之内。
