一种外泌体RNA结合蛋白FUS作为急性缺血性卒中治疗靶点的应用
文献发布时间:2023-06-19 19:38:38
技术领域
本发明涉及生物医药领域,尤其涉及一种外泌体RNA结合蛋白FUS作为急性缺血性卒中治疗靶点的应用。
背景技术
外泌体(sEV)在结构和功能上是多效的,是天然存在的磷脂双分子层纳米囊泡(直径约30-150 nm)。几乎由所有细胞分泌,并通过运输生物活性物质和激活靶细胞中的信号转导通路,在细胞间通信中发挥重要功能。严重的应激会改变sEV的释放和含量,导致损伤或保护作用。
越来越多的研究表明,缺氧促进sEV的分泌,但目前尚不清楚为什么低氧条件下外泌体(HypEV)优先被吸收。也尚不清楚为什么sEV会优先针对神经元。间充质干细胞外泌体(MSC-Exos)通过非侵入性计算机断层扫描(CT)在体内可视化,显示MSC-Exos选择性靶向缺血性中风、帕金森病、阿尔茨海默病和自闭症障碍小鼠模型中受病理影响的大脑区域和神经元。这揭示了MSC-Exosin在体内的归巢现象,这归因于炎症。在体外原代神经元-星形胶质细胞共培养模型中,sEV在一定程度上靶向神经元,但不靶向星形胶质细胞。然而,允许sEV有效靶向神经元的细胞和分子机制仍然未知,因此,需要进一步的研究来确定这些机制。
先前的研究表明,sEV载物分子根据供体细胞的缺氧严重程度和健康状态有很大差异,导致靶细胞的功能结果差异极大。sEV可以运输与细胞损伤相关的分子或为细胞存活提供关键的营养因子。在编码RNA和非编码RNA转运过程中,RNA结合蛋白(RBPs)负责将RNA包装成sEV,并通过RNA-核糖核蛋白(RNP)复合物促进RNA转运。此外,RBPs对于突触mRNA的转运和定位至关重要,这一关键过程使神经元能够通过快速合成蛋白质来应对不同环境中的刺激。
RBPs可以结合特定的RNA并选择性地将其穿梭到sEV中。FUS (Fused in sarcoma)已经证明了这种能力。FUS是一种高度保守的蛋白,首次在人脂肪肉瘤中被鉴定为融合癌基因。有证据证实FUS是中枢神经系统正常发育和神经元存活的重要RBP。FUS突变可导致神经系统易患神经退行性疾病,如ALS和额颞叶痴呆(FTD)。据报道,FUS介导核质穿梭、剪接、转录、microRNA加工、RNA运输和翻译以及应激颗粒形成。虽然先前的研究报道了FUS在细胞中发挥关键作用,但很少有研究FUS和FUS结合mRNA的转运。
发明内容
本发明的目的是提出一种外泌体RNA结合蛋白FUS作为急性缺血性卒中治疗靶点的应用。
本发明的目的将通过以下技术方案得以实现:
本发明一方面提供了靶向FUS (Fused in sarcoma)的物质在制备治疗急性缺血性卒中的药物中的应用,所述药物使FUS在神经元外泌体(HypEV)中高表达。
进一步的,所述高表达的FUS促进HypEV缓解缺血神经元损伤。
本发明另一方面提供了FUS (Fused in sarcoma)在制备治疗急性缺血性卒中的药物中的应用,所述药物使FUS在神经元外泌体(HypEV)中高表达。
进一步的,所述高表达的FUS促进HypEV缓解缺血神经元损伤。
进一步的,所述药物为所述药物为N
进一步的,所述药物包括其药学上可接受的载体。
本发明的突出效果为:本发明的研究表明,常氧和低氧条件下神经元产生的sEV在释放、吸收和功能上具有明显差异。通过PT脑卒中模型模拟小鼠缺血脑卒中,研究在低氧条件下的sEV(HypEV)对缺血小鼠模型皮层的神经元的保护作用机制,发现神经元低氧条件下sEV(HypEV)在神经再生中比神经元常氧条件下sEV(NorEV)对缺血性脑卒中具有更强的神经保护作用,证明了HypEV与NorEV相比更容易在体外被吸收和利用。进一步研究发现,通过调节HypEV中RNA运输的关键RBP—FUS/TLS (Fused in sarcoma/Translocated inliposarcoma protein),其对HypEV对神经突和神经可塑性的神经保护作用至关重要。因此,FUS (Fused in sarcoma)能够作为治疗急性缺血性卒中的靶点,靶向FUS的药物对治疗急性缺血性卒中具有积极的作用。
以下便结合实施例,对本发明的具体实施方式作进一步的详述,以使本发明技术方案更易于理解、掌握。
附图说明
图1为本发明原代皮层神经元来源的外泌体sEV的提取纯化示意图;其中 ①原代皮层神经元体外培养(i)和超离心法提取sEV (ii和iii);②不同培养条件下神经元sEV的蛋白质组学和转录组学分析;③分别从缺氧(i)条件下缺氧、缺氧或FUS siRNA处理的神经元中提取神经元sEV,与神经元孵育或注射到小鼠大脑(ii)中,分别在体外(iv)和体内(v)分析sEV的摄取(iii)和神经保护作用(iii);
图2 A为本发明sEV特征的透射电镜 (TEM)图像(标尺=200 nm)(左);以及免疫电子镜检显示cd63阳性sEV(右);
图2B为图2A的统计分析结果图;
图3 为本发明sEV特征的纳米颗粒跟踪分析在同等数量的神经元中常氧条件下神经元释放sEV (NorEV)和低氧条件下神经元释放sEV (HypEV)的大小分布和浓度分析结果图;
图4为本发明sEV特征的Western blotting检测结果图;
图5为本发明NorEV (PKH26)和HypEV (PKH67)混合培养后的共聚焦荧光图像;
图6为本发明体内荧光成像 显示PKH67标记的HypEV主要被PT小鼠梗死周围神经元摄取(左下框),比例尺= 20um。
图7A为本发明 HypEV与神经元体外共培养,采用微管相关蛋白(MAP2)染色表征神经元体外形态图;
图7B为本发明 HypEV与神经元体外共培养,用肖尔分析(Sholl analysis)量化树状复杂性的图解;
图7C为本发明 HypEV与神经元体外共培养,神经元总神经突长度和神经突数量的统计分析;
图7D为本发明 HypEV与神经元体外共培养,各组突触后密度95 (PSD95)、生长相关蛋白43 (GAP43)和突触素的代表性Western blotting检测结果图;
图7E为图7D的统计分析结果图;
图8 A为本发明利用基因集富集分析(GSEA) 数据库,通过液相色谱/质谱(LC/MS)检测到所有4585个蛋白质的前10个富集基因集;
图8B为图8A前30个上调和下调蛋白的热图;
图8C为图8A使用STRING的60个蛋白质的蛋白质相互作用(PPI)网络;
图8D为图8C的PPI网络中7个蛋白的基因本体(GO)富集分析;
图8E为双差异表达蛋白(HypEV/NorEV)的火山图;
图8F为具有代表性的FUS的 Western blotting检测结果图;
图8G为不同物种FUS的保守序列分析结果;
图9A为本发明PT小鼠皮层注射PBS、NorEV或HypEV后的sEV在皮层的分布图;
图9B为本发明PT小鼠皮层注射PBS、NorEV或HypEV后磁共振成像13 (MRI) T2期捕获的梗死核的代表性图像(上)和脑梗死的三维图像(下:从左到右的冠状面、水平面和矢状面视图);
图9C为本发明PT小鼠皮层注射PBS、NorEV或HypEV后梗死体积和梗死体积比;
图9D为本发明PT小鼠皮层注射PBS、NorEV或HypEV后尼氏染色结果图;
图9E本发明PT小鼠皮层注射PBS、NorEV或HypEV后不同虚线框内完整神经元(尼氏染色)数量;
图10 A为本发明特异性siRNA敲低亲本细胞后FUS的表达;
图10B为本发明特异性siRNA敲低亲本细胞后共聚焦荧光图像;
图10C为本发明特异性siRNA敲低亲本细胞后MAP2染色法对培养的神经元进行体外神经元形态表征;
图10D为本发明特异性siRNA敲低亲本细胞后统计分析神经突的总长度和数量;
图10E为本发明特异性siRNA敲低亲本细胞后Sholl分析法定量枝晶复杂度;
图10F为本发明在PBS、HypEV或FUS siRNA-HypEV治疗的PT小鼠中,MRI (T2期)捕获的梗死核的代表性图像(上)和脑梗死的三维图像(下);
图10G为本发明特异性siRNA敲低亲本细胞后梗死体积及相应比例结果;
图10H为本发明特异性siRNA敲低亲本细胞后 PSD95以及synapsin-1和synaptophysin(突触前突触囊泡蛋白)的Western blotting检测结果图;
图10I为图10H的统计分析图。
实施方式
为使本发明的目的、技术方案及效果更加清楚、明确,以下参照实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限本发明。
本发明上下文中所使用的试剂,均通过市售获得。本发明所使用的实验方法均为本领域的常规方法和技术。
实验材料及方法:
1 、动物
动物成年雌雄Balb/c小鼠60只,22.0-25.5 g,5-7周龄,随机分配,并在严格的恒温恒湿环境中饲养。
光血栓形成(PT)脑卒中模型具有较好的稳定性和较高的研究重复性。因此采用皮质微血管光血栓形成引起小鼠局部皮质缺血。用异氟醚气体麻醉小鼠(4%诱导麻醉,1.5%维持麻醉)并放置在立体定向装置中。通过中线切口暴露颅骨后,将光纤放置在距前囟(ML2.0 mm,AP-0.5 mm)处,并尽可能靠近颅骨。在Rose Bengal(40mg/kg,Sigma)给药5分钟后,用200 W强度的光纤照明器照射大脑15分钟。最后,停止光照,用sEV治疗。
2、 原代皮层神经元培养
Balb/c小鼠胚胎(E18-E19)的大脑皮层分离后,皮层神经元在含10% FBS的DMEM/F12中培养4 h,然后用含2% B27 (Gibco,USA,Cat No. 177504044)的神经基础培养基(Gibco,USA,Cat No. 21103049)换液,在37℃、5% CO
3、 超高速离心技术从原代神经元细胞培养上清中分离、纯化sEV
体外培养(DIV5) 5天后,在37℃、5% CO
4 、sEV特征
将10μl新鲜sEV悬浮液滴在碳涂层铜网格表面10分钟晾干,然后在2.5%戊二醛中固定5分钟。然后用PBS洗涤固定网格,然后用3%磷通酸(G1871,solarbio)复染2分钟。风干后,通过透射电镜(TEM) 在电压设置为120 Kv时捕捉外显体显微照片。如图2所示,透射电镜 (TEM)图像(标尺=200 nm)(图2A-左);免疫电子镜检显示cd63阳性sEV(图2A-右) ,提取的sEV直径为100-200 nm(图2B),且多呈杯状。
纳米颗粒跟踪分析 (NTA;Nanosight NS300,Malvern,England)对sEV的浓度和尺寸分布进行了观察。如图3所示,在同等数量的神经元中,HypEV的输出比NorEV的输出高,HypEV与NorEV之间的浓度差异被认为是显著的,p < 0.05,但颗粒大小没有差异。
Western Blotting验证sEV的经典标记CD63、CD81、TSG101和calnexin作为阴性对照。如图4所示,sEV表达标记蛋白(CD63、CD81和TSG101)(图4-左),在相同的蛋白负载条件下,HypEV比NorEV表达更多的sEV膜标记蛋白(图4-右)
活细胞成像观察被捕获摄取过程,将DIV5原代皮层神经元培养在玻璃状聚合物盖层(D35-20-1.5P,Cellvis)中,放入活细胞工作站(37℃,5% CO
5、 sEV的标记、定位、观察
5.1 PKH67/PKH26 对sEV进行染色
将PKH67/PKH26 (2μl染料/500μl稀释液C)加入到悬浮在500μl稀释液C中的sEV中,在室温下移液5分钟标记sEV,然后加入10 ml DMEM完全培养基(DMEM+ 10%FBS)以停止染色。采用超高速离心保留sEV。最后将25个标记sEV添加到初级皮层神经元中。孵育24 h后,4% PFA固定细胞,DAPI染色,使用Zeiss LSM888 (Zeiss,Oberkochen,Germany)共聚焦激光扫描显微镜(CLSM)进行荧光定量分析。
5.2 sEV与神经元类型的共定位
为了确定sEV在缺血性脑中的位置,通过超离心提取并用PKH67/PKH26标记,然后在光血栓形成(PT)小鼠模型中鼻内给sEV,或者在体外缺血条件下与初级皮层神经元共孵育sEV(图1③)。
通过鼻滴给药给小鼠sEV,鉴定吸收初级皮质神经元来源的sEV的细胞,如图6所示,PKH67标记的HypEV主要被PT小鼠梗死周围神经元摄取(左下框,比例尺= 20μm),发现许多sEV进入了15分钟光血栓形成(PT)损伤的梗死周围神经元。进行体外sEV实验,比较神经元对NorEV和HypEV的摄取,发现HypEV比NorEV更容易被神经元吸收,p < 0.05。
通过测量神经元分支、树突数量和总树突长度来评估神经复杂性,显示HypEV组明显比NorEV组更有效地挽救了缺血神经元的神经复杂性。氧葡萄糖剥夺(OGD)损伤3小时后,将原代皮层神经元与磷酸盐缓冲盐水(PBS)、NorEV或HypEV在正常培养基中再孵育24小时。用PBS (OGD/再灌注[R])、NorEV (OGD/R + NorEV)、HypEV 11 (OGD/R + HypEV)孵育神经元后,采用微管相关蛋白(MAP2)染色表征神经元体外形态,如图7A所示;用肖尔分析(Shollanalysis)量化树状复杂性的图解,如图7B所示;神经元总神经突长度和神经突数量的统计分析如图7C所示;图7A-图7C均显示HypEV组明显比NorEV组更有效地挽救了缺血神经元的神经复杂性,p < 0.05。在一定程度上,在急性损伤阶段维持突触结构连接有助于神经元的恢复。此外,进一步研究了突触可塑性相关蛋白。生长相关蛋白43 (GAP43) 10是轴突发芽和可塑性的标志,突触素(synaptophysin)和突触后密度蛋白95 (PSD95)是突触前和突触后完整性的标志物,Western blotting检测,结果如图7D-7E所示,HypEV比NorEV更有效地恢复缺血神经元的突触完整性和神经元可塑性标志物,p < 0.05。这些结果表明,HypEV对缺血损伤后的神经元具有有益和保护作用,并且这种作用在HypEV中比NorEV更强。
6 、TMT定量蛋白质组学
收集sEV,提取总蛋白。蛋白质经过胰蛋白酶消化后,将多肽溶解在0.5 M TEAB中,并根据制造商的说明使用TMT试剂盒(termos)进行标记。采用Agilent 300Extend C18色谱柱(5 μm颗粒,4.6 mm ID,250 mm长),高ph反相高效液相色谱法对肽进行分离。然后采用液相色谱(EASY-Nlc 1200) -质谱(Q ExactiveTM Plus)进行多肽分析。在Orbitrap中以17500的分辨率检测和分析完整的肽及其二级片段。使用MaxQuant v.1.5.2.8 检索得到的质谱数据。
结果显示这些蛋白与细胞间外泌体(cellar component,CC)、蛋白转运、mRNA加工((biological process,BP)和RNA结合(molecular function,MF)有关。这些结果与sEV的特征一致,表明我们的外泌体分离和质谱分析方法是有效的。使用log2 fold change (FC)对4585个蛋白质进行排序,并用于GSEA分析。如图8A所示,BP富集前10位的基因表明sEV蛋白与细胞氧化磷酸化、mRNA代谢和突触组装有关;CC结果表明,蛋白质主要分布在线粒体、质膜和突触膜;MF检测结果表明,该蛋白的功能与RNA结合和翻译调节有关( p<0.05)。然后,我们分别将前30个差异表达蛋白与NorEV进行聚类,并使用STRING软件分析蛋白-蛋白相互作用(PPIs),图8B为前30个上调和下调蛋白的热图。结果表明,大多数上调蛋白被聚类,揭示了一个高度互联的RBPs网络(如图8C所示)。如图8D所示,这些结果表明sEV含有许多RBP来运输RNA,这意味着它们在健康和疾病中发挥作用。在我们研究中确定的7个RBP中,7个蛋白的基因本体(GO)富集分析,聚集RBP中突出的GO类别与RNA结合、RNA代谢和神经退行性疾病相关,FUS是HypEV组中含量最高且富集最稳定的蛋白;在三次重复实验中,FUS在总上调蛋白的火山图中表达量最高,分别为第一、第四和第十五位(图8E),并且在PPIs中具有较高的相互作用评分。Western blotting证实FUS在神经元HypEV中高表达,但在神经元来源的NorEV中表达较低(图8F)。不同物种保守序列分析显示FUS在物种间高度保守(图8G)。这些数据表明,FUS和相关的RBPs在动员HypEV释放RNA中起着关键作用。
7、 FUS、HypEV在体内的神经保护作用
7.1模型分组
为检测sEV在体内的神经保护作用,将30只小鼠分为4组(5组):SHAM;PT + PBS;PT+ NorEV;PT + HypEV;和(PT+FUS siRNA_HypEV)。PT卒中模型建立后,Balb/c小鼠分别在靠近梗死边界的左皮质(相对于bregma的坐标:ML 2.0 mm,AP +0.2 mm,DV -1.5 mm)以立体定向注射方式微量注射sEV(3µg/μl,3 μl,PBS稀释)或PBS(3µl)。
同时体外进行细胞分为4组(5组):Control,OGD/R,OGD/R+ NorEV,OGD/R+ HypEV,和OGD/R+ Fus siRNA_HypEV。在再灌注开始时加入sEV(1:5000,共60µg)。SH-sy5y细胞取自American Type Culture Collection,在含10%胎牛血清的DMEM中加湿培养箱(37°C,5%CO
7.2.小鼠MRI和三维重建
使用9.4特斯拉小动物MRI扫描仪(Bruker PharmaScan)对小鼠进行MRI。用2%异氟醚经鼻锥麻醉小鼠,监测体温和呼吸频率。PT造模48 h后进行T2加权成像(T2WI)成像。在相同的PT小鼠图像尺度和脑切片下,使用3D切片机软件扫描并量化T2WI成像。利用三维切片机根据T2WI图像重建三维图像,通过阈值调整识别梗死区和非梗死区,通过软件确定梗死体积。
7.3 HypEV对缺血模型的神经元形态和神经轴突的影响
在体内模型中使用光血栓形成(PT)损伤来模拟局灶性缺血,PT小鼠皮层注射PBS、NorEV或HypEV,PT术后第二天处死小鼠,如图9A所示,右图为sEV在皮层的分布。在sEV给药48小时后进行磁共振成像(MRI)以确定梗死体积。图9 B为磁共振成像13 (MRI) T2期捕获的梗死核的代表性图像(上)和脑梗死的三维图像(下:从左到右的冠状面、水平面和矢状面视图)。如图9C所示,T2加权图像(T2WI)结合三维重建显示HypEV脑梗死的体积减少了45%,P<0.05。进一步分析梗死边界神经结构,PT手术后,与假手术组相比,Nissl体更少,更小,更模糊。如图9D所示,尼氏染色显示PBS、NorEV或HypEV处理的PT小鼠假手术和梗死周围的神经元数量(虚线框),用HypEV治疗PT卒中小鼠后,受损神经元得到挽救,梗死区域完全缩小。如图9E 所示,不同虚线框内完整神经元(尼氏染色)数量,NorEV治疗后PT卒中小鼠的改善很少且不显著,相比之下,HypEV可缓解缺血神经元损伤,P<0.05。总之,这些体内实验证实了HypEV缓解缺血神经元损伤的体外证据。
7.4 FUS对PT脑卒中模型中HypEV作用的影响
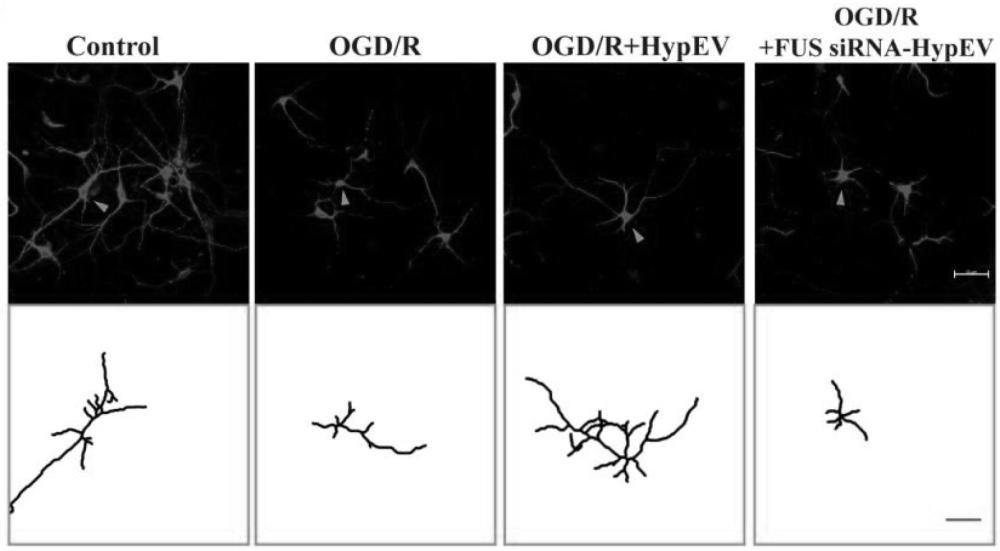
如上所述,从相同数量的神经元中释放出的HypEV比NorEV多得多,并被缺血神经元所吸收,使用FUS小干扰RNA (siRNA)敲除供体神经元及其sEV中的FUS,图10A所示,特异性siRNA敲低亲本细胞后FUS表达显著降低。值得注意的是,siRNA介导的FUS敲低导致sEV中FUS表达减少,sEV共孵育实验表明,图10B共聚焦荧光图像显示HypEV中FUS敲低逆转了对HypEV的摄取偏好。其中,FUS siRNA 目标序列为:5’- CAAGCAGATTGGTATTATT -3’(Ribobio, stB0001791A)。
如图10C-图10E所示,用MAP2染色法对培养的神经元进行体外神经元形态表征(比例尺=50 μm)。底部勾勒出单个神经元,以显示OGD (3h)后再灌注(24 h)和常氧条件(对照)下(比例尺= 50um)神经元的树突分支复杂性。统计分析神经突的总长度和数量,用平均值±SEM表示,HypEV可以显著挽救神经元分支的长度、数量和复杂性,P<0.05。Sholl分析法定量枝晶复杂度。交叉用于量化map2染色的神经复杂性。由此,使用MAP2标记的体外神经复杂性分析显示,HypEV可以显著挽救神经元分支的长度、数量和复杂性,但这些因HypEV中FUS的敲除而显著降低。
在PBS、HypEV或FUS siRNA-HypEV治疗的PT小鼠中,MRI (T2期)捕获的梗死核的代表性图像(图10F上)和脑梗死的三维图像(图10F下)。如图10G所示,梗死体积及相应比例,HypEV敲除FUS后,脑梗死体积增加45%(HypEV处理9.4±2.4 mm
进行PSD95以及synapsin-1和synaptophysin(突触前突触囊泡蛋白)的Westernblot分析。如图10H-10I所示,通过观察梗死边界周围区域,发现HypEV恢复缺血神经元突触完整性标记物和神经元标记物(包括PSD95、synaptophysin和synapsin1)的表达明显高于NorEV(P<0.05)。然而,HypEV中FUS的下调降低了HypEV治疗组突触蛋白的上调表达。综上所述,这些结果表明,在缺血条件下,FUS是sEV摄取及其神经保护作用的关键因素。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 一种环状RNA CircOGDH作为急性缺血性卒中治疗靶点的应用
- 一种血浆外泌体CircOGDH作为急性缺血性卒中诊断性生物标志物的应用
