三肽-1和/或三胜肽在制备防治慢阻肺合并骨骼肌功能障碍的药物中的应用
文献发布时间:2024-01-17 01:13:28
技术领域
本发明属于生物医药技术领域,具体涉及三肽-1和/或三胜肽在制备防治慢阻肺合并骨骼肌功能障碍的药物中的应用。
背景技术
慢性阻塞性肺病(COPD)是一种以持续呼吸道症状和气流受限为特征的慢性气道疾病,常伴有涉及心血管、胃肠道、血液学、肌肉骨骼和其他系统的多种并存病。其中,由于骨骼肌功能障碍导致的运动耐受性降低与预后不良、住院以及发病率和死亡率增加相关。文献报道,约15%-45%的稳定期COPD患者有骨骼肌功能障碍。稳定期COPD合并肌细胞减少症患者呼吸困难指数评分增加,运动耐受性下降,而运动能力下降和活动减少导致肌肉萎缩,疾病进展的恶性循环进一步加剧。
氧化应激正在成为COPD肺部和全身病理的重要因素,并已被证明是COPD相关骨骼肌功能障碍的重要诱因。氧化应激是指氧化损伤(由活性氧介导)和抗氧化防御系统之间的失衡。多项研究表明,骨骼肌细胞中的活性氧种类与骨骼肌纤维的横截面积呈负相关。此外,COPD患者骨骼肌的抗氧化能力与肌肉质量和强度相关。从机制上讲,氧化应激可直接或间接调节转录因子和激酶诱导蛋白水解途径(增加肌肉萎缩相关基因、萎缩蛋白-1和肌生长抑制素的表达),并降低线粒体含量和功能。因此,旨在减少肌肉氧化应激的治疗可能有助于改善COPD患者的肌肉病理。
甘氨酰-组氨酸-赖氨酸,又名三肽-1(Gly-His-Lys,GHK)是具有氨基酸序列甘氨酰-组氨酸-赖氨酸的活性三肽,是人血浆、唾液和尿液中的正常成分,其水平随着年龄的增长而下降。初步研究表明,GHK存在于I型胶原的α2链中,并在损伤激活蛋白水解酶(皮肤修复的早期信号)时释放到损伤部位以发挥局部愈合作用。近年来,随着研究的进展,GHK促进组织再生以及抗炎和抗氧化特性的能力已在骨骼和肝脏等组织中得到证实。在体内,GHK容易与铜形成复合谷氨酸-组氨酸-赖氨酸铜,又名三胜肽(GHK-Cu),提高了GHK的生物利用度。研究表明,外源性给予GHK和GHK-Cu对肺纤维化和急性肺损伤具有潜在的治疗价值,其机制与其抗炎抗氧化作用密切相关。但是,迄今为止,本领域尚无研究GHK-Cu对慢阻肺合并骨骼肌功能障碍的作用。
发明内容
本发明的目的在于提供三肽-1和/或三胜肽在制备防治慢阻肺合并骨骼肌功能障碍的药物中的应用,所述三肽-1及其铜离子螯合物三胜肽可以有效治疗慢阻肺慢阻肺合并骨骼肌功能障碍,增加三肽-1和三胜肽的医药用途。
本发明提供了三肽-1和/或三胜肽在制备防治慢阻肺合并骨骼肌功能障碍的药物中的应用。
优选的,所述药物包括拮抗骨骼肌细胞氧化应激反应、提高骨骼肌细胞中线粒体含量和抑制肌肉萎缩中的一种或多种的药物。
优选的,所述抑制肌肉萎缩的药物包括减少机体肌肉损失的药物。
优选的,所述减少机体肌肉损失的药物包括减少股四头肌、腓肠肌、比目鱼肌、胫骨前肌和趾长伸肌中一种或多种的药物。
优选的,所述抑制肌肉萎缩的药物包括下调p-Akt和/或p-FoxO3a通路表达的药物。
优选的,所述提高骨骼肌细胞中线粒体含量的药物包括下调PCG-1α表达的药物;和/或提高Tom20、Cox2和UCP3蛋白中的一种或多种表达的药物。
优选的,所述拮抗骨骼肌细胞氧化应激反应的药物包括提高骨骼肌细胞中GSH、SOD和T-AOC中的一种或多种的含量的药物;和/或降低骨骼肌细胞中MAD的含量的药物。
优选的,所述拮抗骨骼肌细胞氧化应激反应的药物包括上调Nrf2、SOD2和HO-1蛋白中的一种或多种表达的药物。
本发明还提供了一种防治慢阻肺合并骨骼肌功能障碍的药物,所述药物的活性成分包括三肽-1和/或三胜肽。
有益效果:
本发明提供了三肽-1和/或三胜肽在制备防治慢阻肺合并骨骼肌功能障碍的药物中的应用,本发明所述三肽-1和三胜肽可以通过拮抗氧化应激反应、调控骨骼肌细胞线粒体功能以及抑制肌肉萎缩等途径,抑制慢阻肺合并骨骼肌功能障碍的发生和发展,进而达到预防和治疗慢阻肺合并骨骼肌功能障碍,增加三肽-1和三胜肽,尤其是三胜肽的医药用途。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
图1为实施例1中GHK-Cu的结构图;
图2为实施例1中五个试验组中的细胞活力检测结果;
图3为实施例1中Westernblot法检测五个试验组细胞中蛋白表达水平结果;
图4为实施例1中小鼠肌管的免疫荧光染色结果;
图5为实施例2中GHK-Cu对CSE诱导的C2C12细胞线粒体的荧光染色及定量结果;
图6为实施例2中GHK-Cu对CSE诱导的C2C12细胞线粒体标记物蛋白表达水平结果;
图7为实施例3中GHK-Cu对CSE诱导的C2C12细胞氧化应激的作用结果;
图8为实施例4中吸烟暴露小鼠模型的构建过程图;
图9为实施例4中各试验组小鼠的体重和握力测试结果;
图10为实施例4中各试验组小鼠后腿肌肉质量损失测定结果;
图11为实施例4中各试验组小鼠后腿肌肉苏木精和Eosin染色结果;
图12为实施例4中各试验组小鼠蛋白质印迹分析结果;
图13为实施例5中各试验组小鼠肌肉中GSH、MDA、SOD2和T-AOC活性检测结果。
具体实施方式
本发明提供了三肽-1和/或三胜肽在制备防治慢阻肺合并骨骼肌功能障碍的药物中的应用,优选为三肽-1或三胜肽在制备防治慢阻肺合并骨骼肌功能障碍的药物中的应用,更优选为三胜肽在制备防治慢阻肺合并骨骼肌功能障碍的药物中的应用。
本发明所述药物优选包括拮抗骨骼肌细胞氧化应激反应、提高骨骼肌细胞中线粒体含量和抑制肌肉萎缩中的一种或多种的药物,更优选包括拮抗骨骼肌细胞氧化应激反应、提高骨骼肌细胞中线粒体含量和抑制肌肉萎缩中的药物。
在本发明中,所述抑制肌肉萎缩的药物优选包括减少机体肌肉损失的药物,具体优选包括减少股四头肌、腓肠肌、比目鱼肌、胫骨前肌和趾长伸肌中一种或多种的药物,更优选包括减少股四头肌、腓肠肌、比目鱼肌、胫骨前肌和趾长伸肌的药物。同时,本发明所述抑制肌肉萎缩的药物优选包括下调p-Akt和/或p-FoxO3a通路表达的药物,更优选包括下调p-Akt和p-FoxO3a通路表达的药物。
在本发明中,所述提高骨骼肌细胞中线粒体含量的药物优选包括下调PCG-1α表达的药物;和/或提高Tom20、Cox2和UCP3蛋白中的一种或多种表达的药物,进一步优选包括下调PCG-1α表达的药物和提高Tom20、Cox2和UCP3蛋白中的一种或多种表达的药物,更优选包括下调PCG-1α表达的药物和提高Tom20、Cox2和UCP3蛋白表达的药物。
在本发明中,所述拮抗骨骼肌细胞氧化应激反应的药物优选包括提高骨骼肌细胞中GSH、SOD和T-AOC中的一种或多种的含量的药物;和/或降低骨骼肌细胞中MAD的含量的药物,进一步优选包括提高骨骼肌细胞中GSH、SOD和T-AOC中的一种或多种的含量的药物和降低骨骼肌细胞中MAD的含量的药物,更优选包括提高骨骼肌细胞中GSH、SOD和T-AOC的含量的药物和降低骨骼肌细胞中MAD的含量的药物。同时,本发明所述拮抗骨骼肌细胞氧化应激反应的药物优选包括上调Nrf2、SOD2和HO-1蛋白中的一种或多种表达的药物,更优选包括上调Nrf2、SOD2和HO-1蛋白表达的药物。
本发明对所述三肽-1和三胜肽的来源没有特殊限定,采用本领域中常规市售产品即可。
本发明还提供了一种防治慢阻肺合并骨骼肌功能障碍的药物,所述药物的活性成分包括三肽-1和/或三胜肽,进一步优选包括三肽-1或三胜肽,更优选包括三胜肽。本发明对所述药物的剂型没有特殊限定,采用本领域技术人员熟知的剂型即可,且优选但不限于水溶液注射剂、粉针剂、丸剂、散剂、片剂、贴剂、栓剂、乳剂、霜剂、凝胶剂、颗粒剂、胶囊剂、气雾剂、喷雾剂、粉雾剂、缓释剂和控释剂。本发明对所述药物中的辅料类型和来源没有特殊限定,根据药物剂型常规选择即可。
为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例1
三胜肽(GHK-Cu)对香烟烟雾提取物(CSE)诱导的小鼠骨骼肌C2C12细胞萎缩的作用,步骤如下,其中GHK-Cu的结构如图1所示。
1、香烟烟雾提取物(CSE)诱导的小鼠骨骼肌C2C12细胞萎缩模型的构建方法:
制备香烟烟雾提取物(CSE):去除香烟过滤嘴,连接剩余部分至负压泵接头处;点燃香烟,利用负压泵缓慢将烟雾泵入含100mL RPMI-1640培养基的瓶中;调整pH值至7.4,用0.22μm滤器去除细菌,分装保存至1.5mL的EP管中(1mL/管),长期储存于-80℃冰箱。本发明统一认定此CSE认定为100%CSE。
应用2%的CSE溶液(溶剂为RPMI-1640培养基)刺激小鼠骨骼肌C2C12细胞48h(即将CSE溶液加入到小鼠骨骼肌C2C12细胞培养基中,小鼠骨骼肌C2C12细胞培养基为含10%胎牛血清的DMEM高糖培养基)。
2、试验组设置:
1)对照组:小鼠骨骼肌C2C12细胞,记为Control;
2)模型组:步骤1制备得到的细胞模型,记为CSE;
3)三胜肽组:以浓度为10μM的GHK-Cu处理小鼠骨骼肌C2C12细胞(即,将GHK-Cu加入到小鼠骨骼肌C2C12细胞的细胞培养基中),记为GHK-Cu;
4)处理组1:以浓度为5μM的GHK-Cu处理步骤1制备得到的细胞模型,记为CSE+GHK-Cu(5μM);
5)处理组2:以浓度为10μM的GHK-Cu处理步骤1制备得到的细胞模型,记为CSE+GHK-Cu(10μM)。
3、试验结果检测:
1)采用CCK8法检测步骤2中五个试验组中的细胞活力,结果如图2所示。
由图2可以得出:单独GHK-Cu处理对小鼠骨骼肌C2C12细胞没有显示出明显的细胞毒性,并且GHK-Cu可以浓度依赖性地防止CSE诱导的细胞死亡。
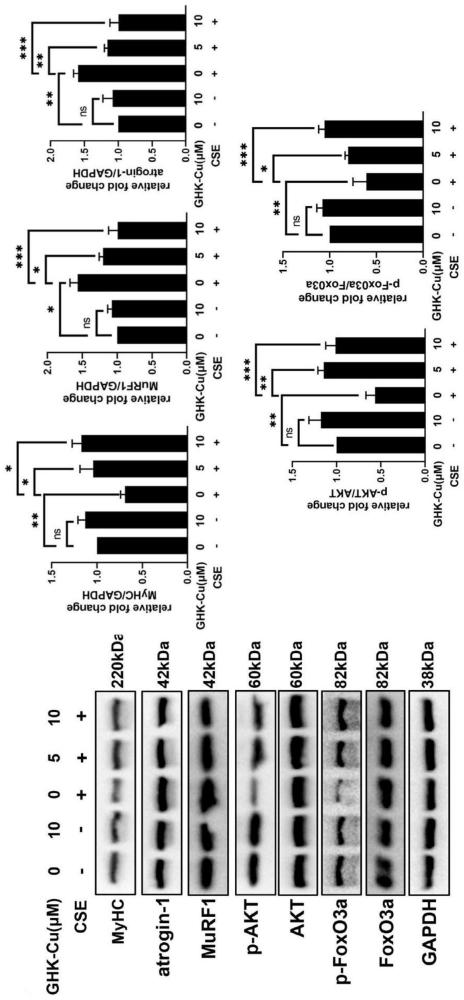
2)采用Westernblot法检测步骤2中五个试验组细胞中蛋白表达水平,并使用Image J软件对条带进行灰度值分析量化蛋白表达水平。结果如图3所示。
由图3可以得出:CSE诱导显著增加了肌肉特异性泛素E3连接酶(atrogin-1和MuRF1)的表达。GHK-Cu处理后完全逆转了CSE诱导的萎缩蛋白-1和MuRF1表达的增加。AKT/FoxO3a途径是调节肌肉萎缩和蛋白质降解的关键途径。本发明还发现GHK-Cu可以显著上调CSE诱导的AKT/FoxO3a通路的降低;CSE诱导后显著降低了骨骼肌C2C12细胞中p-Akt和p-FoxO3a的表达,GHK-Cu处理后完全逆转了上述降低的情况。
3)应用含2%马血清的DMEM高糖培养基培养基作用于小鼠骨骼肌C2C12细胞7天,诱导其分化成为肌管。应用2%的CSE溶液或/和不同浓度的GHK-Cu(5μM或10μM)作用于分化完成的肌管48h后,进行肌球蛋白重链MyHC(肌纤维的主要成分)的免疫荧光染色,结果如图4所示。
由图4可以看出:与未经处理的小鼠肌管相比,CSE诱导的小鼠肌管直径明显更小,表明CSE能够诱导代表肌肉萎缩的肌管萎缩。同时,与CSE处理的小鼠肌管(CSE组)相比,GHK-Cu处理以浓度依赖的方式提高了小小鼠肌管的直径。
基于上述结果,GHK-Cu保护小鼠骨骼肌C2C12细胞免受CSE诱导的萎缩,并调节AKT-FoxO3a通路。
实施例2
GHK-Cu对CSE诱导的C2C12细胞线粒体功能障碍的作用,步骤如下:
吸烟导致的骨骼肌功能障碍伴随着线粒体丢失和功能障碍。因此,本发明试图确定GHK-Cu在线粒体功能调节中的作用。以实施例1中步骤2试验组中的细胞为研究对象,进行细胞线粒体含量检测,具体步骤为:本研究使用Mito-Tracker Green探针作为线粒体荧光标记探针,取1μLMito-Tracker Green加入到5mL的DMEM高糖培养基中,混匀后为Mito-TrackerGreen工作液。去除各组细胞培养液,加入配制好的并37℃预温育的Mito-TrackerGreen染色工作液,与细胞37℃共孵育15分钟。孵育后去除Mito-Tracker Green染色工作液,加入37℃预温育的新鲜细胞培养液。随后使用荧光显微镜进行观察并拍摄照片。各组细胞线粒体荧光强度使用Image J软件进行定量分析。结果如图5所示。
由图5可以看出:CSE明显降低了小鼠骨骼肌C2C12细胞中线粒体的含量;GHK-Cu处理以浓度依赖的方式提高线粒体含量。同时,GHK-Cu可以逆转CSE诱导的线粒体标记物(Tom20、Cox2和UCP3)和上游调节分子PCG-1α的下调(图6)。
上述结果表明,GHK-Cu可以增强CSE诱导的小鼠骨骼肌C2C12细胞中的线粒体含量和功能。
实施例3
GHK-Cu对CSE诱导的C2C12细胞氧化应激的作用,步骤如下:
氧化应激在COPD和肌细胞减少症的病理生理学中起着重要作用,本发明以实施例1中步骤2试验组中的细胞为研究对象,采用
使用购买自南京建成生物工程研究所有限公司的还原型谷胱甘肽(GSH)测定试剂盒(货号:A005-1-2)、总超氧化物歧化酶(SOD)测定试剂盒(货号:A001-3-2)、丙二醛(MDA)测定试剂盒(货号:A003-1-2)、总抗氧化能力(T-AOC)检测试剂盒(货号:A015-1-2)进行GSH、SOD2、MDA和T-AOC含量检测,结果如图7中A~D所示;采用Westernblot方法检测步骤2试验组中的细胞中抗氧化应激蛋白(Nrf2、SOD2、HO-1)的表达水平,结果如图7中E所示。
由图7中A~D可以看出:当CSE应用于小鼠骨骼肌C2C12细胞时,MDA水平升高,T-AOC和GSH水平降低,表明CSE刺激C2C12中氧化应激的增加;并且,GHK-Cu浓度依赖性地抑制CSE诱导的小鼠骨骼肌C2C12细胞中的氧化应激。
由图7中E可以看出GHK-Cu可以上调CSE诱导的抗氧化应激标志性蛋白(Nrf2、SOD2和HO-1)的下调。
以上结果可以表明,GHK-Cu可以减轻CSE诱导的小鼠骨骼肌C2C12细胞中的氧化应激水平。
实施例4
GHK-Cu对香烟烟雾(Cigarette smoking,CS)诱导的小鼠肌肉萎缩的作用,步骤如下:
1、构建吸烟暴露小鼠模型:
将6-10周需构建小鼠香烟烟雾整体暴露模型的小鼠,以5~6只一笼,放入暴露仓内。点燃万宝路香烟,利用负压泵将烟雾吸入暴露仓中,以5支为一个暴露周期,每天10个暴露周期,每周暴露5天,共暴露12周,暴露仓中特殊颗粒物浓度为150-200mg/m
2、试验组设置:
1)对照组:步骤1中的空气暴露组小鼠,记为Air;
2)模型组:步骤1制备得到的吸烟暴露小鼠模型,每周腹腔注射100μLPBS,记为CS;
3)处理组1:从构建模型的第6周开始,以0.2mg/kg的剂量将GHK-Cu溶解于100μLPBS,腹腔注射到处理步骤1制备得到的吸烟暴露小鼠模型,每周注射一次,记为CS+GHK-Cu(0.2mg/kg);
4)处理组2:从构建模型的第6周开始,以2mg/kg的剂量将GHK-Cu溶解于100μLPBS,腹腔注射到处理步骤1制备得到的吸烟暴露小鼠模型,每周注射一次,记为CS+GHK-Cu(2mg/kg)。
2、试验结果检测:
1)在完成12周的烟雾暴露后,首先测定了各试验组小鼠的体重,同时进行握力测试,结果如9所示。
由图9可以看出,烟雾暴露组(CS组)的小鼠体重显著降低,而高剂量和低剂量GHK-Cu治疗均显著减轻CS诱导的体重减轻。进一步的握力测试表明,CS显著降低了小鼠的肌肉强度,而高剂量GHK-Cu治疗可逆转这种情况。
2)解剖各试验组小鼠后腿的肌肉并称重,结果如图10所示。
由图10可以得出:GHK-Cu显著减少了小鼠CS诱导的肌肉质量损失,包括Quad(股四头肌)、Gast(腓肠肌)、TA(胫骨前肌)、sol(比目鱼肌)和EDL(趾长伸肌)。
3)对各试验组小鼠后退肌肉进行苏木精和Eosin(HE)染色,以评估GHK-Cu处理对肌肉形态学的影响,结果如图11~12所示。
由图11可以看出:CS暴露小鼠的Gast和Quad的肌纤维横截面积(CSA)显著低于对照组。GHK-Cu处理显著阻止CS诱导的肌肉横截面积减少。
4)由图12的蛋白质印迹分析表明,GHK-Cu可以逆转CS诱导的萎缩蛋白-1(atrogin-1)和MuRF1表达的升高;同时能够,逆转CS诱导的PGC-1α和Nrf2表达的降低。
以上结果表明:GHK-Cu可以抑制香烟烟雾诱导的小鼠肌肉萎缩。
实施例5
GHK-Cu对香烟烟雾诱导的小鼠肌肉氧化应激的作用,步骤如下:
以实施例4步骤2试验组中的小鼠为对象,使用购买自南京建成生物工程研究所有限公司的还原型谷胱甘肽(GSH)测定试剂盒(货号:A005-1-2)、总超氧化物歧化酶(SOD)测定试剂盒(货号:A001-3-2)、丙二醛(MDA)测定试剂盒(货号:A003-1-2)、总抗氧化能力(T-AOC)检测试剂盒(货号:A015-1-2)进行GSH、MDA、SOD2和T-AOC活性的检测,结果如图13所示。
由图13可以得出:与Air组相比,在烟雾暴露处理后,CS组肌肉中T-AOC和抗氧化酶(GSH和SOD2)的活性降低,MAD含量增加。相应地,服用GHK-Cu后,CS组肌肉中MDA含量的升高呈下降趋势,T-AOC和抗氧化酶(GSH和SOD2)呈上升趋势。可见,GHK-Cu可以降低烟雾暴露所诱导的氧化应激反应。
由以上实施例可以得出:三胜肽(GHK-Cu)可以有效治疗慢阻肺慢合并骨骼肌功能障碍,增加三胜肽的医药用途。
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
- 类蛇毒三胜肽在制备用于治疗皮肤溃疡的药物中的应用
- 类蛇毒三胜肽在制备用于治疗皮肤溃疡的药物中的应用
