一种基于双层PDMS芯片实现均一3D肿瘤细胞球培养的装置及其应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及微流控领域以及抗癌药物筛选领域,更具体地涉及一种基于双层PDMS芯片实现均一3D肿瘤细胞球培养的装置及其应用。
背景技术
癌症具有较高的发病率和死亡率,是全球最危险的非传染性疾病之一,严重地威胁着人类的身体健康和生命安全。有研究发现,在药物防治肿瘤疾病方面,除西药外,许多中药单体也体现出具有较大的潜力,如银杏内酯、穿心莲内酯、蟾毒素和黄苓苷等。中医药是我国传承几千年的民族瑰宝,中药在临床上因具有显著的临床疗效和较低的不良反应,越来越受到重视。探索出更多安全而有效的抗癌中药将会是未来肿瘤疾病研究领域的一大热点。因此,寻求一个操作简单、高通量、低成本的药物筛选平台具有重要意义。
目前抗癌药物筛选主要通过二维(2D)单层细胞培养进行筛选的,但它不能代表包括细胞-细胞和细胞-基质相互作用在内的组织环境,以及不能再现体内癌的结构组织或病理生理特征。近年来,三维(3D)细胞球状体培养模型越来越多地应用于抗癌研究中,比传统的二维(2D)单层结构更接近地模拟三维实体肿瘤组织,更能提高药物筛选的准确性。目前,已经提出了许多生产细胞球状体的方法,其中最早的主要是基于旋转烧瓶和旋转反应器,虽然这些方法可以大量产生球状体,但它们在再现性和球状体均匀性方面有关键的限制,也容易对球状体造成剪切损伤。此外,还提出了声波驱动的聚集、磁悬浮法、乳液基包封、液体大理石基包封和非粘附微孔等技术方法,这些技术方法可以高通量地生产出球状体,但这些技术大多数复杂、昂贵,需要复杂的设备或专门的培训,这可能会限制它们的广泛应用。另外不同的细胞类型和种类可能会对3D细胞球产生不同的响应。因此在选择培养方法时,需要考虑特定细胞类型的属性、操作难度和实验目的等多方面因素,才有可能保证获得高质量的3D细胞球状体。
发明内容
本发明的目的是提供一种基于双层PDMS芯片实现均一3D肿瘤细胞球培养的装置及其在抗癌药物筛选中的应用,从而解决现有抗癌药物筛选技术中存在的再现性差、球状体均匀性不够、需要复杂设备以及费用高昂等问题。
为了解决上述问题,本发明采用以下技术方案:
根据本发明的第一方面,提供一种基于双层PDMS芯片实现均一3D肿瘤细胞球培养的装置,包括:注射泵、液体管道、阀门、液滴微流控PDMS芯片、细胞培养微流控PDMS芯片以及用于收集上清液的离心管;其中,所述液滴微流控PDMS芯片包括:分别位于两端的一个第一进液口和一个第一出液口,以及位于中间的排成一列的N个细胞培养基入口,N=7或8或9,所述第一进液口用于细胞悬液的输入,其与所述细胞培养基入口通过流道连通,所述第一进液口所在流道的液体流向与所述细胞培养基入口所在流道的液体流向相互垂直,并在二者交汇处的下方与外界相通;所述细胞培养微流控PDMS芯片包括:分别位于两端的一个第二进液口和一个第二出液口,以及位于中间的3D细胞培养孔区域,该3D细胞培养孔区域上方与外界连通,所述3D细胞培养孔区域与所述第二进液口和所述第二出液口分别通过直线通道连通,所述3D细胞培养孔区域设有以阵列式分布的N×M个3D细胞培养孔,N=7或8或9,M=6或7或8,所述3D细胞培养孔为直径在190~210μm之间的半球形凹槽;其中,通过将所述液滴微流控PDMS芯片放置于所述细胞培养微流控PDMS芯片的上方,使所述细胞培养基入口与所述3D细胞培养孔一一对准,并不断平移,以及控制细胞悬液流速和接种时间,即可逐列完成向所述3D细胞培养孔中相同数量细胞的接种,从而最终实现均一的3D肿瘤细胞球培养。
更优选地,单个所述3D细胞培养孔的直径为200μm。
优选地,所述液滴微流控PDMS芯片有7个细胞培养基入口,所述细胞培养微流控PDMS芯片有7×6个相互间隔的3D细胞培养孔。
优选地,所述N个细胞培养基入口在所述液滴微流控PDMS芯片上等间隔布置。
优选地,在完成肿瘤细胞接种后,用盖玻片在所述细胞培养微流控PDMS芯片上方封口,可直接在显微镜下观察3D肿瘤细胞球状体的生长情况。
根据本发明的第二方面,提供一种基于双层PDMS芯片实现均一3D肿瘤细胞球培养的装置在抗癌药物筛选中的应用。
根据本发明的一个优选方案,所述应用包括以下步骤:S1:将肿瘤细胞配制成浓度为1×10
根据本发明的另一优选方案,步骤S2还包括:在接受药物治疗数天后,用Live/Dead活力/细胞毒性测定试剂盒检测细胞的活力,然后结合该细胞活力检测结果以及乳酸脱氢酶检测结果,共同评估抗癌药物对3D肿瘤细胞的治疗作用。
根据本发明的又一优选方案,步骤S2还包括:每天灌注给药一次,每天收集灌注排出来的细胞培养基上清液进行生物检测,以更好地模拟体内循环的生理模式。
根据本发明的再一优选方案,步骤S2还包括:将多个微流控PDMS芯片并联引入,将多种类型的肿瘤细胞分别接入不同微流控PDMS芯片的细胞培养孔中,培养成3D细胞球状体,用于抗癌药物治疗效果的检测,从而提高抗癌药物的筛选通量。
根据本发明的一个优选实施例,所述抗癌药物为黄苓苷。
应当理解的是,芯片中常使用泵驱动流体灌注进行细胞接种,不能有效控细胞培养孔中细胞的数量,使得细胞接种效率不高,培养出来的细胞球不均一。然而,液滴微流控可以控制每个液滴中包含的细胞数量,实现单细胞分离和研究,具有广泛的应用。本发明通过引入液滴微流控以形成液滴的方式实现接种,可以通过控制细胞悬液的流速和接种时间,尽可能保证接种的细胞数量一致,同时将细胞培养孔设计为半球形凹槽,细胞可以通过自身重力作用聚集成团,从而使培养后获得尺寸均一的3D细胞球体,进而保证药物筛选时结果的可靠性和整体实验的可重复性。
根据本发明提供的一种基于双层PDMS芯片的3D肿瘤细胞球培养装置,一方面由于PDMS材料自身的非细胞粘附性会对细胞产生排斥,有利于细胞自发聚集起来,另一方面通过细胞培养孔半球体曲面的结构设计,使接种的肿瘤细胞在重力的作用下容易沉淀聚集,进而形成球状体。通过3D细胞培养孔的上方进行接种,采用盖玻片在上方进行封口,方便在培养3D肿瘤细胞球状体过程中直接观察。进一步地,在注射泵的作用下注入抗癌药物溶液,收集上清液用于生物检测,可以实现体外3D模型的抗癌药物筛选。相比于现有技术中注射器控制的接种方式,本发明的端口接种方式操作简单,每个细胞培养孔中的细胞接种量均一,因此短时间内3D细胞球状体形成率高。在该装置上不同类型细胞都可以培养成细胞球状体,因此将多个微流控PDMS芯片并联接入将有利于提高药物筛选的通量,节省筛选时间,提高药物筛选的效率。
根据本发明提供的装置,结合非黏附微孔方法,采用非细胞黏附材料PDMS制备微流控芯片,选择合适的3D细胞培养孔结构设计,并将细胞接种的端口设置于3D细胞培养孔的上方,取代常用的注射器控制的细胞接种方法,该设备可以满足不同种类细胞形成细胞球状体的需要,极大地拓宽了该微流控PDMS芯片的通用性。该装置容易接种细胞、方便进样和收集上清液,可进行生物检测,以评估抗癌药物对3D肿瘤细胞的作用,从而筛选出更加有效的抗癌药物。该方法还可以多个细胞培养微流控PDMS芯片同时进行治疗,以提高药物筛选的疗效。
与现有技术相比,本发明的有益效果在于,该装置可以快速形成3D细胞球状体,借助于显微镜可以直接观察球状体形成过程中的细胞生长情况,同时该装置进样方便,收集的上清液可用于进行生物检测,评估抗癌药物对3D肿瘤细胞的作用,从而筛选出更加有效的抗癌药物。该方法还可以进行多个细胞培养微流控PDMS芯片的并联接入,同时培养多种细胞球状体,同时检测一种抗癌药物对多种肿瘤细胞的有效性,从而确定出抗癌药物的最有效适应症。
附图说明
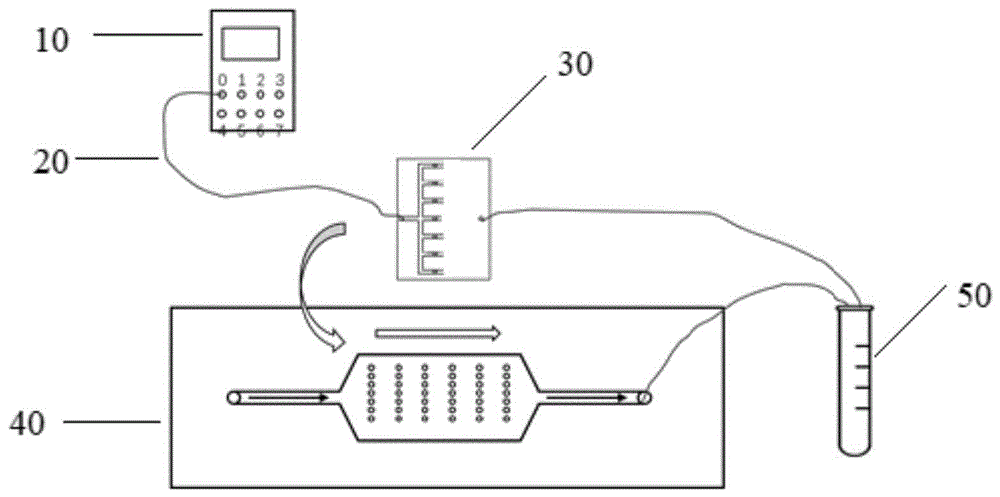
图1示出了实施例1提供的一种基于双层PDMS芯片的3D肿瘤细胞球培养的装置的整体结构示意图;
图2示出了液滴微流控PDMS芯片的三视图;
图3示出了细胞培养微流控PDMS芯片中单个细胞培养孔的横截面示意图,每个芯片有7×6个细胞培养孔,每个细胞培养孔的直径为200μm;
图4示出了实施例2中的活死染料检测结果,包括:LIVE/DEAD Cell Imaging Kit标记肿瘤球状体中活细胞(绿色)和死细胞(红色)的结果图(A),无处理对照(B),用50nM黄苓苷处理后的结果图(C);
图5示出了实施例2中的乳酸脱氢酶检测结果;
图6示出了多个细胞培养微流控PDMS芯片并联接入用于抗癌药物筛选的示意图。
具体实施方式
以下结合说明书附图和具体优选的实施例对本发明作进一步描述,但并不因此而限制本发明的保护范围,以下实施例中所采用的原料和仪器均为市售;所采用的设备和制备工艺若无特别说明均为常规设备和常规工艺。
实施例1一种基于双层PDMS芯片进行3D肿瘤细胞球培养的装置的制备
本实施例制备一种基于双层PDMS芯片进行3D肿瘤细胞球培养的装置,如图1所示,该装置主要由以下部分组成:注射泵10,液体管道20,阀门(图未示出),液滴微流控PDMS芯片30,细胞培养微流控PDMS芯片40,以及收集上清液的离心管50。
1.1PDMS芯片的制备。
PDMS芯片的制备采用以下流程:
首先,使用Solidworks软件(美国马萨诸塞州Concord)进行芯片版图制作,并由EVG620光刻机制造,制得具有微结构的胶片掩膜版;
以单晶硅片为衬底,进行热氧化形成一层2μm的氧化层,再进行光刻,反应离子刻蚀,去胶清洗,光刻,深反应离子刻蚀,对硅片进行浓H
随后将硅片模板置于修饰剂TMSCI蒸汽环境中5min,避免后续操作中PDMS与硅片的过度黏连,接下来裁取适当大小的锡箔纸,将其平铺在平皿的内部,用镊子将修饰好的硅片模板轻放至平皿中;
准备干净的培养皿,锡箔纸,专用胶杯等,然后使用专用量杯依照一定比例(A:B=20:1)称取PDMS预聚物(A胶)和固化剂(B胶)并记录重量,然后将胶杯置于混胶机中,设置好对应重量,混合均匀;
将已经混匀的PDMS混合物倾倒在硅片模板上,之后使用真空泵进行真空脱气20min;将上述抽真空的平皿放置于烘箱中,调节温度到80℃,使其加热固化一定时间(约30min)。固化完成后,将锡箔纸去除,除去硅片模板背面的薄层胶后,小心地将固化好的PDMS层从硅片模板上剥离,动作轻柔防止硅片模板被破坏。最后将剥离的PDMS层按芯片设计的结构进行裁剪,去除多余部分,注意不要影响到结构部分。裁剪好后,按照设计的微结构进行打孔,清理干净孔道,备用。
根据本优选实施提供的一种液滴微流控PDMS芯片30,其结构如图2所示,该液滴微流控PDMS芯片30包括:位于芯片左右两侧的第一进液口31和第一出液口32,以及位于中间部分的7个细胞培养基入口33(在图2中分别编号1-7),这7个细胞培养基入口与第一进液口31的液体流向相互垂直,并通过流道相通,下方与外界相通,以便于通过该处向位于其下方的细胞培养微流控PDMS芯片40进行细胞接种。
根据本优选实施提供的一种细胞培养微流控PDMS芯片40,其结构如图3所示,该细胞培养微流控PDMS芯片40包括:分别位于芯片左右两侧的第二进液口41和第二出液口42,以及位于中间部分的3D细胞培养孔43区域。该3D细胞培养孔43区域与第二进液口41和第二出液口42分别通过一直线通道44、45连通。该3D细胞培养孔区域上设有以7×6阵列排列的3D细胞培养孔43,每个3D细胞培养孔43的直径为200μm,为半球形状凹槽结构。该3D细胞培养孔的上方是裸露的,因此要准备洁净干燥的盖玻片46用于在上方封口。应当理解的是,顶层设有分别与第二进液口41、第二出液口42、3D细胞培养孔43连通的入口端口、出口端口以及中心端口。
1.2装置的组装。
如图1所示,将注射泵10、液体管道20、阀门、液滴微流控PDMS芯片30、离心管50进行连接;同样,将液体管道20,阀门,细胞培养微流控PDMS芯片40,离心管50进行连接;当液滴微流控PDMS芯片30中完成细胞接种后,则将相应的液体管道拆除,上层液滴微流控PDMS芯片30移除,将下层细胞培养微流控PDMS芯片40接入注射泵10;然后将液滴微流控PDMS芯片30放置在细胞培养微流控PDMS芯片40的上方,使七个细胞培养基入口33与一列3D细胞培养孔43一一对准,至此,一种基于双层PDMS的3D肿瘤细胞球培养装置制备完成。接种过程中,每完成一列3D细胞培养孔43的细胞接种,液滴微流控PDMS芯片30从左往右滑动一点,继而进行下一列3D细胞培养孔43的细胞接种,直到完成所有3D细胞培养孔43中的细胞接种。
作为一个优选实施例,细胞接种前,需采用70%乙醇以1μL/min灌注30min对微流控通道和管进行灭菌。乙醇的低表面张力有助于微流控通道的填充而不形成气泡。然后,用消毒过的去离子水以1μL/min的速度冲洗10min,将微通道内表面用1%无菌的泊洛沙姆溶液以1μL/min的速度浸泡30min,以防止细胞粘附,随后即可进行细胞接种。
实施例2抗癌药物的筛选
本实施例采用实施例1制备得到的装置进行抗癌药物黄苓苷的筛选。
2.1肿瘤细胞的接种及培养。
将胃癌细胞MGC-803接种到该装置的3D细胞培养孔43中。整个细胞接种过程要在超净台中进行,保证无菌操作。具体操作如下:待胃癌细胞MGC-803长满后,用胰蛋白酶化,利用细胞计数配制成浓度为2×10
2.2抗癌药物的筛选。
在细胞接种48h后,在细胞培养基中制备50mM黄苓苷,使用注射泵以20μL/min通过微输液装置灌注500μL(20μL/min),持续25min,停止灌注,将装置与泵分离,放回培养箱中孵育,每天灌注一次,每天收集灌注排出来的细胞培养基上清液,在-20℃下保存,用于检测乳酸脱氢酶(LDH)的含量。每天在显微镜下观测拍照一次,连续观测5天,记录细胞球体的生长状况。在接受药物治疗5天后,用Live/
应当理解的是,乳酸脱氢酶(LDH)是一种稳定的蛋白质,存在于正常细胞的胞质中,正常情况下不能透过细胞膜;当细胞受损伤时,膜通透性增强,LDH即被释放到胞外。细胞质内LDH减少,培养液中LDH增多,测定培养液中LDH活性或LDH漏出率即可反映药物的细胞毒性。
根据本发明的一个优选实施例,还可以将多个如图6所示的细胞培养微流控PDMS芯片40并联接入,分别将多种不同类型的细胞接入不同细胞培养微流控PDMS芯片40的3D细胞培养孔43中,培养成3D细胞球状体,用于药物治疗效果的检测,从而提高黄苓苷的筛选通量,拓宽黄苓苷的应用范围,助力肿瘤疾病的治疗。
以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。凡是依据本发明申请的权利要求书及说明书内容所作的简单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
- 一种基于3D打印的细胞均一性分布的生物墨水及其装配方法
- 一种原代肿瘤细胞的3D培养体系及其培养方法和应用
- 一种基于PDMS微孔阵列芯片的细菌分离培养方法
