肾细胞癌生物标记物及其应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明属于生物医药技术领域,具体涉及一种肾细胞癌生物标记物及其应用。
背景技术
肾细胞癌(RCC)起源于肾实质,是最常见的肾细胞癌,占所有肾恶性肿瘤的近90%。大多数国家RCC的发病率仍在增加,发达国家的发病率更高,研究报道全球有超过330,000例RCC发病患者和超过140,000例RCC相关死亡病例。由于RCC初期症状通常不明显,早期诊断RCC并不容易。事实上,约30%的RCC患者在首次诊断时癌细胞已经转移。
尽管舒尼替尼等靶向药物已被用于治疗晚期RCC患者,但不幸的是,耐药性会在6-15个月内出现,使得RCC的总生存期仍不能令人满意。因此,提高RCC对舒尼替尼的敏感性可能是改善RCC预后的重要方法。
长链非编码RNA(lncRNA)被定义为一组长度至少为200个核苷酸的不编码蛋白质的RNA,它们在调节蛋白质编码基因的转录和翻译中发挥着重要作用,基于这些功能,lncRNA参与了多种致癌过程,包括肿瘤细胞增殖、细胞转移、细胞凋亡抑制和细胞耐药性。
ZNF883是一种lncRNA,目前已知其参与卵巢癌和肺癌的发展,但尚未有任何报道表明ZNF883与RCC的发生发展有关,也未有任何报道表明ZNF883与RCC对舒尼替尼的敏感性相关。
发明内容
本发明的发明目的是提供一种肾细胞癌生物标记物及其应用,为肾细胞癌的早期筛查以及肾细胞癌的化疗敏感性及早预测提供了新的途径。
为实现上述发明目的,本发明的技术方案为:
一种肾细胞癌生物标记物,为ZNF883或hsa-miR-567基因,或,ZNF883或hsa-miR-567基因的表达产物。
本发明首次研究发现,ZNF883在肾细胞癌细胞中的表达水平显著低于ZNF883在正常肾上皮细胞中的表达水平;表明ZNF883能够作为肾细胞癌生物标记物,为肾细胞癌的早期筛查或诊断以及预后预测提供一定的参考。
同时,本发明还研究发现,ZNF883与hsa-miR-567在细胞中存在相互作用,当细胞中ZNF883过表达时能够抑制细胞中hsa-miR-567的表达;这与本发明得出的hsa-miR-567在肾细胞癌细胞中显著高表达的结论相一致,表明ZNF883能够通过靶向结合hsa-miR-567而影响肾细胞癌细胞的发生发展。
基于此,本发明提供了上述的肾细胞癌生物标记物在制备肾细胞癌早期筛查或辅助诊断试剂中的应用,以及上述的肾细胞癌生物标记物在制备肾细胞癌预后预测试剂中的应用。
本发明还提供了一种肾细胞癌早期筛查或辅助诊断试剂,以及一种肾细胞癌预后预测试剂;该试剂包括:
特异性识别ZNF883或hsa-miR-567基因的寡核苷酸探针;
或,特异性扩增ZNF883或hsa-miR-567基因的引物;
或,特异性结合ZNF883或hsa-miR-567基因的表达产物的抗体或配体。
作为优选,在上述的肾细胞癌早期筛查或辅助诊断试剂中,所述的特异性扩增ZNF883基因的引物包括:
上游引物:5’-GCATTGGAAGATGTCAGAGAC-3’;
下游引物:5’-GTAGACCAATCCAATGAGATGAG-3’;
所述的特异性扩增hsa-miR-567基因的引物包括:
上游引物:5’-CTTCCAGGACAGAACGTCGT-3’;
下游引物:5’-GTATCCAGTGCGTGTCGTGG-3’。
本发明还提供了一种肾细胞癌早期筛查或辅助诊断试剂盒,该试剂盒中即含有上述的肾细胞癌早期筛查或辅助诊断试剂。
本发明还提供了一种肾细胞癌预后预测试剂盒,该试剂盒中即含有上述的肾细胞癌预后预测试剂。
本发明还研究发现,ZNF883在舒尼替尼耐药肾细胞癌细胞中的表达水平显著低于普通的肾细胞癌细胞,即ZNF883低表达的受试者对舒尼替尼具有更低的化疗敏感性,而ZNF883高表达的受试者对舒尼替尼具有更高的化疗敏感性。基于此,本发明还提供了上述的肾细胞癌生物标记物在制备肾细胞癌化疗敏感性预测试剂中的应用,即通过检测ZNF883的表达水平而预测患者的化疗敏感性,为制定治疗方案提供参考。
本发明还提供了一种肾细胞癌化疗敏感性预测试剂,该化疗敏感性预测包括:
特异性识别ZNF883或hsa-miR-567基因的寡核苷酸探针;
或,特异性扩增ZNF883或hsa-miR-567基因的引物;
或,特异性结合ZNF883或hsa-miR-567基因的表达产物的抗体或配体。
本发明还研究发现,促进ZNF883表达(即降低hsa-miR-567的表达或沉默hsa-miR-567)能够增强肾细胞癌细胞对舒尼替尼的化疗敏感性,抑制肾细胞癌细胞的迁移和侵袭。
基于此,本发明还提供了上述的肾细胞癌生物标记物在制备肾细胞癌化疗敏感性增强试剂中的应用;以及一种肾细胞癌化疗敏感性增强试剂,该化疗敏感性增强试剂包括ZNF883表达促进剂,或者,hsa-miR-567抑制剂或沉默剂。
本发明对ZNF883表达促进剂以及hsa-miR-567抑制剂或沉默剂的具体形式没有特殊要求,只要能够促进ZNF883表达、降低hsa-miR-567的表达或沉默hsa-miR-567即可。
与现有技术相比,本发明的有益效果体现在:
(1)本发明首次研究发现,ZNF883在肾细胞癌细胞中的表达水平显著低于ZNF883在正常肾上皮细胞中的表达水平,并且,ZNF883与hsa-miR-567在细胞中存在相互作用,ZNF883能够通过靶向结合hsa-miR-567而影响肾细胞癌细胞的发生发展;当细胞中ZNF883过表达时能够抑制细胞中hsa-miR-567的表达;这与本发明得出的hsa-miR-567在肾细胞癌细胞中显著高表达的结论相一致,表明ZNF883和hsa-miR-567能够作为肾细胞癌生物标记物,为肾细胞癌的早期筛查或诊断以及预后预测提供一定的参考。
(2)本发明还研究发现,ZNF883在舒尼替尼耐药肾细胞癌细胞中的表达水平显著低于普通的肾细胞癌细胞,即ZNF883低表达的受试者对舒尼替尼具有更低的化疗敏感性,而ZNF883高表达的受试者对舒尼替尼具有更高的化疗敏感性;表明ZNF883和hsa-miR-567能够作为肾细胞癌生物标记物,为肾细胞癌患者对舒尼替尼的化疗敏感性进行检测,为制定治疗方案提供参考。
(3)本发明还研究发现,促进ZNF883表达(即降低hsa-miR-567的表达或沉默hsa-miR-567)能够增强肾细胞癌细胞对舒尼替尼的化疗敏感性,抑制肾细胞癌细胞的迁移和侵袭;给予患者ZNF883表达促进剂或者hsa-miR-567沉默剂能够增强肾细胞癌患者对舒尼替尼的化疗敏感性,提高化疗效果。
附图说明
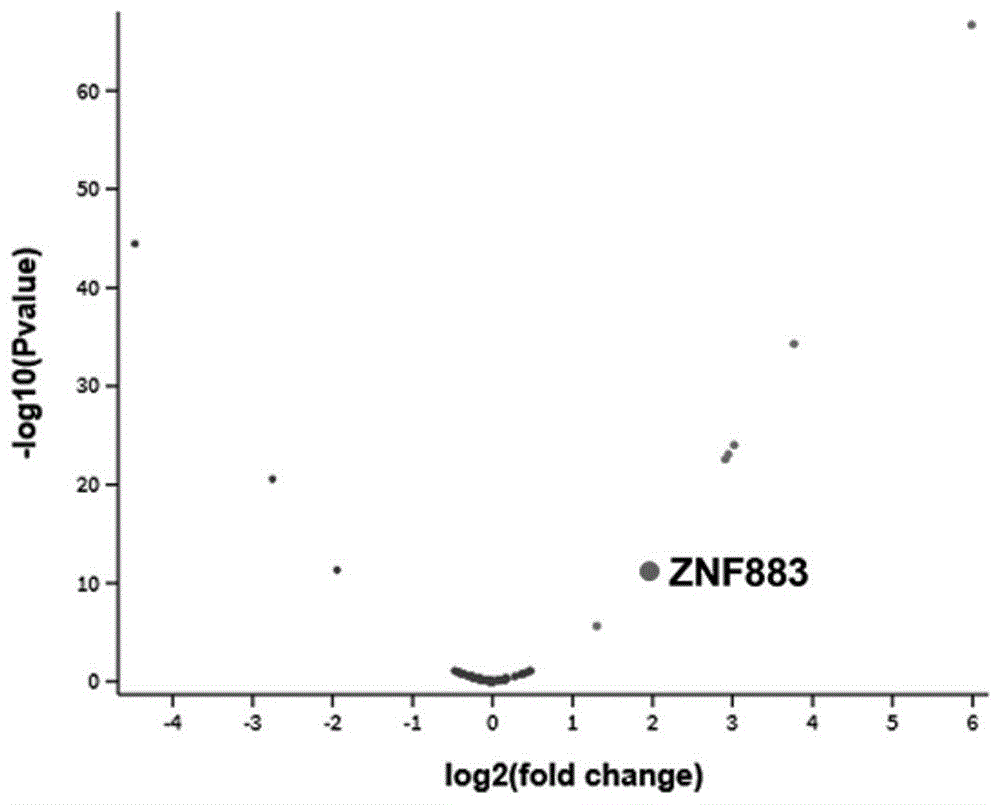
图1为耐舒尼替尼的肾细胞癌细胞中的差异表达lncRNA分析结果;
其中,log2(fold change)表示基因表达倍数以2为底的对数,-log10(Pvalue)表示P值以10为底的负对数;
图2为不同浓度舒尼替尼处理对肾细胞癌细胞活力的影响;
其中,SU(μM)表示舒尼替尼(微摩尔每升),IC50 values(μM)表示半数抑制浓度(微摩尔每升),769P和CAKI-2为肾细胞癌细胞,769P-SU和CAKI-2-SU为耐舒尼替尼的肾细胞癌细胞,Relative cell viability(%)表示相对细胞活力(百分比);##表示与769P相比,769P-SU的细胞活力较强(P<0.01);&&&表示与CAKI-2相比,CAKI-2-SU的细胞活力较强(P<0.001);下同;
图3为lncRNA ZNF883在不同细胞系中的相对表达水平;
其中,HK-2为正常肾上皮细胞,Relative lncRNA ZNF883 expression level表示lncRNA ZNF883的相对表达水平;***表示与HK-2相比,769P、CAKI-2、769P-SU和CAKI-2-SU中lncRNA ZNF883的相对表达水平显著降低(P<0.001);###表示与769P相比,769P-SU中lncRNA ZNF883的相对表达水平显著降低(P<0.001);&&&表示与CAKI-2相比,CAKI-2-SU中lncRNA ZNF883的相对表达水平显著降低(P<0.001);下同;
图4为不同浓度舒尼替尼处理对769P细胞系中lncRNA ZNF883表达的影响;
图5为不同浓度舒尼替尼处理对CAKI-2细胞系中lncRNA ZNF883表达的影响;
图4和图5中,++、+++表示与未采用舒尼替尼处理时,经舒尼替尼处理后细胞中lncRNA ZNF883的相对表达水平显著上升(P<0.01、P<0.001);下同;
图6为不同浓度舒尼替尼处理对769P-SU细胞系中lncRNA ZNF883表达的影响;
图7为不同浓度舒尼替尼处理对CAKI-2-SU细胞系中lncRNA ZNF883表达的影响;
图8为ZNF883过表达对769P-SU细胞系中lncRNA ZNF883表达的影响;
图9为ZNF883过表达对CAKI-2-SU细胞系中lncRNA ZNF883表达的影响;
图8和图9中,NC组表示细胞转染空载体,ZNF883组表示细胞转染ZNF883过表达质粒,NC+SU组表示细胞转染空载体后与2.5μM舒尼替尼共孵育24小时,ZNF883+SU组表示细胞转染ZNF883过表达质粒后与2.5μM舒尼替尼共孵育24小时;下同;
***表示与NC组相比,ZNF883组的lncRNA ZNF883相对表达水平显著上升(P<0.001);&&&表示与NC+SU组相比,ZNF883+SU组的lncRNA ZNF883相对表达水平显著上升(P<0.001);
图10为ZNF883过表达对769P-SU细胞活力的影响;
图11为ZNF883过表达对CAKI-2-SU细胞活力的影响;
图10和图11中,**、***表示与NC组相比,ZNF883组的细胞活力显著上升(P<0.01、P<0.001);&&、&&&表示与NC+SU组相比,ZNF883+SU组的细胞活力显著上升(P<0.01、P<0.001);
图12为ZNF883过表达对769P-SU和CAKI-2-SU细胞迁移能力的影响;
图13为ZNF883过表达对769P-SU细胞迁移能力的影响;
图14为ZNF883过表达对CAKI-2-SU细胞迁移能力的影响;
图13和图14中,Relative migration rate(%)表示相对迁移率(百分比),下同;**、***表示与NC组相比,ZNF883组的相对细胞迁移率显著上升(P<0.01、P<0.001);&&&表示与NC+SU组相比,ZNF883+SU组的相对细胞迁移率显著上升(P<0.001);
图15为ZNF883过表达对769P-SU和CAKI-2-SU细胞侵袭能力的影响;
图16为ZNF883过表达对769P-SU细胞侵袭能力的影响;
图17为ZNF883过表达对CAKI-2-SU细胞侵袭能力的影响;
图16和图17中,Relative invasion rate(%)表示相对侵袭率(百分比),下同;***表示与NC组相比,ZNF883组的相对细胞侵袭率显著上升(P<0.001);&&&表示与NC+SU组相比,ZNF883+SU组的相对细胞侵袭率显著上升(P<0.001);
图18为ZNF883在769P-SU细胞中主要表达位置的测定结果;
其中,Relative RNA expression level表示RNA相对表达水平,cytoplasm表示细胞质,nucleus表示细胞核,下同;
图19为ZNF883在CAKI-2-SU细胞中主要表达位置的测定结果;
图20为ZNF883下游靶基因的筛选方案示意图;
图21为ZNF883与miR-567的结合位点示意;
图22为不同探针拉下的RNA复合物中miR-567的表达情况(769P-SU细胞);
图23为不同探针拉下的RNA复合物中miR-567的表达情况(CAKI-2-SU细胞);
图22和图23中,input为阳性对照,Control probe表示阴性对照探针,ZNF883probe表示ZNF883探针,Enrichment of miR-567in pull-down RNA表示探针拉下的RNA复合物中miR-567的含量,***表示与Control probe组相比,ZNF883 probe组拉下的RNA复合物中miR-567含量显著增加(P<0.001);
图24为ZNF883过表达对769P-SU细胞中miR-567表达的影响;
图25为ZNF883过表达对CAKI-2-SU细胞中miR-567表达的影响;
图24和图25中,Relative miR-567expression level表示miR-567的相对表达水平,+++表示与NC组相比,ZNF883过表达组中miR-567的相对表达水平显著上升(P<0.001);
图26为ZNF883过表达或miR-567过表达对769P-SU细胞中miR-567表达的影响;
其中,NC+MC表示细胞共转染pcDNA3.1空载体和miR-567模拟物对照,ZNF883+MC表示细胞共转染ZNF883过表达质粒和miR-567模拟物对照,M+NC表示细胞共转染pcDNA3.1空载体和miR-567模拟物,M+ZNNF883表示细胞共转染ZNF883过表达质粒和miR-567模拟物;下同;
图27为ZNF883过表达或miR-567过表达对CAKI-2-SU细胞中miR-567表达的影响;
图26和图27中,*、***表示与NC+MC组相比,ZNF883+MC组和M+NC组中miR-567的相对表达水平显著降低或上升(P<0.05、P<0.001);+++表示与M+NC组相比,M+ZNNF883组中miR-567的相对表达水平显著降低(P<0.001);&&&表示与ZNF883+MC相比,M+ZNNF883组中miR-567的相对表达水平显著降低(P<0.001);
图28为ZNF883过表达或miR-567过表达对769P-SU细胞活力的影响;
图29为ZNF883过表达或miR-567过表达对CAKI-2-SU细胞活力的影响;
图28和图29中,**表示与NC+MC组相比,ZNF883+MC组和M+NC组的细胞活力显著降低或上升(P<0.01);+、++表示与M+NC组相比,M+ZNNF883组的细胞活力显著降低(P<0.05、P<0.01);&&、&&&表示与ZNF883+MC相比,M+ZNNF883组的细胞活力显著降低(P<0.01、P<0.001);
图30为ZNF883过表达或miR-567过表达对769P-SU和CAKI-2-SU细胞迁移能力的影响;
图31为ZNF883过表达或miR-567过表达对769P-SU细胞迁移能力的影响;
图32为ZNF883过表达或miR-567过表达对CAKI-2-SU细胞迁移能力的影响;
图31和图32中,*、***表示与NC+MC组相比,ZNF883+MC组和M+NC组的相对细胞迁移率显著降低或上升(P<0.05、P<0.001);+、++表示与M+NC组相比,M+ZNNF883组的相对细胞迁移率显著降低(P<0.05、P<0.01);&&&表示与ZNF883+MC相比,M+ZNNF883组的相对细胞迁移率显著降低(P<0.001);
图33为ZNF883过表达或miR-567过表达对769P-SU和CAKI-2-SU细胞侵袭能力的影响;
图34为ZNF883过表达或miR-567过表达对769P-SU细胞侵袭能力的影响;
图35为ZNF883过表达或miR-567过表达对CAKI-2-SU细胞侵袭能力的影响;
图34和图35中,***表示与NC+MC组相比,ZNF883+MC组和M+NC组的相对细胞侵袭率显著降低或上升(P<0.001);+++表示与M+NC组相比,M+ZNNF883组的相对细胞侵袭率显著降低(P<0.001);&&、&&&表示与ZNF883+MC相比,M+ZNNF883组的相对细胞侵袭率显著降低(P<0.01、P<0.001)。
具体实施方式
下面结合附图和具体实施方式对本发明的技术方案作进一步详细说明。
实施例1ZNF883在肾细胞癌细胞和耐药肾细胞癌细胞中的表达情况1、生物信息分析
通过GEO2R(https://www.ncbi.nlm.nih.gov/geo/geo2r/)分析耐舒尼替尼的肾细胞癌细胞(以下简称RCC细胞)中的差异表达lncRNA(GSE146305数据集),发现ZNF883(核苷酸序列号:NM_001101338.2;
https://www.ncbi.nlm.nih.gov/nuccore/NM_001101338.2)在耐舒尼替尼的RCC细胞中显著低表达,如图1所示。
为验证该发现,本实施例对ZNF883在正常肾上皮细胞HK-2、RCC细胞系(769P,CAKI-2)和耐舒尼替尼RCC细胞系(769P-SU,CAKI-2-SU)中的表达水平进行了实际检测。
2、试验细胞系的获取和耐舒尼替尼RCC细胞系的构建
正常肾上皮细胞系HK-2以及RCC细胞系(769P,CAKI-2)从Procell(中国武汉)获得,并在补充有10%胎牛血清的DMEM中培养。
耐舒尼替尼RCC细胞系的构建方法为:用苹果酸舒尼替尼以0.25μM的初始剂量处理亲代RCC细胞系(769P,CAKI-2)72小时;随后,舒尼替尼的浓度每72小时增加0.25μM;随后对存活的细胞进行传代,直到第10个月IC 50值达到18μM;用补充有0.02μM舒尼替尼的培养基维持稳定的耐舒尼替尼的RCC细胞系(769P-SU,CAKI-2-SU)。
3、试验细胞系的细胞活力检测
采用MTT法测定RCC细胞系(769P,CAKI-2)和耐舒尼替尼的RCC细胞系(769P-SU,CAKI-2-SU)的细胞活力,并计算舒尼替尼对各细胞系的半数最大抑制浓度(IC50)。
通过MTT细胞增殖测定试剂盒测量处理过的细胞的活力:首先,将细胞接种于96孔板(5000个细胞/孔)中;而后分别用0、5、10、20和30μM的舒尼替尼处理769P和CAKI-2细胞以及769P-SU和CAKI-2-SU细胞24小时,之后将10μL MTT试剂添加到每个孔中并孵育4小时,之后,使用DMSO溶解甲臜,并通过酶标仪在570nm波长读取每个孔中的吸光度。检测结果如图2所示。
由图2可见,舒尼替尼对769P细胞的IC50为2.83±0.13μM,舒尼替尼对CAKI-2细胞的IC50为3.04±0.19μM;舒尼替尼对769P-SU细胞的IC50为18.28±1.05μM,舒尼替尼对CAKI-2-SU细胞的IC50为17.28±2.34μM。可以看出,769P-SU和CAKI-2-SU细胞由于经过了舒尼替尼耐药处理,因此细胞活力均大于769P和CAKI-2细胞,表明耐舒尼替尼细胞系构建成功。
4、QRT-PCR测试ZNF883表达水平
用总RNA分离试剂从细胞中提取总RNA,然后在逆转录试剂盒的帮助下将该RNA用于逆转录合成cDNA,之后使用SYBR Green PCR Master Mix进行QRT-PCR反应。
反应条件如下:95℃预变性2分钟;95℃变性15秒,60℃退火/延伸1分钟,共40个循环。引物序列见表1。GAPDH或U6为内源对照,数据采用2
表1引物序列表
检测结果如图3所示。
由图3可见,ZNF883在769P和CAKI-2细胞中的相对表达水平显著低于ZNF883在HK-2细胞中的相对表达水平(p<0.001);同时,ZNF883在769P-SU和CAKI-2-SU细胞中的相对表达水平不仅显著低于ZNF883在HK-2细胞中的相对表达水平(p<0.001),也显著低于ZNF883在769P和CAKI-2细胞中的相对表达水平(p<0.001)。表明ZNF883不仅能够作为肾细胞癌生物标记物,为肾细胞癌的早期筛查或诊断以及预后预测提供一定的参考,还能为肾细胞癌患者对舒尼替尼的化疗敏感性进行预测,为制定治疗方案提供参考。
5、舒尼替尼处理对试验细胞系中ZNF883表达的影响
分别用0、5、10、20和30μM的舒尼替尼处理769P和CAKI-2细胞以及769P-SU和CAKI-2-SU细胞24小时,然后按照与本实施例第(2)部分的相同的方法进行QRT-PCR,检测各细胞系中ZNF883的相对表达水平。检测结果见图4、图5、图6和图7所示。
由图4和图5可见,随着舒尼替尼的浓度增加,769P和CAKI-2细胞中ZNF883的表达不断升高,且存在显著性差异;而由图6和图7可见,随着舒尼替尼的浓度增加,769P-SU和CAKI-2-SU细胞中ZNF883的表达没有显著性改变。进一步证实了ZNF883能够作为肾细胞癌生物标记物,为肾细胞癌患者对舒尼替尼的化疗敏感性进行预测。
实施例2ZNF883过表达对舒尼替尼耐药细胞生物学行为的影响
1、细胞转染
通过PCR扩增ZNF883转录本,然后插入到pcDNA3.1(+)载体中以构建ZNF883过表达质粒,空的pcDNA3.1(+)载体视为阴性对照(NC)。使用Lipo3000转染试剂进行转染:以5×10
2、细胞分组
将细胞分成4组:NC组(769P-SU和CAKI-2-SU细胞转染空载体),ZNF883组(769P-SU和CAKI-2-SU细胞转染ZNF883过表达质粒),NC+SU组(769P-SU和CAKI-2-SU细胞转染空载体后与2.5μM舒尼替尼共孵育24小时)和ZNF883+SU组(769P-SU和CAKI-2-SU细胞转染ZNF883过表达质粒后与2.5μM舒尼替尼共孵育24小时)。
3、转染效率评估
将细胞按照上述第(2)部分分组处理后,按照与实施例1中第(3)的方法进行QRT-PCR,结果如图8和图9所示。
由图8和图9可见,与NC组相比,ZNF883组中由于转染了ZNF883过表达质粒,使得细胞中ZNF883显著高表达(p<0.001);而与NC+SU组相比,ZNF883+SU组中,769P-SU和CAKI-2-SU细胞虽然对舒尼替尼具有耐药性,但由于细胞中转染了ZNF883过表达质粒,ZNF883+SU组中ZNF883的表达水平也被显著提高了(p<0.001)。表明无论肾细胞癌细胞本身对舒尼替尼的化疗敏感性如何,利用ZNF883表达促进剂均能够促进细胞中ZNF883高表达,从而增强肾细胞癌细胞对舒尼替尼的化疗敏感性,提高舒尼替尼的疗效。
4、细胞活力测定
将细胞接种于在96孔板(5000个细胞/孔),然后根据上述第(2)部分分组处理细胞,之后将10μL MTT试剂添加到每个孔中并孵育4小时;之后,使用DMSO溶解甲臜,并通过酶标仪在570nm波长读取每个孔中的吸光度。检测结果如图10和图11所示。
由图10和图11可见,与NC组相比,ZNF883组中由于转染了ZNF883过表达质粒,使得细胞活力显著降低(p<0.001);同时,与NC+SU组相比,ZNF883+SU组的细胞活力也显著降低(p<0.001)。该结论与上述第(3)部分的结论相一致。
5、细胞迁移能力测定
将NC组、ZNF883组、NC+SU组和ZNF883+SU组细胞分别以每孔2×10
由图12、图13和图14可见,与NC组相比,ZNF883组中由于转染了ZNF883过表达质粒,细胞迁移能力显著下降(P<0.01);同时,与NC+SU相比,ZNF883+SU组细胞的迁移能力也被显著抑制(P<0.001)。该结论与上述第(3)和第(4)部分的结论相一致。
6、细胞侵袭能力测定
使用Transwell试验评估转染细胞的侵袭能力。评估方法为:用无血清细胞培养基将细胞的密度调节至5×10
由图15、图16和图17可见,与NC组相比,ZNF883组中由于转染了ZNF883过表达质粒,细胞侵袭能力显著下降(P<0.001);同时,与NC+SU相比,ZNF883+SU组细胞的侵袭能力也被显著抑制(P<0.001)。该结论与上述第(3)、(4)和(5)部分的结论相一致。
实施例3ZNF883下游靶基因的筛选和验证
1、ZNF883的表达位置确定
通过细胞核蛋白与细胞浆蛋白抽提试剂盒来分离细胞核蛋白和细胞浆蛋白,然后按照实施例1第(2)部分的方法分别检测细胞核蛋白和细胞浆蛋白中ZNF883、GAPDH和U6的表达水平。其中,GAPDH作为细胞质中的对照,而U6作为细胞核中的对照。检测结果如图18和图19所示。
由图18和图19可见,ZNF883多在细胞质中表达。
2、生信分析ZNF883下游靶基因
通过GEO2R对GSE37766数据集中的GPL13329筛选log2(fold change)≤-2的在耐舒尼替尼RCC细胞中的差异表达miRNA;同时通过LncBase Predicted v.2(Threshold≥0.8)预测ZNF883下游靶miRNA。两个结果取交集(如图20)后得到一个miRNA,即hsa-miR-567,该miRNA与ZNF883的结合位点如图21所示。
3、RNA下拉实验
根据制造商的建议,使用Pierce Magnetic RNA Protein pull-down Kit(ThermoFisher Scientific)检测miR-567和ZNF883之间的相互作用。生物素化的ZNF883探针和阴性对照探针(ZNF883的反义RNA)由锐博公司合成,Input作为阳性对照。
检测方法为:将磁珠与探针在室温孵育2小时以产生探针包被的磁珠,同时收获1×10
如图22和图23所示,ZNF883探针拉下的RNA复合物中miR-567的表达显著高于阴性对照探针(P<0.001),表明二者具有靶向结合关系。
4、ZNF883过表达对miR-567表达的影响
769P-SU和CAKI-2-SU细胞转染ZNF883过表达质粒或阴性对照质粒后,按照实施案1第(2)部分的方法,通过QRT-PCR检测细胞中miR-567的表达水平;检测结果如图24和图25所示。
如图24和图25所示,ZNF883过表达质粒抑制了细胞中miR-567的表达,表明ZNF883可能通过靶向结合miR-567而影响肾细胞癌的发生和发展。实施例4ZNF883通过靶向miR-567影响舒尼替尼耐药细胞的生物学行为
1、细胞分组
将细胞分成4组:NC+MC组(769P-SU和CAKI-2-SU细胞共转染pcDNA3.1空载体和miR-567模拟物对照),ZNF883+MC组(769P-SU和CAKI-2-SU细胞共转染ZNF883过表达质粒和miR-567模拟物对照),M+NC组(769P-SU和CAKI-2-SU细胞共转染pcDNA3.1空载体和miR-567模拟物),M+ZNNF883组(769P-SU和CAKI-2-SU细胞共转染ZNF883过表达质粒和miR-567模拟物);其中miR-567模拟物的核苷酸序列为:
AGUAUGUUCUUCCAGGACAGAAC(SEQ ID No.5)。
2、细胞转染
按照实施例2第(1)的方式进行细胞转染,然后按照实施例1第(3)的方法进行QRT-PCR,以检测细胞中miR-567的表达;检测结果如图26和图27所示。
由图26和图27所示,与NC+MC组相比,ZNF883+MC组中转染的ZNF883过表达质粒抑制了miR-567的表达,而M+NC组中转染的miR-567模拟物则促进了miR-567的表达;而与ZNF883+MC组相比,M+ZNF883组中虽然共转染了ZNF883过表达质粒和miR-567模拟物,但miR-567模拟物比ZNF883过表达质粒起效更快,总体而言,细胞中miR-567的表达水平仍比ZNF883+MC组要高;但与M+NC组相比,M+ZNF883组中由于存在ZNF883过表达质粒调节miR-567的表达水平,因此总体而言,细胞中miR-567的表达水平比M+NC组要低。
3、细胞活力测定
按照实施例2第(4)部分的方法检测细胞活力,结果如图28和图29所示。
由图28和图29所示,与NC+MC组相比,ZNF883+MC组中由于转染了ZNF883过表达质粒,使得细胞活力显著下降;而M+NC组中由于转染了miR-567模拟物,因此细胞活力显著上升;与ZNF883+MC组相比,M+ZNF883组中虽然共转染了ZNF883过表达质粒和miR-567模拟物,但miR-567模拟物比ZNF883过表达质粒起效更快,总体而言,M+ZNF883组的细胞活力仍高于ZNF883+MC组;但与M+NC组相比,M+ZNF883组中由于存在ZNF883过表达质粒调节miR-567的表达水平,因此总体而言,M+ZNF883组的细胞活力要比M+NC组差。
4、细胞迁移能力测定
按照实施案2第(5)部分的方法检测细胞迁移能力,结果如图30、图31和图32所示。
由图30、图31和图32可见,与NC+MC组相比,ZNF883+MC组中由于转染了ZNF883过表达质粒,使得细胞的迁移能力显著下降;而M+NC组中由于转染了miR-567模拟物,因此细胞的迁移能力显著上升;与ZNF883+MC组相比,M+ZNF883组中虽然共转染了ZNF883过表达质粒和miR-567模拟物,但miR-567模拟物比ZNF883过表达质粒起效更快,总体而言,M+ZNF883组的细胞迁移能力仍高于ZNF883+MC组;但与M+NC组相比,M+ZNF883组中由于存在ZNF883过表达质粒调节miR-567的表达水平,因此总体而言,M+ZNF883组的细胞迁移能力要比M+NC组差。
5、细胞侵袭能力测定
按照实施案2第(6)部分的方法检测细胞侵袭能力,结果如图33、图34和图35所示。
由图33、图34和图35可见,与NC+MC组相比,ZNF883+MC组中由于转染了ZNF883过表达质粒,使得细胞的侵袭能力显著下降;而M+NC组中由于转染了miR-567模拟物,因此细胞的侵袭能力显著上升;与ZNF883+MC组相比,M+ZNF883组中虽然共转染了ZNF883过表达质粒和miR-567模拟物,但miR-567模拟物比ZNF883过表达质粒起效更快,总体而言,M+ZNF883组的细胞侵袭能力仍高于ZNF883+MC组;但与M+NC组相比,M+ZNF883组中由于存在ZNF883过表达质粒调节miR-567的表达水平,因此总体而言,M+ZNF883组的细胞侵袭能力要比M+NC组差。
