包含羟丙基纤维素的改良释放药物制剂
文献发布时间:2023-06-19 19:30:30
技术领域
目前公开的工艺、步骤、方法、产品、结果和/或概念(以下统称为“本公开”)通常涉及羟丙基纤维素(HPC)及其应用。本公开还涉及了衍生自羟丙基纤维素的改良释放药物制剂。
背景技术
药物组合物通常包含聚合物以实现具体的期望的治疗效果,包括用作包衣剂、成膜剂、用于改良释放的速率控制剂、稳定剂、悬浮剂、片剂粘合剂和增粘剂。
人们早就知道,几乎所有药理学活性化合物当在血浆中以一定浓度范围存在时是最有效的,而超过这个范围可能会导致有害的副作用。此外,如果血浆中的过量药物的浓度显著高于产生最大药理作用的推荐血液水平,则可能会浪费,从而使得药物制剂的生产和使用都不必要地昂贵。或者,当血浆中的药物浓度低于最有效范围时,存在活性成分可能不是最有效的或可能根本无效的危险。
当生理上可能时,口服剂型是大多数药物化合物的优选施用途径,因为它提供了容易的、低成本的施用。然而,在口服药物化合物时,患者的依从性是需要考虑的关键因素,特别是如果该化合物必须一天服用三次或四次。为了最大化患者的依从性,期望减少患者为获得有效治疗而必须服用的日剂量单位的数量。使用更少、更长作用的剂量也改善了随时间推移的血液中药物浓度的恒定性,并且由于药物在一天中可以更接近其理想的治疗剂量,这可以改善治疗。
实现这些目标的一种方法是使用改良释放制剂,其在延长的一段时间内有效维持了治疗性血液水平,从而达到最佳治疗。它们不仅降低了给药频率,而且还降低了副作用的严重程度和频率,因为它们维持了基本恒定的血液水平,并且避免了与一天施用三到四次的常规速释制剂相关的波动。
市面上有许多不同的改良释放剂型。这些改良的递送系统中的许多利用了亲水性的聚合物基质,为药物的递送提供了有用的控制水平。在摄入制剂后,活性药物成分从聚合物基质中缓慢释放,导致活性成分的延长释放。配制改良释放组合物的一种方法包括将一种或多种聚合物与所需药物干混,形成组合物,当其暴露于液体时,该组合物形成凝胶;然后药物通过扩散从凝胶中缓慢释放。
过去已经制备了能够改进所含药物的释放的片剂,但是它们并不完全令人满意。它们中的一些由于昂贵的成分或制造它们的复杂的设备或工艺而使制造它们太昂贵,或者由于为获得延迟释放所必需的添加剂而太大。其他片剂由于缺乏一致的释放时间而不令人满意。
另一个重要的考虑因素是引起改良药物释放的材料必须是生理上可接受的。它必须对人体没有毒性作用或只有轻微的毒性作用。它必须被完全清除,使得即使长期使用,它也不会在人体组织中积累。需要用于制备作为改良释放的可口服递送的药物制剂的组合物和工艺,以克服与上述工艺相关的问题。
发明内容
在一方面,本公开提供了一种羟丙基纤维素(HPC),其具有约3.0至约3.9的摩尔取代度、约700,000至约2,000,000道尔顿的重均分子量、和小于100微米的体积平均粒度。在本公开的一个非限制性实施方案中,羟丙基纤维素的摩尔取代度为约3.2至约3.8,或约3.4至约3.7的范围。在本公开的一个非限制性实施方案中,羟丙基纤维素的重均分子量为约1,000,000至约1,500,000道尔顿的范围。在本公开的一个非限制性实施方案中,羟丙基纤维素在25℃的1重量%水溶液中的粘度为至少300mPa.s。在本公开的另一个非限制性实施方案中,羟丙基纤维素在25℃的1重量%水溶液中的粘度可以为约1,000至约3,000mPa.s的范围。
在另一方面,本公开提供了包含羟丙基纤维素的改良释放制剂,所述羟丙基纤维素具有约3.0至约3.9的摩尔取代度、约700,000至约2,000,000道尔顿的重均分子量、和小于100μm的体积平均粒度。在本公开的一个非限制性实施方案中,羟丙基纤维素的摩尔取代度为约3.2至约3.8,或约3.4至约3.7的范围。在本公开的一个非限制性实施方案中,羟丙基纤维素的重均分子量为1,000,000至约1,500,000道尔顿的范围。存在于本公开的改良释放制剂中的羟丙基纤维素在25℃的1重量%水溶液中的粘度为至少300mPa.s。在本公开的一个非限制性实施方案中,羟丙基纤维素在25℃的1重量%水溶液中的粘度为约1,000至约3,000mPa.s的范围。
在本公开的一个非限制性实施方案中,改良释放制剂中羟丙基纤维素的量为总制剂的约5重量%至约99重量%、或约10重量%至约90重量%或约15重量%至约75重量%的范围。
此外,本公开的改良释放制剂还包含药学有效量的至少一种药物,所述药物在25℃的水溶性大于1mg/L。在本公开的一个非限制性实施方案中,所述药物的水溶性大于20mg/L,或大于700mg/L。
在本公开的一个非限制性实施方案中,所述药物选自由以下组成的组:解热、镇痛和抗炎药物,驱肠虫药物,心血管药物,抗菌药物,支气管扩张剂,抗哮喘药物,胃肠道药物,抗糖尿病药物,抗原虫药物,抗病毒药物,抗癫痫药物,利尿剂,或其药学上可接受的盐和酯。
在本公开的另一个非限制性实施方案中,所述药物选自由以下组成的组:依托度酸、阿苯达唑、环丙沙星、红霉素及其衍生物、布洛芬、双氯芬酸、托法替尼、卡维地洛、美托洛尔、沙库巴曲(sacubitril)、缬沙坦、沙丁胺醇、多索茶碱、茶碱、西咪替丁、奥美拉唑、盐酸二甲双胍、西他列汀、替硝唑、氯噻嗪、氢氯噻嗪、阿昔洛韦、卡马西平,及他们的药学上可接受的盐和酯。
在另一非限制性实施方案中,本公开的改良释放制剂还包含至少一种药学上可接受的赋形剂,其选自由以下组成的组:填料、粘合剂、表面活性剂、崩解剂、润滑剂和助流剂。在本公开的一个非限制性实施方案中,所述药学上可接受的赋形剂是选自由以下组成的组的填料:单糖、二糖、多糖及其组合。在本公开的另一非限制性实施方案中,所述填料选自由以下组成的组:纤维素、乳糖、蔗糖、糖、淀粉、加工淀粉、甘露醇、山梨醇、木糖醇、乳糖醇、硅酸、硫酸钙、硅酸铝和硅酸镁的复合物和氧化物、二磷酸钙二水合物和硫酸氢盐。
在本公开的另一非限制性实施方案中,所述药学上可接受的赋形剂是选自由以下组成的组的润滑剂:滑石、硬脂酸钙、硬脂酸镁、聚乙二醇、硬脂酸、胶态二氧化硅、硅酸钙、矿物油、蜡、氢化植物油、山嵛酸甘油酯、苯甲酸钠、乙酸钠、硬脂酰富马酸钠及其组合。
在本公开的另一个非限制性实施方案中,所述药学上可接受的赋形剂是选自由以下组成的组的粘合剂:聚乙烯吡咯烷酮、蔗糖、乳糖、淀粉、加工淀粉、糖、阿拉伯树胶、黄蓍胶、瓜尔胶、果胶、蜡基粘合剂、微晶纤维素(MCC)、甲基纤维素、羧甲基纤维素、共聚维酮、明胶、海藻酸钠、羟丙基甲基纤维素、羟乙基纤维素及其组合。
在本公开的一个非限制性实施方案中,所述药学上可接受的赋形剂以基于改良释放制剂的总重量的约1重量%至约85重量%的量存在。在本公开的另一非限制性实施方案中,所述改良释放制剂是片剂、胶囊、粉末、颗粒、小袋或锭剂的形式。
附图说明
结合附图/图阅读以下描述后,本发明的目的、特征和优点将变得显而易见,其中:
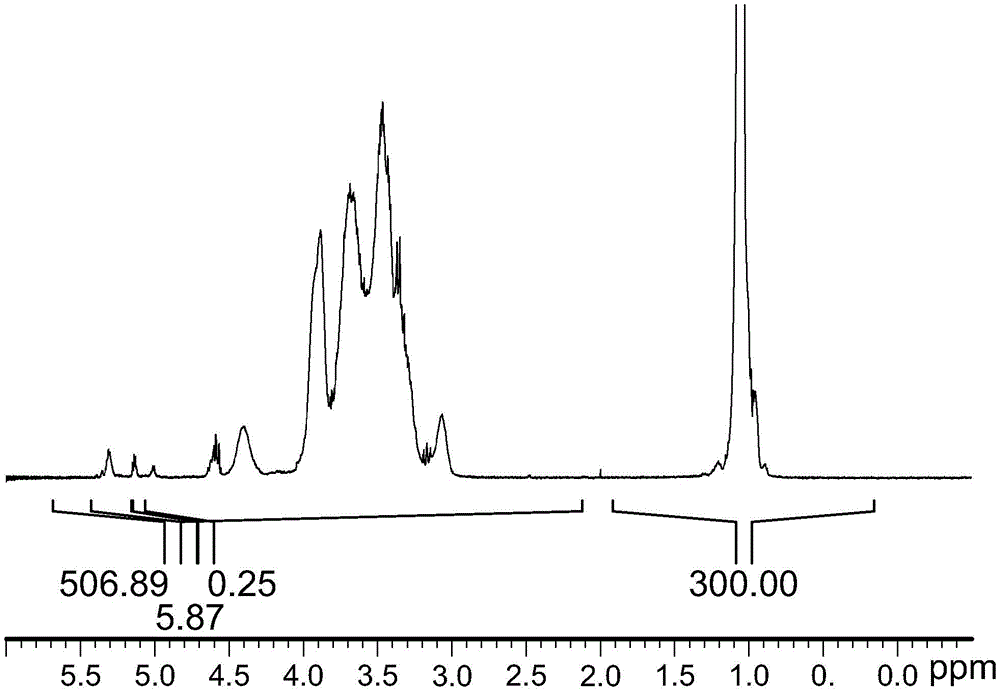
图1显示了代表性羟丙基纤维素样品的NMR光谱。
图2显示了存在于通过使用30重量%的实施例1的羟丙基纤维素(HPC)制备的实施例6的改良释放制剂中的氢氯噻嗪(HCTZ)药物的溶出曲线(以24小时内释放的总药物的百分比表示),以及其与存在于通过使用30重量%的对比实施例5的HPC制备的实施例6A的对比改良释放制剂中的HCTZ药物的溶出曲线的比较。
图3显示了存在于通过使用60重量%的实施例1的HPC制备的实施例7的改良释放制剂中的氢氯噻嗪(HCTZ)药物的溶出曲线(以24小时内释放的总药物的百分比表示),以及其与存在于通过使用30重量%的对比实施例5的HPC制备的实施例7A的对比改良释放制剂中的HCTZ药物的溶出曲线的比较。
图4显示了存在于通过使用20重量%的实施例2的HPC制备的实施例8的改良释放制剂中的布洛芬药物的溶出曲线(以24小时内释放的总药物的百分比表示),以及其与存在于通过使用20重量%的对比实施例5的HPC制备的实施例8A的对比改良释放制剂中的布洛芬药物的溶出曲线的比较。
图5显示了存在于通过使用10重量%的实施例2的HPC制备的实施例9的改良释放制剂中的布洛芬药物的溶出曲线(以24小时内释放的总药物的百分比表示),以及其与存在于通过使用10重量%的对比实施例5的HPC制备的实施例9A的对比改良释放制剂中的布洛芬药物的溶出曲线的比较。
图6显示了存在于通过使用25重量%的实施例2的HPC制备的实施例10的改良释放制剂中的布洛芬药物的溶出曲线(以24小时内释放的总药物的百分比表示),以及其与存在于通过使用25重量%的对比实施例5的HPC制备的实施例10A的对比改良释放制剂中的布洛芬药物的溶出曲线的比较。
图7显示了存在于通过使用15重量%的实施例3的HPC制备的实施例11的改良释放制剂中的氢氯噻嗪(HCTZ)药物的溶出曲线(以24小时内释放的总药物的百分比表示),以及其与通过使用15重量%的对比实施例5的HPC制备的实施例11A的对比改良释放制剂的溶出曲线的比较。
图8显示了存在于通过使用15重量%的实施例4的HPC制备的实施例12的改良释放制剂中的氢氯噻嗪(HCTZ)药物的溶出曲线(以24小时内释放的总药物的百分比表示),以及其与实施例11A的对比改良释放制剂的溶出曲线的比较。
具体实施方式
在通过示例性附图、实验、结果和实验室步骤详细解释本发明概念的至少一个实施方案之前,应当理解,本发明概念的应用不限于在以下描述中阐述的或在附图、实验和/或结果中示出的组件/组分的结构和布置的细节。本发明概念能够具有其他实施方案,或者能够以多种方式实施或执行。因此,本文所使用的语言旨在提供尽可能广泛的范围和含义;并且这些实施方案旨在是示例性的,而不是穷尽性的。此外,应当理解,本文使用的措辞和术语是出于描述的目的,而不应该被认为是限制性的。
除非本文另有定义,否则与本公开结合使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。此外,除非上下文另有要求,单数术语应包括复数,并且复数术语应包括单数。通常,与本文所述的化学技术相关的术语和化学技术是本领域中众所周知和常用的。根据制造商的说明书或本领域中通常完成的或本文所述的来进行反应和纯化技术。与本文所述的分析化学、合成有机化学以及医药化学相关的术语以及其实验室步骤和技术是本领域中众所周知和常用的。标准技术用于化学合成、化学分析、药物制备、制剂和递送、以及患者治疗。
本说明书中提及的所有专利、公布的专利申请和非专利出版物表示本公开所属领域的技术人员的技术水平。在本申请的任何部分中引用的所有专利、公布的专利申请和非专利出版物均通过引用整体地明确地并入本文,其程度与每个单独的专利或出版物被具体地和单独地指示通过引用并入的程度相同。
本文公开和要求保护的所有组合物和/或方法都可以根据本公开来制造和实施,无需过度的实验。虽然已经根据优选实施方案描述了本发明的组合物和方法,但是对于本领域技术人员来说显而易见的是,可以对本文所描述的组合物和/或方法以及所述方法的步骤或步骤的顺序进行改变,而不脱离本公开的构思、精神和范围。所有对本领域技术人员来说显而易见的这些类似的替代和改变都被视为在由所附权利要求限定的本发明概念的精神、范围和构思内。
如根据本公开所使用的,除非另有说明,否则以下术语应理解为具有以下含义:
当在权利要求和/或说明书中与术语“包括”结合使用时,不定冠词(“a”或“an”)的使用可以表示“一个”,但是其也符合“一个或多个”、“至少一个”和“一个或多于一个”的意思。权利要求中术语“或”的使用用于表示“和/或”,除非明确说明是仅指替代方案或替代方案相互排斥,尽管本公开支持仅指替代方案和“和/或”的定义。在整个本申请中,术语“约”用于表示值包括设备、用于确定该值的方法的固有误差变化、或研究对象之间存在的变化。术语“至少一个”的使用将理解为包括一个以及多于一个的任何数量,包括但不限于2、3、4、5、10、15、20、30、40、50、100等。术语“至少一个”可以扩展到100或1000或更多,这取决于其所连接的术语。此外,不应将100/1000的数量视为限制,因为更高的限制也会产生令人满意的结果。此外,术语“X、Y和Z中的至少一个”的使用将理解为包括单独的X、单独的Y和单独的Z,以及X、Y和Z的任何组合
如在本说明书和权利要求中所使用的,词语“包含(comprising)”(和包含的任何形式,例如“comprise”和“comprises”)、“具有(having)”(和具有的任何形式,例如“have”和“has”)、“包括(including)”(和包括的任何形式,例如“includes”和“include”)或“含有(containing)”(和含有的任何形式,例如“contains”和“contain”)是包容性的或开放的,且不排除额外的、未引用的要素或方法步骤。
如本文所使用的术语“或其组合”是指该术语之前的所列项目的所有排列和组合。例如,“A、B、C或其组合”旨在包括A、B、C、AB、AC、BC或ABC中的至少一个,并且如果顺序在特定的上下文中很重要,则还包括BA、CA、CB、CBA、BCA、ACB、BAC或CAB。继续该实例,明确包括的是包含一个或多个项目或术语的重复的组合,例如BB、AAA、MB、BBC、AAABCCCC、CBBAAA、CABABB等等。本领域技术人员将理解,通常对任何组合中的项目或术语的数量没有限制,除非从上下文中显而易见。
如本文所用,术语“药物”或“活性药物成分”或“API”是指旨在用于制造药物(药用)产品的任何物质或物质的混合物,当用于生产药物产品时,其成为药物产品的活性成分。这些物质旨在提供药理学活性或疾病的诊断、治愈、缓解、治疗或预防中的其他直接作用,或影响人类或其他动物的身体的结构或功能。此外,术语“药物”或“活性药物成分”或“API”在本公开中可以互换使用。
如本文所用,与本公开的组合物相关的术语“改良释放”是指不旨在速释,并且可以包括控制释放、持续释放、延长释放、定时释放、延缓释放、缓慢释放和延迟释放的组合物。
如本文所用,术语“改良释放药物制剂”或“改良释放剂型”可描述为这样的剂型,其药物释放的时间过程和/或位置的特征选择为实现常规剂型如溶液或速释剂型所不能提供的治疗或方便目的。改良释放固体口服剂型包括延迟释放和缓慢释放药物产品(根据USFDA的关于“SUPAC-MR:改良释放固体口服剂型”的指南)。
如本文所用,术语“药物有效量”可以描述治疗或预防疾病所需的无毒且足够的药物的量,并且可以根据多种因素进行调整,包括但不限于疾病类型,疾病严重程度,制剂中包含的活性成分或其他成分的类型和含量,剂型,患者的年龄、体重、健康状况、性别和饮食行为,药物施用时间等。在任何个别情况下的合适的有效量可以由本领域普通技术人员仅使用常规实验来确定。
本公开的一个方面提供了一种羟丙基纤维素(HPC),其具有为约3.0至约3.9的范围的每摩尔无水葡萄糖的摩尔取代度(MS),以及为约700,000至约2,000,000道尔顿的范围的重均分子量。在本公开的一个非限制性实施方案中,羟丙基纤维素的摩尔取代度可以为约3.2至约3.8的范围。在本公开的另一非限制性实施方案中,羟丙基纤维素的摩尔取代度可以为约3.4至约3.7的范围。
在本公开的一个非限制性实施方案中,羟丙基纤维素的重均分子量可以为约750,000至约2,000,000道尔顿或约800,000至约2,000,000道尔顿或约800,000至约1,700,000道尔顿或约1,000,000至约1,500,000道尔顿的范围。
根据本公开的羟丙基纤维素可以以粉末形式存在,并且可以具有体积平均粒度小于100μm的颗粒。在本公开的一个非限制性实施方案中,羟丙基纤维素的体积平均粒度可以为约40μm至约80μm或约50μm至约75μm的范围。本公开的羟丙基纤维素的体积平均粒度是指在通过使用称为Malvern Mastersizer 3000的激光散射粒度分布测量装置进行测量而获得的粒度分布中,累积体积达到50%的点处的粒度D50。
根据本公开的羟丙基纤维素(HPC)可以通过相关领域中已知的用于制备羟烷基纤维素的方法来制备。在本公开的一个非限制性实施方案中,羟丙基纤维素(HPC)可以通过以下方式来获得:(i)使纤维素原料与碱性水溶液反应以获得碱性纤维素;(ii)进一步使碱性纤维素与环氧丙烷反应,以获得粗羟丙基纤维素产物;(iii)用酸性水溶液中和过量的碱性溶液;以及(iv)洗涤、过滤和干燥粗产物以获得最终纯化的羟丙基纤维素产物。可以将纯化的羟丙基纤维素产物进一步研磨以获得粉末形式的羟丙基纤维素。根据本公开获得的羟丙基纤维素的1重量%水溶液在25℃可具有至少300mPa.s的粘度。在本公开的一个非限制性实施方案中,羟丙基纤维素的粘度可以为约300mPa.s至约10,000mPa.s或约500mPa.s至约8,000mPa.s或约1,000mPa.s至约5,000mPa.s或约1500mPa.s至约3,000mPa.s的范围。
本公开的另一方面提供了一种包含羟丙基纤维素(HPC)的改良释放制剂或改良释放剂型,所述羟丙基纤维素具有为约3.0至约3.9的范围的每摩尔无水葡萄糖的摩尔取代度(MS),以及约700,000至约2,000,000道尔顿的重均分子量。在本公开的一个非限制性实施方案中,羟丙基纤维素的摩尔取代度可以为约3.2至约3.8的范围。在本公开的另一非限制性实施方案中,羟丙基纤维素的摩尔取代度可以为约3.4至约3.7的范围。
在本公开的一个非限制性实施方案中,羟丙基纤维素(HPC)的重均分子量可以为约750,000至约2,000,000道尔顿的范围。在本公开的另一非限制性实施方案中,羟丙基纤维素的重均分子量可以为约800,000至约2,000,000道尔顿或约800,000至约1,700,000道尔顿或约1,000,000至约1,500,000道尔顿的范围。
在本公开的一个非限制性实施方案中,羟丙基纤维素(HPC)可以以粉末形式存在,并且可以具有体积平均粒度小于100μm的颗粒。在本公开的一个非限制性实施方案中,HPC的体积平均粒度可为约40μm至约80μm或约50μm至75μm的范围。本公开的羟丙基纤维素的体积平均粒度是指在通过使用称为Malvern Mastersizer 3000的激光散射粒度分布测量装置进行测量而获得的粒度分布中,累积体积达到50%的点处的中值粒度(D50)。
此外,根据本公开的羟丙基纤维素(HPC)可以以足以改进存在于本公开的改良释放制剂中的至少一种活性药物成分(API)的释放的量使用。在本公开的一个非限制性实施方案中,羟丙基纤维素的量可以为占总改良释放制剂的约5重量%至约99重量%、或约10重量%至约90重量%、或约15重量%至约75重量%、或约30重量%至约60重量%的范围。
本公开的改良释放制剂还可以包含至少一种活性药物成分(API)。在本公开的一个非限制性实施方案中,所述活性药物成分可以是药物。或者,所述活性药物成分(API)可以是生物功能性成分。用于本公开目的的生物功能性成分的实例可包括但不限于膳食补充剂,包括但不限于维生素,如维生素C、维生素B1、B2、B3、B6和B12;矿物质,如锌、镁、铁和褪黑激素;草药膳食补充剂,如姜黄素、南非醉茄(ashwagandha)和胡芦巴提取物;氨基酸,如异亮氨酸、甘氨酸、L-色氨酸、葡萄糖胺、软骨素等。任何具有宽范围的水溶性的药物都可以适用于本公开的改良释放制剂。在本公开的一个非限制性实施方案中,所述药物可以选自在25℃具有大于1mg/L、或大于16mg/L、或大于20mg/L、或大于700mg/L、或大于18,000mg/L、或大于300,000mg/L的水溶性的药物的组。此外,适用于本公开的改良释放制剂的药物可选自属于不同治疗类别的那些药物,例如解热、镇痛和抗炎药物,驱肠虫药物,心血管药物,抗菌药物,支气管扩张药物,抗哮喘药物,胃肠道药物,抗糖尿病药物,抗原虫药物,抗病毒药物,抗癫痫药物,抗利尿药物,或其药学上可接受的盐和酯。
解热、镇痛和抗炎药物的实例可以包括但不限于依托度酸、布洛芬、双氯芬酸和托法替尼。驱肠虫药物的实例包括但不限于阿苯达唑。心血管药物的实例可以包括但不限于卡维地洛、美托洛尔、沙库巴曲和缬沙坦。抗菌药物的实例可以包括但不限于红霉素、环丙沙星或任何药学上可接受的盐或酯。支气管扩张药物的实例包括但不限于沙丁胺醇。抗哮喘药物的实例包括但不限于多索茶碱和茶碱。胃肠道药物的实例可以包括但不限于西咪替丁和奥美拉唑。抗糖尿病药物的实例包括但不限于盐酸二甲双胍和西他列汀。抗原虫药物的实例包括但不限于替硝唑。抗病毒药物的实例包括但不限于阿昔洛韦。抗癫痫药物的实例包括但不限于卡马西平。抗利尿药物的实例包括但不限于氯噻嗪和氢氯噻嗪。
此外,活性药物成分可以以药物有效量存在于本公开的改良释放制剂中。如上所述,本公开的改良释放制剂可适用于具有宽范围的水溶性的任何药物。因此,存在于本公开的改良释放制剂中的一种或多种药物的量可以根据多种因素而变化,这些因素包括但不限于所使用的一种或多种药物的类型,所治疗/治愈的疾病的性质和严重程度,制剂中所含的活性成分或其他成分的类型和含量、剂型,患者的年龄、体重、健康状况、性别和饮食行为,药物施用时间等。
本公开的改良释放制剂还可以包含至少一种药学上可接受的赋形剂。通常用于药物组合物的药学上可接受的赋形剂也适用于本发明的改良释放制剂,例如,在Handbook ofPharmaceutical Excipients,Rows et al.,Eds.,4th Edition,Pharmaceutical Press(2003)或Remington:The Science and Practice of Pharmacy,(formerly calledRemington's Pharmaceutical Sciences),Alfonso R.Gennaro,ed.,LippincottWilliams&Wilkins;20th edition(Dec.15,2000)中描述的赋形剂。这类赋形剂的实例可以包括但不限于填料、色素、粘合剂、润滑剂、助流剂、调味剂、甜味剂、防腐剂、稳定剂、抗氧化剂等。
药学上可接受的赋形剂可以以不影响本改良释放制剂的治疗性质的量存在。药学上可接受的赋形剂可以包含总改良释放制剂的约1重量%至约85重量%。在本公开的一个非限制性实施方案中,药学上可接受的赋形剂可以包含总改良释放制剂的约5重量%至约75重量%或总改良释放制剂的约5重量%至约60重量%。
可存在于本公开的改良释放制剂中的填料的实例可包括但不限于纤维素;低聚糖,如乳糖和蔗糖;糖;淀粉;加工淀粉;糖醇,如甘露醇、山梨醇、木糖醇和乳糖醇;硅酸;无机酸盐;硫酸钙、和硅酸铝和硅酸镁的复合物和氧化物。无机酸盐赋形剂的具体实例可以包括但不限于磷酸盐如二磷酸钙二水合物和硫酸氢盐。此外,填料可以以总改良释放制剂的约5.0重量%至约15重量%的量存在。
可存在于本公开的改良释放制剂中的粘合剂的实例可包括但不限于聚乙烯吡咯烷酮(PVP)、蔗糖、乳糖、淀粉、加工淀粉、糖、阿拉伯树胶、黄蓍胶、瓜尔胶、果胶、蜡基粘合剂、微晶纤维素(MCC)、甲基纤维素、羧甲基纤维素、共聚维酮、明胶和海藻酸钠。粘合剂可以以总改良释放制剂的约1重量%至约80重量%的量存在。
类似地,可存在于本公开的改良释放制剂中的合适的润滑剂可包括但不限于硬脂酸镁、硬脂酸、棕榈酸、硬脂酸钙、滑石、巴西棕榈蜡、氢化植物油、矿物油、聚乙二醇、硬脂酰富马酸钠和酸(例如硬脂酸、棕榈酸、肉豆蔻酸、油酸、月桂酸、山嵛酸、芥酸)的蔗糖脂肪酸酯等。此外,润滑剂可以以总改良释放制剂的约0.1重量%至约20重量%的量存在。
本公开的改良释放制剂还可以包含至少一种额外的改良释放剂。此类改良释放剂的实例可以包括但不限于海藻酸钠、羧基乙烯基聚合物、丙烯酸基聚合物如甲基丙烯酸氨基烷基酯共聚物RS(Eudragit RS,由Rohm Pharma GmbH制造)和丙烯酸乙酯-甲基丙烯酸甲酯共聚物悬浮液(Eudragit NE,由Rohm Pharma GmbH制造)。额外的改良释放剂可以以总改良释放制剂的约5重量%至约50重量%的量存在。
适用于本公开的改良释放制剂的pH调节剂的实例可以是无机酸,如盐酸、硫酸、氢溴酸和磷酸;有机酸,如乙酸、琥珀酸、富马酸、苹果酸、草酸、乳酸、戊二酸、水杨酸和酒石酸及其盐;或者其任意组合。
其他药学上可接受的赋形剂也可以存在于本公开的改良释放制剂中。例如,着色剂或食品染料,如食品黄5号、食品红2号和食品蓝2号、食品色淀染料或三氧化二铁;pH缓冲液,例如基于胺的缓冲液或基于碳酸盐的缓冲液;表面活性剂,例如十二烷基硫酸钠、聚山梨醇酯80、氢化油或聚氧乙烯(160)聚氧丙烯(30)二醇;稳定剂,如生育酚、乙二胺四乙酸四钠、烟酰胺或环糊精;以及酸化剂,如柠檬酸、酒石酸、苹果酸或抗坏血酸。
本公开的改良释放制剂可以以干燥的固体剂型存在。干燥的固体剂型对于将准确的剂量递送到具体部位特别有用,通常是口服,但也可以通过相关领域技术人员已知的其他途径施用,例如舌下/颊、直肠、阴道和眼部施用。在本公开的一个非限制性实施方案中,改良释放制剂可以以适用于口服施用的固体剂型存在。此类剂型可以包括但不限于片剂、胶囊、粉末、颗粒、小袋或锭剂。在本公开的一个非限制性实施方案中,改良释放制剂是片剂。
此外,出于掩盖气味或味道、稳定化、保持功效等目的,可以将本公开的改良释放制剂的片剂形式用基质材料包衣。包衣可以包含糖或成膜聚合物。
在本公开的一个非限制性实施方案中,片剂可以是糖包衣的、膜包衣的、肠溶包衣的或用改良释放剂的薄层或薄膜包衣的,以进一步改进药物/活性药物成分从制剂中的释放。
在本公开的一个非限制性实施方案中,片剂可以是糖包衣的。片剂的糖包衣基本上是包裹在片剂表面的厚且硬的糖包衣,这是为了隐藏特别令人不愉快的味道的药物或任何其他活性药物成分的味道,并为片剂提供稳定性,防止其在光和湿气的作用下破裂。根据本公开的片剂的糖包衣可以使用糖基材料进行。可用于本公开目的的糖基材料的实例可包括但不限于绵白糖。也可以在糖基材料中加入额外的药学上可接受的赋形剂,以增强糖基包衣的性质,例如改善的结合能力和机械强度,以及抗粘性质。此类额外的赋形剂的实例可以包括但不限于明胶、阿拉伯树胶、聚乙烯吡咯烷酮、普鲁兰多糖、滑石、沉淀碳酸钙、磷酸钙、钙等。此外,糖基包衣还可以包含作为额外的药物赋形剂的食用香料或着色剂/色素。
在本公开的另一非限制性实施方案中,片剂可以是膜包衣片。片剂的膜包衣通常包括用保护性聚合物薄膜对片剂的芯进行包裹。因此,本公开的片剂可以包含聚合物薄膜,特别是作为包衣层的基于水溶性膜的聚合物。合成聚合物和天然聚合物都可用于片剂膜包衣。合成聚合物的实例可以包括但不限于聚乙烯醇、聚乙烯醇-聚乙二醇接枝共聚物、聚乙烯醇-丙烯酸-甲基丙烯酸甲酯共聚物、聚乙烯醇缩乙醛二乙氨基乙酸酯、甲基丙烯酸氨基烷基酯共聚物、聚乙烯吡咯烷酮和聚乙二醇。天然聚合物的实例可以包括但不限于多糖,例如普鲁兰多糖。
在本公开的另一非限制性实施方案中,片剂可以是肠溶膜包衣的。片剂上的肠溶膜包衣期望保护胃免受片剂制剂的影响;保护药物免受胃酸的影响,并在具体位置(通常是胃或肠的下部区域)释放活性药物成分。本片剂的肠溶膜包衣可以使用肠溶膜包衣基质材料来进行。此类材料的实例可以包括但不限于丙烯酸衍生物,例如甲基丙烯酸共聚物L、甲基丙烯酸共聚物LD和甲基丙烯酸共聚物S;以及天然材料如虫胶。
此外,本公开的改良释放制剂的片剂形式可以用改良释放剂薄层或薄膜来包衣,以进一步增强或改善本改良释放制剂的改良释放效率。为此,本公开的片剂可以用本改良释放制剂的薄层或薄膜,或额外的改良释放剂的薄层或薄膜,或两者的组合来包衣。
在一个非限制性实施方案中,片剂可以用本公开的改良释放制剂的薄层或薄膜来包衣。用于包衣目的的改良释放制剂还可包含至少一种用于糖包衣、膜包衣和肠溶包衣的包衣材料,如本公开上文所述。
在本公开的另一非限制性实施方案中,片剂可以用额外的改良释放剂的薄层或薄膜来包衣。此类额外的改良释放剂的实例可以包括但不限于羟丙甲纤维素、聚环氧乙烷、羟乙基纤维素、乙基纤维素、甲基丙烯酸共聚物、瓜尔胶、黄原胶、海藻酸盐、淀粉衍生物、蜡和脂肪。
用于本公开目的的包衣材料还可以包含至少一种在本公开上文中描述的药学上可接受的赋形剂,例如粘合剂、润滑剂、增塑剂、稳定剂、着色剂等。
对于用于制备本公开的改良释放制剂,特别是固体口服剂型如片剂的改良释放制剂所采用的方法是没有限制的。任何药学领域中公知的压片方法,例如湿法制粒压片法或干法制粒压片法或干法直接压片法,都可以适用于本公开的目的。在一个非限制性实施方案中,片剂形式的改良释放制剂可以通过湿法制粒法制备,其中所述方法包括以下步骤:(i)混合羟丙基纤维素、活性药物成分如药物和其他需要的药学上可接受的赋形剂的混合物,以制备均匀的均质共混物;(ii)加入润湿剂以获得捏合的共混物,随后将其制粒以获得所得颗粒;(iii)将所得颗粒干燥并筛分至适于压制的最佳尺寸;(iv)将从工艺步骤(iii)获得的筛过的颗粒与合适的药学上可接受的润滑剂如硬脂酸镁共混;以及最后(v)将从工艺步骤(iv)获得的共混颗粒压制成片剂。
在另一非限制性实施方案中,本公开的改良释放制剂可以通过干法制粒法制备,所述方法包括以下步骤:(i)分配并混合预定量的本公开的改良释放制剂的各种成分,例如羟丙基纤维素、活性药物成分和药学上可接受的赋形剂,以获得均匀的粉末共混物;(ii)通过冲击(slugging)或辊压对均匀的粉末共混物进行压实,以获得扁平的大片剂或丸;(iii)将扁平的大片剂或丸研磨和筛分以获得均匀的颗粒;以及(iv)对颗粒进行压片。润滑剂如硬脂酸镁和其他赋形剂如崩解剂、助流剂等也可以在对均匀颗粒进行压片之前加入到其中。
在另一非限制性实施方案中,本公开的改良释放制剂可以通过干法直接压片法或直接可压制法来制备,所述方法包括以下步骤:(i)预研磨或筛分本公开的改良释放制剂的各种成分,如羟丙基纤维素、活性药物成分如药物和药学上可接受的赋形剂包括润滑剂,以获得粉末成分;(ii)均匀地共混或混合粉末成分以获得均质共混物;以及(iii)对均质共混物进行压片以获得片剂。
在本公开的一个非限制性实施方案中,存在于改良释放制剂中的羟丙基纤维素:(i)可提供活性药物成分的低剂量倾倒(dumping),(ii)可在一段时间内均匀释放活性药物成分,(iii)可提供有效的片剂压制特性,以及(iv)可提供较低的聚合物用量水平的活性药物成分的控制释放。
除非另有说明,以下实施例说明了本公开,份数和百分比均以重量计。每个实施例是通过解释本公开而不是限制本公开的方式提供的。实际上,对于本领域技术人员来说显而易见的是,可以在不脱离本发明的范围或精神的情况下在本公开中进行各种修改和变化。例如,作为一个实施方案的一部分示出或描述的特征可以用于另一个实施方案以产生又一实施方案。因此,本公开旨在覆盖落入所附权利要求及其等同物的范围内的这种修改和变化。
实施例
本公开的实施例1-4提供了本公开的羟丙基纤维素(HPC)。
实施例1(Ex.1):HP-MS为3.72的羟丙基纤维素(HPC)的制备
将1份切割的纯化的纤维素浸入7份庚烷、2份叔丁醇、0.5份水和0.2份50%氢氧化钠水溶液的混合物中,得到浆料。搅拌该浆料以获得碱性纤维素。然后将2.6份环氧丙烷(PO)加入到含有碱性纤维素的浆料中,得到反应混合物。然后将所得反应混合物加热至105℃并保持该温度,直到所有PO反应。然后将含有粗羟丙基纤维素产物的反应混合物冷却至室温,用乙酸中和过量的氢氧化钠。通过过滤去除溶剂,然后用热水洗涤产物,过滤去除盐和杂质。将如此获得的纯化滤饼在约130℃-140℃干燥,直到达到水分<5%。将如此获得的干燥的羟丙基纤维素研磨,直到获得具有D
实施例2(Ex.2):HP-MS为3.72的HPC的制备
除了使用2.8份的环氧丙烷之外,以与实施例1所述相同的方式制备该实施例的HPC。
实施例3(Ex.3):HP-MS为3.56的HPC的制备
除了使用2.0份的环氧丙烷之外,使用实施例1所述步骤制备该实施例的HPC。
实施例4(Ex.4):HP-MS为3.56的HPC的制备
除了使用2.1份的环氧丙烷之外,以与实施例1所述相同的方式制备该实施例的HPC。
对比实施例5(Comp.Ex.5):
使用购自Ashland Specialty Ingredient G.P.的市售HPC,Klucel HXF作为对比实施例来说明本公开的实施例1-4的HPC的益处。
按照下文给出的测试方法,测量实施例1-4和对比实施例5的羟丙基纤维素的羟丙基摩尔取代度(HP-MS)、分子量(MW)分布、粘度和体积平均粒度。测量值在表1中给出。
表1:实施例1-4和对比实施例5的HPC的特征细节
/>
测试方法:
1.羟丙基摩尔取代度的测量:
实施例1-4和对比实施例5的HPC的HP-MS值通过NMR进行测定,如下:
样品水解:首先将25mg样品在1.00gm D
NMR测量:定量
1H NMR光谱使用Bruker 400MHz NMR光谱仪进行记录,并用Topspin软件处理。采集参数如下:温度300K,扫描宽度20ppm,脉冲宽度45deg,扫描次数32,弛豫延迟30s。处理参数如下:谱线增宽0.3Hz。
使用标准实践对光谱进行相位和基线校正。最高场信号的中心(羟丙基取代的甲基)参照1.05ppm。光谱积分如下:
区域A(IA)=1.90-0.15ppm(积分面积校准到值为300,其他积分面积与该积分值相关)。
区域B(IB)=5.70-2.15ppm。
代表性HPC样品的NMR光谱如图1所示。
HP MS和重量%HP的计算如下
HP MS=(7/(IB–IA))*100
重量%HP=((HP MS*MW OC3H6OH)/(MW AHG+(HP MS*(MW C3H6OH–MW H))))*100
MW OC3H6OH=75.086
MW C3H6OH=59.087
MW AHG=162.141
MW H=1.008
2.分子量(MW)分布:
本实施例1-4和对比实施例5的羟丙基纤维素的分子量(MW)分布的分析通过使用尺寸排阻色谱法来确定。分子量是分子中原子的原子量的总和。如本文关于聚合物所使用的,术语分子量、平均分子量、均值分子量和表观分子量是指通过尺寸排阻色谱法(SEC)测量的单个大分子的分子量的算术平均值。相对于具有窄分子量分布的聚(乙二醇/环氧乙烷)(PEG/PEO)标准品,计算来自分析SEC的相对分子量平均值。根据以下方法实施尺寸排阻色谱法:
(a).色谱装置
装置中的所有Waters模块均由Waters Corporation(34 Maple Street,Milford,MA 01757,USA)制造。该装置可由不同制造商的类似装置代替。
Waters M515溶剂输送系统
Waters M717自动采样器
Waters M2414示差折光率检测器(DRI),用于相对SEC*
色谱柱组-请参见下面“分析条件”部分中的详细信息
Waters Empower 2软件
*RI范围1.00至1.75RIU
测量范围7x10-7RIU
漂移-2x10-7RIU
(b)SEC的分析条件
流动相-55%0.1M乙酸锂/45%乙醇
流速-0.8ml/min
色谱柱-TSKgel guard(6mm x 40mm)+2Linear TSK GMPWXL色谱柱;13μm;300mm x7.8mm(TOSOH Bioscience LLC,3604Horizon Drive,Suite 100,King of Prussia,PA19406,USA
柱温-35℃
DRI(示差折光率)检测器温度-35℃
校准-具有窄分子量分布的PEO/PEG标准品(PSS-USA,Inc.Amherst FieldsResearch Park,160 Old Farm Road,Amherst,MA 01002)
样品浓度-通常为1mg/ml(除非另有说明)
注射体积-200μl
3.粘度测量:
将HPC缓慢加入搅拌的去离子水中,并搅拌1小时。在25℃的恒温槽中平衡温度1小时。使用LV主轴#4以30rpm通过Brookfield粘度计测量粘度,3分钟后读取读数。
4.粒度测量:
通过使用Malvern Mastersizer 3000激光散射粒度分析仪测量实施例1-4和对比实施例5的粉末形式的羟丙基纤维素的粒度。使用配备有通用料斗/样品托盘对和标准不锈钢文丘里粉末分配器的Aero S干粉进料器对粉末形式的样品进行测量。Aero S料斗间隙设置为4.0mm。通过完全填充1/4茶匙测量勺并将其装入料斗来测量粉末样品。粉末进料速率设定为30%,空气压力设定为3.0巴。在关闭遮蔽滤波(obscuration filtering)的情况下,将遮蔽限制设置为0.2%下限和10%上限。将背景测量时间设置为10秒,样品测量时间设置为20秒,测量设置为一旦遮蔽在设置的范围内并且在0.1秒的稳定时间之后开始。将Fraunhofer散射模型和“General Purpose”分析模型用于数据分析,使用体积分布将其转换为颗粒直径。
一种市售的HPC,商品名为Nisso HPC H,分子量为652,000,在25℃的1重量%水溶液粘度为146mPa.s,以及粒度D50为170μm,预期显示出比本公开的HPC更差的改良药物释放性能。Nisso HPC H的分子量、粘度和粒度按照上文描述的测试方法进行测量。
药物改良释放测试
本实施例1-4的羟丙基纤维素与药物和其他药学上可接受的赋形剂一起进一步用于改良释放制剂中。表2列出了用于生产本改良释放制剂的药物。
表2:用于本改良释放制剂的测试药物列表
实施例6:具有30重量%的实施例1的HPC的改良释放制剂(Ex.6)
氢氯噻嗪、实施例1的HPC和喷雾干燥的乳糖(成分1-3)按表3中列出的重量比例称重,通过USP筛#20进行筛分,并在Turbula混合器中共混10分钟。硬脂酰富马酸钠、胶态二氧化硅和硬脂酸镁也分别称重,通过USP筛#20进行筛分,并加入到成分1-3的共混物中。将如此获得的所得粉末共混物再次在Turbula混合器中共混2分钟,以获得均质的粉末共混物。然后使用压实模拟器STYL’one,模拟以67RPM(64320片/小时)的压制速度操作的manestybeta压制机,使用11.28平面冲头和25kN压实力的模具,将均质的粉末共混物压制成片剂。获得单个片剂重量为约500mg的片剂。
表3:实施例6和实施例6A的改良释放制剂
/>
实施例6A:具有30重量%的对比实施例5的HPC的对比改良释放制剂(Ex.6A)
使用以上表3中所列量的成分,以与以上实施例6中所述相同的方式,制备使用30.0重量%的对比实施例5的HPC的对比改良释放制剂(Ex.6A)。
在pH=6.8的0.05M磷酸盐中以100RPM的恒定搅拌速度使用USP装置I以50mg的剂量进行实施例6和实施例6A的片剂的溶出测试。在0.25、0.5、0.75、1、2、3、4、6、8、10、12、14、16、20、22、24小时取样,并通过0.45μm尼龙膜过滤。通过在线(inline)UV检测在272nm分析样品。图2显示了对于两种制剂即Ex.6和Ex.6A,以24小时内释放的总药物的百分比表示的氢氯噻嗪(HCTZ)的溶出曲线。从图2中明显看出,药物从实施例6的改良释放制剂中的释放比药物从实施例6A的对比改良释放制剂中的释放更慢。
实施例7:具有60重量%的实施例1的HPC的改良释放制剂(Ex.7)
在本实施例中制备了包含60重量%的实施例1的HPC的改良释放制剂(Ex.7)。使用以下表4中所列量的成分,以与上述实施例6相同的方式制备本实施例的改良释放制剂。
表4:实施例7和实施例7A的改良释放制剂
/>
实施例7A:具有60重量%的对比实施例5的HPC的对比改良释放制剂(Ex.7A)
使用以上表4中所列量的成分,以与上述实施例7的改良释放制剂相同的方式,制备包含60.0重量%的对比实施例5的HPC的对照改良释放制剂(Ex.7A)。
以与上述实施例6和实施例6A相同的方式,在pH=6.8的0.05M磷酸盐中以100RPM的恒定搅拌速度使用USP装置I以50mg的剂量进行实施例7和实施例7A的片剂的溶出测试。图3显示了对于两种制剂即Ex.7和Ex.7A,以24小时内释放的总药物的百分比表示的氢氯噻嗪(HCTZ)的溶出曲线。从图3中明显看出,药物从实施例7的改良释放制剂中的释放比实施例7A的对比改良释放制剂中的释放更慢。
实施例8:具有20重量%的实施例2的HPC的改良释放制剂(Ex.8)
在该实施例中,使用20重量%的实施例2的HPC制备单个片剂重量为约860mg的改良释放制剂片剂(Ex.8)。使用以下表5中所列量的成分,以与上述实施例6相同的方式制备本实施例的改良释放制剂(Ex.8)。
表5:实施例8和实施例8A的改良释放制剂
实施例8A:具有20重量%的对比实施例5的HPC的对比改良释放制剂(Ex.8A)
使用以上表5中所列量的成分,以与上述实施例8的改良释放制剂相同的方式,制备包含20.0重量%的对比实施例5的HPC的对比改良释放制剂(Ex.8A)。
以与上述实施例6和实施例6A相同的方式,在pH=7.2的0.05M磷酸盐中以100RPM的恒定搅拌速度使用USP装置I以60mg的剂量进行实施例8和实施例8A的片剂的溶出测试。通过在线UV检测在221nm分析样品。图4显示了对于两种制剂即Ex.8和Ex.8A,以24小时内释放的总药物的百分比表示的布洛芬的溶出曲线。药物从实施例8的改良释放制剂中的释放比药物从实施例8A的对比改良释放制剂中的释放更慢。
实施例9:具有10重量%的实施例2的HPC的改良释放制剂(Ex.9)
类似于实施例8的制剂,该实施例描述了除了使用10重量%的实施例2的HPC以外,使用与实施例8中所述相同的成分和步骤制备单个片剂重量为约860mg的改良释放制剂。因此,调整了其他成分的重量比例,并列于下表6中。
表6:实施例9和实施例9A的改良释放制剂
实施例9A:具有10重量%的对比实施例5的HPC的对比改良释放制剂(Ex.9A)
使用以上表6中所列量的成分,以与上述实施例9的改良释放制剂相同的方式,制备包含10.0重量%的对比实施例5的HPC的对比改良释放制剂(Ex.9A)。
使用与上述实施例6和实施例6A相同的步骤,在pH=7.2的0.05M磷酸盐中使用USP装置I以600mg剂量进行实施例9和实施例9A的片剂的溶出测试。图5显示了对于两种制剂Ex.9和Ex.9A,以24小时内释放的总药物的百分比表示的布洛芬的溶出曲线。药物从实施例9的改良释放制剂中的释放比药物从实施例9A的对比改良释放制剂中的释放更慢。
实施例10:具有25重量%的实施例2的HPC的改良释放制剂(Ex.10)
在该实施例中,使用25重量%的实施例2的HPC来制备单个片剂重量为约500mg的改良释放制剂片剂(Ex.10)。使用以下表7中所列量的成分,以与上述实施例6中相同的方式,制备本实施例的改良释放制剂(Ex.10)。
表7:实施例10和实施例10A的改良释放制剂
实施例10A:具有25重量%的对比实施例5的HPC的对比改良释放制剂(Ex.10A)
使用以上表7中所列量的成分,以与上述实施例10的改良释放制剂相同的方式,还制备了包含25.0重量%的对比实施例5的HPC的对比改良释放制剂(Ex.10A)。
以与上述实施例6和实施例6A相同的方式,在pH=7.2的0.05M磷酸盐中以100RPM的恒定搅拌速度使用USP装置I以600mg剂量进行实施例10和实施例10A的片剂的溶出测试。图6显示了对于两种制剂即Ex.10和Ex.10A,以24小时内释放的总药物的百分比表示de布洛芬的溶出曲线。药物从实施例10的改良释放制剂中的释放比药物从实施例10A的对比改良释放制剂中的释放更慢。
实施例11:具有15重量%的实施例3的HPC的改良释放制剂(Ex.11)
在本实施例中,使用15重量%的实施例3的HPC制备单个片剂重量为约500mg的改良释放制剂片剂。使用以下表8中所列量的成分,以与上述实施例6中所述相同的方式制备所述片剂。
表8:实施例11和实施例11A的改良释放制剂
/>
实施例11A:具有15重量%的对比实施例5的HPC的对比改良释放制剂(Ex.11A)
使用以上表8中所列量的成分,以与上述实施例11的改良释放制剂相同的方式,制备包含15.0重量%的对比实施例5的HPC的对比改良释放制剂(Ex.11A)。
以与上述实施例6相同的方式,在pH=6.8的0.05M磷酸盐中以100RPM的恒定搅拌速度使用USP装置I以50mg的剂量进行实施例11和实施例11A的片剂的溶出测试。实施例11的改良释放制剂(Ex.11)的溶出曲线显示在图7中,并与实施例11A的对比改良释放制剂的溶出曲线进行了比较。药物从实施例11的改良释放制剂(Ex.11)中的释放比药物从实施例11A的对比改良释放制剂(Ex.11A)中的释放更慢。
实施例12:具有15重量%的实施例4的HPC的改良释放制剂(Ex.12)。
在本实施例中,使用15重量%的实施例4的HPC制备了单个片剂重量为约500mg的改良释放制剂片剂。使用以下表9中所列量的成分,以与上述实施例6中所述相同的方式制备所述片剂。
表9:实施例12的改良释放制剂
以与上述实施例6相同的方式,在pH=6.8的0.15M磷酸盐中以100RPM的恒定搅拌速度使用USP装置I以50mg的剂量进行本实施例的片剂的溶出测试。通过在线UV检测在272nm分析样品。实施例12的改良释放制剂(Ex.12)的溶出曲线显示在图8中,并与对照改良释放制剂Ex.11A的溶出曲线进行了比较。药物从实施例12的改良释放制剂中的释放比药物从实施例11A的对比改良释放制剂中的释放更慢。
