一种大肠杆菌无抗生素表达系统及其在高效表达目的基因中的应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及生物工程技术领域,具体涉及一种大肠杆菌无抗生素表达系统及其在高效表达目的基因中的应用。
背景技术
大肠杆菌是一种革兰氏阴性菌,因其遗传背景清晰,易于基因工程操作,繁殖迅速,生长要求低,来源广泛等优点,使其成为利用最为广泛的基因工程菌株,目前已经广泛应用于代谢工程产物以及重组蛋白的生产。EcN是大肠杆菌中唯一一种益生菌,利用EcN益生菌自身的菌体特性,在治疗各种肠胃疾病如溃疡性结肠炎、传染性腹泻等具有良好效果。EcN自身生物安全性加上大肠杆菌的优良特性,在利用EcN生产某些食品级代谢物优于一般大肠杆菌菌株,并且被广泛应用于医药研发中。
目前,肠杆菌表达系统中最为主要的原件是质粒载体,大部分的质粒通过抗性筛选标记维持分离稳定性。然而,抗生素的使用会造成耐药菌的出现,会对环境带来负面影响,增加生产成本。同时,质粒上的抗性基因,也会造成基因污染,造成基因突变。在EcN中转入常规抗性质粒,导致EcN的益生菌特性大幅降低,使该菌株在使用范围上极度受限,几乎不能在临床上应用。因此,基于生物安全性益生菌EcN构建无抗生素表达平台具有重要的意义。
有研究人员也在致力于开发无抗生素标记的大肠杆菌表达系统。如CN115029365A公开了一种大肠杆菌益生菌EcN无抗生素表达体系,但pMUT1和pMUT2的改造后质粒虽然不需使用抗生素培养,但是质粒上的抗性基因依然存在,可能有抗性基因污染的风险。而且pMUT1和pMUT2的生物学作用还未完全研究清楚,对其进行改造,可能会影响菌株的生长发育,削弱EcN的益生菌特性。CN102604983A也公开了一种无抗生素筛选标记大肠杆菌表达体系,其中菌株表达依然需要三氯生辅助,三氯生的使用存在争议,比如,有研究表明三氯生可能的致癌性,美国FDA禁止洗涤品中添加三氯生,总的来说,三氯生的使用范围在不断缩小。因此,如何构建无抗生素、无抗性基因筛选标记、安全性高的高效表达系统至关重要。
发明内容
为解决上述技术问题,本发明构建了一种大肠杆菌益生菌无抗生素表达系统,以大肠杆菌益生菌EcN为原始菌株,通过生物分子技术在表达载体中引入基因
本发明的第一个目的是提供一种无抗生素筛选标记筛选大肠杆菌的方法,包括以下步骤:
S1、将表达载体中的抗性基因替换为山梨醇脱氢酶编码基因
S2、将S1得到的重组大肠杆菌于含有碳源的培养基中培养实现筛选,所述碳源为可被山梨醇脱氢酶降解且降解产物可用于重组大肠杆菌生长的物质。
进一步地,所述表达载体优选为质粒。
进一步地,所述质粒可为任何适用于大肠杆菌表达的质粒种类,包括但不限于改造或未改造的pCDFduet1质粒、pET质粒、pBAD质粒、pTrc质粒、pGEX质粒等。本发明能够改造目前最广泛应用的大肠杆菌表达载体,所有大肠杆菌类的表达载体均可使用本发明进行改造,最终实现菌株在无抗生素条件下的蛋白表达。
进一步地,所述大肠杆菌宿主菌为改造或未改造的大肠杆菌。
进一步地,所述大肠杆菌宿主菌包括但不限于大肠杆菌Nissle 1917或其衍生菌株。
进一步地,通过分子生物学技术将抗性基因替换为
进一步地,所述山梨醇脱氢酶可来源于任何含有该酶且能在大肠杆菌中实现异源表达的物种,应包括所有枯草芽孢杆菌属以及其余菌属的同源基因或人工优化序列,如萎缩芽胞杆菌globigii亚种(
进一步地,山梨醇脱氢酶编码基因
进一步地,所述碳源包括但不局限于山梨醇、木糖醇、艾杜醇、核糖醇、半乳糖醇、甘露醇等,以及基因
进一步地,培养基中上述碳源浓度为5-20 g/L。
本发明的第二个目的是提供一种无抗生素筛选标记的质粒,所述质粒是采用山梨醇脱氢酶编码基因
本发明的第三个目的是提供一种无抗生素筛选标记的重组大肠杆菌,所述重组大肠杆菌含有上述质粒。
进一步地,所述重组大肠杆菌为改造或未改造的大肠杆菌Nissle 1917。
本发明的第四个目的是提供一种大肠杆菌无抗生素表达系统,表达系统包括表达原件、表达菌株和培养体系:
所述表达原件中包括重组质粒,所述重组质粒为采用山梨醇脱氢酶编码基因
所述表达菌株为改造或未改造的大肠杆菌;
所述培养体系中包括含有碳源的培养基,所述碳源为可被山梨醇脱氢酶降解且降解产物可用于重组大肠杆菌生长的物质。
本发明的第五个目的是提供上述质粒、重组大肠杆菌或表达系统在合成生物学领域中的应用。
进一步地,所述合成生物学领域应用包括苯丙氨酸解氨酶、橄榄酸合成通路、萜类物质合成通路等。
本发明的第六个目的是提供上述质粒、重组大肠杆菌或表达系统在制备生物药物(如基因工程疫苗、微生物菌剂等)中的应用。
进一步地,基因工程疫苗包括但不限于如下种类:流感疫苗、霍乱疫苗或活菌疫苗载体等;还可以用于制备如下种类的药物:重组人胰岛素、a2b型干扰素、兰尼单抗、青蒿素、GLP-1多肽(人胰高血糖素样肽-1)等。
进一步地,制备生物药物时,在载体上连接目的基因,所述目的基因为药物有效成分的编码基因和/或成药辅助物质的编码基因。其中,药物有效成分即为上述抗体、多肽等,成药辅助药物可为用于靶向、阻断等用途的物质。
本发明的第七个目的是提供一种采用大肠杆菌高效表达目的基因的方法,包括以下步骤:
S1、将表达载体中的抗性基因替换为山梨醇脱氢酶编码基因
S2、将S1得到的重组大肠杆菌于含有碳源的培养基中培养实现目的基因的高效表达,所述碳源为可被山梨醇脱氢酶降解且降解产物可用于重组大肠杆菌生长的物质。
进一步地,目的基因包括但不限于荧光蛋白基因、人表皮生长因子基因、血红素蛋白基因、GLP-1多肽基因、苯丙氨酸解氨酶基因、聚酮合酶基因、聚酮环化酶基因等。
本发明的有益效果:
本发明以大肠杆菌益生菌EcN作为底盘菌,采用基因
附图说明
图1为实施例1中pCDFduet1-gutB无抗生素表达质粒图谱。
图2为实施例2中EcN-pCDFduet1-gutB无抗生素表达菌株在分别以山梨醇、木糖醇、艾杜醇、核糖醇、半乳糖醇、甘露醇为碳源进行培养的生长曲线。
图3为pCDFduet1-gutB-eGFP质粒图谱。
图4为pCDFduet1-eGFP质粒图谱。
图5为pCDFduet1-dadX-eGFP质粒图谱。
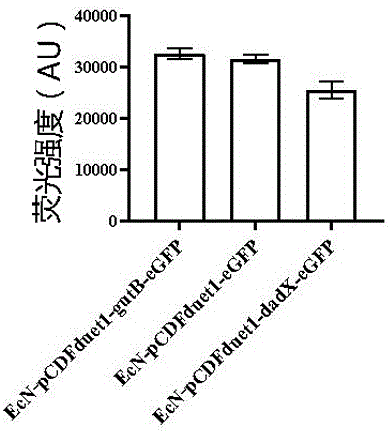
图6为实施例3中EcN-pCDFduet1-gutB-eGFP无抗生素表达菌株、EcN-pCDFduet1-eGFP常规表达菌株、EcN-pCDFduet1-dadX-eGFP营养缺陷型无抗生素表达菌株的荧光强度测定结果。
图7为实施例4中的EcN-pCDFduet1-gutB-eGFP无抗生素表达菌株、EcN-pCDFduet1-eGFP常规表达菌株、EcN-pCDFduet1-dadX-eGFP营养缺陷型无抗生素表达菌株的质粒稳定性测定结果。
图8为实施例5中苯丙酮尿症(PKU)小鼠血液中苯丙氨酸含量的变化。ICR小鼠为对照组,代表正常小鼠;PKU-0 为喂养正常饲料7天的PKU小鼠;PKU-3、PKU-6、PKU-9、PKU-12分别为连续3天、6天、9天和12天定时灌喂EcN-pCDFduet1-gutB-PAL菌株的发病PKU小鼠。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
下述实施例中所用的引物如下:
无抗生素表达菌株构建时涉及的PCR引物
下述实施例中涉及的材料:
大肠杆菌Nissle 1917(EcN)、质粒pCDFduet1均购自武汉淼灵生物科技有限公司。
下述实施例中涉及的培养基:
SOC培养基:2% 胰蛋白胨 、0.5% 酵母提取物、0.05% 氯化钠、2.5 mM 氯化钾、10mM 氯化镁、10mM 硫酸镁、20 mM D-葡萄糖,调节至pH7.5。
gutB培养基:33.90 g/L 磷酸氢二钠、15.00 g/L 磷酸二氢钾、2.50 g/L 氯化钠、5.00 g/L 氯化铵、0.24 g/L 硫酸镁、0.01 g/L 氯化钙、10 g/L 艾杜糖(可替换为同浓度的山梨醇、木糖醇、核糖醇、半乳糖醇、甘露醇等碳源物质)。
实施例1 EcN-pCDFduet1-gutB无抗生素表达菌株的构建
1.质粒pCDFduet1-gutB构建
以枯草芽孢杆菌基因组为模板,使用gutB-F/gutB-R引物,PCR扩增得到基因
2.EcN电转感受态细胞的制备
将EcN种子悬液以2 mL接种于300 mL SOC液体培养基中,37 ℃,220 rpm振荡培养3 h至OD
3.表达菌株EcN-pCDFduet1-gutB构建
将构建好的质粒pCDFduet1-gutB电转化至EcN感受态细胞中,转化方法如下:
(1)从-80 ℃冰箱中取出EcN感受态细胞,置于冰上解冻,加入pCDFduet1-gutB质粒,冰浴10分钟,同时将电转化杯进行冰浴。
(2)打开电转仪,调节电压为2.1 KV。
(3)将冰浴后的感受态细胞转移到电转化杯中,轻轻敲击电极杯使混合物均匀进入电极杯的底部。
(4)将电极杯推入电转化仪中,按一下脉冲键,听到蜂鸣声后,电转完成,向电击杯中迅速加入800 μL的LB液体培养基,重悬细胞后,转移到1.5 mL的离心管中。
(5)30 ℃,220 rpm复苏1小时。
(6)涂布于gutB培养基(无抗生素添加),37 ℃倒置培养16 小时。
挑平板EcN-pCDFduet1-gutB上的单克隆至5mL 液体gutB培养基中,37℃,220rpm培养16小时,提取质粒,利用引物gutB-F/gutB-R进行PCR鉴定,PCR为阳性的即为EcN-pCDFduet1-gutB无抗生素表达菌株。
实施例2 EcN-pCDFduet1-gutB无抗生素表达菌株利用不同碳源的生长情况对比
为了进一步优化EcN-pCDFduet1-gutB无抗生素表达菌株的生长条件,选取6种gutB基因可以降解的碳源,分别为:山梨醇、木糖醇、艾杜醇、核糖醇、半乳糖醇、甘露醇,对其进行培养,并且绘制不同碳源培养条件下的生长曲线。将菌株EcN-pCDFduet1-gutB分别接种到500mL不同碳源的gutB培养基中,37 ℃,220 rpm培养24小时。每隔2小时定时取样,采用分光光度计测定OD
生长曲线结果如图2所示,EcN-pCDFduet1-gutB无抗生素表达菌株在所选6种碳源不同的培养基中,均可正常生长,并且该菌株在艾杜糖中生长情况最好。
实施例3 EcN-pCDFduet1-gutB-eGFP、EcN-pCDFduet1-eGFP菌株、EcN-pCDFduet1-dadX-eGFP营养缺陷型无抗生素菌株的蛋白表达比较
1.EcN-pCDFduet1-gutB-eGFP无抗生素表达菌株、EcN-pCDFduet1-dadX-eGFP无抗生素表达菌株和EcN-pCDFduet1-eGFP常规表达菌株的构建
为测试本发明大肠杆菌益生菌无抗生素表达系统的效果,分别构建不同无抗生素表达菌株和常规表达菌株,同时检测这三种菌株荧光活性。
以pET23b-eGFP质粒为模板,使用eGFP-F/eGFP-R引物,PCR扩增得到eGFP基因, 通过同源重组的方法,将eGFP基因分别组装至pCDFduet1-gutB和pCDFduet1质粒上,形成质粒pCDFduet1-gutB-eGFP和pCDFduet1-eGFP,质粒pCDFduet1-gutB-eGFP和pCDFduet1-eGFP图谱如图3-4所示。将质粒pCDFduet1-gutB-eGFP和pCDFduet1-eGFP采用实施例1的方法转入至EcN中,形成EcN-pCDFduet1-gutB-eGFP和EcN-pCDFduet1-eGFP菌株。
EcN-pCDFduet1-dadX-eGFP表达菌株以EcN为底盘菌,通过基因编辑手段敲除dadX和alr基因,形成不能合成D-丙氨酸的营养缺陷型菌株。在该菌株中,将pCDFduet1质粒上的抗性基因替换为dadX基因,形成营养缺陷型无抗生素菌株EcN-pCDFduet1-dadX-eGFP(图谱见图5)。本实施例中引入该菌株,旨在对比常见的营养缺陷型无抗生素菌株和本发明构建的无抗生素表达菌株在蛋白表达方面的能力,故不解释详细构建过程。
2.EcN-pCDFduet1-gutB-eGFP无抗生素表达菌株、EcN-pCDFduet1-eGFP菌株、EcN-pCDFduet1-dadX-eGFP营养缺陷型无抗生素菌株的荧光强度测定
将EcN-pCDFduet1-eGFP和EcN-pCDFduet1-dadX-eGFP分别加入5 mL SOC培养基,EcN-pCDFduet1-gutB-eGFP加入5 mL gutB培养基中,37 ℃,220 rpm培养16小时,作为种子液。取两种菌株1 mL的种子液,分别将入50 mLgutB培养基中,37 ℃,220 rpm培养至OD
结果表明(图6),EcN-pCDFduet1-gutB-eGFP无抗生素表达菌株在不需要添加抗生素的培养条件下,可达到和EcN-pCDFduet1-eGFP菌株相同的表达效果,比EcN-pCDFduet1-dadX-eGFP营养缺陷型无抗生素菌株的表达能力更强。
实施例4 EcN-pCDFduet1-gutB-eGFP无抗生素菌株质粒稳定性评价
1. 菌株传代
分别取10.0 μL过夜培养的EcN-pCDFduet1-gutB-eGFP、EcN-pCDFduet1-eGFP、EcN-pCDFduet1-dadX-eGFP菌株的菌液,加入20 mL的培养基中,37 ℃,220 rpm培养24小时,作为初代菌。从初代菌开始,重复上述操作,连续传代12天。
2. 菌株计数
分别取每一代培养的菌液10.0 μL,进行梯度稀释,稀释10^7倍为止,将各个菌株的菌液涂布至相应平板上,37 ℃,培养16小时后,进行菌落计数。
3. 结果分析
结果表明(图7),EcN-pCDFduet1-gutB-eGFP和EcN-pCDFduet1-eGFP菌株连续培养十二代,质粒无明显丢失。EcN-pCDFduet1-dadX-eGFP菌株在培养至第8代时,质粒出现丢失。此结果说明EcN无抗生素表达菌株体系的质粒稳定性强于营养缺陷型无抗生素菌株体系,并且和常规菌株的无明显差异。
实施例5 EcN-pCDFduet1-gutB-PAL无抗生素表达菌株对小鼠血液中降解苯丙氨酸的降解情况
1.EcN-pCDFduet1-gutB-PAL无抗生素表达菌株的构建
为进一步评估本发明构建的大肠杆菌益生菌无抗生素表达系统的应用,以pET23b-PAL质粒为模板,使用PAL-F/ PAL-R引物,PCR扩增得到PAL基因(SEQ ID NO.2),通过同源重组的方法,将PAL基因组装至pCDFduet1-gutB质粒上,形成质粒pCDFduet1-gutB-PAL。采用实施例1的方法将质粒pCDFduet1-gutB-PAL转入至EcN中,形成菌株EcN-pCDFduet1-gutB-PAL。
2.EcN-pCDFduet1-gutB-PAL无抗生素表达菌株对小鼠血液中降解苯丙氨酸的降解情况
选用8 只SPF 级ICR 小鼠,检测血液中苯丙氨酸浓度作为对照。选取8只PKU纯合雄鼠,用普通维持饲料连续喂食7天,检测验证小鼠血液中苯丙氨酸浓度升高至发病水平。然后在继续喂食普通维持饲料的基础上,每日定时灌胃0.5 mL 1×10
结果表明(图8),本发明构建的工程益生菌EcN-pCDFduet1-gutB-PAL可以显著降低PKU 小鼠血液中的苯丙氨酸浓度,在9天内将发病PKU小鼠血液中苯丙氨酸浓度降至ICR的正常水平。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
- 采样保持电路极其形成方法和模数转换器
- 一种比特精度改善的光子模数转换方法及系统
- 光子模数转换系统的光采样信号保持方法
- 基于光子并行采样的光模数转换架构及其实现方法
