通过使用抗Globo H或抗SSEA-4抗体与抗负面免疫检查点抗体的联合疗法
文献发布时间:2023-06-19 09:44:49
对相关申请的交叉引用
本申请案主张于2018年6月1日申请的美国专利申请号62/679,510的优先权,其全部公开内容在此并入本案以作为参考资料。
技术领域
本发明涉及与抗PD-1或PD-L1抗体组合的抗Globo H或抗SSEA-4碳水化合物抗体。研究结果为抗Globo H或抗SSEA-4碳水化合物抗体与抗PD-1或抗PD-L1抗体的共同施用提供理论基础,其以协同方式挽救由Globo H神经酰胺或SSEA-4神经酰胺配合PD-1/PD-L1所诱导的T细胞失活。本发明提供了以抗Globo H或抗SSEA-4碳水化合物抗体结合抗PD-1或抗PD-L1抗体用于治疗癌症的方法。
背景技术
在恶性肿瘤细胞中表达许多表面碳水化合物。举例而言,碳水化合物抗原Globo H(Fucα1→2Galβ1→3GalNAcβ1→3Galα1→4Galβ1→4Glc)最初在1984年时以神经酰胺连接的糖脂从乳腺癌MCF-7细胞中分离与鉴定(Bremer E G,et al.(1984)J Biol Chem 259:14773-14777)。先前的研究亦显示,在乳腺癌细胞与乳腺癌干细胞中观察到Globo H与阶段特异性胚胎抗原3(Galβ1→3GalNAcβ1→3Galα1→4Galβ1→4Glcβ1)(SSEA-3,亦称作Gb5)(WW Chang et al.(2008)Proc Natl Acad Sci USA,105(33):11667-11672)。此外,SSEA-4(阶段特异性胚胎抗原-4)(Neu5Acα2→3Galβ1→3GalNAcβ1→3Galα1→4Galβ1→4Glcβ1)通常作为多能人类胚胎干细胞的细胞表面标志物,并用于分离间充质干细胞及富集化神经祖细胞(Kannagi R et al.(1983)EMBO J,2:2355-2361)。这些发现支持,Globo系列抗原(Globo H、SSEA-3、及SSEA-4)为癌症疗法的独特靶标,且可用于引导治疗剂有效靶向癌细胞。
程序性死亡1(PD-1)为表达在T细胞、B细胞、或单核细胞上的抑制性受体(Ishidaet al.(1992)EMBO J.11:3887-2895;Agata et al.(1996)Int.Immunol.8:765-772)。PD-L1与PD-L2为PD-1的配体,其经确定在结合至PD-1时下调T细胞活化与细胞因子分泌(Freeman et al.(2000)J Exp Med 192:1027-34;Latchman et al.(2001)Nat Immunol2:261-8)。以PD-1配合PD-L1或PD-L2,导致免疫反应下调。因此,已知阻断PD-1/PD-L1途径可减弱对抗癌症时的中枢与外周免疫反应。在包括黑素瘤、非小细胞肺癌(NSCLC)、肾细胞癌(RCC)、膀胱癌、及何杰金氏淋巴瘤(Hodgkin’s lymphoma)等15种以上的癌症类型中,靶向PD-1与PD-L1途径显示临床功效(Sharma et al.(2015)Science 348(6230):56–61)。然而,仍有许多患者没有反应;一些患者出现最初的反应,但随时间推移产生抗药性。因此,迫切需要确定联合疗法的抗药性机制。
经鉴定,Globo H神经酰胺会脱落入肿瘤微环境中。据报导,免疫细胞摄入Globo H神经酰胺会抑制细胞增殖及细胞因子产生,显示Globo H神经酰胺可作为免疫检查点,以逃避免疫监控(YC Tsai et al.(2013)J Cancer Sci Ther 5:264-270)。T细胞表达广范围的共受体(co-receptors),例如,CTLA4、LAG3、TIGIT、及TIM3,其负向调节T细胞活化(Sledzinska et al.(2015)Mol Oncol.Dec;9(10):1936-65)。
发明内容
据此,利用抗Globo H抗体清除Globo H神经酰胺组合负面免疫检查点的阻断,可有效克服免疫抑制。发明人的研究结果显示,靶向Globo系列抗原(Globo H或SSEA-4)与抗负面免疫检查点阻断协同作用,以挽救T细胞失活。
因此,本发明的第一个实施方案涉及一种组合,其包含抗Globo H和/或抗SSEA-4抗体或其片段及免疫检查点的至少一种抑制剂。在某些特定实施方案中,免疫检查点抑制剂为抗负面免疫检查点抗体。
在一个优选实施方案中,本发明的组合包含一种抗Globo-H和/或抗SSEA-4抗体或其片段及一种抗PD-1抗体或其片段。
优选地,所述适用于与Globo H或SSEA-4抗体的联合疗法的抗体选自Keytruda和/或Tecentriq。
在一个非限制性实施方案中,Keytruda与Tecentriq源自:
针对本发明的目的,抗体优选地选自于鼠科抗体、重组抗体、人源化或完全人类抗体、嵌合抗体、多特异性抗体(特别是双特异性抗体)、或其片段组成的组。
在一个进一步的实施方案中,本发明的组合的有效成分,亦即抗Globo H或抗SSEA-4抗体或其片段及免疫检查点的至少一种抑制剂,可同时、分开、或依序施用,且针对各有效成分,可遵循不同施用途径。
依据本发明的进一步实施方案,组合的有效成分可通过相同施用途径或通过不同施用途径一起施用,或其可通过相同施用途径或通过不同施用途径分开施用。
在本发明的一个优选方面中,抗Globo H或抗SSEA-4抗体或其片段可配制成注射剂形式、口服形式、片剂、胶囊、溶液、悬剂、颗粒、油性胶囊等形式,而免疫检查点的至少一种抑制剂以胃肠外方式配制,如水性缓冲溶液或油性悬液。
依据本发明的一个优选实施方案,含有抗Globo-H或SSEA-4抗体或其片段的配制剂每周施用或一周施用数次,而含有免疫检查点的至少一种抑制剂的配制剂通过胃肠外途径施用,优选地每周一至数次。
据此,本发明基于以下发现,即癌症上的Globo系列抗原可脱落入微环境中并渗入T细胞。T细胞活化作用在渗入Globo H神经酰胺或SSEA-4神经酰胺后受抑制。添加抗GloboH抗体或抗SSEA-4抗体以抑制Globo H神经酰胺或SSEA-4神经酰胺渗入T细胞,可抑制GloboH神经酰胺或SSEA-4神经酰胺诱发的免疫抑制。PD-1/PD-L1配合可抑制TCR信号传导途径。将Globo H神经酰胺或SSEA-4神经酰胺添加至T细胞,可进一步抑制TCR信号传导。Globo H神经酰胺或SSEA-4神经酰胺的渗入降低TCR信号传导发挥作用,其为抗PD-1或抗PD-L1抗体阻断由PD-1/PD-L1配合的抑制作用(亦即,免疫检查点效应)的结果。添加抗Globo H抗体或抗SSEA-4抗体及抗PD-1或抗PD-L1抗体,可协同地逆转由Globo H神经酰胺或SSEA-4神经酰胺及PD-1/PD-L1配合所抑制的TCR信号传导。表达Globo H抗原或SSEA-4抗原的癌症包括但不局限于,肉瘤、皮肤癌、白血病、淋巴瘤、脑癌、胶质母细胞瘤、肺癌、乳腺癌、口腔癌、头颈癌、鼻咽癌、食道癌、胃癌、肝癌、胆道癌、胆囊癌、膀胱癌、胰腺癌、肠癌、结肠直肠癌、肾癌、子宫颈癌、子宫内膜癌、卵巢癌、睾丸癌、颊癌、口咽癌、喉癌、及前列腺癌。
在一方面,本发明提供用于治疗癌症的方法,其中方法包含对有此需要的受试者施用治疗上有效量的药物组合物,其包含与抗负面免疫检查点抗体组合的抗Globo系列抗原抗体。
在一个实施方案中,Globo系列抗原为阶段特异性胚胎抗原-4(Neu5Acα2→3Galβ1→3GalNAcβ1→3Galα1→4Galβ1→4Glcβ1)、阶段特异性胚胎抗原-3(SSEA-3;Galβ1→3GalNAcβ1→3Galα1→4Galβ1→4Glcβ1)、或Globo H(Fucα1→2 Galβ1→3 GalNAcβ1→3Galα1→4 Galβ1→4 Glc)。
在一个实施方案中,免疫检查点抗原分子选自由PD-1/PD-L1抗原、CTLA-4(细胞毒性T淋巴细胞相关蛋白4)、LAG-3(淋巴细胞活化基因3)、TIGIT(T细胞免疫球蛋白与免疫受体的基于酪氨酸的抑制性基序域)、Ceacam 1(癌胚抗原相关细胞粘附分子1)、LAIR-1(白细胞相关的免疫球蛋白受体-1)、或TIM-3(T细胞免疫球蛋白与粘蛋白域-3)组成的组。
在一个实施方案中,抗Globo系列抗原抗体为OBI-888或OBI-898。
在一个实施方案中,抗负面免疫检查点药剂为PD-1/PD-L1拮抗剂。
在一个实施方案中,抗PD-1/PD-L1抗体为Bavencio(Bavencio(阿维鲁单抗))、Opdivo(Opdivo(纳武单抗))、Keytruda(帕博利珠单抗)、Imfinzi(Imfinzi(度伐鲁单抗))、和/或Tecentriq(阿特珠单抗)。
在一个实施方案中,癌症选自由乳腺癌、肺癌、食道癌、直肠癌、胆道癌、肝癌、颊癌、胃癌、肠癌、鼻咽癌、肾癌、前列腺癌、卵巢癌、子宫颈癌、子宫内膜癌、胰腺癌、睾丸癌、膀胱癌、头颈癌、口腔癌、神经内分泌癌、肾上腺癌、甲状腺癌、骨癌、皮肤癌、基底细胞癌、鳞状细胞癌、黑素瘤、或脑肿瘤组成的组。
在一个实施方案中,本方法包含施用一种抗Globo系列抗原抗体或其片段及一种抗PD-1/PD-L1抗体或其片段。
在一个实施方案中,抗Globo系列抗原抗体和/或免疫检查点的至少一种抑制剂为单克隆抗体,其选自鼠科抗体、重组抗体、人源化或完全人类抗体、嵌合抗体、多特异性抗体(特别是双特异性抗体)、或其片段。
在一个实施方案中,免疫检查点的至少一种抑制剂为抗体、蛋白质、小分子、和/或si-RNA。
在一个实施方案中,抗Globo系列抗原抗体或其片段为抗Globo H抗体,其包含:如表1-2所示的SEQ.ID No:1-108,或抗SSEA4抗体,其包含:如表6-9所示的SEQ.ID No:109-182。
在一个实施方案中,免疫检查点的抑制剂为抗体或其片段,其结合抗原(PD-1/PD-L1、CTLA-4、LAG-3、TIGIT、Ceacam 1、LAIR-1、或TIM-3)。
在一个实施方案中,抗Globo系列抗原抗体或其片段及免疫检查点的至少一种抑制剂同时、分开、或依序施用。
在一个实施方案中,受试者为人类。
在一个实施方案中,Globo系列抗原(抗Globo H或抗SSEA-4)的抗体靶向结合抗负面免疫检查点的阻断,以共同、加成、和/或协同方式作用,以挽救T细胞失活及改进治疗功效。
在一个实施方案中,利用挽救T细胞失活以增进治疗功效。
在一个实施方案中,抑制和/或降低癌症的生长或进展。
在一个实施方案中,肿瘤体积减少。
在一方面,本发明提供用于挽救T细胞失活的方法,其中本方法包含对有此需要的受试者施用治疗上有效量的药物组合物,其包含与抗负面免疫检查点抗体组合的抗Globo系列抗原抗体。
在一方面,本发明提供用于降低和/或抑制癌症生长/进展的方法,其中本方法包含对有此需要的受试者施用治疗上有效量的药物组合物,其包含与抗负面免疫检查点抗体组合的抗Globo系列抗原抗体。
在一个实施方案中,该抗负面免疫检查点抗体抑制剂包含抗PD-1抗体,其选自Keytruda(帕博利珠单抗)和/或Opdivo(纳武单抗),及抗PD-L1抗体,其选自Bavencio(阿维鲁单抗)、Imfinzi(度伐鲁单抗)、和/或Tecentriq(阿特珠单抗)。
在一方面,本发明提供药物组合物,其包含抗Globo系列抗原抗体与抗负面免疫检查点抗体及医药上可接受载体。
在一方面,本发明提供试剂盒,其包含药物组合物及其使用说明。
附图说明
当参考附图且配合后续详尽说明考量时,可获取本发明的更完整理解。附图所示的实施方案仅旨在示例本发明,且不应理解为局限在本发明所述的实施方案。
图1,Globo H或SSEA-4从各种癌细胞脱落入人类CD3+ T细胞。
图2,利用Globo H神经酰胺或SSEA-4神经酰胺抑制T细胞活化。
图3,利用抗Globo H抗体逆转Globo H神经酰胺诱发的T细胞失活。
图4,利用抗SSEA-4抗体逆转SSEA-4神经酰胺诱发的T细胞失活。
图5,Globo H神经酰胺或SSEA-4神经酰胺及PD-1/PD-L1的配合增进对TCR信号传导的抑制作用。
图6,Globo H神经酰胺降低Keytruda或Tecentriq缓解的PD-1/PD-L1配合抑制的TCR信号传导。
图7,SSEA-4神经酰胺降低Keytruda或Tecentriq缓解的PD-1/PD-L1配合抑制的TCR信号传导。
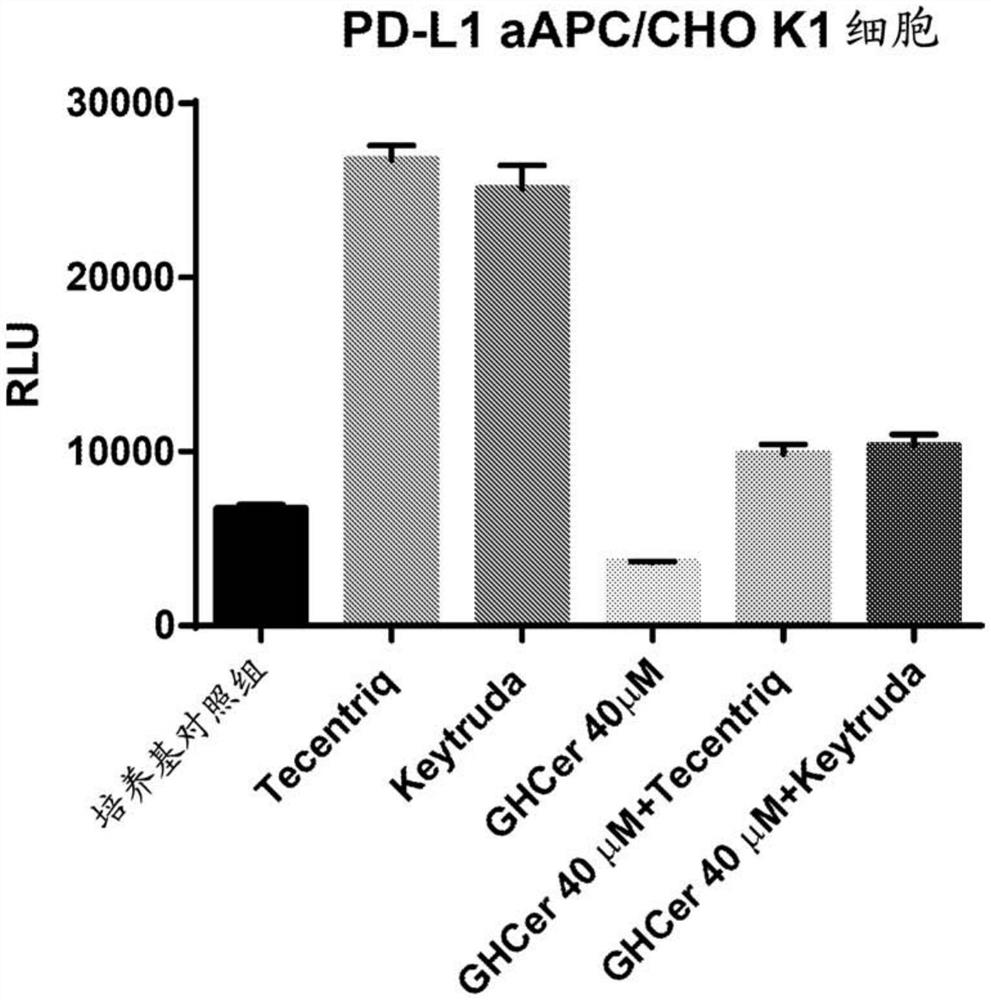
图8,抗Globo H抗体与Keytruda或Tecentriq的组合缓解Globo H神经酰胺及PD-1/PD-L1配合抑制的TCR信号传导。
图9,抗Globo H抗体与Keytruda或Tecentriq的组合缓解SSEA-4神经酰胺及PD-1/PD-L1配合抑制的TCR信号传导。
图10,Globo H神经酰胺或SSEA-4神经酰胺与负面免疫检查点配合以抑制T细胞活性的作用机制示意图。
图11,抗Globo H抗体或抗SSEA-4抗体与抗负面免疫检查点抗体以挽救T细胞活性的作用机制示意图。
具体实施方式
本发明涉及抗Globo H或抗SSEA-4抗原抗体与抗PD-1或PD-L1抗体的组合以治疗癌症患者。
据此,本发明系基于如下发现,即癌症上的Globo系列抗原可脱落入微环境中并渗入T细胞。T细胞活化作用在渗入Globo H神经酰胺或SSEA-4神经酰胺后受抑制。添加抗Globo H抗体或抗SSEA-4抗体以抑制Globo H神经酰胺或SSEA-4神经酰胺渗入T细胞,可抑制Globo H神经酰胺或SSEA-4神经酰胺诱发的免疫抑制。PD-1/PD-L1配合可抑制TCR信号传导途径。将Globo H神经酰胺或SSEA-4神经酰胺添加至T细胞,可进一步抑制TCR信号传导。Globo H神经酰胺或SSEA-4神经酰胺的渗入,降低TCR信号传导发挥作用,其为抗PD-1或抗PD-L1抗体阻断由PD-1/PD-L1配合的抑制作用(亦即,免疫检查点效应)的结果。添加抗Globo H抗体或抗SSEA-4抗体及抗PD-1或抗PD-L1抗体,可协同地逆转由Globo H神经酰胺或SSEA-4神经酰胺及PD-1/PD-L1配合所抑制的TCR信号传导。表达Globo H抗原或SSEA-4抗原的癌症包括但不局限于,肉瘤、皮肤癌、白血病、淋巴瘤、脑癌、胶质母细胞瘤、肺癌、乳腺癌、口腔癌、头颈癌、鼻咽癌、食道癌、胃癌、肝癌、胆道癌、胆囊癌、膀胱癌、胰腺癌、肠癌、结肠直肠癌、肾癌、子宫颈癌、子宫内膜癌、卵巢癌、睾丸癌、颊癌、口咽癌、喉癌、及前列腺癌。
定义
本文中使用的“抗原”术语定义为任何能引起免疫反应的物质。
本文中使用的“免疫原性”术语意指免疫原、抗原、或疫苗引起免疫反应的能力。
本文中使用的“表位”术语定义为与抗体或T细胞受体的抗原结合位点接触的抗原分子部分。
本文中使用的“疫苗”术语意指含有抗原的制剂,其由完整致病生物体(杀死或弱化)或此类生物体的组分(如蛋白质、肽、或多糖)组成,用于赋予针对该生物体所引起疾病的免疫力。疫苗制剂可包括或排除天然、合成、或以重组方式衍生的制剂之任一者。以重组方式衍生的制剂可利用重组DNA技术取得。
本文中使用的“抗原特异性”术语意指细胞群的特性,使得特定抗原或抗原片段的供应导致特异性细胞增殖。
本文中使用的“CD1d”术语意指在各种人类抗原呈递细胞表面上表达的CD1(分化簇1)糖蛋白家族的成员。CD1d呈现的脂质抗原活化自然杀伤T细胞。CD1d具有与糖脂抗原结合的深层抗原结合沟。在树突细胞上表达的CD1d分子可结合并呈现糖脂,包括GalCer类似物,如C34。
本文中使用的“聚糖”术语意指多糖或寡糖。本文中使用的聚糖亦指糖缀合物的碳水化合物部分,如糖蛋白、糖脂、糖肽、糖蛋白质组、肽聚糖、脂多糖、或蛋白聚糖。聚糖通常仅由单糖间的O-糖苷键联组成。举例而言,纤维素为由β-1,4-键结的D-葡萄糖组成的聚糖(或更特别地葡聚糖),且几丁质为由β-1,4-键结的N-乙酰基-D-葡萄糖胺组成的聚糖。聚糖可为单糖残基的共聚物或杂聚物,且可为直链或支链。可发现与糖蛋白和蛋白聚糖中蛋白质相连的聚糖。其通常于细胞外表面上发现。O-与N-键结的聚糖很常见于真核生物,但亦可于原核生物中发现,尽管较不常见。N-键结的聚糖发现附着于序列子(sequon)的天冬酰胺的R基团氮(N)。序列子为Asn-X-Ser或Asn-X-Thr序列,其中X为除了脯氨酸以外的任何氨基酸。
本文中使用的“特异性结合”术语意指结合对(如抗体与抗原)间的相互作用。在各种情况下,特异性结合可通过亲和力常数约10
本文中使用的“流式细胞术”或“FACS”等词意指通过光学与电子检测装置,检查悬浮在流体流中的颗粒或细胞的物理与化学性质的技术。
本文中使用的“糖酶”术语意指在globo系列生物合成途径中的至少部分酶;示例性糖酶包括α-4GalT;β-4GalNAcT-I;或β-3GalT-V酶。
“分离的”抗体为经鉴定且从其自然环境的组分中分开和/或回收者。其自然环境的污染物组分为会干扰抗体的研究、诊断、或治疗用途的材料,且可包括酶、激素、及其他蛋白质性或非蛋白质性溶质。在一个实施方案中,抗体将会纯化成:(1)大于95重量%的抗体,其通过诸如洛瑞法(Lowry method)测定,且在一些实施方案中,大于99重量%;(2)足以取得N端或内部氨基酸序列的至少15个残基的程度,其使用诸如旋转杯测序仪(spinning cupsequenator)获得;或(3)在还原或非还原条件下利用SDS-PAGE均质化,其使用诸如考马斯蓝或银染进行。分离的抗体包括重组细胞中原位的抗体,因为抗体的自然环境的至少一组分将不存在。然而,通常,分离的抗体将利用将由至少一个纯化步骤制备。
本文中可互换使用的“支持物”或“基底”术语指材料或一组材料,其包含一或复数个组分,其与一或多个分子直接或间接结合、相连、合成在其上、连接、或相关联。支持物可由生物、非生物、无机、有机、或这些结合物的材料构成。基于在特定实施方案中的用途,支持物可为任何适当尺寸或构造。
本文中使用的“靶标”术语意指试验中的感兴趣种类。靶标可为天然存在的或合成的,或组合。靶标可保持不变(如直接在生物体内或其样本中使用),或以适合于试验的方式进行改变(如纯化、扩增、过滤)。在特定试验中,靶标可通过适用方式结合至结合成员。靶标的非局限实例包括但不局限于,抗体或其片段、细胞膜受体、特异性抗原决定簇(如在病毒、细胞、或其他材料上)反应性的单克隆抗体和抗血清、药物、寡核苷酸、核酸、肽、辅因子、糖类、凝集素、多糖、细胞、细胞膜、及细胞器。取决于试验,靶标可为任何合适尺寸。
本文中使用的“实质上类似”、“实质上相同”、“等同””、或“实质上等同”等词表示两个数值间足够高的相似程度(如一者与分子相关联,且其他者与参考/比较分子相关联),使得本领域技术人员在由所述值(如Kd值、抗病毒功效等)测量的生物特征背景中,将考虑到两值间的差异为微小或无生物上和/或统计上显著性。举例而言,该两值间之差异为,作为参考/比较分子值的函数,小于约50%、小于约40%、小于约30%、小于约20%、和/或小于约10%。
因此,本发明的抗癌症抗体包括组合非鼠科源(优选地人类源)的重链或轻链可变区、重链或轻链恒定区、框架区、或其任何部分,其可并入本发明的抗体。
本发明的抗体在体外、原位、和/或体内能调节、减少、拮抗、减轻、缓解、阻断、抑制、消除、废除、和/或干扰至少一种表达Globo-H和/或SSEA-4的癌细胞活性。
本发明的抗体包括任何含有重链或轻链的至少一个互补决定区(CDR)或其配体结合部分的蛋白质或肽,其源自本文所述的杂交瘤名为2C2(保存在ATCC登录号:PTA-121138)、杂交瘤名为3D7(保存在ATCC登录号:PTA-121310)、杂交瘤名为7A11(保存在ATCC登录号:PTA-121311)、杂交瘤名为2F8(保存在ATCC登录号:PTA-121137)、或杂交瘤名为1E1(保存在ATCC登录号:PTA-121312)产生的抗体。抗体包括抗体片段、抗体变体、单克隆抗体、多克隆抗体、及重组抗体及其类似物。抗体可在小鼠、兔、或人体中产生。
“抗体”术语进一步旨在涵盖抗体、水解片段、特定部分及其变体,包括抗体拟物(mimetics)或包含模拟抗癌症抗体或其特定片段或部分的结构和/或功能的抗体部分,包括单链抗体及其片段,各含有至少一个源自本发明抗癌症抗体的CDR。
举例而言,功能性片段包括结合至表达Globo-H的癌细胞的抗原结合片段。举例而言,能结合至表达Globo-HD癌细胞或其部分的抗体片段,包括但不局限于,Fab(如利用木瓜蛋白酶消化)、Fab'(如利用胃蛋白酶消化及部分还原)、及F(ab')
抗体的抗原结合部位可包括抗体的部分,其特异性结合至碳水化合物抗原(如Globo H、SSEA-4)。
本发明的人源化抗体为源自非人类物种的抗体,其中在非抗原结合区(和/或抗原结合区)中的氨基酸序列经改变,以使抗体更类似于人类抗体,同时保留其原始结合能力。
利用人类可变区的等同序列替换未直接参与抗原结合的可变区序列,可产生人源化抗体。那些方法包括分离、操纵、及表达编码源自重链或轻链之至少一者的全部或部分可变区的核酸序列。此类核酸的来源是本领域技术人员公知的。编码人源化抗体或其片段的重组DNA可随后克隆至适当表达载体中。
本发明的人源化抗体可利用本领域公知方法产生。举例而言,一旦取得非人类(如鼠科)抗体,可将可变区测序,且可确定CDR及框架残基的位置。Kabat,E.A.,et al.(1991)Sequences of Proteins of Immunological Interest,Fifth Edition,U.S.Departmentof Health and Human Services,NIH Publication No.91-3242;Chothia,C.et al.(1987)J.Mol.Biol.,196:901-917。任选地,编码轻链与重链可变区的DNA可以连接至相对应的恒定区,之后亚克隆至适当表达载体。CDR嫁接的抗体分子可利用CDR嫁接法或CDR取代法产生。可替换免疫球蛋白链的一、二、或所有CDR。举例而言,特定抗体的所有CDR可源自非人类动物(如小鼠CDR)的至少一部分或可替换CDR的仅一些。仅必须维持抗体结合预定的碳水化合物抗原(如Globo H)需要的CDR。Morrison,S.L.,1985,Science,229:1202-1207;Oiet al.,1986,BioTechniques,4:214;美国专利号5,585,089;5,225,539、5,693,761、及5,693,762;EP 519596;Jones et al.,1986,Nature,321:552-525;Verhoeyan et al.,1988,Science,239:1534;Beidler et al.,1988,J.Immunol.,141:4053-4060。
本发明亦涵盖抗体或其抗原结合部分,其含有一或二个如本文所公开的可变区,其他区域以至少一个不同物种的序列替换,包括但不局限于,人类、兔、绵羊、犬、猫、牛、马、山羊、猪、猴、猿、大猩猩、黑猩猩、鸭、鹅、鸡、两栖动物、爬行类动物、及其他动物。
嵌合抗体为分子,其中不同部分源自不同动物物种。举例而言,抗体可含有衍生自鼠科mAb的可变区和人免疫球蛋白恒定区。嵌合抗体可利用重组DNA技术产生。Morrison,etal.,Proc Natl Acad Sci,81:6851-6855(1984)。举例而言,以限制酶消化编码鼠科(或其他物种)抗体分子的基因,以移除编码鼠科Fc的区域,且随后将编码人类Fc恒定区基因的等同部分取代至重组DNA分子中。亦可利用重组DNA技术创建嵌合抗体,其中可将编码鼠科V区的DNA连接至编码人类恒定区的DNA。Better et al.,Science,1988,240:1041-1043;Liuet al.PNAS,1987 84:3439-3443;Liu et al.,J.Immunol.,1987,139:3521-3526;Sun etal.PNAS,1987,84:214-218;Nishimura et al.,Canc.Res.,1987,47:999-1005;Wood etal.Nature,1985,314:446-449;Shaw et al.,J.Natl.Cancer Inst.,1988,80:1553-1559。国际专利公开号WO1987002671与WO 86/01533。欧洲专利公开号184,187、171,496、125,023、及173,494;美国专利号4,816,567。
抗体可为全长或可包含抗体的片段(或数个片段),其具有抗原结合部分,包括但不局限于,Fab、F(ab')
本发明的抗体或其抗原结合部分可为单特异性、双特异性、或多特异性。多特异性或双特异性抗体或其片段可具有一个靶标碳水化合物(如Globo H)不同表位的特异性或可含有超过一个靶标碳水化合物特异性的抗原结合域(如Globo H与SSEA-4特异性的抗原结合域)。在一个实施方案中,多特异性抗体或其抗原结合部分包含至少两个不同可变域,其中各可变域能特异性结合至单独的碳水化合物抗原或同一碳水化合物抗原上的不同表位。Tutt et al.,1991,J.Immunol.147:60-69;Kufer et al.,2004,Trends Biotechnol.22:238-244。本发明抗体可连接至其他功能性分子(如其他肽或蛋白质)或与其他功能性分子(如其他肽或蛋白质)共表达。举例而言,抗体或其片段可功能性连接(如利用化学偶联、基因融合、非共价结合或其他方式)至一或多个其他分子实体,如其他抗体或抗体片段,以产生具有第二结合特异性的双特异性或多特异性抗体。多特异性或双特异性抗体或其片段可具有一个靶标碳水化合物(如Globo H)不同表位的特异性或可含有超过一个靶标碳水化合物特异性的抗原结合域(如Globo H与SSEA-4特异性的抗原结合域)。在一个实施方案中,多特异性抗体或其抗原结合部分包含至少两个不同可变域,其中各可变域能特异性结合至单独的碳水化合物抗原或同一碳水化合物抗原上的不同表位。Tutt et al.,1991,J.Immunol.147:60-69;Kufer et al.,2004,Trends Biotechnol.22:238-244。本发明抗体可连接至其他功能性分子(如其他肽或蛋白质)或与其他功能性分子(如其他肽或蛋白质)共表达。举例而言,抗体或其片段可功能性连接(如利用化学偶联、基因融合、非共价结合或其他方式)至一或多个其他分子实体,如其他抗体或抗体片段,以产生具有第二结合特异性的双特异性或多特异性抗体。
抗体轻链或重链可变区包含由三个高变区(称作互补决定区或CDR)分段的框架(FW)。依据本发明的一方面,抗体或其抗原结合部分可具有下列结构:
前导序列-FW1-CDR1-FW2-CDR2-FW3-CDR3-
其中公开本发明的FW1、FW2、FW3、CDR1、CDR2、及CDR3的氨基酸序列。
亦落入本发明范畴者为抗体或其抗原结合部分,其中特定氨基酸经取代、删除、或添加。在一个示例性实施方案中,这些改变(亦即,保守性取代、保守性删除、或保守性添加)对肽的生物性质(如效应子功能或结合亲和力)不具实质影响。针对将氨基酸改变分类为保守性或非保守性的目的,氨基酸可分组如下:疏水性、中性、酸性、及碱性。保守性取代涉及同一组氨基酸间之取代。非保守性取代将这些组之一者的成员交换成另一者的成员。Ng etal.(Predicting the Effects of Amino Acid Substitutions on Protein Function,Annu.Rev.Genomics Hum.Genet.2006.7:61–80)提供多种氨基酸取代(AAS)预测方法的回顾,使得本领域技术人员能预测及选择氨基酸取代,而不改变蛋白质功能。
在另一个示例性实施方案中,抗体可具有CDR中的氨基酸取代,例如,以改进抗体对抗原的结合亲和力。于又另一个示例性实施方案中,经选取的少数接受体框架残基可由相对应的供体氨基酸替代。供体框架可为成熟或种系人类抗体框架序列或共有序列。关于如何制作表型沉默的氨基酸取代作用的方针提供于Bowie et al.,Science,247:1306-1310(1990);Cunningham et al,Science,244:1081-1085(1989);Ausubel(ed.),CurrentProtocols in Molecular Biology,John Wiley and Sons,Inc.(1994);T.Maniatis,E.F.Fritsch and J.Sambrook,Molecular Cloning:A Laboratory Manual,Cold SpringHarbor laboratory,Cold Spring Harbor,N.Y.(1989);Pearson,Methods Mol.Biol.243:307-31(1994);Gonnet et al.,Science 256:1443-45(1992)。
依据本发明的一方面,本文所述的氨基酸取代发生在与卡贝特(Kabat)编号方案(如Kabat et al.,Sequences of Immunological Interest.5th Ed.Public HealthService,National Institutes of Health,Bethesda,Md.(1991))相对应的位置。
本文中使用的“正常水平”可为例如基于正常患者或正常患者群体样本中TACA结合的抗体水平的测定的参考数值或范围。“正常水平”亦可为例如基于正常患者或正常患者群体样本中TACA测定的参考数值或范围。
本文中使用的“受试者”为哺乳动物。此类哺乳动物包括家禽动物、农场动物、实验用动物、动物园动物、及其类似物。在一些实施方案中,受试者为人类。
“Globo系列相关的病症”术语意指或说明一般而言以该路径的异常功能或表现为特征或由其引起的病症。此类病症的实例包括但不局限于,过度增殖性疾病,包括癌症。过度增殖性疾病和/或病况的实例包括新生物/增生及癌症,包括但不局限于,脑癌、肺癌、乳腺癌、口腔癌、食道癌、胃癌、肝癌、胆管癌、胰腺癌、肠癌、肾癌、子宫颈癌、卵巢癌、及前列腺癌。在一些实施方案中,癌症为脑癌、肺癌、乳腺癌、卵巢癌、前列腺癌、肠癌、或胰腺癌。在其他实施方案中,过度增殖性疾病状态是与乳房、卵巢、肺、胰腺、胃(胃的)、结肠直肠、前列腺、肝、子宫颈、食道、脑、口腔、及肾相关联。
在一个实施方案中,本发明提供确定抗肿瘤剂在治疗有需求的受试者的治疗功效的方法,其包含:(a)提供来自受试者的样本;(b)接触从受试者收集的样本;(c)试验肿瘤相关联抗原(TACA)或抗体之一或多者的结合;以及(d)依据聚糖检测的试验值确定抗肿瘤剂在新生物治疗中的治疗效果。本发明提供令人惊奇之加成性和/或协同性功效的证据,以及接头-糖缀合物(如Globo H)在检测癌症上的实用性。其提供如下基础,即本文的接头与缀合物适合作为任何靶向与globo系列糖蛋白相关联的决定因子及分子的治疗剂的伴随诊断组合物及方法。含有适合用于结合本发明的抗肿瘤剂的示例性治疗方法及组合物,以作为伴随诊断方法及用途描述于(如OBI-822、OBI-833、及OBI-888)例如专利公开号:WO2015159118、WO2014107652、及WO2015157629的公开。各内容在此并入本案以作为参考资料。
本文中使用的“特异性结合”术语意指结合对(如抗体与抗原)间的相互作用。在各种情况下,特异性结合可通过亲和力常数约10
本文中使用的“实质上减少””或“实质上不同”等词组表示两数值间足够高的差异程度(一般而言一者与分子相关联,且其他者与参考/比较分子相关联),使得本领域技术人员在由所述值(如Kd值)测量的生物特征背景中,将考虑到两个值间之差异为统计上显著性。举例而言,该二值间的差异为作为参考/比较分子的值的函数,大于约10%、大于约20%、大于约30%、大于约40%、和/或大于约50%。
本文中使用的“结合亲和力”一般而言意指分子的单一结合位点(如抗体)与其结合配对体(如抗原)间全部非共价相互作用总和的强度。除非另有指明,本文中使用的“结合亲和力”意指固有结合亲和力,其反映了结合配对(如抗体与抗原)成员间的1:1相互作用。分子X与其配对体Y的亲和力一般而言可以解离常数(Kd)表示。亲和力可利用本领域已知的常见方法测定,包括本文所述者。低亲和力抗体一般而言结合抗原缓慢,且倾向容易解离,而高亲和力抗体一般而言结合抗原较快,且倾向保持更长结合时间。各测定结合亲和力的方法是本领域已知的,其之任一者可用于本发明之目的。以下描述特定说明性具体实施方案。
在特定实施方案中,根据本发明的“Kd”或“Kd值”利用放射性标记抗原结合试验(RIA)测定,其以感兴趣抗体的Fab版本及其抗原进行,如下列试验所述。如下测定Fab对抗原的溶液结合亲和力:在滴定系列的未经标记的抗原存在下,以最小浓度(125I)标记的抗原平衡Fab,之后以抗Fab抗体涂布的培养盘捕捉结合的抗原(Chen,et al.,(1999)J.MolBiol 293:865-881)。欲建立试验条件,将溶于50mM碳酸钠(pH 9.6)的5μg/mL捕捉Fab抗体(Cappel Labs)过夜涂布于微滴定盘(Dynex),接着于室温下(约23℃)以溶于PBS的2%(w/v)牛血清白蛋白封闭二至五小时。于非吸附盘中(Nunc,Cat#269620),将100pM或26pM[125I]抗原混合一系列稀释的感兴趣的Fab(例如,与抗VEGF抗体Fab-12的评估一致,参见Presta et al.,(1997)Cancer Res.
57:4593-4599)。感兴趣的Fab随后过夜培养;不过,可持续培养更长时间(如65小时)以确保达到平衡。之后将混合物移至捕捉盘以室温温育(如一小时)。接着移除溶液,并以含0.1%Tween-20的PBS清洗培养盘八次。当培养盘干燥时,每孔加入150μL闪烁剂(MicroScint-20;Packard),且培养盘于Topcount伽玛计数器(Packard)上计数十分钟。选择各Fab浓度产生小于或等于最大结合的20%,用于竞争结合试验。依据另一个实施方案,于25℃下,使用BIAcore
根据本发明的“结合速率(on-rate或rate of association或association rate或kon)”可于25℃下以前述的相同表面等离子体共振试验测定,并使用BIAcore
本文中使用的“载体”术语意指核酸分子能运送已经与其连接的另一核酸。一类载体为“质粒”,其意指环状双链DNA环,其中连接额外的DNA片段。另一类型载体为噬菌体载体。另一类型载体为病毒载体,其中额外的DNA片段可连接至病毒基因组。特定载体能在其被导入的宿主细胞内自主复制(如具有细菌复制起点的细菌载体及附加型哺乳动物载体)。其他载体(如非附加型哺乳动物载体)在导入宿主细胞内时可整合入宿主细胞基因组内,因而伴随宿主基因组复制。此外,特定载体能引导与它们连接的基因表达。此类载体于此意指“重组表达载体”(或简言之,“重组载体”)。一般而言,应用于重组DNA技术的表达载体常为质粒形式。于本说明书中,“质粒”及“载体”可互换使用,因为质粒为最常使用的载体形式。
本文中可互换使用的“多核苷酸”或“核酸”意指任何长度的核苷酸聚合物,且包括DNA与RNA。核苷酸可为脱氧核糖核苷酸、核糖核苷酸、经修饰的核苷酸、或碱基,和/或其类似物,或任何可利用DNA或RNA聚合酶或利用合成反应并入而成聚合物的底物。多核苷酸可包含经修饰的核苷酸,如甲基化核苷酸及其类似物。若存在该情况,则于聚合物组装前或后,可进行核苷酸结构修饰。核苷酸序列可利用非核苷酸组分中断。
本文中使用的“寡核苷酸”一般而言意指短型、单链、合成多核苷酸,其长度通常但未必小于约200个核苷酸。“寡核苷酸”与“多核苷酸”等词不互斥。上述针对多核苷酸的说明同等且完全适用于寡核苷酸。
本文中使用的“抗体(Ab)”及“免疫球蛋白(Ig)”具有相同结构特征的糖蛋白。尽管抗体对特定抗原呈现结合特异性,但免疫球蛋白包括抗体与其他抗体样分子,其一般而言缺乏抗原特异性。举例而言,后一类多肽由淋巴系统于低量时及骨髓瘤于增量时产生。
本文中使用的“抗体”与“免疫球蛋白”等词于最广泛之意义上互换使用,且包括单克隆抗体(如全长或完整单克隆抗体)、多克隆抗体、单价、多价抗体、多特异性抗体(如双特异性抗体,只要其具有所需的生物活性),且亦可包括特定抗体片段,如本文更详尽说明。抗体可为嵌合、人类、人源化、和/或亲和力成熟抗体。
本文中使用的抗体“可变区”或“可变域”意指抗体重链或轻链的氨基端域。这些域一般而言是抗体的最可变部位,且含有抗原结合位点。
本文中使用的“可变”术语意指事实上于抗体中可变区的特定部分序列差异极大,且用于各特定抗体对其特定抗原的结合及特异性。然而,于整个抗体可变域中,可变性并未均匀分布。其集中于三片段,称作互补决定区(CDR)或高变区,皆位于轻链与重链可变域。可变域中更高度保守的部分称作框架(framework;FR)。天然重链与轻链的可变域各包含四个FR区,大量具备β片层构型,利用三个CDR相连接,其形成环连接,且在一些情况下,形成β片层结构的部分。各链的CDR利用FR区与其他链的CDR紧贴在一起,导致形成抗体的抗原结合位点(参见,Kabat et al.,Sequences of Proteins of Immunological Interest,FifthEdition,National Institute of Health,Bethesda,Md.(1991))。恒定区未直接涉及抗体与抗原的结合,但呈现多种效应子功能,如抗体参与抗体依赖性细胞毒性。
木瓜蛋白酶消化抗体,产生两个相同抗原-结合片段,称作“Fab”片段,每一者具有单一抗原结合位点,及其余的“Fc”片段,其名称反映其易结晶的能力。胃蛋白酶处理产生F(ab’)
“Fv”为最小抗体片段,其含有完整抗原识别与结合位点。于二链Fv种类中,此区由紧密、非共价结合的一个重链与一个轻链可变区的二聚体组成。于单链Fv种类中,一个重链与一个轻链可变区可利用柔性肽接头共价连接,如此轻链与重链可结合成“二聚体”结构,其类似于双链Fv种类。于此构型中,各可变域的三个CDR相互作用,以在VH-VL二聚体表面上界定出抗原结合位点。总的来说,该六个CDR对抗体赋予抗原结合特异性。然而,即使单一可变域(或Fv之一半,其仅含有三个抗原特异性CDR)仍具有识别及结合抗原的能力,尽管其亲和力低于整体结合位点。
Fab片段亦含有轻链恒定域与重链第一恒定域(CH1)。Fab′片段不同于Fab片段之处在于重链CH1域羧基端增加数个残基,包括一或多个半胱氨酸位于抗体铰链区。Fab′-SH于此表示Fab′恒定域的半胱氨酸残基含有游离硫醇基。产生的F(ab′)
任何脊椎动物物种的抗体(免疫球蛋白)的“轻链”可指定为两种明显不同类型之一,称作卡帕(κ)与拉目达(λ),其是以其恒定域的氨基酸序列为基准。
取决于其重链恒定区的氨基酸序列,抗体(免疫球蛋白)可分配至不同类别。免疫球蛋白有五大类:IgA、IgD、IgE、IgG、及IgM,且这些之数者可进一步分成子类(同种型),如IgG
“全长抗体”、“完整抗体”、及“全部抗体”等词于此可互换使用,意指抗体实质上为完整形式,而非以下定义的抗体片段。该词特别指抗体重链含有Fc区。
本文中使用的“抗体片段”仅包含完整抗体的一部分,其中该部分保留至少一种,且多达大多数或全部的、在完整抗体中存在时与该部分通常相关联的功能。在一个实施方案中,抗体片段包含完整抗体的抗原结合位点,因此保留结合抗原的能力。在另一个实施方案中,抗体片段,如包含Fc区者,保留至少一种、在完整抗体中存在时与Fc区通常相关联的功能,如FcRn结合、抗体半衰期调控、ADCC功能、及补体结合。在一个实施方案中,抗体片段为单价抗体,其具有实质上类似于完整抗体的体内半衰期。举例而言,此抗体片段可具有连接至Fc序列的抗原结合臂(arm),能赋予该片段体内稳定性。
本文中使用的“单克隆抗体”术语意指抗体取自一群实质上均质性抗体,亦即构成群体的个别抗体皆相同,除了可能的天然存在的突变以外,该突变以少量存在。因此,修饰语“单克隆”代表抗体的特征并非个别抗体之混合物。此单克隆抗体通常包括含有结合靶标的多肽序列的抗体,其中该靶标结合多肽序列由如下过程取得,包括由复数个多肽序列中挑选单一靶标结合多肽序列。在特定实施方案中,单克隆抗体可排除天然序列。在一些方面中,挑选过程可为由复数个克隆,如杂交瘤克隆库、噬菌体克隆库、或重组DNA克隆库中挑选独特克隆。应理解到,所挑选的靶标结合序列可进一步改变,例如,改进靶标亲和力、人源化靶标结合序列、改进其于细胞培养中之产量、减少其体内免疫原性、创建多特异性抗体等,且含有改变的靶标结合序列的抗体亦为本发明的单克隆抗体。相对于通常包括针对不同决定区(如表位)的不同抗体的多克隆抗体制备物,单克隆抗体制备物的各单克隆抗体针对抗原上单一决定区。除了其特异性以外,单克隆抗体制备物之优势在于,其通常不受其他免疫球蛋白污染。修饰语“单克隆”代表抗体的特征为取自实质上均质性群体的抗体,且不应理解为需要以任何特定方法产生抗体。举例而言,根据本发明使用的单克隆抗体可利用各种技术制成,包括例如,杂交瘤方法(如Kohler et al.,Nature,256:495(1975);Harlow etal.,Antibodies:A Laboratory Manual,(Cold Spring Harbor Laboratory Press,2nded.1988);Hammerling et al.所著:Monoclonal Antibodies and T-Cell hybridomas563-681(Elsevier,N.Y.,1981))、重组DNA方法(参见,如美国专利号4,816,567)、噬菌体展示技术(参见,如Clackson et al.,Nature,352:624-628(1991);Marks et al.,J.Mol.Biol.222:581-597(1992);Sidhu et al.,J.Mol.Biol.338(2):299-310(2004);Leeet al.,J.Mol.Biol.340(5):1073-1093(2004);Fellouse,Proc.Natl.Acad.Sci.USA 101(34):12467-12472(2004);以及Lee et al.,J.Immunol.Methods 284(1-2):119-132(2004)、及用于以动物产生人类或人样抗体的技术,其具有部分或全部的人免疫球蛋白基因座或编码人免疫球蛋白序列的基因(参见如WO98/24893;WO96/34096;WO96/33735;WO91/10741;Jakobovits et al.,Proc.Natl.Acad.Sci.USA 90:2551(1993);Jakobovits etal.,Nature 362:255-258(1993);Bruggemann et al.,Year in Immunol.7:33(1993);美国专利号5,545,807;5,545,806;5,569,825;5,625,126;5,633,425;5,661,016;Marks etal.,Bio.Technology 10:779-783(1992);Lonberg et al.,Nature 368:856-859(1994);Morrison,Nature 368:812-813(1994);Fishwild et al.,Nature Biotechnol.14:845-851(1996);Neuberger,Nature Biotechnol.14:826(1996)与Lonberg and Huszar,Intern.Rev.Immunol.13:65-93(1995)。
本文中单克隆抗体特别包括“嵌合”抗体,其中一部分的重链和/或轻链相同或同源于源自特定物种或属于特定抗体类别或子类的抗体的相应序列,而链的其余部分则相同或同源于源自另一物种或属于另一抗体类别或子类的抗体的相对应序列,以及此类抗体的片段,只要其呈现所需的生物活性(美国专利号4,816,567;以及Morrison et al.,Proc.Natl.Acad.Sci.USA 81:6851-6855(1984))。
本发明的抗体亦包括由本发明抗体产生的嵌合化或人源化单克隆抗体。
抗体可为全长或可包含抗体的片段(或数个片段),其具有抗原结合部位,包括但不局限于,Fab、F(ab')
本发明的抗体或其抗原结合部分可为单特异性、双特异性、或多特异性。
所有抗体同种型皆涵盖于本发明之中,包括IgG(如IgG
具有可变重链区与可变轻链区的抗体是至少约70%、至少约75%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、或约100%(或介于上述两个值之间的任何数字)同源于参考抗体所产生的抗体可变重链区与可变轻链区,且亦可结合至碳水化合物抗原(如Globo H、SSEA-4)。同源性(homology)可呈现于氨基酸序列或核苷酸序列水平。在一些方面中,具有所述氨基酸序列或核苷酸序列同源性的抗体序列将排除天然存在的抗体序列。在一些方面中,具有所述氨基酸序列或核苷酸序列同源性的抗体序列将涵盖天然存在的抗体序列。
在特定实施方案中,CDR具有序列变化。举例而言,其中的1、2、3、4、5、6、7、或8个残基,或小于CDR中全部残基的20%、30%、或约40%的残基系经取代或删除的CDR可存在于结合碳水化合物抗原的抗体(或其抗原结合部分)。
抗体或抗原结合部位可为肽。此类肽可包括肽的变体、类似物、直向同源物、同源物、及衍生物,其呈现生物活性,如碳水化合物抗原之结合。肽可含有一或多个氨基酸类似物(包括例如,非天然存在的氨基酸、仅在不相关的生物系统中天然出现的氨基酸、哺乳动物系统的经修饰的氨基酸等)、具有经取代的键结的肽,以及本领域抑制的的其他修饰。
同时,于本发明之范畴内,于抗体或其抗原结合部分中,特定氨基酸经取代、删除、或添加。在一个示例性实施方案中,这些改变对肽生物性质,如结合亲和力,不具有实质影响。在另一个示例性实施方案中,抗体的框架区可具有氨基酸取代,从而改进抗体与抗原的结合亲和力。在又另一示例性实施方案中,经选取的少数接受体框架残基可由相对应的供体氨基酸替代。供体框架可为成熟或种系人类抗体框架序列或共有序列。关于如何制作表型沉默的氨基酸取代作用的方针,描述于Bowie et al.,Science,247:1306-1310(1990);Cunningham et al,Science,244:1081-1085(1989);Ausubel(ed.),Current Protocolsin Molecular Biology,John Wiley and Sons,Inc.(1994);T.Maniatis,E.F.Fritschand J.Sambrook,Molecular Cloning:A Laboratory Manual,Cold Spring Harborlaboratory,Cold Spring Harbor,N.Y.(1989);Pearson,Methods Mol.Biol.243:307-31(1994);Gonnet et al.,Science 256:1443-45(1992)。
抗体或其抗原结合部分可衍生或连接至另一功能分子。举例而言,抗体可以是功能上连接至(利用化学偶联、基因融合、非共价相互作用等)一或多个其他分子实体,如另一抗体、可检测剂、细胞毒剂、药剂、可介导缔合另一分子的蛋白质或肽(如链霉亲合素核心区或多组氨酸标签)、氨基酸接头、信号序列、免疫原性载体、或适于蛋白质纯化的配体,如谷胱甘肽-S-转移酶、组氨酸标签、及葡萄球菌蛋白A。一类衍生蛋白利用交联两个或更多个蛋白(相同类型或不同类型)制成。适用的交联剂包括这些异双官能性,具有由合适间隔子(如间马来酰亚氨基苯甲酰基-N-羟基琥珀酰亚胺酯)隔开的两个不同反应性基团,或同双官能性(如二琥珀酰亚氨基辛二酸酯)。此类接头购自Pierce Chemical Company,Rockford,111。可衍生(或标记)蛋白质的有用可检测剂包括荧光化合物、各种酶、辅基、发光材料、生物发光材料、及放射性材料。非局限的示例性荧光可检测剂包括荧光素、荧光素异硫氰酸酯、罗丹明、及藻红蛋白。蛋白质或抗体亦可用可检测酶衍生,如碱性磷酸酶、辣根过氧化物酶、β-半乳糖苷酶、乙酰胆碱酯酶、葡萄糖氧化酶、及其类似物。蛋白质亦可用辅基(如链霉亲合素/生物素及抗生物素蛋白/生物素)衍生。
编码本发明抗体或其抗原结合部分的功能活性变体的核酸亦涵盖于本发明。这些核酸分子可于中度严谨、高度严谨、或极高度严谨条件下杂交于编码本发明抗体或其抗原结合部分任一者的核酸。进行杂交反应之方针可见于Current Protocols in MolecularBiology,John Wiley&Sons,N.Y.6.3.1-6.3.6,1989,其在此并入本案以作为参考资料。本文提及的特异性杂交条件如下:1)中度严谨杂交条件:于约45℃下加入6X SSC,接着于60℃下以0.2X SSC与0.1%SDS清洗一或多次;2)高度严谨杂交条件:于约45℃下加入6X SSC,接着于65℃下以0.2X SSC与0.1%SDS清洗一或多次;以及3)极高度严谨杂交条件:于65℃下加入0.5M磷酸钠与7%SDS,于65℃下以0.2XSSC与1%SDS清洗一或多次。
编码本发明抗体或其抗原结合部分的核酸可导入表达载体,其可于合适的表达系统中表达,接着分离或纯化表达的抗体或其抗原结合部分。可选择地,编码本发明抗体或其抗原结合部分的核酸可于无细胞翻译系统中翻译。参见美国专利号4,816,567;Queen etal,Proc Natl Acad Sci USA,86:10029-10033(1989)。
本发明抗体或其抗原结合部分可利用编码期望抗体轻链与重链(或其部分)的DNA转化宿主细胞而产生。抗体可利用标准技术自这些培养基上清液和/或细胞分离及纯化。举例而言,宿主细胞可以用编码抗体轻链、重链、或两者的DNA转化。重组DNA技术亦可用于移除一些或所有编码轻链与重链之一或二者的DNA,其并非结合作用所需(如恒定区)。
本发明核酸可表达于各种适用细胞,包括原核与真核细胞,如细菌细胞(如大肠杆菌)、酵母细胞、植物细胞、昆虫细胞、及哺乳动物细胞。一些哺乳动物细胞系是本领域已知的,且包括购自美国典型培养物保藏中心(ATCC)的永生化细胞系。细胞的非局限实例包括所有哺乳动物源或类哺乳动物特征的细胞系,包括但不局限于,以下各项的亲代细胞、衍生物和/或工程化变体:猴肾细胞(COS,如COS-1、COS-7)、HEK293、幼仓鼠肾细胞(BHK,如BHK21)、中国仓鼠卵巢细胞(CHO)、NSO、PerC6、BSC-1、人肝细胞癌细胞(如HepG2)、SP2/0、HeLa、马丁-达比牛肾细胞(Madin-Darby bovine kidney;MDBK)、骨髓瘤、及淋巴瘤细胞。工程化变体包括,例如,聚糖概况修饰和/或位点特异性整合位点衍生物。
本发明亦提供含有本文所述核酸的细胞。该细胞可为杂交瘤或转染体(transfectant)。
或者,本发明抗体或其抗原结合部分可利用本领域公知的固相程序合成。SolidPhase Peptide Synthesis:A Practical Approach by E.Atherton and R.C.Sheppard,由Oxford University Press之IRL(1989)出版;Methods in Molecular Biology,Vol.35:Peptide Synthesis Protocols(ed.M.W.Pennington and B.M.Dunn),第7章;Solid PhasePeptide Synthesis,2nd Ed.,Pierce Chemical Co.,Rockford,IL(1984);G.Barany andR.B.Merrifield,The Peptides:Analysis,Synthesis,Biology,编辑系E.Gross andJ.Meienhofer,Vol.1and Vol.2,Academic Press,New York,(1980),pp.3-254;M.Bodansky,Principles of Peptide Synthesis,Springer-Verlag,Berlin(1984)。
“人源化”形式的非人类(如鼠科)抗体为嵌合抗体,其含有衍生自非人免疫球蛋白的最小序列。在一个实施方案中,人源化抗体为人免疫球蛋白(受体抗体),其中受体高变区的残基以具有所需的特异性、亲和力、和/或能力的非人类物种(供体抗体)高变区的残基替代,该非人类物种如小鼠、大鼠、兔、或非人类灵长类。在一些情况下,人免疫球蛋白的框架区(FR)残基系以相对应的非人类残基替代。此外,人源化抗体可包含未在受体抗体或供体抗体中发现之残基。这些修饰之进行旨在进一步精化抗体表现。一般而言,人源化抗体将包含至少一个,及通常为两个基本上整个可变域,其中所有或实质上所有高度可变环对应于这些非人免疫球蛋白的,且所有或实质上所有FR是这些人免疫球蛋白序列的。人源化抗体亦将可选择地包含通常人免疫球蛋白的至少一部分免疫球蛋白恒定区(Fc)。详情参见Jones et al.,Nature 321:522-525(1986);Riechmann et al.,Nature 332:323-329(1988);以及Presta,Curr.Op.Struct.Biol.2:593-596(1992)。亦请参见下列引用的回顾文献及参考资料:Vaswani and Hamilton,Ann.Allergy,Asthma&Immunol.1:105-115(1998);Harris,Biochem.Soc.Transactions 23:1035-1038(1995);Hurle and Gross,Curr.Op.Biotech.5:428-433(1994)。
本文中使用的“高变区”、“HVR”、或“HV”等词意指抗体可变区的区域,其序列高度可变和/或形成结构上可定义环。一般而言,抗体包含六个高变区;三者位于VH(H1、H2、H3),且三者位于VL(L1、L2、L3)。许多高变区轮廓被使用,且涵盖于本文中。卡贝特(Kabat)互补决定区(CDR)依据序列可变性,且最常被使用(Kabat et al.,Sequences of Proteins ofImmunological Interest,5th Ed.Public Health Service,National Institutes ofHealth,Bethesda,Md.(1991))。丘夏(Chothia)则提出结构环位置(Chothia and LeskJ.Mol.Biol.196:901-917(1987))。
本文中使用的“框架”或“FW”残基是本文定义的高变区残基以外的那些可变域残基。
“如卡贝特(Kabat)中的可变区残基的编号方式”或“如卡贝特(Kabat)中的氨基酸位置的编号方式”等术语及其变化形,意指卡贝特(Kabat)等人在Sequences of Proteinsof Immunological Interest,5th Ed.Public Health Service,National Institutes ofHealth,Bethesda,Md.(1991)中,用于汇编抗体的重链可变区或轻链可变区的编号系统。使用此编号系统,实际的线型氨基酸序列可含有较少或额外的对应于缩短或插入可变区的FR或HVR的氨基酸。举例而言,重链可变区可包括位于H2的残基52之后的单一氨基酸插入子(如卡贝特之残基52a),以及位于重链FR残基82之后的插入残基(如卡贝特的残基82a、82b、及82c等)。卡贝特的残基编号方式可针对给定的抗体进行确定,其利用“标准”卡贝特编号序列比对抗体序列的同源区域。
本文中使用的“单链Fv”或“scFv”抗体片段包含抗体的VH与VL域,其中这些域以单一多肽链呈现。一般而言,scFv多肽进一步包含介于VH与VL域之间的多肽接头,其使得scFv形成所需结构以进行抗原结合。针对scFv之评述,参见Pluckthun的The Pharmacology ofMonoclonal Antibodies,vol.113,Rosenburg and Moore eds.,Springer-Verlag,NewYork,pp.269-315(1994)。
本文中使用的“双抗体”术语意指具有两个抗原结合位点的小型抗体片段,该片段包含连接至相同多肽链的轻链可变结构区(VL)(即VH-VL)的重链可变区(VH)。利用过短而无法在相同链的二域间进行配对的接头,这些区被迫与另一链的互补区配对并创建两个抗原结合位点。双功能抗体更充分描述于,例如,EP 404,097;WO93/1161;以及Hollinger etal.,Proc.Natl.Acad.Sci.USA 90:6444-6448(1993)。
本文中使用的“人类抗体”指产生的氨基酸序列相应于人类产生的抗体和/或利用任一技术制备本发明公开的人类抗体。此人类抗体的定义特别排除含有非人类抗原结合残基的人源化抗体。
本文中使用的“亲和力成熟抗体”为抗体之一或多个HVR具有一或多个改变,其造成与不产生这些改变的母体抗体相比较抗体与抗原的亲和力改进。在一个实施方案中,亲和力成熟抗体具有纳摩尔或甚至皮摩尔的亲和力以靶向抗原。亲和力成熟抗体利用本领域已知的程序产生。Marks et al.Bio/Technology 10:779-783(1992)描述亲和力成熟利用VH与VL区改组进行。CDR和/或框架残基的随机突变描述于:Barbas et al.ProcNat.Acad.Sci.USA 91:3809-3813(1994);Schier et al.Gene 169:147-155(1995);Yelton et al.J.Immunol.155:1994-2004(1995);Jackson et al.,J.Immunol.154(7):3310-9(1995);以及Hawkins et al,J.Mol.Biol.226:889-896(1992)。
本文中使用的“阻断抗体”或“拮抗抗体”指抗体能抑制或降低所结合抗原的生物活性。特定阻断抗体或拮抗抗体实质上或完全地抑制抗原的生物活性。
本文中使用的“激动抗体”指抗体模拟感兴趣的多肽的功能活性的至少一种。
本文中使用的“病症”指可受益于本发明抗体治疗的任何病况。其包括慢性与急性病症或疾病,包括这些使哺乳动物易患病症的病理状况。欲治疗的病症的非局限实例包括癌症。
本文中使用的“细胞增殖性病症”与“增殖性病症”等词意指与一定程度的异常细胞增殖相关联的病症。在一个实施方案中,细胞增殖性病症为癌症。
本文中使用的“肿瘤”意指所有肿瘤细胞生长与增殖,不论恶性或良性,以及所有癌前和癌细胞与组织。本文中使用的“癌症”、“癌性”、“细胞增殖性病症”、“增殖性病症”、及“肿瘤”等词系非互斥。
本文中使用的“癌症”与“癌性”意指或说明哺乳动物生理状况,特征通常为未调节的细胞生长/增殖。癌症的实例包括但不局限于,癌、淋巴瘤(如霍奇金氏与非霍奇金氏淋巴瘤)、母细胞瘤、肉瘤、及白血病。此类癌症的更特定实例包括鳞状细胞癌、小细胞肺癌、非小细胞肺癌、肺腺癌、鳞状肺癌、腹膜癌、肝细胞癌、胃肠癌、胰腺癌、神经胶质母细胞瘤、子宫颈癌、卵巢癌、肝癌、膀胱癌、肝瘤、乳腺癌、结肠癌、结肠直肠癌、子宫内膜或子宫癌、唾液腺癌、肾癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌、白血病与其他淋巴增殖性病症及各种头颈癌。
本文中使用的“治疗”意指临床上的介入,其旨在改变经治疗的受试者或细胞的自然过程,且可以在预防(prophylaxis)或在临床病理过程中进行。理想的治疗效果包括预防疾病发生或复发、缓解症状、减轻疾病的任何直接或间接病理后果、预防或减少发炎和/或组织/器官损伤、降低疾病进展速度、改善或减轻疾病状态、及缓解或改进预后。在特定实施方案中,本发明抗体用于延缓疾病或病症的发展。
本文中使用的“抗体-药物缀合物(ADC)”意指抗体缀合至细胞毒剂,如化学治疗剂、药物、生长抑制剂、毒素(如细菌、真菌、植物或动物源的酶活性毒素或其片段)、或放射性同位素(亦即,放射性缀合物)。
本文中使用的“T细胞表面抗原”意指抗原可包括本领域已知的代表性T细胞表面标记,包括T细胞抗原受体(TcR),其为所有T细胞的主要定义标记,其被T细胞用于特异性识别MHC相关联的肽抗原。TcR的相关联实例为CD3蛋白复合体,其参与TcR结合至其关联MHC/抗原复合体后的细胞内信号传导。T细胞表面抗原的其他实例可包括((或排除)CD2、CD4、CD5、CD6、CD8、CD28、CD40L、和/或CD44。
本文中使用的“个体”或“受试者”是脊椎动物。在特定实施方案中,脊椎动物为哺乳动物。哺乳动物包括但不局限于,农场动物(如牛)、运动动物、宠物(如猫、狗、及马)、灵长类动物、小鼠、及大鼠。在特定实施方案中,脊椎动物是人类。
本文中使用的因应治疗目的的“哺乳动物”意指任何分类为哺乳动物的动物,包括人类、家畜、及农场动物,以及动物园、运动场、或宠物动物,如狗、马、猫、牛等。在特定实施方案中,哺乳动物是人类。
本文中使用的“有效量”意指在所需剂量与时间期内,能有效达到所需的治疗或预防结果的量。
本发明物质/分子的“治疗上有效量”可依个体的疾病状态、年龄、性别、及体重,以及该物质/分子于个体内引发所需的反应的能力等因素而变。治疗上有效量亦为,治疗上有益效果超越物质/分子的任何有毒或有害影响的量。“预防上有效量”意指在所需剂量与时间期内,能有效达到所需的预防结果的量。通常但非必需,因受试者在疾病之前或疾病早期阶段使用预防剂量,该预防上有效量将小于治疗上有效量。
本文中使用的“细胞毒剂”术语意指抑制或预防细胞功能和/或导致细胞破坏的物质。该词旨在包括放射性同位素(如At211、I131、I125、Y90、Re186、Re188、Sm153、Bi212、P32、Pb212、及Lu的放射性同位素)、化学治疗剂(如甲氨蝶呤、阿霉素、长春花生物碱类、长春新碱、长春碱、依托泊苷、多柔比星、美法仑、丝裂霉素C、苯丁酸氮芥、道诺霉素、或其他嵌入剂)、酶及其片段,如核苷酸分解酶(nucleolyticenzymes)、抗生素、及毒素,如细菌、真菌、植物或动物源的小分子毒素或酶活性毒素,包括其片段和/或变体、及以下公开的各种抗肿瘤剂或抗癌剂。其他细胞毒剂说明如下。肿瘤毒杀剂(tumoricidal agent)导致肿瘤细胞破坏。
本文中使用的“化疗剂”为可用于治疗癌症的化学化合物。示例性化疗剂的实例包括烷化剂如塞替派及
药物组合物
在一些实施方案中,本发明提供药物组合物,其包含本文所述的抗体或其抗原结合部分,以及医药上可接受载体。医药上可接受载体包括任何或所有溶剂、分散介质、等张和吸收延迟剂等,它们是生理上相容的。在一个实施方案中,药物组合物有效抑制受试者的癌细胞。在一些实施方案中,配制剂为含有两个或更多个治疗剂的组合配制剂。
施用途径
本发明药物组合物的施用途径包括但不局限于,静脉内、肌肉内、鼻内、皮下、口服、局部、皮下、皮内、经皮、表皮下、胃肠外、直肠、脊髓、或表皮施用。
配制剂
本发明联合疗法的药物组合物可制成单独的单一疗法或共同配制成注射剂,不论液体溶液或悬液,或制成固体形式,其于注射前适用于液体载体中的溶液或悬液。药物组合物亦可制成固体形式、乳化、或将活性成分包入微脂体载剂或其他颗粒载体中,以用于持续输送。举例而言,药物组合物可为油乳剂、油包水乳剂、水包油包水乳剂、特定位点乳剂、长驻留乳剂、粘性乳剂、微乳剂、纳米乳剂、微脂体、微粒、微球、纳米球、纳米颗粒、及各种天然或合成聚合物,如不可再吸收性不可渗透聚合物,如乙烯乙酸乙烯酯共聚物和
自然地,用于体内施用的药物组合物必需无菌;可利用常规技术完成除菌,例如,利用除菌滤膜过滤。抗体浓度增至所谓的高浓度液体配制剂(HCLF)亦可行;已有说明各种产生此类HCLF的方式。
药物组合物可以以组合共同施用和/或与又另一治疗剂混合。组合产物可为两个或更多个成分的混合物,或其可共价相接。在特定实施方案中,抗体亦可结合癌症疫苗(如Globo H与白喉毒素共价相接)与皂苷佐剂施用。额外的治疗剂可与可选择地作为相同医药制剂的组分同时施用,或在施用本发明所公开抗体之前或之后施用。制备此类剂型的实际方法是本领域技术人员已知的或可改良。参见,例如,Remington’s PharmaceuticalSciences,Mack Publishing Company,Easton,Pennsylvania,21st edition。
给药与剂型
药物组合物可于单一剂量治疗或多剂量治疗中按照时间表及适合于受试者年龄、体重及病况、使用的特定组合物、及施用途径、药物组合物是否用于预防或治疗目的等条件下施用一段时间。举例而言,在一个实施方案中,本发明药物组合物的施用是每月一次、每月两次、每月三次、每隔一周(qow)、每周一次(qw)、每周两次(biw)、每周三次(tiw)、每周四次、每周五次、每周六次、每隔一天(qod)、每天(qd)、每天两次(qid)、或每天三次(tid)。
本发明抗体联合疗法的施用时间,亦即,施用药物组合物的时间段可变,取决于多种因素之任一者,如受试者反应等。举例而言,药物组合物可施用的时间范围为约一或多秒至一或多个小时、一天至约一周、约两周至约四周、约一个月至约两个月、约两个月至约四个月、约四个月至约六个月、约六个月至约八个月、约八个月至约一年、约一年至约二年、或约二年至约四年、或以上。
为便于施用及剂量均匀性,可使用剂量单位形式的口服或胃肠外药物组合物。本文中使用的剂量单位形式意指适于作为欲治疗对象的单位剂量的物理离散单位;各单位含有预定量的活性化合物,其经计算以产生所需治疗效果,其与所需的医药载体相关联。
细胞培养试验与动物研究取得的数据可用于配制用于人体的系列剂量。在一个实施方案中,此类化合物的剂量落于循环浓度范围内,包括具有些微或无毒性的ED
本发明抗体或抗原结合部位的治疗上或预防上有效量的示例性、非局限范围为约0.001至约60mg/kg的体重、约0.01至约30mg/kg的体重、约0.01至约25mg/kg的体重、约0.5至约25mg/kg的体重、约0.1至约20mg/kg的体重、约10至约20mg/kg的体重、约0.75至约10mg/kg的体重、约1至约10mg/kg的体重、约2至约9mg/kg的体重、约1至约2mg/kg的体重、约3至约8mg/kg的体重、约4至约7mg/kg的体重、约5至约6mg/kg的体重、约8至约13mg/kg的体重、约8.3至约12.5mg/kg的体重、约4至约6mg/kg的体重、约4.2至约6.3mg/kg的体重、约1.6至约2.5mg/kg的体重、约2至约3mg/kg的体重、或约10mg/kg的体重。
药物组合物经配制以含有有效量的本发明抗体或其抗原结合部分,其中该量取决于欲处理的动物及欲治疗的病况。在一个实施方案中,本发明抗体或其抗原结合部分的施用剂量范围为约0.01mg至约10g、约0.1mg至约9g、约1mg至约8g、约2mg至约7g、约3mg至约6g、约10mg至约5g、约20mg至约1g、约50mg至约800mg、约100mg至约500mg、约0.01μg至约10g、约0.05μg至约1.5mg、约10μg至约1mg蛋白、约30μg至约500μg、约40μg至约300μg、约0.1μg至约200μg、约0.1μg至约5μg、约5μg至约10μg、约10μg至约25μg、约25μg至约50μg、约50μg至约100μg、约100μg至约500μg、约500μg至约1mg、约1mg至约2mg。任何特定受试者的具体剂量程度取决于多个因素,包括特定肽的活性、年龄、体重、整体健康状况、性别、饮食、施用时间、施用途径、及排泄速率,药物组合及特定疾病于治疗时的严重程度,并且可由本领域普通技术人员确定,而无需过度实验。
本文中使用的“疫苗”术语意指含有抗原的制备物,其由完整致病生物体(非活性或弱化)或此类生物体的组分(如蛋白质、肽、或多糖)所组成,用于赋予免疫性以对抗生物体导致的疾病。疫苗制备物可为天然、合成、或衍生自重组DNA技术。
本文中使用的“特异性结合”术语意指结合对(如抗体与抗原)间的相互作用。在各种情况下,特异性结合可通过亲和力常数约10
本文中使用的“糖酶”术语意指在globo系列生物合成途径中的至少部分酶;示例性糖酶包括α-4GalT;β-4GalNAcT-I;或β-3GalT-V酶。
适用于组合的OBI-888(GloboH抗体)的实例描述
在特定实施方案中,抗体是OBI-888(抗GloboH单克隆抗体)。OBI-888的实例如PCT专利公开案(WO2015157629A及WO2017062792A1)专利申请案中记载,其全部内容在此并入以作为参考资料。
本发明提供Globo H抗体、或结合碳水化合物抗原的包含可变域的其抗原结合部分、这些抗体的缀合版本、其相关的编码或互补核酸、载体、宿主细胞、组合物、制剂、装置、转基因动物、转基因植物、以及其制造及使用方法,如本文所描述和启用的,与本领域已知的物质组合。抗体或其抗原结合部分可具有大约10E-7M或更小、大约10E-8M或更小、大约10E-9M或更小、大约10E-10M或更小、大约10E-11M或更小、或大约10E-12M或更小的解离常数(K
在一个实施方案中,本发明提供抗体、或其抗原结合部分,其包含包括大约80%至大约100%与SEQ ID NO:3所示的氨基酸序列同源的氨基酸序列的重链可变域。
在另一个实施方案中,本发明提供抗体、或其抗原结合部分,其包含包括大约80%至大约100%与SEQ ID NO:4所示的氨基酸序列同源的氨基酸序列的轻链可变域。
在又另一个实施方案中,本发明提供抗体、或其抗原结合部分,其包含包括大约80%至大约100%与SEQ ID NO:3所示的氨基酸序列同源的氨基酸序列的重链可变域;以及包括大约80%至大约100%与SEQ ID NO:4所示的氨基酸序列同源的氨基酸序列的轻链可变域。
在第四个实施方案中,本发明提供抗体、或其抗原结合部分,包含重链区,其中该重链区包含三个互补决定区(CDR),CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:5、6及7中所阐明的氨基酸序列同源的氨基酸序列。在一个示例性实施方案中,重链进一步包含在前导序列和所述CDR1之间的框架,其具有大约80%至大约100%与SEQID NO:87同源的氨基酸序列。在另一个实施方案中,重链进一步包含在所述CDR2和CDR3之间的框架,其具有大约80%至大约100%与SEQ ID NO:89同源的氨基酸序列。在又另一个示例性实施方案中,重链进一步包含在具有大约80%至大约100%与SEQ ID NO:11同源的氨基酸序列的重链的所述CDR1和CDR2之间的框架,其中该框架含有在位置9的甘氨酸,且其抗体或其抗原结合部分结合至碳水化合物抗原,诸如Globo H。
在第五个实施方案中,本发明提供抗体、或其抗原结合部分,包含轻链区,其中轻链区包含三个CDR,CDR1、CDR2及CDR3,其分别具有大约80%至100%与SEQ ID NO:8、9及10中所阐明的氨基酸序列同源的氨基酸序列。在一个示例性实施方案中,轻链进一步包含在前导序列和所述CDR1之间的框架,其具有大约80%至大约100%与SEQ ID NO:88同源的氨基酸序列。在另一个示例性实施方案中,轻链进一步包含在轻链之所述CDR2和CDR3之间的框架,其具有大约80%至大约100%与SEQ ID NO:90同源的氨基酸序列。在又另一个示例性实施方案中,轻链进一步包含在具有大约80%至大约100%与SEQ ID NO:12同源的氨基酸序列的轻链的所述CDR1和CDR2之间的框架,其中该框架含有在位置12的脯氨酸,且抗体或其抗原结合部分结合至Globo H。在又另一个示例性实施方案中,轻链进一步包含在具有大约80%至大约100%与SEQ ID NO:12同源的氨基酸序列的轻链的所述CDR1和CDR2之间的框架,其中该框架含有在位置13的色氨酸,且抗体或其抗原结合部分结合至碳水化合物抗原,诸如Globo H。
在第六个实施方案中,本发明提供抗体、或其抗原结合部分,其包含重链区和轻链区,其中该重链区包含三个CDR,CDR1、CDR2以及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:5、6及7中所阐明的氨基酸序列同源的氨基酸序列,且其中轻链区包含三个CDR,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:8、9及10中阐明的氨基酸序列同源的氨基酸序列。
在一些实施方案中,所提供的是抗体或其抗原结合部分,其包含:重链区,其中该重链区包含具有大约80%至大约100%与选自SEQ ID NO:5、6或7的氨基酸序列同源的氨基酸序列的CDR。在其他实施方案中,所提供的是抗体或其抗原结合部分,其包含轻链区,其中轻链区包含具有大约80%至大约100%与选自SEQ ID NO:8、9或10的氨基酸序列同源的氨基酸序列的CDR。
本发明也关于抗体、或其抗原结合部分,其包含:包括大约80%至大约100%与SEQID NO:13所示的氨基酸序列同源的氨基酸序列的重链可变域。
本发明也关于抗体、或其抗原结合部分,其包含:包括大约80%至大约100%与SEQID NO:14所示的氨基酸序列同源的氨基酸序列的轻链可变域。
本发明也关于抗体、或其抗原结合部分,其包含:包括大约80%至大约100%与SEQID NO:13所示的氨基酸序列同源的氨基酸序列的重链可变域;以及包括大约80%至大约100%与SEQ ID NO:14所示的氨基酸序列同源的氨基酸序列的轻链可变域。
一个示例性实施方案提供抗体、或其抗原结合部分,包含重链区,其中重链区包含三个CDR,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:15、16及17中所阐明的氨基酸序列同源的氨基酸序列。另一个示例性实施例提供抗体、或其抗原结合部分,包含轻链区,其中轻链区包含三个CDR,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:18、19及20中所阐明的氨基酸序列同源的氨基酸序列。
另一个示例性实施例提供抗体、或其抗原结合部分,其包含重链区和轻链区,其中重链区包含三个CDR,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:15、16及17中所阐明的氨基酸序列同源的氨基酸序列,且其中轻链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:18、19及20所阐明的氨基酸序列同源的氨基酸序列。
在一些实施方案中,所提供的是抗体、或其抗原结合部分,其包含:重链区,其中重链区包括具有大约80%至大约100%与选自SEQ ID NO:15、16或17的氨基酸序列同源的氨基酸序列的CDR。在其他实施方案中,所提供的是抗体或其抗原结合部分,其包含轻链区,其中轻链区包含具有大约80%至大约100%与选自SEQ ID NO:18、19或20的氨基酸序列同源的氨基酸序列的CDR。
本发明的一个实施方案是抗体、或其抗原结合部分,其包含:包括大约80%至大约100%与SEQ ID NO:21所示的氨基酸序列同源的氨基酸序列的重链可变域。
另一个本发明的实施方案是抗体或其抗原结合部分,其包含:包括大约80%至大约100%与SEQ ID NO:22所示的氨基酸序列同源的氨基酸序列的轻链可变域。
在本发明的另一个实施方案是抗体或其抗原结合部分,其包含:包括大约80%至大约100%与SEQ ID NO:21所示的氨基酸序列同源的氨基酸序列的重链可变域;以及包括大约80%至大约100%与SEQ ID NO:22中所示的氨基酸序列同源的氨基酸序列的轻链可变域。
一个示例性实施方案提供抗体、或其抗原结合部分,包含重链区,其中该重链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:23、24及25中所阐明的氨基酸序列同源的氨基酸序列。另一个示例性实施例提供抗体、或其抗原结合部分,包含轻链区,其中该轻链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:26、27及28中所阐明的氨基酸序列同源的氨基酸序列。
另一个示例性实施例提供抗体、或其抗原结合部分,其包括重链区和轻链区,其中重链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:23、24及25中所阐明的氨基酸序列同源的氨基酸序列,且其中轻链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:26、27及28所阐明的氨基酸序列同源的氨基酸序列。
在一些实施方案中,所提供的是抗体或其抗原结合部分,其包含:重链区,其中该重链区包括具有大约80%至大约100%与选自SEQ ID NO:23、24或25的氨基酸序列同源的氨基酸序列的CDR。在其他实施方案中,所提供的是抗体或其抗原结合部分,其包含轻链区,其中轻链区包括具有大约80%至大约100%与选自SEQ ID NO:26、27或28的氨基酸序列同源的氨基酸序列的CDR。
本发明也公开抗体、或其抗原结合部分,其包含:包括大约80%至大约100%与SEQID NO:29所示的氨基酸序列同源的氨基酸序列的重链可变域。
本发明也公开抗体、或其抗原结合部分,其包含:包括大约80%至大约100%与SEQID NO:30所示的氨基酸序列同源的氨基酸序列的轻链可变域。
本发明也公开抗体、或其抗原结合部分,其包含:包括大约80%至大约100%与SEQID NO:29所示的氨基酸序列同源的氨基酸序列的重链可变域;以及包括大约80%至大约100%与SEQ ID NO:30所示的氨基酸序列同源的氨基酸序列的轻链可变域。
一个示例性实施方案提供抗体、或其抗原结合部分,包含重链区,其中该重链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:31、32及33中所阐明的氨基酸序列同源的氨基酸序列。另一个示例性实施例提供抗体、或其抗原结合部分,包含轻链区,其中该轻链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:34、35及36中所阐明的氨基酸序列同源的氨基酸序列。
另一个示例性实施例提供抗体、或其抗原结合部分,其包含重链区和轻链区,其中重链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:31、32及33中所阐明的氨基酸序列同源的氨基酸序列,且其中轻链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:34、35及36所阐明的氨基酸序列同源的氨基酸序列。
在一些实施方案中,所提供的是抗体或其抗原结合部分,其包含:重链区,其中该重链区包括具有大约80%至大约100%与选自SEQ ID NO:31、32或33的氨基酸序列同源的氨基酸序列的CDR。在其他实施方案中,所提供的是抗体或其抗原结合部分,其包含轻链区,其中轻链区包含具有大约80%至大约100%与选自SEQ ID NO:34、35或36的氨基酸序列同源的氨基酸序列的CDR。
本发明的一个实施方案是抗体、或其抗原结合部分,其包含:包括大约80%至大约100%与SEQ ID NO:37所示的氨基酸序列同源的氨基酸序列的重链可变域。
本发明的另一个实施方案提供抗体或其抗原结合部分,其包含:包括大约80%至大约100%与SEQ ID NO:38所示的氨基酸序列同源的氨基酸序列的轻链可变域。
在本发明的另一个实施方案中提供抗体或其抗原结合部分,其包含:包括大约80%至大约100%与SEQ ID NO:37所示的氨基酸序列同源的氨基酸序列的重链可变域;以及包括大约80%至大约100%与SEQ ID NO:38中所示的氨基酸序列同源的氨基酸序列的轻链可变域。
一个示例性实施方案提供抗体、或其抗原结合部分,包含重链区,其中该重链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:39、40及41中所阐明的氨基酸序列同源的氨基酸序列。另一个示例性实施例公开抗体、或其抗原结合部分,包含轻链区,其中该轻链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:42、43及44中所阐明的氨基酸序列同源的氨基酸序列。
另一个示例性实施例提供抗体、或其抗原结合部分,其包含重链区和轻链区,其中重链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:39、40及41中所阐明的氨基酸序列同源的氨基酸序列,且其中轻链区包含三个CDRs,CDR1、CDR2及CDR3,其分别具有大约80%至大约100%与SEQ ID NO:42、43及44所阐明的氨基酸序列同源的氨基酸序列。
在一些实施方案中,所提供的是抗体或其抗原结合部分,其包含:重链区,其中该重链区包含具有大约80%至大约100%与选自SEQ ID NO:39、40或41的氨基酸序列同源的氨基酸序列的CDR。在其他实施方案中,所提供的是抗体或其抗原结合部分,其包含轻链区,其中轻链区包含具有大约80%至大约100%与选自SEQ ID NO:42、43或44的氨基酸序列同源的氨基酸序列的CDR。
本发明提供包含如本文描述的抗体或其抗原结合部分以及至少一个药学上可接受的载体的药物组合物。
本发明也提供用于抑制表达Globo H的癌细胞的方法,其包含对需要的受试者施用如本文所提供的抗体或其抗原结合部分的有效量,其中表达Globo H的癌细胞被抑制。
本发明也提供指定为2C2,保藏于美国典型培养物保藏中心(American TypeCulture Collection,ATCC)保藏号PTA-121138);3D7(保藏于ATCC保藏号PTA-121310);7A11(保藏于ATCC保藏号PTA-121311);2F8(保藏于ATCC保藏号PTA-121137)以及1E1(保藏于ATCC保藏号PTA-121312)的杂交瘤克隆(clones),以及从其产生的抗体与抗原结合部分。
本发明的抗体或其抗原结合部分以小于约10E-7M、小于约10E-8M、小于约10E-9M、小于约10E-10M、小于约10E-11M、或小于约10E-12M的解离常数(KD)特异性地结合至GloboH。在一个实施方案中,抗体或其抗原结合部分具有1~10x10E-9或小于其的解离常数(K
抗体具有可变重链区和可变轻链区,它们是至少约70%、至少约75%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同源于由克隆2C2所产生的抗体的可变重链区和可变轻链区,并且也可结合至碳水化合物抗原(例如,Globo H)。同源性可以氨基酸或核苷酸序列水平来表达。
在一些实施方案中,抗体或其抗原结合部分包含例如藉由杂交瘤2C2、杂交瘤3D7、杂交瘤7A11、杂交瘤2F8、以及杂交瘤1E1所产生的抗体的可变重链和/或可变轻链,显示于表1中。
在相关的实施方案中,抗体或其抗原结合部分包括例如从杂交瘤2C2、杂交瘤3D7、杂交瘤7A11、杂交瘤2F8、以及杂交瘤1E1产生的抗体的可变重链的CDR和/或可变轻链的CDR。来自这些杂交瘤克隆中可变重链和可变轻链的CDR和框架显示于表1。
表1:SEQ ID NO:1–90
本发明也涵盖编码可特异地结合至碳水化合物抗原的本发明的抗体或其抗原结合部分的核酸。在一个实施方案中,碳水化合物抗原是Globo H。
在又另一个实施方案中,碳水化合物抗原是SSEA-4。核酸可在细胞中表达以产生本发明的抗体或其抗原结合部分。
在特定实施方案中,本发明的抗体或其抗原结合部分包括包含至少约70%、至少约75%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同源至下列:SEQ ID NO:3(杂交瘤2C2);SEQ ID NO:13(杂交瘤3D7);SEQ ID NO:21(杂交瘤7A11);SEQ ID NO:29(杂交瘤2F8);或SEQ ID NO:37(杂交瘤1E1)的任一个的氨基酸序列的可变重链区。
在特定实施方案中,本发明的抗体或其抗原结合部分包括包含至少约70%、至少约75%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同源至下列:SEQ ID NO:4(杂交瘤2C2);SEQ ID NO:14(杂交瘤3D7);SEQ ID NO:22(杂交瘤7A11);SEQ ID NO:30(杂交瘤2F8);或SEQ ID NO:38(杂交瘤1E1)的任一个的氨基酸序列的可变轻链区。
在本发明的一方面中,未修饰抗体或其抗原结合部分包含重链可变区,其中该重链可变区包含三个CDR(CDR1、CDR2以及CDR3),其分别具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:91、92以及93所示的氨基酸序列同源的氨基酸序列。
在部分实施方案中,未修饰抗体或其抗原结合部分的重链可变区进一步包含至少一个选自以下的框架:(i)于前导序列及重链CDR1之间的框架,其具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:94同源的氨基酸序列;(ii)于重链的CDR1及CDR2之间的框架,其具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:95同源的氨基酸序列;(iii)于重链的CDR2及CDR3之间的框架,其具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:96同源的氨基酸序列。
在另一个实施方案中,重链可变区的框架2(SEQ ID NO:95)中的氨基酸残基46(或由框架2的C端算起第6个氨基酸残基)为甘氨酸且未经取代。SEQ ID NO:95的氨基酸残基位置呈现如下:
*框架2的氨基酸残基38(W)为与CDR1相邻的残基或由框架2的N端起算的第1个氨基酸残基。
**框架2的氨基酸残基51(A)为与CDR2相邻的残基或由框架2的C端起算的第1个氨基酸残基。
在本发明的另一方面中,未修饰抗体或其抗原结合部分包含轻链可变区,其中轻链可变区包含三个CDR(CDR1、CDR2以及CDR3),其分别具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:97、98以及99中所示的氨基酸序列同源的氨基酸序列。
在部分实施方案中,未修饰抗体或其抗原结合部分的轻链可变区进一步包含至少一个选自以下的框架:(a)于前导序列及轻链的DR1之间的框架,其具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:100同源的氨基酸序列;(b)于轻链的CDR1及CDR2之间的框架,其具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:101同源的氨基酸序列;或(c)于轻链的CDR2及CDR3之间的框架,其具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:102同源的氨基酸序列。在其他实施方案中,在氨基酸残基45和/或氨基酸残基46未被取代的前提下,轻链的框架2(SEQ ID NO:11)中的氨基酸残基45(或由框架2的C端算起第4个氨基酸残基)为脯氨酸和/或轻链的框架2中的氨基酸残基46(或由框架2的C端算起第3个氨基酸残基)为色氨酸。SEQ ID NO:101的氨基酸的位置呈现如下:
*在框架2的位置34的氨基酸(W)为与CDR1相邻的残基或由框架2的N端起算的第1个氨基酸残基。
**在框架2的位置48的氨基酸(Y)为与CDR2相邻的残基或由框架2的C端起算的第1个氨基酸残基。
本发明的未修饰抗体亦包含与肿瘤碳水化合物或其片段结合的人源化抗体。在一个实施方案中,人源化抗体包含具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ IDNO:103同源的氨基酸序列的重链可变区;和/或轻链可变区包含具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:104同源的氨基酸序列的轻链。
本发明的未修饰抗体亦包含与肿瘤碳水化合物或其片段结合的嵌合抗体。在一个实施方案中,该嵌合抗体包含具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ IDNO:105同源的氨基酸序列的重链可变区;和/或轻链可变区包含具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:106同源的氨基酸序列的轻链。
表2呈现未修饰抗体及经修饰抗体的一个示例性实施方案的重链可变区、轻链可变区、CDR以及FW的氨基酸序列。
表2:GH 888 2017 SEQ ID No.91-108
根据本说明书及本领域的教导,涵盖的是在部分实施方案中,相较于野生型对应抗体,本发明的经修饰抗体可包含一或多种修改(例如:于一或多个CDR中)。经修饰抗体相较于其未修饰野生型对应抗体将留存与用于治疗应用所需的特性实质上相同的特性。然而,认为相较于自其生成经修饰抗体的未修饰野生型抗体,于本文所述的位置处的一些氨基酸残基修改将生成对肿瘤相关碳水化合物具有提升或最佳化结合亲和力的经修饰抗体。在一个实施方案中,本发明的经修饰抗体为“亲和力成熟”抗体。
修改的一个类型包含取代野生型/未修饰抗体的CDR的一或多个氨基酸残基以生成经修饰抗体。此种经修饰抗体可利用以噬菌体展示为基础的亲和力成熟技术而便利的生成。简言之,将数个高变区位点(例如:6-7个位点)突变以在每个位点产生所有可能的氨基酸取代。因此生成的抗体以包覆于每个颗粒中的至少一部分噬菌体壳体蛋白(例如:M13的基因III产物)的融合物自丝状噬菌体颗粒展示。其后,筛选该噬菌体呈现的变体的生物活性(例如结合亲和力)。为确认用以修饰的候选高变区位点,可执行扫描诱变(例如:丙氨酸扫描)以确认对抗原结合有显著贡献的高变区残基。替代性地,或另外,可能有益的是分析抗原-抗体复合物晶体结构以确认抗体及抗原间之接触位点。根据包含本文中所详述的本领域已知技术,此类接触残基及相邻残基为取代的候选残基。一旦生成经修饰抗体,则利用包含本文中所详述的该领域所知技术对变体组进行筛选,且在一或多个相关分析中可选定具优异特性的经修饰抗体以进行进一步的开发。
经修饰抗体亦可由描述于,例如:Mark等人,1992,(affinity maturation byvariable heavy chain(VH)and variable light chain(VL)domain shuffling)或Barbas,等人,1994;Shier等人,1995;Yelton等人,1995;Jackson等人,1995;及Hawkins等人,1992(random mutagenesis of CDR and/or framework residues)的方法生成。
在本发明的一方面中,本发明所述的经修饰抗体或其抗原结合部分包含重链可变区,其中该重链可变区包含三个CDR(CDR1、CDR2以及CDR3),其分别具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:91、92以及93所示的氨基酸序列同源的氨基酸序列;其中选自氨基酸残基28、31、57、63或105中的至少一个氨基酸残基被与存在于未修饰抗体中的氨基酸不同的另一氨基酸取代,进而提升未修饰抗体的结合亲和力大约5%、大约10%、大约20%、大约30%、大约40%、大约50%、大约60%、大约70%、大约80%、大约90%、大约100%、大约150%、大约200%、大约300%、大约400%、大约500%、大约600%或大约700%。
在一个实施方案中,经修饰抗体的重链可变区包含至少一种以下氨基酸取代:
(a)CDR1中的氨基酸残基28(丝氨酸)被碱性氨基酸、非丝氨酸之中性氨基酸或疏水性氨基酸取代;
(b)CDR1中的氨基酸残基31(苏氨酸)被碱性氨基酸取代;
(c)CDR2中的氨基酸残基57(天门氨酸)被中性氨基酸、碱性氨基酸或疏水性氨基酸取代;
(d)CDR2中的氨基酸残基63(脯氨酸)被中性氨基酸、碱性氨基酸或非脯氨酸的疏水性氨基酸取代,或
(e)CDR3中的氨基酸残基105(天门氨酸)被碱性氨基酸、疏水性氨基酸或中性氨基酸取代。
二十种氨基酸根据其侧链被分成四个类别(碱性、中性、疏水性以及酸性)。表3列出四个类别的氨基酸。
表3.GH888 2017四个类别的氨基酸。
实施方案包含在重链区具有至少一个以下氨基酸取代的经修饰抗体:(a)CDR1中的氨基酸残基28(或由CDR1的N端起算的第3个氨基酸残基)被碱性氨基酸;非丝氨酸、甘氨酸或谷氨酰胺的中性氨基酸;或非异亮氨酸、亮氨酸、甲硫氨酸或色氨酸的疏水性氨基酸取代,(b)CDR1中的氨基酸残基31(或由CDR1的N端起算的第6个氨基酸残基)被非组氨酸的碱性氨基酸取代,(c)CDR2中的氨基酸残基57(或由CDR2的N端起算的第6个氨基酸残基)被非天冬酰胺或苏氨酸的中性氨基酸;碱性氨基酸或非异亮氨酸、脯氨酸或缬氨酸的疏水性氨基酸取代,(d)CDR2中的氨基酸残基63(或由CDR2的C端起算的第5个氨基酸残基)被非天冬酰胺、谷氨酰胺或苏氨酸的中性氨基酸;碱性氨基酸或非脯氨酸或甲硫氨酸的疏水性氨基酸取代,或(e)CDR3中的氨基酸残基105(或由CDR3的N端起算的第6个氨基酸残基)被碱性氨基酸、中性氨基酸或非亮氨酸的疏水性氨基酸取代。
表4提供经修饰抗体的重链可变区的氨基酸取代的实例。对于各取代而言,第一字母表示未修饰抗体的氨基酸,数字代表其根据卡贝特编号方案的位置,且第二字母代表经修饰抗体的氨基酸。例如:在氨基酸残基28的丝氨酸被赖氨酸(S028K)、精氨酸(S028R)、酪氨酸(S028Y)或苯丙氨酸(S028F)取代,在氨基酸残基31的苏氨酸被赖氨酸(T031K)或精氨酸(T031R)取代,在氨基酸残基57的天门氨酸被甘氨酸(D057G)、丝氨酸(D057S)、谷氨酰胺(D057Q)、组氨酸(D057H)或色氨酸(D057W)取代,在氨基酸残基63的脯氨酸被组氨酸(P063H)、精氨酸(P063R)、酪氨酸(P063Y)、丙氨酸(P063A)、亮氨酸(P063L)或缬氨酸(P063V)取代,在氨基酸残基105的天门氨酸被精氨酸(D105R)、甘氨酸(D105G)、苏氨酸(D105T)、甲硫氨酸(D105M)、丙氨酸(D105A)、异亮氨酸(D105I)、赖氨酸(D105K)或缬氨酸(D105V)取代。
表4:重链可变区的氨基酸取代的GH 888 2017实例
在本发明的另一方面中,本发明的经修饰抗体或其抗原结合部分包含轻链可变区,其中轻链可变区包含三个CDR(CDR1、CDR2以及CDR3),其分别具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:97、98以及99所示的氨基酸序列同源的氨基酸序列;其中选自氨基酸残基24、32、49、53或93中的至少一个氨基酸残基被与存在于未修饰抗体中的氨基酸不同的另一氨基酸取代,进而提升未修饰抗体的结合亲和力大约5%、大约10%、大约20%、大约30%、大约40%、大约50%、大约60%、大约70%、大约80%、大约90%、大约100%、大约150%、大约200%、大约300%、大约400%、大约500%、大约600%或大约700%。
在一个实施方案中,经修饰抗体的轻链可变区包含至少一种以下氨基酸取代:
(a)CDR1中的氨基酸残基24(精氨酸)(或由CDR1的N端起算的第1个氨基酸残基)被中性氨基酸或疏水性氨基酸取代,
(b)CDR1中的氨基酸残基32(甲硫氨酸)(或由CDR1的C端起算的第2个氨基酸残基)被中性氨基酸或非甲硫氨酸之疏水性氨基酸取代,
(c)CDR2中的氨基酸残基49(丙氨酸)(或由CDR2的N端起算的第1个氨基酸残基)被中性氨基酸取代,
(d)CDR2中的氨基酸残基53(亮氨酸)(或由CDR2的N端起算的第5个氨基酸残基)被中性氨基酸或碱性氨基酸取代,或
(e)CDR3中的氨基酸残基93(天冬酰胺)(或由CDR3的N端起算的第6个氨基酸残基)被非天冬酰胺的中性氨基酸、碱性氨基酸或疏水性氨基酸取代。
实施方案包含在轻链区具有至少一个以下氨基酸取代的经修饰抗体:(a)CDR1中的氨基酸残基24被非苏氨酸的中性氨基酸或非甲硫氨酸、脯氨酸或缬氨酸的疏水性氨基酸取代,(b)CDR1中的氨基酸残基32被非丝氨酸或苏氨酸的中性氨基酸或非甲硫氨酸、亮氨酸或色氨酸的疏水性氨基酸取代,(c)CDR2中的氨基酸残基49被非天冬酰胺或苏氨酸的中性氨基酸取代,(d)CDR2中的氨基酸残基53被非天冬酰胺或丝氨酸的中性氨基酸或非精氨酸的碱性氨基酸取代,或(e)CDR3中的氨基酸残基93被非天冬酰胺的中性氨基酸、碱性氨基酸或非缬氨酸的水性氨基酸取代。
表5提供经修饰抗体的轻链可变区的该氨基酸取代的实例。举例而言,使用卡贝特编号方案,在位置24的氨基酸残基被甘氨酸(R024G)、丝氨酸(R024S)或色氨酸(R024W)取代,在位置32的氨基酸残基被甘氨酸(M032G)、谷氨酰胺(M032Q)或缬氨酸(M032V)取代,在位置49的氨基酸残基被甘氨酸(A049G)取代,在位置53的氨基酸残基被赖氨酸(L053K)、甘氨酸(L053G)或苏氨酸(L053T)取代,在位置93的氨基酸残基被精氨酸(N093R)、谷氨酰胺(N093Q)、丝氨酸(N093S)、苏氨酸(N093T)、苯丙氨酸(N0936F)、亮氨酸(N093L)或甲硫氨酸(N093M)取代。
表5:轻链可变区的氨基酸取代的GH 888 2017实例
在一个实施方案中,经修饰抗体包含:
(a)重链可变区,其包含三个CDR(CDR1、CDR2以及CDR3),其分别具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:91、92以及93所示的氨基酸序列同源的氨基酸序列,且包含至少一个以下氨基酸取代:
(i)CDR1中的氨基酸残基28被赖氨酸(S028K)、精氨酸(S028R)、酪氨酸(S028Y)或苯丙氨酸(S028F)取代,
(ii)CDR1中的氨基酸残基31被赖氨酸(T031K)或精氨酸(T031R)取代,
(iii)CDR2中的氨基酸残基57被组氨酸(D057H)、甘氨酸(D057G)、丝氨酸(D057S)、谷氨酰胺(D057Q)或色氨酸(D057W)取代,
(iv)CDR2中的氨基酸残基63被组氨酸(P063H)、精氨酸(P063R)、酪氨酸(P063Y)、丙氨酸(P063A)、亮氨酸(P063L)或缬氨酸(P063V)取代,
(v)CDR3中的氨基酸残基105被精氨酸(D105R)、甘氨酸(D105G)、苏氨酸(D105T)、甲硫氨酸(D105M)、丙氨酸(D105A)、异亮氨酸(D105I)、赖氨酸(D105K)或缬氨酸(D105V)取代,以和/或
(b)轻链可变区,其包含三个CDR(CDR1、CDR2以及CDR3),其分别具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:97、98以及99所示的氨基酸序列同源的氨基酸序列且包含至少一个以下氨基酸取代:
(i)CDR1中的氨基酸残基24被甘氨酸(R024G)、丝氨酸(R024S)或色氨酸(R024W)取代,
(ii)CDR1中的氨基酸残基32被甘氨酸(M032G)、谷氨酰胺(M032Q)或缬氨酸(M032V)取代,
(iii)CDR2中的氨基酸残基49被甘氨酸(A049G)取代,
(iv)CDR2中的氨基酸残基53被赖氨酸(L053K)、甘氨酸(L053G)或苏氨酸(L053T)取代,
(v)CDR3中的氨基酸残基93被精氨酸(N093R)、谷氨酰胺(N093Q)、丝氨酸(N093S)、苏氨酸(N093T)、苯丙氨酸(N093F)、亮氨酸(N093L)或甲硫氨酸(N093M)。
在另一个实施方案中,经修饰抗体包含:
(a)重链可变区,其包含三个CDR(CDR1、CDR2以及CDR3),其分别具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:91、92以及93所示的氨基酸序列同源的氨基酸序列且包含至少一个以下氨基酸取代:
(i)CDR1中的氨基酸残基28被精氨酸(S028R)取代,
(ii)CDR1中的氨基酸残基31被精氨酸(T031R)取代,
(iii)CDR2中的氨基酸残基57被甘氨酸(D057G)取代
(iv)CDR2中的氨基酸残基63被酪氨酸(P063Y)取代,
(v)CDR3中的氨基酸残基105被精氨酸取代(D105R)取代,和/或
(b)轻链可变区,其包含三个CDR(CDR1、CDR2以及CDR3),其分别具有大约80%、大约81%、大约82%、大约83%、大约84%、大约85%、大约86%、大约87%、大约88%、大约89%、大约90%、大约91%、大约92%、大约93%、大约94%、大约95%、大约96%、大约97%、大约98%、大约99%或大约100%与SEQ ID NO:97、98以及99所示的氨基酸序列同源的氨基酸序列且包含至少一个以下氨基酸取代:
(i)CDR1中的氨基酸残基24被色氨酸(R024W)取代,
(ii)CDR1中的氨基酸残基32被谷氨酰胺(M032Q)取代,
(iii)CDR2中的氨基酸残基49被甘氨酸(A049G)取代,
(iv)CDR2中的氨基酸残基53被赖氨酸取代(L053K),
(v)CDR3中的氨基酸残基93被精氨酸取代(N093R)。
适用于组合的OBI-898(SSEA-4抗体)的实例描述
在特定实施方案中,抗体是OBI-898(抗SSEA-4loboH单克隆抗体)。OBI-898的实例如PCT专利公开案(WO2017172990A1)、美国专利公开案(US2018339061A1))专利申请案所述,其全部内容在此并入以作为参考资料。
提供针对标志物的抗体方法及组合物,用于诊断及治疗广泛的癌症。此处发展并公开抗SSEA-4抗体。使用方法包括不限于癌症疗法及诊断。此处所描述的抗体可结合至一大批表达SSEA-4的癌细胞,藉此加速癌症诊断及治疗。抗体可靶向的细胞包括癌瘤(carcinoma),例如,皮肤、血液、淋巴结、脑、肺、乳腺、小鼠、食道、胃、肝、胆管、胰腺、结肠、肾、子宫颈、卵巢、前列腺癌等中的。
本公开的示例性SSEA-4抗体及结合片段是基于以下发现:阶段特异性胚胎抗原4(SSEA-4)大量表达于一大批癌症,而非正常细胞中。表达SSEA-4的癌症包括但不局限于,乳腺癌、肺癌、食道癌、结肠癌、胆道癌、肝癌、颊癌、胃癌、肠癌、鼻咽癌、肾癌、前列腺癌、卵巢癌、子宫颈癌、子宫内膜癌、胰腺癌、睾丸癌、膀胱癌、头颈癌、口腔癌、神经内分泌癌、肾上腺癌、甲状腺癌、骨癌、皮肤癌、基底细胞癌、鳞状细胞癌、黑素瘤或脑肿瘤。
在一方面,本发明的特征为特异于SSEA-4的抗体或其结合片段。抗SSEA-4抗体结合至Neu5Acα2→3Galβ1→3GalNAcβ1→3Galα1→4Galβ1→4Glcβ1。
在特定方面,本发明提供称为1J1s(美国典型培养物保藏中心(ATCC)保藏号PTA-122679所保藏)、1G1s(ATCC保藏号PTA-122678保藏)、2F20s(ATCC保藏号PTA-122676所保藏)的杂交瘤克隆,以及自其产生的抗体或抗原结合片段。
在一方面,本发明提供抗体或其抗原结合片段,其包含:重链可变区(VH),其包含与SEQ ID NO:111所示的氨基酸序列具有至少约80%序列同源性的氨基酸序列,和/或轻链可变区(VL),其包含与SEQ ID NO:112所示的氨基酸序列具有至少约80%同源性的氨基酸序列。于一些方面,包含与SEQ ID NO:111所示的氨基酸序列具有至少约80%序列同源性的氨基酸序列的重链可变区(VH)氨基酸序列将包含或排除天然存在的序列。在一些方面,包含与SEQ ID NO:112所示的氨基酸序列具有至少约80%序列同源性的氨基酸序列的轻链可变区(VL)氨基酸序列将包含或排除天然存在的序列。
在特定实施方案中,抗体或抗原结合片段进一步包含:H-CDR1、H-CDR2、及H-CDR3,其分别选自于如下所示的(i)-(iii):
(i)选自SEQ ID NO:121的H-CDR1;
(ii)选自SEQ ID NO:123的H-CDR2;
(iii)选自SEQ ID NO:125的H-CDR3;
以及包含L-CDR1、L-CDR2、及L-CDR3,其分别选自于(iv)-(vi):
(iv)选自SEQ ID NO:114的L-CDR1;
(v)选自SEQ ID NO:116的L-CDR2;以及
(vi)选自SEQ ID NO:118的L-CDR3。
在特定实施方案中,抗体或其抗原结合片段包含重链区,其中重链区包含互补决定区(CDR)氨基酸序列,其与选自于SEQ ID NO:121、123或125的氨基酸序列具有至少约80%的同源性。在特定实施方案中,抗体或其抗原结合片段包含轻链区,其中轻链区包含互补决定区(CDR)氨基酸序列,其与选自于SEQ ID NO:114、116或118的氨基酸序列具有至少约80%的同源性。在特定实施方案中,抗体或抗原结合片段排除天然存在的序列。在特定实施方案中,抗体或抗原结合片段涵盖天然存在的序列。
在特定实施方案中,抗体或抗原结合片段进一步包含:H-FW1、H-FW2、H-FW3、及H-FW4,其分别选自于如下所示的(i)-(iv):
(i)选自SEQ ID NO:120的H-FW1;
(ii)选自SEQ ID NO:122的H-FW2;
(iii)选自SEQ ID NO:124的H-FW3;
(iv)选自SEQ ID NO:126的H-FW4;
以及包含L-FW1、L-FW2、L-FW3、及L-FW4,其分别选自于(v)-(viii):
(v)选自SEQ ID NO:113的L-FW1;
(vi)选自SEQ ID NO:115的L-FW2;
(vii)选自SEQ ID NO:117的L-FW3;
(viii)选自SEQ ID NO:119的L-FW4。
在一方面,本发明提供抗体或其抗原结合片段,由称为1J1s以ATCC保藏号PTA-122679保藏的杂交瘤产生。
在一方面,本发明提供称为1J1s以ATCC保藏号PTA-122679保藏的杂交瘤。
在特定方面,本发明提供抗体或其抗原结合片段,其包含:包含与SEQ ID NO:129所示的氨基酸序列具有至少约80%的序列同源性的氨基酸序列的重链可变区(VH)和/或包含与SEQ ID NO:130所示的氨基酸序列具有至少约80%同源性的氨基酸序列的轻链可变区(VL)。在一些方面,包含与SEQ ID NO:129所示的氨基酸序列具有至少约80%的序列同源性的氨基酸序列的重链可变区(VH)的氨基酸序列将涵盖或排除天然存在的序列。在一些方面,包含与SEQ ID NO:130所示的氨基酸序列具有至少约80%的序列同源性的氨基酸序列的轻链可变区(VL)的氨基酸序列,将涵盖或排除天然存在的序列。
在特定实施方案中,抗体或抗原结合片段进一步包含H-CDR1、H-CDR2、及H-CDR3,其分别选自以下所示的(i)-(iii):
(i)选自SEQ ID NO:139的H-CDR1;
(ii)选自SEQ ID NO:141的H-CDR2;
(iii)选自SEQ ID NO:143的H-CDR3;
以及包含L-CDR1、L-CDR2、及L-CDR3,其分别选自于(iv)-(vi):
(iv)选自SEQ ID NO:132的L-CDR1;
(v)选自SEQ ID NO:134的L-CDR2;以及
(vi)选自SEQ ID NO:136的L-CDR3。
在特定实施方案中,抗体或其抗原结合片段包含重链区,其中重链区包含互补决定区(CDR)氨基酸序列,其与选自于SEQ ID NO:139、141、或143的氨基酸序列具有至少约80%的序列同源性。在特定实施方案中,抗体或其抗原结合片段包含轻链区,其中轻链区包含互补决定区(CDR)氨基酸序列,其与选自于SEQ ID NO:132、134、或136的氨基酸序列具有至少约80%的序列同源性。在特定实施方案中,抗体或抗原结合片段涵盖或排除天然存在的序列。
在特定实施方案中,抗体或抗原结合片段进一步包含:H-FW1、H-FW2、H-FW3、及H-FW4,其分别选自于表2所示的(i)-(iv):
(i)选自SEQ ID NO:138的H-FW1;
(ii)选自SEQ ID NO:140的H-FW2;
(iii)选自SEQ ID NO:142的H-FW3;
(iv)选自SEQ ID NO:144的H-FW4;
以及包含L-FW1、L-FW2、L-FW3、及L-FW4,其分别选自于(v)-(viii):
(v)选自SEQ ID NO:131的L-FW1;
(vi)选自SEQ ID NO:133的L-FW2;
(vii)选自SEQ ID NO:135的L-FW3;
(viii)选自SEQ ID NO:137的L-FW4。
在一方面,本发明提供抗体或其抗原结合片段,其由保藏于ATCC保藏号PTA-122678下、称为1G1s的杂交瘤产生。
在一方面,本发明提供保藏于ATCC保藏号PTA-122678下、称为1G1s的杂交瘤。
在特定方面,本发明提供抗体或其抗原结合片段,其包含:包含与SEQ ID NO:147所示的氨基酸序列具有至少约80%的序列同源性的氨基酸序列的重链可变区(VH)和/或包含与SEQ ID NO:148所示的氨基酸序列具有至少约80%同源性的氨基酸序列的轻链可变区(VL)。在一些方面包含与SEQ ID NO:147所示的氨基酸序列具有至少约80%的序列同源性的氨基酸序列的重链可变区(VH)将涵盖或排除天然存在之序列。在一些方面,包含与SEQID NO:148所示的氨基酸序列具有至少约80%序列同源性的氨基酸序列的轻链可变区(VL)将涵盖或排除天然存在之序列。
在特定实施方案中,抗体或其抗原结合片段进一步包含H-CDR1、H-CDR2、及H-CDR3,其分别选自以下所示的(i)-(iii):
(i)选自SEQ ID NO:157的H-CDR1;
(ii)选自SEQ ID NO:159的H-CDR2;
(iii)选自SEQ ID NO:161的H-CDR3;
以及包含L-CDR1、L-CDR2、及L-CDR3,其分别选自于(iv)-(vi):
(iv)选自SEQ ID NO:150的L-CDR1;
(v)选自SEQ ID NO:152的L-CDR2;以及
(vi)选自SEQ ID NO:154的L-CDR3。
在特定实施方案中,抗体或其抗原结合片段包含重链区,其中重链区包含互补决定区(CDR)氨基酸序列,其与选自于SEQ ID NO:157、159或161的氨基酸序列具有至少约80%的序列同源性。在特定实施方案中,抗体或其抗原结合片段包含轻链区,其中轻链区包含互补决定区(CDR)氨基酸序列,其与选自于SEQ ID NO:150、152、或154的氨基酸序列具有至少约80%的序列同源性。在特定实施方案中,抗体或抗原结合片段涵盖或排除天然存在的序列。
在特定实施方案中,抗体或抗原结合片段进一步包含:H-FW1、H-FW2、H-FW3、及H-FW4,其分别选自于表3所示的(i)-(iv):
(i)选自SEQ ID NO:156的H-FW1;
(ii)选自SEQ ID NO:158的H-FW2;
(iii)选自SEQ ID NO:160的H-FW3;
(iv)选自SEQ ID NO:162的H-FW4;
以及包含L-FW1、L-FW2、L-FW3、及L-FW4,其分别选自于(v)-(viii):
(v)选自SEQ ID NO:149的L-FW1;
(vi)选自SEQ ID NO:151的L-FW2;
(viii)选自SEQ ID NO:153的L-FW3;
(viii)选自SEQ ID NO:155的L-FW4。
在一方面,本发明提供抗体或其抗原结合片段,其由保藏于ATCC保藏号PTA-122676下、称为2F20s的杂交瘤产生。
在一方面,本发明提供保藏于ATCC保藏号PTA-122676下、称为2F20s的杂交瘤。
在特定实施方案中,抗体或抗原结合片段进一步包含H-CDR1、H-CDR2、及H-CDR3,其分别选自如下所示的(i)-(iii):
(i)选自SEQ ID NO:175的H-CDR1;
(ii)选自SEQ ID NO:176的H-CDR2;
(iii)选自SEQ ID NO:177的H-CDR3;
以及包含L-CDR1、L-CDR2、及L-CDR3,其分别选自于(iv)-(vi):
(iv)选自SEQ ID NO:180的L-CDR1;
(v)选自SEQ ID NO:181的L-CDR2;以及
(vi)选自SEQ ID NO:182的L-CDR3。
在特定实施方案中,抗体或其抗原结合片段包含重链区,其中重链区包含互补决定区(CDR)氨基酸序列,其与选自于SEQ ID NO:175、176、或177的氨基酸序列具有至少约80%的序列同源性。在特定实施方案中,抗体或其抗原结合片段包含轻链区,其中轻链区包含互补决定区(CDR)氨基酸序列,其与选自于SEQ ID NO:180、181、或182的氨基酸序列具有至少约80%的序列同源性。在特定实施方案中,抗体或抗原结合片段涵盖或排除天然存在的序列。
在特定实施方案中,示例性抗体或其抗原结合片段包括可变区,其能结合至一个或多个碳水化合物抗原。
在特定实施方案中,抗体或其抗原结合片段靶向碳水化合物抗原SSEA-4(Neu5Acα2→3Galβ1→3GalNAcβ1→3Galα1→4Galβ1→4Glcβ1)(SSEA-4六糖)。
在特定实施方案中,抗体或其抗原结合片段选自:(a)整个免疫球蛋白分子;
(b)scFv;
(c)Fab片段;
(d)F(ab')
(e)双硫键连接的Fv。
在特定实施方案中,抗体为人源化抗体。
在特定实施方案中,抗体为IgG或IgM。
一方面,本发明提供药物组合物,其包含抗体或其抗原结合片段;以及至少医药上可接受载体。
在特定实施方案中,药物组合物进一步包含至少附加的治疗剂。
在一方面,本发明提供抑制癌细胞增殖的方法,其包含对有此需要的受试者施用有效量的示例性药物组合物,其中癌细胞的增殖经抑制。
在特定实施方案中,本发明提供在受试者中治疗癌症的方法。本方法包含对有此需要的受试者施用有效量的本发明所述示例性抗体。
在特定实施方案中,癌症选自由乳腺癌、肺癌、食道癌、直肠癌、胆道癌、肝癌、颊癌、胃癌、结肠癌、鼻咽癌、肾癌、前列腺癌、卵巢癌、子宫颈癌、子宫内膜癌、胰腺癌、睾丸癌、膀胱癌、头颈癌、口腔癌、神经内分泌癌、肾上腺癌、甲状腺癌、骨癌、皮肤癌、基底细胞癌、鳞状细胞癌、黑素瘤或脑肿瘤组成的组。
在一方面,本发明提供将受试者的癌症分期的方法,其包含:
(a)施加一个或多个检测SSEA-4表达的抗体至取自受试者的细胞或组织样本;
(b)试验一个或多个抗体与细胞或组织样本的结合;
(c)与正常对照比较结合,以确定受试者癌症的存在;以及
(d)基于与正常基线指数相比相应抗体结合的相对水平将疾病进展阶段分类。
靶向SSEA-4的抗体
本发明的一方面为靶向SSEA-4相关抗原的新颖抗体。
mAb 1J1s(ATCC保藏号PTA-122679)为单克隆抗体,其利用杂交瘤细胞系(ATCC保藏号PTA-122679)产生。本文所述抗体可含有与抗体1J1s相同的VH与VL链。与1J1s结合相同表位的抗体亦落入本发明的范畴。
以下提供实例及其氨基酸与核酸结构/序列:
表6.抗体1J1s的SSEA-4 898氨基酸与核苷酸序列
mAb 1G1s(ATCC保藏号PTA-122678)为小鼠单克隆抗体,其利用杂交瘤细胞系(ATCC保藏号PTA-122678)产生。本文所述抗体可含有与抗体1G1s相同的VH与VL链。与1G1s结合相同表位之抗体亦落入本发明的范畴。
以下提供实例及其氨基酸与核酸结构/序列
表7.抗体1G1s的SSEA-4 898氨基酸与核苷酸序列
mAb 2F20s(与ATCC保藏号PTA-122676)为单克隆抗体,其利用杂交瘤细胞系(ATCC保藏号PTA-122676)产生。本文所述抗体可含有与抗体2F20s相同的VH与VL链。与2F20s结合相同表位之抗体亦落入本发明的范畴。
以下提供实例及其氨基酸与核酸结构/序列:
表8.抗体2F20s的SSEA-4 898氨基酸与核苷酸序列
以下提供SSEA-4-898人源化克隆的实例及其氨基酸序列。
表9.SSEA-4 898人源化克隆氨基酸序列列表
本发明的一方面特征为特异于SSEA-4的新颖抗体。抗SSEA-4抗体结合至Neu5Acα2→3Galβ1→3GalNAcβ1→3Galα1→4Galβ1→4Glcβ1(SSEA-4六糖)。
宿主动物的免疫作用及杂交瘤技术
在一个实施方案中,本文所述抗体之任一者可为全长抗体或其抗原结合片段。于一些实例中,抗原结合片段为Fab片段、F(ab')
本文所述抗体之任一者具有一或多个以下特征:(a)为重组抗体、单克隆抗体、嵌合抗体、人源化抗体、人类抗体、抗体片段、双特异性抗体、单特异性抗体、单价抗体、IgG
优选的是,抗体与其个别抗原的结合具特异性。“特异性”术语一般而言用于意指结合配对的成员除了其特异性结合配对体以外,不会显示与分子有任何显著结合的情况,并且例如除了本文指定的那些以外,其与任何其他分子具有小于约30%,优选为20%、10%、或1%的交叉反应性。
抗体适于以高亲和力(低KD值)结合靶标表位,且优选地KD为纳摩尔范围或更低。亲和力可利用本领域已知的方法测定,如表面等离子体共振法。
示例性抗体制备物
能够结合本文所述的Globo H表位和SSEA-4表位的示例性抗体可藉由本领域已知的任何方法来制备。参见例如Harlow和Lane,(1988)Antibodies:A Laboratory Manual,Cold。本发明提供了一种制造杂交瘤的方法,所述杂交瘤表达特异性结合碳水化合物抗原(如Globo H)的抗体。本方法含有下列步骤:以包括碳水化合物抗原(如Globo H)的组合物进行动物免疫作用;由动物分离脾细胞;自脾细胞产生杂交瘤;以及挑选可产生特异性结合Globo H的抗体的杂交瘤。Kohler and Milstein,Nature,256:495,1975;Harlow,E.andLane,D.Antibodies:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,1988。
在一个实施方案中,碳水化合物抗原用于皮下免疫小鼠。可以给予或可以不给予一或多次加强(boosts)。可利用如ELISA(酶联免疫吸附测定)或流式细胞术监测血浆中抗体效价。以具有足够抗碳水化合物抗原抗体效价的小鼠进行融合。于处死及移除脾脏之前,小鼠可或可不以抗原加强3天。分离小鼠脾细胞,并用PEG与小鼠骨髓瘤细胞系融合。所得杂交瘤随即经筛选其抗原特异性抗体的产生。将细胞接种,之后于选择性培养基中培养。各孔之上清液随即以ELISA筛选人类抗碳水化合物抗原单克隆抗体。重复抗体分泌性杂交瘤、再次筛选,且若抗碳水化合物抗原抗体仍呈现阳性,可利用有限稀释亚克隆。
佐剂可用于增加碳水化合物抗原之一或多者的免疫原性。佐剂的非局限实例包括磷酸铝、氢氧化铝、MF59(4.3%w/v角鲨烯、0.5%w/v Polysorbate 80(Tween 80)、0.5%w/v三油酸山梨坦(Span 85))、含CpG的核酸、QS21(皂苷佐剂)、α-半乳糖基神经酰胺或其合成类似物(如C34,参见美国专利号8,268,969)、MPL(单磷酰基脂质A)、3DMPL(3-O-脱酰化MPL)、艾奎拉(Aquilla)萃取物、ISCOMS(参见,如Sjolander et al.(1998)J.LeukocyteBiol.64:713;WO90/03184;W096/11711;WO 00/48630;W098/36772;WO00/41720;WO06/134423;以及WO07/026190)、LT/CT突变体、聚(D,L-丙交酯-共-乙交酯)(PLG)微粒、Quil A、白介素、弗氏佐剂(Freund's)、N-乙酰基胞壁酰基-L-苏氨酰基-D-异谷氨酰胺(thr-MDP)、N-乙酰基去甲胞壁酰基-L-丙氨酰基-D-异谷氨酰胺(N-acetyl-nor-muramyl-L-alanyl-D-isoglutamine)(CGP 11637,称作nor-MDP)、N-乙酰基胞壁酰基-L-丙氨酰基-D-异谷氨酰胺酰基-L-丙氨酸-2-(-2'-二棕榈酰基-sn-甘油基-3-羟基磷酰氧基)-乙胺(CGP 19835A,称作MTP-PE)及RIBI,其含有萃取自细菌的三种成分,单磷酰基脂质A、海藻糖二霉菌酸酯(trehalose dimycolate)及细胞壁骨架(MPL+TDM+CWS),溶于2%角鲨烯/Tween 80乳剂。
可以通过从检查血清中所需抗体增加的经免疫的哺乳动物采集血液,以及通过以任何常规方法由血液中分离血清制备针对SSEA-4抗体的示例性多克隆抗体。多克隆抗体包括含多克隆抗体的血清,以及可分离自血清的含多克隆抗体的级份。
多克隆抗体一般而言于多次皮下(sc)或腹膜内(ip)注射相关抗原与佐剂的宿主动物(如兔、小鼠、马、或山羊)产生。以相关抗原缀合对要免疫的物种具免疫原性的蛋白质可能有用,该蛋白质如钥孔戚血蓝蛋白(keyhole limpet hemocyanin)、血清白蛋白、牛甲状腺球蛋白、或大豆胰蛋白酶抑制剂,其使用双功能或衍生剂,如马来酰亚氨基苯甲酰基磺基琥珀酰亚胺酯(经由半胱氨酸残基缀合)、N-羟基琥珀酰亚胺(经由赖氨酸残基)、戊二醛、琥珀酸酐、SOCl
任何哺乳动物可免疫接种抗原以产生所需抗体。一般而言,可使用啮齿目、兔类、或灵长类动物。啮齿目动物包括例如,小鼠、大鼠、及仓鼠。兔类动物包括例如兔。灵长类动物包括例如狭鼻类(Catarrhini)猴子(旧大陆猴),如食蟹猕猴(Macaca fascicularis)、恒河猴(rhesus monkey)、狒狒及黑猩猩。
以抗原免疫动物的方法是本领域中已知的。腹膜内注射或皮下注射抗原为哺乳动物免疫的标准方法。更特别地,抗原可稀释并悬浮于适量磷酸缓冲盐液(PBS)、生理食盐水等。视需求,抗原悬液可混合适量标准佐剂,如弗氏完全佐剂(Freund's completeadjuvant),制成乳剂,接着施用于哺乳动物。以抗原、免疫原性缀合物、或衍生物免疫动物,其藉由组合1mg或1μg肽或缀合物(分别针对兔或小鼠)与3个体积的弗氏不完全佐剂(Freund's incomplete adjuvant)。
动物可经加强直到效价高峰,其每隔4至21天施用数次抗原混合适量的弗氏不完全佐剂。动物皮下注射多处溶于弗氏完全佐剂的1/5至1/10原始量的肽或缀合物以进行加强。于7至14天后,将动物放血并分析血清的抗体效价。亦可使用适当载体进行免疫。于如上述的免疫后,以标准方法检查血清中所需抗体的增加量。优选地,动物以相同抗原的缀合物加强,但缀合至不同蛋白质和/或经由不同交联试剂。缀合物亦可于重组细胞培养基中制造,以蛋白质融合体进行。凝集剂,如明矾也适于增进免疫反应。
在过去二十至三十年中,开发出一些制备嵌合、人源化、或人类抗体的方法,其可用于人类体内治疗应用。最常使用且经证实的方法学为利用杂交瘤方法学制备小鼠mAb,之后将mAb的VH与VL区的框架区及恒定区转换成人类VH与VL区的最同源人类框架区及所需人类γ免疫球蛋白同种型和亚类的恒定区来使mAB人源化。许多临床上使用的mAbs,如喜瑞乐(Xolair)是人类γ1、κ同种型和亚类的人源化mAb,并利用此方法学制备。
在特定实施方案中,抗体可以常规杂交瘤技术制造。Kohler et al.,Nature,256:495(1975)。于杂交瘤方法中,小鼠或其他适当宿主动物,如仓鼠或兔,以上述方法进行免疫,以引发产生或能产生抗体的淋巴细胞,所述抗体将特异性结合至用于免疫作用的蛋白质。或者,淋巴细胞可体外进行免疫。
为了制备单克隆抗体,从用抗原免疫并如上述检查血清中所需抗体的增加水平的哺乳动物收集免疫细胞,且进行细胞融合。用于细胞融合的免疫细胞优选地取自脾脏。其他要与上述免疫细胞融合的优选亲代细胞包括例如,哺乳动物骨髓瘤细胞,更优先是具有可利用药物筛选出融合细胞的获得性质的骨髓瘤细胞。
优选骨髓瘤细胞是那些有效融合者、支持以筛选的抗体生产细胞稳定高水平生产抗体者、及对培养基如HAT培养基敏感者。这些中,优选的骨髓瘤细胞系为鼠科骨髓瘤系,如那些衍生自MOPC-21与MPC-11小鼠肿瘤者,购自Salk Institute Cell DistributionCenter,San Diego,Calif.USA,以及SP-2细胞,购自美国典型培养物保藏中心,Rockville,Md.USA。亦有提及人类骨髓瘤及小鼠-人类异源骨髓瘤细胞系用于产生人类单克隆抗体(Kozbor,J.Immunol.,133:3001(1984);Brodeur et al.,Monoclonal AntibodyProduction Techniques and Applications,pp.51-63(Marcel Dekker,Inc.,New York,1987))。
上述免疫细胞与骨髓瘤细胞可依据已知方法融合,例如,Milstein等人的方法(Galfre et al.,Methods Enzymol.73:3-46,1981)。以适当的融合剂,如聚乙二醇,融合淋巴细胞与骨髓瘤细胞,以形成杂交瘤细胞(Goding,Monoclonal Antibodies:Principlesand Practice,pp.59-103(Academic Press,1986))。所得的取自细胞融合的杂交瘤,可利用将其培养于标准选择培养基,如HAT培养基(含有次黄嘌呤、氨基蝶呤、及胸苷的培养基),以进行筛选。通常,细胞培养于HAT培养基中持续数天至数周,该时间足以容许除了所需的杂交瘤以外之所有其他细胞(非融合细胞)死亡。之后,进行标准有限稀释,以筛选及克隆可产生所需抗体的杂交瘤细胞。
将制备的杂交瘤细胞种植与生长于适用的培养基,该培养基优选地含有一或多个抑制未经融合的亲代骨髓瘤细胞的物质。举例而言,若亲代骨髓瘤细胞缺乏酶次黄嘌呤鸟嘌呤磷酸核糖转移酶(HGPRT或HPRT),杂交瘤使用的培养基通常将包括次黄嘌呤、氨基蝶呤、及胸苷(HAT培养基),该物质防止HGPRT缺陷细胞的生长。
以生长杂交瘤细胞的培养基试验针对抗原的单克隆抗体生产。优选地,利用免疫沉淀或利用体外结合试验测定杂交瘤细胞所产生单克隆抗体结合特异性。测定酶联免疫吸附试验(ELISA)、酶免疫试验(EIA)、放射免疫试验(RIA)、和/或免疫荧光的吸光度可用于测定本发明抗体的抗原结合活性。于ELISA中,本发明抗体固定于培养盘上,将本发明的蛋白施加于培养盘,之后施加含有所需的抗体的样本,如抗体生产细胞的培养基上清液或纯化的抗体。随后,施加二级抗体,其识别一级抗体,且用酶,如碱性磷酸酶标记,并温育该培养盘。接着,于清洗后,将酶底物,例如对硝苯基磷酸酯,加入培养盘,并测定吸光度以评估样本的抗原结合活性。本方法可使用蛋白质片段,如C端或N端片段。可使用BIAcore(Pharmacia),以评估本发明抗体的活性。可以Munson et al.,Anal.Biochem.,107:220(1980)提出的斯卡查德分析(Scatchard analysis)测定单克隆抗体的结合亲和力。
应用包括上述的那些常规方法之任一者,可鉴定出产生结合本文所述表位的抗体的杂交瘤细胞,并选取以进一步确认。
于杂交瘤细胞经鉴定产生所需特异性、亲和力、和/或活性的抗体后,克隆可藉由有限稀释程序及标准方法生长以成为亚克隆(Goding,Monoclonal Antibodies:Principles and Practice,pp.59-103(Academic Press,1986))。适用此目的的培养基包括例如,D-MEM或RPMI-1640培养基。利用常规免疫球蛋白纯化程序,如蛋白A琼脂糖、羟磷灰石层析、凝胶电泳、透析、或亲和力层析,将亚克隆分泌出的单克隆抗体适当地从培养基、腹水液、或血清中分离。
此外,杂交瘤细胞可于动物体内生长成腹水肿瘤。举例而言,所得的杂交瘤可随即移植至小鼠腹腔并收取腹水。
所得单克隆抗体可藉由例如硫酸铵沉淀、蛋白A或蛋白G管柱、DEAE离子交换层析、或可偶联本发明蛋白质的亲和力管柱来纯化。本发明的抗体不仅可用本发明蛋白质的纯化与检测,还可作为本发明蛋白质激动剂与拮抗剂的候选。此外,此抗体可应用于本发明蛋白质相关的疾病抗体治疗。
重组技术
所得单克隆抗体亦可使用遗传工程技术进行重组制备(参见,例如,BorrebaeckC.A.K.and Larrick J.W.Therapeutic Monoclonal Antibodies,published in theUnited Kingdom by MacMillan Publishers LTD,1990)。可从免疫细胞,如杂交瘤或生产抗体的免疫接种淋巴细胞克隆出编码抗体的DNA、插入适当载体中、及导入宿主细胞,以制备重组抗体。本发明亦提供如上述制备的重组抗体。
当所得抗体欲施用于人体时(抗体治疗),人类抗体或人源化抗体优选用于减少免疫原性。举例而言,具有人类抗体基因全集的转基因动物可以藉由选自于蛋白质、表达蛋白的细胞、或其溶解产物的抗原而免疫。随后,自动物收集抗体生产细胞并与骨髓瘤细胞融合,以取得杂交瘤,由其中制备针对蛋白的人类抗体。或者,生产抗体的免疫细胞,如免疫接种的淋巴细胞,可利用致癌基因进行永生且用于制备单克隆抗体。
使用常规流程,编码单克隆抗体的DNA可易于分离且测序(如凭借使用能特异性结合至编码有鼠科抗体重链与轻链的基因的寡核苷酸探针)。杂交瘤细胞可作为此类DNA的优选来源。一旦经分离,DNA可置入表达载体,其随后转染至不另外产生免疫球蛋白的宿主细胞,如大肠杆菌细胞、猴COS细胞、中国仓鼠卵巢(CHO)细胞、或骨髓瘤细胞,以得到重组宿主细胞中单克隆抗体的合成。细菌重组表达编码抗体的DNA的回顾文献包括Skerra et al.,Curr.Opinion in Immunol.,5:256-262(1993)及Pluckthun,Immunol.Rev.,130:151-188(1992)。
上述利用杂交瘤细胞生产编码抗体的DNA可经由常规技术进行遗传修饰,以产生遗传工程化抗体。遗传工程化抗体,如人源化抗体、嵌合抗体、单链抗体、及双特异性抗体例如可利用常规重组技术生产。随后可修饰DNA,例如,通过用人类重链与轻链恒定域的编码序列置换同源鼠科序列,Morrison et al.,(1984)Proc.Nat.Acad.Sci.81:6851,或以非免疫球蛋白多肽编码序列的全部或部分共价连接免疫球蛋白编码序列。以此方式,可制备具有靶标抗原结合特异性的遗传工程化抗体,如“嵌合”或“杂交”抗体。
经开发用于生产“嵌合抗体”的技术是本领域公知的。参见,如Morrison et al.(1984)Proc.Natl.Acad.Sci.USA 81,6851;Neuberger et al.(1984)Nature 312,604;以及Takeda et al.(1984)Nature 314:452。
通常,此免疫球蛋白多肽用于取代抗体恒定区,或其用于取代抗体的一个抗原结合位点的可变区,以创建嵌合二价抗体,其包含一个具有抗原特异性的抗原结合位点与另一个具有不同抗原特异性的抗原结合位点。
亦可使用公知的合成蛋白化学方法体外制备嵌合或杂交抗体,包括那些涉及交联剂者。举例而言,使用二硫化物交换反应或藉由形成硫醚键,可构建免疫毒素。此目的的适用试剂实例包括亚氨基硫醇酯及甲基-4-巯基丁酰亚胺酯(methyl-4-mercaptobutyrimidate)。
非人类抗体的人源化方法是本领域公知的。一般而言,人源化抗体具有由非人来源导入的一个或多个氨基酸残基。这些非人类氨基酸残基常称作“输入”残基,其通常取自“输入”可变区。人源化反应基本上可以下列Winter与其同事的方法进行(Jones et al.,Nature,321:522-525(1986);Riechmann et al.,Nature,332:323-327(1988);Verhoeyenet al.,Science,239:1534-1536(1988)),其以啮齿动物CDRs或CDR序列取代人类抗体之相应序列。据此,此类“人源化”抗体为嵌合抗体(美国专利号4,816,567),其中实质上小于完整人类可变区由非人类物种的相应序列取代。于执行上,人源化抗体通常为人类抗体,其中一些CDR残基与可能的一些FR残基由啮齿动物抗体的类似位置的残基取代。
用于制造人源化抗体以减少抗原性的轻链与重链人类可变区的选择都极其重要。依据所谓“最合适”方法,针对已知人类可变区序列的整个文库,筛选出啮齿动物的抗体可变区序列。最接近啮齿动物的人类序列随即入选作为人源化抗体的人类框架(FR)(Sims etal.,J.Immunol.,151:2296(1993);Chothia et al.,J.Mol.Biol.,196:901(1987))。另一方法使用衍生自特定亚群的轻链或重链的人类抗体共有序列的特定框架。相同框架可用于数种不同人源化抗体(Carter et al.,Proc.Natl.Acad Sci.USA,89:4285(1992);Prestaetal.,J.Immnol.,151:2623(1993))。
更重要的是,经人源化的抗体保留对抗原的高度亲和力及其他有利生物性质。欲达成此目的,依据优选的方法制备人源化抗体,其利用亲代与人源化序列三维模型的亲代序列与各概念性人源化产物的分析方法。三维免疫球蛋白模型常可取得,且为本领域技术人员熟悉。计算机程序是可得的,其描绘并且显示所选取的候选免疫球蛋白序列可能的三维构象结构。检查这些显示结果,使得能分析残基在候选免疫球蛋白序列功能上的可能角色,亦即分析影响候选免疫球蛋白结合其抗原的能力的残基。以此方式,可从受体与输出序列中筛选出FR残基并组合,因此达到所需的抗体特性,如对靶标抗原增加的亲和力。一般而言,CDR残基直接且最实质上涉及影响抗原结合。
或者,现有已可能生产转基因动物(如小鼠),其能在免疫作用时,于缺乏内源性免疫球蛋白生成之下,产生完整库的人类抗体。举例而言,已经描述,嵌合与种系突变体小鼠的抗体重链连接区(J
编码本文所述SSEA-4抗体核酸之任一者(包括重链、轻链、或两者)、载体,如包含核酸之一或多者的表达载体、及包含载体的一或多者的宿主细胞皆落入本发明的范畴。于一些实例中,载体包含核酸,其包含编码本文所述Globo H抗体的重链可变区或轻链可变区的核苷酸序列。于一些实例中,载体包含核酸,其包含编码本文所述SSEA-4抗体的重链可变区或轻链可变区的核苷酸序列。于其他实例中,载体包含编码重链可变区与轻链可变区的核苷酸序列,其表达可利用单一启动子或两个个别启动子控制。于此亦提供用于产生本文所述的Globo H抗体与SSEA-4抗体之任一者的方法,如经由本文所述的重组技术。
其他制备抗体的技术
在特定实施方案中,可利用商业购得的小鼠取得完整人类抗体,该小鼠经工程化以表达特定人免疫球蛋白。经设计以产生更理想(如完整人类抗体)或更健全免疫反应的转基因动物,亦可用于产生人源化或人类抗体。此技术的实例为Amgen,Inc.(Fremont,Calif.)的Xenomouse
可经由常规方法制备完整抗体(亦即,全长抗体)的抗原结合片段。举例而言,可利用抗体分子的胃蛋白酶消化产生F(ab')
或者,本文所述的Globo H抗体与SSEA-4抗体可分离自抗体噬菌体库(如单链抗体噬菌体库),其利用McCafferty et al.,Nature,348:552-554(1990);Clackson et al.,Nature,352:624-628(1991);以及Marks et al.,J.Mol Biol.,222:581-597(1991)所述的技术产生。后续出版品描述了利用链改组(chain shuffling)方式产生高亲和力(nM范围)人类抗体(Marks et al.,Bio/Technology,10:779-783(1992)),以及组合感染与体内重组作为策略以构建极大的噬菌体库(Waterhouse et al.,Nuc.Acids.Res.,21:2265-2266(1993))。因此,这些技术为用于分离单克隆抗体的传统单克隆抗体杂交瘤技术的可行替代方法。
本文所得的抗体可纯化至均质化。举例而言,可使用一般蛋白质的分离与纯化方法进行抗体的分离与纯化。举例而言,抗体的分离与纯化可利用适当选取与组合用途的管柱层析,如亲和力层析、过滤、超过滤、盐析、透析、SDS聚丙烯酰胺凝胶电泳、等电聚焦、及其他(Antibodies:A Laboratory Manual.Ed Harlow and David Lane,Cold Spring HarborLaboratory,1988),但不局限于此。上述所得抗体的浓度可利用吸光度测量、酶联免疫吸附试验(ELISA)等决定。除了亲和力层析之外,示例性层析包括例如,离子交换层析、疏水性层析、凝胶过滤、逆相层析、吸附层析等(Strategies for Protein Purification andCharacterization:A Laboratory Course Manual.Ed Daniel R.Marshak et al.,ColdSpring Harbor Laboratory Press,1996)。层析程的进行可利用液相层析,如HPLC或FPLC。
抗体的确认可利用本领域公知的方法。举例而言,一种方法为鉴定抗原结合的表位,或“表位定位(epitope mapping)”。有许多本领域公知方法用于定位及确认蛋白质上表位位置,包括描述于例如,Harlow and Lane,Using Antibodies,a Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,1999的第11章中的解析抗体-抗原复合体的晶体结构、竞争试验、基因片段表达试验、及合成肽为主的试验。此外,表位定位可用于决定抗体结合的序列。表位可为线性表位(如含于单独延伸的氨基酸中)或构象表位,其由氨基酸的三维相互作用形成,其不一定含于单独延伸之中(一级结构线性序列)。可分离或合成(如重组方式)不同长度的肽(如至少4至6个氨基酸的长度),且用于抗体结合试验。于另一实例中,可利用系统性筛选方式决定抗体结合表位,其利用衍生自靶标抗原序列的重叠肽,并以抗体确定结合作用。依据基因片段表达试验,编码靶标抗原的可读框经随机分段或利用特异性遗传构建分段,并测定抗原表达片段与欲测试抗体的反应性。举例而言,可利用PCR产生基因片段,之后于放射性氨基酸存在下,体外转录与翻译成蛋白质。随后,利用免疫沉淀与凝胶电泳测定抗体与放射性标记抗原片段的结合。亦可利用显示于噬菌体颗粒表面上的大型随机肽序列库(噬菌体库)鉴定特定表位。或者,可于简易结合试验中,测试经定义的重叠肽片段库与受测抗体的结合。
于额外的实例中,可进行抗原结合区的诱变、区交换实验、及丙氨酸扫描诱变,以鉴定表位结合所需、足够、和/或必需的残基。举例而言,可利用靶标抗原的突变体进行区交换实验,其中针对候选抗体的结合表位各残基经紧密相关但抗原独特的蛋白质(如神经滋养蛋白家族的另一成员)的序列替代(置换)。藉由评估抗体与突变体靶标蛋白的结合,可评估特定抗原片段对抗体结合的重要性。
或者,可利用其他已知的结合相同抗原的抗体进行竞争试验,以决定是否抗体如同其他抗体一般结合至相同表位(如本文所述的MC45抗体)。竞争试验亦为本领域技术人员已知。
示例性适用的一般抗体生产方法的其他方面
于动物中(如小鼠、兔、山羊、绵羊、或马)制造单克隆与多克隆抗体及其片段的方法是本领域公知的。参见,例如,Harlow and Lane,(1988)Antibodies:A LaboratoryManual,Cold Spring Harbor Laboratory,New York。“抗体”术语包括完整免疫球蛋白分子及其片段,如Fab、F(ab')
本文公开的组合物可包括于药物组合物且伴随额外的活性剂、载体、载剂、赋形剂、或辅助剂,本领域技术人员在阅读本公开内容时可易于辨别。
药物组合物优选包含至少一种医药上可接受载体。于此类药物组合物中,本文公开的组合物形成“活性化合物”,亦称作“活性剂”。本文中使用的术语“医药上可接受载体”包括溶剂、分散介质、涂层、抗细菌剂与抗真菌剂、等张与吸收延迟剂、及其类似物,其与医药施用相容。补充性活性化合物亦可并入组合物中。药物组合物配制成与其预期施用途径相容。施用途径的实例包括胃肠外,如静脉内、皮内、皮下、口服(如吸入)、经皮(如局部)、经粘膜、及直肠施用。用于胃肠外、皮内、或皮下应用的溶液或悬液可包括下列成分:无菌稀释剂如注射用水、盐液、固定油、聚乙二醇、甘油、丙二醇、或其他合成溶剂;抗细菌剂如苯甲醇或对羟苯甲酸甲酯;抗氧化剂如抗坏血酸或亚硫酸氢钠;螫合剂如乙二胺四乙酸;缓冲液如乙酸盐、柠檬酸盐、或磷酸盐以及张力调整剂的试剂如氯化钠或右旋糖。pH值可以是用酸或碱调整,如盐酸或氢氧化钠。胃肠外制备物可以封闭在安瓿、一次性注射器、或玻璃或塑料制的多剂型小瓶。
提供含有至少一种SSEA-4抗体或至少一种包含编码SSEA-4抗体的序列的多核苷酸的组合物。在特定实施方案中,组合物可为药物组合物。如本文所用的组合物包含结合一个或多个SSEA-4的一个或多个抗体和/或一或多个多核苷酸,其包含编码一个或多个结合一或多个SSEA-4的抗体的序列。这些组合物可进一步包含适用的载体,如医药上可接受赋形剂,包括缓冲液,其是本领域公知的。
在一个实施方案中,SSEA-4抗体为单克隆的。在另一个实施方案中,提供了SSEA-4抗体的片段(如Fab、Fab’-SH、及F(ab’)
各方法是本领域已知的,用于产生噬菌体展示库,自其可取得感兴趣的抗体。产生感兴趣抗体的一种方法为通过使用噬菌体抗体库,其描述于Lee et al.,J.Mol.Biol.(2004),340(5):1073-93。
本发明的SSEA-4抗体可利用组合库制造,以筛选具有所需活性的合成抗体克隆。原则上,合成抗体克隆利用筛选噬菌体库而选取,所述噬菌体库含有展现融合至噬菌体壳体蛋白的各抗体可变区(Fv)片段的噬菌体。此类噬菌体库利用针对所需抗原的亲和力层析进行淘选。将表达能结合所需抗原的Fv片段的克隆吸附至抗原,从而于库中分离出非结合克隆。结合克隆随后从抗原溶洗脱,且可进一步利用额外的抗原吸附/洗脱循环富集。本发明SSEA-4抗体之任一者可藉由设计适用的抗原筛选程序取得,以选取感兴趣的噬菌体克隆,接着构建全长SSEA-4抗体克隆,其利用感兴趣噬菌体克隆的Fv序列与适用的恒定区(Fc)序列,其描述于Kabat et al.,Sequences of Proteins of ImmunologicalInterest,Fifth Edition,NIH Publication 91-3242,Bethesda Md.(1991),第1-3卷。
抗体的抗原结合区从约110个氨基酸的两个可变(V)区形成,所述可变区各来自轻链(VL)和重链(VH),两者呈现三个高变环或互补决定区(CDR)。可变区可功能上显示于噬菌体上,其可为单链Fv(scFv)片段,其中VH与VL经由短型柔性肽共价连接,或可为Fab片段,其各融合至恒定区且非共价相互作用,其描述于Winter et al.,Ann.Rev.Immunol.,12:433-455(1994)。如本文所用的scFv编码噬菌体克隆并且Fab编码噬菌体克隆统称为“Fv噬菌体克隆”或“Fv克隆”。
VH和VL基因库可个别以聚合酶链反应(PCR)克隆,且随机重组于噬菌体库,其可随即用于寻找抗原结合克隆,如描述于Winter et al.,Ann.Rev.Immunol.,12:433-455(1994)。源自免疫源的库提供针对免疫原的高亲和力抗体而无需构建杂交瘤。或者,可克隆原始库,以提供单一来源的人类抗体以广泛范围的非自身及自身抗原而无任何免疫作用,如描述于Griffiths et al.,EMBO J,12:725-734(1993)。最后,原始库亦可以合成方式制造,其藉由自干细胞克隆未经重排的V基因片段,并使用含有随机序列的PCR引物,以编码高度可变的CDR3区且完成体外重排,如描述于Hoogenboom and Winter,J.Mol.Biol.,227:381-388(1992)。
丝状噬菌体用于显示抗体片段,藉由融合至次要壳体蛋白pIII。抗体片段可显示成单链Fv片段,其中VH与VL区藉由柔性多肽间隔子连接相同多肽链,如例如描述于Markset al.,J.Mol.Biol.,222:581-597(1991),或显示成Fab片段,其中一链融合至pIII且其他者分泌至细菌宿主细胞周质,在那里组装Fab壳体蛋白结构,其藉由置换一些野生型壳体蛋白而于噬菌体表面上显示,如例如描述于Hoogenboom et al.,Nucl.Acids Res.,19:4133-4137(1991)。
一般而言,核酸编码抗体基因片段取自人类或动物所收取的免疫细胞。若期望偏向有利于抗SSEA-4克隆的文库,则受试者以SSEA-4免疫,以产生抗体反应,并回收脾脏细胞和/或循环B细胞或其他外周血淋巴细胞(PBLs)以进行库构建。在一个实施方案中,取得偏向有利于抗人类SSEA-4克隆的人类抗体基因片段库,其藉由在携带功能性人免疫球蛋白基因阵列(且缺乏功能性内源性抗体生产系统)的转基因小鼠产生人类SSEA-4抗体反应,使得SSEA-4免疫作用引发B细胞产生针对SSEA-4的人类抗体。人类抗体产生型转基因小鼠的产生描述如下。
利用适当筛选程序分离表达SSEA-4特异性抗体DB细胞,如利用SSEA-4亲和力层析分离细胞或将细胞吸附于荧光染料标记的SSEA-4且随后利用流式活化细胞分选(flow-activated cell sorting;FACS),可取得额外的抗SSEA-4反应性细胞群富集。
或者,使用未经免疫的供体的脾脏细胞和/或B细胞或其他PBL提供可能的抗体库的较佳呈现,且亦容许利用任何动物(人类或非人类)物种构建抗体库,其中SSEA-4是非抗原性的。针对并入体外抗体基因构建的库,从受试者收取干细胞,以提供编码未重排抗体基因片段的核酸。感兴趣的免疫细胞可取自各种动物物种,如人类、小鼠、大鼠、兔形目(lagomorpha)、狼(luprine)、犬(canine)、猫(feline)、猪(porcine)、牛(bovine)、马(equine)、及禽(avian)物种等。
编码抗体可变基因片段(包括VH与VL片段)的核酸回收自感兴趣的细胞并扩增。于重组VH与VL基因库的情况中,所需DNA的取得可利用从淋巴细胞分离基因组DNA或mRNA,接着进行聚合酶链反应(PCR),其中引物符合5’端与3’端重组VH与VL基因,如描述于Orlandiet al.,Proc.Natl.Acad.Sci.(USA),86:3833-3837(1989),从而制造不同V基因库以进行表达。V基因可从cDNA与基因组DNA扩增,用编码成熟V区的外显子5′端的反向引物及基于J片段内的正向引物进行,如描述于Orlandi et al.(1989)与Ward et al.,Nature,341:544-546(1989)。然而,针对从cDNA扩增,反向引物亦可基于前导序列外显子,如描述于Jones et al.,Biotechnol.,9:88-89(1991),且正向引物位于恒定区,如描述于Sastry etal.,Proc.Natl.Acad.Sci.(USA),86:5728-5732(1989)。为了最大化互补性,简并性可掺入引物中,如描述于Orlandi et al.(1989)或Sastry et al.(1989)。在特定实施方案中,通过利用靶向各V基因家族的PCR引物将库多样性最大化,以扩增存在于免疫细胞核酸样本中的所有可得之VH与VL排列,例如,如描述于Marks et al.,J.Mol.Biol.,222:581-597(1991)的方法,或描述于Orum et al.,Nucleic Acids Res.,21:4491-4498(1993)的方法。为了将扩增的DNA克隆至表达载体,可将稀有限制位点导入PCR引物内以作为一端的标签,如描述于Orlandi et al.(1989),或进一步利用标记引物进行PCR扩增反应,如描述于Clackson et al.,Nature,352:624-628(1991)。
以合成方式重排的V基因库可从V基因片段体外衍生。多数人类VH基因片段经克隆与测序(报导于Tomlinson et al.,J.Mol.Biol.,227:776-798(1992)),且定位(报导于Matsuda et al.,Nature Genet.,3:88-94(1993);这些克隆片段(包括H1与H2环的所有主要构象)可用于产生不同VH基因库,其中PCR引物编码不同序列与长度的H3环,如描述于Hoogenboom and Winter,J.Mol.Biol.,227:381-388(1992)。VH库亦可以所有专注于单一长度长型H3环的序列多样性制造,如描述于Barbas et al.,Proc.Natl.Acad.Sci.USA,89:4457-4461(1992)。人类Vκ与Vλ片段经克隆与测序(报导于Williams and Winter,Eur.J.Immunol.,23:1456-1461(1993)),且可用于制造合成的轻链库。合成的V基因库,基于一定范围的VH与VL折叠,及L3与H3长度,将编码相当多的结构多样性的抗体。于扩增V基因编码DNA之后,可于体外重排种系V基因片段,其方法依据Hoogenboom and Winter,J.Mol.Biol.,227:381-388(1992)。
可藉由数个方法组合VH与VL基因库以构建抗体片段库。各库可以不同载体创建,且于体外重组载体,如例如描述于Hogrefe et al.,Gene,128:119-126(1993),或于体内组合感染,如loxP系统,描述于Waterhouse et al.,Nucl.Acids Res.,21:2265-2266(1993)。体内重组方法利用Fab片段的二链本质,以克服大肠杆菌转化效率造成的库大小限制。初级VH与VL库分开克隆,一者进入噬菌粒(phagemid)且其他者进入噬菌体载体。该二库随后藉由噬菌体感染含噬菌粒的细菌而组合,使得各细包含有不同组合,且该库大小仅受限于存在的细胞数目(约1012个克隆)。两个载体含有体内重组信号,使得VH与VL基因重组为单一复制子(replicon),且共同组装成噬菌体病毒体。这些巨型库提供大量良好亲和力的不同抗体。
或者,该库可依序克隆至相同载体,如描述于例如Barbas et al.,Proc.Natl.Acad.Sci.USA,88:7978-7982(1991),或利用PCR组装在一起然后克隆,如例如描述于Clackson et al.,Nature,352:624-628(1991)。PCR组装亦可用于连接VH和VL DNA与编码柔性肽间隔子的DNA,以形成单链Fv(scFv)库。于又另一技术,“以细胞PCR组装”用于在淋巴细胞内藉由PCR组合VH与VL基因,之后克隆连接的基因库,如描述于Embleton etal.,Nucl.Acids Res.,20:3831-3837(1992)。
该库的筛选可利用任何本领域公知技术完成。举例而言,SSEA-4靶标可用于涂布吸附盘的孔,于贴在吸附盘的宿主细胞上表达或用于细胞分选,或缀合至生物素以捕捉链霉亲合素涂布珠粒,或用于任何其他本领域已知方法以淘选噬菌体展示库。
在适合至少一部分噬菌体颗粒与吸附剂的结合的条件下将噬菌体库样本接触经固定的SSEA-4。正常而言,所选择的条件,包括pH、离子强度、温度、及其类似物模拟生理条件。结合于固相的噬菌体经清洗,且之后以酸洗脱,如例如描述于Barbas et al.,Proc.Natl.Acad.Sci.USA,88:7978-7982(1991),或以碱洗脱,如例如描述于Marks etal.,J.Mol.Biol.,222:581-597(1991),或利用SSEA-43/抗原竞争,例如在类似于Clacksonet al.,Nature,352:624-628(1991)的抗原竞争方法的程序中。噬菌体可于单一回合筛选中富集20-1,000倍。此外,富集的噬菌体可培养于细菌培养基,且进行进一步的筛选。
筛选效率取决于许多因素,包括清洗时的分离动力学,以及是否单一噬菌体上的多个抗体片段可同时与抗原接触。藉由使用短暂清洗、多价噬菌体展示、及固相中抗原高涂布密度,可保留具有快速分离动力学(与弱结合亲和力)的抗体。高密度不仅经由多价相互作用稳定噬菌体,还有利于已经解离的噬菌体的再结合。可以通过利用长时间清洗及单价噬菌体展示,如描述于Bass et al.,Proteins,8:309-314(1990)及WO 92/09690,以及低涂布密度的抗原,如描述于Marks et al.,Biotechnol.,10:779-783(1992)促进具有缓慢解离动力学(与良好结合亲和力)的抗体筛选。
针对SSEA-4,即使亲和力稍微不同,亦可能在不同亲和力噬菌体抗体之间筛选。然而,经筛选抗体的随机突变(如上述一些亲和力成熟技术所进行的实验)可产生许多突变体,多数结合于抗原,且少数具有更高的亲和力。藉由限制SSEA-4,可竞争出稀少的高亲和力噬菌体。为了保留所有较高亲和力突变体,噬菌体可温育于过量生物素化SSEA-4,但生物素化SSEA-4的摩尔浓度低于SSEA-4的靶标摩尔亲和力常数。随后可利用链霉亲合素涂布的顺磁性珠粒捕捉高亲和力结合噬菌体。此“平衡捕捉(equilibrium capture)”容许抗体依据其结合亲和力筛选,其敏感性使得能从大量过多较低亲和力的噬菌体中分离具最少二倍高亲和力的突变体克隆。用于清洗结合于固相的噬菌体的条件亦可基于解离动力学操作而辨别。
可筛选抗SSEA-4克隆。在一个实施方案中,本发明提供阻断SSEA-4配体与SSEA-4间结合,但其不阻断SSEA-4配体与第二蛋白间的结合的抗SSEA-4抗体。可筛选相应于此类抗SSEA-4抗体的Fv克隆,其利用:(1)从噬菌体库分离抗SSEA-4克隆,如描述于上述B(I)(2),且任意地扩增分离的噬菌体克隆群体,藉由在适当细菌宿主中生长该群体;(2)筛选SSEA-4和第二蛋白,针对该第二蛋白分别期望阻断与非阻断活性;(3)吸附抗SSEA-4噬菌体克隆以固定SSEA-4;(4)使用过量的第二蛋白以洗脱识别重叠或共享第二蛋白的结合决定区的SSEA-4结合决定区的任何非所需的克隆;以及(5)洗脱出在步骤(4)后仍吸附的克隆。可选择地,具有所需阻断/非阻断性质的克隆可进一步藉由重复本文所述筛选程序一或多次而富集。
编码本发明Fv克隆的DNA易于利用常规程序分离及测序(如使用寡核苷酸引物,其经设计以从杂交瘤或噬菌体DNA模板特异性扩增感兴趣的重链与轻链编码区)。一旦经分离,DNA可置入表达载体,其之后转染至不另外产生免疫球蛋白的宿主细胞,如大肠杆菌细胞、猴COS细胞、中国仓鼠卵巢(CHO)细胞、或骨髓瘤细胞,以于重组宿主细胞中合成所需的单克隆抗体。于细菌中重组表达抗体编码DNA的回顾文献包括Skerra et al.,Curr.Opinion in Immunol.,5:256(1993)及Pluckthun,Immunol.Revs,130:151(1992)。
编码本发明Fv克隆的DNA可结合已知的编码重链和/或轻链恒定区的DNA序列(如可自前述Kabat等人取得适当DNA序列),以形成编码全部或部分长度的重链和/或轻链的克隆。应理解到,就此目的可使用任何同种型的恒定区,包括IgG、IgM、IgA、IgD、及IgE恒定区,且此类恒定区可取自任一人类或动物物种。将源自一种动物(如人类)物种可变区DNA的Fv克隆融合至另一动物物种的恒定区DNA,以形成“杂交”用的编码序列,本文中使用的“嵌合”与“杂交”抗体等定义涵盖全长重链和/或轻链。在一个实施方案中,将衍生自人类可变DNA的Fv克隆融合至人类恒定区DNA,以形成所有人类全部或部分长度的重链和/或轻链的编码序列。
由初级库(天然或合成)产生的抗体可为中度亲和力,但亲和力成熟亦可体外模拟,其藉由描述于上述的Winter等人(1994)从第二库构建与再筛选。于一些方面,抗体可排除天然存在的抗体序列。于一些方面,突变可体外随机导入,其利用易错聚合酶(报导于Leung et al.,Technique,1:11-15(1989))在Hawkins et al.,J.Mol.Biol.,226:889-896(1992)的方法或Gram et al.,Proc.Natl.Acad.Sci.USA,89:3576-3580(1992)的方法中进行。此外,亲和力成熟可利用随机突变一或多个CDR进行,如使用携带跨越感兴趣CDR的随机序列的引物的PCR,于选取的个别Fv克隆中,并筛选更高亲和力的克隆。WO 9607754(公开于1996年3月14日)描述于免疫球蛋白轻链互补决定区诱导诱变的方法,以创建轻链基因库。另一有效方法为将VH或VL区重组,它们通过用取自未经免疫的供体的天然存在的V域变体库进行噬菌体展示,并以数轮的链再改组方式筛选更高的亲和力选择,如描述于Marks etal.,Biotechnol.,10:779-783(1992)。此技术能产生亲和力范围10
产生抗SSEA-4抗体
其他产生及评估抗体亲和力的方法为本领域公知,且描述于Kohler et al.,Nature 256:495(1975);美国专利号4,816,567;Goding,Monoclonal Antibodies:Principles and Practice,pp.59-103(Academic Press,1986;Kozbor,J.Immunol.,133:3001(1984);Brodeur et al.,Monoclonal Antibody Production Techniques andApplications,pp.51-63(Marcel Dekker,Inc.,New York,1987;Munson et al.,Anal.Biochem.,107:220(1980);Engels et al.,Agnew.Chem.Int.Ed.Engl.,28:716-734(1989);Abrahmsen et al.,EMBO J.,4:3901(1985);Methods in Enzymology,vol.44(1976);Morrison et al.,Proc.Natl.Acad.Sci.USA,81:6851-6855(1984)。
一般方法
一般而言,本发明提供亲和力成熟的SSEA-4抗体。这些抗体具有增加的SSEA-4亲和力和特异性。此亲和力与敏感性的增加使得本发明分子可用于若干应用与方法,其受益于(a)本发明分子敏感性增加,和/或(b)本发明分子紧密结合SSEA-4。
在一个实施方案中,SSEA-4抗体适用于治疗SSEA-4介导的病症,其中需要部分或全部阻断一或多个SSEA-4活性。在一个实施方案中,本发明抗SSEA-4抗体用于治疗癌症。
本发明抗SSEA-4抗体能敏感地与特异地直接检测表位,且用于常规生物分子试验,如免疫沉淀、ELISA、或免疫显微术,而无需质谱法或遗传操作。继而,这提供明显优势于观察与阐明这些途径的正常功能,及检测途径的功能失常。
本发明的SSEA-4抗体亦可用于确定疾病发展与发病机制的角色。举例而言,如上述,本发明的SSEA-4抗体可用于确定TACA在正常情况下是否暂时表达,其可与一或多个疾病状态相关。
本发明的SSEA-4抗体可进一步用于治疗疾病,其中一或多个SSEA-4s异常调节或功能异常,而不干扰SSEA-4s的正常活性,其中本发明抗SSEA-4抗体对其不具特异性。
于另一方面,本发明抗SSEA-4抗体可作为试剂,以检测各细胞类型与组织的癌症状态。
于又另一方面,本发明抗SSEA-4抗体适于发展为SSEA-4拮抗剂,其中阻断活性情况类似于本发明的主体抗体的那些。举例而言,本发明的抗SSEA-4抗体可用于测定并且鉴定其他具有相同SSEA-4结合特征和/或阻断SSEA-4途径的能力的抗体。
作为进一步实例,本发明抗SSEA-4抗体可用于鉴定其他抗SSEA-4抗体,其与本文示例性抗体实质上结合相同的SSEA-4抗原决定区,包括线性和构象性表位。
本发明的抗SSEA-4抗体可用于基于生理途径的试验,其中SSEA-4涉及筛选SSEA-4的小分子拮抗剂,其与抗体呈现相似的阻断一或多个结合配对体与SSEA-4结合的药理效用。
抗体的产生可使用本领域常规技术实现,包括那些本文所述者,如杂交瘤技术及筛选结合剂分子的噬菌体展示库。这些方法于本领域是完善建立的。
简言之,本发明抗SSEA-4抗体的制造可使用组合库,以筛选具有所需活性的合成抗体克隆。原则上,合成抗体克隆的选择藉由筛选含有噬菌体的噬菌体库,该噬菌体展示融合至噬菌体壳体蛋白的多个抗体可变区(Fv)片段。此类噬菌体库利用亲和力层析针对所需抗原进行淘选。将表达能结合至所需抗原的Fv片段的克隆吸附于抗原,因此于库中可自非结合克隆分开。随后自抗原洗脱出结合克隆,且可进一步利用额外的抗原吸附/洗脱循环富集。本发明抗SSEA-4抗体之任一者可如下取得:设计适用的抗原筛选程序以选择感兴趣的噬菌体克隆,接着利用感兴趣噬菌体克隆的Fv序列与描述于Kabat et al.,Sequences ofProteins of Immunological Interest,Fifth Edition,NIH Publication 91-3242,Bethesda Md.(1991),第1至3卷的适用的恒定区(Fc)序列构建全长抗SSEA-4抗体克隆。
在一个实施方案中,本发明的抗SSEA-4抗体为单克隆的。本发明的范畴亦涵盖本文所提供抗SSEA-4抗体的抗体片段,如Fab、Fab’、Fab’-SH、及F(ab’)
单克隆抗体可取自一群实质上均质化抗体,亦即,构成群体的个别抗体是一致的,除了可能的天然存在的突变以外,该突变可以小量存在。因此,修辞“单克隆”代表不是离散抗体混合物的抗体特征。
本发明的抗SSEA-4单克隆抗体可利用本领域的各已知方法制造,包括杂交瘤方法,其首先描述于Kohler et al.,Nature,256:495(1975),或者,其可利用重组DNA方法制造(如美国专利号4,816,567)。
载体、宿主细胞、及重组方法
针对重组产生本发明抗体,将其编码的核酸分离且插入可复制载体以进一步克隆(扩增DNA)或表达。编码抗体的DNA易于以常规程序分离且测序(如利用寡核苷酸探针,其能特异性结合至编码抗体重链和轻链的基因)。许多载体是可得的。载体的选择部分取决于欲使用的宿主细胞。宿主细胞包括但不局限于,原核或真核(一般为哺乳动物)源的细胞。应理解到,任何同种型的恒定区可用于此目的,包括IgG、IgM、IgA、IgD、及IgE恒定区,且此类恒定区可取自任何人类或动物物种。
利用原核宿主细胞产生抗体
载体构建
编码本发明抗体多肽组分的多核苷酸序列可利用标准重组技术取得。所需的多核苷酸序列可由抗体生产细胞如杂交瘤细胞分离并且测序。或者,多核苷酸可利用核苷酸合成仪或PCR技术合成。一旦取得后,将编码多肽的序列插入能于原核宿主中复制和表达异源性多核苷酸的重组载体。许多可得且本领域已知的载体可用于本发明之目的。适用载体的选择主要取决于欲插入载体的核酸大小,及欲以载体转化的特定宿主细胞。各载体含有多个成分,取决于其功能(异源性多核苷酸的扩增或表达,或两者)及与其所存在的特定宿主细胞的相容性。载体组分一般而言包括但不局限于:复制起点、筛选标记基因、启动子、核糖体结合位点(RBS)、信号序列、异源性核酸插入子、及转录终止序列。
一般而言,含有复制子和衍生自与宿主细胞相容的种类的控制序列的质粒载体与这些宿主结合使用。载体正常而言携带复制位点,以及标记序列,其能提供经转化细胞的表型筛选。举例而言,大肠杆菌通常以pBR322(衍生自大肠杆菌物种的质粒)转化。pBR322含有编码氨苄青霉素(Amp)和四环霉素(Tet)抗性的基因,因此提供简易判定经转化细胞的方法。pBR322、其衍生物、或其他微生物质粒或噬菌体亦可含有或经修饰而含有启动子,其可为微生物所用以表达内源性蛋白质。用于表达特定抗体的pBR322衍生物的实例详述于Carter等人的美国专利号5,648,237。
此外,含有复制子和与宿主微生物相容的控制序列的噬菌体载体可作为与这些宿主结合的转化载体。举例而言,噬菌体,如λGEM
本发明的表达载体可包含两个或更多个启动子-顺反子对,其编码多肽成分之每一者。启动子为位于调控其表达的顺反子上游(5’)的未翻译调节序列。原核启动子通常落入两类,诱导型和组成型。诱导型启动子为启动顺反子转录程度增加的启动子,于其控制下响应培养条件的改变,如存在或不存在营养物或温度改变。
可由各潜在宿主细胞识别的众多启动子是公知的。所选择的启动子可操作地连接至编码轻链或重链的顺反子DNA,其藉由从来源DNA经由限制酶消化以取出启动子,并将分离的启动子序列插入本发明的载体。原始启动子序列和许多异源性启动子两者可用于直接扩增和/或表达靶标基因。在特定实施方案中,使用异源性启动子,因其一般而言相较于原始靶标多肽启动子,容许更大的转录及更高产率的靶标基因表达。
适用于原核宿主的启动子包括PhoA启动子,相较于原始靶标多肽启动子,具有更高产率的靶标基因表达,藉由从来源DNA经由细菌中的限制酶消化以取出启动子(如其他抑制的细菌或噬菌体启动子)的方法亦适用。其核苷酸序列是已公开的,从而使得本领域技术人员可操作地连接其与编码靶标轻链与重链的顺反子(Siebenlist et al.(1980)Cell20:269),利用接头或衔接子以供应任何所需的限制位。
于本发明的一方面,重组载体内的各顺反子包含分泌型信号序列组分,其导引表达多肽转位通过细胞膜。一般而言,信号序列可为载体的组分,或其可为插入载体的靶标多肽DNA的部分。针对本发明目的所选择的信号序列应为宿主细胞能识别及加工者(亦即,由信号肽酶切割)。针对无法识别与加工对于异源性多肽天然的信号序列的原核宿主细胞,选择原核信号序列取代该信号序列,例如,选自由碱性磷酸酶、青霉素酶、Ipp、或热稳定肠毒素II(STII)前导序列、LamB、PhoE、PelB、OmpA、及MBP组成的组。于本发明的一个实施方案中,用于表达系统的两顺反子的信号序列为STII信号序列或其变体。
本发明免疫球蛋白的产生可发生于宿主细胞的细胞质,因此各顺反子内无需存在分泌型信号序列。于此方面,将免疫球蛋白轻链和重链表达、折叠、组装以于细胞质内形成功能性免疫球蛋白。特定宿主菌株(如大肠杆菌trxB
本发明的抗体亦可使用表达系统生产,其中可调控所表达的多肽组分的定量比,以最大化本发明所分泌与适当组装的抗体的产率。至少部分通过同时调控多肽组分翻译强度实现此类调节。
一种用于调控翻译强度的技术公开于Simmons等人的美国专利号5,840,523。其使用顺反子内的翻译起始区(TIR)变体。针对给定的TIR,可以用翻译强度范围创建一系列氨基酸或核酸序列变体,藉以提供便利方法,通过该方法以针对特定链的所需表达水平调整此因子。TIR变体可利用常规诱变技术产生,该技术造成密码子改变,其可改变氨基酸序列。在特定实施方案中,核苷酸序列的改变是沉默的。TIR的改变可包括例如,改变夏因-达尔加诺序列(Shine-Dalgarno sequences)的数目或间隔,伴随改变信号序列。产生突变体信号序列的一种方法为在编码序列开始时产生“密码子库”,所述编码序列不改变信号序列的氨基酸序列(亦即,该改变是沉默的)。这可藉由改变各密码子的第三个核苷酸位置而达成;此外,一些氨基酸,如亮氨酸、丝氨酸、及精氨酸,具有多个第一与第二位置,其可以增加制作该库的复杂度。此诱变方法详述于Yansura et al.(1992)METHODS:A Companion toMethods in Enzymol.4:151-158。
在一个实施方案中,制作一组载体,其中各顺反子内具有一定范围的TIR强度。此局限组提供各链表达水平的比较,以及于多个TIR强度组合下所需抗体产物的产率。TIR强度可利用量化报导基因的表达水平而确定,如详述于Simmons等人的美国专利号5,840,523。依据翻译的强度比较,选择所需个别TIR于本发明的表达载体构建体上组合。
适于表达本发明抗体的原核宿主细胞包括古生菌与真细菌,如革兰氏阴性或革兰氏阳性菌。适用的细菌实例包括大肠杆菌属(如大肠杆菌)、杆菌属(如枯草芽孢杆菌)、肠杆菌属、假单孢菌属物种(如铜绿假单胞菌)、鼠伤寒沙门氏菌、粘质沙雷氏菌、克雷白氏菌属、变形杆菌属、志贺氏菌属、根瘤菌属、透明颤菌属(Vitreoscilla)、或副球菌属(Paracoccus)。在一个实施方案中,使用革兰氏阴性细胞。在一个实施方案中,本发明以大肠杆菌细胞作为宿主。大肠杆菌菌株之实例包括菌株W3110(Bachmann,Cellular andMolecular Biology,vol.2(Washington,D.C.:American Society for Microbiology,1987),pp.1190-1219;ATCC保藏号27,325)及其衍生物,包括菌株33D3,其具基因型W3110hmann,Cellular and Molecular Biology,vol.2(Washington,D.C.:American Societyfor Microbiology,1987),pp.1190-1219;ATCC保藏N大肠杆菌294(ATCC 31,446)、大肠杆菌B、大肠杆菌(ATCC 31,446)、enod大肠杆菌RV308(ATCC 31,608)亦适用。这些实例用于阐明而非局限。用于构建上述具有经定义基因型的细菌之任一者的衍生物的方法是本领域已知的,并描述于例如Bass et al.,Proteins,8:309-314(1990)中。一般而言需要选择适当细菌,以考量细菌细胞的复制子的可复制性。举例而言,当以公知的质粒如pBR322、pBR325、pACYC177、或pKN410用于供应复制子时,大肠杆菌、粘质沙雷氏菌、或沙门氏菌属物种可适于作为宿主。通常而言宿主细胞应分泌最小量的蛋白水解酶,且期望可将额外的蛋白酶抑制剂掺入细胞培养基中。
抗体产生
宿主细胞以上述表达载体转化,并培养于常规营养培养基,其经适当改良,以诱导启动子、筛选转化体、或扩增编码所需序列的基因。
转化意指将DNA导入原核宿主,以便DNA可复制,不论是作为染色体外元件或以染色体整合体方式进行。取决于所用的宿主细胞,转化以适用于此类细胞的标准技术进行。一般而言,采用氯化钙的钙处理方式用于含有实质上细胞壁屏障的细菌细胞。另一转化方法采用聚乙二醇/DMSO。又另一使用的技术为电穿孔。
用于产生本发明多肽的原核细胞生长于本领域已知的培养基,其适于培养所选的宿主细胞。适用培养基的实例包括luria肉汤培养液(LB)加上必需营养补充物。在特定实施方案中,培养基亦含有筛选剂,其选用基于所构建的表达载体,以选择性容许含表达载体的原核细胞生长。举例而言,将氨苄青霉素加入培养基,用于生长表达氨苄青霉素抗药基因的细胞。
除了碳源、氮源、及无机磷酸盐源之外,亦可包括任何必需的补充剂,如复杂氮源,其以合适浓度单独导入或混合另一补充剂或培养基。可选地,培养基可含有一或多个还原剂,其选自由谷胱甘肽、半胱氨酸、胱胺、硫胶质(thioglycollate)、二硫丁四醇、及二硫苏糖醇组成的组。
原核宿主细胞培养于适当温度。例如,针对大肠杆菌的生长,生长发生在一定的温度范围,包括但不局限于,约20℃至约39℃、约25℃至约37℃、及约30℃。培养基的pH值可为约5至约9的任何pH值范围,主要取决于宿主生物体。针对大肠杆菌,pH值可为约6.8至约7.4,或约7.0。
若本发明的表达载体使用诱导性启动子,则在适于活化启动子的条件下,可诱导蛋白质表达。于本发明的一方面,使用PhoA启动子控制多肽转录。据此,将转化的宿主细胞培养于磷酸盐限制培养基以进行诱导。在一个实施方案中,磷酸盐限制培养基为C.R.A.P培养基(参见,如Simmons et al.,J.Immunol.Methods(2002),263:133-147)。依据所采用的载体构建体,可使用如本领域所已知的各种其他诱导剂。
在一个实施方案中,本发明所表达的多肽分泌至宿主细胞周质,且可自其中回收。蛋白质回收通常涉及破坏微生物,一般而言所使用的方式为渗透性休克、超声处理、或降解。一旦破坏细胞,可利用离心或过滤移除细胞碎片或整个细胞。可进一步纯化蛋白质,例如,利用亲和力树脂层析。或者,可将蛋白质输送至培养基,并自其中分离。可自培养基移除细胞,并过滤培养基上清液,且浓缩以进一步纯化。所表达的多肽可进一步分离,并以一般已知方法鉴定,如聚丙烯酰胺凝胶电泳(PAGE)及Western印迹试验。
于本发明的一方面,抗体产生以发酵过程大量进行。有多个大规模进料批次发酵程序可用,以产生重组蛋白质。大规模发酵具有至少1000升容量,如约1,000至100,000升容量。这些发酵罐以叶轮搅拌器分配氧气与营养物,尤其是葡萄糖(常见的碳源/能量来源)。小规模发酵一般而言指发酵罐的发酵反应不超过约100升体积容量,且范围可为约1升至约100升。
于发酵过程中,诱发蛋白质表达通常始于细胞在适当条件下生长至所需密度后,该阶段的细胞处于早期稳定期(如OD
为了改进本发明多肽的产率与产量,可改良各发酵条件。举例而言,为了改进分泌型抗体多肽的适当组装与折叠,可使用过表达伴侣蛋白,如Dsb蛋白(DsbA、DsbB、DsbC、DsbD、和/或DsbG)或FkpA(具有伴侣蛋白活性的肽基脯氨酰基顺,反-异构酶)的额外的载体共同转化宿主原核细胞。伴侣蛋白经证实可促进于细菌宿主细胞中生产的异源性蛋白的适当折叠及溶解性。Chen et al.(1999)J Bio Chem 274:19601-19605;Georgiou等人的美国专利号6,083,715;Georgiou等人的美国专利号6,027,888;Bothmann and Pluckthun(2000)J.Biol.Chem.275:17100-17105;Ramm and Pluckthun(2000)J.Biol.Chem.275:17106-17113;Arie et al.(2001)Mol.Microbiol.39:199-210。
为了最小化表达的异源性蛋白的蛋白质水解(尤其是那些蛋白质水解敏感型的),本发明可使用特定蛋白水解酶缺失型宿主菌株。举例而言,宿主细胞菌株可经改良,以影响编码已知细菌蛋白酶的基因的遗传突变,该蛋白酶如蛋白酶III、OmpT、DegP、Tsp、蛋白酶I、蛋白酶Mi、蛋白酶V、蛋白酶VI、及其缀合物。一些大肠杆菌蛋白酶缺失型菌株是可得的,且描述于例如Joly et al.(1998),上文;Georgiou等人的美国专利号5,264,365;Georgiou等人的美国专利号5,508,192;Hara et al.,Microbial Drug Resistance,2:63-72(1996)。
在一个实施方案中,本发明的表达系统使用蛋白水解酶缺失型及过表达一或多个伴侣蛋白的质粒转化的大肠杆菌菌株作为宿主细胞。
抗体纯化
在一个实施方案中,于此产生的抗体蛋白进行进一步纯化,以取得实质上同源性的制备物以进一步试验与使用。可采用本领域已知的标准蛋白质纯化方法。下列程序为适用的纯化程序示例:以免疫亲和力或离子交换管柱分级、乙醇沉淀、逆相HPLC、硅胶层析或阳离子交换树脂如DEAE、层析聚焦、SDS-PAGE、硫酸铵沉淀、及凝胶过滤,如使用SephadexG-75。
于一方面,以蛋白A固定于固相,用于本发明抗体产物的免疫亲和力纯化。蛋白A为41kD的金黄色葡萄球菌细胞壁蛋白,其与抗体Fc区的结合具有高亲和力。Lindmark et al(1983)J.Immunol.Meth.62:1-13。固定蛋白A的固相可为包含玻璃或二氧化硅表面的管柱,或孔隙可控的玻璃管柱或硅酸管柱。于一些应用中,管柱以试剂涂布,如甘油,以尽可能防止污染物的非特异性粘附。
作为纯化的第一步骤,源自上述细胞培养物的制备物可施加至固定蛋白A的固相,使得感兴趣的抗体特异性结合至蛋白A。随后清洗固相,以移除非特异性结合至固相的污染物。最终,藉由洗脱自固相回收感兴趣的抗体。
使用真核宿主细胞产生抗体
载体组分一般而言包括但不局限于,下列一或多者:信号序列、复制起点、一或多个标记基因、增强子元件、启动子及转录终止序列。
真核宿主细胞所使用的载体亦可含有信号序列或其他多肽,其在成熟蛋白或感兴趣多肽的N端具有特殊切割位点。所选的异源性信号序列一般而言可由宿主细胞识别及加工(亦即,利用信号肽酶切割)。于哺乳动物细胞表达中,可得到哺乳动物信号序列及病毒分泌型前导序列,例如,单纯疱疹gD信号。
此前驱区的DNA以符合读码框的方式连接至编码抗体的DNA。
一般而言,哺乳动物表达载体不需要复制起点组分。举例而言,通常仅可使用SV40起点,因为其含有早期启动子。
表达和克隆载体可含有筛选基因,其亦称作可筛选标记。通常,筛选基因所编码的蛋白质:(a)赋予抗生素或其他毒素抗性,如氨苄青霉素、新霉素、甲氨蝶呤、或四环霉素;(b)于相关情况下补充营养缺失;或者(c)供应复合培养基所没有的关键营养物。
筛选方案的一个实例利用药物阻止宿主细胞生长。那些成功地以异源性基因转化的细胞产生具抗药性的蛋白,因此能于筛选方案中存活。此优势筛选的实例使用药物如新霉素、霉酚酸、及潮霉素。
哺乳动物细胞的另一适用可筛选标记实例为那些能鉴定能摄入抗体核酸的细胞,如DHFR、胸苷激酶、金属硫蛋白I与II(如灵长类动物金属硫蛋白基因)、腺苷脱氨酶、鸟氨酸脱羧酶等。
举例而言,以DHFR筛选基因转化的细胞可首先将所有转化体培养于培养基的方式鉴定,该培养基含有甲氨蝶呤(Mtx),DHFR的竞争性拮抗剂。当采用野生型DHFR时,适用的宿主细胞包括例如,DHFR活性缺失的中国仓鼠卵巢(CHO)细胞系(如ATCC CRL-9096)。
或者,以编码抗体、野生型DHFR蛋白、及另一可筛选标记如氨基糖苷3′-磷酸转移酶(APH)的DNA序列转化或共转化的宿主细胞(特别是含有内源性DHFR的野生型宿主)筛选,可利用将细胞生长于含有针对可筛选标记的筛选剂的培养基进行,该筛选剂如氨基糖苷抗生素,如卡那霉素、新霉素、或G418。参见,美国专利号4,965,199。
表达和克隆载体通常含有启动子,其由宿主生物体识别且操作地连接至编码感兴趣多肽(如抗体)的核酸。真核生物的启动子序列是已知的。实质上所有真核基因具有富含AT的区,位于转录起始位点上游约25至30个碱基处。另一于许多基因的转录起始位点上游70至80个碱基处发现的序列为CNCAAT区,其中N可为任一核苷酸。多数真核基因的3’端处为AATAAA序列,其可为添加多聚A尾至编码序列3’端的信号。所有这些序列适当地插入真核表达载体。
载体于哺乳动物宿主细胞中的抗体多肽转录是可控的,例如,利用取自病毒基因组的启动子,该病毒如多瘤病毒、禽痘病毒、腺病毒(如腺病毒二型)、牛乳头瘤病毒、禽肉瘤病毒、巨细胞病毒、反转录病毒、B型肝炎病毒、及猴病毒40(SV40);利用异源性哺乳动物启动子,如肌动蛋白启动子或免疫球蛋白启动子;或者利用热休克启动子,条件是此类启动子相容于宿主细胞系统。
SV40病毒的早期和晚期启动子以SV40限制片段方便取得,所述SV40限制片段亦含有SV40病毒复制起点。人类巨细胞病毒的立即早期启动子以HindIII E限制片段方便取得。于哺乳动物宿主中以牛乳头瘤病毒作为载体的DNA表达系统公开于美国专利号4,419,446。此系统的改良描述于美国专利号4,601,978。亦参见Reyes et al.,Nature 297:598-601(1982),其于小鼠细胞中在单纯疱疹病毒胸苷激酶启动子控制下表达人类β干扰素cDNA。或者,可以劳斯肉瘤病毒长末端重复序列(long terminal repeat)作为启动子。
以高等真核生物转录编码本发明抗体多肽的DNA,常可藉由插入增强子序列至载体而增加效能。哺乳动物基因(球蛋白、弹性蛋白酶、白蛋白、甲胎蛋白、及胰岛素)的许多增强子序列现在是已知的。然而通常将使用真核细胞病毒的增强子。实例包括位于复制起点晚期侧的SV40增强子(bp100-270)、巨细胞病毒早期启动子增强子、位于复制起点晚期侧的多瘤增强子、及腺病毒增强子。亦参见Yaniv,Nature 297:17-18(1982),其关于用于活化真核启动子的增强元件。增强子可剪接至载体中,位于抗体多肽编码序列的5’或3’,但一般而言位于启动子5′位点。
真核宿主细胞所使用的表达载体通常亦含有终止转录与稳定mRNA所需的序列。此类序列通常可从真核或病毒DNA或cDNA的5’与偶尔3’未翻译区获得。这些区域含有核苷酸片段,其可在编码抗体的mRNA的未翻译部位转录成多聚腺苷酸化片段。适用的转录终止组分为牛生长激素多聚腺苷酸化区。参见WO94/11026,及其公开的表达载体。
用于本文载体中克隆或表达DNA的适用宿主细胞包括本文所述的高等真核细胞,包括脊椎动物宿主细胞。脊椎动物细胞于培养基(组织培养)的繁殖已经变为常规程序。适用的哺乳动物宿主细胞系的实例为:SV40转化的猴肾CV1细胞系(COS-7,ATCC CRL 1651);人类胚胎肾细胞系(293或293细胞,经亚克隆以生长于悬浮培养物,Graham et al.,J.GenVirol.36:59(1977));幼仓鼠肾细胞(BHK,ATCC CCL 10);中国仓鼠卵巢细胞/-DHFR(CHO,Urlaub et al.,Proc.Natl.Acad.Sci.USA 77:4216(1980));小鼠赛特利(sertoli)细胞(TM4,Mather,Biol.Reprod.23:243-251(1980));猴肾细胞(CV1,ATCC CCL70);非洲绿猴肾细胞(VERO-76,ATCC CRL-1587);人类子宫颈癌细胞(HELA,ATCC CCL 2);犬肾细胞(MDCK,ATCC CCL 34);水牛鼠肝细胞(BRL3A,ATCC CRL 1442);人类肺细胞(W138,ATCC CCL 75);人类肝细胞(Hep G2,HB 8065);小鼠乳腺肿瘤(MMT 060562,ATCC CCL51);TRI细胞(Matheret al.,Annals N.Y.Acad.Sci.383:44-68(1982));MRC 5细胞;FS4细胞;以及人类肝瘤细胞系(Hep G2)。
宿主细胞以上述的表达或克隆载体转化,以产生抗体,并培养于常规营养培养基,其适当改良以诱导启动子、筛选转化体、或扩增编码所需序列的基因。
用于产生本发明抗体的宿主细胞可培养于各种培养基。商业购得的培养基如汉氏F10(Sigma)、最小基础培养基(MEM)(Sigma)、RPMI-1640(Sigma)、及杜尔贝寇氏改良伊格尔氏培养基(Dulbecco's Modified Eagle's Medium,DMEM)(Sigma)适用于培养宿主细胞。此外,Ham et al.,Meth.Enz.58:44(1979)、Barnes et al.,Anal.Biochem.102:255(1980)、美国专利号4,767,704;4,657,866;4,927,762;4,560,655;或者5,122,469;WO 90/03430;WO 87/00195;或者美国专利回复号30,985所述培养基的任一者皆可用作宿主细胞的培养基。这些培养基的任一者可视需求补充激素和/或其他生长因子(如胰岛素、转铁蛋白、或表皮生长因子)、盐类(如氯化钠、钙、镁、及磷酸盐)、缓冲液(如HEPES)、核苷酸(如腺苷和胸苷)、抗生素(如GENTAMYCIN
当使用重组技术时,抗体可于细胞内产生,或直接分泌至培养基。若抗体于细胞内产生,作为第一步骤,一般而言移除颗粒型碎片(宿主细胞或裂解片段),例如利用离心或超过滤。当抗体分泌至培养基时,此类表达系统的上清液通常首先以商业购得的蛋白质浓缩过滤器浓缩,例如,Amicon或Millipore Pellicon超过滤单元。蛋白酶抑制剂如PMSF可包括于前述步骤之任一者,以抑制蛋白质水解,且可包括抗生素,以防止偶发污染物的生长。
由细胞制备的抗体组合物的纯化可利用例如羟磷灰石层析、凝胶电泳、透析、及亲和力层析,其中亲和力层析一般而言是可接受的纯化技术。以亲和力试剂如蛋白A作为亲和力配体的适用性取决于存在于抗体的任一免疫球蛋白Fc区的物种和同种型。蛋白A可用于纯化抗体,其基于人类γ1、γ2、或γ4重链(Lindmark et al.,J.Immunol.Meth.62:1-13(1983))。针对所有小鼠同种型及人类γ3,推荐使用蛋白G(Guss et al.,EMBO J.5:15671575(1986))。亲和力配体附接的基质最常为琼脂糖,但可使用其他基质。机械稳定性基质如可控孔隙玻璃或聚(苯乙烯二乙烯基)苯容许比使用琼脂糖达到更快流速及更短加工时间。当抗体包含CH3区时,Bakerbond ABX
在任何初步纯化步骤之后,含有感兴趣的抗体与污染物的混合物可进行进一步的纯化步骤,视需求而定,如利用低pH值疏水性相互作用层析,所使用的洗脱缓冲液pH值介于约2.5至4.5之间,一般而言于低盐浓度下进行(如约0至0.25M盐类)。
应注意到,一般而言制备用于研究、测试、及临床用途的抗体的技术及方法学是于本领域已发展成熟,针对感兴趣的特定抗体,其与前述一致和/或本领域技术人员确认合适的。
本发明的抗体可利用本领域已知的各种试验确认其物理/化学性质及生物功能。
本发明公开的抗体或抗原结合片段、变体、或其衍生物亦可于其与抗原的结合亲和力方面进行说明或指定。抗体与碳水化合物抗原的亲和力可使用任何适用方法以实验方式测定(参见,如Berzofsky et al,"Antibody-Antigen Interactions,"In FundamentalImmunology,Paul,W.E.,Ed.,Raven Press:New York,N.Y.(1984);Kuby,JanisImmunology,W.H.Freeman and Company:New York,N.Y.(1992);以及本文所述方法)。若于不同条件下测定(如盐类浓度、pH),则所测的特定抗体-碳水化合物抗原相互作用亲和力可变。因此,亲和力及其他抗原结合参数(如K
本发明的抗体或其抗原结合部分具有体外与体内治疗、预防、和/或诊断用途。举例而言,这些抗体可施用于培养的细胞,如体外或离体,或施用于受试者,如体内,以治疗、抑制癌症、预防复发、和/或诊断癌症。
纯化的抗体可进一步利用一系列的试验确认,其包括但不局限于,N端测序、氨基酸分析、非变性大小排阻高压液相层析(HPLC)、质谱法、离子交换层析、及木瓜蛋白酶消化。
视需求,分析抗体的生物活性。在特定实施方案中,测试本发明抗体的抗原结合活性。本发明可使用的抗原结合试验是本领域已知的,其包括但不局限于,任何直接或竞争结合试验,所使用的技术如Western印迹、放射免疫试验、ELISA(酶联免疫吸附分析法)、“夹层”免疫试验、免疫沉淀试验、荧光免疫试验、化学发光免疫试验、纳米颗粒免疫试验、适体免疫试验、及蛋白A免疫试验。
抗体片段
本发明涵盖抗体片段。于特定情况下,使用抗体片段,而非完整抗体具有优势。较小尺寸的片段容许快速清除,且可导致进入实体肿瘤的改善。
有多个技术经开发以生产抗体片段。传统上,这些片段是完整的抗体经由蛋白分解消化而衍生(参见,如Morimoto et al.,Journal of Biochemical and BiophysicalMethods 24:107-117(1992);以及Brennan et al.,Science,229:81(1985))。然而,这些片段目前可直接由重组宿主细胞产生。Fab、Fv、及ScFv抗体片段可全部于大肠杆菌中表达且自其分泌,因此容许产生大量的这些片段。抗体片段可从上述抗体噬菌体库中分离。或者,Fab’-SH片段可直接从大肠杆菌回收,且化学偶联以形成F(ab’)
人源化抗体
本发明涵盖人源化抗体。人源化非人类抗体的各方法是本领域已知的。举例而言,人源化抗体可具一或多个源自非人类源的氨基酸残基导入其中。这些非人类氨基酸残基常意指“输入”残基,其通常取自“输入”可变区。人源化基本上可依据Winter与其同事的方法进行(Jones et al.(1986)Nature 321:522-525;Riechmann et al.(1988)Nature 332:323-327;Verhoeyen et al.(1988)Science 239:1534-1536),其是利用高变区序列取代相应的人类抗体序列。据此,此类“人源化”抗体为嵌合抗体(美国专利号4,816,567),其中实质上小于完整的人类可变域经相应的非人类物种序列取代。于执行上,人源化抗体通常为人类抗体,其中一些高变区残基与可能地一些FR残基经啮齿动物抗体的类似位点残基取代。
用于制备人源化抗体的人类可变区(轻链与重链)的选择对于降低抗原性是重要的。依据所谓“最佳拟合”方法,针对已知的人类可变区序列的整个库,筛选啮齿动物抗体的可变区序列。最接近啮齿动物的人类序列随即认定为人源化抗体的人类框架(Sims et al.(1993)J.Immunol.151:2296;Chothia et al.(1987)J.Mol.Biol.196:901。另一方法使用衍生自特定亚群的轻链或重链的所有人类抗体共有序列的特定框架。相同框架可用于数个不同人源化抗体(Carter et al.(1992)Proc.Natl.Acad.Sci.USA,89:4285;Presta etal.(1993)J.Immunol.,151:2623)。
一般而言更需要抗体人源化,以保留对抗原的高亲和力和其他有利生物性质。为了达此目标,依据一个方法,利用亲代与人源化序列三维模型的亲代序列与各概念性人源化产物分析过程制备人源化抗体。三维免疫球蛋白模型通常可得,且为本领域技术人员熟悉。计算机程序可用于说明与显示所选的候选免疫球蛋白序列的可能的三维构形结构。检查这些显示可容许分析残基在候选免疫球蛋白序列功能上的可能角色,亦即,影响候选免疫球蛋白结合其抗原的能力的残基分析。以此方式,可从受体与输入序列选择与组合FR残基,以便达成所需的抗体特征,如增加对靶标抗原的亲和力。一般而言,高变区残基直接且最实质上涉及影响抗原结合。
本发明的人类抗SSEA-4抗体可藉由将选自人类衍生的噬菌体展示库的Fv克隆可变区序列与已知的人类恒定域序列(如上述)相结合而构建。或者,本发明的人类单克隆抗SSEA-4抗体可利用杂交瘤方法制造。用于生产人类单克隆抗体的人类骨髓瘤与小鼠-人类异源骨髓瘤细胞已有描述,例如,Kozbor J.Immunol.,133:3001(1984);Brodeur et al.,Monoclonal Antibody Production Techniques and Applications,pp.51-63(MarcelDekker,Inc.,New York,1987);以及Boerner et al.,J.Immunol.,147:86(1991)。
目前可生产能在免疫作用后,且不存在内源性免疫球蛋白的情况下,产生完整人类抗体库的转基因动物(如小鼠)。举例而言,已有提及,嵌合与种系突变体小鼠的抗体重链连接区(JH)基因的同源缺失将导致完全抑制内源性抗体产生。于此类种系突变小鼠中转移人类种系免疫球蛋白基因阵列,将导致抗原攻击后的人类抗体产生。参见,如Jakobovitset al.,Proc.Natl.Acad.Sci.USA,90:2551(1993);Jakobovits et al.,Nature,362:255(1993);Bruggermann et al.,Year in Immunol.,7:33(1993)。
基因改组亦可用于从非人类(如啮齿动物)抗体中衍生人类抗体,其中人类抗体对起始非人类抗体具有类似的亲和力与特异性。依据此方法,其亦称作“表位印记法”,取自上述噬菌体展示技术的非人类抗体片段重链或轻链可变区以人类V域基因库替代,产生非人类链/人类链scFv或Fab嵌合体的群体。以抗原筛选导致非人类链/人类链嵌合体scFv或Fab的分离,其中人类链可使抗原结合位点恢复,所述抗原结合位点于移除主噬菌体展示克隆中的相应非人类链时经破坏,即表位控制(印记)人类链配对的选择。当重复该方法以替代剩余的非人类链时,可获得人类抗体(参见PCT WO 93/06213,于1993年4月1日公开)。不同于传统非人类抗体藉由CDR移植人源化,此技术完全提供完全人类抗体,其不具有非人类源的FR或CDR残基。
双特异性抗体
双特异性抗体为对至少两种不同抗原具有结合特异性的单克隆抗体。在特定实施方案中,双特异性抗体为人类或人源化抗体。在特定实施方案中,结合特异性之一者为针对SSEA-4,其包括特异性赖氨酸键结,另一者为针对任何其他抗原。在特定实施方案中,双特异性抗体可结合至具两种不同赖氨酸键结的两种不同SSEA-4。双特异性抗体可制成全长抗体或抗体片段(如F(ab’)
制造双特异性抗体的方法是本领域已知的。传统上,双特异性抗体的重组生产基于两个免疫球蛋白重链-轻链对的共表达,其中两个重链具有不同特异性(Milstein andCuello,Nature,305:537(1983))。由于免疫球蛋白重链与轻链的随机分类,这些杂交瘤(四源杂交瘤(quadromas))产生10个不同抗体分子的潜在混合物,其中仅一者具有正确双特异性结构。通常,以亲和力层析步骤进行正确分子的纯化相当麻烦,且产物产率低。类似的程序公开于WO 93/08829,于1993年5月13日公开,以及Traunecker et al.,EMBO J.,10:3655(1991)。
依据不同实施方案,具有所需结合特异性的抗体可变区(抗体-抗原结合位点)融合于免疫球蛋白恒定区序列。例如,该融合体具有免疫球蛋白重链恒定区,其含有至少一部分铰链区、CH2区、及CH3区。在特定实施方案中,含有轻链结合所需位点的第一重链恒定区(CH1)存在于至少一个融合体中。视需求,将编码免疫球蛋白重链融合体的DNA与免疫球蛋白轻链插入个别的表达载体中,且共转染至适用的宿主生物体。在构建中所使用三个多肽链的不等比率提供最佳产率的实施方案中,这提供了调整三个多肽片段相互比例的极大灵活性。然而,在相等比例的至少二多肽链的表达导致高产率或比率无显著性时,可将两个或所有三个多肽链的编码序列插入一个表达载体中。
在一个实施方案中,双特异性抗体的组成为一个臂中具有第一结合特异性的杂交免疫球蛋白重链与另一臂中的杂交免疫球蛋白重链-轻链对(提供第二结合特异性)。发现到,此不对称结构有助于所需的双特异性化合物与不需要的免疫球蛋白链组合分离,因为仅一半的双特异性分子存在免疫球蛋白轻链提供容易的分离方式。此方法公开于WO 94/04690。针对产生双特异性抗体的进一步详述,参见如Suresh et al.,Methods inEnzymology,121:210(1986)。
依据另一方法,可改造一对抗体分子间的界面,以最大化从重组细胞培养物中回收的异二聚体百分比。该界面包含抗体恒定区中至少一部分的CH3区。在此方法中,源自第一抗体分子界面的一或多个小型氨基酸侧链以大型侧链(如酪氨酸或色氨酸)替代。藉由以小型氨基酸(如丙氨酸或苏氨酸)替代大型氨基酸侧链,于第二抗体分子的界面产生与大型侧链相同或相似尺寸的补偿性“空腔”。相对于其他不需要的最终产物如同二聚体,这提供用于增加异二聚体产率的机制。
双特异性抗体包括交联或“异缀合物”抗体。举例而言,异缀合物中的一个抗体可偶联抗生物素蛋白,另一者偶联生物素。举例而言,经提出,此类抗体将免疫系统细胞靶向到不需要的细胞(美国专利号4,676,980),及用于治疗HIV感染(WO 91/00360、WO 92/00373、及EP 03089)。可使用任何便利的交联方法制造异缀合物抗体。适用的交联剂是本领域公知的,且公开于美国专利号4,676,980,并伴随一些交联技术。
用于从抗体片段产生双特异性抗体的技术亦于文献中描述。举例而言,可使用化学键结制备双特异性抗体。Brennan et al.,Science,229:81(1985)描述完整抗体经蛋白分解切割以产生F(ab’)
最近的进展有助于从大肠杆菌中直接回收Fab’-SH片段,其可以化学偶联形成双特异性抗体。Shalaby et al.,J.Exp.Med.,175:217-225(1992)描述完整人源化双特异性抗体F(ab’)
亦有描述直接从重组细胞培养物中制造与分离双特异性抗体片段的各种技术。举例而言,以亮氨酸拉链产生双特异性抗体。Kostelny et al.,J.Immunol.,148(5):1547-1553(1992)。Fos与Jun蛋白的亮氨酸拉链肽藉由基因融合连接至二不同抗体的Fab’部位。抗体同二聚体的铰链区经还原以形成单体,之后再氧化以形成抗体异二聚体。此方法亦可用于产生抗体同二聚体。“双抗体(diabody)”技术描述于Hollinger et al.,Proc.Natl.Acad.Sci.USA,90:6444-6448(1993),其提供另一用于制造双特异性抗体片段的机制。该片段包含藉由接头将重链可变区(VH)连接至轻链可变区(VL),该接头太短而无法于同一链的两个区间配对。据此,迫使一个片段的VH和VL区与另一片段的互补型VL与VH区配对,藉以形成两个抗原结合位点。亦报告另一利用单链Fv(sFv)二聚体制造双特异性抗体片段的策略。参见Gruber et al.,J.Immunol.,152:5368(1994)。
考量到具有二价以上的抗体。举例而言,可制备三特异性抗体。Tutt etal.J.Immunol.147:60(1991)。
多价抗体
藉由表达抗体可结合的抗原的细胞,多价抗体的内化(和/或分解代谢)比二价抗体的更快。本发明的抗体可为具有三或多个抗原结合位点(如四价抗体)的多价抗体(其不同于IgM类别),其易于藉由重组表达编码抗体多肽链的核酸而产生。多价抗体可包含二聚化区与三或多个抗原结合位点。二聚化区包含(或组成为)如Fc区或铰链区。在此情况下,抗体将包含Fc区和Fc区氨基端的三或多个抗原结合位点。在一个实施方案中,多价抗体包含(或组成为),如三至约八个,或四个抗原结合位点。多价抗体包含至少一个多肽链(如两个多肽链),其中多肽链包含两个或更多个可变区。举例而言,多肽链可包含VD1-(X1)n-VD2-(X2)n-Fc,其中VD1为第一可变区、VD2为第二可变区、Fc为Fc区的多肽链、X1与X2代表氨基酸或多肽、及n为0或1。举例而言,多肽链可包含:VH-CH1-柔性接头-VH-CH1-Fc区链;或者VH-CH1-VH-CH1-Fc区链。本文的多价抗体可进一步包含至少两个(如四个)轻链可变区多肽。举例而言,本文的多价抗体可包含约两个至约八个轻链可变区多肽。本文考量的轻链可变区多肽包含轻链可变区,且任意地更包含CL区。
抗体变体
在特定实施方案中,考量本文所述抗体的氨基酸序列改良。举例而言,需要改进抗体的结合亲和力和/或其他生物性质。藉由导入适当核苷酸变化至抗体核酸,或藉由肽合成,制备抗体的氨基酸序列变体。此类改良包括例如,抗体氨基酸序列残基的删除和/或插入和/或取代。可进行删除、插入、及取代之任一组合,达成最终构建体,只要最终构建体具有所需特征即可。氨基酸的改变可在制备序列时导入主体抗体氨基酸序列。
用于鉴定抗体的特定残基或区域为优选诱变位置的适用方法称为“丙氨酸扫描突变”,其描述于Cunningham and Wells(1989)Science,244:1081-1085。于此,鉴定残基或一组靶标残基(如带电残基,如arg、asp、his、lys、及glu),并以中性或带负电氨基酸(如丙氨酸或聚丙氨酸)取代,以影响氨基酸与抗原的相互作用。然后,证实对取代的功能敏感性的那些氨基酸位置藉由在取代位点导入进一步或其他变体而进行精化。因此,虽然导入氨基酸序列变异的位点是预先确定的,但突变本身的性质不需要预先确定。举例而言,为了分析给定位点的突变表现,于靶标密码子或区域进行ala扫描或随机突变,并筛选所表达的免疫球蛋白,以获得所需活性。
氨基酸序列插入包括氨基端和/或羧基端融合,其长度范围为一个残基至含有一百或以上个残基的多肽,以及单一或多个氨基酸残基的序列内插入。末端插入的实例包括具有N端甲硫氨酰基残基的抗体或融合至细胞毒性多肽的抗体。抗体分子的其他插入型变体包括抗体N端或C端与酶(如针对ADEPT)或增加抗体的血清半衰期的多肽的融合物。
另一变体类型为氨基酸取代变体。这些变体的抗体分子中具有至少一氨基酸残基由不同残基替代。针对取代型诱变,最感兴趣的位点包括高变区,但亦可考量框架改变。
抗体生物性质的实质改良藉由选择取代而进行,该取代在其对维持下述的影响明显不同:(a)取代区域的多肽框架结构,例如,片层或螺旋构象;(b)靶标位点处分子的电荷或疏水性;或者(c)侧链主体。氨基酸可依据其侧链性质的相似性分组(描述于A.L.Lehninger,in Biochemistry,second ed.,pp.73-75,Worth Publishers,New York(1975)):
(1)非极性:Ala(A)、Val(V)、Leu(L)、Ile(I)、Pro(P)、Phe(F)、Trp(W)、Met(M);
(2)不带电极性:Gly(G)、Ser(S)、Thr(T)、Cys(C)、Tyr(Y)、Asn(N)、Gln(O);
(3)酸性:Asp(D)、Glu(E);
(4)碱性:Lys(K)、Arg(R)、His(H)。
或者,天然存在的残基可依据常见侧链性质分组:
(1)疏水性:正亮氨酸、Met、Ala、Val、Leu、Ile;
(2)中性亲水性:Cys、Ser、Thr、Asn、Gln;
(3)酸性:Asp、Glu;
(4)碱性:His、Lys、Arg;
(5)影响侧链方向的残基:Gly、Pro;
(6)芳族:Trp、Tyr、Phe。
非保守取代意味着需要以这些类别之一者的成员交换另一类别。此类经取代的残基亦可导入保守性取代位点,或导入剩余的(非保守性)位点中。
一类取代变体涉及取代亲源抗体(如人源化或人类抗体)的一或多个高变区残基。一般而言,选择用于进一步开发的所得变体,相对于其产生的亲源抗体,将具有改良的(如改进的)生物性质。产生此类取代变体的便利方法涉及亲和力成熟,其使用噬菌体展示。简言之,数个高变区位点(如6至7个位点)经突变以在各位点产生所有可能的氨基酸取代。从其产生的抗体由丝状噬菌体颗粒显示,其中各颗粒内包装至少部分噬菌体壳体蛋白(如M13的基因III产物)的融合物。随后,如本文所公开的,筛选噬菌体展示变体的生物活性(如结合亲和力)。为了鉴定用于改良的候选高变区位点,可进行扫描诱变(如丙氨酸扫描),以鉴定对抗原结合有显著贡献的高变区残基。或者,或此外,有利的是,分析抗原-抗体复合物晶体结构,以鉴定抗体与抗原间的接触点。此类接触残基与相邻的残基是本领域已知技术中(包括本文所述技术),用于取代的候选。一旦产生此类变体,则使用本领域已知技术(包括本文所述技术)对变体组进行筛选,且可选择在一或多个相关试验中具有优异性质的抗体进行进一步开发。
编码抗体氨基酸序列变体的核酸分子以本领域已知的多种方法制备。这些方法包括但不局限于,从天然来源分离(于天然存在氨基酸序列变体的情况),或利用寡核苷酸介导的(或定点)诱变、PCR诱变、及早期制备的变体或非变体形式的抗体的盒诱变等方式制备。于一些方面,核酸分子将排除天然存在的序列。
可能需要的是,于本发明抗体Fc区导入一或多个氨基酸改良体,藉以产生Fc区变体。Fc区变体可包含人类Fc区序列(如人类IgG
免疫缀合物
于另一方面,本发明提供免疫缀合物或抗体-药物缀合物(ADC),其包含将抗体缀合至细胞毒剂,如化学治疗剂、药物、生长抑制剂、毒素(如细菌、真菌、植物、或动物源的酶学上活性毒素,或其片段)、或放射性同位素(亦即,放射性缀合物)。
以抗体-药物缀合物进行细胞毒剂或细胞增殖抑制剂(即药物)的局部输送,以杀死或抑制肿瘤细胞,并治疗癌症(Syrigos and Epenetos(1999)Anticancer Research 19:605-614;Niculescu-Duvaz and Springer(1997)Adv.Drg Del.Rev.26:151-172;美国专利号4,975,278),使得能靶标输送药物部分至肿瘤,并于细胞内累积,其中全身性施用这些非缀合药物试剂可导致正常细胞及应可消除的肿瘤细胞无法接受的毒性程度(Baldwin etal.,(1986)Lancet pp.(Mar.15,1986):603-05;Thorpe,(1985)“Antibody Carriers OfCytotoxic Agents In Cancer Therapy:A Review,”in Monoclonal Antibodies'84:Biological And Clinical Applications,A.Pinchera et al.(ed.s),pp.475-506)。因此,寻求具有最小毒性的最大功效。多克隆抗体与单克隆抗体两者经报告适用于这些策略(Rowland et al.,(1986)Cancer Immunol.Immunother.,21:183-87)。这些方法使用的药物包括道诺霉素、多柔比星、甲氨蝶呤、及长春地辛(Rowland et al.,(1986),如上述)。用于抗体-毒素缀合物的毒素包括细菌毒素如白喉毒素、植物毒素如蓖麻毒蛋白、小分子毒素如格尔德霉素(geldanamycin)(Mandler et al(2000)Jour.of the Nat.Cancer Inst.92(19):1573-1581;Mandler et al(2000)Bioorganic&Med.Chem.Letters 10:1025-1028;Mandler et al(2002)Bioconjugate Chem.13:786-791)、美登木素(maytansinoids)(EP1391213;Liu et al.,(1996)Proc.Natl.Acad.Sci.USA 93:8618-8623)、及卡奇霉素(calicheamicin)(Lode et al(1998)Cancer Res.58:2928;Hinman et al(1993)CancerRes.53:3336-3342)。毒素可影响其细胞毒性与细胞增殖性效应,其机制包括微管蛋白结合、DNA结合、或拓扑异构酶抑制。当结合至大型抗体或蛋白质受体配体时,一些细胞毒性药物倾向无活性的或低活性。
抗体衍生物
本发明抗体可进一步改良以含有额外的本领域已知且可得的其他非蛋白质部分。在一个实施方案中,适于抗体衍生化的部分为水溶性聚合物。水溶性聚合物的非局限实例包括但不局限于,聚乙二醇(PEG)、乙二醇/丙二醇的共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二草酸酯、聚-1,3,6-三氧环己烷、乙烯/马来酸酐共聚物、聚氨基酸(共聚物或随机共聚物)、及葡聚糖或聚(正乙烯基吡咯烷酮)聚乙二醇、聚丙二醇共聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙烯化多元醇(如甘油)、聚乙烯醇、及其混合物。聚乙二醇丙醛于制造时由于其水中稳定性而具有优势。聚合物可为任何分子量,且可为支链或非支链。连接抗体的聚合物数量是可变,且若大于一个聚合物经连接,则聚合物可为相同或不同分子。一般而言,用于衍生化的聚合物数量和/或类型可基于若干考量而决定,包括但不限于,欲改进的抗体的特定性质或功能、抗体衍生物是否将用于定义的条件下的治疗等。
在另一个实施方案中,提供可利用暴露于辐射而选择性加热的抗体及非蛋白质部分的缀合物。在一个实施方案中,非蛋白质部分为纳米管(Kam et al.,Proc.Natl.Acad.Sci.102:11600-11605(2005))。辐射可为任何波长,且包括但不局限于,不伤害普通细胞的波长,但其将非蛋白质部分加热至抗体-非蛋白质部分附近的细胞被杀死的温度。
医药配制剂
在一个实施方案中,本发明提供包含本文所述的抗体或其抗原结合部分,及医药上可接受载体的药物组合物。在另一个实施方案中,药物组合物包含编码本发明抗体或其抗原结合部分的核酸,及医药上可接受载体。医药上可接受载体包括生理上相容的任何及所有溶剂、分散介质、等张与吸收延迟剂、及其类似物。在一个实施方案中,组合物有效抑制受试者的癌细胞。
本发明药物组合物的给药途径包括但不局限于,静脉内、肌内内、鼻内、皮下、口服、局部、皮下、皮内、经皮、表皮下、胃肠外、直肠、脊髓、或表皮施用。
本发明的药物组合物可制成注射剂,不论液体溶液或悬液,或制成固体形式,其于注射前适用于液体载体中的溶液或悬液。药物组合物亦可制成固体形式、乳化、或将活性成分包入微脂体载剂或其他颗粒载体中,以用于持续输送。举例而言,药物组合物可为油乳剂、油包水乳剂、水包油包水乳剂、特定位点乳剂、长驻留乳剂、粘性乳剂、微乳剂、纳米乳剂、微脂体、微粒、微球、纳米球、纳米颗粒、及各种天然或合成聚合物,如不可再吸收性不可渗透聚合物,如乙烯乙酸乙烯酯共聚物与
本发明的抗体或其抗原结合部分配制成药物组合物,用以输送至哺乳动物受试者。药物组合物单独施用,和/或与医药上可接受载剂、赋形剂、或载体混合。例如,适用的载剂为水、盐液、葡萄糖、甘油、乙醇、或其类似物,及其缀合物。此外,载剂可含有少量辅助物质,如润湿剂或乳化剂、pH值缓冲剂、或佐剂。医药上可接受载体可包含生理上可接受化合物,其作为如稳定、或增加或减少本发明药物组合物的吸收率或清除率。生理上可接受化合物可包括如碳水化合物,如葡萄糖、蔗糖、或葡聚糖、抗氧化剂,如抗坏血酸或谷胱甘肽、螯合剂、低分子量蛋白、清洁剂、微脂体载体、或赋形剂或其他稳定剂、和/或缓冲液。其他生理上可接受化合物包括润湿剂、乳化剂、分散剂、或防腐剂。参见,例如,21
此外,药物组合物可配制成中性或盐类形式的药物组合物。医药上可接受盐类包括酸加成盐(用活性多肽的游离氨基形成),且用无机酸,如盐酸或磷酸,或有机酸如乙酸、草酸、酒石酸、杏仁酸、及其类似物形成。由游离羧基形成的盐类亦可衍生自无机碱,如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙、或氢氧化铁,以及有机碱诸如异丙基胺、三甲基胺、2-乙基氨基乙醇、组氨酸、普鲁卡因、及其类似物。
制备此类剂型的实际方法是已知的,或对本领域技术人员而言将是显而易见。参见,例如,Remington's Pharmaceutical Sciences,Mack Publishing Company,Easton,Pennsylvania,21
药物组合物可于单一剂量治疗或多剂量治疗中按照时间表及适合于受试者年龄、体重及病况、使用的特定组合物、及施用途径、药物组合物是否用于预防或治疗目的等条件下施用一段时间。举例而言,在一个实施方案中,本发明的药物组合物的施用每月一次、每月两次、每月三次、每隔一周(qow)、每周一次(qw)、每周两次(biw)、每周三次(tiw)、每周四次、每周五次、每周六次,每隔一天(qod)、每天(qd)、每天两次(qid)、或每天三次(tid)。
本发明抗体的施用时间,亦即,施用药物组合物的时间段可变,取决于多种因素之一者,如受试者反应等。举例而言,药物组合物可施用的时间范围为约一或多秒至一或多个小时、一天至约一周、约两周至约四周、约一个月至约两个月、约两个月至约四个月、约四个月至约六个月、约六个月至约八个月、约八个月至约一年、约一年至约二年、或约二年至约四年、或以上。
为便于施用及剂量均匀性,可使用剂量单位形式的口服或胃肠外药物组合物。本文中使用的剂量单位形式意指适于作为欲治疗对象的单位剂量的物理离散单位;各单位含有预定量的活性化合物,其经计算以产生所需治疗效果,其与所需的医药载体相关联。
细胞培养试验与动物研究取得的数据可用于配制用于人体的一系列剂量。在一个实施方案中,此类化合物的剂量落于一个循环浓度范围内,包括具有些微或无毒性的ED
本发明抗体或抗原结合部位的治疗上或预防上有效量的示例性、非局限范围为约0.001至约60mg/kg的体重、约0.01至约30mg/kg的体重、约0.01至约25mg/kg的体重、约0.5至约25mg/kg的体重、约0.1至约20mg/kg的体重、约10至约20mg/kg的体重、约0.75至约10mg/kg的体重、约1至约10mg/kg的体重、约2至约9mg/kg的体重、约1至约2mg/kg的体重、约3至约8mg/kg的体重、约4至约7mg/kg的体重、约5至约6mg/kg的体重、约8至约13mg/kg的体重、约8.3至约12.5mg/kg的体重、约4至约6mg/kg的体重、约4.2至约6.3mg/kg的体重、约1.6至约2.5mg/kg的体重、约2至约3mg/kg的体重、或约10mg/kg的体重。
药物组合物经配制以含有有效量的本发明抗体或其抗原结合部分,其中该量取决于欲处理的动物及欲治疗的病况。在一个实施方案中,本发明抗体或其抗原结合部分的施用剂量范围为约0.01mg至约10g、约0.1mg至约9g、约1mg至约8g、约2mg至约7g、约3mg至约6g、约10mg至约5g、约20mg至约1g、约50mg至约800mg、约100mg至约500mg、约0.01μg至约lOg、约0.05μg至约1.5mg、约10μg至约1mg蛋白、约30μg至约500μg、约40μg至约300μg、约0.1μg至约200μg、约0.1μg至约5μg、约5μg至约10μg、约10μg至约25μg、约25μg至约50μg、约50μg至约100μg、约100μg至约500μg、约500μg至约1mg、约1mg至约2mg。任何特定受试者的具体剂量程度取决于多个因素,包括特定肽的活性、年龄、体重、整体健康状况、性别、饮食、施用时间、施用途径、及排泄速率,药物组合及特定疾病于治疗时的严重程度,并且可由本领域普通技术人员确定,而无需过度实验。
制备含有本发明抗体的治疗配制剂并保藏,其藉由混合具所需纯度的抗体与任意的生理上可接受载体、赋形剂、或稳定剂(Remington's Pharmaceutical Sciences 16
本文的制剂亦可含有大于一种活性化合物,以针对所需治疗的特定适应症,其包括但不限于,那些具有互补活性且不相互有不良影响者。此类分子合适地存在于缀合物中,其量对预期的目的有效。
活性成分亦可包入微胶囊中,其制自例如凝聚技术或界面聚合作用,如分别为羟甲基纤维素或明胶微胶囊与聚(甲基丙烯酸甲酯);包入胶体药物输送系统(如微脂体、白蛋白微球、微乳剂、纳米颗粒、及纳米胶囊)或包入巨乳剂。此类技术公开于Remington'sPharmaceutical Sciences 16th edition,Osol,A.Ed.(1980)。
用于体内施用的制剂必须无菌。这通过无菌过滤膜过滤而易于实现。
可制备持续释放制备物。持续释放制备物的适用实例包括含有本发明免疫球蛋白的固体疏水性聚合物的半透性基质,该基质为成形制品形式,如薄膜或微胶囊。持续释放基质的实例包括聚酯类、水凝胶(如聚(2-羟乙基甲基丙烯酸酯)或聚(乙烯醇))、聚交酯(美国专利号3,773,919)、L-谷氨酸与γ乙基-L-谷氨酸的共聚物、非降解性乙烯-乙酸乙烯酯、降解性乳酸-乙醇酸共聚物,如LUPRON DEPOT
用途
本发明抗体可用于如体外、离体、及体内的治疗方法。本发明抗体可作为拮抗剂,以部分或全部阻断体外、离体、和/或体内的特异性抗原活性。此外,本发明的至少一些抗体可中和其他物种的抗原活性。据此,本发明抗体可用于抑制特异性抗原活性,如在含有抗原的细胞培养物中、在人类受试者中、或在其他哺乳动物受试者中(如黑猩猩、狒狒、绒猿、食蟹猴与恒河猴、猪、或小鼠),其具有本发明抗体可交叉反应的抗原。在一个实施方案中,本发明抗体可用于抑制抗原活性,其藉由使抗体与抗原接触以抑制抗原活性。在一个实施方案中,抗原为人类蛋白质分子。
在一个实施方案中,本发明抗体可用于抑制患有病症的受试者的抗原的方法,其中该抗原活性是有害,包含对受试者施用本发明的抗体,使得受试者的抗原活性受抑制。在一个实施方案中,抗原为人类蛋白质分子且受试者为人类受试者。或者,受试者可为表达抗原的哺乳动物,且本发明抗体可与的结合。此外,受试者可为抗原经导入的哺乳动物(如藉由施用抗原或藉由表达抗原转基因)。针对治疗目的,本发明抗体可施用于人类受试者。此外,本发明抗体可施用于表达可与抗体交叉反应的抗原的非人类哺乳动物(如灵长类动物、猪、或小鼠),用于兽医目的或作为人类疾病的动物模式。关于后者,此类动物模式可用于评估本发明抗体的治疗功效(如剂量测试及施用时程)。本发明抗体可用于治疗、抑制、延缓进展、预防/延迟复发、改善、或预防与SSEA-4和SSEA-4化蛋白的异常表达和/或活性相关联的疾病、病症、或病况,包括但不局限于,癌症、肌肉病症、泛素途径相关的遗传病症、免疫/发炎性病症、神经障碍、及其他泛素途径相关的病症。
在一方面,本发明的阻断抗体特异于SSEA-4。
在特定实施方案中,对患者施用包含本发明抗体与细胞毒剂缀合的免疫缀合物。在特定实施方案中,免疫缀合物和/或其结合的抗原由细胞内化,该细胞于其表面上表达一或多个与SSEA-4相关联的蛋白,导致免疫缀合物毒杀其相关联的靶标细胞的治疗功效增加。在一个实施方案中,细胞毒剂靶向或干扰靶标细胞的核酸。此类细胞毒剂的实例包括本文所述的化学治疗剂的任一者(如美登木素或卡奇霉素)、放射性同位素、或核糖核酸酶或DNA内切核酸酶。
本发明的抗体(与辅助治疗剂)可利用任何合适的方式施用,包括胃肠外、皮下、腹膜内、肺内、及鼻内,且视需求,用于局部治疗、病灶内施用。胃肠外输注包括肌肉内、静脉内、动脉内、腹膜内、或皮下施用。此外,抗体适于藉由脉冲输注施用,特别是针对抗体剂量渐降。给药可利用任何合适途径,如利用注射(如静脉呢或皮下注射),其部分取决于施用是否为短暂或慢性。
在制备和施用抗体时,可考量本发明抗体的结合靶标的位置。当结合靶标为细胞内分子时,本发明的特定实施方案提供将抗体或其抗原结合片段导入含有结合靶标的细胞。在一个实施方案中,本发明抗体可于细胞内表达,成为内抗体。本文中使用的“内抗体”术语意指抗体或其抗原结合部分于细胞内表达,且其能选择性结合靶标分子,其描述于Marasco,Gene Therapy 4:11-15(1997);Kontermann,Methods 34:163-170(2004);美国专利号6,004,940与6,329,173;美国专利申请公开号2003/0104402;及PCT公开号WO2003/077945。内抗体于细胞内的表达受到将编码所需抗体或其抗原结合部分的核酸导入靶标细胞的影响(缺乏野生型前导序列和分泌信号,其通常与编码抗体或抗原结合片段的基因相关联)。可使用任何将核酸导入细胞的标准方法,包括但不局限于,显微注射、弹道注射、电穿孔、磷酸钙沉淀、微脂体、及以携带感兴趣核酸的逆转录病毒、腺病毒、腺相关病毒、及牛痘载体转染。编码本发明抗SSEA-4抗体的全部或部分的一或多个核酸可输送至靶标细胞,使得表达一或多个内抗体,其能于细胞内结合SSEA-4,并调控一或多个SSEA-4介导的细胞途径。
在另一个实施方案中,提供内化的抗体。抗体可具有特定特征,其增强抗体输送至细胞,或可经改良以产生此类特征。为了达此目的的技术是本领域已知的。举例而言,已知抗体阳离子化(cationization)有助于其摄入细胞(参见,美国专利号6,703,019)。脂转染或微脂体亦可用于将抗体输送至细胞。当使用抗体片段时,针对特异性结合靶标蛋白的结合区,最小的抑制片段通常具优势。举例而言,依据抗体的可变区序列,可设计保留结合靶标蛋白序列能力的肽分子。此类肽可化学合成和/或利用重组DNA技术产生。参见,如Marasco et al.,Proc.Natl.Acad.Sci.USA,90:7889-7893(1993)。
利用本领域公知方法,可增强调节子多肽进入靶标细胞。举例而言,特测序列,如那些衍生自HIV Tat或触角足(Antennapedia)同源性域蛋白者,能直接有效地摄入异源性蛋白跨越细胞膜。参见,如Chen et al.,Proc.Natl.Acad.Sci.USA(1999),96:4325-4329。
当结合靶标位于脑部时,本发明的特定实施方案提供抗体或其抗原结合片段穿过血脑障壁。特定的神经变性性疾病与血脑障壁渗透性增加相关联,使得抗体或抗原结合片段可易于导入脑部。当血脑障壁仍完整时,有数个现有的本领域已知的运送分子穿越方法,包括但不局限于,物理方法、基于脂质的方法、及基于受体与通道的方法。
运输抗体或抗原结合片段穿越血脑障壁的物理方法包括但不局限于,完全避开血脑障壁,或藉由在血脑障壁创建开口。规避方法包括但不局限于,直接注入脑部(参见,如Papanastassiou et al.,Gene Therapy 9:398-406(2002))、间质输液/对流增强输送(参见,如Bobo et al.,Proc.Natl.Acad.Sci.USA 91:2076-2080(1994))、及在脑部植入输送装置(参见,如Gill et al.,Nature Med.9:589-595(2003);以及Gliadel Wafers
运输抗体或抗原结合片段穿越血脑障壁的基于脂质的方法包括但不局限于,将抗体或抗原结合片段包入偶联抗体结合片段的微脂体,所述抗体结合片段结合血脑障壁血管内皮上的受体(参见,如美国专利申请公开号20020025313),并将抗体或抗原结合片段涂布于低密度脂蛋白颗粒(参见,如美国专利申请公开号20040204354)或载脂蛋白E(参见,如美国专利申请公开号20040131692)。
运输抗体或抗原结合片段穿越血脑障壁的基于受体与通道的方法包括但不局限于,使用糖皮质素阻断剂以增加血脑障壁通透性(参见,如美国专利申请公开号2002/0065259、2003/0162695、及2005/0124533);活化钾通道(参见,如美国专利申请公开号2005/0089473)、抑制ABC药物运输蛋白(参见,如美国专利申请公开号2003/0073713);以转铁蛋白涂布抗体并调节一或多个转铁蛋白受体的活性(参见,如美国专利申请公开号2003/0129186)、及将抗体阳离子化(参见,如美国专利号5,004,697)。
本发明抗体组合物将以符合良好医学实践的方式配制、给药、及施用。在此情况下的考虑因素包括,欲治疗的特定病症、欲治疗的特定哺乳动物、受试者患者的临床状况、病症成因、药剂输送部位、施用方法、施用方案、及医师已知的其他因素。抗体毋须,而是任意地与目前用于预防或治疗有问题病症的一或多个药剂一同配制。此类其他药剂的有效量取决于配制剂中存在的本发明抗体量、病症或治疗类型、及上述的其他因素。这些一般而言以与本文所述相同剂量与施用途径使用,或本文所述剂量的约1至99%,或以经验上/临床上确定为适当的任何剂量及任何途径使用。
针对疾病的预防或治疗,本发明抗体的适当剂量(当单独使用或与其他试剂结合使用时,如化学治疗剂)将取决于欲治疗疾病的类型、抗体类型、疾病严重性与过程、抗体是否用于预防或治疗目的、先前治疗、患者临床病史及对抗体的反应、及主治医师判断。抗体适合以一次性或一系列治疗方式施用于患者。取决于疾病类型与严重性,施用于患者的起始候选剂量可为约1μg/kg至15mg/kg(如0.1mg/kg至10mg/kg)的抗体,例如,不论是藉由一或多次分开施用,或连续输注。通常每日剂量范围可从约1μg开始,以预防或治疗疾病,本发明抗体的适当剂量(数天或更长时间)取决于病况,治疗一般而言将持续到疾病症状出现抑制。抗体的示例性剂量范围为约0.05mg/kg至约10mg/kg。因此,可施用于患者一或多剂的约0.5mg/kg、2.0mg/kg、4.0mg/kg、或10mg/kg(或其任何组合)。此类剂量可间歇施用,如每周或每三周(诸如使患者接受约2至约20剂,或诸如约6剂的抗体)。一开始可施用较高负荷剂量,接着为一或多个较低剂量。示例性给药方案包含施用约4mg/kg的初始负荷剂量,接着每周维持约2mg/kg的抗体剂量。然而,可使用其他给药方案。此治疗的进展易于以常规技术与试验监测。
制品
于本发明的另一方面,所提供的制品含有治疗、预防、和/或诊断上述病症的适用材料。该制品包含容器及容器上或粘贴于容器的标签或包装插页。适用的容器包括例如,瓶、小瓶、注射器等。容器可由各材料制成,如玻璃或塑料。容器所持有的组合物其本身或当与另一组合物结合时能有效治疗、预防、和/或诊断病况,且可具有无菌进入口(例如,容器可为静脉输液袋或供皮下注射针使用的塞盖小瓶)。组合物中至少一活性剂为本发明抗体。标签或包装插页指示组合物所适用的病况治疗选择。此外,该制品可包含:(a)其中含有组合物的第一容器,其中该组合物包含本发明抗体;以及(b)其中含有组合物的第二容器,其中该组合物包含进一步细胞毒性或其他治疗剂。本发明的此实施方案的制品可进一步包含包装插页,其指示组合物可用于治疗特定病况。或者,或此外,制品可进一步包含第二(或第三)容器,其包含医药上可接受缓冲液,如抑菌性注射用水(BWFI)、磷酸缓冲盐液、林格氏液、及葡萄糖溶液。可进一步包括商业与用户观点上所需的其他材料,包括其他缓冲液、稀释剂、过滤器、针头、及注射器。
在特定实施方案中,欲治疗的受试者为哺乳动物。在特定实施方案中,受试者为人类。在特定实施方案中,受试者为驯养动物,如犬、猫、牛、猪、马、绵羊、或山羊。在特定实施方案中,受试者为伴侣动物,如犬或猫。在特定实施方案中,受试者为家畜动物,如牛、猪、马、绵羊、或山羊。在特定实施方案中,受试者为动物园动物。在另一个实施方案中,受试者为研究用动物,啮齿动物、犬、或非人类灵长类动物。在特定实施方案中,受试者为非人类转基因动物,如转基因小鼠或转基因猪只。
药物组合物及配制剂
于制备本文所述的抗体后,可制成“预冻干配制剂”。用于制成配制剂的抗体优选地基本上纯质,且理想地基本上是同源性(亦即,无蛋白质污染等)。“基本上纯质”蛋白质意指组合物包含至少约90重量百分比的蛋白质,其是以组合物的总重量为基准,优选地至少约95重量百分比。“基本上均质化”蛋白质意指组合物包含至少约99重量百分比的蛋白质,其是以组合物的总重量为基准。在特定实施方案中,蛋白质为抗体。
预冻干配制剂中抗体量的决定是考量所需的剂量体积、施用方式等。当所选择的蛋白质为完整抗体(全长抗体)时,示例性起始蛋白质浓度为约2mg/mL至约50mg/mL、优选地约5mg/mL至约40mg/mL、最佳地约20至30mg/mL。蛋白质一般而言存在于溶液中。举例而言,蛋白质可存在于pH值约4-8的缓冲溶液中,优选地pH值约5-7。示例性缓冲液包括组氨酸、磷酸盐、Tris、柠檬酸盐、琥珀酸盐、及其他有机酸。缓冲液浓度可为约1mM至约20mM,或约3mM至约15mM,取决于如缓冲液与配制剂(如重建的配制剂)所需的等张性。优选的缓冲液为组氨酸,因为如下所示,其可具冻干保护性质。琥珀酸盐经证明为另一适用的缓冲液。
冻干保护剂加入预冻干配制剂。在优选的实施方案中,冻干保护剂为非还原性糖,如蔗糖或海藻糖。冻干保护剂于预冻干制剂中的量通常使得在重建时,所得配制剂将呈现等张性。然而,高张性重建配制剂亦可适用。此外,冻干保护剂的量不能过低,使得冻干时出现不可接受量的蛋白质降解/聚集。当冻干保护剂为糖(如蔗糖或海藻糖)且蛋白质为抗体时,示例性冻干保护剂于预冻干配制剂中的浓度为约10mM至约400mM,优选地约30mM至约300mM,最佳地约50mM至约100mM。
针对各蛋白质与冻干保护剂组合,选择蛋白质与冻干保护剂的比率。在以抗体作为所选的蛋白质且以糖(如蔗糖或海藻糖)作为冻干保护剂而产生具高蛋白质浓度的等张性重建配制剂的情况下,冻干保护剂与抗体的摩尔比率可为约100至约1500摩尔冻干保护剂比上1摩尔抗体,且优选地约200至约1000摩尔冻干保护剂比上1摩尔抗体,如约200至约600摩尔冻干保护剂比上1摩尔抗体。
在本发明的优选实施方案中,发现到,需要将表面活性剂加入预冻干配制剂。或者,或此外,可将表面活性剂加入冻干配制剂和/或重建配制剂。示例性表面活性剂包括非离子性表面活性剂,如Polysorbate(如Polysorbate 20或80);泊洛沙姆(如泊洛沙姆188);Triton;十二烷基硫酸钠(SDS);月桂基硫酸钠;辛基辛糖钠;月桂基、肉豆蔻基、亚油酰基、或硬脂基磺基甜菜碱;月桂基、肉豆蔻基、亚油酰基、或硬脂基肌氨酸;亚油酰基、肉豆蔻基、或十六烷基甜菜碱;月桂酰氨基丙基、椰油酰胺丙基、亚油酰氨基丙基、肉豆蔻酰氨基丙基、棕榈酰丙基、或异硬脂酰胺丙基甜菜碱(如月桂酰氨基丙基);肉豆蔻酰氨基丙基、棕榈酰丙基、或异硬脂酰胺丙基二甲基胺;甲基椰油基甲酯钠、或油基牛磺酸甲酯二钠;以及MONAQUATTM系列(Mona Industries,Inc.,Paterson,N.J.)、聚乙二醇、聚丙二醇、及乙烯与丙二醇的共聚物(如Pluronics、PF68等)。添加的表面活性剂量使得重建蛋白的聚集减少,并使重建后的颗粒形成最小化。举例而言,表面活性剂可以约0.001-0.5%的量存在于预冻干配制剂中,优选地约0.005-0.05%。
于本发明的特定实施方案中,以冻干保护剂(如蔗糖或海藻糖)与填充剂(如甘露糖醇或甘氨酸)的混合物用于制备预冻干配制剂。填充剂可容许产生均匀的冻干饼状物,而无过多袋于其中,等等。
其他医药上可接受载体、赋形剂、或稳定剂,如那些描述于Remington'sPharmaceutical Sciences 16th edition,Osol,A.Ed.(1980)者,可包括于预冻干配制剂(及或冻干配制剂和/或重建配制剂)中,条件为其不会不良影响配制剂所需的特征。可接受的载体、赋形剂、或稳定剂于使用的剂量与浓度下对接受者无毒,包括:额外的缓冲剂;防腐剂;共溶剂;抗氧化剂,包括抗坏血酸与甲硫氨酸;螯合剂,如EDTA;金属复合物(如Zn-蛋白质复合物);生物可降解性聚合物,如聚酯;和/或成盐相对离子,如钠。
本文所述的药物组合物与配制剂优选地是稳定的。“稳定”配制剂/组合物是其中的抗体于保藏时基本上维持其物理与化学稳定性及完整性。用于测定蛋白质稳定性的各分析技术是本领域可得,并于Peptide and Protein Drug Delivery,247-301,Vincent LeeEd.,Marcel Dekker,Inc.,New York,N.Y.,Pubs.(1991)及Jones,A.Adv.Drug DeliveryRev.10:29-90(1993)等文献中回顾。稳定性可于所选温度下的所选时间段测定。
用于体内施用的配制剂必须无菌。此可于冻干与重建之前或之后利用过滤通过无菌过滤膜而易于达成。或者,除了蛋白质以外,可于约120℃下高压灭菌该成分约30分钟,达到整体混合物的无菌性。
于蛋白质、冻干保护剂、及其他任意组分混合在一起后,将配制剂冻干。有许多不同冷冻干燥机可用于此目的,如
于一些情况下,可能需要冻干容器中的蛋白质配制剂,其中进行蛋白质重建,以避免转移步骤。容器在此情况下可为,例如,3、5、10、20、50、或100cc小瓶。于一般前提下,冻干将产生冻干配制剂,其中水分含量是小于约5%,且优选地小于约3%。
于所需阶段,通常以蛋白质施用于患者时,可以稀释剂重建冻干配制剂,使得重建配制剂的蛋白质浓度为至少50mg/mL,如约50mg/mL至约400mg/mL,更佳地约80mg/mL至约300mg/mL,最佳地约90mg/mL至约150mg/mL。于重建配制剂中此类高蛋白质浓度于皮下输送该重建配制剂时特别适用。然而,针对其他施用途径,如静脉施用,重建配制剂中可能需要较低浓度的蛋白质(例如,重建配制剂中含有约5-50mg/mL或约10-40mg/mL的蛋白质)。在特定实施方案中,重建配制剂的蛋白质浓度明显比预冻干配制剂的高。举例而言,重建配制剂的蛋白质浓度可为预冻干配制剂的约2-40倍,优选地3-10倍,且最佳地3-6倍(如至少3倍或至少4倍)。
重建通常在约25℃温度下进行,以确保完全水合,尽管可视需求使用其他温度。重建所需的时间将取决于,如稀释剂类型、赋形剂与蛋白质的量。示例性稀释剂包括无菌水、抑菌性注射用水(BWFI)、pH值缓冲液(如磷酸缓冲盐液)、无菌盐液、林格氏溶液、或葡萄糖溶液。稀释剂可选地含有防腐剂。示例性防腐剂如上述,优选的防腐剂为芳族醇类,如苄基或酚醇是。防腐剂的用量取决于评估不同防腐剂浓度与蛋白质的相容性及防腐功效测试。举例而言,若防腐剂为芳族醇(如苯甲醇),则其存在量可为约0.1-2.0%,优选地约0.5-1.5%,最佳地约1.0-1.2%的。优选地,重建配制剂每瓶具有小于6000个颗粒,其粒径大于10μm。
治疗应用
本文描述治疗方法,包括对有此需要的受试者施用一治疗上有效量的组合物治疗,该组合物包括本文所述的一或多个抗体。
在特定实施方案中,有治疗需求的受试者(如人类患者)诊断出、疑似患有、或有癌症风险。癌症的实例包括但不局限于,肉瘤、皮肤癌、白血病、淋巴瘤、脑癌、肺癌、乳腺癌、口腔癌、食道癌、胃癌、肝癌、胆管癌、胰腺癌、结肠癌、肾癌、子宫颈癌、卵巢癌、及前列腺癌。在特定实施方案中,癌症为肉瘤、皮肤癌、白血病、淋巴瘤、脑癌、肺癌、乳腺癌、卵巢癌、前列腺癌、结肠癌、或胰腺癌。在一些优选的实施方案中,癌症为脑癌或多形性成胶质细胞瘤(GBM)癌。
在优选的实施方案中,抗体能靶向SSEA-4表达的癌细胞。在特定实施方案中,抗体能靶向癌细胞上的SSEA-4。在特定实施方案中,抗体能靶向癌症的SSEA-4。
该治疗导致减少肿瘤尺寸、消除恶性细胞、预防转移、预防复发、减少或毒杀弥漫性癌症、延长存活时间、和/或延长肿瘤的癌症进展时间。
在特定实施方案中,该治疗进一步包含在施用该抗体之前、期间、或之后,施用于受试者一额外的治疗。在特定实施方案中,额外的治疗以化学治疗剂治疗。在特定实施方案中,额外的治疗以辐射治疗。
本发明方法在治疗与预防早期肿瘤方面特别有利,藉以防止进展到更晚期的阶段,使得晚期癌症相关的发病率与死亡率下降。本发明方法亦有利于预防肿瘤复发或肿瘤再生长,如于移除原发性肿瘤后仍存在的休眠肿瘤(dormant tumor),或减少或预防肿瘤发生。
以本文所述方法治疗的受试者可为哺乳动物,更佳地是人类。哺乳动物包括但不局限于,农场动物、竞技动物、宠物、灵长类动物、马、犬、猫、小鼠、及大鼠。需要治疗的人类受试者可以是、存在风险、或疑似患有癌症的人类患者,该癌症包括但不局限于,乳腺癌、肺癌、食道癌、结肠癌、胆道癌、肝癌、颊癌、胃癌、结肠癌、鼻咽癌、肾癌、前列腺癌、卵巢癌、子宫颈癌、子宫内膜癌、胰腺癌、睾丸癌、膀胱癌、头颈癌、口腔癌、神经内分泌癌、肾上腺癌、甲状腺癌、骨癌、皮肤癌、基底细胞癌、鳞状细胞癌、黑素瘤、或脑肿瘤。患有癌症的受试者可藉由常规医学检查而判定。
本文中使用的“有效量”意指不论单独使用或结合一或多个其他活性剂使用,对受试者产生治疗效果所需的各活性剂的量。有效量可变,如本领域那些技术人员的理解,取决于欲治疗的特定病况、病况严重程度、个别患者参数,包括年龄、身体状况、尺寸、性别、及体重、治疗时间、并行治疗的性质,视需求,特定施用途径、及健康从业者的知识与专长范畴内的类似因素。这些因素是本领域的这些普通技术人员已知,且仅能采取常规实验方式解决。一般而言优选的是,使用个别组分或其组合的最大剂量,亦即,依据健康医学判断的最高安全剂量。然而,本领域的那些普通技术人员应理解到,基于医疗原因、心理原因、或实质上任何其他原因,患者可能坚持使用较低剂量或耐受剂量。
经验上考量,如半衰期,通常有助于确定给药量。举例而言,可使用与人类免疫系统相容的抗体(如人源化抗体或完整人抗体)延长抗体半衰期,并防止抗体受宿主免疫系统攻击。于治疗过程中可确定与调整施用频率,且一般而言但不一定是,基于癌症的治疗和/或抑制和/或改善和/或延缓。或者,本文所述抗体的持续连续释放配制剂可能适用。用于达成持续释放的各配制剂与装置是本领域已知。
在一个实例中,针对一或多次给予抗体的受试者,可凭经验决定本文所述抗体的剂量。对受试者施用递增剂量的抗体。欲评估抗体功效,可按照常规实践遵循疾病指示(如癌症)。
一般而言,针对施用本文所述抗体之任一者,起始候选剂量可为约2mg/kg。针对本发明的目的,通常每日剂量范围可为约0.1μg/kg至3μg/kg至30μg/kg至300μg/kg至3mg/kg至30mg/kg至100mg/kg或以上的任一者,其取决于上述参数。针对数天或更长时间的重复施用,根据病况,治疗持续到发生所需的症状抑制或直到达到足够的治疗程度以缓解癌症或其症状为止。示例性给药方案包括施用约2mg/kg的初始剂量,随后每周维持约1mg/kg抗体的剂量,或随后每隔一周施用约1mg/kg的维持剂量。然而,可使用其他剂量方案,其取决于从业人员预期达成的药代物动力学衰变模式。举例而言,考量每周给药一至四次。在特定实施方案中,可使用的给药范围为约3μg/mg至约2mg/kg(如约3μg/mg、约10μg/mg、约30μg/mg、约100μg/mg、约300μg/mg、约1mg/kg、及约2mg/kg)。在特定实施方案中,给药频率为每周一次、每2周一次、每4周一次、每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、或每10周一次;或每月一次、每2个月一次、或每3个月一次,或更长时间。此治疗的进展是易于利用常规技术与试验监测。所使用的给药方案,包括抗体,可随时间改变。
针对本发明的目的,本文所述抗体的适当剂量将取决于所使用的特异性抗体(或其组合物)、癌症的类型与严重程度、抗体是否用于预防或治疗目的、先前的治疗、患者临床病史与对抗体的反应、及主治医师的判断。本文所述抗体的施用可基本上持续一段预选时间,或可为一系列间隔剂量,如于癌症发展之前、期间、或之后进行。
本文中使用的“治疗”术语意指施加或施用包括一或多个活性剂的组合物至受试者,其患有癌症、癌症症状、或癌症倾向,目的在于治愈、疗愈、减轻、缓解、改变、补救、改善、改进、或影响癌症、癌症症状、或癌症倾向。
缓解癌症包括延缓癌症的发展或进展,或降低癌症的严重程度。缓解癌症不一定需要治疗结果。本文中使用的“延缓”癌症发展意指推迟、阻止、缓慢、延缓、稳定、和/或推迟癌症进展。取决于癌症和/或欲治疗的受试者的病史,此延迟可为不同时间长度。当相较于未使用方法时,“延迟”或减轻癌症发展或延缓癌症发病的方法,为在给定的时间范围内降低发生癌症的一或多个症状可能性(风险)和/或在给定的时间范围内减少症状程度的方法。此类比较通常基于临床研究,其使用足以给出统计学上显著结果的一些受试者。
癌症的“发展”或“进展”意指癌症的初步表现和/或后续发展。利用本领域已知的标准临床技术,可检测与评估癌症的发展。然而,发展亦指无法检测的进展。针对本发明的目的,发展或进展意指症状的生物过程。“发展”包括发生、复发、及发病。本文中使用的癌症的“发病”或“复发”包括初始发病和/或复发。
医药领域普通技术人员已知的常规方法可用于施用药物组合物至受试者,其取决于欲治疗的疾病类型或疾病的部位。此组合物亦可经由其他常规途径施用,如利用口服、胃肠外、吸入喷雾、局部、直肠、鼻腔、口腔、阴道、或经由植入贮液等方式施用。本文中使用的“胃肠外”术语包括皮下、皮内、静脉内、肌肉、关节、动脉内、滑膜、胸骨、鞘内、脑内、及颅内注射或输注技术。此外,可经由可注射储库施用途径施用于受试者,例如,使用1、3、或6个月的可注射储库或生物可降解性材料及方法。
可注射组合物可含有各载体,如植物油、二甲基乳酰胺、二甲基甲酰胺、乳酸乙酯、碳酸乙酯、肉豆蔻酸异丙酯、乙醇、及多元醇(甘油、丙二醇、液体聚乙二醇、及其类似物)。针对静脉注射,可利用滴注法施用水溶性抗体,其输注含有抗体与生理上可接受赋形剂的医药配制剂。生理上可接受赋形剂可包括例如,5%葡萄糖、0.9%盐液、林格氏液、或其他适用的赋形剂。肌肉注射制备物,如抗体的适用可溶性盐形式无菌配制剂,可溶解于医药赋形剂(如注射用水、0.9%盐液、或5%葡萄糖溶液)并施用。
“化疗剂”为可用于治疗癌症的化学化合物。示例性化疗剂的实例包括单甲基奥瑞斯他汀E(MMAE)、单甲基奥瑞斯他汀F(MMAF)、mertansine(DM1)、蒽环类药物、吡咯苯二氮杂卓、α-鹅膏蕈碱、tubulysin、地西泮、厄洛替尼、硼替佐米、氟维司群、舒尼替尼、来曲唑、甲磺酸伊马替尼、PTK787/ZK 222584、奥沙利铂、亚叶酸钙、雷帕霉素、拉帕替尼、洛那法尼(
“生物治疗剂”是可用于治疗癌症的生物分子。化疗剂的例子包括PD-1拮抗剂,PD-1抗体,CTLA拮抗剂,CTLA抗体,白介素,细胞因子,GM-CSF,干扰受体酪氨酸激酶(RTK)的试剂,雷帕霉素的哺乳动物靶标(mTOR)抑制剂,人类表皮生长因子受体2(HER2)抑制剂,表皮生长因子受体(EGFR)抑制剂,整联蛋白阻断剂,CDK4/6抑制剂,PI3K抑制剂,mTOR抑制剂,AKT抑制剂或Anti-Globo系列抗原抗体
“抗Globo系列抗原抗体”包括抗GloboH抗体,抗SSEA-4抗体或抗SSEA-4抗体
适合于组合的OBI-868(Globo H神经酰胺或SSEA-4神经酰胺)的实例描述
在特定实施方案中,Globo H神经酰胺或SSEA-4神经酰胺的结构描述于PCT专利公开案(WO2017041027A1)专利申请案,其全部内容在此并入以作为参考资料。
Globo H和SSEA-4(碳水化合物聚糖的globo系列)和唾液酰Lewis A(SLe
Globo H为一种具有结构(Fucα1→2Galβ1→3GalNAcβ1→3Galα1→4Galβ1→4Glc)的六糖,其为在各种类型的癌症,特别是乳腺癌、前列腺癌和肺癌上高度表达的抗原性碳水化合物家族的成员(Kannagi R等人,J Biol Chem 258:8934-8942,1983;Zhang SL等人,Int J Cancer 73:42-49,1997;Hakomori S等人,Chem Biol 4:97-104,1997;Dube DH等人,Nat Rev Drug Discov 4:477-488,2005)。Globo H在癌细胞表面上作为糖脂表达并且可能作为糖蛋白表达(Menard S等人,Cancer Res 43:1295-1300,1983;Livingston POCancer Biol 6:357-366,1995)。乳腺癌患者的血清含有高量的针对Globo H表位的抗体(Menard S等人,Cancer Res 43:1295-1300,1983)。
一方面,本公开的Globo H神经酰胺和/或SSEA-4神经酰胺涉及接头组成及其使用方法,其可促进聚糖,例如Globo系列聚糖(Globo系列鞘糖脂抗原)和/或肿瘤相关碳水化合物抗原(TACA)的有效检测和结合。
TACA可被分为两类:糖蛋白抗原以及糖脂抗原。糖蛋白抗原可包括或排除,例如:(1)粘蛋白可包括或排除,例如:α-2,6-N-乙酰半乳糖氨基(Tn)、Thomsen-Friendreich抗原(TF),以及唾液酰-Tn(sTn)和(2)聚唾液酸(PSA)。糖脂抗原可包括或排除,例如:(1)Globo系列抗原可包括或排除,例如:Globo H、SSEA-3(或Gb5)、SSEA-4、Gb3以及Gb4;(2)血型决定因子可包括或排除,例如:Lewis
在一方面,本发明提供了可用于多种应用的接头。例如,本发明的接头可被用于将分子连接到基质,其可以包括或排除:表面、固体表面、颗粒、阵列或珠粒。在一些方面,该接头包含与碳水化合物相互作用的第一部分以及与表面相互作用的第二部分。
在一些方面,本发明提供接头,以及接头和聚糖的缀合物,其可以包括或排除:接头-TACA,包括接头-Globo系列聚糖或其它TACA、接头-globo系列糖蛋白缀合物,以及制备和使用它们的方法。示例性Globo系列聚糖可以包括或排除SSEA-4,以及Globo H。示例性Globo系列糖蛋白可以包括或排除SSEA-4,以及连接到肽或蛋白质的Globo H。额外的TACA聚糖可包括或排除,例如Le
在一些方面,本发明提供了与基质共价的聚糖,包括透过接头的方式。
本发明的另一方面为在测试样品中检测癌症(包括乳腺癌)的方法,其可包含(a)使测试样品与共价附着到聚糖的接头接触,该聚糖包含Globo H、SSEA-3、SSEA-4、Le
其中该手性碳原子例如C1为消旋的或手性的;n为范围在5至9的整数,包括n=7;且TACA选自Globo H、SSEA-4、Gb3、Gb4、Le
在一些方面,本发明关于用于疾病诊断、复发监测和药物开发的复数个珠粒,其中每个珠粒在每个珠粒上或内部具有唯一的标识记号,其中珠粒-n包含复数个G
一方面,本发明关于下式的化合物:G-A-Z-X(式1),其中:G为聚糖;A为包含酯或酰胺的部分;X为基质,例如表面、固体表面、透明固体、非透明固体、选定波长的可见光或不可见光透过的固体、颗粒、阵列、微泡或珠粒、涂覆的基质、涂覆的表面、聚合物表面、硝化纤维素涂覆的表面或珠粒表面;附着到该基质的间隔基团或具有用于将该接头附着到该基质的基团的间隔基团;而且Z为一个或复数个脂质链,具有脂质链的一个或复数个间隔基团。
在一方面,本发明的特征在于具有下式的化合物:
在一方面,本发明的特征在于具有下式的化合物:
在一方面,本发明的特征在于具有下式的示例性G-A-Z化合物:
其中Q可为
在一方面,示例性的G-A-Z化合物具有下式:
其中C
在一方面,m可为5,[脂质链1]可为下式
其中n为1至10的整数,包括7,且该波浪线表示为连接至[脂质链1]的羰基碳的键。
在一方面,提供了根据下式的化合物:
其中C
在一方面,提供了根据下式的化合物:
其中[脂质链],在本文中也称为“脂质”,可为任何C
在一方面,提供了根据下式的化合物:
其中该手性碳原子C
其中R
其中n=4至9的整数,包括n=7;以及
其中TACA选自Globo H、SSEA-3、Gb3、Gb4、SSEA-4、Le
在一方面,提供了根据任一下式的化合物:
其中该手性碳原子C
其中n=4至9的整数,包括n=7;以及
其中TACA选自Globo H、SSEA-3(或Gb5)、Gb3、Gb4、SSEA-4、Le
在一方面,提供了制备本文的化合物的方法,其中脂质链-1或脂质链-2与戊基胺-官能化的Globo H反应以形成酰胺键。
在一方面,提供了根据下式的化合物:
其中m可以具有范围从1至10的整数值;
其中V可为氧或碳;
其中q可以具有范围从1至3的整数值;
其中TACA选自以下之一:Globo H、SSEA-3(或Gb5)、SSEA-4、Gb3、Gb4、Le
在一方面,提供了在阵列中改善灵敏度的方法,其中该方法包含使用本文公开的接头。
在一方面,本发明关于癌症诊断方法,其包含(a)提供来自怀疑患有癌症的受试者的含有抗体的样品;(b)使该样品与包含一种或多种TACA的阵列接触;(c)形成与一种或多种TACA结合的样品中抗体的复合物;(d)检测与一种或多种TACA结合的抗体的量;以及(e)相比于与所述一种或多种TACA结合的抗体的正常水平,基于与所述一种或多种TACA结合的所述抗体的量确定该受试者的疾病状态。在一些方面,正常水平可为例如基于来自正常患者或正常患者群体的样品中TACA结合的抗体的量的测量的参考值或范围。在一些方面,检测的TACA结合抗体为循环抗体。在一方面,检测包含分析针对至少一种TACA的至少一种抗体。在一些方面,阵列上的TACA可以选自Tn、TF、sTn、聚唾液酸、Globo H、SSEA-3、SSEA-4、Gb3、Gb4、Le
在一方面,该样品为体液(血清、唾液、淋巴液、尿液、阴道抹片或口腔抹片)。
在一方面,本发明关于筛选用于TACA结合配偶体的聚糖结合配偶体库。在一些方面,该分子或库可包含例如抗体、纳米抗体、抗体片段、适体、凝集素、肽,或组合库分子。在一方面,筛选该库以鉴定该TACA结合配偶体包含使用本文公开的TACA聚糖阵列。
在一些方面,TACA结合配偶体可被用于各种应用中。例如,在一方面,本发明关于用于确定有需要的受试者的疾病状态的方法,该方法包含(a)提供受试者的样品;(b)使样品与一种或多种TACA结合配偶体接触;(c)测量TACA和结合配偶体之间的结合特异性,以及(d)检测肿瘤相关碳水化合物抗原(TACA)的表达水平。
TACA结合配偶体可以被用于例如治疗有需要的患者的治疗剂,例如,具有表达TACA的癌症、肿瘤、新生物或增生的患者。
在一方面,该检测包含检测TACA。在一方面,所述TACA的检测包含使用TACA聚糖阵列。
在一些方面,该方法包含分析样品,该样品选自下列一个或多个:肉瘤、皮肤癌、白血病、淋巴瘤、脑癌、成胶质细胞瘤、肺癌、乳腺癌、口腔癌、头颈癌、鼻咽癌、食道癌、胃癌、肝癌、胆管癌、胆囊癌、膀胱癌、胰腺癌、肠癌、结肠直肠癌、肾癌、子宫颈癌、子宫内膜癌、卵巢癌、睾丸癌、颊癌、口咽癌、喉癌和/或前列腺癌。一方面,该方法包含分析选自乳房、卵巢、肺、胰腺、胃、结肠直肠、前列腺、肝、子宫颈、食管、脑、口腔和/或肾癌中的一种或多种的样品。在一些方面,该方法包含检测乳房、卵巢、肺、胰腺、胃、结肠直肠、前列腺、肝、子宫颈、膀胱、食道、脑、口腔和/或肾癌的一种或多种癌症、新生物、增生。
在一方面,一种或多种疾病状态的特征在于B细胞淋巴瘤、黑素瘤、神经母细胞瘤、肉瘤、非小细胞肺癌(NSCLC)。
在一方面,本发明关于使用本发明的新颖阵列以确定抗肿瘤剂在治疗有需要的受试者的治疗功效的方法,该方法包含:(a)提供来自受试者的样品;(b)使该样品与TACA阵列接触,(c)分析一种或多种TACA或抗体的结合,以及(d)基于该聚糖检测的分析值,确定抗肿瘤剂在新生物治疗中的治疗效果。
在一方面,使用本发明的新颖阵列以在治疗有需要的受试者期间确定抗肿瘤剂的治疗功效的方法,包含:(a)在治疗之前自受试者提供样品;(b)使该样品与TACA阵列接触;(c)分析在处理前TACA结合部分的效价;(d)提供在施用该抗肿瘤剂后该受试者的一个或复数个样品;(e)使该一个或复数个样品与该TACA阵列接触;(f)分析该一个或复数个样品中的TACA效价,以及(g)基于TACA效价的变化,确定该抗肿瘤剂治疗新生物的治疗效果。在一些方面,该TACA结合部分可为抗体。
在一方面,该抗肿瘤剂包含疫苗。该疫苗可以包含与载体蛋白缀合的碳水化合物抗原或碳水化合物免疫原性片段。在一些方面,该碳水化合物抗原或碳水化合物免疫原性片段可包含Globo H、阶段特异性胚胎抗原3(SSEA-3)、阶段特异性胚胎抗原4(SSEA-4)、Tn、TF、sTn、聚唾液酸、Globo H、SSEA-3、SSEA-4、Gb3、Gb4、Le
在一方面,有需要的受试者被怀疑患有下列一种或多种:癌症、新生物或增生。在一方面,该癌症选自以下所组成的组:肉瘤、皮肤癌、白血病、淋巴瘤、脑癌、成胶质细胞瘤、肺癌、乳腺癌、口腔癌、头颈癌、鼻咽癌、食道癌、胃癌、肝癌、胆管癌、胆囊癌、膀胱癌、胰腺癌、肠癌、结肠直肠癌、肾癌、子宫颈癌、子宫内膜癌、卵巢癌、睾丸癌、颊癌、口咽癌、喉癌以及前列腺癌。
使用于本发明的阵列上的聚糖可以包括两个或更多个糖单元。本发明的聚糖可以包括直链和支链寡糖以及天然存在的和合成的聚糖。预期任何类型的糖单元可以存在于本发明的聚糖中,包括阿洛糖、阿卓糖、阿拉伯糖、葡萄糖、半乳糖、古洛糖、岩藻糖、果糖、艾杜糖、来苏糖、甘露糖、核糖、塔罗糖、木糖、神经氨酸或其它糖单元。此类糖单元可以具有各种取代基。例如,可以代替通常存在糖单元上的取代基或除了该取代基外存在的取代基包括氨基、羧基,包括离子羧基及其盐类(例如羧酸钠)、硫醇、叠氮化物、N-乙酰基、N-乙酰神经氨酸、氧基(=O)、唾液酸、硫酸盐(-SO
在另一方面,本发明提供了一种微阵列,其包括固体基质以及在该固体支持物上的多个确定的聚糖位置,每个聚糖位置限定固体支持物的区域,其包含附着到其上的一种类型的聚糖分子的多个拷贝,其中聚糖透过如本文所述的接头附着到微阵列上。这些微阵列可以具有例如约1至约100,000个之间不同的聚糖位置,或约1至约10,000个之间不同的聚糖位置,或约2至约100个之间不同的聚糖位置,或约2至约5个之间不同的聚糖位置。在一些方面,附着到该阵列的聚糖被称为聚糖探针。
在另一方面,本发明提供了鉴定测试分子或测试物质是否可以结合存在于本发明的阵列或微阵列上的聚糖的方法。该方法包括使阵列与测试分子或测试物质接触,并观察测试分子或测试物质是否结合聚糖库中或阵列上的聚糖。在一些方面,本发明关于在如本文所述的库中的测试分子或测试物质。
在另一方面,本发明提供了鉴定测试分子或测试物质可结合哪种聚糖的方法,其中该聚糖存在于本发明的阵列上。该方法包括使阵列与测试分子或测试物质接触,并观察测试分子或测试物质可以结合到阵列上的哪个聚糖。
可以透过改变施加到衍生化聚糖位置的聚糖溶液的浓度来调节每个聚糖位置处的聚糖密度。
本发明的另一方面关于分子阵列,其可以包含透过接头分子附着到阵列的分子库,其中该可切割的接头具有以下结构:
G-A-Z-X 式1
其中G为聚糖;A为包含酯或酰胺的部分;X为基质,例如表面、固体表面、透明固体、非透明固体、选定波长的可见光或不可见光透过的固体、颗粒、阵列、微泡或珠粒、涂覆的基质、涂覆的表面、聚合物表面、硝化纤维素涂覆的表面或珠粒表面;附着到该基质的间隔基团或具有用于将该接头附着到该基质的基团的间隔基团;而且Z为一个或复数个接头,其中该接头可以包含脂质链,具有脂质链的一个或复数个间隔基团。
在一些方面,该阵列包括基质以及在该固体支持物上的多个确定的聚糖探针位置,每个聚糖探针位置下定固体支持物的区域,其具有附着于其上的一种类型的相似聚糖分子的多个拷贝。
在一些方面,A与X之间的相互作用可为共价键、范德华相互作用、氢键、离子键或疏水相互作用。
本发明的另一方面为测试测试样品中的分子是否可以结合分子阵列的方法,该方法可以包含(a)使阵列与测试样品接触,以及(b)观察在该测试样品中的分子是否与附着于该阵列的分子结合。
本发明的另一方面为确定哪些分子结构与测试样品中的生物分子结合的方法,其可以包含使分子阵列与测试样品接触,洗涤阵列和切割可切割接头以允许对附着到阵列的分子的分子结构进行结构或功能分析。例如,该生物分子可为抗体、受体或蛋白质复合物。
本发明的另一个方面是在测试样品中检测癌症(包括乳腺癌)的方法,其包括(a)使测试样品与共价附着到聚糖的接头接触,所述聚糖包括Globo H、SSEA-3、SSEA-4、Le
在一方面,本发明的特征在于具有下式的化合物:
本发明的一般方面
据此,本发明系基于如下的发现,即癌症上的Globo系列抗原可脱落入微环境并渗入T细胞。T细胞活化作用在渗入Globo H神经酰胺或SSEA-4神经酰胺后受抑制。添加抗Globo H抗体或抗SSEA-4抗体以抑制Globo H神经酰胺或SSEA-4神经酰胺渗入T细胞,可抑制Globo H神经酰胺或SSEA-4神经酰胺诱发的免疫抑制。PD-1/PD-L1配合可抑制TCR信号传导途径。将Globo H神经酰胺或SSEA-4神经酰胺添加至T细胞,可进一步抑制TCR信号传导。Globo H神经酰胺或SSEA-4神经酰胺的渗入降低TCR信号传导的发挥作用,其为抗PD-1或抗PD-L1抗体阻断由PD-1/PD-L1结合的抑制作用(亦即,免疫检查点效应)的结果。添加抗Globo H抗体或抗SSEA-4抗体及抗PD-1或抗PD-L1抗体,可协同地逆转由Globo H神经酰胺或SSEA-4神经酰胺及PD-1/PD-L1配合所抑制的TCR信号传导。表达Globo H抗原或SSEA-4抗原的癌症包括但不局限于,肉瘤、皮肤癌、白血病、淋巴瘤、脑癌、胶质母细胞瘤、肺癌、乳腺癌、口腔癌、头颈癌、鼻咽癌、食道癌、胃癌、肝癌、胆道癌、胆囊癌、膀胱癌、胰腺癌、肠癌、结肠直肠癌、肾癌、子宫颈癌、子宫内膜癌、卵巢癌、睾丸癌、颊癌、口咽癌、喉癌、及前列腺癌。
联合疗法中检查点抑制剂的非局限实例的说明
免疫检查点抑制剂为抑制/阻断免疫检查点系统的分子,已成为晚期新生物的有效疗法;这些之中有阻断细胞毒性T淋巴细胞关联性抗原4(CTLA4)与程序性细胞死亡蛋白1(PD-1)的治疗性抗体,其用于数种肿瘤(Topalian SL et al.,Nat Rev Cancer.2016May;16(5):275-87)。PD-1(程序性细胞死亡蛋白,CD279)(B7/CD28受体家族成员之一)为表达在活化型白细胞细胞表面上的单体分子,包括T、B、NK、及髓样衍生型抑制细胞,其表达由遗传与表观遗传机制间之相互作用精确调节。已知的PD-1配体为PD-L1与PD-L2(Farkona S.etal.,BMC Med.2016May 5;14:73)。
PD-L1(程序性细胞死亡蛋白配体1、B7H1、CD274)以低水平表达在造血细胞,包括T、B、髓样、及树突细胞以及非造血细胞(如肺、心脏、内皮、胰岛细胞、角质细胞)及特殊地癌细胞上,且在细胞活化时上调。PD-L2(程序性细胞死亡蛋白配体2、B7-DC、CD273)表达在巨噬细胞、树突细胞(DC)、活化型CD4+与CD8+淋巴细胞、及一些实体瘤(卵巢癌、小细胞肺癌、食道癌)。在正常及癌症相关联的成纤维细胞中亦检测到PD-L1与PD-L2表达。PD-L1及PD-L2两者与额外的受体相互作用:PD-L1与CD28配体CD80,且PD-L2与排斥导向分子(RepulsiveGuidance Molecule;RGM)b,其表达在巨噬细胞与其他细胞型上。PD-1的细胞质尾端含有基于免疫受体酪氨酸的抑制基序(Tyrosine-based Inhibition Motif;ITIM)及基于免疫受体酪氨酸的转换基序(tyrosine-based switch motif;ITSM)。在T淋巴细胞中,PD-1与其配体相互作用造成PD-1的胞内尾端两个酪氨酸的磷酸化;将含有SH2域的蛋白质酪氨酸磷酸酶(SHP-1和/或SHP-2)募集至PD-1的ITSM细胞质区域,接着抑制T细胞受体的下游信号,从而抑制T细胞增殖与细胞因子产生。PD-1对T细胞亦发挥其他作用;举例而言,利用抑制Akt与Ras途径,PD-1触发抑制泛素连接酶组分SKP2的转录:其造成SKP2介导的细胞周期蛋白依赖型激酶抑制剂p27(kip1)的降解受损,从而阻断细胞周期进程。此外,PD-1可藉由一个以上的机制促进凋亡。除了直接抑制T细胞活化以外,利用PD-L1的PD-1触发可诱发T调节细胞(Treg)的发展,T调节细胞为周边耐受性的关键介体,可主动抑制效应子T细胞。利用PD-1触发的Treg诱发藉由调控关键信号传导分子而介导,该关键信号传导分子如磷酸-Akt,其水平由于PD-1诱发的PTEN活性而保持较低。数种类型的癌细胞确实表达PD-L1。此外,在肿瘤微环境中的非新生物细胞(内皮细胞、白细胞、成纤维细胞)亦可表现PD-L1。这显示,其可耐受肿瘤浸润的PD-1+T淋巴细胞(TIL),和/或诱发Treg发展;的确,越来越多证据显示,以抗PD-1/PD-L1单克隆抗体(mAb)治疗患有某些癌症类型(黑素瘤、肾癌、非小细胞肺癌等)的患者可降低肿瘤生长。
目前,有100多项临床试验正在研究PD-1与PD-L1阻断对多种癌症的临床功效。然而,尽管有令人鼓舞的结果,但显而易见的是:a)并非所有肿瘤类型对于抗PD-1或抗PD-L1mAb显示出显著反应,以及b)在反应性癌症的子集合中,并非所有患者皆具有反应性,且有些反应是非常部分的。这些证据以及在研究的现阶段有关反应的持久性的不确定性显示在抗PD-1/PD-L1mAb与作用于其他途径的工具之间,需要有效的治疗组合(Topalian SL etal.Cancer Cell.201 5Apr 13;27(4):450-61)。
已知免疫检查点抑制剂在人体内可提供一些抗肿瘤活性,此种部分抗肿瘤活性仅在一部分接受治疗的受试者中观察到。检查点抑制剂可包括或排除蛋白质、多肽,包括氨基酸残基与单克隆或多克隆抗体。本文所述的组合物可包括一个以上的检查点抑制剂或与一个以上的检查点抑制剂一起施用。在一些实施方案中,检查点抑制剂结合至配体或蛋白质,其可在T细胞调节分子家族中之任一者找到,包括CD28/CTLA-4。检查点抑制剂的靶标可包括或排除表达在免疫系统效应子或调节子细胞(如T细胞)上的受体或共受体(如CTLA-4;CD8);表达在抗原呈现细胞表面上(亦即,表达在活化型T细胞表面上,其可包括或排除PD-1、PD-2、PD-L1、及PD-L2)的蛋白质;代谢酶或由肿瘤与肿瘤浸润细胞表达的代谢酶(如吲哚胺(IDO),包括同种型,如IDO1与IDO2);隶属于免疫球蛋白超家族的蛋白质(如淋巴细胞活化基因3,亦称作LAG3);隶属于B7超家族的蛋白质(如B7-H3或其同源物)。B7蛋白可在活化型抗原呈现细胞与T细胞上发现。在一些实施方案中,可将两个或更多个检查点抑制剂结合或配对。举例而言,在抗原呈现细胞上找到的B7家族检查点抑制剂,可与T细胞表面上表达的CD28或CTLA-4抑制剂配对,产生共抑制性信号,以减少这两类型细胞间的活性。共受体意指位于同一细胞上的两个不同受体的存在,其在与外部配体结合后,可调节内部细胞过程。共受体可为刺激性或抑制性。共受体有时称作辅助受体(accessory receptors)或共信号受体(co-signally receptors)。本文中使用的“共抑制性”术语意指一个以上的分子与细胞表面上其各自受体结合的结果,从而减缓或防止细胞内过程的发生。
在特定实施方案中,免疫检查点抑制剂可包含抑制性受体(其抑制PD-1或CTLA-4途径)的拮抗剂,如抗PD-1、抗PD-L1、或抗CTLA-4抗体或抑制剂。PD-1或PD-L1抑制剂的实例可包括但不局限于,阻断人类PD-1的人源化抗体,如兰博单抗(lambrolizumab)(抗PD-1Ab,商品名Keytruda)或皮立珠单抗(pidilizumab)(抗PD-1Ab)、Bavencio(抗PD-L1 Ab,阿维鲁单抗)、Imfinzi(抗PD-L1 Ab,度伐鲁单抗)、及Tecentriq(抗PD-L1 Ab,阿特珠单抗),以及完全人类抗体,如纳武单抗(抗PD-1Ab,商品名Opdivo)。其他PD-1抑制剂可包括可溶性PD-1配体的呈现,包括但不局限于,PD-L2 Fc融合蛋白,亦称作B7-DC-Ig或AMP-244,及其他目前正在研究中和/或开发用于治疗的PD-1抑制剂。此外,免疫检查点抑制剂可包括但不局限于,阻断PD-L1的人源化或完全人类抗体,如度伐鲁单抗和MIH1,及其他目前正在研究中的PD-L1抑制剂。在一些实施方案中,免疫检查点抑制剂为CTLA-4、PD-L1、或PD-1抗体。在一些实施方案中,PD-1或CTLA-4抑制剂包括但不局限于,阻断人类PD-1的人源化抗体,如兰博单抗(抗PD-1Ab,商品名Keytruda)或皮立珠单抗(抗PD-1Ab)、纳武单抗(抗PD-1Ab,商品名Opdivo)、替西木单抗(ticilimumab)(抗CTLA-4Ab)、伊匹单抗(ipilimumab)(抗CTLA-4Ab)、MPDL3280A、BMS-936559、AMP-224、IMP321(ImmuFact)、MGA271、Indoximod、及INCB024360。
联合疗法
据此,利用抗Globo H抗体清除Globo H神经酰胺结合负面免疫检查点的阻断,可有效克服免疫抑制。发明人的研究结果显示,靶向Globo系列抗原(Globo H或SSEA-4)与抗负面免疫检查点阻断共同、加成、和/或协同作用,以挽救T细胞失活。
因此,本发明的第一个实施方案涉及一种组合,其包含抗Globo H和/或抗SSEA-4抗体或其片段及免疫检查点的至少一种抑制剂。在某些特定实施方案中,免疫检查点抑制剂为抗负面免疫检查点抗体。
本发明提供用于有抗肿瘤免疫治疗需求的受试者的联合疗法的方法,其中受试者需要经由增进或增加的检查点抑制剂调控增加的功效或改进的肿瘤反应。
在一方面中,联合疗法同时或依序施用,不论是单独的单一治疗配制剂或结合的共同配制剂。为了达到最大治疗功效,施用顺序可为交错的或嵌套的。在一方面中,治疗剂为疫苗,且检查点抑制剂为PD-1抑制剂。
在一方面中,利用1)T细胞抗肿瘤活性的增加、肿瘤消退或肿瘤体积缩小或肿瘤坏死的增加,以增进治疗功效。在特定实施方案中,该检查点抑制剂为PD-1、PD-L1、或CTLA-4检查点抑制剂。
实施例
实施例1.Globo H或SSEA-4从各种癌细胞脱落入人类CD3+ T细胞的证明
将人类癌细胞系(HCC1428、MDA-MB-231、SKOV-3、ACHN、或NCI-H526;全部皆购自ATCC,Manassas,VA)接种于含有ATCC个别建议的完全生长培养基的24孔培养盘中,并在37℃与5%CO
实施例2.通过Globo系列鞘糖脂(glycosphingolipids)抑制T细胞活化的证明
将Jurkat/NFAT-Re Luc细胞(Promega,Inc.,Cat#G7102)在有或无各种浓度的化学合成的Globo H神经酰胺(GHCer)或SSEA-4神经酰胺(SSEA4Cer)的情况下在48孔培养盘中预温育18–24小时。收集细胞,并移至在37℃培养箱中以抗人类CD3(100ng/孔)(BioLegend,Inc.,Cat#317326)和抗人类CD28(300ng/孔)(BioLegend,Inc.,Cat#302914)涂布过夜的白色平底96孔试验培养盘(Greiner Bio-One GmbH,Cat#655073)以活化6小时。将试验培养盘从培养箱中移开,并平衡15分钟至室温(22–25℃)。将75μL的Bio-Glo
实施例3.利用抗Globo H抗体逆转Globo H神经酰胺诱发的T细胞失活的证明
在37℃将40、20、及5μM GHCer与10μM OBI-888(抗Globo H抗体)温育于含有RPMI-1640培养基(Life Technologies,Cat#A1049101)与0.5%超低IgG胎牛血清(Hyclone,Cat#SH30898.03)的试验培养基中3小时。样本以5000xg离心5分钟且收取上清液,并与Jurkat/NFAT-Re Luc细胞一起温育18-24小时。收集细胞,并移至在37℃培养箱中以抗人类CD3(100ng/孔)和抗人类CD28(300ng/孔)涂布过夜的白色平底96孔试验培养盘以活化6小时。将试验培养盘从培养箱中移开,并平衡15分钟至室温(22–25℃)。将75μL的Bio-Glo
实施例4.利用抗SSEA-4抗体逆转SSEA-4神经酰胺诱发的T细胞失活的证明
在37℃将40、20、及10μM SSEA4Cer与5μM OBI-898(抗SSEA-4抗体)温育于含有RPMI-1640培养基(Life Technologies,Cat#11875093)与0.1%超低IgG胎牛血清(Hyclone,Cat#SH30898.03)的试验培养基中5小时。样本以7000xg离心5分钟两次且收取上清液,并与Jurkat/NF-κB-Re Luc细胞(Signosis,Inc.,Cat#SL-0050-NP)一起培养18-24小时。收集细胞,并移至在37℃培养箱中以抗人类CD3(100ng/孔)和抗人类CD28(300ng/孔)涂布过夜的白色平底96孔试验培养盘以活化6小时。将试验培养盘从培养箱中移开,并平衡15分钟至室温(22–25℃)。将75μL的Bio-Glo
实施例5.Globo系列鞘糖脂及PD-1/PD-L1配合的协同反应在增进对TCR信号传导的抑制作用的证明
将各种浓度的GHCer或SSEA4Cer与PD-1效应子细胞(PD-1/PD-L1BlockadeBioassay Kit,Promega,Cat#J3011)一起温育,之后在37℃下温育24小时。将PD-L1+靶标细胞(PD-1/PD-L1 Blockade Bioassay Kit,Promega,Cat#J3011)接种于96孔培养盘中,并在37℃与5%CO
实施例6.Globo H神经酰胺降低Keytruda或Tecentriq缓解的PD-1/PD-L1配合抑制的TCR信号传导
将40μM GHCer与PD-1效应子细胞(PD-1/PD-L1 Blockade Bioassay Kit,Promega,Cat#J3011)一起温育,之后在37℃与5%CO
实施例7.SSEA-4神经酰胺降低Keytruda或Tecentriq缓解的PD-1/PD-L1配合抑制的TCR信号传导
将40μM SSEA4Cer与PD-1效应子细胞(PD-1/PD-L1 Blockade Bioassay Kit,Promega,Cat#J3011)一起温育,之后在37℃与5%CO
实施例8.利用抗Globo H抗体组合Keytruda或Tecentriq抗体逆转Globo H神经酰胺及PD-1/PD-L1配合抑制的TCR信号传导
在37℃将GHCer与10μM OBI-888温育于含有99%RPMI 1640/1%FBS(PD-1/PD-L1Blockade Bioassay Kit,Promega,Cat#J3011)的试验培养基中4小时。样本以8000xg离心5分钟两次且收取上清液,并与PD-1效应子细胞一起温育24小时。将PD-L1+靶标细胞接种于96孔培养盘中,并在37℃与5%CO
实施例9.利用抗SSEA-4抗体结合Keytruda或Tecentriq抗体逆转SSEA-4神经酰胺及PD-1/PD-L1配合抑制的TCR信号传导
在37℃将SSEA4Cer与5μM OBI-898温育于试验培养基中4小时。样本以8000xg离心5分钟两次且收取上清液,并与PD-1效应子细胞一起温育24小时。将PD-L1+靶标细胞接种于96孔培养盘中,并在37℃与5%CO
除非另有定义,否则本文中使用的所有技术性与科学性术语以及任何缩写字具有与本发明领域普通技术人员通常能理解的相同含义。尽管可使用与本文所述的这些类似或等同的传达信息的任何组合物、方法、试剂盒、及工具以实践本发明,但用于传达信息的优选组合物、方法、试剂盒、及工具如本文所述。
本文引用的所有参考文献皆在法律允许范围内并入本案以作为参考资料。这些参考文献的讨论仅旨在总结其作者提出的主张。不承认任何参考文献(或任何参考文献之一部分)与先前技术相关。申请人保留质疑任何所引用参考文献的准确性与相关性的权利。
- 通过使用抗Globo H或抗SSEA-4抗体与抗负面免疫检查点抗体的联合疗法
- 使用抗EGFR抗体和抗激素剂的联合疗法
