一种靶向HER2的CAR-T表达载体及其构建和应用
文献发布时间:2023-06-19 09:58:59
技术领域
本发明涉及生物技术和医学技术领域,更具体的说是涉及一种表达PD1CD28嵌合分子、靶向HER2的CAR-T表达载体及其构建和应用。
背景技术
人表皮生长因子受体2(HER2)是一种受体酪氨酸蛋白激酶,其过表达对于肿瘤的发生、发展与转移起着关键性作用。自1998年FDA批准曲妥珠单抗以来,特异性单克隆抗体治疗改变了HER2阳性肿瘤的治疗,在化疗中加入曲妥珠单抗可降低死亡率延长生存期,并降低20%的死亡风险。然而,一些HER2阳性肿瘤患者用药后并没有取得良好效果或者渐渐产生耐药反应;因此,需要进一步研究新的方法来治疗HER2过表达的肿瘤患者。
嵌合抗原受体(CAR)T细胞治疗对肿瘤的杀伤因不受MHC的限制,并可克服肿瘤局部免疫抑制微环境,打破宿主免疫耐受状态,在治疗肿瘤方面具有独特的优势。研究表明,HER2在人类正常机体组织中不表达或微量表达,而30%以上的肿瘤组织中会过量表达,且位于细胞表面,易被抗体识别,可作为肿瘤特异性CAR-T细胞治疗的理想靶点。CAR-T细胞通过靶向识别肿瘤细胞表面抗原,特异性杀伤肿瘤细胞目前在血液肿瘤中取得了较好的临床效果,但在实体瘤治疗中面临诸多挑战。实体肿瘤内免疫抑制性的微环境及其他机制和因素抑制CAR-T细胞的激活和功能。因此,如何减少CAR-T细胞在免疫抑制性微环境中的失能,增强其抗肿瘤能力,对实体肿瘤的细胞免疫疗法具有重要意义。
发明内容
有鉴于此,本发明提供了一种靶向HER2的CAR-T表达载体,其包含PD1胞外区(PD1信号肽、PD1胞外域)、CD28的跨膜域和CD28胞质信号域(活化信号),通过构建HER2/PD-1/CD28 CAR结构,使用CD28胞内活化基因序列取代PD-1胞内介导抑制信号的结构域,在PD1与其肿瘤高表达的相应配体PD-L1结合时,介导活化信号,而非抑制性信号,使T细胞充分活化,增强T淋巴细胞对肿瘤细胞的杀伤,从而提高CAR-T免疫疗法抗肿瘤效果。
为了实现上述目的,本发明采用如下技术方案:
一种靶向HER2的CAR-T表达载体,包含靶向HER2的嵌合抗原受体基因序列;
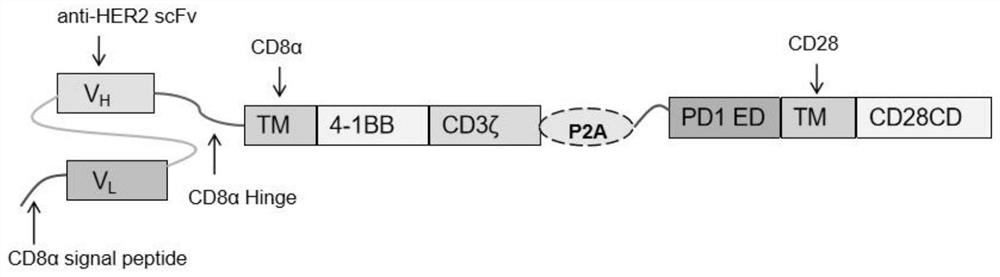
靶向HER2的嵌合抗原受体包括依次连接的:CD8α信号肽、靶向HER2的单链抗体、CD8α铰链区、CD8α跨膜区、共刺激因子4-1BB、CD3ζ胞内信号肽、P2A连接肽、PD1信号肽、PD1胞外域、CD28跨膜域以及CD28胞质信号域。
PD-1/PDL1信号通路会抑制CAR-T细胞的激活和功能,本申请在CAR-T表达载体中引入PD1信号肽、PD1胞外域、CD28跨膜域以及CD28胞质信号域,将PD-L1与PD-1结合诱发的T细胞抑制性信号转换为CD28传递的活化信号,可减少CAR-T细胞在免疫抑制性微环境中的失能,从而增强其抗肿瘤能力。
优选地,CD8α信号肽核苷酸序列如SEQ ID NO.1所示;
靶向HER2的单链抗体轻链VL核苷酸序列如SEQ ID NO.2所示;
靶向HER2的单链抗体铰链Linker核苷酸序列如SEQ ID NO.3所示;
靶向HER2的单链抗体重链VH核苷酸序列如SEQ ID NO.4所示;
CD8α铰链区核苷酸序列如SEQ ID NO.5所示;
CD8α跨膜区核苷酸序列如SEQ ID NO.6所示;
共刺激因子4-1BB核苷酸序列如SEQ ID NO.7所示;
CD3ζ胞内信号肽核苷酸序列如SEQ ID NO.8所示;
P2A连接肽核苷酸序列如SEQ ID NO.9所示;
PD1信号肽核苷酸序列如SEQ ID NO.10所示;
PD1胞外域核苷酸序列如SEQ ID NO.11所示;
CD28跨膜域核苷酸序列如SEQ ID NO.12所示;
CD28胞质信号域核苷酸序列如SEQ ID NO.13所示。
一种靶向HER2的CAR-T表达载体的构建方法,以靶向HER2的嵌合抗原受体基因为目的基因,利用重组慢病毒包装系统,构建获得靶向HER2的CAR-T表达载体。
一种CAR-T细胞,使用上述CAR-T表达载体转导T淋巴细胞获得。
上述CAR-T表达载体或CAR-T细胞在制备抗肿瘤药物中的应用。
优选地,上述肿瘤为HER2过表达肿瘤。
优选地,上述肿瘤包括HER2阳性乳腺癌。
由上述技术方案可知,本发明构建了一种能够表达PD1CD28嵌合分子、靶向HER2的CAR-T表达载体,将其转导T淋巴细胞获得的CAR-T细胞对HER2阳性肿瘤细胞具有显著的抑制效果。
附图说明
图1A所示为靶向HER2的嵌合抗原受体CAR-Her2-PD1CD28示意图。
图1B所示为靶向HER2的嵌合抗原受体CAR-Her2示意图。
图2A所示为Lv-CAR-HER2-PD1CD28重组慢病毒质粒示意图。
图2B所示为Lv-CAR-HER2重组慢病毒质粒示意图。
图3所述为根据ALB及LTR基因绘制的标准曲线。
图4所示为流式细胞仪检测识别HER2的单链抗体在T细胞表面的表达。
图5所示为流式细胞仪检测PD1在T细胞表面的表达。
图6所示为靶细胞MCF7、SH-SY5Y表面HER2及PDL1的表达情况。
图7A所示为CAR-T细胞与HER2高表达靶细胞MCF7共孵育后的杀伤结果。
图7B所示为CAR-T细胞与不表达HER2抗原的靶细胞SH-SY-5Y共孵育后的杀伤结果。
图8A所示为CAR-T细胞与靶细胞共孵育后胞内因子TNF-α表达情况。
图8B所示为CAR-T细胞与靶细胞共孵育后胞内因子IFN-γ表达情况。
图9A所示为ELISA检测靶细胞与CAR-T细胞共培养后上清中细胞因子IL-2的分泌水平。
图9B所示为ELISA检测靶细胞与CAR-T细胞共培养后上清中细胞因子TNF-α的分泌水平。
图9C所示为ELISA检测靶细胞与CAR-T细胞共培养后上清中细胞因子IFN-γ的分泌水平。
图10A所示为体内抗肿瘤实验输注不同T细胞治疗后各组小鼠肿瘤体积的大小;
其中,左图为NT组,中图为CART-HER2组,右图为CART-HER2-PD1CD28组。
图10B所示为体内抗肿瘤实验终止时各组小鼠的肿瘤组织。
图11A所示为NT细胞治疗组的肿瘤组织淋巴细胞浸润结果。
图11B所示为CART-HER2细胞治疗组的肿瘤组织淋巴细胞浸润结果。
图11C所示为CART-HER2-PD1CD28细胞治疗组的肿瘤组织淋巴细胞浸润结果。
图12所示为输注NT、CART-HER2、CART-HER2-PD1CD28细胞治疗乳腺肿瘤模型小鼠的生存曲线。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1构建靶向HER2的CAR重组表达载体
1.构建靶向HER2的嵌合抗原受体基因序列
(1)如图1A所示,包含PD1CD28嵌合分子的嵌合抗原受体CAR-Her2-PD1CD28,包括依次连接的:CD8α信号肽(CD8αsignal peptide)、靶向HER2的单链抗体(anti-HER2 scFv)、CD8α铰链区(CD8αHinge)、CD8α跨膜区(CD8αTM)、共刺激因子4-1BB、CD3ζ胞内信号肽(CD3ζsignal)、P2A连接肽、PD1信号肽、PD1胞外域、CD28跨膜域(CD28TM)以及CD28胞质信号域(CD28CD);
CD8α信号肽核苷酸序列如SEQ ID NO.1所示:ATGGCCTTACCAGTGACCGCCTTGCTCCTGCCGCTGGCCTTGCTGCTCCACGCCGCCAGGCCG;
靶向HER2的单链抗体轻链VL核苷酸序列如SEQ ID NO.2所示:GACATCCAGATGACCCAGTCTCCGTCTTCTCTGTCTGCTTCTGTTGGTGACCGTGTTACCATCACCTGCCGTGCTTCTCAGGACGTTAACACCGCTGTTGCTTGGTACCAGCAGAAACCGGGTAAAGCTCCGAAACTGCTGATCTACTCTGCTTCTTTCCTGTACTCTGGTGTTCCGTCTCGTTTCTCTGGTTCTCGTTCTGGTACCGACTTCACCCTGACCATCTCTTCTCTGCAGCCGGAAGACTTCGCTACCTACTACTGCCAGCAGCACTACACCACCCCGCCGACCTTCGGTCAGGGTACCAAAGTTGAAATCAAA;
靶向HER2的单链抗体铰链Linker核苷酸序列如SEQ ID NO.3所示:GGTGGCGGTGGCTCGGGCGGTGGTGGGTCGGGTGGCGGCGGATCT;
靶向HER2的单链抗体重链VH核苷酸序列如SEQ ID NO.4所示:GAAGTTCAGCTGGTTGAATCTGGTGGTGGTCTGGTTCAGCCGGGTGGTTCTCTGCGTCTGTCTTGCGCTGCTTCTGGTTTCAACATCAAAGACACCTACATCCACTGGGTTCGTCAGGCTCCGGGTAAAGGTCTGGAATGGGTTGCTCGTATCTACCCGACCAACGGTTACACCCGTTACGCTGACTCTGTTAAAGGTCGTTTCACCATCTCTGCTGACACCTCTAAAAACACCGCTTACCTGCAGATGAACTCTCTGCGTGCTGAAGACACCGCTGTTTACTACTGCTCTCGTTGGGGTGGTGACGGTTTCTACGCTATGGACTACTGGGGTCAGGGTACCCTGGTTACCGTTTCTTCT;
CD8α铰链区核苷酸序列如SEQ ID NO.5所示:ACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGAT;
CD8α跨膜区核苷酸序列如SEQ ID NO.6所示:ATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGC;
共刺激因子4-1BB核苷酸序列如SEQ ID NO.7所示:AAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTG;
CD3ζ胞内信号肽核苷酸序列如SEQ ID NO.8所示:AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC;
P2A连接肽核苷酸序列如SEQ ID NO.9所示:GCAACAAACTTCTCTCTGCTGAAACAAGCCGGAGATGTCGAAGAGAATCCTGGACCG;
PD1信号肽核苷酸序列如SEQ ID NO.10所示:ATGCAGATCCCACAGGCGCCCTGGCCAGTCGTCTGGGCGGTGCTACAACTGGGCTGGCGG;
PD1胞外域核苷酸序列如SEQ ID NO.11所示:CCAGGATGGTTCTTAGACTCCCCAGACAGGCCCTGGAACCCCCCCACCTTCTCCCCAGCCCTGCTCGTGGTGACCGAAGGGGACAACGCCACCTTCACCTGCAGCTTCTCCAACACATCGGAGAGCTTCGTGCTAAACTGGTACCGCATGAGCCCCAGCAACCAGACGGACAAGCTGGCCGCCTTCCCCGAGGACCGCAGCCAGCCCGGCCAGGACTGCCGCTTCCGTGTCACACAACTGCCCAACGGGCGTGACTTCCACATGAGCGTGGTCAGGGCCCGGCGCAATGACAGCGGCACCTACCTCTGTGGGGCCATCTCCCTGGCCCCCAAGGCGCAGATCAAAGAGAGCCTGCGGGCAGAGCTCAGGGTGACAGAGAGAAGGGCAGAAGTGCCCACAGCCCAC;
CD28跨膜域核苷酸序列如SEQ ID NO.12所示:TGTCCAAGTCCCCTATTTCCCGGACCTTCTAAGCCCTTTTGGGTGCTGGTGGTGGTTGGTGGAGTCCTGGCTTGCTATAGCTTGCTAGTAACAGTGGCCTTTATTATTTTCTGGGTG;
CD28胞质信号域核苷酸序列如SEQ ID NO.13所示:AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCCTAA。
(2)如图1B所示,普通靶向HER2的嵌合抗原受体CAR-Her2,包括依次连接的:CD8α信号肽、靶向HER2的单链抗体(HER2 scFv)、CD8α铰链区(CD8αHinge)、CD8α跨膜区(CD8αTM)、共刺激因子4-1BB、CD3ζ胞内信号肽(CD3ζsignal);核苷酸序列同SEQ ID NO.1-SEQ IDNO.8所示。
2.构建重组慢病毒质粒
将步骤1中设计的基因序列插入至慢病毒骨架质粒中的EcoRI和BamH1酶切位点之间,分别记为Lv-CAR-Her2-PD1CD28、Lv-CAR-Her2;将重组慢病毒质粒于所设计基因序列两端的酶切位点使用限制性内切酶进行双酶切后,进行SDS-PAGE电泳,选择与设计酶切片段一致大小的片段区域进行胶回收,经测序鉴定获得序列正确的阳性克隆质粒,成功构建如图2A所示的Lv-CAR-Her2-PD1CD28和如图2B所示的Lv-CAR-Her2质粒;依照DH5α感受态大肠杆菌(生工,Cat#B528413)说明书,将阳性克隆质粒与DH5α感受态大肠杆菌混合,加入不含抗生素的LB液体培养基培养,制备成原始菌液并接种至100mL的Amp抗性的LB培养基中,37℃摇床200rpm过夜,第二天收获菌液进行质粒抽提,检测质粒纯度和浓度,-20℃备用。
3.慢病毒制备及滴度检测
(1)慢病毒制备:消化293T细胞,使用含有10%FBS的DMEM培养基重悬混匀后以5*10
(2)滴度检测:
消化293T细胞,使用完全培养基重悬混匀后以5*10
准备荧光定量PCR所需的标准曲线样品:取pUC-LTR质粒(携带LTR基因的质粒)和pUC-ALB质粒(携带ALB基因的质粒),分别进行10倍稀释。
按照表1所示的PCR反应体系,制备PCR反应预混液。
表1
其中,所用引物的序列及荧光基团表2所示。
表2
取一块新的96孔PCR反应板,按照每孔加入5μL基因组样品或标准曲线样品,然后向每孔加入15μL上述制备的PCR反应预混液,使用封膜密封后,短暂离心1分钟,根据表3中的PCR程序进行PCR反应。
表3
PCR反应结束后,使用Roche 480的配套软件获取标准曲线样品的Ct值及基因组样品的Ct值;以标准曲线样品Ct值为纵坐标,以拷贝数的Log值为横坐标,得标准曲线(图3);基因组样品Ct值如表4所示。
表4
根据标准曲线及基因组样品的Ct值(平均值)计算基因组样品的拷贝数;并根据以下公式计算病毒的滴度:CAR-Her2组慢病毒滴度为1.2×10
式中,Copy
CopyALB为根据ALB标准曲线计算的基因组样品拷贝数;
Cell
Volume
实施例2靶向HER2 CAR-T细胞的制备
1.T淋巴细胞的分离分选及激活
(1)CD3/CD28抗体包被:取6mL PBS至离心管中,加入10μg/mLCD3抗体、10μg/mLCD28抗体重悬混匀后转移至T75瓶中,拧紧瓶盖,水平晃动瓶身,使瓶底被液体完全覆盖,用封口膜封口后4℃冰箱孵育过夜备用。
(2)分离获得PBMC细胞:取志愿者外周血25mL至离心管中,向离心管加入等量的PBS稀释血细胞,得到血细胞稀释液。取2个新的离心管各加入15mL淋巴细胞分离液(GEHealthcare,Cat#17-5442-02),小心加入血细胞稀释液25mL于上层,800g,20min,升1降1,20℃离心;移液管吸取中间白膜层至新的离心管中,PBS洗涤一次后重悬混匀,即得PBMC细胞重悬液,取少量PBMC细胞计数。
(3)CD3磁珠分选获得T细胞:PBMC细胞重悬液吸弃上清,根据PBMC计数结果,以80μL/10
(4)T细胞激活:T细胞重悬液吸弃上清,根据T细胞计数结果,加入T细胞培养基(X-VIVO 15+5%FBS+10ng/ml IL-2+5ng/ml IL-15)调整细胞密度为1×10
2.慢病毒转导T淋巴细胞
取激活后的T细胞计数,用T细胞培养基调整细胞密度,以5×10
实施例3靶向HER2 CAR-T细胞的体外功能学检测
1.流式检测CAR转导效率
细胞扩增培养4天后,分别取NT(未经慢病毒转导的T淋巴细胞)、CART-HER2、CART-HER2-PD1CD28细胞各1×10
2.流式检测CAR-T细胞的PD1表达情况
细胞培养4天后,分别取NT(未经慢病毒转导的T淋巴细胞)、CART-HER2、CART-HER2-PD1CD28细胞各1×10
3.CAR-T细胞体外杀伤肿瘤效果
(1)收集效应细胞:NT(未经慢病毒转导的T淋巴细胞)、CART-HER2、CART-HER2-PD1CD28细胞,分别用PBS洗涤两遍,1200rpm 5min离心,分别用杀伤培养基(1640+4%FBS)重悬细胞,取少量细胞计数后调整细胞密度为2×10
(2)收集靶细胞:取市售的HER2、PDL1高表达细胞MCF7及不表达HER2的SH-SY5Y细胞(流式检测靶细胞的表型检测结果如图6所示),用PBS洗涤两遍,1200rpm 5min离心,分别用杀伤培养基重悬细胞,取少量细胞计数后调整细胞密度为2×10
(3)实验组:分别将效应细胞悬液与靶细胞悬液各取50μL加于96孔板中共孵育,总体系为100μL,每组三复孔,组别为10:1、5:1、2.5:1、1:1、0.5:1组;
(5)设置对照组:靶细胞自发释放(靶细胞50μL+50μL杀伤培养基);靶细胞最大释放(靶细胞50μL+50μL杀伤培养基);效应细胞自发释放(效应细胞50μL+50μL杀伤培养基);背景(杀伤培养基100μL);体积校正对照组(杀伤培养基100μL);
(6)将铺板后的96孔板用封口膜封口,放于水平离心机250g离心5min,于37℃5%CO
(7)靶细胞最大释放组及体积校正对照组每孔分别加入10μL10X Lysis Solution(Promega,Cat#G182A),将96孔板放于培养箱继续培养45min后,用封口膜封口,250g水平离心5min;
(8)根据LDH检测试剂盒说明书(Promega,Cat#G1780)准备一个新的96孔板,每孔加入50μL离心后获得的细胞杀伤上清液,同时加入50μL LDH检测底物溶液(避光操作),室温避光孵育10min;每孔添加50μL终止溶液,酶标仪检测492nm的吸光值;
(10)结果统计:所有的实验组、效应细胞自发释放组、靶细胞自发释放组的吸收值应减去背景平均吸收值;
靶细胞最大释放组的吸收值应减去体积校正对照组的平均吸收值;
校正后的值用于杀伤率的统计:
细胞杀伤率(%)=[(实验组释放-效应细胞自发释放-靶细胞自发释放)/(靶细胞最大释放-靶细胞自发释放)]×100%
计算得到的杀伤效率如图7A、7B所示,图7A显示NT细胞对HER2阳性靶细胞MCF7基本无杀伤作用,CART-HER2-PD1CD28细胞和CART-HER2细胞对靶细胞MCF7均有显著杀伤效果;图7B显示对于HER2抗原不表达的SH-SY-5Y细胞,离体培养的NT、CARTT-HER2、CART-HER2-PD1CD28与该靶细胞共培养后LDH检测结果显示均无杀伤效果,说明CAR-T细胞特异性靶向HER2抗原。
4.流式检测CAR-T细胞与靶细胞共培养后胞内因子TFN-α、IFN-γ表达情况
(1)收集效应细胞:NT(未经慢病毒转导的T淋巴细胞)、CART-HER2、CART-HER2-PD1CD28细胞,分别用PBS洗涤两遍,1200rpm 5min离心,分别用杀伤培养基(1640+4%FBS)重悬细胞,取少量细胞计数后调整细胞密度为4×10
(2)收集靶细胞:取市售的HER2高表达细胞MCF7及不表达HER2的SH-SY5Y细胞,用PBS洗涤两遍,1200rpm 5min离心,分别用杀伤培养基重悬细胞,取少量细胞计数后调整细胞密度为4×10
(3)分别将上述效应细胞及靶细胞悬液各取250μL加于24孔板中,每孔加入阻断剂(ebioscience,Cat#00-4980-03)各1μL,重悬混匀后37℃5%CO
(4)分别收集上述共孵育的细胞样本,PBS洗涤两次,1500rpm 5min离心后弃除上清液;各加入100μL抗体孵育液及3μL CD3-FITC抗体重悬混匀表染细胞样本,室温孵育15min;再加入500μL/管1X Fixation/Permeabilization Concentrate,4℃下对细胞进行破膜处理40min;再加入1mL/管1X PermeabilizationBuffer,500g离心5min后弃除上清液;再加入100μL抗体孵育液及anti human TNFα-APC抗体和anti human IFNγ-PE抗体各3μL,重悬混匀后4℃孵育30min;加入1mL/管1X Permeabilization Buffer,500g离心5min(设置空白对照组及单染组调节补偿:不加任何抗体的细胞为空白对照组;单染组分别为CD3-FITC单染细胞组、TNFα-APC单染细胞组、IFNγ-PE单染细胞组),100μLPBS重悬后流式检测CD3+TNF-α+/CD3+IFN-γ+表达情况。
流式检测结果如图8A、8B所示,结果显示NT细胞与靶细胞共孵育(分别记为NT-MCF7、NT-L929)后均不表达TNF-α和IFN-γ;CART-HER2-PD1CD28细胞和CART-HER2细胞与靶细胞MCF7共孵育(分别记为CART-PD1CD28-MCF7、CART-MCF7)后均表达TNF-α和IFN-γ,说明CAR-T细胞特异性识别HER2抗原的靶细胞MCF7,且CART-HER2-PD1CD28细胞表达水平明显高于CART-HER2细胞,说明嵌合PD1CD28分子后的CAR-T细胞体外抗肿瘤活性高于常规靶向HER2的CAR-T细胞。
5.ELISA法检测CAR-T细胞与靶细胞共培养后细胞因子IL-2、TFN-α、IFN-γ分泌情况
(1)收集效应细胞:NT(未经慢病毒转导的T淋巴细胞)、CART-HER2、CART-HER2-PD1CD28细胞,分别用PBS洗涤两遍,1200rpm 5min离心,分别用杀伤培养基(1640+4%FBS)重悬细胞,取少量细胞计数后调整细胞密度为1×10
(2)收集靶细胞:取市售的HER2高表达细胞MCF7,用PBS洗涤两遍,1200rpm 5min离心,分别用杀伤培养基重悬细胞,取少量细胞计数后调整细胞密度为2×10
(3)将效应细胞及靶细胞悬液分别取250μL加于24孔板中共孵育,总体系为500μL,效靶比为5:1,放于37℃5%CO
(4)取出已包被抗体(IFN-γ、IL-2、TNF-α,均购自达优公司)的酶标板,100μL/well加入稀释后的Cytokine standard至标准品孔,100μL/well加入样本至样本孔,100μL/well加入Dilutionbuffer R(1×)至空白对照孔;
(5)加检测抗体:50μL/well加入Biotinylated antibody工作液;混匀后盖上封板膜,室温孵育1h;
(6)洗板:扣去孔内液体,300μL/well加入1×Washing buffer工作液;停留1分钟后弃去孔内液体;重复3次,每一次在滤纸上扣干;
(7)加酶:100μL/well加入Streptavidin-HRP工作液;盖上封板膜,室温孵育20min;
(8)洗板:重复步骤(6);
(9)显色:100μL/well加入TMB,室温避光孵育5-30min,根据孔内颜色的深浅(深蓝色)来判定终止反应,迅速加入100μL/well Stop solution终止反应。15min内用酶标仪在450nm波长处测定OD值,根据标准品标准曲线计算样本中IFN-γ、TNF-α、IL-2细胞因子水平,检测结果如图9A、9B、9C所示。
根据结果可知,靶向HER2的CAR-T细胞可以特异性地识别HER2+的MCF7肿瘤细胞,并大量分泌IL-2(图9A)、TNF-α(图9B)、IFN-γ(图9C);且与靶细胞共孵育的CART-HER2-PD1CD28细胞表达水平明显高于CART-HER2细胞,而无靶向性的NT细胞与靶细胞共孵育后基本检测不出细胞因子分泌。结果表明,CART-HER2细胞可以特异性的识别HER2+的肿瘤细胞;将PD-L1与PD-1结合诱发的T细胞抑制性信号转换为CD28传递的活化信号后显著提高CAR-T细胞对肿瘤的细胞活化及杀伤因子分泌,提高抗肿瘤效果。
实施例4靶向HER2 CAR-T细胞的体内抗肿瘤检测
1.评估靶向HER2的CAR-T细胞的小鼠体内杀伤肿瘤情况
给每只重度免疫缺陷的雌性B-NDG小鼠(订购于百奥赛图公司)乳房垫处皮下注射2×10
结果如图10A、10B所示;从图10A可以看出因NT细胞无靶向性,无法抑制肿瘤的生长,肿瘤体积越来越大;经靶向HER2的CART-HER2、CART-HER2-PD1CD28细胞治疗组的小鼠乳腺肿瘤得到了明显的抑制,且CART-HER2-PD1CD28细胞阻止PD-1与PD-L1的相互作用,体内抗肿瘤效果明显高于CART-HER2组;图10B为小鼠解剖后取下的各组肿瘤,进一步证实PD1CD28优化后的CAR-T细胞体内杀伤肿瘤效果更好。
2.评估输注CAR-T细胞后淋巴细胞对小鼠肿瘤的浸润情况
经上述实验取出的各组肿瘤组织固定于4%多聚甲醛中,分别对NT、CART-HER2、CART-HER2-PD1CD28三组实验肿瘤进行石蜡包埋切片,组织切片经脱蜡抗原修复后分别用T细胞marker CD3抗体进行抗体孵育,确定回输的T细胞是否进入肿瘤组织抑制肿瘤的生长。
结果如图11A、11B、11C所示,结果表明经PD1CD28改造后的靶向HER2的CAR-T细胞比NT、CART-HER2细胞更易进入肿瘤组织对肿瘤细胞的生长起到显著抑制作用,进一步表明PD1CD28嵌合分子将PDL1结合的抑制信号转化为激活信号促进T淋巴细胞浸入肿瘤组织杀伤肿瘤细胞。
3.评估靶向HER2的CART细胞治疗小鼠乳腺肿瘤的生存期情况
给每只小鼠乳房垫处皮下注射2×10
从图12可以看出经PD1CD28嵌合分子后靶向HER2的嵌合抗原受体T细胞使得小鼠在培养90天时存活率还高于50%以上,远远超过NT组和CART-HER2组。表明经过本方法制备的靶向HER2的嵌合抗原受体T细胞能够更好的保护小鼠免于因肿瘤导致的死亡。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
序列表
<110> 中国医学科学院基础医学研究所
<120> 一种靶向HER2的CAR-T表达载体及其构建和应用
<160> 13
<170> SIPOSequenceListing 1.0
<210> 1
<211> 63
<212> DNA
<213> Artificial
<400> 1
atggccttac cagtgaccgc cttgctcctg ccgctggcct tgctgctcca cgccgccagg 60
ccg 63
<210> 2
<211> 321
<212> DNA
<213> Artificial
<400> 2
gacatccaga tgacccagtc tccgtcttct ctgtctgctt ctgttggtga ccgtgttacc 60
atcacctgcc gtgcttctca ggacgttaac accgctgttg cttggtacca gcagaaaccg 120
ggtaaagctc cgaaactgct gatctactct gcttctttcc tgtactctgg tgttccgtct 180
cgtttctctg gttctcgttc tggtaccgac ttcaccctga ccatctcttc tctgcagccg 240
gaagacttcg ctacctacta ctgccagcag cactacacca ccccgccgac cttcggtcag 300
ggtaccaaag ttgaaatcaa a 321
<210> 3
<211> 45
<212> DNA
<213> Artificial
<400> 3
ggtggcggtg gctcgggcgg tggtgggtcg ggtggcggcg gatct 45
<210> 4
<211> 360
<212> DNA
<213> Artificial
<400> 4
gaagttcagc tggttgaatc tggtggtggt ctggttcagc cgggtggttc tctgcgtctg 60
tcttgcgctg cttctggttt caacatcaaa gacacctaca tccactgggt tcgtcaggct 120
ccgggtaaag gtctggaatg ggttgctcgt atctacccga ccaacggtta cacccgttac 180
gctgactctg ttaaaggtcg tttcaccatc tctgctgaca cctctaaaaa caccgcttac 240
ctgcagatga actctctgcg tgctgaagac accgctgttt actactgctc tcgttggggt 300
ggtgacggtt tctacgctat ggactactgg ggtcagggta ccctggttac cgtttcttct 360
<210> 5
<211> 135
<212> DNA
<213> Artificial
<400> 5
accacgacgc cagcgccgcg accaccaaca ccggcgccca ccatcgcgtc gcagcccctg 60
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 120
gacttcgcct gtgat 135
<210> 6
<211> 72
<212> DNA
<213> Artificial
<400> 6
atctacatct gggcgccctt ggccgggact tgtggggtcc ttctcctgtc actggttatc 60
accctttact gc 72
<210> 7
<211> 126
<212> DNA
<213> Artificial
<400> 7
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 120
gaactg 126
<210> 8
<211> 336
<212> DNA
<213> Artificial
<400> 8
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 9
<211> 57
<212> DNA
<213> Artificial
<400> 9
gcaacaaact tctctctgct gaaacaagcc ggagatgtcg aagagaatcc tggaccg 57
<210> 10
<211> 60
<212> DNA
<213> Artificial
<400> 10
atgcagatcc cacaggcgcc ctggccagtc gtctgggcgg tgctacaact gggctggcgg 60
<210> 11
<211> 405
<212> DNA
<213> Artificial
<400> 11
ccaggatggt tcttagactc cccagacagg ccctggaacc cccccacctt ctccccagcc 60
ctgctcgtgg tgaccgaagg ggacaacgcc accttcacct gcagcttctc caacacatcg 120
gagagcttcg tgctaaactg gtaccgcatg agccccagca accagacgga caagctggcc 180
gccttccccg aggaccgcag ccagcccggc caggactgcc gcttccgtgt cacacaactg 240
cccaacgggc gtgacttcca catgagcgtg gtcagggccc ggcgcaatga cagcggcacc 300
tacctctgtg gggccatctc cctggccccc aaggcgcaga tcaaagagag cctgcgggca 360
gagctcaggg tgacagagag aagggcagaa gtgcccacag cccac 405
<210> 12
<211> 117
<212> DNA
<213> Artificial
<400> 12
tgtccaagtc ccctatttcc cggaccttct aagccctttt gggtgctggt ggtggttggt 60
ggagtcctgg cttgctatag cttgctagta acagtggcct ttattatttt ctgggtg 117
<210> 13
<211> 126
<212> DNA
<213> Artificial
<400> 13
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcctaa 126
- 一种靶向HER2的CAR-T表达载体及其构建和应用
- 能靶向Her2并封闭PD-L1降低肿瘤免疫逃逸的CAR-T载体及其构建方法和应用
