一种花鲈血管囊细胞的分离和原代培养方法
文献发布时间:2023-06-19 11:19:16
技术领域
本发明涉及鱼类细胞培养方法,具体涉及一种花鲈血管囊细胞的分离和原代培养方法。
技术背景
花鲈(Lateolabrax maculatus)硬骨鱼纲(Osteichthyes)、辐鳍亚纲(Actinopterygii)、鲈形目(Perciformes)、鲈亚目(Percoidei)、鮨科(Serranidae)、花鲈属(Lateolabrax)。花鲈广泛分布于中国、朝鲜和日本沿海,具有适温范围广、适盐性强、肉质鲜美、经济效益高等特点,是我国重要的水产养殖品种。
花鲈属短日照季节性繁殖鱼类,北方产卵期为10月-12月,南方为11月-翌年1月。季节性繁殖鱼类会出现光周期反应且甲状腺素会参与季节性生殖调控,由于花鲈繁育正值寒冬腊月,低温导致的一系列问题(如仔鱼成活率低,饵料培育成本较高等)成为花鲈苗种生产规模化的主要制约因素,通过调节光周期长短可以诱导花鲈性腺提前或推后成熟,因此通过调控生态环境条件,实现不同季节的产卵繁殖,已经是花鲈人工繁殖需要解决的重要问题。研究发现血管囊是调节鱼类光周期的器官,原代细胞与体内细胞特性相近,能较真实的反应体内细胞活性与功能。鱼类细胞能为鱼类病毒分离、抗病毒机制、疫苗研发、转基因技术、嵌合体组织工程等研究提供极大便捷,且设施人力等资源要求相对活体实验低,重复性好,研究周期短。目前,国内外还没有花鲈血管囊分离和原代培养相关的资料,因此,很有必要建立规范的、可复制的花鲈血管囊细胞分离与原代培养的方法,为花鲈季节性繁殖研究提供实验平台。
发明内容
本发明的目的是在于提供一种花鲈血管囊细胞分离与原代培养的方法。
为实现上述目的,本发明采取的技术方案是:一种花鲈血管囊细胞的分离和原代培养方法,取完整的血管囊组织经缓冲液和培养基润洗后,将其切成不少于3块,然后将血管囊组织块置于孔板中静置培养。
本发明中,将完整的血管囊组织切成3-4块即可,若血管囊组织块少于3块,从切面爬出细胞量太少,直接导致细胞贴壁情况差,若血管囊组织块多于5块,血管囊本身只有3-4毫米,由于过度切割,组织散烂,在滴加培养基的过程中,细胞大量悬散在培养基里,而血管囊的悬液细胞几乎不贴壁,悬浮的细胞活性低无法生长。
本发明中,润洗和培养中使用的培养基为L-15完全培养基,其中包含300-500U/mL青霉素、300-500U/mL链霉素和10-30%FBS。优选地,L-15完全培养基包含350-450U/mL青霉素、350-450U/mL链霉素和15-25%FBS。
本发明中,所述培养为将血管囊组织块铺展在血清浸润过的孔板上,血清浸润可帮助细胞贴壁,然后置于28℃培养箱中倒置培养1.5-2小时,之后在组织块正上方滴加少量L-15完全培养基,此方法可帮助组织块铺展避免血管囊组织块飘起,有利于细胞析出贴壁,过夜培养12小时后,将培养基补足至500微升,正常大气压下培养,利用显微镜观察其生长铺展状况。一般培养4天后可明显观察到大量贴壁细胞,一周后可传代培养。
本发明中,润洗中使用的缓冲液为双抗杜氏磷酸盐缓冲液(双抗DPBS),含有400U/mL青霉素和400U/mL链霉素。润洗中使用的培养还包括双抗L-15培养基,含有400U/mL青霉素和400U/mL链霉素。
本发明的优点在于:
1.本发明采用的花鲈血管囊分离方法,可以减少在操作及润洗过程中的细胞流失以及细胞形态损伤。
2.本发明采用的花鲈血管囊培养方法可让血管囊细胞大量贴壁,传代效果好。
3.本发明对已有的海水鱼细胞方法进行借鉴,改良,摸索了适合花鲈血管囊的体外培养方法,以期为花鲈功能基因研究提供实验平台。
4.本发明提供的方法不局限于花鲈,可推广至其他鱼类血管囊细胞的分离和培养。
附图说明
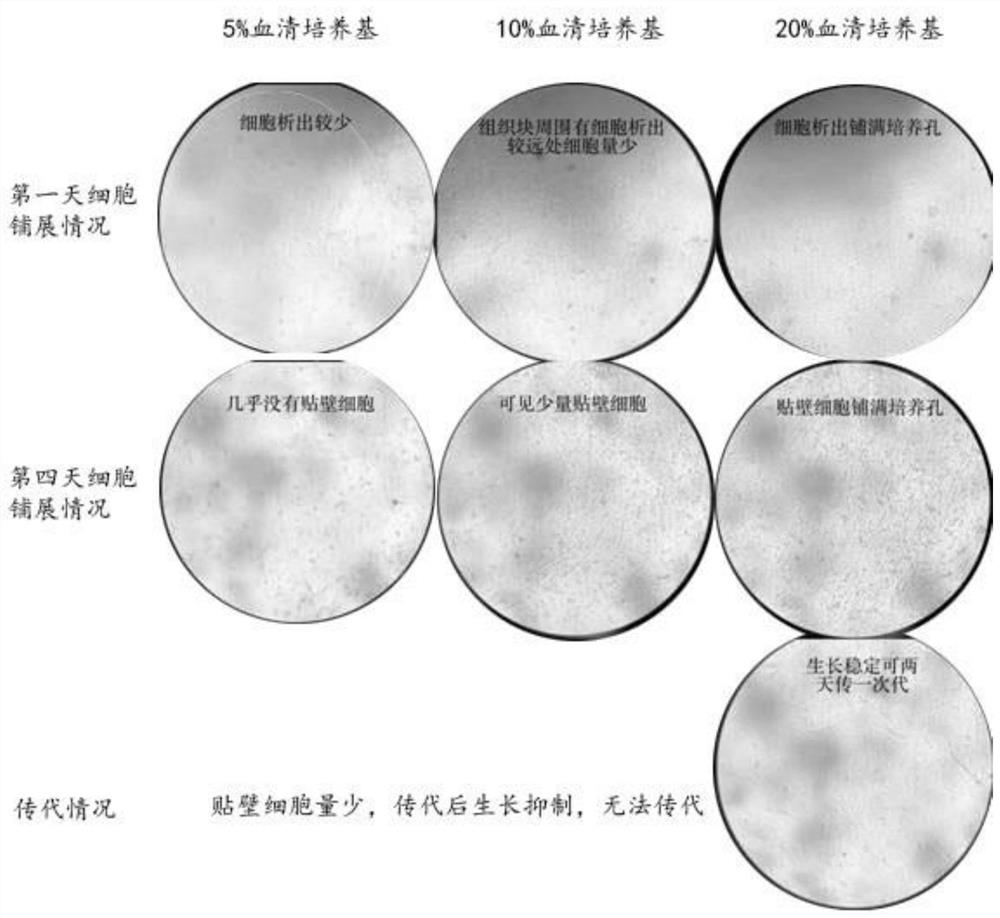
图1为完全培养基筛选结果。
图2为花鲈下丘脑和血管囊组织。
图3为本发明的花鲈血管囊原代培养24小时后的显微镜照片。
图4为本发明的花鲈血管囊原代培养第4天的显微镜照片。
图5为本发明的花鲈血管囊原代培养第7天的显微镜照片。
图6为本发明的花鲈血管囊培养传代后的显微镜照片。
图7为本发明的花鲈血管囊切块数量对细胞爬出效果的对比。
具体实施方式
以下通过具体实施方式结合附图对本发明的技术方案进行进一步的说明和描述。
以下实施例中DPBS basic(1x)缓冲液、L-15基础培养基、青霉素链霉素双抗购于GIBCO,美国;胎牛血清FBS购于GIBCO,胰酶消化液购于Biosharp。
1.配制溶液
双抗DPBS:在DPBS中添加青霉素和链霉素双抗至400U/mL。
双抗L-15培养基:在L-15基础培养基中添加青霉素链霉素双抗至400U/mL。
L-15完全培养基1:在L-15基础培养基中添加青霉素链霉素双抗至400U/mL,同时添加20%FBS。
L-15完全培养基2:在L-15基础培养基中添加青霉素链霉素双抗至400U/mL,同时添加10%FBS。
L-15完全培养基3:在L-15基础培养基中添加青霉素链霉素双抗至400U/mL,同时添加5%FBS。
2.无菌取血管囊
选择体质健康,外表无伤,体重0.5kg-1kg的花鲈,在无菌环境下使用灭菌剪刀将花鲈头顶剪开,用无菌镊子轻轻的将脑部组织翻转过来,即可观察到白色圆形垂体组织,红色血管囊组织以及一对月牙形的下丘脑组织(图2)。小心取出完整的花鲈血管囊组织,放入事先准备好的加有双抗DPBS的培养皿中漂洗2遍,初步清洗后用胶管或镊子将血管囊组织转入加有双抗L-15培养基的培养皿中润洗2遍,再将组织放入含有血清的L-15完全培养基的培养皿中润洗两次。
3.血管囊组织块培养
3.1用无菌刀片在培养皿中将血管囊组织切成3-4块,均匀置于血清浸润过的24孔板上,置于28℃培养箱中倒置培养1.5-2小时,再轻轻滴加少量L-15完全培养基过夜培养,尽量避免组织块飘起,12小时后将培养基补足至500微升,正常大气压下培养,利用显微镜观察其生长铺展状况。一般培养24小时后,可在细胞块边缘观察到大量析出的细胞(图2),2-3天后更换培养基,并将组织块轻轻吹掉,培养并进行观察。如图1所示,L-15完全培养基1培养的细胞,在第一天时,细胞析出铺满培养孔,到第四天观察到大量贴壁细胞铺满培养孔且有少量悬浮细胞(图1、图3-4),7天左右整个24孔板细胞贴壁90%以上(图5),可进行传代培养,且生长稳定可两天传代一次(图1)。L-15完全培养基2培养的细胞,在第一天时,组织块周围有细胞析出但较远处细胞量少,到第四天有少量贴壁细胞(图1),由于贴壁细胞量少,传代后生长出现抑制,无法进行传代培养。L-15完全培养基3培养的细胞,在第一天时,组织块周围有细胞析少,到第四天几乎没有贴壁细胞(图1),由于贴壁细胞量少,传代后生长出现抑制,无法进行传代培养。
3.2用无菌刀片在培养皿中将血管囊组织切成2或5块,均匀置于血清浸润过的24孔板上,置于28℃培养箱中倒置培养1.5-2小时,再轻轻滴加少量L-15完全培养基1过夜培养,尽量避免组织块飘起,12小时后将培养基补足至500微升,正常大气压下培养,利用显微镜观察其生长铺展状况。如图7所示,血管囊组织切成2块的,从切面爬出细胞量太少,直接导致细胞贴壁情况差。而切成5块的,血管囊本身只有3-4毫米,过度切割,组织散烂,在滴加培养基的过程中,细胞大量悬散在培养里,而血管囊的悬液细胞几乎不贴壁,悬浮的细胞活性低无法生长。
4.血管囊传代
将24孔板中的培养基吸出,加入300微升双抗杜氏磷酸盐缓冲液(双抗DPBS),轻摇培养板,润洗细胞,将双抗DPBS吸出,加入300微升胰酶消化酶液,消化3-5min,加入1毫升完全培养基终止消化。将上述液体1000rpm离心10分钟,弃上清,加入完全培养基将白色的细胞沉淀重悬,分装至新的培养板中培养。2天后铺板可达到80%(图6)。根据情况可进行后续传代。
最后,还需注意的是,以上举例的仅是本发明若干具体实施例中的一种。显然,本发明不局限于以上实施案例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 一种花鲈血管囊细胞的分离和原代培养方法
- 一种原代犬血管内皮细胞的分离培养方法
