从消毒处理容器一体化连续分离流体流
文献发布时间:2023-06-19 11:50:46
本发明申请是基于申请日为2015年10月20日,申请号为201580070285.9(国际申请号为PCT/US2015/056422)、名称为“从消毒处理容器一体化连续分离流体流”的发明专利申请的分案申请。
相关申请的交叉引用
本申请要求保护2014年10月24日提交的美国临时专利申请系列号62/068,181的优先权,其整体内容在本文通过提述并入。
技术领域
本发明涉及重组蛋白的生物技术和生物制造方法。
发明背景
含有编码重组蛋白的核酸的哺乳动物细胞通常用于生产治疗上或商业上重要的蛋白质。在当前多样化产品线的环境中,生物技术公司越来越多地受到驱动去开发创新的解决方案用于高度灵活且成本有效地制造治疗剂(例如,治疗蛋白药物物质)。
在连续生物制造过程中,通常有必要从无菌过程容器(sterile process vessel)去除流体。这种流体的去除基于一些预定的触发方式可以是连续流或间歇流。去除需要以一种保护从其中去除流体的容器的无菌性的方式来进行。当流体流有促进生物生长的潜力(其最终能够长回无菌过程容器)时,这在生物制造中可能是富于挑战的。如今使用的主流方法是分批传输方法,其中在第二无菌容器中收集废料流,并且当该容器达到容量时,再将其与无菌过程容器断开,然后丢弃废料。但这并不理想,因为这是分批的过程(非连续的),并且要花费许多时间操作和灭菌容器。如果任何步骤失败的话,这些操作还创造了过程的风险。或者,相同的过程也可以使用预灭菌袋来完成,然而袋的成本可能阻碍进行连续过程,并且袋的使用并没有消除过程中的风险。
发明概述
本发明部分基于开发了分离过程和相关硬件以允许从含有无菌过程的灭菌系统(sterilized system)(例如,无菌处理容器(sterile process vessel))周期性或连续地分离(例如,去除)流体流。所述分离过程利用分离容器来将无菌过程与环境和废料流分开。分离容器仅部分填充且保留了容器内的顶部空间,其中所述顶部空间含有灭菌剂。所述灭菌剂(例如,灭菌气体(例如,含有臭氧、环氧乙烷、二氧化氮或汽化过氧化氢的气体))可以喷射入所述容器或直接引入所述容器的顶部空间。所述灭菌剂保持了所述容器的顶部空间内的灭菌环境(sterilizing atmosphere),其提供了在输入无菌工艺流和输出流体流(例如,废料流)之间的分离。在容器的顶部空间内灭菌剂(例如,灭菌气体)的浓度受到控制,以提供必要的灭菌环境。
在一方面中,本发明提供抑制灭菌系统污染的方法,所述方法包括提供一种系统,其包括第一容器,其中所述第一容器包含液体;使第一体积的所述液体流出所述第一容器,并通过一定体积的灭菌气体且流入第二容器。本发明考虑的灭菌系统包括但不限于生物制造系统和药物制造系统。所述第一容器是灭菌的容器。在示例性的实施方案中,所述第一容器包括生物制造系统的部件。例如,所述第一容器可以是(例如,本文描述的或本领域已知的任何示例性生物反应器):层析系统(chromatography system)的一个或多个部件(例如,层析柱),微滤系统的一个或多个部件,或超滤/渗滤(UF/DF)系统的一个或多个部件。对于生物制造系统,第一容器的液体可以是液体培养基和/或包含重组治疗性蛋白的液体。在一些实施方案中,第一容器的液体包含含有重组治疗性蛋白的细胞。重组治疗性蛋白可以是从细胞分泌的蛋白质或不从细胞分泌的蛋白质。
在一些方面中,灭菌气体选自下组:臭氧、环氧乙烷、二氧化氮或汽化过氧化氢(例如,含有臭氧的气体,含有环氧乙烷的气体,含有氮氧化物(nitrogen oxide)的气体,和含有过氧化氢的气体)。
从第一容器流至第二容器的第一体积的液体可以是废料流。在另一方面中,从第一容器流至第二容器的所述第一体积的液体包含重组治疗性蛋白。或者,从第一容器流至第二容器的第一体积的液体不含重组治疗性蛋白(即,所述第一体积的液体是废料流或包含细胞培养开始前的培养基)。所述第一体积的液体可以包含发酵副产物。
在一方面中,本文公开的方法进一步包括使第二体积的液体从第二容器流入用于纯化和精制重组蛋白的装置。例如,本文公开的方法可进一步包括使第二体积的液体从第二容器流入第一多柱层析系统(MCCS1),使用MCCS1捕获液体培养基中的所述重组治疗性蛋白,其中将含有所述重组治疗性蛋白的MCCS1的洗脱液连续进料至第二多柱层析系统(MCCS2),和使用MCCS2纯化和精制所述重组治疗性蛋白,其中来自MCCS2的洗脱液是重组治疗性蛋白;并且其中所述过程是一体化的并且从第一容器中的所述液体连续运行至来自MCCS2的洗脱液,所述来自MCCS2的洗脱液是重组治疗性蛋白。在一些实施方案中,第二体积的液体包含重组蛋白。
在一方面中,本文公开的方法进一步包括使来自第二容器的第二体积的液体流入用于放置生物废料流的容器。例如,所述容器可以是用于放置废料的水槽,或用于储存和/或去除废液的烧杯或其他容器。
本发明还提供了一种用于从非无菌环境分离无菌工艺流的系统。在一方面中,所述系统包含含有流体出口的第一容器;和至少一个第二容器,所述第二容器包含与所述第一容器的流体出口流体连通并配置成使得进入第二容器的流体流过所述第二容器内的灭菌气体填充的顶部空间的流体入口,配置成使得离开所述第二容器的液体从所述第二容器内灭菌气体填充的顶部空间之下移出的流体出口,至少一个气体入口,和至少一个气体出口。在一些实例中,所述第一容器是灭菌容器。在示例性实施方案中,所述第一容器是生物制造系统的部件。例如,所述第一容器是流体管道(例如,本文描述的或本领域已知的任何示例性生物反应器),层析系统的一个或多个部件(例如,层析柱),微滤系统的一个或多个部件,或超滤/渗滤系统的一个或多个部件。例如,所述生物反应器是灌注生物反应器、补料分批生物反应器、生产生物反应器或种子生物反应器。在一些实施方案中,第二容器流体出口与用于纯化和精制重组蛋白的装置流体连通。在示例性实施方案中,所述第一容器和第二容器置于滑架上。
在一些方面中,本文公开的系统进一步包括置于所述第一容器和第二容器之间的流体管道,和任选地进一步包含置于所述第一容器和第二容器之间的流体管道中并配置成从流体管道中的流体去除颗粒物质的过滤器。本文公开的系统可以还包括泵系统(例如,泵),其中所述泵系统置于流体管道中。在一些实例中,本文公开的系统包含与第一容器的流体出口流体连通的泵,与第二容器的流体出口流体连通的泵,或二者兼有。在一个实施方案中,所述泵系统配置成从容器出口去除一定体积的流体并使所述体积流入第二容器的流体入口。
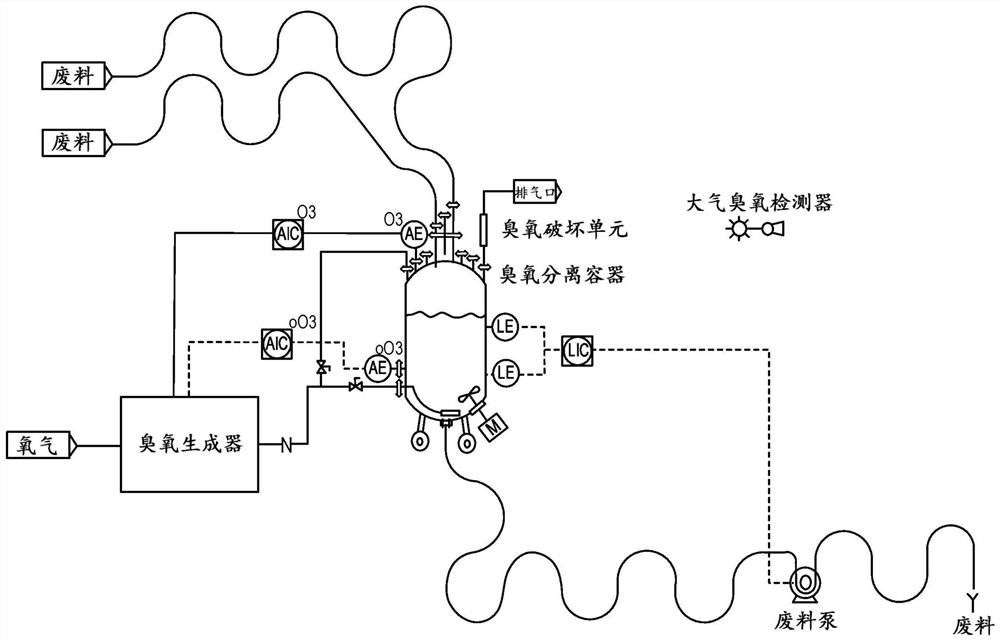
在一方面中,本文公开的系统包括第二容器内的灭菌气体填充的顶部空间。例如,所述灭菌气体可以是选自下组的气体:臭氧、环氧乙烷、二氧化氮或汽化过氧化氢。在一些实施方案中,所述至少一个气体入口与允许气体排入第二容器并供应至顶部空间的一个或多个气体喷射元件连接。术语“喷射元件”指有孔元件(例如,过滤器、开口管或烧结玻璃(frit)),其用于通过液体鼓出气泡。为了填充顶部空间,所述第二容器包含至少一个气体入口,所述至少一个气体入口与用于生成或递送灭菌气体的系统,或用于生成和递送灭菌气体的系统气体连通。在一些实施方案中,用于生成或递送灭菌气体的系统是臭氧生成或递送系统,或臭氧生成和递送系统。在一些实施方案中,用于递送灭菌气体的系统是瓶装气体。另外,在一些实施方案中,所述第二容器包含至少一个气体出口,所述至少一个气体出口配置成连续或周期性地从所述第二容器排出气体。对于使用臭氧的系统,气体出口与臭氧破坏单元气体连通。为了控制第二容器中含有的灭菌气体的浓度或量,所述系统可包括例如溶解气体探测器或用于监测所述第二容器的顶部空间内的灭菌气体浓度的传感器。
在一方面中,所述第一容器包含与第二容器的流体入口流体连通的流体出口。在示例性的实施方案中,所述第二容器包含配置成使得进入第二容器的所述体积的液体通过顶部空间的流体入口(例如,位于第二容器上在液面之上位置的流体入口)、配置成使得离开第二容器的液体自所述灭菌气体填充的顶部空间之下流过的流体出口(例如,位于第二容器上在液面之下位置的流体出口)、至少一个气体入口和至少一个气体出口,其中所述流体入口与所述第一容器流体连通。有利地,将所述体积的灭菌气体置于第二容器的顶部空间内。为了填充顶部空间,可以将所述灭菌气体喷射入第二容器或直接引入第二容器的顶部空间。在一些实例中,所述第二容器至少部分填充有液体。
在一些实施方案中,第一容器中的液体包含重组治疗性蛋白。
具体地,本发明涉及如下各项:
1.一种抑制灭菌系统污染的方法,所述方法包括
提供包含第一容器的系统,其中所述第一容器包含液体;
使第一体积的所述液体流出所述第一容器,并通过一定体积的灭菌气体并流入第二容器。
2.项1的方法,其中将所述体积的灭菌气体置于所述第二容器的顶部空间内。
3.项2的方法,其中所述第二容器包含:
(i)流体入口,其配置成使得进入所述第二容器的所述体积的液体通过所述顶部空间,
(ii)流体出口,其配置成使得离开所述第二容器的液体自所述灭菌气体填充的所述顶部空间之下流过,
(iii)至少一个气体入口;和
(iv)至少一个气体出口,
其中所述流体入口与所述第一容器流体连通。
4.项3的方法,其中所述第一容器包含与所述第二容器的流体入口流体连通的流体出口。
5.项1的方法,其中在过程中,所述第二容器至少部分填充有液体。
6.项2的方法,其中所述灭菌气体被喷射入所述第二容器或直接引入所述第二容器的所述顶部空间。
7.项1的方法,其中所述第一容器是灭菌容器。
8.项1的方法,其中所述灭菌系统是生物制造系统或药物制造系统。
9.项8的方法,其中所述第一容器是生物反应器、层析系统(chromatographysystem)、微滤(MF)系统或超滤/渗滤(UF/DF)系统。
10.项1的方法,其中所述第一容器中的液体包含含有治疗性蛋白的细胞。
11.项1的方法,其中所述第一容器中的液体包含重组治疗性蛋白。
12.项11的方法,其中所述重组蛋白是从细胞分泌的或不是从细胞分泌的。
13.项1的方法,其中所述液体的所述第一体积包含重组治疗性蛋白。
14.项1的方法,其中所述第一容器中的液体不包含重组治疗性蛋白。
15.项1的方法,其中所述第一体积不包含重组治疗性蛋白。
16.项1的方法,其中所述第一容器中的所述液体包含发酵副产物。
17.项13的方法,进一步包括:
(i)使第二体积的液体从所述第二容器流入第一多柱层析系统(MCCS1);
(ii)使用所述MCCS1捕获液体培养基中的所述重组治疗性蛋白,其中将含有所述重组治疗性蛋白的所述MCCS1的洗脱液连续馈入至第二多柱层析系统(MCCS2);和
(iii)使用所述MCCS2纯化和精制所述重组治疗性蛋白,其中来自所述MCCS2的洗脱液是重组治疗性蛋白;且
其中所述过程是一体化的并且从所述第一容器连续运行至来自所述MCCS2的洗脱液,来自所述MCCS2的洗脱液是所述重组治疗性蛋白。
18.项13的方法,其进一步包括使来自所述第二容器的第二体积的液体流入用于纯化和精制所述重组蛋白的装置。
19.项17的方法,其中所述第二体积的液体包含重组蛋白。
20.项11-13或19任一项的方法,其中所述重组治疗性蛋白是抗体或抗体片段、酶、工程化蛋白(engineered protein)或免疫原性蛋白或蛋白片段。
21.项1的方法,其中所述灭菌气体选自下组:臭氧、环氧乙烷、二氧化氮或汽化过氧化氢。
22.项1的方法,其中所述第一体积的液体是废料流。
23.一种用于从非无菌环境分离无菌工艺流(sterile process stream)的系统,其包含:
含有流体出口的第一容器;和
至少一个第二容器,其含有:
(i)流体入口,其与所述第一容器的所述流体出口流体连通并配置成使得进入所述第二容器的流体通过所述第二容器内的灭菌气体填充的顶部空间,
(ii)流体出口,其配置成使得离开所述第二容器的液体从在所述第二容器内的所述灭菌气体填充的顶部空间下移出,
(iii)至少一个气体入口;和
(iv)至少一个气体出口。
24.项23的系统,其中所述第一容器是生物制造系统的部件。
25.项24的系统,其中所述第一容器是流体管道、生物反应器、层析系统、微滤(MF)系统或超滤/渗滤(UF/DF)系统。
26.项25的系统,其中所述生物反应器是生产生物反应器或种子生物反应器(seedbioreactor)。
27.项25的系统,其中所述生物反应器是灌注生物反应器或分批补料生物反应器。
28.项23的系统,其进一步包括置于所述第一容器和所述第二容器之间的流体管道。
29.项28的系统,其进一步包括过滤器,所述过滤器置于所述第一容器和所述第二容器之间的所述流体管道中并配置成从所述流体管道中的流体去除颗粒物质。
30.项28的系统,其进一步包含置于所述流体管道中的泵系统。
31.项30的系统,其中所述泵系统包括泵,所述泵配置成从所述容器出口去除一定体积的流体并使所述体积流入所述第二容器的所述流体入口。
32.项23的系统,其进一步包括与所述第二容器的所述流体出口流体连通的泵系统。
33.项31的系统,其进一步包括过滤器,所述过滤器置于所述第一容器和所述泵之间的所述流体管道中,并且配置成从存在于所述流体管道中的流体去除颗粒物质。
34.项23的系统,其中将所述第一容器和所述第二容器置于滑架(skid)上。
35.项23的系统,其中所述灭菌气体选自下组:臭氧、环氧乙烷、二氧化氮或汽化过氧化氢。
36.项23的系统,其中所述至少一个气体出口配置成连续或周期性地从所述第二容器排出气体。
37.项23的系统,其中所述至少一个气体出口与臭氧破坏单元气体连通。
38.项23的系统,其中所述至少一个气体入口与用于生成或递送灭菌气体的系统气体连通,或与用于生成和递送灭菌气体的系统气体连通。
39.项38的系统,其中所述用于生成或递送灭菌气体的系统是臭氧生成或递送系统,或是臭氧生成和递送系统。
40.项23的系统,其中至少一个气体入口与一个或多个气体喷射元件连接,所述一个或多个气体喷射元件允许气体排入所述第二容器。
41.项40的系统,其中所述气体喷射元件是过滤器、开口管或烧结玻璃(frit)。
42.项23的系统,其进一步包括溶解的气体探测器(dissolved gas probe)。
43.项23的系统,其进一步包括用于监测所述第二容器的所述顶部空间内的灭菌气体浓度的传感器。
44.项23的系统,其中所述第二容器的所述流体出口与用于纯化和精制重组蛋白的装置流体连通。
45.项23的系统,其中所述容器是灭菌容器。
如用于本文,词语“一/一个/一种”用于名词前代表一个或多个/一种或多种该特定名词。例如,短语“一/一个/一种重组哺乳动物细胞”代表“一个或多个/一种或多种重组哺乳动物细胞”。
术语“容器(vessel)”是本领域已知并且意指任何形状或大小的装置(例如,容器(container)),其具有适合于容纳一定体积的液体或气体的内部容积。所述容器可以是开放的(即,直接与其外部环境相互作用的装置)或封闭的(即,与其外部环境没有相互作用的隔离的装置)。术语“容器”包括,例如,具有适合于在液体培养基(culture medium)中于一组受控的允许维持或增殖细胞的物理条件下培养多个细胞(例如,重组哺乳动物细胞)的内部容积的装置。容器的非限制性实例是流体管道、生物反应器(例如,本文描述的或本领域已知的任何示例性生物反应器)、层析系统的一个或多个部件(例如,层析柱)、微滤系统的一个或多个部件、超滤/渗滤的一个或多个部件、烧杯、水槽或管。
术语“灭菌”是本领域已知的并且指任何用于使组合物无菌的确证的方法,例如,消除(去除)或杀死所有生命形式的方法,所述生命形式包括表面存在的、流体中含有的、药品中的或化合物如生物培养基中的可传播物质(transmissible agent)(如真菌、细菌、病毒、孢子形式等)。灭菌可以通过施加热、化学(例如气体)、辐照、高压或过滤或其组合实现。
术语“灭菌气体”如用于本文指能够使组合物无菌的气体或气态组合物,例如,消除(去除)或杀死所有生命形式的方法,所述生命形式包括表面存在的、流体中含有的、药品中的或化合物如生物培养基中的可传播物质(如真菌、细菌、病毒、孢子形式等)。
“绝对无菌性”或“绝对无菌”是用于描述完全没有自复制性生物污染物的组合物或过程的术语。例如,所述术语可用于γ-辐照过的容器、容器的内表面和内容物和/或缓冲液。绝对无菌组合物或过程可以是洁净的(如该术语在本领域所知那样)。
“无菌”或“无菌性”是用于描述具有约或小于1.0x 10
术语“无菌保证水平”或“SAL”是本领域已知的并且意指在经处理单元的批次内实现绝对无菌性的置信水平。概率通常基于在确证过程中进行的失活研究的结果计算并以1x10
术语“灭菌容器”和“无菌过程容器”可以互换,并且指已经经历了灭菌过程的容器。如用于本文,术语“灭菌容器”或“无菌过程容器”包括,例如,含有生物负载受控的单一培养物(bioburden controlled monoculture)(例如,重组哺乳动物细胞的生物负载受控的单一培养物)的容器。如用于本文,术语“灭菌系统”指包括一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个、十个或更多)无菌过程容器的集合的系统,所述无菌过程容器配合发挥实现特定结果的功能(例如,从液体培养基表达和纯化重组蛋白)。“灭菌系统”指总共两个或更多个相互连接或切换的容器的系统,其中所述系统中的至少一个或多个容器是灭菌容器。
如用于本文,术语“生物制造系统”或“生物-制造系统”指用于生产生物药物的系统。术语“药物制造系统”指用于生产小分子药物(例如,药物、前药或药物产品)的系统。本文涵盖的生物制造系统和药物系统的部件包括,例如,一种或多种用于培养起始和生产的生物反应器、烧瓶、流体管道、容器、层析系统的一个或多个部件(例如,层析柱、泵、过程容器)、过滤系统的一个或多个部件(例如,微滤系统的一个或多个部件,或超滤/渗滤系统的一个或多个部件),和其他用于药物分离和纯化的装置。所述系统可以是开放的、封闭的、一体化的或连续的,如本文所限定的或如以其他方式为本领域技术人员所通常理解的。
术语“生物药物”如用于本文指从活生物体或其产物制备或获得的任何治疗性物质,其用于预防、诊断或治疗病理。因此,生物药或生物药物是使用生物技术产生的医学药物,例如,蛋白质(例如,重组治疗性蛋白),或核酸(DNA、RNA或反义寡核苷酸),其用于治疗或体内诊断目的。
术语“小分子药物”如用于本文指具有低分子量的、用于预防、诊断或治疗病理的治疗剂。治疗剂通常通过有机化学合成,但也可以从天然来源如植物、真菌和微生物分离。
如用于本文,当第一和第二容器经由允许容器之间的气体流动或连通的装置或管道连接时,第一容器与第二容器“气体连通”。类似地,当第一和第二容器经由允许容器之间的流体流动或连通的装置或管道连接时,第一容器与第二容器“流体连通”。与本发明的教导一致,术语流体连通和气体连通拟是同义术语。在这方面,流体拟包括有流动倾向或符合其容器的轮廓的物质,无论液体或气体。在这方面,不仅液体符合流体的定义,气体也符合,因为气体能够流动并且符合其所处容器的轮廓。
术语“灌注生物反应器”是本领域已知的,并且意指具有内部容积用于在液体培养基中培养多个细胞(例如,重组哺乳动物细胞)的生物反应器,并且具有用于周期性或连续去除生物反应器中的液体培养基的手段(例如,出口、入口、泵或其他这样的装置),并且具有用于向所述生物反应器添加基本上相同体积的替换液体培养基的手段(例如,出口、入口、泵或其他这样的装置)。添加替换液体培养基可以在从生物反应器去除液体培养基的基本上同时或稍后进行。用于从生物反应器去除液体培养基的手段和用于添加替换液体培养基的手段可以是单一装置或系统。
术语“生产生物反应器”是本领域术语,并且意指大规模生物反应器(例如,具有超过500L、1,000L、5,000L、10,000L、20,000L、50,000L或100,000L的内部容积)。例如,生产生物反应器可以是灌注生物反应器。
术语“补料分批生物反应器”是本领域的术语,并且意指在第一液体培养基中包括多个细胞(例如,重组哺乳动物细胞)的生物反应器,其中培养存在于生物反应器中的细胞包括周期性或连续地添加第二液体培养基至所述第一液体培养基而不实质性或显著地从细胞培养物去除所述第一液体培养基或第二液体培养基。所述第二液体培养基可以与所述第一液体培养基相同。在一些补料分批培养的实例中,所述第二液体培养基是第一液体培养基的浓缩形式。在一些补料分批培养的实例中,所述第二液体培养基作为干粉添加。
术语“多柱层析系统”或“MCCS”意指总共两个或更多个相互连接的或切换的层析柱和/或层析膜的系统。多柱层析系统的非限制性实例是周期逆流层析系统(PCC),包括总共两个或更多个相互连接的或切换的层析柱和/或层析膜。多柱层析系统的其他实例在本文描述并且是本领域已知的。
术语“哺乳动物细胞”意指任何来自或源自任何哺乳动物(例如,人、仓鼠、小鼠、绿猴、大鼠、猪、牛或兔)的细胞。例如,哺乳动物细胞可以是永生化细胞。在一些实施方案中,所述哺乳动物细胞是分化的细胞。在一些实施方案中,所述哺乳动物细胞是未分化的细胞。哺乳动物细胞的非限制性实例在本文描述。哺乳动物细胞的其他实例是本领域已知的。
术语“培养”或“细胞培养”意指在一组受控的物理条件下维持或增殖哺乳动物细胞(例如,重组哺乳动物细胞)。
术语“哺乳动物细胞的培养物”或“细胞培养物”意指含有多个哺乳动物细胞的液体培养基,所述哺乳动物细胞在一组受控的物理条件下维持或增殖。
术语“液体培养基”或“培养基”意指含有允许细胞(例如,哺乳动物细胞)在体外生长或增殖的充足营养物的流体。例如,液体培养基可以含有下列中的一种或多种:氨基酸(例如,20种氨基酸)、嘌呤(例如次黄嘌呤)、嘧啶(例如胸腺嘧啶)、胆碱、肌醇、硫胺素、叶酸、生物素、钙、烟碱酰胺、吡哆醇、核黄素、胸苷、氰钴胺、丙酮酸、硫辛酸、镁、葡萄糖、钠、钾、铁、铜、锌和碳酸氢钠。在一些实施方案中,液体培养基可含有来自哺乳动物的血清。在一些实施方案中,液体培养基不含来自哺乳动物的血清或另外的提取物(限定的液体培养基)。在一些实施方案中,液体培养基可含有微量金属、哺乳动物生长激素和/或哺乳动物生长因子。液体培养基的另一个实例是基本培养基(minimal medium)(例如只含有无机盐类、碳源和水的培养基)。本文描述了液体培养基的非限制性实例。液体培养基的其他实例为本领域已知且为商业上可购得。液体培养基可含有任何密度的哺乳动物细胞。例如,如本文所用,从生产生物反应器移出的一定体积的液体培养基可基本上不含哺乳动物细胞。
术语“重组治疗性蛋白”或“重组蛋白”是本领域已知并且意指包括任何经由重组DNA技术获得的治疗性蛋白。如用于本文,“重组治疗性蛋白”包括,例如,抗体或抗体片段、酶、工程化蛋白或免疫原性蛋白或蛋白片段。
术语“蛋白片段”或“多肽片段”意指长度为至少或约4个氨基酸、至少或约5个氨基酸、至少或约6个氨基酸、至少或约7个氨基酸、至少或约8个氨基酸、至少或约9个氨基酸、至少或约10个氨基酸、至少或约11个氨基酸、至少或约12个氨基酸、至少或约13个氨基酸、至少或约14个氨基酸、至少或约15个氨基酸、至少或约16个氨基酸、至少或约17个氨基酸、至少或约18个氨基酸、至少或约19个氨基酸、或至少或约20个氨基酸,或超过20个氨基酸的多肽序列的一部分。重组蛋白片段可以使用任何本文描述的方法产生。
术语“工程化蛋白”意指一种多肽,其并非由存在于生物体(例如哺乳动物)中的内源性核酸天然编码。工程化蛋白的实例包括酶(例如,带有一个或多个氨基酸取代、缺失、插入或添加,其使得工程化酶的稳定性和/或催化活性增强)、融合蛋白、抗体(例如二价抗体、三价抗体或双抗体)和含有至少一个重组骨架序列的抗原-结合蛋白。
术语“一体化的过程”表示一种过程,其使用功能上相配合以达到特定结果(例如,从液体培养基生成分离的重组蛋白)的结构元件实施。
术语“连续的过程”表示一种过程,其连续地进料流体通过系统的至少一部分。
术语“过滤”意指从液体(例如,本文描述的任何系统或过程中存在的液体培养基或流体)去除至少部分(例如,至少80%、90%、95%、96%、97%、98%或99%)不想要的生物污染物(例如,哺乳动物细胞、细菌、酵母细胞、病毒或分枝杆菌)和/或颗粒物质(例如,沉淀的蛋白)。
术语“灌注培养”是本领域术语,并且意指在容器(例如,生物反应器)中培养细胞培养物,其中在容器中培养细胞培养物包括周期性或连续地去除容器中存在的液体培养基(例如,基本上不含细胞的液体培养基),并且在同时或稍后向所述容器添加基本上相同体积的替换液体培养基。在一些实例中,在培养期间,在递增的时间段期间(例如,约24小时时间段、约1分钟至约24小时之间的时间段或超过24小时的时间段),在去除的液体培养基体积和添加的替换培养基体积方面存在递增变化(例如,增加或减少)(例如,以每日为基础的培养基再补料速率)。每日去除和替换的培养基所占分数可依赖于所培养的特定细胞、初始接种密度和特定时间的细胞密度而变化。“RV”或“反应器体积”表示在培养过程开始时存在的培养基体积(例如,在接种后存在的培养基总体积)。
术语“补料分批培养”是本领域的术语,并且意指在液体培养基中包括多个细胞(例如,哺乳动物细胞)的容器(例如,生产生物反应器),其中培养存在于容器(例如,生产生物反应器)中的细胞包括在培养过程中周期性或连续添加新鲜液体培养基至所述容器,而没有实质性或显著地从容器移出液体培养基。新鲜液体培养基可与培养开始时容器中存在的液体培养基相同。在补料分批培养的一些实例中,新鲜液体培养基是培养开始时容器中存在的液体培养基的浓缩形式。在补料分批培养的一些实例中,新鲜液体培养基作为干粉添加。
“滑架(skid)”是本领域的术语,并且如本文所用指可用作本文所述系统的平台或支撑体的三维固体结构。若滑架包含一个或多个使移动成为可能的结构(例如轮、滑轮或类似物),则其可为系统或系统的一部分赋予移动性。本文描述了滑架的非限制性实例。滑架的其他实例为本领域已知。
除非另有定义,否则本文使用的所有技术与科学术语的意思与本发明所属领域的普通技术人员的一般理解相同。本文描述了用于本发明的方法和材料;还可使用本领域已知的其他适宜方法与材料。材料、方法和实施例仅用于说明而非意在限制。本文提及的所有公开、专利申请、专利、序列、数据库条目和其他参考文献通过提述以其整体并入。在冲突的情况下,以本说明书(包括定义)为准。
本发明的其他特征和优势将根据下列详述和附图以及由权利请求范围而显而易见。
附图简述
图1是描绘示例系统的示意图,所述示例系统用于根据本发明从非无菌环境分离无菌工艺流(process flow)。
图2是描绘示例系统的示意图,所述示例系统用于根据本发明从非无菌环境分离无菌工艺流。
发明详述
本文提供分离方法和相关硬件以允许从含有无菌过程的灭菌系统(例如,无菌过程容器)分离流体流。本文描述的分离方法提供多种益处。例如,所述分离方法允许周期性或连续地从灭菌系统移出流体流,其提供对该灭菌系统较少的手动操作和降低污染该灭菌系统的风险。例如,本文描述的分离方法提供从生物反应器周期性或连续地移出液体(例如、废料流、含有重组治疗性蛋白的液体),其继而提供对细胞培养物较少的手动操作和降低污染细胞培养物的风险。本文描述了这些分离方法的非限制性方面,并且这些方面可以任意组合使用。
本文描述的方法包括使流体体积从第一容器流动至第二容器,使流体体积从第三容器流动至第四容器,或使流体体积从第五容器流动至第六容器。如本领域所理解的,有许多方法使液体体积从第一容器流动至第二容器,例如重力流动或藉助于泵。如此,在一些方面中,本文描述的系统还可包括一个或多个(例如,两个、三个、四个或五个)泵(例如自动的泵,例如,自动蠕动泵)。所述一个或多个泵可以置于设置在第一容器和第二容器之间的流体管道中。例如,本文描述的系统还可包括一个或多个泵,将其配置成将一定体积的流体从第一容器出口移出并使该体积流动至第二容器。在一些实例中,所述一个或多个泵配置成将一定体积的流体从无菌过程容器出口移出并使该体积流动至分离容器流体入口,如本文所述。在一些实例中,一个或多个泵与分离容器的至少一个流体出口流体连通。可以将所述流体从无菌过程容器移出,移出可以通过泵系统(例如,交替切向流(ATF)过滤系统或切向流体过滤(TFF))进行。
在一些实例中,本文描述的系统可以包括一个或多个(例如两个、三个、四个或五个)过滤器,用于从液体(例如,本文描述的任何系统或过程中存在的液体培养基或流体)去除不想要的生物污染物(例如,哺乳动物细胞、细菌、酵母细胞、病毒或分枝杆菌)和/或颗粒物质(例如,沉淀的蛋白质)。
在一些方面中,本公开提供抑制对灭菌系统的污染的方法,包括提供包含第一容器的系统,其中所述第一容器包含液体,使第一体积的液体从所述第一容器流出并通过一定体积的灭菌气体并流入第二容器。
在一些方面中,本发明提供对灭菌系统抑制污染的方法,包括提供包含第一容器的系统,其中所述第一容器包含液体,使第一体积的液体从所述第一容器流出并通过一定体积的灭菌气体并流入第二容器。在一些实例中,所述第一容器是无菌过程容器,其中所述无菌过程容器包含流体出口,所述流体出口与第二容器的流体入口流体连通。在一些实例中,所述第二容器是如本文所述的分离容器,并且所述体积的灭菌气体置于分离容器的顶部空间内。
在一些方面中,本发明提供从无菌环境分离无菌工艺流的系统。对于一些实例,所述系统包含含有流体出口的无菌过程容器(例如,第一容器),和至少一个分离容器(例如,第二容器),所述至少一个分离容器包含(i)流体入口,其与第一容器的流体出口流体连通并且配置成使得进入第二容器的流体通过第二容器内灭菌气体填充的顶部空间,(ii)流体出口,其配置成使得离开第二容器的流体自所述第二容器内灭菌气体填充的顶部空间之下移出,(iii)至少一个气体入口;和(iv)至少一个气体出口。在一些实例中,本文公开的系统进一步包括置于第一容器和第二容器之间的流体管道。
本文公开的分离方法利用容器(即,“分离容器”)将无菌过程与环境和废料流分开。在一些实例中,所述分离容器包含(i)流体入口,其与无菌过程容器的流体出口流体连通并且配置成使得进入所述分离容器的流体通过所述分离容器内的灭菌气体填充的顶部空间,(ii)流体出口,其配置成使得离开分离容器的流体自所述分离容器内的灭菌气体填充的顶部空间之下移出,(iii)至少一个气体入口;和(iv)至少一个气体出口。
如本领域中能够理解的,所述分离容器可具有多种不同的体积/容积。例如,所述分离容器可具有约0.20L-约20L(例如,约0.20L-约18L,约0.20L-约16L,约0.20L-约14L,约0.20L-约12L,约0.20L-约10L,约0.20L-约9.0L,约0.20L-约8.0L,约0.20L-约7.0L,约0.20L-约6.0L,约0.20L-约5.0L,约0.20L-约4.0L,约0.20L-约3.0L,约0.20L-约2.0L,约0.20L-约1.0L,约0.50L-约18L,约0.50L-约16L,约0.50L-约14L,约0.50L-约12L,约0.50L-约10L,约0.50L-约9.0L,约0.50L-约8.0L,约0.50L-约7.0L,约0.50L-约6.0L,约0.50L-约5.0L,约0.50L-约4.0L,约0.50L-约3.0L,约0.50L-约2.0L,约0.50L-约1.0L,约1.0L-约20L,约1.0L-约18L,约1.0L-约16L,约1.0L-约14L,约1.0L-约12L,约1.0L-约10L,约1.0L-约9.0L,约1.0L-约8.0L,约1.0L-约7.0L,约1.0L-约6.0L,约1.0L-约5.0L,约1.0L-约4.0L,约1.0L-约3.0L,约1.0L-约2.0L,约1.0L-约1.0L),或约0.20L,约0.50L,约1.0L,约2.0L,约3.0L,约4.0L,约5.0L,约6.0L,约7.0L,约8.0L,约9.0L,约10.0L,约12.0L,约14.0L,约16.0L,约18.0L或约20.0L的内部容积。
所述分离容器仅部分填充并且保留了容器内的顶部空间。所述顶部空间可包括灭菌剂(例如,灭菌气体)。在一些实例中,分离容器内含有的灭菌气体填充的顶部空间占据分离容器总内部容积的约3%-约97%;分离容器总内部容积的约5%-约95%,例如,分离容器总内部容积的约10%-约90%;分离容器总内部容积的约15%-约85%;分离容器总内部容积的约20%-约80%;分离容器总内部容积的约25%-约75%;分离容器总内部容积的约30%-约70%;分离容器总内部容积的约35%-约65%;分离容器总内部容积的约40%-约60%;分离容器总内部容积的约45%-约55%;或分离容器总内部容积的约5%;分离容器总内部容积的约10%;分离容器总内部容积的约15%;分离容器总内部容积的约20%;分离容器总内部容积的约25%;分离容器总内部容积的约30%;分离容器总内部容积的约35%;分离容器总内部容积的约40%;分离容器总内部容积的约45%;分离容器总内部容积的约50%;分离容器总内部容积的约55%;分离容器总内部容积的约60%;分离容器总内部容积的约65%;分离容器总内部容积的约75%;分离容器总内部容积的约80%;分离容器总内部容积的约85%;分离容器总内部容积的约90%;或分离容器总内部容积的约95%。
用于本文描述的系统和方法中的示例性灭菌气体包括,例如,臭氧气体、环氧乙烷气体、二氧化氮气体和汽化过氧化氢(例如,含有臭氧的气体、含有环氧乙烷的气体、含有氮氧化物的气体和含有过氧化氢的气体),或这些气体的任何合适的混合物。在一些实例中,所述分离容器的顶部空间内所含的灭菌气体可保持在,例如,约15℃-约70℃,约20℃-约65℃,约25℃-约60℃,约30℃-约55℃,约35℃-约50℃,或约40℃-约45℃的温度。
臭氧作为灭菌气体可提供许多优势。臭氧是非常有效的灭菌剂,因为其强氧化性质,这能够破坏范围广泛的病原体,包括朊病毒(prion)。臭氧的高反应性意味着废弃的臭氧能够通过使臭氧通过将臭氧回复成氧气的简单催化剂而被破坏。这也意味着循环时间相对较短。在一些实例中,所述顶部空间含有臭氧,例如,含有臭氧的气体,所述气体具有至少约3000ppm,例如,至少约4000ppm,至少约5000ppm,至少约6000ppm,至少约7000ppm,至少约8000ppm,至少约9000ppm,至少约10,000ppm,至少约15,000ppm,至少约20,000ppm,至少约50,000ppm,至少约100,000ppm,至少约500,000ppm或至少约1,000,000ppm的臭氧浓度。
环氧乙烷具有杀微生物性质,并且能够杀死所有已知的病毒、细菌和真菌,包括细菌孢子,并且与大多数材料兼容(例如,生物制造过程中使用的无菌过程容器)。在一些实例中,所述顶部空间含有环氧乙烷,例如,含有环氧乙烷的气体,所述气体具有至少约500ppm,例如,至少约850ppm,至少约1000ppm,至少约2000ppm,至少约3000ppm,至少约4000ppm,至少约5000ppm,至少约6,000ppm,至少约7,000ppm,至少约8,000ppm,至少约9,000ppm,至少约10,000ppm,至少约15,000ppm,至少约20,000ppm,至少约50,000ppm,至少约100,000ppm,至少约500,000ppm或至少约1,000,000ppm的环氧乙烷浓度。
二氧化氮(NO
过氧化氢(H
所述分离容器可进一步包括用于监测所述容器顶部空间内的灭菌剂(例如,灭菌气体)浓度的部件以监测灭菌环境。例如,分离容器可以包括用于监测顶部空间内灭菌气体浓度的传感器,或用于监测分离容器中所含液体的溶解气体浓度的传感器(例如,溶解气体探测器)。
在一些实例中,分离容器内液体填充的空间占据分离容器总容积的约3%至约97%;分离容器总容积的约5%至约95%;分离容器总容积的约10%至约90%;分离容器总容积的约15%至约85%;分离容器总容积的约20%至约80%;分离容器总容积的约25%至约75%;分离容器总容积的约30%至约70%;分离容器总容积的约35%至约65%;分离容器总容积的约40%至约60%;分离容器总容积的约45%至约55%;或分离容器总容积的约5%;分离容器总容积的约10%;分离容器总容积的约15%,分离容器总容积的约20%;分离容器总容积的约25%;分离容器总容积的约30%;分离容器总容积的约35%;分离容器总容积的约40%;分离容器总容积的约45%;分离容器总容积的约50%;分离容器总容积的约55%;分离容器总容积的约60%;分离容器总容积的约65%;分离容器总容积的约75%;分离容器总容积的约80%;分离容器总容积的约85%;分离容器总容积的约90%;或分离容器总容积的约95%。
分离容器可包括至少一个用于将灭菌气体引入分离容器顶部空间的气体入口。如本领域能够理解的,有多种方式可以将气体引入容器的顶部空间。例如,可将气体喷射入容器或直接引入容器的顶部空间。如此,可将所述至少一个气体入口与允许气体排入分离容器的一个或多个气体喷射元件连接。所述气体入口可经由与用于生成或递送灭菌气体的或用于生成和递送灭菌气体(例如,臭氧、环氧乙烷、二氧化氮或汽化过氧化氢)的系统气体连通。例如,所述气体入口可与用于生成臭氧的系统气体连通,如本领域所公知的。
所述分离容器可以包括至少一个气体出口,其配置成连续或周期性地从分离容器的顶部空间排出气体。如本领域能够理解的,所述气体出口可以配置成自动排出气体,如若所述顶部空间气压超量。所述气体出口可以与配置用于容纳、破坏或削弱(attenuate)灭菌气体的单元气体连通。例如,所述气体出口可以与臭氧破坏单元气体连通。所述臭氧破坏单元是本领域已知的,并且可以是催化性、热的、热-催化性的或活性炭(activated carbon)。催化单元可以使用二氧化锰或涂覆有钯的铝,并在约50℃的温度破坏臭氧。热破坏单元通常在约120℃的温度下操作。
在一些实例中,本文描述的分离容器包含至少一个流体入口,其与无菌过程容器的至少一个流体出口流体连通,并且配置成使得进入分离容器的流体通过分离容器内灭菌气体填充的顶部空间。在一些方面中,分离容器的至少一个流体入口与无菌过程容器的至少一个流体出口经由流体管道流体连通。
在一些实例中,本文描述的分离容器包含至少一个流体出口。对于一些示例性系统配置,所述分离容器的至少一个流体出口与用于纯化和精制重组蛋白的装置流体连通。因此,在一些方面中,本文公开的方法包括使一定体积的液体从分离容器(例如,第二容器)流入用于纯化和精制重组蛋白的装置。
术语“纯化”意指为了将重组蛋白(例如,重组治疗性蛋白)从存在于含有重组蛋白的流体中的一种或多种其他杂质(例如,大块杂质)或组分(例如液体培养基蛋白或一种或多种存在于哺乳动物细胞或自哺乳动物细胞分泌的其他组分(例如DNA、RNA、其他蛋白、内毒素、病毒等)分离而实施的步骤。例如,纯化可在初始捕获步骤期间或在初始捕获步骤后实施。纯化可使用本领域已知的任何方法进行,例如使用结合重组蛋白或污染物的树脂、膜或任何其他固体支持物实施(例如通过使用亲和层析、疏水性相互作用层析、阴离子或阳离子交换层析或分子筛层析)。重组蛋白可从含有该重组蛋白的流体使用至少一个层析柱和/或层析膜(例如,本文所述的任何层析柱或层析膜)来进行纯化。
术语“精制”是本领域的术语且意指为了从接近最终想要纯度的含有重组治疗性蛋白的流体中移出剩余微量或少量污染物或杂质而实施的步骤。例如,精制可以藉由使含有所述重组治疗性蛋白的流体通过选择性结合至存在于含有重组治疗性蛋白的流体中的目标重组治疗性蛋白或少量污染物或杂质的(多个)层析柱或(多个)膜吸收材料实施。在这样的实例中,(多个)层析柱或(多个)膜吸收材料的洗脱液/滤液含有所述重组治疗性蛋白。
例如,本公开提供如下方法,所述方法包括使包含重组蛋白的一定体积的液体从分离容器(例如,第二容器)流入第一多柱层析系统(MCCS1),使用MCCS1捕获液体培养基中的所述重组治疗性蛋白,其中将含有所述重组治疗性蛋白的MCCS1的洗脱液连续进料至第二多柱层析系统(MCCS2);并使用所述MCCS2纯化和精制所述重组治疗性蛋白,其中来自MCCS2的洗脱液是重组治疗性蛋白;并且其中所述过程是一体化的并且从所述第一容器连续运行至来自MCCS2的洗脱液,所述来自MCCS2的洗脱液是重组治疗性蛋白。
术语“多柱层析系统”或“MCCS”表示具有总共两个或多个相互连接或切换的层析柱和/或层析膜的系统。多柱层析系统的非限制性实例为周期性逆流层析系统(PCC),其含有总共两个或多个相互连接或切换的层析柱和/或层析膜。多柱层析系统的其他实例在本文描述且为本领域已知。
术语“捕获”意指为了从存在于液体培养基或经稀释液体培养基中的一种或多种其他组分(例如培养基蛋白或存在于哺乳动物细胞中或从哺乳动物细胞分泌的一种或多种其他组分(例如DNA、RNA或其他蛋白))部分纯化或分离(例如以重量计至少或约5%,例如至少或约10%、15%、20%、25%、30%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%,或至少或约95%纯的)、浓缩并稳定重组蛋白(例如,重组治疗性蛋白)而实施的步骤。通常,捕获使用结合重组蛋白的树脂实施(例如,通过使用亲和层析)。本文描述了用于从液体培养基或经稀释液体培养基捕获重组蛋白的非限制性方法且其他方法本领域已知。重组蛋白可以由液体培养基使用至少一个层析柱和/或层析膜(例如,本文所述的任何层析柱和/或层析膜)捕获。
术语“洗脱液/滤液”是本领域的术语且意指一种由层析柱或层析膜排出的流体,其含有可检测量的重组蛋白(例如,重组治疗性蛋白)。
术语”过滤”表示从液体(例如,存在于本文所述的任何系统或过程中的液体培养基或流体)移出至少一部分(例如至少80%、90%、95%、96%、97%、98%或99%)不想要的生物污染物(例如哺乳动物细胞、细菌、酵母细胞、病毒或分枝杆菌)和/或颗粒物质(例如,沉淀的蛋白质)。
术语“分泌的蛋白”或“分泌的重组蛋白”表示一种蛋白(例如,一种重组蛋白),当其在哺乳动物细胞内翻译时最初至少含有一个分泌信号序列,且至少在某种程度上通过酶在哺乳动物细胞中切割分泌信号序列使其被分泌至细胞外空间(例如液体培养基)。本领域的技术人员将会理解“分泌的”蛋白不需要与细胞完全脱离才视为是分泌的蛋白。
对于一些示例性系统配置,所述分离容器的至少一个流体出口与用于接收和/或放置废料的容器(receptacle)(例如,容器(vessel)、水槽或本领域技术人员已知的用于放置生物过程流体材料的单元)流体连通。
所述分离方法和系统允许流体流得以从含有无菌过程的灭菌系统的容器(例如,无菌过程容器)中分离。在一些实例中,所述无菌过程容器含有无菌过程并且包含用于从容器移出流体的至少一个流体出口。对于本文描述的过程和系统,所述至少一个流体出口与分离容器的至少一个流体入口流体连通,其中所述分离容器的流体入口配置成使得进入所述分离容器的流体通过分离容器内灭菌气体填充的顶部空间。
如本领域能够理解的,所述无菌过程容器可具有多种不同的体积/容积。例如,步骤中的无菌过程容器可具有约0.50L-约200L的(例如,约0.50L-约180L,约0.50L-约160L,约0.50L-约140L,约0.50L-约120L,约0.50L-约100L,约0.50L-约90L,约0.50L-约80L,约0.50L-约70L,约0.50L-约60L,约0.50L-约50L,约0.50L-约40L,约0.50L-约30L,约0.50L-约20L,约0.50L-约10L,约0.50L-约5.0L,约1.0L-约200L,约1.0L-约180L,约1.0L-约160L,约1.0L-约140L,约1.0L-约120L,约1.0L-约100L,约1.0L-约90L,约1.0L-约80L,约1.0L-约70L,约1.0L-约60L,约1.0L-约50L,约1.0L-约40L,约1.0L-约30L,约1.0L-约20L,约1.0L-约10L,约1.0L-约5.0L,约1.5L-约200L,约1.5L-约180L,约1.5L-约160L,约1.5L-约140L,约1.5L-约120L,约1.5L-约100L,约1.5L-约90L,约1.5L-约80L,约1.5L-约70L,约1.5L-约60L,约1.5L-约50L,约1.5L-约40L,约1.5L-约30L,约1.5L-约20L,约1.5L-约10L,约1.5L-约5.0L,约2.0L-约200L,约2.0L-约180L,约2.0L-约160L,约2.0L-约140L,约2.0L-约120L,约2.0L-约100L,约2.0L-约90L,约2.0L-约80L,约2.0L-约70L,约2.0L-约60L,约2.0L-约50L,约2.0L-约40L,约2.0L-约30L,约2.0L-约20L,约2.0L-约10L,约2.0L-约5.0L,约2.5L-约200L,约2.5L-约180L,约2.5L-约160L,约2.5L-约140L,约2.5L-约120L,约2.5L-约100L,约2.5L-约90L,约2.5L-约80L,约2.5L-约70L,约2.5L-约60L,约2.5L-约50L,约2.5L-约50L,约2.5L-约40L,约2.5L-约30L,约2.5L-约20L,约2.5L-约10L,约2.5L-约5.0L,约5.0L-约200L,约5.0L-约180L,约5.0L-约160L,约5.0L-约140L,约5.0L-约120L,约5.0L-约100L,约5.0L-约90L,约5.0L-约80L,约5.0L-约70L,约5.0L-约60L,约5.0L-约50L,约5.0L-约40L,约5.0L-约30L,约5.0L-约20L,或约5.0L-约10L)的内部容积。
在一些实例中,含有无菌过程的容器是生物制造系统的部件。本文考虑的生物制造系统的部件包括,例如,烧瓶、流体管道、生物反应器、层析系统的一个或多个部件(例如,层析柱)、微滤系统的一个或多个部件、或超滤/渗滤系统的一个或多个部件。
在一些实施方案中,所述生物反应器是灌注生物反应器、补料分批生物反应器或生产生物反应器。所述灌注生物反应器可为任何本文所述的或本领域已知的示例性灌注生物反应器。例如,灌注生物反应器可由不锈钢或塑料(例如,塑料无菌袋)制成。灌注生物反应器的内表面可具有至少一层涂料(例如至少一层明胶、胶原蛋白、聚-L-鸟胺酸、聚苯乙烯和层粘连蛋白涂料),且如同本领域已知的,一个或多个用于将O
所述体积的液体可例如使用机械系统和/或通过使所述体积渗过或重力流过具有排除该体积中存在的哺乳动物细胞的分子量截留的无菌膜而被移出。
如本领域能够理解的,含有无菌过程的容器可为本领域用于培养哺乳动物细胞的目的的任何装置(例如,烧瓶(例如,旋转摇瓶)、摇管或生物反应器)。例如,含有无菌过程的容器可为本领域用于培养重组哺乳动物细胞的目的的任何装置。所述容器可包括用于搅拌的内部装置(例如,叶轮)或所述容器可外部搅拌(例如,通过使用旋转和/或倾斜平台)。所述容器可由不锈钢或塑料(例如,塑料无菌袋)制成。在一些实施方案中,所述容器可以是可丢弃的一次性生物反应器(例如,Millipore TM
重组哺乳动物细胞可以是人、小鼠、仓鼠或猴细胞。例如,重组哺乳动物细胞可以是细胞系,例如,中国仓鼠卵巢(CHO)细胞(例如,CHO DG44细胞、CHO-K1s细胞、C02.31克隆细胞、A14.13克隆细胞、C02.57克隆细胞和F05.43克隆细胞)、Sp2.0、骨髓瘤细胞(例如,NS/0)、B-细胞、杂交瘤细胞、T-细胞、人胚肾(HEK)细胞(例如,HEK 293E和HEK 293F)、非洲绿猴肾上皮细胞(Vero)细胞或Madin-Darby犬(可卡犬)肾上皮细胞(MDCK)细胞。
可以使用分子生物学和分子遗传学中已知的广泛多样的方法将编码重组蛋白的核酸引入哺乳动物细胞以产生重组哺乳动物细胞。非限制性实例包括转染(例如脂转染)、转导(例如慢病毒、腺病毒或逆转录病毒感染)和电穿孔。在一些情况中,编码重组蛋白的核酸不会稳定地整合入重组哺乳动物细胞的染色体中(瞬时转染),而在其他重组哺乳动物细胞中核酸是一体化的。可替换地或此外,编码重组蛋白的核酸可以存在于质粒中和/或存在于哺乳动物人工染色体(例如人的人工染色体)中。可替换地或此外,该核酸可使用病毒载体(例如慢病毒、逆转录病毒或腺病毒载体)引入哺乳动物细胞中。可将该核酸可操作地连接至启动子序列(例如强启动子,如β-肌动蛋白启动子和CMV启动子,或诱导型启动子)。含有核酸的载体(若需要的话)还可包含可选择标记(例如赋予哺乳动物细胞潮霉素、嘌呤霉素或新霉素抗性的基因)。
液体培养基(培养基)为本领域已知。液体培养基可补充有哺乳动物血清(例如,胎牛血清和牛血清)和/或生长激素或生长因子(例如胰岛素、转铁蛋白和表皮生长因子)。本文描述的任何液体培养基可以选自下组:无动物衍生组分液体培养基、无血清液体培养基、含血清液体培养基、化学限定的液体培养基和无蛋白质液体培养基。化学限定的液体培养基的非限制性实例、无动物衍生组分液体培养基、无血清液体培养基和含血清液体培养基是商业上可购得的。
液体培养基通常包括能量来源(例如,碳水化合物,如葡萄糖)、必须氨基酸(例如二十种氨基酸加上半胱胺酸的基本组合)、维生素和/或以低浓度需要的其他有机化合物、游离脂肪酸和/或微量元素。液体培养基(例如,第一和/或第二液体培养基)可(若需要的话)补充有例如哺乳动物激素或生长因子(例如胰岛素、转铁蛋白或表皮生长因子)、盐和缓冲液(例如,钙、镁和磷酸盐)、核苷和碱基(例如腺苷、胸苷和次黄嘌呤)、蛋白质和组织水解物和/或这些添加剂的任意组合。
可用于在本文所述任何方法的任何步骤中培养细胞(例如哺乳动物细胞)的广泛多种不同液体培养基为本领域已知。可用于本方法中的培养基组分包括但不限于化学限定的(CD)水解物,例如CD蛋白胨、CD多肽(两个或多个氨基酸)和CD生长因子。液体组织培养基和培养基组分的其他实例为本领域已知。
获得自重组哺乳动物细胞培养物的液体培养基可以经过滤或澄清以获得基本上不含细胞和/或病毒的液体培养基。用于过滤或澄清液体培养基以移除细胞的方法为本领域已知(例如,0.2-μm过滤,使用交替切向流(ATF
在本文所述的任何方法的任何步骤中使用的液体培养基可以是本文所述或本领域已知任何类型的液体培养基。在本文所述用于分离重组蛋白的任何示例性方法中,从生产细胞培养物获得的液体培养基可以通过添加第二流体(例如,缓冲液)来稀释。
含有重组蛋白(例如,重组治疗性蛋白)的基本上无细胞的液体培养基可以在将重组蛋白分离之前(例如,将液体培养基进料入第一MCCS(例如,第一PCCS)之前)储存(例如,在低于约15℃的温度(例如低于约10℃、低于约4℃、低于约0℃、低于约-20℃、低于约-50℃、低于约-70℃或低于约-80℃)至少1天(例如至少约2天、至少约5天、至少约10天、至少约15天、至少约20天或至少约30天)。或者,在一些实例中,将含有重组蛋白的基本上不含细胞的液体培养基进料入用于分离重组蛋白的系统。
重组蛋白可以是重组治疗性蛋白。能够通过本文提供的方法产生的重组治疗性蛋白的非限制性实例包括免疫球蛋白(包括轻链与重链免疫球蛋白、抗体或抗体片段(例如,本文所述的任何抗体片段))、酶(例如,半乳糖苷酶(例如α-半乳糖苷酶)、
分泌的可溶性重组蛋白可以从液体培养基藉由移出或以其他方式在物理上将液体培养基与细胞(例如哺乳动物细胞)分开而回收。用于将液体培养基从细胞(例如哺乳动物细胞)移出的各种不同方法为本领域已知,包括例如离心、过滤、吸取和/或抽吸。随后可回收分泌的重组治疗性蛋白并使用各种生化技术从液体培养基中分离,所述生化技术包括各种类型层析(例如亲和层析、分子筛层析、阳离子交换层析、疏水相互作用层析或阴离子交换层析)和/或过滤(例如分子量截留过滤)。
可通过连续或周期性的移出将流体从无菌过程容器移出。在一些实例中,从无菌过程容器移出的流体包含重组蛋白。在一些实例中,从无菌过程容器移出的流体包含培养基。在一些实例中,从无菌过程容器移出的流体不包含重组蛋白。
实施例
本发明在以下实施例中进一步描述,以下实施例不限制本发明的范围,本发明的范围在权利要求的范围中描述。
图2描述了用于根据本发明从非无菌环境分离无菌工艺流的示例系统。所述系统可以是任何无菌过程,包括,例如,生物制造工艺流的部件。如图2中所示,所述系统包含无菌过程容器(110)(例如,第一容器),其包含流体出口(130)。对于生物制造工艺流,所述第一容器可以是例如用于使液体培养基流动的流体管道、生物反应器(例如,本文描述的或本领域已知的任何示例性生物反应器)、层析系统的一个或多个部件(例如,层析柱)、微滤系统的一个或多个部件、超滤/渗滤系统的一个或多个部件。图2中描述的系统进一步包括分离容器(120)(例如,第二容器),所述分离容器(120)包含经由流体管道(210)与第一容器(110)的流体出口(130)流体连通并且配置成使得进入第二容器的流体通过第二容器(120)内灭菌气体填充的顶部空间(150)的流体入口(140)、配置成使得离开第二容器的流体自所述第二容器(120)内的所述灭菌气体填充的顶部空间(150)之下移出的流体出口(130)。所述第二容器包括至少一个气体入口(180),以经由气体管道(220)供应灭菌气体以填充第二容器的顶部空间。所述第二容器还包括至少一个气体出口(160),其配置成连续或周期性地从分离排出气体。
图1提供用于根据本发明从非无菌环境分离无菌工艺流的示例性实施方案。对于图1中描述的系统,来自无菌过程容器(例如,第一容器,未显示)的废料流与分离容器(例如,第二容器)流体连通,所述分离容器配置成使得流体进入第二容器的顶部并通过第二容器内灭菌气体填充的顶部空间。第二容器进一步包含流体出口,所述流体出口配置成使得离开第二容器的流体从第二容器内灭菌气体填充的顶部空间之下移出(即,在第二容器的流体填充部分之下)。图2进一步展示了泵系统,所述泵系统包含泵,其被配置成将一定体积的流体从第二容器出口移出并使所述体积流入用于放置生物废料流的容器。所述第二容器包括至少一个气体入口,其与用于生成或递送灭菌气体的或用于生成和递送灭菌气体的系统(例如,生成臭氧的系统)气体连通以填充第二容器的顶部空间。根据这一实施方案,将灭菌气体喷射入第二容器。所述第二容器还包括至少一个气体出口,其配置成连续或周期性地从分离过程排出气体。
其他实施方案
要理解的是,尽管本发明已经结合实施方式进行了描述,但是前述说明书拟在阐释而非限制本发明的范围,本发明的范围由所附权利要求的范围来限定。其他方面、优势和修改形式在以下权利要求的范围的范围之内。
- 从消毒处理容器一体化连续分离流体流
- 从消毒处理容器一体化连续分离流体流
