一种小分子非编码RNA及宿主基因在胃癌诊断及治疗的应用
文献发布时间:2023-06-19 11:59:12
技术领域
本发明涉及一种小分子非编码RNA(microRNA-210)与其宿主基因(lncRNAMIR210HG),具体涉及小分子非编码RNA(microRNA-210)与其宿主基因(lncRNA MIR210HG)用于胃癌诊断及治疗的应用,属于肿瘤学领域。
背景技术
胃癌(Gastric Cancer)是世界上第四大常见的癌症,在全球男性中发病率排第四位,女性中排第五位。尽管胃癌在一些国家的发病率有所降低,但由于具有高致死性,胃癌在与癌症相关的死亡中位居世界第二。我国是胃癌高发国家,最新统计数据表明,在中国,胃癌的发病率高达每10万人有679.1人,死亡率达每10万人有498.0人。近年来,得益于胃肠镜检查的普及和手术技术的革新,早期胃癌患者五年死亡率显着降低;然而,晚期胃癌患者,五年死亡率仍保持在30~50%。
由于胃癌起病隐匿,早期无明显症状,加之缺乏有效的筛查手段,导致80%胃癌患者诊断时已处于进展期,错失根治性切除机会;此外,晚期胃癌患者的死亡原因常常与腹膜、血道和淋巴结转移有关。可见,早期诊断治疗以及有效防治胃癌转移是增加胃癌患者生存率,降低胃癌死亡率的有效途径。
目前临床上主要通过肿瘤标志物,包括癌胚抗原(CEA)、糖蛋白类抗原(CA19-9、CA125)等以及胃肠镜、影像学检查筛查胃癌。然而肿瘤标志物敏感性和特异性不高。尽管超声、CT、MRI等影像学检查方法以及胃肠镜检查可以作为肿瘤标志物的补充,但是这些方法的检出率有赖于肿瘤大小及操作者的经验,因而可能出现误诊、漏诊的情况。因此,发现新的高敏感性、高特异性,且低廉又易于检测的胃癌诊断标志物具有重要的临床意义。
早期胃癌患者临床治疗以手术切除为主,对于失去手术机会和术后复发的患者,以辅助化疗为主的治疗方案。胃癌对放疗的敏感度较低,故较少采用放疗。目前用于胃癌化疗的药物主要包括氟尿嘧啶(5-Fu)、丝裂霉素(MMC)、司莫司汀(甲基环已亚硝脲)以及多柔比星(阿霉素)等。近些年,靶向治疗已然成为癌症治疗的趋势。靶向治疗是指在细胞分子水平上,针对明确的致癌位点(如靶基因)设计相应药物的治疗方式,靶向治疗的药物进入体内会特异地结合致癌位点,使肿瘤细胞特异性死亡,而不会波及肿瘤周围的正常组织细胞。目前临床使用靶向治疗药曲妥珠单抗治疗Her2阳性的胃癌患者,然而对胃癌的靶向治疗研究仍然较少。寻找新的作用靶点,研究和开发胃癌特异的靶向药物,有利于胃癌的有效防治。
研究发现,60%的人类基因组DNA可被广泛转录,而只有不到2%的基因编码蛋白。然而这些非编码RNA具有重要的生物学功能,参与调控细胞分化、增殖、凋亡等生命活动,在胚胎发育、机体代谢、疾病发生发展等多种生理和病理过程中发挥重要作用。目前已知非编码RNA主要有微RNA(microRNA),长链非编码RNA(lncRNA),环状RNA(circRNA),小核仁RNA(snoRNA),Piwi相互作用RNA(piRNA)等。近年来,研究人员发现microRNA等非编码RNA可作为肿瘤等疾病的生物标志物,适用于高危人群筛查;此外,这些非编码RNA参与肿瘤的发生发展,发挥癌基因或抑癌基因的作用,可作为肿瘤药物开发的潜在靶点或用于肿瘤药物的制备。
在本发明研究过程中,发明人基于胃癌成对癌巢与癌旁组织的检测,确定了小分子非编码RNA(microRNA-210)与其宿主基因(lncRNA MIR210HG)在胃癌癌巢表达水平升高,表明两者可作为胃癌诊断生物标志物的潜能。与此同时,发明人还通过体外转移小室及体内小鼠尾静脉注射肿瘤细胞肺转移模型,表明microRNA-210与lncRNA MIR210HG及两者的共用转录因子可作为制备抑制胃癌转移药物的靶点。
发明内容
基于此,本发明的目的在于克服现有技术的缺点与不足,提供一种操作简便、能够有效诊断胃癌的诊断标志物。
为实现上述技术目的,本发明提供了一种小分子非编码RNA,所述小分子非编码RNA为microRNA-210,其核苷酸序列如SEQ ID NO.1所示。
进一步,所述小分子非编码RNA的宿主基因为MIR210HG,MIR210HG的核苷酸序列如SEQ ID NO.2所示。
进一步,所述小分子非编码RNA及其宿主基因的共用启动子为c-Myc。
如上所述的小分子非编码RNA在胃癌诊断中的应用。
如上所述的小分子非编码RNA在作为制备抑制胃癌转移药物靶点和/或制备抗肿瘤药物靶点中的应用。
如上所述的小分子非编码RNA的宿主基因在胃癌诊断中的应用。
如上所述的小分子非编码RNA的宿主基因在作为制备抑制胃癌转移药物靶点和/或制备抗肿瘤药物靶点中的应用。
如上所述的小分子非编码RNA及其宿主基因的共用启动子在作为制备抑制胃癌转移药物靶点中的应用和/或制备抗肿瘤药物靶点中的应用。
本发明还提供一种用于胃癌诊断的试剂盒,包括如上所述的小分子非编码RNAmicroRNA-210及其宿主基因MIR210HG。
与现有技术相比,本发明的有益效果是:本发明的microRNA-210及lncRNAMIR210HG可作为胃癌的特异性标志物。此外,本发明的microRNA-210、lncRNAMIR210HG以及两者的共用转录因子还可作为制备抑制胃癌转移或抗肿瘤药物的靶点。
为了更好地理解和实施,下面结合附图详细说明本发明。
附图说明
图1为本发明实施例1胃癌患者成对癌巢与癌旁组织microRNA-210与MIR210HG的表达水平。
图2为本发明实施例3体外转移小室结果图。其中,(A)为敲低microRNA-210或/和MIR210HG对抑制胃癌细胞迁移的影响,(B)为过表达microRNA-210或/和MIR210HG对胃癌细胞迁移能力的影响。
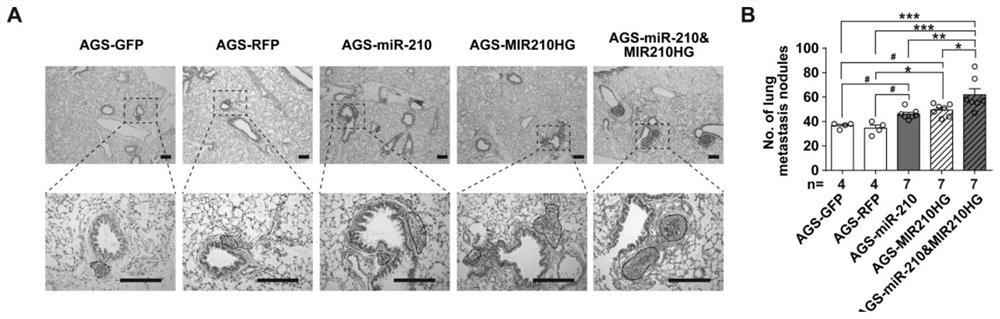
图3为本发明实施例4体内小鼠尾静脉注射胃癌细胞肺转移结果图。其中,(A)为小鼠肺组织HE染色结果图,(B)为小鼠肺组织转移结节统计结果图。
图4为本发明实施例5鉴定microRNA-210与MIR210HG共用转录因子c-Myc的结果图。其中,(A)为采用siRNA敲低c-Myc对microRNA-210与MIR210HG表达的影响,(B)为采用抑制剂敲低c-Myc对microRNA-210与MIR210HG表达的影响,(C)为过表达c-Myc对microRNA-210与MIR210HG表达的影响。
图5为本发明实施例6中c-Myc抑制剂对胃癌细胞肺转移的影响。其中,(A)为小鼠肺组织HE染色结果图,(B)为小鼠肺组织转移结节统计结果图。
具体实施方式
以下实施例便于理解本发明,但并不限定本发明。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明所用术语应用的语境及具体定义将在下文中列出,以帮助理解本发明。这些定义不用于限制本发明的范围。
本发明所用术语“胃癌”是指起源于胃黏膜上皮的恶性肿瘤。
本发明所用术语“microRNA”是指一类广泛存在于真核生物中的内源性小分子非编码RNA,长度为18~24个核苷酸(nt)。
本发明所用术语“lncRNA”是指一类广泛存在于真核生物中的内源性非编码RNA,长度为200个核苷酸(nt)以上。
本发明所用术语“宿主基因”是指一类内含子microRNA所在的编码或非编码基因。
本发明所用试剂、序列相关信息将在下文列出,以帮助理解本发明。
本发明所采用的PrimeScript RT reagent Kit with gDNA Eraser逆转录试剂盒购自TAKARA公司(日本),2x SYBR Green qPCR Master Mix试剂盒购自Biotool公司(美国)。引物公司购买或自行设计,其中U6、microRNA-210引物购买自锐博公司(广州),货号分别为MQPS0000002-1、MQPS0000810-1;ACTB及MIR210HG引物为自行设计,其DNA序列为:
ACTB F:5’-AAGATGACCCAGATCATGTTTGAG-3’(如SEQ ID NO.3所示)
ACTB R:5’-GCAGCTCGTAGCTCTTCTCCAG-3’(如SEQ ID NO.4所示)
MIR210HG F:5’-TTTGTGTGCTCCAGAGAAAG-3’(如SEQ ID NO.5所示)
MIR210HG R:5’-ACAAGTTTGCCCTAGATCAT-3’(如SEQ ID NO.6所示)。
优选的外参NC67序列是基于与人类基因组序列没有同源性的线虫miR-67成熟体序列所设计的双链RNA,其检测序列为5’-UCACAACCUCCUAGAAAGAGUAGA-3’(如SEQ ID NO.7所示)。
实施例1:检测microRNA-210及MIR210HG在临床样本中的表达水平
本发明的试验已得到由中山大学附属第六医院以及南方医科大学南方医院伦理委员会的批准,并获得参与者的知情同意。本发明人于中山大学附属第六医院以及南方医科大学南方医院分别采集31对及19对胃癌患者成对的癌巢与癌旁组织,共计50对。液氮速冻后放于置于-80℃中保存备用。
1、RNA提取
(1)取50-100mg组织,优选地加入1ml Trizol裂解液,充分振荡混匀,冰浴15min。
(2)加入200μl预冷氯仿,振荡混匀,4℃,12000g离心15min。
(3)转移上清,加入等体积异丙醇,振荡混匀,4℃,16000g离心30min。
(4)小心倾倒上清,用1ml 70%乙醇洗涤沉淀一次,4℃,16000g离心10min。
(5)弃上清,待乙醇挥发后,加入10μl DEPC(焦碳酸二乙酯)处理过的水溶解,置于-80℃中保存备用。
2、实时定量RT-qPCR检测及分析
本发明采用TAKARA公司的PrimeScript RT reagent Kit with gDNA Eraser逆转录试剂盒进行逆转录,具体程序为:1)42℃2min;2)37℃15min;3)85℃5s。获得的cDNA于-20℃保存。
本发明采用Biotool公司的2x SYBR Green qPCR Master Mix试剂盒,以稀释10倍的cDNA为模板,优选地采用相应引物进行RT-qPCR检测。所述试剂盒包括5对引物,分别为:microRNA-210、MIR210HG、U6、ACTB以及检测外参NC67的引物。PCR程序为:1)95℃10min;2)95℃10s,60℃1min,保持1.6℃/s的升降温速度;3)以39个循环重复2);4)熔解曲线分析,95℃20s,60℃20s,然后以0.11℃/s的速度升温至95℃;5)40℃30s结束程序。
本发明采用LightCycler 480自带的软件进行RT-qPCR数据分析。通过相应参照校准,得到microRNA-210及MIR210HG的表达值2
实施例2:诊断试剂盒的制作
本发明试剂盒用于胃癌检测以及胃癌诊断,由样品RNA提取系统、逆转录系统、实时定量RT-qPCR系统、引物系统以及结果分析系统组成。
其中所述试剂盒的样品RNA提取系统中,发明人采用Trizol试剂提取,异丙醇沉淀的方法获得RNA。优选地,血液样本采用加有外参NC67的Trizol试剂提取,进一步结合酚/氯仿抽提纯化、糖原助沉获得RNA。发明人采用TAKARA公司的PrimeScript RT reagent Kitwith gDNAEraser逆转录试剂盒进行逆转录。发明人采用锐博公司引物或自行设计引物作为所述试剂盒的引物系统,包括microRNA-210、MIR210HG、U6、ACTB以及NC67(外参)的引物。实时定量RT-qPCR系统中,发明人采用Biotool公司的2x SYBR Green qPCR Master Mix试剂盒进行检测。结果分析系统发明人采用LightCycler 480自带的软件进行RT-qPCR数据分析,通过相应参照校准,得到microRNA-210及MIR210HG在待检样本中的水平2
实施例3:体外转移小室实验
体外转移小室实验是通过检测计数迁移到转移小室基底膜另一侧的肿瘤细胞来评价肿瘤细胞迁移侵袭能力的实验。本发明通过以下体外转移小室实验结合缺失性功能实验以及获得性功能实验两方面研究microRNA-210与MIR210HG在体外对胃癌细胞迁移能力的影响:
1、缺失性功能实验
(1)采用siRNA或microRNA反义核苷酸分别敲低基因或microRNA。上述siRNA为MIR210HG的siRNA:siMIR210HG-1以及siMIR210HG-2,为分别靶标MIR210HG不同位点的siRNA,其阴性对照为NC;microRNA反义核苷酸为microRNA-210的反义核苷酸Anti-miR-210,其阴性对照为Anti-NC。实验终浓度分别为50nM siRNA及200nM反义核苷酸。根据不同组合形式,设置以下组别:
阴性对照组:Anti-NC+NC;
实验组一:Anti-miR-210+NC;
实验组二:Anti-NC+siMIR210HG-1;
实验组三:Anti-NC+siMIR210HG-2;
实验组四:Anti-miR-210+siMIR210HG-1;
实验组五:Anti-miR-210+siMIR210HG-2。
(2)将上述不同组合的RNA稀释于100μl OPTI-MEMI,混匀后每管加入1μlLipofectamine RNAiMAX,轻柔混匀,室温放置15min。
(3)向24孔板中每孔加入100μl上述转染体系,再加入500μl细胞悬液。
(4)细胞转染48小时后,胰酶消化细胞计数,细胞经无血清DMEM培养基洗涤一次。
(5)转移小室下室加入600μl含10%血清的DMEM培养基,上室加入100μl无血清DMEM培养基重悬的6×10
(6)37℃培养20小时后,甲醇固定小室15分钟,0.1%结晶紫染色15分钟。随后,采用棉棒擦掉小室上层细胞,再用显微镜观察,拍照,计数迁移细胞数目。
结果表明,敲低microRNA-210或MIR210HG可以抑制胃癌细胞迁移,共同敲低两者抑制效果进一步加强(图2A)。
2、获得性功能实验
(1)采用慢病毒感染获得胃癌细胞稳定株,包括:
阴性对照稳定株一:AGS-GFP;
阴性对照稳定株二:AGS-RFP;
microRNA-210过表达稳定株:AGS-miR-210;
MIR210HG过表达稳定株:AGS-MIR210HG;
microRNA-210与MIR210HG同时过表达稳定株:AGS-miR-210&MIR210HG。
(2)胰酶消化细胞计数,细胞经无血清DMEM培养基洗涤一次。
(3)转移小室下室加入600μl含10%血清的DMEM培养基,上室加入100μl无血清DMEM培养基重悬的6×10
(4)37℃培养13小时后,甲醇固定小室15分钟,0.1%结晶紫染色15分钟。随后,采用棉棒擦掉小室上层细胞,再用显微镜观察,拍照,计数迁移细胞数目。
结果表明,microRNA-210及MIR210HG过表达稳定株细胞较对照组迁移能力增强,共同过表达两者的稳定株细胞迁移能力进一步加强(图2B)。
实施例4:体内小鼠尾静脉注射肿瘤细胞肺转移模型
小鼠尾静脉注射肿瘤细胞肺转移模型是通过小鼠尾静脉注射肿瘤细胞,一定时间后收取小鼠肺组织用于石蜡包埋切片,随后通过HE染色,显微镜镜下计数肿瘤结节,以此反映肿瘤细胞肺转移能力。本实施例选取NOD-SCID免疫缺陷小鼠作为研究材料。具体步骤如下:
1.取处于对数生长期的5株胃癌稳定株(上述AGS-GFP、AGS-RFP、AGS-miR-210、AGS-MIR210HG和AGS-miR210&MIR210HG),用胰蛋白酶消化成细胞悬液,500g离心3分钟。
2.1×PBS洗涤细胞后计数,配制成5×10
3.尾静脉注射10周后,安乐死小鼠并收集其肺组织用于石蜡包埋切片,随后通过HE染色,显微镜镜下计数肿瘤结节。
结果表明,microRNA-210及MIR210HG过表达稳定株细胞在小鼠体内肺转移能力较对照组增强,共同过表达两者的稳定株细胞在小鼠体内肺转移能力进一步加强(图3)。
实施例5:鉴定microRNA-210及MIR210HG的共用转录因子
基因表达异常主要受表观遗传调控以及转录调控。本实施例中,发明人通过信息学预测microRNA-210及MIR210HG上游启动子以及可能结合该启动子区域的转录因子。预测结果显示,转录因子c-Myc可能结合microRNA-210及MIR210HG的共用启动子,进而调控microRNA-210及MIR210HG的转录。进一步,通过以下三个实验证明c-Myc调控microRNA-210及MIR210HG的转录:
1、采用siRNA敲低c-Myc可抑制microRNA-210及MIR210HG的表达
(1)采用siRNA敲低c-Myc:sic-Myc-1以及sic-Myc-2,为分别靶标c-Myc不同位点的siRNA,其阴性对照为NC。实验终浓度为50nM siRNA,并设置以下组别:
阴性对照组:NC;
实验组一:sic-Myc-1;
实验组二:sic-Myc-2。
(2)将上述RNA稀释于100μl OPTI-MEMI,混匀后每管加入1μl LipofectamineRNAiMAX,轻柔混匀,室温放置15min。
(3)向24孔板中每孔加入100μl上述转染体系,再加入500μl胃癌细胞悬液。
(4)细胞转染48小时后,500μl Trizol裂解细胞,提取RNA。
(5)采用TAKARA公司的PrimeScript RT reagent Kit with gDNAEraser逆转录试剂盒进行逆转录。
(6)进一步采用Biotool公司的2x SYBR Green qPCR Master Mix试剂盒进行RT-qPCR检测,通过LightCycler 480自带的软件进行RT-qPCR数据分析,通过相应参照校准,得到microRNA-210及MIR210HG在待检样本中的水平2
结果表明(图4A),敲低c-Myc可以抑制microRNA-210及MIR210HG的转录。
2、采用抑制剂敲低c-Myc可抑制microRNA-210及MIR210HG的表达
(1)提前一天在24孔板中种植1×10
(2)采用c-Myc抑制剂10058-F4敲低c-Myc,并设置以下组别:
阴性对照组:DMSO;
实验组一:50μM抑制剂10058-F4;
实验组二:100μM抑制剂10058-F4;
实验组三:200μM抑制剂10058-F4。
(3)细胞处理48小时后,500μl Trizol裂解细胞,提取RNA。
(4)采用TAKARA公司的PrimeScript RT reagent Kit with gDNA Eraser逆转录试剂盒进行逆转录。
(5)进一步采用Biotool公司的2x SYBR Green qPCR Master Mix试剂盒进行RT-qPCR检测,通过LightCycler 480自带的软件进行RT-qPCR数据分析,通过相应参照校准,得到microRNA-210及MIR210HG在待检样本中的水平2
结果表明(图4B),c-Myc抑制剂10058-F4的处理可以抑制microRNA-210及MIR210HG的转录。
3、过表达c-Myc可促进microRNA-210及MIR210HG的表达
(1)提前一天在24孔板中种植1×10
(2)采用Lipofectamine 3000转染质粒,设置以下组别:
阴性对照组:500ng pCDH;
实验组:500ng pCDH-c-Myc。
(3)将上述质粒稀释于25μl OPTI-MEMI,混匀后每管加入1μl p3000,轻柔混匀为A管。与此同时配置另一管25μl OPTI-MEMI的B管,该管含1μl Lipofectamine 3000,轻柔混匀。将A管与B管轻柔混匀,室温放置5-10min。
(4)向种植有胃癌细胞的24孔板中加入50μl上述转染体系。
(5)细胞转染48小时后,500μl Trizol裂解细胞,提取RNA。
(6)采用TAKARA公司的PrimeScript RT reagent Kit with gDNA Eraser逆转录试剂盒进行逆转录。
(7)进一步采用Biotool公司的2x SYBR Green qPCR Master Mix试剂盒进行RT-qPCR检测,通过LightCycler 480自带的软件进行RT-qPCR数据分析,通过相应参照校准,得到microRNA-210及MIR210HG在待检样本中的水平2
结果表明(图4C),过表达c-Myc可以促进microRNA-210及MIR210HG的转录。
实施例6:抑制microRNA-210及MIR210HG的共用转录因子减少体内小鼠肺转移
1.取处于对数生长期的AGS胃癌细胞株,用胰蛋白酶消化成细胞悬液,500g离心3分钟。
2.1×PBS洗涤细胞后计数,配制成5×10
3.尾静脉注射1周后,将小鼠随机分成三组:①PBS组②玉米油溶剂组③c-Myc抑制剂组(10058-F4,Selleck,#S7153)。其中PBS组和玉米油溶剂组按每只25g小鼠腹腔注射100μl的PBS或玉米油溶剂,c-Myc抑制剂组按20mg抑制剂(10058-F4)/kg小鼠的量来进行腹腔注射。
4.每周同一时间根据老鼠体重来进行腹腔给药,总共给药8次。
5.给药结束后的两个星期后,安乐死小鼠并收集肺组织用于石蜡包埋切片,随后通过HE染色,显微镜镜下计数肿瘤结节。
结果表明(图5),c-Myc抑制剂10058-F4的处理可以抑制胃癌细胞在小鼠体内肺转移。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
序列表
<110> 暨南大学
<120> 一种小分子非编码RNA及宿主基因在胃癌诊断及治疗的应用
<160> 7
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> RNA
<213> 智人(Homo sapiens)
<400> 1
CUGUGCGUGU GACAGCGGCU GA 22
<210> 2
<211> 1991
<212> DNA
<213> 智人(Homo sapiens)
<400> 2
GAGGGTGCCA GCGGCCGCAG CTGAAGTTGG GCCGAGAGCC GGCGACGGCC CCGCGCCGGG 60
GTCGCAGGCC TGCAGGAGTT GAGGGCTGCA CCTGCTCGCT GGAGAGGGAG AGGCAGATTT 120
AGTGGACGCC TGGCATGGAC TCGGACTGGC CTTTGGAAGC TCCCTGCCCT GACGGGGTTG 180
CCTGTCACCA CTGCGAAGTG AGGCTTGGCA GGACCTGCAC CTGAGAAAGG CTGTGTGTGG 240
TCTTGGGGTC CACACCTGCA GAGCTAACTT ACTGCCAGAC GGCGACTTAC TGTGGGCCAC 300
CCTCAGTGAA CCGGGGTGTC CTCAGCTGGC CCTACAGAGC ACTTCTGTGC TGGGGATGAG 360
TAGGAACTCT GGGCGAGGAG GGTCCCAGCG CCGCCCCTCG ATACAGCCTG GCTCTGCCCT 420
CTGCCCGTAC TTACACCAGG TGGGATCCCT GCCCTGCATT GCCTGGGGAT TGGCTGGGCT 480
TGGGCCCGCC CTGCTGTGGA ACTGGATGTT TTCAGGGAGC CCAGCCTTTC CTCATGTCAA 540
CACAGTTCAC AATATAGTTT TCAAAGTACA GTTTAAAACT CAAAAGTAAA CTTTTCAGCA 600
ACTCAAAGGT TTGCTGAGTG ATCTGAAGCA CTCTGGCCAC TTTTTGGGGC CATGGGATTT 660
GGTTCACCTG AAACAGCCAG TGAGAGGCCG GGTGTGGTGG CTCACACCCG TAATCCCAAC 720
ACTTCAGGAG GCAGACGCGG GTGATCGCTC ACTTGAGATC AGGAGTTCAA GACCAGCCTG 780
GGCAACATGG TGAAACCTCG TCTCTACTAA AAATACAAAA ATTAGCTAGG CATGGTGGTG 840
GGCACCTGTA ATCCCAGCTA CTTGGAAGGC TGAGGCAAGA GAATCGCTTG AACCTGGGAG 900
GTGGAGGTTG CAGCGAGACG AGATTACGCC GCTGCACTCC AGCCTGGGTG ACGAGAGACT 960
CTGCCTCAAA AAAATAAAAA AATGAAACAG CCAGTGAGGA GGAAGGCTCC CCGCCTTCCC 1020
CCCGCCGGAA CATAGCCATA GCTGCTGCTG GGACACCCTC TTGGTGGGGA AGAAGGCTGG 1080
TTAGCTTCAT CAGAGCCAGC AGCAGCAGAC CAGGGACGGG CACCTAGGCA GTGGCCTCAG 1140
AGTGAACAGG AGTTCCTCAG AAACACACAC AGGGACGGCG TGGCGCATGC TCTGCCAGCT 1200
CCATGCCTCC TTCCCATTGT GGGGCTGGGG TACGTAGGGC AGAGCTCATG ACCTCCGGGA 1260
GGACATGGGG GTGGGCTCTG GATGGCACCT GGCATTGCCC CCTGCTGGCC TATGTGACGG 1320
TGTGGAGGGC TGGTCACAGA GGTACGACCA TCCCTCCAGA ATGTGGGTCG GGGCTGTGGA 1380
TGGAGGAGTA GGCCCCTCAT ATCCCAGGCC TGCTGCCCAG GCACAACCCA CTTGGCCTAT 1440
GCATTCCAGG CTCCATCCCA TGTGACTCTG GGCTTAGCCC CTTCTGGGGC CACAGGTCAG 1500
GCAGGTCCAG GCCCCAAGGA CCTCCCAGTG ACAGGCGACT GTGAGCTGGG CAGACAGGAG 1560
TGAAGTCAGG TGGGGGTTCT GGCTTGCTGA CACCAGCGTT TGGAGCCTCC TGCTGCTGCC 1620
TGGCTTCCCT GCATTCCCTG TTCCCTGCCT CAGGCAAGAA ATAACCAAGC CGAGTTGCCT 1680
CTGCACAGCA GTGAGCTCCT GGTGGCCCTG GCTTCTGGGG AGCCCTGTGG ATGGCTTCCT 1740
TGCCCAAGTC CAGGCCTTCT TGTTCCCTTT GTGTGCTCCA GAGAAAGGGG GCAGCACCAG 1800
ATCCAGATCC AGGGCCAACC AACAGAAAGC TGAGTCCATC CCAAACTCGC CCATTCTCAG 1860
AGCACAAAGA CCCCATGATC TAGGGCAAAC TTGTCCAACT GTTGGCCCAT GGAACAGCTT 1920
TGAATGCAGC CCAACACAAA TCTATAAATT TTCTTAAACA TCAAAAAAAA AAAAAAAAAA 1980
AAAAAAAAAA A 1991
<210> 3
<211> 24
<212> DNA
<213> 人工序列
<400> 3
AAGATGACCC AGATCATGTT TGAG 24
<210> 4
<211> 22
<212> DNA
<213> 人工序列
<400> 4
GCAGCTCGTA GCTCTTCTCC AG 22
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<400> 5
TTTGTGTGCT CCAGAGAAAG 20
<210> 6
<211> 20
<212> DNA
<213> 人工序列
<400> 6
ACAAGTTTGC CCTAGATCAT 20
<210> 7
<211> 24
<212> RNA
<213> 人工序列
<400> 7
UCACAACCUC CUAGAAAGAG UAGA 24
- 一种小分子非编码RNA及宿主基因在胃癌诊断及治疗的应用
- CCAT1长链非编码RNA及其小分子抑制剂在肝细胞癌治疗方面的应用
