蛋白酶体抑制剂PR171在制备治疗骨质疏松药物上的应用
文献发布时间:2023-06-19 12:05:39
技术领域
本发明涉及骨质疏松药物技术领域,特别涉及一种蛋白酶体抑制剂PR171在制备治疗骨质疏松药物上的应用。
背景技术
骨质疏松症(Osteoporosis,简称OP)是一种系统性、代谢性的骨骼疾病,是指人体的骨含量减少和骨微小结构改变,其特征在于骨量减少和骨组织微结构的恶化及易发生骨折,增加了骨的脆性,容易导致骨折,尤其是髋部的骨折,导致患者的身体机能和生活质量显著降低。随着经济和社会的发展,社会老龄化的日益加重,OP是常见的慢性疾病之一,在老年人的骨疾病中居于首位,使患者尤其是绝经后女性患者更容易发生脆性骨折。因此,治疗骨质疏松症的最终目标是恢复骨折前的功能水平并降低随后的骨折风险。
成骨细胞(osteoblasts,OB)是骨骼形成的主要功能细胞,它们负责骨骼基质的合成、分泌和矿化。成骨细胞起源于骨髓间充质干细胞,最初前体成骨细胞不断增殖,然后成骨细胞进一步成熟,和胶原一起共同组成基本骨架,经过钙磷元素的沉积生成新的骨质。在1873年,Kolliker首次报道发现破骨细胞(osteoclasts,OC),破骨细胞来源于单核巨噬细胞系,是专门的骨吸收细胞,破骨细胞在骨表面上移动时吸收骨基质,可以控制生理和病理性骨转换,参与骨骼代谢的全过程。骨代谢平衡依赖骨形成和骨吸收的平衡,一旦破骨细胞介导的骨吸收过度活跃时,会导致骨质疏松症等骨病的发生。
蛋白酶体就是存在于真核细胞中的蛋白酶复合体,它可以将细胞内非必需的蛋白质降解成短肽,进一步清除非必需蛋白质,在机体蛋白质代谢中尤为重要。PSME1(Proteasome activator complex subunit 1,蛋白酶体激活剂复合物亚基1)是11s自酶体调节基因亚基(又称PA28α)的编码基因,位于人类染色体14q11.2。研究报道,PSME1在多种人类恶性肿瘤,如胃癌、白血病中表达下调,参与多种癌症相关通路,在癌症的发生发展中发挥重要作用,但PSME1在骨质疏松中的作用与机制尚无文献报道。PSME2(Proteasomeactivator complex subunit 2,蛋白酶体激活剂复合物亚基2)是PA28家族的成员,又称为11S调节复合物β亚基(REG beta)、多催化蛋白酶亚基2的激活剂和蛋白酶体激活剂28亚基β(PA28β),在多种细胞的胞浆中被发现。PSME2在多种恶性肿瘤的进展中发挥作用。PSME2可与PSME1形成异二聚体。PSME2与免疫蛋白酶体组装有关,是高效抗原处理所必需的。研究发现,PSME2激活复合物通过改变蛋白酶体的裂解模式来促进I类结合肽的生成。
Wnt信号通路具有调控机体组织发育、体内平衡和再生等一系列重要生理功能。Nusse等为Wnt通路的发现贡献了丰富证据,1982年Nusse首次从小鼠乳腺癌中发现一种可以调节生长和发育的基因,命名为Int基因,将Int基因和果蝇的无翅基因(Wingless基因)依据相同功能统称为Wnt基因。由Wnt基因调控的相关信号通路被称作Wnt信号转导途径。Wnt信号通路是生物体内高度保守的信号通路,是胃癌、肝癌、骨肉瘤等肿瘤病理过程中的重要因素。随着对Wnt信号分子、相关靶蛋白的不断研究,科学家们发现Wnt信号通路在调节骨代谢方面也起到关键作用。Wnt信号转导包括经典Wnt信号通路和非经典信号通路,非经典信号通路包括Wnt/Ca
研究发现,Wnt/β-catenin信号是一种细胞调节途径,已被证明对破骨细胞功能至关重要,可以通过RANKL/OPG轴间接调节破骨细胞分化,造成骨骼被侵蚀,也可以直接减少破骨细胞的生成以使骨量增加。Wnt信号通路对骨的调节作用非常突出。代运章等证实,Wnt1基因突变可诱发成骨不全,改变了miRNA表达及两者间的调节模式。β-catenin是由42个氨基酸组成的环状蛋白质,其中,氨基端有140个氨基酸残基,羧基端有100个氨基酸残基。β-catenin是成骨细胞分化和功能的关键因子,通过调节成骨细胞分化及破骨细胞表达最终达到平衡机体骨量。动物实验发现,β-catenin在体内含量为零时,小鼠在母体内或出生后不久即死亡。通过构建转基因小鼠(Col2a1-ICAT)模型,β-catenin和T细胞因子结合被抑制,信号向下游靶点传递被阻断,使Wnt/β-catenin通路不能正常传导。此时发现,软骨细胞开始出现增殖障碍和分化异常,最终细胞凋亡,生长板次级骨化中心出现较晚,造成骨发育障碍。因此,β-catenin是Wnt信号通路的关键调控因子,促进了动态骨的形成,即β-catenin的增多益于骨的生成。
目前有许多治疗骨质疏松症的药物,如何合理用药是骨科医师面临的抉择。传统抗骨吸收药物包括双膦酸盐、激素、选择性雌激素受体调节剂、钙和维生素D补充剂、核因子κB受体活化因子配体抑制剂等等。甲状旁腺激素(parathyroid hormone,PTH)是目前较新的骨形成促进剂。实验发现,PTH可通过β-catenin信号阻断糖基化终末产物(AGEs)对大鼠BMSCs的负性成骨作用,显著增加骨量。最新合成代谢药物如特立帕肽、罗莫珠单抗已应用临床。罗莫珠单抗(Romosozumab)是一种人源化单克隆抗体,设计用于针对硬化蛋白,硬化蛋白是一种由骨细胞分泌的糖蛋白,可抑制成骨细胞谱系细胞中的Wnt信号传导。罗莫珠单抗通过结合和抑制硬化素,增加骨形成并降低骨吸收。应用Romosozumab的1年后骨量较用药前增加11.3%。Romosozumab使用后短期就可以有促进骨形成的作用,长期应用还可以减少骨吸收,可能为临床上治疗骨质疏松提供新的方向。另外,新的RANKL中和抗体-Denosumab的出现,表明应用Wnt通路的靶点在诊治骨质疏松症中的前景广阔。针对骨质疏松症的靶向治疗的临床实用性较高,继续研发此类药物可能为治疗骨质疏松提供新的方向。
PR171也称Carfilzomib,中文名卡非佐米,是由美国Onyx制药公司开发的新一代蛋白酶体抑制剂,于2012年7月20日获美国FDA批准上市,商品名为Kyprolis,化学名称:N-12S)-[2-(4-吗啉基)乙酰氨基]4-苯基丁酰基-L-亮氨酰-N-13-甲基-IS)-LQR)甲基环氧。PR171是由具有抗炎活性的环氧酶素(Epoxomicin)进一步合成得到,Epoxomicin是一种环氧酮肽类天然产物,最初因具有抗癌活性被发现,其环氧酮结构和蛋白酶体共价结合后,可以选择性地抑制蛋白酶体,但具有容易脱靶的缺点。因此,科学家们将Epoxomicin结构进一步优化,得到活性更强、成药性更好的PR171。PR171作为较新的蛋白酶体抑制剂,其抑制功能是强效的、不可逆的,能结合并抑制20S蛋白酶体的活性,抑制它的胰凝乳蛋白酶活性,效果与已经应用于临床的蛋白酶体抑制剂硼替佐米(bortezomib)相当,而毒副反应比bortezomib小。一项对肿瘤恶病质的研究表明,PR171可以缓解荷瘤小鼠体质量下降,抑制骨骼肌萎缩和肿瘤生长。以PR171为基础的联合方案主要用于治疗多发性骨髓瘤、套细胞淋巴瘤等,且具有良好的安全性和有效性。然而,迫切需要更多治疗高效的药物。
发明内容
本发明要解决的技术问题是:现有的治疗骨质疏松症药物可选择性不足。
为了解决上述技术问题,本发明提供了一种蛋白酶体抑制剂PR171在制备治疗骨质疏松药物上的应用。
优选的,所述的治疗骨质疏松药物中PR171的有效浓度为10~25μmol/L。
优选的,所述的蛋白酶体抑制剂PR171在治疗骨质疏松药物中的有效浓度为15μmol/L。
优选的,所述的蛋白酶体抑制剂PR171在治疗骨质疏松药物中的有效浓度为20μmol/L。
与现有技术相比,本发明具有以下优点:
本发明的通过将蛋白酶体抑制剂应用于制备骨质疏松药物,使得蛋白酶体抑制剂PR171抑制蛋白酶体的活性,然后使破骨细胞中的β-catenin含量表达增多,打破骨形成和骨吸收的平衡,降低或减弱破骨细胞的活性,抑制破骨细胞分化,促进成骨细胞更多的增殖,以达到骨生成和增长的目的;特别的,PR171在治疗骨质疏松药物中的含量为10~25μmol/L。
附图说明
图1是PR171的分子结构图。
图2是OVX组、Sham组小鼠股骨骨小梁三维重建图。
图3是60倍镜下OVX组、Sham组小鼠股骨髓腔内PSME1及OCN免疫荧光双标染色图。
图4是60倍镜下OVX组、Sham组小鼠股骨髓腔内PSME1及CTSK免疫荧光双标染色图。
图5是60倍镜下OVX组、Sham组小鼠股骨髓腔内PSME2及OCN免疫荧光双标染色图。
图6是60倍镜下的OVX组、Sham组小鼠股骨髓腔内PSME2及CTSK免疫荧光双标染色图。
图7是control组、OVX组、OVX+PR171组骨组织切片20倍镜下的HE染色图。
图8是control组、OVX组、OVX+PR171组骨组织切片20倍镜下的TRAP染色图。
图9是60倍镜下的control组、OVX组、OVX+PR171组骨髓腔内OCN免疫荧光染色图。
图10是60倍镜下的小鼠股骨髓腔内PSME1,β-catenin免疫荧光双标染色图。
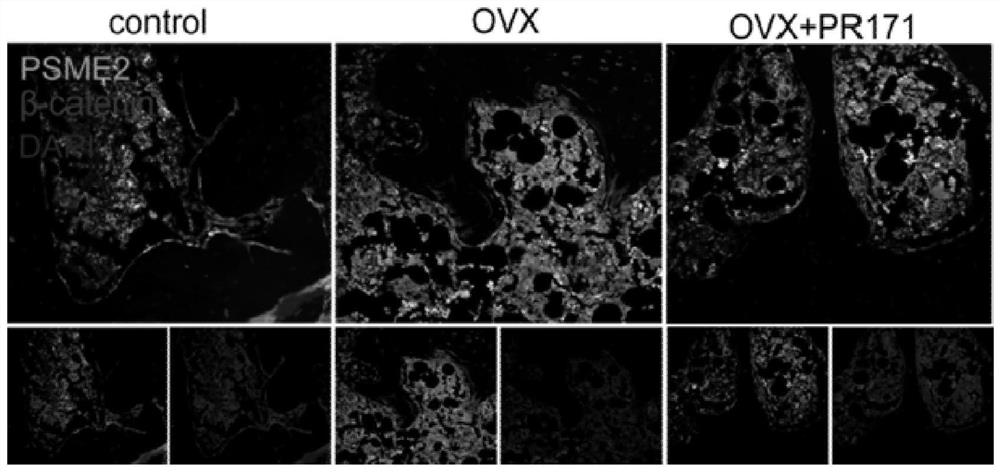
图11是60倍镜下的小鼠股骨髓腔内PSME2,β-catenin免疫荧光双标染色图。
图12是PSME1、PSME2、PSME1+PSME2重组蛋白处理C3H10细胞后,通过茜素红染色鉴定细胞是否向成骨细胞方向转化的实验结果图。
图13是20倍镜下的PSME1、PSME2、PSME1+PSME2重组蛋白处理RAW264.7细胞后,观察TRAP染色鉴定破骨细胞含量的实验结果图。
图14是60倍镜下的PSME1、PSME2、PSME1+PSME2重组蛋白处理C3H10细胞后,β-catenin及OCN免疫荧光双标染色实验结果图。
图15是60倍镜下的PR171处理C3H10细胞后,PSME1及β-catenin免疫荧光双标染色图。
图16是60倍镜下的PR171处理C3H10细胞后,PSME2及β-catenin免疫荧光双标染色图。
图17是60倍镜下的PR171处理C3H10细胞后同时加OCN成骨诱导,OCN及β-catenin免疫荧光双标染色,通过茜素红染色鉴定细胞是否向成骨细胞方向转化的实验结果图。
图18是60倍镜下的PR171处理RAW264.7细胞后同时加RANKL诱导破骨形成,CTSK及F-ACTIN免疫荧光双标染色。
图19是PR171为10μmol/L、15μmol/L和20μmol/L时的Micro-CT三维重构结果的对比。
其中,OCN是指骨钙素,CTSK是指蛋白激酶K。
具体实施方式
下面结合附图和实施例,对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明的保护范围。
一、实验方法
1、PBS(磷酸盐缓冲溶液)(10X浓缩液)的配制:
电子天平秤取80g NaCl、2gKCl、37.08g Na
2、PBS(1X工作液)的配制:
需要应用PBS的实验前临时配置1X PBS工作液。取已配置完成的10X PBS浓缩液100ml于烧杯中,并加入900ml去离子水,制得浓度为0.01M的PBS缓冲液。
3、脱钙液的配制:
称取EDTA(乙二胺四乙酸)l00g;加入温热(60-70℃)的蒸馏水约450ml,加入NaOHl5g左右,搅拌至透明;加入0.2M的PBS500ml,调节pH值至7.2~7.3,PBS的终浓度为0.1M,蒸馏水定容至1000ml。
4、4%多聚甲醛固定液的配置:
电子天平称取多聚甲醛40g,置于烧瓶中并用去离子水500ml充分溶解。NaOH调节pH值至7.4。之后加入1X PBS工作液500ml,滤纸过滤后定容至1000ml,制得质量百分比为4%的多聚甲醛固定液。
动物饲养:
4周龄雌性C57小鼠,35只。实验动物分笼饲养,正常昼夜节律(12小时光照/黑暗循环,22℃,室温),避免噪音或者强光刺激,自由进食和饮水。所有动物实验程序均通过医学伦理委员会审查通过。
动物分组:
将实验小鼠随机分成
①Control组:在笼中正常饲养,5只小鼠。
②OVX组:去卵巢手术,5只小鼠。
③OVX+PR171组:去卵巢手术后骨髓腔注射PR171,20只小鼠。
④Sham组:去卵巢手术后骨髓腔注射生理盐水,5只小鼠。
骨质疏松模型的建立:
①使用10%水合氯醛溶液对小鼠进行腹腔注射麻醉(0.8ul/10g体重)。
②待麻醉实施成功后,小鼠采取俯卧位于无菌操作台上,皮肤碘伏充分消毒后采用后正中入路,用手术刀纵行逐层切开小鼠腰背部的皮肤及皮下筋膜,切口约2cm。向两侧牵开皮肤后,于腰部脊柱中央旁开约5mm找到双侧卵巢所在位置(通常较周围组织呈稍淡粉色)。
③用手术刀于双侧卵巢所在位置纵行切开肌层、腹膜后壁,切口约2mm,用有齿镊小心牵拉出埋藏在脂肪组织内的双侧卵巢。先用手术缝线于双侧输卵管远端靠近卵巢处结扎,之后用组织剪剪去双侧卵巢。然后将剩余已结扎的输卵管组织还纳于小鼠腹腔内。
④确认双侧卵巢均切除后,无活动性出血,逐层缝合手术切口。
⑤术毕,腹腔注射青霉素预防感染,8万单位每鼠,之后将小鼠置于恒温箱中复苏。待小鼠麻醉复苏后观察其活力,并放回鼠笼,饲养条件同前。OVX组、OVX+PR171组及Sham组麻醉及基本操作相同。小鼠术后继续连续饲养3个月,以确保有充分的时间使骨质疏松小鼠模型完全建立。
骨髓腔给药:
每周一次,共8次,持续2个月。
①使用wt10%水合氯醛溶液对小鼠进行腹腔注射麻醉(0.8ul/10g体重)。
②待麻醉实施成功后,小鼠采取仰卧位置于无菌操作台上,用手术刀在小鼠左下肢膝关节处纵行逐层切开皮肤、皮下筋膜。
③手术刀横行离断左下肢髌韧带,有齿镊钝性分离周围肌肉韧带组织,显露出左侧股骨内侧髁与外侧髁。
④在股骨髁间窝处用皮质钻头打穿一个直径约为0.3mm小孔。
⑤之后用微量注射器通过钻取的小孔穿刺进入股骨髓腔(穿刺进入时可伴有轻微突破感),为股骨髓腔进行髓腔注射,其中Sham组注入5ul生理盐水,OVX+PR171组注入5ulTCP复合材料PR171。
⑥注射完成后,用骨蜡封闭穿刺口,查看无活动性出血后丝线缝合髌韧带。
⑦缝合皮肤,术毕,青霉素腹腔注射预防感染,8万单位每鼠。之后置于恒温箱中观察手术小鼠活力,无异常后放回鼠笼。饲养条件同前。
骨组织标本的固定与脱钙:
①取实验小鼠股骨骨质标本,将标本上的软组织剔除干净。之后将剔净的股骨组织置于wt4%多聚甲醛溶液中固定约48小时。
②固定后的股骨组织标本在1XPBS溶液中简单漂洗后,转移至配置好的脱钙液中,并在4℃冰箱中脱钙21d(每2d更换一次脱钙液,股骨标本软化后终止脱钙)。
③将已经完成脱钙后的标本在1XPBS溶液中简单漂洗后,置于wt70%酒精溶液中4℃保存。
骨组织标本的包埋与切片:
①室温下组织浸泡于水中30分钟。
②室温下组织浸泡于wt75%酒精2小时。
③室温下组织浸泡于wt85%酒精2小时。
④室温下组织浸泡于1号wt95%酒精2小时。
⑤室温下组织浸泡于2号wt95%酒精2小时。
⑥室温下组织浸泡于1号wt100%酒精2小时。
⑦室温下组织浸泡于2号wt100%酒精2小时。
⑧通风橱内组织第一次于纯二甲苯中浸泡20分钟。
⑨通风橱内组织第二次于纯二甲苯中浸泡20分钟。
⑩组织浸泡于软蜡1.5-2小时。
□组织浸泡于硬蜡1.5-2小时。
□将组织放入盛有石蜡的模具中,摆好位置,于石蜡包埋机的冷台上冷却。
□切片:将包埋好的蜡块修整至所需大小。在石蜡切片机上切片,切片厚度取3um,切片置于37℃干燥箱过夜备用。
骨组织切片HE染色操作步骤流程如下:
①脱蜡和水化:脱蜡前将石蜡切片置于65℃恒温烘箱中烘片处理120分钟。烘片完成后进行脱蜡、水化步骤。脱蜡顺序为二甲苯I(纯二甲苯,I表示第一次浸泡)浸泡10分钟,二甲苯II(纯二甲苯,II表示第二次浸泡)浸泡10分钟;水化步骤为无水乙醇I浸泡5分钟,无水乙醇II浸泡5分钟,之后按照wt90%乙醇、wt80%乙醇、wt70%乙醇、wt50%乙醇的顺序各浸泡5分钟。脱蜡、水化完成后,切片用去离子水浸泡3分钟(此过程注意保持切片干燥)。然后用PBS(磷酸盐缓冲盐水)冲洗三次,每次5分钟。
②染色:Harris苏木素液染5分钟,去离子水洗后吹干,伊红染色1分钟,最后用去离子水洗去余留染色剂。③脱水透明、封片:脱水顺序为wt50%乙醇、wt70%乙醇、wt80%乙醇、wt90%乙醇、无水乙醇I(I表示第一次浸泡)、无水乙醇II(II表示第二次浸泡)各浸泡5分钟;透明顺序为二甲苯I(I表示第一次浸泡)、二甲苯II(II表示第二次浸泡)各浸泡10分钟。之后脱水、透明完成的切片置于通风橱内风干约2小时。风干后,切片表面滴中性树脂,置盖玻片封片。显微镜下观察、拍照。
TRAP染色操作步骤流程如下:
①石蜡切片4-5um,脱蜡至水洗;细胞爬片或者冰冻切片用wt80%酒精固定后蒸馏水水洗3次,每次3分钟。
②配制六偶氮副品红溶液。
③配制孵育液:取1ml六偶氮副品红加到18ml醋酸盐溶液中,再加入1ml萘酚AS-BI磷酸盐溶液,再加酒石酸钾钠282mg。调pH值5.0,过滤备用。
④阴性对照孵育液:取1ml六偶氮副品红加到18ml醋酸盐溶中,再加酒石酸钾钠282mg。调pH值5.0,过滤备用。
⑤切片入37℃蒸馏水水洗30秒。
⑥入孵育液37℃孵育50-60分钟。
⑦去离子水水洗3分钟。
⑧入苏木素液复染40秒。
⑨自来水水洗10分钟返蓝。
⑩使用甘油明胶封片。
茜素红染色操作步骤流程如下:
①在培养板中将已爬好细胞的盖玻片用PBS(1X工作液,即0.01MPBS缓冲液)浸洗3次,每次1min。
②4%的甲醛固定爬片15min,PBS(1X工作液)浸洗玻片3次,每次3min。
③0.2%茜素红染液染色5-30min,PBS(1X工作液)冲洗。
④镜下观察:钙沉积阳性细胞呈现桔红色。
骨组织免疫荧光双标染色操作步骤流程如下:
①烤片:新近切好的股骨组织切片置入37℃干燥箱过夜,第二天取出后放入65℃恒温烘箱中烘片处理120分钟。
②进行常规脱蜡水化步骤:顺序为二甲苯I(纯二甲苯,I表示第一次浸泡)、二甲苯II(纯二甲苯,II表示第二次浸泡)各10分钟,无水乙醇I、无水乙醇II、wt90%乙醇、wt80%乙醇、wt70%乙醇、wt50%乙醇各浸泡5分钟。去离子水3min,PBS(1X工作液)5分钟,重复3次。
③抗原修复:切片浸泡在TE9.0抗原修复液中,并置于62℃恒温水浴箱中过夜(14个小时)。次日从恒温箱中取出,并冷却到室温(至少1小时),PBS(1X工作液)洗3次,每次5分钟。
④封闭:甩去切片表面PBS(1X工作液)液,用免疫组化笔勾勒出切片上组织的范围,然后滴加封闭液封闭。37℃烘箱孵育1小时。
⑤敷一抗:用wt0.1%BSA(牛血清白蛋白)—0.01MPBS缓冲液按不同比例在同一支离心管中稀释免疫荧光双标一抗,其中PSME1鼠来源一抗(XYbscience,XY10543-1)稀释比例为1:200,PSME2鼠来源一抗(XYbscience,XY12937-2)稀释比例为1:200,OCN鼠来源一抗(HZbscience,HZ-4917R)稀释比例为1:200,CTSK羊来源一抗(Solarbio,K002980P)稀释比例为1:100,β-catenin鼠来源一抗(赛默飞,MA1-300)稀释比例为1:200。
⑥敷二抗:敷二抗及之后所有步骤均应注意避光,否则易致荧光基团淬灭。先用wtO.1%BSA(牛血清白蛋白)—PBS按1:500稀释比例稀释免疫荧光二抗,加入荧光二抗分别为羊抗鼠488绿色荧光二抗及驴抗羊594红色荧光二抗。室温孵育1小时。之后0.01MPBS缓冲液洗三次,每次5分钟。
⑦染核、封片:DAPI染剂滴加至切片上,盖玻片封片。DAPI,即4',6-二脒基-2-苯基吲哚,是一种能够与DNA强力结合的荧光染料,常用于荧光显微镜观测。因为DAPI可以透过完整的细胞膜,它可以用于活细胞和固定细胞的染色。
⑧观察、拍照:应用聚焦显微镜观察切片并拍照。
Micro-CT扫描及分析扫描配置如下:
①机型:活体Micro-CT美国PE Quantum GXⅡ。
②标本:小鼠股骨。
③Voxel Size:36um,Scan Mode:High resolution 57min。
④扫描方法:松质骨区域扫描自小鼠股骨下端生长板开始,向近端延伸100层。
⑤分析区域选取:采用系统自带软件分析。用形态模仿方法(morphometircanalysis)选定分析区域。松质骨区域第一圈选自股骨远端股骨髁完全融合处,向近端延伸100层;皮质骨区域第一圈选自第一张扫描图,并继续选取70层。然后使用contouring工具,关键层面手动选取小梁骨区域,其他层面由软件自动划出。
⑥分析参数:其指标采用松质骨容量(cancellous bone volume,BV)和松质骨总容量(cancellous totalvolume,TV)的比值,即BV/TV。松质骨分析松质骨骨密度(BMD,mg/cc),骨体积分数BV/TV(%),骨小梁数量(Tb.N,/mm),骨小梁厚度(Tb.Th,mm)等如表1所示,OVX组的BMD相比于control组降幅明显,而PR171治疗后的BMD较OVX组有上升。OVX+PR171组较骨质疏松小鼠的骨体积分数增大,提示PR171可以增加小鼠骨量和骨强度。Tb.N(本实验检测取值为全部扫描层面骨小梁数目的均值)方面,OVX组的Tb.N相比于control组有下降,同样的使用PR171后该数值有增高。Tb.Th在三组之间无明显差异,P>0.05。
表1:control组、OVX组、OVX+PR171组的数据对比表
⑦得出三维重构结果:如图2所示,当OVX加入PR171时,明显比OVX组的骨质增量大;当进一步增大PR171的含量时,如图19所示,骨小梁厚度增加,连接紧密,数量变多,骨小梁占视野面积升高,其抗骨质疏松效果较好。
统计学分析:本研究采用软件SPSS20.0进行统计学分析。计量资料采用均数±标准差表示。使用单因素方差分析进行组间比较,然后进行Tukey检验,P<0.05表示有统计学差异。
下面结合附图1至19对PSME1、PSME2的含量与骨质疏松的发生有相关性讨论:
预实验表明,PSME1、PSME2在人类骨质疏松骨组织中表达量升高,与骨质疏松可能存在一定相关性。PSMEl是11S/PA28α亚基的编码基因,人类PSMEl定位于14q11.2,编码249个氨基酸。11S/PA28另外1个亚基是PA28β,由PSME2编码。PSME1和PSME2都由11个外显子和10个内含子组成,二者基因结构相同,长度相似,剪切位点相近。研究发现,PSMEl蛋白主要在细胞胞浆表达,细胞核中也有少量的存在。那么,PSME1在细胞内的含量是否会影响胞浆中信号通路的传导呢?实验证实,PSME1,PSME2在Wnt通路和NF-κB通路中显著富集。因此,作者尝试进行探索骨组织内PSME1,PSME2表达量升高、下降是否可以进一步影响骨形成。
实验基础为成功构建骨质疏松小鼠模型。正常发育的C57小鼠首先进行OVX手术使体内雌激素缺乏,然后持续饲养3个月,最终小鼠显示出严重的骨质疏松症表型。我们发现OVX组小鼠体重增长均明显大于Sham组。另外,从附图2中,可以看出OVX组小鼠股骨骨小梁立体网格变得疏松、数目减少,骨小梁之间距离变大,髓腔扩大。
下一步,取OVX组和Sham组小鼠股骨标本,固定脱钙、包埋切片后免疫荧光染色。同时标记OCN和PSME1,结果如附图3所示,OVX组相对于Sham组,PSME1染色较亮,OCN染色较暗,得出OVX组小鼠股骨骨髓腔内PSME1表达量明显高于Sham组,OCN表达量则低于Sham组。标记CTSK和PSME1,结果如附图4所示,OVX组相对于Sham组,PSME1染色较亮,CTSK染色较亮,得出OVX组小鼠股骨骨髓腔内PSME1表达量、CTSK表达量明显高于Sham组。
同法标记OCN和PSME2,结果如附图5所示,OVX组相对于Sham组,PSME2染色较亮,OCN染色较暗,得出OVX组小鼠股骨骨髓腔内PSME2表达量明显高于Sham组,OCN表达量则低于Sham组。标记CTSK和PSME2,结果如附图6所示,OVX组相对于Sham组,PSME2染色较亮,CTSK染色较亮,得出OVX组小鼠股骨骨髓腔内PSME2表达、CTSK表达明显高于Sham组。
以上动物实验结果支持PSME1、PSME2在骨质疏松骨组织的髓腔内处于高表达的状态,并且进一步得出成骨细胞、破骨细胞均能够分泌PSME1和PSME2。因此,接下来的实验主要为了证实,改变条件使PSME1、PSME2的表达受抑制后,能否逆转骨质疏松。从本实验可以得出OVX组小鼠PSME1、PSME2的含量与骨质疏松的发生有相关性。
为了进一步明确PR171对骨质疏松的作用,进行如下实验:
我们首先明确实验对象为control组、OVX组、OVX+PR171组小鼠。其中,OVX+PR171组小鼠进行股骨骨髓腔注射PR171,每周一次,共8次,用药持续2个月后继续喂养3个月,最后取股骨标本。HE染色结果提示OVX组小鼠骨皮质变薄,骨髓腔扩大,骨小梁稀疏或断裂,骨小梁宽度变窄,骨小梁间距变宽。如附图7所示,OVX组小鼠相对于control组,其骨小梁稀疏,骨小梁宽度变窄,骨小梁间距变宽,PR171组较OVX组骨小梁数目增多,表明注射PR171后骨小梁厚度增加,连接紧密,数量变多,骨小梁占视野面积升高。如附图8所示,OVX组红染细胞数较control组增加,PR171组红染细胞数减少,红染细胞数量通过图8中的黑色区域大小来表示,黑色区域大表示红染细胞数量多,黑色区域小表示红染细胞数量少,提示在使用PR171后破骨细胞的表达减少。如附图9所示,OVX组相对于control组,OCN染色较暗,PR171组OCN染色较OVX组明亮,结果说明去卵巢骨质疏松小鼠的股骨髓腔内OCN表达下降,PR171注射后OCN表达升高,PR171注射组相对于control组有少量提升。
为了探索PSME1和PSME2的下游位点,我们将小鼠股骨髓腔内PSME1和β-catenin,PSME2和β-catenin分别进行免疫荧光双标染色,如附图10所示,OVX组相对于control组,PSME1染色较亮,同时β-catenin染色较暗,PR171组PSME1染色较暗,同时β-catenin染色较OVX组明亮,如附图11所示,OVX组相对于control组,PSME2染色较亮同时β-catenin染色较暗,PR171组PSME2染色较暗同时β-catenin染色较OVX组明亮,得出骨质疏松小鼠PSME1、PSME2低表达,则β-catenin表达增高;骨质疏松小鼠PSME1、PSME2高表达,则β-catenin处于低表达状态。
最终得出,PSME1、PSME2的高表达与骨质疏松的发生相关,当PSME1、PSME2处于高表达时,β-catenin表达就会受到抑制。PR171很可能通过抑制蛋白酶体,增加β-catenin胞内的含量来缓解骨质疏松,但是仍需要相关细胞实验进一步证实我们的结论。
先前的动物研究发现,骨质疏松后PSME1、PSME2的表达升高。为了进一步研究PSME1、PSME2在骨骼代谢中的功能,我们人为的使PSME1、PSME2在小鼠C3H10细胞的成骨分化过程中增加。骨质疏松症是一种溶骨性骨病,其特征是骨强度降低和骨脆性增加,这是骨形成减少或骨吸收增加的结果。骨形成与成骨细胞功能有关,PSME1、PSME2可能引起成骨细胞成骨活性的异常。因此,使用茜素红染色测定PSME1、PSME2对C3H10细胞成骨分化表型的影响,如附图12所示,PSME1、PSME2、PSME1+PSME2组矿化结节数目均低于control组橘红色的矿化结节数目,可以得出:该结果与先前一致,PSME1、PSME2、PSME1+PSME2组的分化、矿化能力被明显抑制。
上述体外细胞功能学实验已经证明了PSME1、PSME2的过表达可抑制成骨细胞的增殖,但是对确切机制了解不深。所以通过查阅文献了解,发现Wnt/β-catenin在骨正常生长和代谢中极为重要,β-catenin是介导成骨细胞存活和分化的关键分子。
β-catenin,也称β-连环蛋白,是Wnt经典信号通路中重要的组成蛋白,具有较高的保守性。β-catenin的结构包括781个氨基酸,其中,由42个氨基酸序列构成核心区域。蛋白酶体是细胞内蛋白质降解的主要途径之一,通过泛素-蛋白酶体通路发挥作用,PSME1、PSME2激活蛋白酶体后,β-catenin被其降解,正常生物功能受影响,因此后期实验需要验证PR171的蛋白酶体抑制剂作用。同时前文实验中,OVX组小鼠股骨髓腔内PSME1、PSME2及β-catenin免疫荧光双标染色结果提示骨髓腔内PSME1、PSME2处于高表达时,β-catenin表达就会受到抑制。为了进一步明确PSME1、PSME2与细胞内β-catenin表达的关联性,标记β-catenin,OCN进行免疫荧光,如附图13所示,PSME1组、PSME2组和PSME1+PSME2组β-catenin及OCN染色较control组变暗,得出应用PSME1、PSME2重组蛋白处理细胞后,干扰了β-catenin及OCN的表达。证实PSME1、PSME2可以通过影响β-catenin调节Wnt/β-catenin传导进而抑制C3H10细胞的成骨分化。
如果破骨细胞的分化增多或活性增强,可使骨溶解增多,诱发骨质疏松,所以我们也探索了PSME1、PSME2对破骨细胞的生成和调节是否存在影响。使用PSME1、PSME2、PSME1+PSME2重组蛋白处理RAW264.7细胞后,我们发现,分别加入PSME1、PSME2、PSME1+PSME2进行干预后,TRAP染色鉴定各组破骨细胞形成情况,如附图14所示,PSME1、PSME2、PSME1+PSME2组红染细胞数较control组增加,与对照组相比,PSME1组、PSME2组可以促进破骨细胞生成,PSME1+PSME2组促进效果更加明显。
综上所述,本实验已经证明了PSME1、PSME2激活后可以促进β-catenin降解,并且通过动物实验得出PR171能够改善骨质疏松小鼠的表型,因此申请人设计如下实验并得出结果如下。
首先,应用PR171重组蛋白处理C3H10细胞,进行PSME1及β-catenin免疫荧光染色,如附图15所示,PR171组对于对照组PSME1染色较暗,β-catenin染色较亮,说明PR171组PSME1表达被抑制,而β-catenin处于高表达水平。运用同样的方法检测PSME2,如附图16所示,PR171组对于对照组PSME2染色较暗,β-catenin染色较亮,可得出PR171组PSME2的表达情况与PSME1基本保持一致,PSME1/2和β-catenin之间的调节关系已被证实。该结果符合我们的预期,骨质疏松症(OP)的发生和进展部分是由成骨细胞分化受损引起的,骨钙素,也称γ-羧基谷氨酸蛋白,是一种骨基质蛋白,主要由OB细胞分泌,而肥大软骨细胞和成牙质细胞也少量分泌。通过测定OCN表达水平,就可以评估骨形成与骨转化功能,所以我们下一步在PR171处理C3H10细胞同时加入OCN,使其向成骨方向分化。结果显示PR171组β-catenin和OCN的表达量明显升高,如附图17所示,PR171组对于对照组OCN、β-catenin染色较亮,PR171组的矿化结节数目较对照组增多,说明PR171对成骨细胞向成熟成骨细胞分化产生了明显的促进作用。综上可以得出PR171通过抑制蛋白酶体,增加β-catenin,激活Wnt信号通路促进成骨形成。
破骨细胞是骨骼的关键细胞成分,是导致各种骨骼问题(如骨质疏松症)的原因。在上述研究中,PR171对骨骼的影响是在卵巢切除术诱导的动物模型进行研究。现在通过免疫荧光、TRAP染色检测破骨细胞相关蛋白(例如CTSK和F-ACTIN)的表达水平,以了解PR171对破骨细胞产生的抑制作用和对成骨细胞标志物表达的影响。研究发现,RANKL可以通过介导NF-κB和MAPK信号通路来促进RAW 264.7细胞向破骨细胞方向分化。CTSK又被称为溶酶体半胱氨酸组织蛋白酶K,在骨吸收中起重要作用。破骨细胞中表达较多,在心肌细胞,骨骼肌细胞中也有少量表达,所以,CTSK表达的高低就反应出破骨细胞活性的强弱。F-ACTIN是破骨细胞中负责细胞骨架重塑的蛋白质,在调节破骨细胞粘附中具有重要作用。因此我们通过免疫荧光检测各组RAW264.7细胞中CTSK和F-ACTIN蛋白的表达。如附图18所示,与control组相比,PR171组F-ACTIN、CTSK的染色偏暗,红染细胞数减少,说明PR171能够抑制破骨细胞形成。
获得的结果表明,PR171通过限制PSME1、PSME2来促进β-catenin的表达,从而抑制RANKL诱导的破骨细胞生成并促进成骨细胞生成。因此,PR171通过抑制骨形成和刺激骨吸收来调节骨改造的稳定性,从而防止骨丢失。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和替换,这些改进和替换也应视为本发明的保护范围。
- 蛋白酶体抑制剂PR171在制备治疗骨质疏松药物上的应用
- 稀土阿伦膦酸盐在制备治疗骨质疏松症药物上的应用
