一种赛门苷I的纯化制备方法
文献发布时间:2023-06-19 12:13:22
技术领域
本发明属于天然产物生物合成和分离纯化技术领域,具体涉及罗汉果苷类天然甜味剂赛门苷I的生物合成和纯化制备。
背景技术
进入21世纪后,随着人类生活水平不断提高,“三高”人群的数量也呈现出爆炸式增长,其中糖尿病已成为一种全球性慢性疾病,占据了大量的医疗资源。近年来,人们已逐渐意识到低糖饮食对健康的重要性。因此,天然甜味剂如甜菊苷、甜茶苷、甘草酸、莱鲍迪苷A、罗汉果苷等逐渐进入人们的视野,成为低热饮食添加剂的代名词,展现出了极高的商业价值。
赛门苷Ⅰ(siamenoside I)是一种来源自罗汉果的葫芦烷型四环三萜皂苷,其相对甜度是蔗糖的460-563倍,口感与蔗糖相似,已经被FDA认定为“一般公认安全”(GRAS)的成分。目前,赛门苷Ⅰ已成为众多饮料和食品公司开发新型低热量甜味剂的热点化合物。但是,赛门苷I的天然含量极低,不足0.5%,难以规模化生产。本研究组前期的发明专利(CN112063678A)公开了一种采用糖基转移酶和代谢流改造大肠杆菌成功生物合成赛门苷I的方法,为解决赛门苷I来源问题提供了一种可行的方案。不过,由于细菌成分的特殊性,纯化制备的赛门苷I常会掺入蛋白质和水溶性色素等杂质,致使产品质量难以控制。
本发明针对蛋白质和色素的理化性质,尝试了加热煮沸、活性炭吸附、乙醇沉淀、离子交换和物理吸附等方法,最终建立了纯化制备高质量赛门苷I的工艺,成功去除了蛋白质和色素的干扰,为赛门苷I的规模化生产提供技术。
发明内容
生物合成所得赛门苷I的纯化制备过程易受到细菌蛋白质和色素等杂质干扰,常规的大孔树脂吸附难以获得质量稳定的赛门苷I。因此,本发明针对蛋白质和色素的特征,系统考察蛋白质和色素去除方法后建立了一种操作简便,成本低,适合规模化应用的赛门苷I纯化制备新工艺。
本发明技术方案具体如下:
1)根据前期发明专利CN112063678A构建赛门苷I的生物合成体系;
2)考察活性炭在水溶液或乙醇/水混合溶液中对色素以及蛋白质的吸附情况;
3)考察非离子型大孔树脂在水溶液或乙醇/水混合溶液中对色素以及蛋白质的吸附情况;
4)考察煮沸除蛋白和乙醇沉淀去蛋白的效果;
5)考察阴离子型大孔树脂去除蛋白质和色素的效果;
6)根据工艺考察结果建立赛门苷I的最佳纯化制备工艺,并验证。具体为:
根据CN112063678A将赛门苷I的生物合成体系扩大至0.5~1L,反应完成后利用盐酸稀溶液将反应液体pH值5.0~5.5,煮沸或加入等体积乙醇,过滤除去沉淀物,用D101大孔树脂吸附除蛋白质,所得滤色用氢氧化钠溶液将滤液pH值调至7.0左右,然后采用D900大孔弱碱性阴离子交换树脂除去色素,所收集的洗脱液干燥后即得高质量赛门苷I。
或反应完成后利用盐酸稀溶液将反应液体pH值5.0~5.5,煮沸或加入等体积乙醇,过滤除去沉淀物,利用氢氧化钠溶液将滤液pH值调至7.0左右,然后采用D900大孔弱碱性阴离子交换树脂除去色素,所收集的洗脱液用D101大孔树脂二次吸附,40%乙醇水溶液等度洗脱,洗脱液干燥后即得高质量赛门苷I。本发明具有如下优点:
1)建立了一条从生物合成体系中规模化制备高质量赛门苷I的工艺,理论上可适用于其他种类罗汉果苷的纯化制备;
2)赛门苷I纯化制备过程中未使用有毒溶剂,避免了工艺安全性和产品安全性问题;
3)赛门苷I纯化制备过程中使用的D101大孔树脂和D900大孔弱碱性阴离子交换树脂均可重复利用,降低了工艺成本;
4)本发明建立的赛门苷I纯化制备工艺,操作简单,重复性好,适用于规模化生产。
附图说明
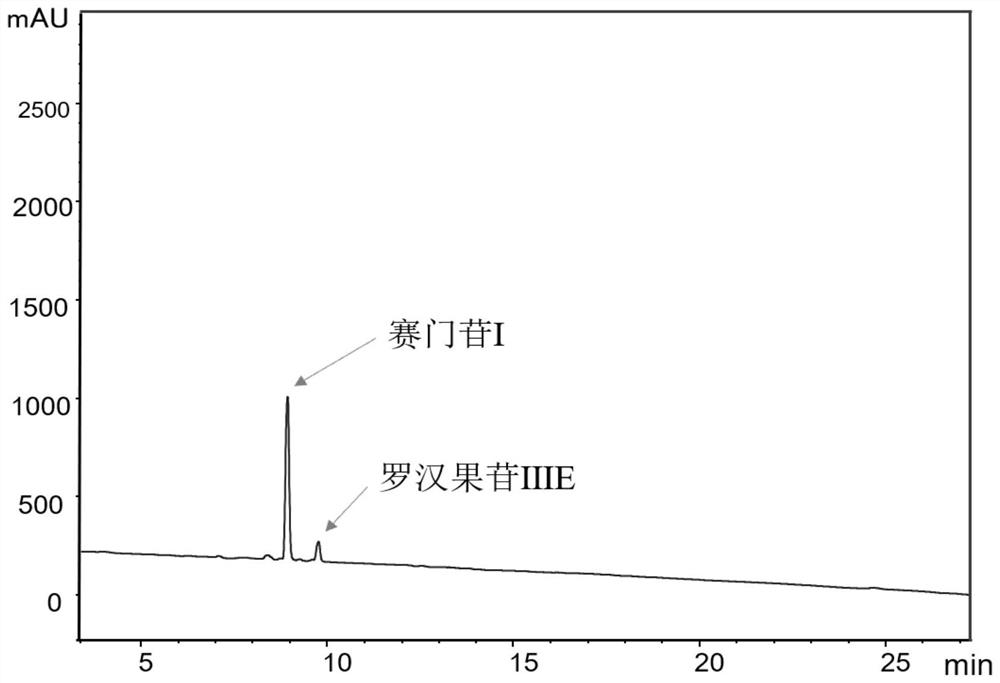
图1为反应体系中赛门苷I和罗汉果苷IIIE的HPLC分析
图2为不同非极性大孔树脂对赛门苷I的吸附/解吸率
图3为赛门苷I纯品的SDS-PAGE检测结果
图4为赛门苷I纯品的HPLC检测结果
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1赛门苷I的HPLC检测方法
本发明中所涉及赛门苷I样品的HPLC分析,其方法参数均如下:
仪器型号:Agilent 1260
色谱柱:YMC-Pack ODS-A(250mm×4.6mm,5μm)
流动相A:水(含1‰甲酸);流动相B:乙腈(含1‰甲酸)
柱温:30℃;流速:1mL/min;检测波长:205nm;进样量:5μL
洗脱梯度:10%~90%;梯度时间25min。
在上述HPLC检测条件下,罗汉果苷IIIE和赛门苷I的保留时间分别是8.7min和9.5min(图1)。
实施例2赛门苷I的生物合成和除细菌碎片方法的比较
利用CN112063678A中的全细胞生物催化剂构建0.5L的赛门苷I生物合成体系,其中底物罗汉果苷IIIE浓度为15g/L,蔗糖浓度为500mg/mL,反应液为pH=9.0的M9培养基,反应时间12小时。反应结束后将反应液的pH用稀盐酸(0.1M)调至5.0~5.5,并分成两等份(A和B)。A反应液煮沸5分钟,过滤除蛋白及细菌碎片。B反应液中加入等量的无水乙醇,充分混匀后静置5分钟,过滤除蛋白质及细菌碎片。所得滤液呈现出微黄色,经SDS-PAGE检测仍含有蛋白质,且两种方法无显著差异。
实施例3大孔吸附树脂的吸附考察
参照文献报道,本发明考察了五种非极性大孔树脂D3520、HPD100、D101、HP20和AB-8对赛门苷I的纯化效果。首先将大孔树脂分别于95%乙醇溶液中浸泡8小时,蒸馏水洗至无乙醇味;再用5%NaOH溶液浸泡4小时,蒸馏水洗至中性,再用5%盐酸浸泡4小时,最后用蒸馏水洗至中性。
分别称取上述预处理的五种预处理树脂各5g置于摇瓶中,每瓶加入40mL煮沸处理的反应液,常温条件下振荡吸附12小时。取出树脂,用95%乙醇溶液振荡解吸6小时,HPLC测定吸附前后反应液、以及解析溶液中的赛门苷I的含量,计算每种树脂的饱和吸附量、吸附以及解析效率。结果如图2所示,上述5种大孔树脂均可吸附赛门苷I,但吸附率和解析率存在明显差异。其中,大孔树脂D101对赛门苷I的吸附率最高,饱和吸附量达到了59.2mg/g解吸率也达到了92%。因此选用大孔树脂D101作为赛门苷I的纯化材料。SDS-PAGE检测显示,D101基本可去除溶液中的蛋白质,但无法完全去除色素。相比之下,含50%乙醇的赛门苷I溶液中的赛门苷I无法被上述其他大孔树脂较好吸附。
实施例4活性炭除色素考察
将D101大孔树脂解析所得含赛门苷I溶液和含50%乙醇的赛门苷I分别用活性炭静置吸附1小时,过滤得无色透明溶液。HPLC检测结果显示,滤液中无赛门苷I,其与色素一同被活性炭完全吸附。因此,无法采用活性炭进行去除色素。
实施例5阴离子交换树脂除蛋白质和色素方法比较
鉴于酸性或碱性条件不利于糖苷类化合物的稳定,故将实施列2中所得2种反应液用氢氧化钠溶液调节pH至7.0。在该pH条件下,蛋白质和水溶性色素带负电荷。因此,本发明选择D900大孔弱碱性阴离子交换树脂和D201大孔强碱性苯乙烯系阴离子树脂去除蛋白质和色素。
分别称取5g D900柱材,按照操作说明先后完成饱和NaCl浸泡、去离子水清洗、3%HCl溶液浸泡,去离子水洗至pH=6.0~7.0、4%NaOH溶液浸泡、去离子水洗净等操作流程,以进行柱材预处理。上样并水洗脱即得含赛门苷I的无色透明液体,被吸附于柱材,但仍含极少量的蛋白质。与此同时,D201树脂处理后的样品和D900处理所得的赛门苷I质量基本相同。
实施例6赛门苷I的组合纯化法1
取实施例2中的A反应液50mL,盐酸稀溶液调节pH至5.0,煮沸5min后过滤除沉淀物得微黄色滤色。用氢氧化钠稀溶液调节pH至7.0,上样至D900大孔弱碱性阴离子交换树脂,去离子水洗脱后收集合并获得无色含赛门苷I的溶液。将其上样至大孔树脂D101,吸附12小时后用40%(v/v)乙醇溶液洗脱收集含赛门苷I的洗脱液,合并后干燥获得赛门苷I白色固体。SDS-PAGE检测显示,赛门苷I产物无蛋白质残留(图3);HPLC检测显示赛门苷I的纯度为96.5%(图4)。
实施例7赛门苷I的组合纯化法2
取实施例2中的A反应液50mL,盐酸稀溶液调节pH至5.0,煮沸5min后过滤除沉淀物得微黄色滤色。将其上样至大孔树脂D101,吸附12小时后用40%(v/v)乙醇溶液洗脱收集含赛门苷I的洗脱液,合并后用氢氧化钠稀溶液调节pH至7.0。然后上样至D900大孔弱碱性阴离子交换树脂,去离子水洗脱后收集合并获得无色含赛门苷I的溶液,干燥获得赛门苷I白色固体。SDS-PAGE和HPLC检测结果显示蛋白质和色素均被去除(图3)。
实施例8赛门苷I的制备
根据实施例2将反应体系放大至1L,按照实施例6所述工艺制备赛门苷I,结果获得无蛋白质和色素的高纯度赛门苷I固体粉末11.4g,样品的回收率为76.53%,纯度为96.4%(图3)。
- 一种赛门苷I的纯化制备方法
- 一种纯化赛门苷Ⅰ的方法
