用于改善卵巢早衰的组合物及其制备方法和应用
文献发布时间:2023-06-19 12:14:58
技术领域
本发明属于生物医药技术领域,具体涉及一种用于改善卵巢早衰的组合物及其制备方法和应用。
背景技术
卵巢早衰指的是女性卵巢功能提前衰退,分原发性卵巢早衰和继发性卵巢早衰,具体表现为卵巢功能下降的一些症状,如月经周期紊乱、月经量异常,甚至不孕不育等。现有的治疗方法包括药物、手术、干细胞及干细胞衍生物、组织工程学方法等。药物治疗主要为服用中西药,中药服用时间长,效果不明显,且易造成肝肾毒性,西药以激素类药物为主,但长时间服用激素副作用大,且不能彻底恢复卵巢功能;手术治疗主要针对因血管因素诱发的营养不良性卵巢早衰,需要行卵巢内血管搭桥手术,风险高,患者痛苦感强;干细胞及干细胞衍生物治疗是目前的新兴疗法,包括间充质干细胞悬液注射治疗及干细胞外泌体治疗。间充质干细胞悬液治疗及外泌体治疗虽然都取得了一定的进展,但单细胞悬液注射后细胞易发生吸收、扩散,无法达到均匀分布使得修复效能较低,而外泌体会随组织微环境变化而变化,因此治疗范围较窄,适用于原发性卵巢早衰。组织工程方法是将种子细胞和外源性支架材料结合形成具有生物活性的组织替代物,但种子细胞要经过胰蛋白酶消化后收集起来,破坏了原有的细胞外基质及细胞间连接蛋白,影响细胞的生物活性和功能,而且到目前为止,还没有一种完全合格的支架材料,且现在使用的胶原支架材料大部分为动物源性,存在免疫风险。
综上,现有技术存在的问题是,缺乏一种副作用小、治疗范围广、安全性高的卵巢早衰治疗药物。
发明内容
为了解决上述技术问题,本发明提供了一种用于改善卵巢早衰的组合物。
本发明的目的是提供一种用于改善卵巢早衰的组合物的制备方法,包括:
子宫内膜干细胞细胞膜片的制备:选用低代数的人子宫内膜干细胞接种于子宫内膜干细胞培养基中培养,培养8-15h后弃掉原有培养基,换成细胞膜片诱导液持续培养,间隔1-2d换一次细胞膜片诱导液,待培养基中出现半透明的细胞膜片,则将其收集,作为子宫内膜干细胞细胞膜片,备用;
间充质干细胞外泌体的制备:间充质干细胞培养至密度为80%-85%时,换无血清培养基继续培养24-36h,之后收集上清液,提取其中的间充质干细胞外泌体,间充质干细胞外泌体浓度≥0.45mg/mL;
子宫内膜干细胞细胞膜片与间充质干细胞外泌体的复合:将新鲜制备的人子宫内膜干细胞细胞膜片破碎后与间充质干细胞外泌体混合,得到用于改善卵巢早衰的组合物。
优选的,上述用于改善卵巢早衰的组合物的制备方法中,所述的低代次人子宫内膜干细胞代数为0-10代。
优选的,上述用于改善卵巢早衰的组合物的制备方法中,所述的子宫内膜干细胞培养基为:体积分数10%FBS+体积分数90%DMEM/F12培养基;所述的细胞膜片诱导液为50μg/mL的抗坏血酸+体积分数10%FBS+体积分数90%DMEM/F12培养基。
优选的,上述用于改善卵巢早衰的组合物的制备方法中,所述的人子宫内膜干细胞接种密度为3.0-4.0×10
优选的,上述用于改善卵巢早衰的组合物的制备方法中,所述的细胞膜片诱导液持续培养时间为6-8d。
优选的,上述用于改善卵巢早衰的组合物的制备方法中,所述间充质干细胞外泌体包括但不限于骨髓间充质干细胞、脂肪间充质干细胞、脐带间充质干细胞、胎盘间充质干细胞或者子宫内膜间充质干细胞。
优选的,上述用于改善卵巢早衰的组合物的制备方法中,所述上清液的具体制备方法如下:将间充质干细胞以1-2×10
优选的,上述用于改善卵巢早衰的组合物的制备方法中,将所述培养上清依次经过300-500×g低速离心、10000-12000×g高速离心及100000-120000×g超高速离心后,取最后一次沉淀,用生理盐水悬浮,即可得到间充质干细胞外泌体。
本发明还提供了一种由上述方法制备的用于改善卵巢早衰的组合物。
本发明还提供了一种上述的组合物的应用优选的,所述组合物用于制备治疗原发性或继发性的卵巢储备功能不良、抗缪勒管激素分泌不良、促卵泡生成素分泌过高、卵巢细胞凋亡或者多囊卵巢综合征的药物。
与现有技术相比,本发明具有以下有益效果:
(1)本发明提供的一种用于改善卵巢早衰的组合物,将体外构建的人子宫内膜干细胞细胞膜片与间充质干细胞外泌体复合使用。间充质干细胞外泌体可调节卵巢发育的TGF-β/Smad信号通路,其能参与Smad信号通路中Smad2、Smad3蛋白表达,从而调节TGF-β信号通路,调控下丘脑-垂体-卵巢轴神经内分泌系统;同时间充质干细胞外泌体中富含有大量miRNA,这些miRNA靶向基因主要富集于凋亡途径,抑制凋亡基因Fas、FasL、Capase3、Capase9的表达,从而促进卵巢内血管再生,抑制卵巢颗粒细胞凋亡。细胞膜片不仅为卵巢修复提供充足的细胞来源,还能分泌多种与卵泡发育相关的营养因子,例如生长因子、血管生成因子等,协同细胞外基质蛋白发挥作用,减轻卵巢内炎症反应,改善卵巢微环境;细胞膜片所分泌的生物活性因子能创造一个有利于外泌体发挥作用的微环境,两者相辅相成,相互促进,用于改善卵巢早衰。
(2)本发明提供的一种用于改善卵巢早衰的组合物,所获得的人子宫内膜干细胞细胞膜片完整的保留了细胞之间的自然产生的细胞外基质及相关蛋白,保证了细胞在体内的生物活性和功能发挥,同时可以避免组织工程治疗方法中因胰酶消化导致的细胞活性丢失,提高了细胞的存活率。
(3)本发明提供的一种用于改善卵巢早衰的组合物,所获得的人子宫内膜干细胞细胞膜片含有高密度的间充质干细胞,且细胞与细胞间依靠细胞外基质连接形成细胞聚合体,避免了单细胞在体内流失、分布不均的现象。
(4)本发明提供的一种用于改善卵巢早衰的组合物,其制备过程简单,无需特殊的试剂耗材,整个制备过程不超过8d,制备周期短,适合大规模生产。
(5)本发明提供的一种用于改善卵巢早衰的组合物,能促进卵泡发育,提高抗缪勒管激素水平,调节促卵泡生成素的生成、抑制卵巢细胞凋亡,改善卵巢储备功能不良性疾病,改善原发性或者继发性卵巢早衰的效果好,为临床用于治疗卵巢功能不全、多囊卵巢综合征提供新的思路。
附图说明
图1为本发明实施例1制备的人子宫内膜干细胞细胞膜片;
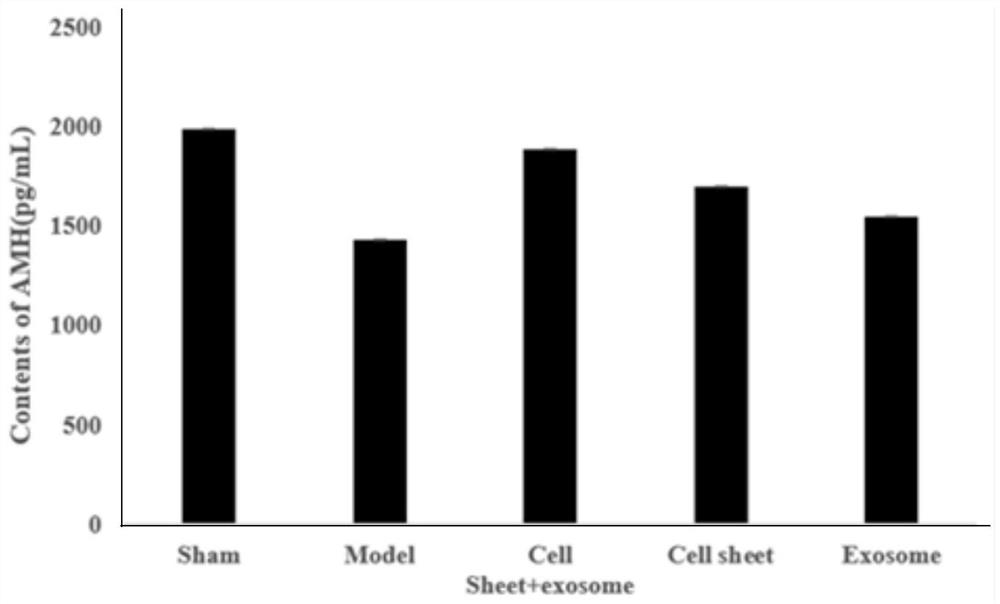
图2为本发明实施例1制备的组合物进行大鼠实验后血液中抗苗勒管激素(AMH)的含量;
图3为本发明为本发明实施例1制备的组合物进行大鼠实验后血液中促卵泡生成素(FSH)的含量。
具体实施方式
为了使本领域技术人员更好地理解本发明的技术方案能予以实施,下面结合具体实施例和附图对本发明作进一步说明。
在本发明的描述中,如未特殊说明,所用试剂均为市售,所用方法均为本领域常规技术。人子宫内膜干细胞、间充质干细胞均为本实验室制备所得。
人子宫内膜干细胞具体制备方法如下:
1.组织接收:经咨询同意后,与患者签订《患者知情书及同意书》,采集患者术后临床样本(子宫内膜组织),并放置在无菌生理盐水中,密封保存,1h内尽快送达实验室;
2.组织处理:在超净工作台内,将接收的临床子宫内膜组织取出,放入培养皿中,将组织铺展,测量组织长度与宽度。测量完毕后,用无菌剪刀及镊子剪切成1mm
3.组织消化:将组织块移至50mL离心管中,加入2倍体积的含300mg/mL的胶原酶III的PBS液,拧紧管口,在37℃培养箱中振荡消化40min;
4.原代细胞获得:消化后的细胞悬液用无菌200目筛网过滤一遍,收集滤液,1000rpm离心10min,弃上清,沉淀用10mL DMEM/F12培养液悬浮,细胞悬液即为子宫内膜干细胞悬液;
5.细胞培养:将细胞悬液转移至T75细胞培养瓶内,37℃、5%CO
间充质干细胞具体制备方法如下:(下述实施例所用间充质干细胞为脐带间充质干细胞)
1.组织接收:离体采集临床健康分娩的婴儿脐带,并放置在无菌生理盐水中(含5%(v/v)青链霉素),密封保存,1h内尽快送达实验室;
2.组织清洗:在超净工作台内,将接收的脐带组织取出,放入培养皿中,用生理盐水(含5%(v/v)青链霉素)冲洗两次,剪掉脐带两端结扎部位,生理盐水再次洗涤2-3遍;沿脐带生长方向,用无菌剪刀剪开脐带,生理盐水(含5%青链霉素)洗涤脐带内血块,直至组织发白。
3.组织贴壁培养:用无菌剪刀和镊子剔除脐带内血管(2条动脉,1条静脉),生理盐水(含5%青链霉素)清洗一遍,获得华通氏胶。华通氏胶剪碎至1mm
4.细胞获得:组织块约培养10-14d,显微镜下观察组织块周围有大量细胞爬出,此时转移组织块,PBS缓冲液清洗细胞表面,加入0.25%不含EDTA的胰蛋白酶消化2-3min,完全培养基终止后,吹打获得细胞悬液,800rpm离心5min,弃上清,所的沉淀即为P0代细胞。
需要说明的是,上述人子宫内膜干细胞、间充质干细胞制备所用初始材料均为离体材料,本发明是将离体的材料收集后使用,并非手术方法。本领域技术人员也可以选择其他合法合伦理的方式获得人子宫内膜或者脐带,或者选择人工培养的子宫内膜组织和脐带组织。
实施例1
本发明提供了一种用于改善卵巢早衰的组合物,包括人子宫内膜干细胞细胞膜片和间充质干细胞外泌体,所述组合物按照以下步骤制备:
S1,子宫内膜干细胞细胞膜片的制备
人子宫内膜干细胞培养:选用第5代数(从第0代开始培养)的人子宫内膜干细胞接种于六孔板中,加入子宫内膜干细胞培养基培养,培养12h后弃掉原有培养基,换细胞膜片诱导液持续培养,间隔1d换一次细胞膜片诱导液。培养结束后培养孔中出现半透明的细胞膜片,细胞膜片边缘卷起,可用镊子夹起,该细胞膜片具有一定的韧性,不易破损,证明此膜片成熟。本实施例制备的人子宫内膜干细胞细胞膜片参见图1。
所述的人子宫内膜干细胞接种密度为3.0×10
所述的子宫内膜干细胞培养基为:体积分数10%FBS+体积分数90%DMEM/F12培养基;所述的细胞膜片诱导液为50μg/mL的抗坏血酸+体积分数10%FBS+体积分数90%DMEM/F12培养基。
所述的细胞膜片诱导液持续培养时间为6d,此时细胞膜片已成熟,形成半透明膜装,边缘卷起。超过8d,细胞膜片卷曲成团状,难以实现后续操作。
S2,间充质干细胞外泌体的制备
1)间充质干细胞培养及上清液收集:将间充质干细胞以1×10
所述的间充质干细胞培养基为含体积分数10%胎牛血清的α-MEM;
所述的无血清培养基为不含任何血清的α-MEM培养液;
2)外泌体的提取及浓度测定:将步骤1)中得到的培养上清经过低速离心、高速离心及超高速离心系列步骤后,取沉淀,用3mL生理盐水悬浮即可得到外泌体,留少量液体做浓度检测。
所述的低速离心具体为:300×g,离心10min留上清,上清继续2000×g,离心10min去除死细胞,留上清进行高速离心步骤。
所述的高速离心具体为10000×g,离心30min,去除细胞碎片,留上清进行超速离心步骤。
所述的超高速具体为100000×g,离心80min。
所述的外泌体浓度大于0.45mg/mL时判定为合格外泌体,如果测定的浓度低于0.45mg/mL,则可将其浓缩,或者冻干后重新溶解,合格外泌体才可进行用于组合物的制备。
S3,子宫内膜干细胞细胞膜片与间充质干细胞外泌体的复合
将新鲜制备的人子宫内膜干细胞细胞膜片在孔板中剪碎后与外泌体混合,卵巢内注射使用。优选的,以六孔板中一个孔培养出来的一个膜片为例,将其剪碎后加1ml外泌体。
实施例2
本发明提供了一种用于改善卵巢早衰的组合物,包括人子宫内膜干细胞细胞膜片和间充质干细胞外泌体,所述组合物按照以下步骤制备:
S1,子宫内膜干细胞细胞膜片的制备
人子宫内膜干细胞培养:选用第10代数(从第0代开始培养)的人子宫内膜干细胞接种于六孔板中,加入子宫内膜干细胞培养基培养,培养15h后弃掉原有培养基,换细胞膜片诱导液持续培养,间隔2d换一次细胞膜片诱导液。培养结束后培养孔中出现半透明的细胞膜片,细胞膜片边缘卷起,可用镊子夹起,该细胞膜片具有一定的韧性,不易破损,证明此膜片成熟。
所述的人子宫内膜干细胞接种密度为4.0×10
所述的子宫内膜干细胞培养基为:体积分数10%FBS+体积分数90%DMEM/F12培养基;所述的细胞膜片诱导液为50μg/mL的抗坏血酸+体积分数10%FBS+体积分数90%DMEM/F12培养基。
所述的细胞膜片诱导液持续培养时间为8d,此时细胞膜片已成熟,形成半透明膜装,边缘卷起。超过8d,细胞膜片卷曲成团状,难以实现后续操作。
S2,间充质干细胞外泌体的制备
1)间充质干细胞培养及上清液收集:将间充质干细胞以2×10
所述的间充质干细胞培养基为含体积分数10%胎牛血清的α-MEM;
所述的无血清培养基为不含任何血清的α-MEM培养液;
2)外泌体的提取及浓度测定:将步骤1)中得到的培养上清经过低速离心、高速离心及超高速离心系列步骤后,取沉淀,用4mL生理盐水悬浮即可得到外泌体,留少量液体做浓度检测。
所述的低速离心具体为:300×g,离心10min留上清,上清继续2000×g,离心10min去除死细胞,留上清进行高速离心步骤。
所述的高速离心具体为10000×g,离心30min,去除细胞碎片,留上清进行超速离心步骤。
所述的超高速具体为100000×g,离心80min。
所述的外泌体浓度大于0.45mg/mL时判定为合格外泌体,合格外泌体才可进行用于组合物的制备。
S3,子宫内膜干细胞细胞膜片与间充质干细胞外泌体的复合
将新鲜制备的人子宫内膜干细胞细胞膜片在孔板中剪碎后与外泌体混合,卵巢内注射使用。
实施例3
本发明提供了一种用于改善卵巢早衰的组合物,包括人子宫内膜干细胞细胞膜片和间充质干细胞外泌体,所述组合物按照以下步骤制备:
S1,子宫内膜干细胞细胞膜片的制备
人子宫内膜干细胞培养:选用第3代数(从第0代开始培养)的人子宫内膜干细胞接种于六孔板中,加入子宫内膜干细胞培养基培养,培养12h后弃掉原有培养基,换细胞膜片诱导液持续培养,间隔1d换一次细胞膜片诱导液。培养结束后培养孔中出现半透明的细胞膜片,细胞膜片边缘卷起,可用镊子夹起,该细胞膜片具有一定的韧性,不易破损,证明此膜片成熟。
所述的人子宫内膜干细胞接种密度为3.4×10
所述的子宫内膜干细胞培养基为:体积分数10%FBS+体积分数90%DMEM/F12培养基;所述的细胞膜片诱导液为50μg/mL的抗坏血酸+体积分数10%FBS+体积分数90%DMEM/F12培养基。
所述的细胞膜片诱导液持续培养时间为7d,此时细胞膜片已成熟,形成半透明膜状,边缘卷起。超过8d,细胞膜片卷曲成团状,难以实现后续操作。
S2,间充质干细胞外泌体的制备
1)间充质干细胞培养及上清液收集:将间充质干细胞以1.3×10
所述的间充质干细胞培养基为含体积分数10%胎牛血清的α-MEM;
所述的无血清培养基为不含任何血清的α-MEM培养液;
2)外泌体的提取及浓度测定:将步骤1)中得到的培养上清经过低速离心、高速离心及超高速离心系列步骤后,取沉淀,用5mL生理盐水悬浮即可得到外泌体,留少量液体做浓度检测。
所述的低速离心具体为:300×g,离心10min留上清,上清继续2000×g,离心10min去除死细胞,留上清进行高速离心步骤。
所述的高速离心具体为10000×g,离心30min,去除细胞碎片,留上清进行超速离心步骤。
所述的超高速具体为100000×g,离心80min。
所述的外泌体浓度大于0.45mg/mL时判定为合格外泌体,合格外泌体才可进行用于组合物的制备。
S3,子宫内膜干细胞细胞膜片与间充质干细胞外泌体的复合
将新鲜制备的人子宫内膜干细胞细胞膜片在孔板中剪碎后与外泌体混合,卵巢内注射使用。
实施例4
本发明提供了一种用于改善卵巢早衰的组合物,其制备方法与实施例3相同,区别在于,将选用第0代数的人子宫内膜干细胞接种于六孔板中。
实验例1
将30只2-3月龄SD大鼠分为五组,分别为对照组(Sham组)、模型组(Model组)、细胞膜片组(Cell sheet组)、外泌体组(Exosome组)、组合物组(Cell sheet+Exosome组),每组6只大鼠。除Sham组外,其余各组大鼠按照20mg/kg.d的剂量每日腹腔注射环磷酰胺,持续注射20d进行卵巢早衰模型建立。20d后各组给予相应的治疗:模型组注射1ml生理盐水,细胞膜片组注射1ml含实施例1制备的细胞膜片的生理盐水,外泌体组注射1ml实施例1制备的合格的外泌体;组合物组注射1ml实施例1制备的外泌体与细胞膜片复合物,Sham组注射1ml生理盐水,所有注射均为卵巢内注射。注射后2w,各组大鼠行尾静脉采血,按照市售的大鼠抗缪勒管激素(AMH)ELISA检测试剂盒、大鼠促卵泡生成素(FSH)ELISA检测试剂盒说明书进行检测及数据分析。
图2是各组大鼠卵巢修复后血液中抗苗勒管激素(AMH)的含量。图3是各组大鼠卵巢修复后血液中促卵泡生成素(FSH)的含量。
结果显示,模型组大鼠血清中AMH含量低于对照组,FSH高于对照组,说明卵巢早衰造模成功。与模型组相比较,细胞膜片组、外泌体组和组合物治疗组大鼠血清中的AMH含量上升,FSH含量降低,其中组合物治疗组AMH含量最高,FSH含量最低,说明子宫内膜干细胞膜片与间充质干细胞外泌体复合使用治疗卵巢早衰效果更好,优于子宫内膜干细胞膜片和间充质干细胞外泌体单独治疗。经过我们的分析,发现本发明组合物中的子宫内膜干细胞细胞膜片中含有大量的子宫内膜干细胞,能补充卵巢中的“种子”细胞起到修复作用,其还能分化为卵巢细胞,并表达FSH受体(FSHR),抑制因FSHR基因突变导致的FSH水平升高。
另外,将上述采血后的各组大鼠脱颈处死,摘取卵巢,浸泡于4%w/v多聚甲醛中过夜,之后进行常规石蜡包埋,切片,HE染色,进行卵泡计数。其中,每个卵巢共取10张切片统计各级卵泡数目。在镜下计数HE染色片中各级卵泡数目。各级卵泡分类标准如下:(1)原始卵泡:卵母细胞周围围绕单层扁平状颗粒细胞;(2)初级卵泡:单层颗粒细胞,但3个以上颗粒细胞为柱状;(3)次级卵泡:包含两层以上颗粒细胞,尚未形成卵泡腔;(4)窦卵泡:包含两层以上颗粒细胞,可见卵泡腔。卵泡计数结果参见表1。
表1各组大鼠的卵泡计数结果
注:a:与Sham组相比较,P<0.05;b:与Model组相比较,P<0.05;c:与Cell Sheet组相比,P<0.05;d:与Exosomes组比较,P<0.05。
表1结果显示,与Sham组相比较,Model组各级卵泡数量都有所下降,说明造模成功;与Model组相比较,Cell Sheet组与Exosome组各级卵泡数量增加,说明卵巢功能有所恢复;与Model组相比较,组合物组各级卵泡数量增加,卵巢部分功能恢复;与Cell Sheet组与Exosome组相比,组合物组中能原始卵泡转化为初级卵泡、次级卵泡的数量明显提升,能发育成成熟卵子的窦卵泡显著增加,说明本发明实施例1中所制备的组合物对于改善卵巢早衰的功效优于Cell sheet组与Exosome组单独使用。
需要说明的是,在本发明中,所述实施例1-4制备的组合物的效果误差不超过5%,为了防止赘述,本实验例仅记载了实施例1制备的组合物的效果,但是不应忽略其他实施例2-4效果的可信度。
需要说明的是,本发明中涉及数值范围时,应理解为每个数值范围的两个端点以及两个端点之间任何一个数值均可选用,由于采用的步骤方法与实施例相同,为了防止赘述,本发明描述了优选的实施例。尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例做出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 用于改善卵巢早衰的组合物及其制备方法和应用
- 一种用于改善卵巢储备功能减退和预防卵巢早衰的组合物及其应用
