一种肺炎支原体减毒突变株及应用
文献发布时间:2023-06-19 12:18:04
技术领域
本发明涉及一种肺炎支原体减毒突变株及其作为活疫苗的应用。
背景技术
肺炎支原体(Mycoplasima pneumonia)属于柔膜体纲,支原体目,支原体科,支原体属的一种缺乏细胞壁、加压可通过0.45μm除菌滤器的原核细胞型微生物。1962年,Chanock和Hayflick用人工培养基从原发性非典型肺炎患者痰液中分离培养出该病原体,并命名为“肺炎支原体”。肺炎支原体是社区获得性肺炎的常见病原体,主要导致儿童或青少年上下呼吸道感染(如咽炎、支气管炎、间质性肺炎等),部分病例可发展为可危及生命的严重肺损伤(肺脓肿、坏死性肺炎、急性呼吸窘迫综合症等),可伴有肺血管栓塞、胸腔积液、多脏器功能障碍、严重的长期后遗症(如闭塞性细支气管炎、肺不张、支气管扩张等)以及肺外并发症(如皮疹、胸膜炎、脑膜脑炎、心肌炎、肾炎等)。此外,肺炎支原体感染还与支气管哮喘和动脉粥样硬化的发病密切相关。
临床上治疗儿童或青少年肺炎支原体感染的首先药物为大环内酯类抗生素,但在我国约有69%~95%肺炎支原体临床分离株对大环内酯类抗生素耐药,且因此类耐药株引起的难治性支原体肺炎(RMPP)的死亡病例也正逐年增多,不仅使临床治疗用药受到限制,而且提高了重症肺炎及肺外并发症的发病率。疫苗接种是控制传染病的最有力武器,但国内外有关肺炎支原体潜在疫苗应用后存在产生的免疫保护效率低、免疫力持续时间短、存在严重不良反应等缺陷,故目前尚无疫苗成功上市。
发明内容
发明目的:
本发明的目的是提供一种肺炎支原体减毒突变株,该菌株可通过诱导机体产生细胞免疫或体液免疫,从而提供优良的免疫刺激能力和免疫保护效力。
技术方案:
本发明的目的采用如下技术方案实现。
肺炎支原体减毒突变株,分类命名为肺炎支原体Mut129(Mycolplasmapneumonia),保藏于中国武汉,武汉大学,中国典型培养物保藏中心,保藏编号为CCTCC PB2021038,保藏时间2021.6.22。
该菌株的具体来源为:南华大学病原生物学研究所保藏的肺炎支原体M129株(ATCC 29342)接种到PPLO液体培养基中培养并传代至少80次(约5-7天,以培养基颜色由红变黄后进行传代)后的毒力减弱的突变株,经基因组重测序和单核苷酸突变分析,并将其命名为肺炎支原体M129(肺炎支原体CCTCC PB2021038)。
本发明提供所述肺炎支原体减毒突变株在构建肺炎支原体活疫苗中的应用,优选的技术方案为:采用所述肺炎支原体减毒突变株纯培养物并联合环二鸟苷酸作为佐剂,以滴鼻方式进行免疫。纯培养物的细菌密度约为3.5×108CFU/ml,接种溶液总体积约为30μL,接种活菌总量为107CFU/mL,环二鸟苷酸一次用量约为5ng。
有益效果
本发明中的减毒株具有三个优势特征。第一,经减毒株免疫后,肺组织中无法检出抗原且未出现炎性细胞浸润,未出现明显不良反应。第二,经减毒株免疫后,可诱导机体产生稳定而持久的特异性IgG型抗体(以IgG1和IgG2a亚类为主,总效价可高达1:6400)以及IgA型抗体。第三,经减毒株免疫后,再次用野生型肺炎支原体攻毒,能完全阻止该菌在肺组织中的增殖,且肺组织未出现明显病理变化。由此可见,采用所述肺炎支原体减毒突变株制备的活疫苗生物安全性好、可提供良好的免疫刺激能力和攻毒保护效力,这三个优势特征均有利于该疫苗的广泛应用。
附图说明:
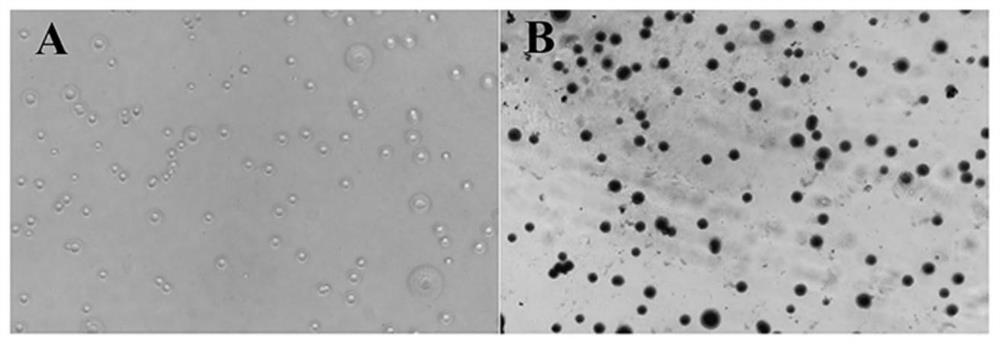
图1:肺炎支原体Mut129株在固体琼脂平板培养基上的菌落形态。(A):显微镜直接观察(10×10);(B):Dienes染色后显微镜观察(10×10)。
图2:p1基因PCR扩增片段电泳凝胶成像图。1-2:Mut129株;3:marker;4-6:M129标准株。
图3:肺炎支原体Mut129株和M129株分别滴鼻攻毒小鼠后,肺组织匀浆中活菌数量(A)及Mp抗原(B)测定。
图4:肺炎支原体Mut129株滴鼻攻毒小鼠后,肺组织切片HE染色后观察病理变化,A为100×视野,B为400×视野。
图5:间接ELISA法测定免疫后第14d、28d、42d小鼠血清中IgG抗体水平,以酶催化底物后溶液的颜色深度(450nm处的吸光度值,A
图6:肺炎支原体Mut129株免疫小鼠后,攻毒感染M129株,小鼠血清中抗体的表达水平,其中A为IgA,B为IgG,C为IgG1,D为IgG2a。
图7:肺炎支原体Mut129株免疫小鼠后,攻毒感染M129株,小鼠肺组织匀浆中肺炎支原体活菌计数,A为PPLO固体平板计数法检测,B为qPCR检测结果。
图8:肺炎支原体Mut129株免疫小鼠后,攻毒感染M129株,小鼠肺组织病理学变化情况,其中A为100×视野,B为400×视野。
具体实施方式
以下通过实施例进一步阐述本发明内容,本发明保护范围不以实施例为限。本发明在本技术领域具有多种公知的替代或变形,在不脱离本发明实质意义的前提下,均在本发明的保护范围之内。
PPLO液体\固体培养基的配制:称取PPLO干粉21g,酵母粉4g,酚红0.04g于700mL双蒸水中充分溶解,用3mol/L氢氧化钠溶液将培养基pH值调节至7.9±0.02,用双蒸水定容至780mL。121℃高压蒸汽灭菌15min,冷却至60℃后,加入160万单位青霉素溶液、10mL 50%的无菌葡萄糖溶液及胎牛血清200mL,混匀后4℃冰箱保存备用。PPLO固体培养基:在上述高压蒸汽灭菌步骤前加入1.5%(w/v)的琼脂充分混匀,其它步骤如PPLO液体培养基制备方法相同。
实施例1:肺炎支原体减毒突变株的获得及基因突变检测
南华大学衡阳医学院病原生物学研究所保藏的肺炎支原体Mp 129标准株(ATCC29342)接种于PPLO液体培养基,置于37℃(5%CO
分类命名:肺炎支原体Mut129株;
拉丁文名称:Mycoplasima pneumonia;
保藏单位:中国典型培养物保藏中心;
地址:中国.武汉.武汉大学;
保藏日期:2021年6月15日;
保藏编号:CCTCC NO:PB 2021038。
表1肺炎支原体Mut129株与野生型菌株(M129株)相比,编码粘附相关蛋白的基因突变情况(部分)
表2编码粘附相关蛋白的基因突变情况(部分)
实施例2:肺炎支原体Mut129株的毒力评价
实验动物:4-6周龄SPF级BALB/c小鼠24只,随机分为正常组、Mut129攻毒组和M129攻毒组各8只,实验前饲养1周以适应环境。
供试材料:肺炎支原体Mut129株接种到PPLO液体培养基中,37℃(5%CO
毒力测试:异氟烷麻醉小鼠,当小鼠由胸式呼吸转为腹式呼吸后,分别用移液器吸取30μL 3.5×10
实验结果:肺炎支原体Mut129株和M129株滴鼻测试小鼠后,PPLO固体平板计数结果为:Mut129攻毒组活菌数量未检出,M129攻毒组活菌数量为(2.67±0.65)×10
实施例3:肺炎支原体Mut129株免疫原性评价
实验动物:4-6周龄SPF级BALB/c小鼠24只,随机分为正常组、佐剂对照组、免疫组和联合免疫组各6只,实验前饲养1周以适应环境。
供试材料:同实施例2。
免疫方法:采用异氟烷麻醉小鼠,观察到小鼠由胸式呼吸转为腹式呼吸后,用Mut129菌株进行免疫。方法如下:正常组用30μL PBS滴鼻、佐剂对照组用30μL 5ng c-di-GMP(溶剂PBS)滴鼻、免疫组用30μL 3.5×10
免疫原性测试:取3.5×10
实验结果:佐剂对照组抗肺炎支原体特异性IgG抗体并无明显增加,第28天与第42天联合免疫组抗体水平分别为2.16±0.07、2.85±0.27,第42天特异性IgG抗体效价可达到1:6400。联合免疫组抗体水平明显高于免疫组(如图5所示)。
实施例4:肺炎支原体Mut129株免疫保护性评价
实验动物:4-6周龄SPF级BALB/c小鼠24只,随机分为正常对照组、Mut129株免疫组和未免疫M129攻毒组各8只,实验前饲养1周以适应环境。
供试材料:同实施例2。
免疫与攻毒方法:用联合免疫组滴鼻等量混合液(5ng c-di-GMP+3.5×10
免疫保护性测试:攻毒7天后,眼球静脉采血分离血清标本,测定抗体表达水平。颈部脱臼处死小鼠,无菌环境取小鼠的肺组织制备匀浆,用PPLO固体平板计数法测定肺组织活菌数量。提取肺组织匀浆的总DNA,并用RT-qPCR法检测肺炎支原体活菌数量。上游引物:CCAACCAAACAACAACGTTCA;下游引物:ACCTTGACTGGAGGCCGTTA,目的片段大小为76bp,根据qPCR反应标准曲线计算肺炎支原体活菌数量。同时,制作肺组织切片并进行HE染色(方法同实施例2),观察肺组织病理变化。
实验结果:攻毒后小鼠血清抗体水平结果显示:免疫组IgA(0.69±0.10)、IgG(2.96±0.20)、IgG1(0.36±0.01)及IgG2a(0.32±0.013)抗体水平均高于感染组IgA(0.07±0.01)、IgG(0.34±0.07)、IgG1(0.18±0.01)及IgG2a(0.018±0.01)抗体(P<0.05)(如图6所示)。PPLO固体平板计数法结果显示在免疫组小鼠肺组织中未检出肺炎支原体活菌,未免疫攻毒组活菌数量为0.87×10
- 一种肺炎支原体减毒突变株及应用
- 一种肠炎沙门菌基因敲除减毒突变株及其制备与应用
