一种用于抗炎和促组织再生的巨噬细胞来源外泌体制剂及其制备方法和应用
文献发布时间:2023-06-19 13:46:35
技术领域
本发明涉及生物医药技术领域,特别涉及一种用于抗炎和促组织再生的巨噬细胞来源外泌体制剂及其制备方法和应用。
背景技术
维持皮肤完整性对于机体至关重要,而组织损伤和修复是人体中极其复杂的过程,涉及各种分子机制及遗传表观学机制。到目前为止,已有研究证实了伤口愈合是通过四个精确且高度程序化的阶段实现的:止血、炎症、增殖和重塑。若这些阶段受到干扰,未能及时、适当地发生则会导致伤口延迟愈合或病理性伤口愈合。其中,炎症在生物学上被定义为"身体的免疫系统对某种刺激的反应",主要是由各种病原体感染、或组织损伤引起的,被认为是机体的保护性反应,在组织修复中起着重要作用。因此,针对炎症的研究在改善和治疗慢性病领域具有良好的前景。
止血在组织损伤后会立即开始,伴随着血管收缩和纤维蛋白凝块的形成。一旦出血得以控制,即进入炎症阶段。该阶段在急性伤口中一般持续2-5天,而受种种因素影响,炎症期亦可持续数周或甚至数月,此时伤口转变为慢性伤口。早期伤口处的炎症可以起到保护伤口的作用,是对伤口愈合有利的,但一旦炎症迁延成慢性炎症,会使伤口转为慢性伤口,不利于伤口愈合,因此,调节控制促炎-抗炎平衡对伤口愈合很重要。
巨噬细胞是先天免疫细胞,在生理和病理过程中都扮演着极其重要的角色。在伤口修复的早期,巨噬细胞导致炎性细胞因子的产生以及病原体和碎片的清除。在伤口愈合炎症阶段的后期,巨噬细胞有助于炎症的消退并促进组织修复。巨噬细胞主要分为经典激活的促炎M1型巨噬细胞和交替激活的抗炎M2型巨噬细胞。M1巨噬细胞可分泌促炎因子如IL-1β、IL-6等促进炎症发展,而M2巨噬细胞则主要分泌IL-10、Arg-1等抑制炎症发展。因此,巨噬细胞表型的可塑性是皮肤伤口修复过程中重要的调控靶点,进而发明人认为,提供一种通过调节促炎-抗炎平衡从而治疗多种炎症相关疾病的制剂是非常有必要的。
发明内容
本发明为了解决上述技术问题,提供了一种用于抗炎和促组织再生的巨噬细胞来源外泌体制剂及其制备方法和应用。
第一方面,本申请提供了一种巨噬细胞来源外泌体制剂,是通过以下技术方案得以实现的。
一种巨噬细胞来源外泌体制剂,包括M2型巨噬细胞来源外泌体。
进一步的,制剂中M2型巨噬细胞来源外泌体的有效浓度大于等于50μg/mL。
进一步的,制剂总体积为200μL,外泌体含量大于等于10μg。
进一步的,M2型巨噬细胞来源外泌体的直径为30-150nm。优选的,M2型巨噬细胞来源外泌体的直径为50-90nm。
进一步的,所述M2型巨噬细胞来源于人或动物,所述动物选自鼠、兔、猪、羊或猴。
进一步的,所述制剂还包括药学上可接受的载体。
进一步的,所述药学上可接受的载体选自磷酸盐缓冲液和/或生理盐水,或具备缓释功能的水凝胶。所述具备缓释功能的水凝胶选自海藻酸盐水凝胶、壳聚糖、透明质酸、PEG中的一种或多种。
进一步的,所述制剂为注射剂、胶囊剂、片剂、粉末剂、软膏剂或喷雾剂。
进一步的,所述M2型巨噬细胞来源外泌体应用基因工程方法进行改造,优选为,负载具有特殊功能的mRNA、LcRNA的M2型巨噬细胞来源外泌体,得到具有特定功能的外泌体制剂。
第二方面,本申请提供了一种巨噬细胞来源外泌体制剂的制备方法,是通过以下技术方案得以实现的。
一种上述巨噬细胞来源外泌体制剂的制备方法,包括以下步骤:
S1.将M0巨噬细胞以1×10
S2.将M2巨噬细胞在无血清条件下孵育2-3d,收集上清,通过差速离心方法收集外泌体:4℃300-400g离心8-10min以移除细胞;2000-2500g离心8-10min以移除死细胞;130000-150000g离心90-100min以获取外泌体球;130000-150000g离心90-100min得到外泌体沉淀;用PBS溶液重悬外泌体沉淀,滤膜过滤后得到M2型巨噬细胞来源外泌体。
第三方面,本申请提供了巨噬细胞来源外泌体制剂的临床应用,是通过以下技术方案得以实现的。
一种上述巨噬细胞来源外泌体制剂在制备治疗炎症性疾病药物、保健品或营养补充剂中的应用。所述炎症性疾病包括类风湿性关节炎、肾炎、SLE或硬皮病。
一种上述巨噬细胞来源外泌体制剂在制备修复组织损伤药物、保健品或营养补充剂中的应用。所述组织损伤包括心梗后损伤,皮肤缺损、骨缺损、软骨损伤、肌肉损伤、肌腱损伤或神经缺损。
一种上述巨噬细胞来源外泌体制剂在制备治疗退变性疾病药物、保健品或营养补充剂中的应用。所述退变性疾病包括骨关节炎、脊柱退行性疾病。
本申请具有以下有益效果。
本发明采用M2型巨噬细胞外泌体引导的细胞重编程技术可实现从M1型巨噬细胞到M2型巨噬细胞的转变,从而使伤口部位通过促进血管生成、再上皮化和胶原沉积加速愈合。本发明M2巨噬细胞外泌体制剂制备简单、材料来源广泛、储存方便,相对于细胞疗法,外泌体副作用小且不易引起免疫反应,应用后能调节炎症平衡、促进伤口愈合、减缓退变性疾病进展,可以多种形式应用,具有很好的临床应用价值。
附图说明
图1是本发明RAW264.7细胞STR位点的基因分型结果图;
图2是本发明M2巨噬细胞的表型验证结果图(其中,A.Western Blot检测结果图;B.qRT-PCR检测结果图,**p<0.01);
图3是本发明M2-Exo的表征结果图(其中,A.M2-Exo的TEM图;B.M2-Exo粒径的检测结果图;C.流式细胞分析术检测结果图;D.Western blot检测结果图);
图4是本发明M1巨噬细胞的表型验证结果图(其中,A.Western Blot检测结果图;B.qRT-PCR检测结果图,**p<0.01);
图5是本发明细胞摄取实验结果图;
图6是本发明M2-Exo重编程有效浓度的检测结果图(其中,A.不同浓度外泌体与M1巨噬细胞共培养后Western Blot检测结果图;B.不同浓度外泌体与M1巨噬细胞共培养后qRT-PCR检测结果图,**p<0.01;C.不同浓度外泌体与M1巨噬细胞共培养后免疫荧光染色图);
图7是本发明M2-Exo重编程效应验证结果图(**p<0.01);
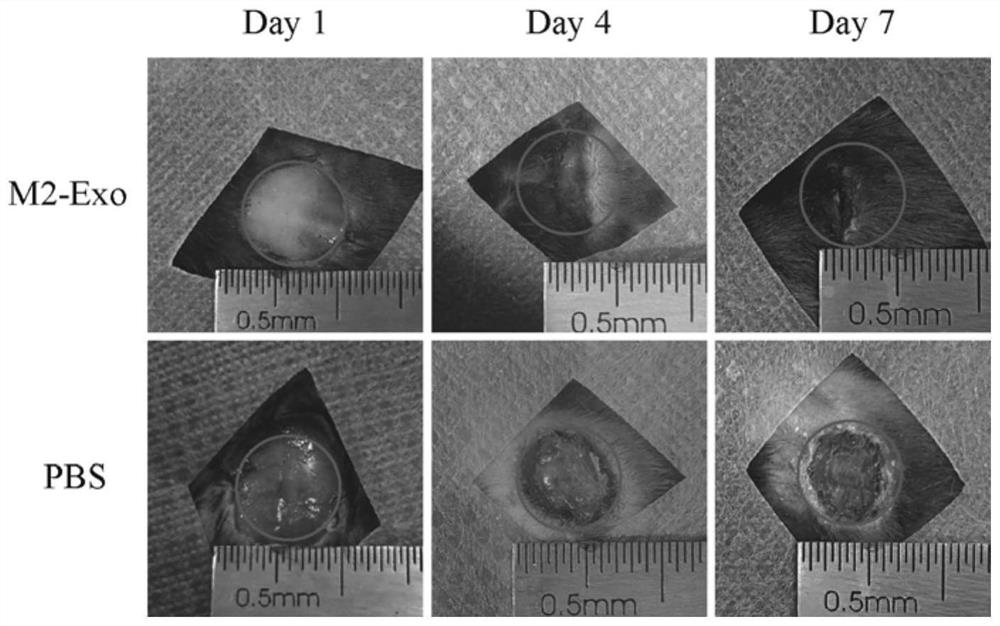
图8是本发明M2-Exo处理促小鼠皮肤伤口愈合效果图;
图9是本发明皮下注射M2-Exo 7天后伤口的H&E染色图。
具体实施方式
以下结合附图和实施例对本发明进行进一步的说明。需要说明的是,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
一、M2-Exo的制备
1、从武汉普诺赛生物公司购买小鼠单核巨噬细胞白血病细胞(RAW 264.7),并进行相关鉴定(鉴定结果参见图1),以确定为M0巨噬细胞。将细胞以1×10
2、M2巨噬细胞的激活:将M0巨噬细胞以1×10
3、M2巨噬细胞的鉴定
3.1、qRT-PCR验证M2巨噬细胞相关基因的表达水平(Arginase)
使用RNA提取试剂盒提取总RNA,Nanodrop检测所提RNA浓度及纯度。按照试剂盒说明加入反转录酶,进行反转录及合成cDNA,-20℃保存。按照2×qPCR
表1 qRT-PCR引物序列信息
3.2、Western blot技术鉴定M2巨噬细胞特异性标志物(Arginase、CD206)
使用含有PMSF和磷酸酶抑制剂的RIPA裂解液,收集样品后置于冰上裂解1h,12000rpm 4℃离心20min,收集上清,并用BCA试剂盒进行蛋白定量。在上清中加入适量5xSDS蛋白上样缓冲液,95℃金属浴煮沸蛋白10min。配制PAGE凝胶,在浓缩胶中上样蛋白30μg,80V电压30min,120V电压60min进行蛋白电泳,待溴酚蓝跑出分离胶底部即可停止电泳。将PAGE凝胶转移到PVDF膜中,转膜220mA,90min。5%脱脂奶粉室温封闭1h后,按蛋白marker裁剪PVDF膜条带,在Arg-1、CD206一抗中4℃孵育过夜。TBST洗膜10min三次,辣根过氧化物酶标记的二抗室温孵育1h,TBST再次洗膜10min三次。加入ECL发光液,于化学发光显影系统中观察。
qRT-PCR和Western blot检测结果参见图2,从图2中可以看出,本申请制备得到的M2巨噬细胞能够表达M2表型相关基因Arg-1,且能够表达Arg-1、CD206特征性蛋白。
4、M2-Exo的分离:M2巨噬细胞在无血清条件下孵育2天。孵育2天后,收集上清,通过差速离心方法收集外泌体:4℃300g离心10min,移除细胞;2000g离心10min以移除死细胞;150000g离心90min以获取外泌体球。150000g离心90min得到外泌体沉淀。用1ml PBS溶液重悬外泌体沉淀,使用0.22μm滤膜过滤,用于后续实验。
5、M2-Exo的鉴定
直径:应用动态光散射技术(DLS,Zetasizer Nano,Malvern Instruments,UK)或Nanosight技术。
结构:应用2%多聚甲醛固定外泌体过夜,150000g离心30min后在无水乙醇中重悬。随后取2μL的悬液置于聚醋酸甲基乙烯脂-碳涂层的电镜格,电镜格预先已应用醋酸铀处理1min,最后进行透射电镜(Tecnai F20 G2)观察。
特异性标记物:采用流式细胞分析术验证外泌体特异性标记物的阳性表达率(CD9、CD63、CD81)。
标志物:Western blot技术鉴定外泌体表面标志物(CD9、Alix):步骤如3.2所述。
实验结果参见图3,TEM显示M2-Exo为双层囊泡结构;NTA结果显示M2-Exo主要粒径为120nm左右;流式细胞分析验证了M2-Exo特异性标记物的阳性表达;Western blot验证了M2-Exo能够表达CD9、Alix外泌体特异性蛋白。
二、M2-Exo重编程M1巨噬细胞向M2巨噬细胞转变以实现促炎作用向抗炎作用的转变
1、M0巨噬细胞的提取与鉴定、M2巨噬细胞外泌体制备同上述方法。
2、M1巨噬细胞的激活:将M0巨噬细胞以1×10
3、M1巨噬细胞的鉴定:
3.1、qRT-PCR验证M1巨噬细胞相关基因的表达水平(iNOS):方法同M2巨噬细胞的鉴定,qRT-PCR引物序列信息参见表2。
表2 qRT-PCR引物序列信息
3.2、Western blot技术鉴定M1巨噬细胞特异性标志物(iNOS、CD86):方法同M2巨噬细胞的鉴定。
qRT-PCR和Western blot检测结果参见图4,从图4中可以看出,本申请制备得到的M1巨噬细胞能够表达M1表型相关基因iNOS,且能够表达iNOS、CD86特征性蛋白。
4、M1巨噬细胞摄取实验:用膜标记染料PKH67标记M2-Exo,120000g,90min超速离心去除未标记上的荧光染料,用PBS缓冲液重悬超速离心沉淀获得已标记外泌体。将外泌体悬液用0.22μm滤器过滤细菌后,加入铺有1×10
实验结果参见图5,将M2-Exo与M1巨噬细胞共培养,M2-Exo可被M1巨噬细胞摄取。
5、M2-Exo重编程M1巨噬细胞:
(1)当M1巨噬细胞融合率为70%-80%时,将不同浓度外泌体(10,25,50μg/mL)与M1巨噬细胞在无血清培养基中共同孵育24h,通过qRT-PCR验证M2巨噬细胞相关基因的表达水平(Arg-1),Western blot技术鉴定M2巨噬细胞特异性标志物(Arg-1),以及免疫荧光染色检测M1、M2巨噬细胞相关标记物(iNOS、CD206)的表达水平,以确定起效所需最低浓度。
实验结果参见图6,Western Blot显示50ug/mL M2-Exo可有效转换M1/M2型巨噬细胞表面标记物表达;qRT-PCR结果证明了50ug/mL M2-Exo处理M1巨噬细胞后M2型相关基因表达水平显著升高,M1型相关基因表达水平显著降低;免疫荧光染色进一步证实,随着M2-Exo处理浓度的增高,M1型标记物iNOS表达降低,M2型标记物CD206表达升高。综上所述,M2-Exo对M1巨噬细胞重编程作用的最低有效浓度为50μg/mL。
(2)以最低有效浓度50μg/mL M2-Exo处理M1细胞获得重编程后的巨噬细胞(RM2),并利用qRT-PCR进行检测RM2炎症基因的表达水平,以进一步确定M2-Exo重编程M1巨噬细胞的作用,qRT-PCR引物序列信息参见表3。
表3 qRT-PCR引物序列信息
实验结果参见图7,应用50μg/mL M2-Exo处理M1巨噬细胞后获得重编程后的巨噬细胞(RM2),可见RM2相关炎症基因表达水平显著降低。
三、M2-Exo促进伤口愈合
1、材料:5周龄雄性C57/b小鼠。
2、分组:根据处理不同分为PBS组,M2-Exo组。
3、手术处理:首先麻醉,然后电动剃须刀剃除背部毛发,70%酒精消毒后待干燥,使用8mm无菌活检针穿孔,推动活检针至背部皮肤中部,并左右扭转以穿透背部皮肤。术后分别在不同组伤口边缘皮下注射200ul PBS、M2-Exo(100ug溶于200ul PBS)处理。
4、术后4d、7d拍照确定伤口闭合情况。
实验结果如图8、图9所示,从图8中可以看出,与PBS组相比,M2-Exo处理组可显著促进皮肤组织愈合;从图9可以看出,皮下注射PBS、M2-Exo 7天后,PBS组可见大量的炎性细胞浸润,新生血管较少,而M2-Exo无炎性细胞浸润,新生血管较多。
本具体实施方式的实施例均为本发明的较佳实施例,并非依此限制本发明的保护范围,故:凡依本发明的结构、形状、原理所做的等效变化,均应涵盖于本发明的保护范围之内。
