用于检测对虾致急性肝胰腺坏死病弧菌及虾肝肠胞虫的引物与探针序列及其应用
文献发布时间:2023-06-19 18:37:28
技术领域
本发明涉及对虾致病菌检测领域,尤其是涉及一种用于检测对虾高致病性副溶血弧菌及虾肝肠胞虫的引物与探针序列及其应用。
背景技术
急性肝胰腺坏死病(acute hepatopancreas necrosis disease,AHPND)是一种新出现的、危害极大的对虾疫病。该病爆发速度快、传播范围广,患病对虾死亡率可达90%以上,排塘率高达80%。目前,认为该病病原为一类含有特殊质粒的弧菌,称之为致急性肝胰腺坏死病,绝大多数报道是高致病性副溶血弧菌(
针对上述对虾病原的检测,传统方法主要依赖于以显微技术为支撑的分离培养与形态观察。当前,以聚合酶链式反应(PCR)及其延伸出的多重PCR技术、实时荧光定量PCR技术等,常被世界动物卫生组织(WOAH)推荐作为传统检测方法的有效补充。上述PCR等方法在对虾生物性疾病的临床检测中发挥了重要作用,但随着疫病复杂化等原因,这些方法体现出了明显的局限性,比如,这些方法需配备PCR仪、荧光定量PCR仪、凝胶成像系统等昂贵精密仪器,易接触到溴化乙锭(EB)等有毒物质,对检测人员的专业性要求较高。以重组酶聚合酶扩增(recombinase polymerase amplification, RPA)为代表的等温扩增技术,克服了热循环等造成的仪器的复杂程度,在微生物的即时快速检测中展示出一定的应用前景。尽管针对单一病原的快速检测技术得到了快速发展,病原的检测与鉴定越发变得快速和准确,但多病原的混合感染也已成为一种常态,多种病原针对同一宿主也可引起相似的症状或体征变化。在面对频繁出现的多病原混合感染时,单一病原检测方法重复性操作较多,检测过程冗余繁琐,费时费力,限制着检测的时效和工效,极易导致错过最佳预防或治疗时机。目前,国内外还没有公开用于检测对虾致急性肝胰腺坏死病弧菌及虾肝肠胞虫的引物与探针序列及其应用的相关研究报道。
发明内容
本发明所要解决的技术问题是提供一种检测速度快,检测灵敏度和准确性高的用于检测对虾致急性肝胰腺坏死病弧菌及虾肝肠胞虫的引物与探针序列及其应用。
本发明解决上述技术问题所采用的技术方案为:用于检测对虾致急性肝胰腺坏死病弧菌及虾肝肠胞虫的引物与探针序列,根据致急性肝胰腺坏死病弧菌的毒力基因PirA与PirB、虾肝肠胞虫的核糖体RNA序列(SSU rRNA)分别设计一对引物序列和一条探针序列,其中用于检测致急性肝胰腺坏死病弧菌毒力基因PirA的引物序列是:
上游引物VP
下游引物VP
用于检测致急性肝胰腺坏死病弧菌毒力基因PirA的探针序列是:
VP
用于检测致急性肝胰腺坏死病弧菌毒力基因PirB的引物序列是:
上游引物VP
下游引物VP
用于检测致急性肝胰腺坏死病弧菌毒力基因PirB的探针序列是:
VP
/BHQ1-dT/GGTCTGGATTATAAG/C3spacer/;
用于检测虾肝肠胞虫的引物序列是:
上游引物EHP-RPA-F: AGCCATTGAGTTTGTTGAGAGTAGCGGAAC;
下游引物EHP-RPA-R: CTTAGTTTTCGGGCTCTGGGGATAGTACGC;
用于检测虾肝肠胞虫的探针序列是:
EHP-RPA-P:TAGAACTACAGCGGTGTCTAATCACTTTCGA/FAM-dT//THF/C/BQH-dT/CTAGCCTTCGTCCTTG/C3spacer/,其中,探针序列经过荧光基团(FAM)、淬灭基团(BHQ1)、核酸外切酶exo识别位点四氢呋喃(THF)以及3’端阻断物C3spacer修饰。
上述用于检测对虾致急性肝胰腺坏死病弧菌及虾肝肠胞虫的引物与探针序列的应用,具体检测步骤如下:
(1)微流控芯片的点制:首先将根据致急性肝胰腺坏死病弧菌的毒力基因PirA与PirB、虾肝肠胞虫的核糖体RNA序列(SSU rRNA)设计的三对引物依次点至芯片各反应池,并脱水处理,每个反应池内的引物包含检测靶标DNA序列对应的上游引物和下游引物终浓度各2 pmol;
(2)配置反应体系:反应体系各成分分别为:12 μL RPA反应缓冲液 (rehydrationbuffer),1 μL 280 mM醋酸镁溶液(magnesium acetate),1 μL的10 µM探针溶液,加双蒸水补足反应体系,1个单元所需的总体系为20 µL;
(3)微流控芯片上的RPA反应:将步骤(2)的反应体系与1 µL样品模板混合后,通过进样孔,一次性加入进芯片,将芯片放置在等温扩增微流控芯片核酸分析仪上,进行RPA反应,反应结果以荧光曲线的形式实时呈现,反应结束后由该仪器自行完成结果判定,其中阳性结果以“+”表示,阴性结果以“-”表示。
步骤(3)所述的RPA反应进行核酸扩增的温度为39 ℃,反应时间为20 min。依据上述序列,建成的等温扩增微流控芯片检测体系,优化的反应温度为39℃,反应时间20 min,达到的效果是以10copies/μL浓度下的致急性肝胰腺坏死病弧菌与虾肝肠胞虫的特异性靶标序列质粒标准品或同等病原浓度级别下基因组DNA为模板,可完成对致急性肝胰腺坏死病弧菌与虾肝肠胞虫的检测与鉴定。
与现有技术相比,本发明的优点在于:
1. 检测指标数多:本方法一次性可以检测并鉴定出致急性肝胰腺坏死病弧菌、虾肝肠胞虫两种对虾重要病原微生物;同时能够鉴别出致急性肝胰腺坏死病弧菌中毒力基因PirA与PirB的携带情况,有助于判断菌株致病力;
2.检测时间短:通过微流控芯片上进行的RPA反应,实现实时荧光即时检测,或反应结束后终点判读,实现对虾致急性肝胰腺坏死病弧菌及虾肝肠胞虫的快速检测。DNA样本加入芯片后,整个扩增反应时间为20 min,大幅度提高了检测效率;
3. 灵敏度高:以致急性肝胰腺坏死病弧菌与虾肝肠胞虫的特异性靶标序列质粒标准品为模板,本方法可以检测到10copies/μL;以虾肝肠胞虫的基因组DNA为模板,本方法可以检测到0.1个虫体/μL的基因组DNA;
4. 特异性强:应用于致急性肝胰腺坏死病弧菌与虾肝肠胞虫检测/鉴定的引物序列均是根据各自物种的目标基因的不同保守区域设计,具有更强的特异性;同时,引入包含有荧光基团(FAM)、淬灭基团(BHQ1)、核酸外切酶exo识别位点四氢呋喃(THF)以及3’端阻断物C3spacer的1条特殊探针,提升了检测特异性;
5. 结果判断简单:可通过出现的荧光曲线实时判读结果,也可以借助仪器配套的人工智能判读软件判读;
6. 对人身和环境更加安全,检测过程中不涉及EB等有毒试剂。
综上所述,使用本发明的用于检测对虾致急性肝胰腺坏死病弧菌及虾肝肠胞虫的引物与探针序列,具有检测物种数和样本数多、操作简单快捷,高灵敏度和特异性等优势,有利于对虾致急性肝胰腺坏死病弧菌与虾肝肠胞虫的即时检测和快速鉴定,可满足现场疫源地检测的需要。
附图说明
图1为等温扩增微流控芯片及相关检测设备,其中A:微流控芯片简图;B:微流控芯片分解图;C:微流控芯片详细视图及布局;D:微流控检测平台检测流程;
图2为用于VP
图3为VP
图4为虾肝肠胞虫等温扩增微流控芯片检测的引物和探针的特异性实验结果:NC:阴性对照;以虾肝肠胞虫的gDNA(10
图5为用于致急性肝胰腺坏死病弧菌与虾肝肠胞虫等温扩增微流控芯片检测的引物和探针的灵敏度结果;将致急性肝胰腺坏死病弧菌的PirA/B重组质粒、虾肝肠胞虫的SSUrRNA重组质粒的DNA标准品稀释得到浓度分别为10
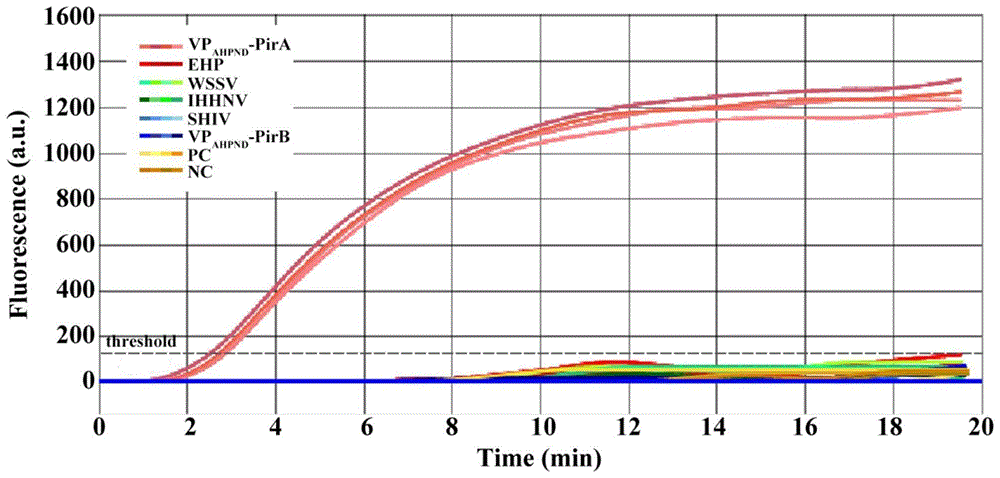
图6为致急性肝胰腺坏死病弧菌与虾肝肠胞虫等温扩增微流控芯片检测方法的多指标同步检测的结果;测试时除了使用高致病性副溶血弧菌弧菌与虾肝肠胞虫的检测靶标重组质粒DNA之外,还选择了对虾传染性皮下及造血组织坏死病毒(IHHNV)、白斑综合症病毒(WSSV),以及虾血细胞虹彩病毒(SHIV)三种对虾重要病原的检测靶标重组质粒DNA作为等温扩增微流控芯片检测的模板。TM1:选择VP
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
具体实施例一
等温扩增微流控芯片检测致急性肝胰腺坏死病弧菌与虾肝肠胞虫的方法的建立
1. 引物设计:根据致急性肝胰腺坏死病弧菌的两个毒力基因PirA与PirB的序列、虾肝肠胞虫的核糖体RNA序列(SSU rRNA)分别设计一对引物序列和一条探针序列,建立等温扩增微流控芯片检测体系,完成致急性肝胰腺坏死病弧菌与虾肝肠胞虫的检测,其中,用于检测致急性肝胰腺坏死病弧菌毒力基因PirA的引物序列是:
上游引物VP
下游引物VP
用于检测致急性肝胰腺坏死病弧菌毒力基因PirA的探针序列是:
VP
用于检测致急性肝胰腺坏死病弧菌毒力基因PirB的引物序列是:
上游引物VP
下游引物VP
用于检测致急性肝胰腺坏死病弧菌毒力基因PirB的探针序列是:
VP
/BHQ1-dT/GGTCTGGATTATAAG/C3spacer/;
用于检测虾肝肠胞虫的引物序列是:
上游引物EHP-RPA-F: AGCCATTGAGTTTGTTGAGAGTAGCGGAAC;
下游引物EHP-RPA-R: CTTAGTTTTCGGGCTCTGGGGATAGTACGC;
用于检测虾肝肠胞虫的探针序列是:
EHP-RPA-P: TAGAACTACAGCGGTGTCTAATCACTTTCGA/FAM-dT//THF/C/BQH-dT/
CTAGCCTTCGTCCTTG/C3spacer/。其中,探针序列经过荧光基团(FAM)、淬灭基团(BHQ1)、核酸外切酶exo识别位点四氢呋喃(THF)以及3’端阻断物C3spacer等修饰。
2. DNA的制备
利用血球计数板在显微镜下计数高致病性副溶血弧菌、虾肝肠胞虫的数量,取适量使用DNA提取试剂盒(Omega, Norcross, GA, USA)提取高致病性副溶血弧菌、虾肝肠胞虫等实验所用细菌的基因组DNA,将提取的DNA溶解于50 μL 双蒸水中,并使用Nanodrop2000分光光度计(Thermo Scientific, Waltham, MA, USA)进行浓度测定。所得基因组DNA用作等温扩增微流控芯片扩增的模板,-30℃贮存备用。
以高致病性副溶血弧菌、虾肝肠胞虫的基因组DNA为模板,分别进行PCR扩增特异性靶标基因的部分片段,将扩增子克隆到pMD19-T Simple载体中(TaKaRa,中国大连)并进行测序(Sangon Biotech,中国上海)。重组质粒DNA使用质粒提取试剂盒I(Omega Bio-tek,Norcross, GA, USA)进行提取,并使用Nanodrop 2000分光光度计进行浓度测定。所得重组质粒标准品用作等温扩增微流控芯片扩增的模板,-30℃贮存备用。
3. 微流控芯片的设计与点制
使用的微流控芯片(由宁波爱基因科技有限公司提供)为蝶式芯片,直径为81 mm,厚度为2.5 mm。芯片的材质为聚甲基丙烯酸甲酯 (PMMA)。芯片由两层组成,即芯片基板和热封膜,二者结合以形成集成和密封的腔室和通道。芯片分为八个相同的独立单元,每个单元配有一个进样孔、一个出风口、四个球阀和四个反应池(图 1)。反应池体积为5 μL。在芯片点制过程中,首先将选好的三对引物依次点至芯片各反应池,并脱水处理。每个反应池内的引物包含检测靶标DNA序列对应的上游引物和下游引物各2 pmol,以不含DNA的无菌水作为阴性对照。对芯片进行封膜,保证芯片的密闭性。
4. 配置反应体系:12 μL rehydration buffer(由潍坊安普未来生物科技有限公司提供),1 μL magnesium acetate (280 mM) (由潍坊安普未来生物科技有限公司提供),1 μL探针,加双蒸水补足反应体系,1个单元所需的总体系为20 µL。
5. 微流控芯片上的RPA反应:将上述反应体系与1 µL样品模板混合后,通过进样孔,一次性加入进芯片,将芯片放置在恒温扩增微流控芯片核酸分析仪(宁波爱基因科技有限公司)上,进行RPA反应。该仪器采用末端检测法进行荧光信号采集,反应结果以荧光曲线的形式实时呈现,反应结束后由该仪器自行完成结果判定,其中阳性结果以“+”表示,阴性结果以“-”表示。利用RPA反应进行核酸扩增的温度为39 ℃,反应时间为20 min。
具体实施例二
使用本发明的引物和探针进行对虾致急性肝胰腺坏死病弧菌、虾肝肠胞虫等温扩增微流控芯片检测的特异性测定
采用上述具体实施例一的步骤2病原基因组DNA和重组质粒DNA的提取方法,提取对虾高致病性副溶血弧菌、虾肝肠胞虫、对虾传染性皮下及造血组织坏死病毒(IHHNV)、白斑综合症病毒(WSSV),以及虾血细胞虹彩病毒(SHIV)的基因组DNA。利用设计的引物,分别以上述5种病原的基因组DNA为模板。其中,高致病性副溶血弧菌、虾肝肠胞虫的基因组DNA为10
具体实施例三
使用本发明的引物进行对虾致急性肝胰腺坏死病弧菌、虾肝肠胞虫等温扩增微流控芯片检测的灵敏度测定
采用上述具体实施例一的步骤2重组质粒DNA标准品的制备方法,制备对虾高致病性副溶血弧菌、虾肝肠胞虫靶标序列的重组质粒DNA标准品,并进行10倍梯度稀释,稀释获得的浓度分别为10
采用上述具体实施例一的步骤2基因组DNA的制备方法,制备虾肝肠胞虫的基因组DNA标准品,并进行10倍梯度稀释,稀释获得的系列浓度,根据虫体的显微镜计数进行换算,分别为10
具体实施例四
用本发明等温扩增微流控芯片技术进行多指标同步检测的测定。
采用上述具体实施例一的步骤2重组质粒DNA标准品的制备方法,制备对虾高致病性副溶血弧菌、虾肝肠胞虫靶标序列、IHHNV、WSSV,以及SHIV的重组质粒DNA标准品,并进行10倍梯度稀释。选择10倍灵敏度浓度,即10
上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
