基于核酸适配体置换结合检测多种生物胺的色谱分析法
文献发布时间:2023-06-19 19:27:02
技术领域
本发明属于食品药品检测技术领域,涉及实现高通量同时检测多种生物胺的方法,具体为基于核酸适配体置换结合检测多种生物胺的色谱分析法。
背景技术
生物胺是一类有生物活性的、含氮的、低分子量有机物质的统称。低水平的生物胺是生物蛋白质中至关重要的部分,在调控核酸与蛋白质的化学组成及生物膜稳定性等方面起着重要作用。然而一些高水平的生物胺则被归类为有害化合物,可能会在敏感的人体中引起疾病或不良症状。生物胺的高摄取量(食物中超过100mg/kg)可能对人类健康构成威胁。生物胺主要的外部摄入来源是一些常见的食品或药品,如抗生素和肉制品等。因此,精确检测食品药品中生物胺(尤其是组胺、酪胺、精胺和色胺)含量是否超标具有重要意义。
传统的检测生物胺的策略主要包括色谱法、光谱法、电泳法、比色法、化学发光法、和电化学方法等。其中常用的色谱方法有薄层色谱法、离子交换色谱法、气相色谱法、液相色谱法(HPLC)等,结合不同的检测器进行检测。然而,传统的色谱法检测多种生物胺需要复杂的衍生化步骤以及繁琐的样品前处理,并且现有的色谱方法有时无法在一次运行中检测多种不同种类的生物胺,需要选择不同的色谱方法对同一个样品进行多次检测。同时,常规的色谱检测方法无法有效解决抗生素中混合物基质干扰的难题,在目标生物胺含量低的时候,目标峰常常淹没于杂质谱中,无法有效识别。此外,较窄的线性范围和较高的检测限(LOD)也是限制传统色谱法准确识别多种生物胺的主要因素。
核酸适配体(Aptamer)作为一种新型的检测探针,被广泛应用于各种检测分析技术之中。核酸适配体是一段寡核苷酸序列,能与特定的目标物质高特异性、高选择性地结合。目前,针对生物胺的适配体也已被广泛筛选并应用于检测方法之中。核酸适配体对生物胺的选择性结合和分离,能够有效排除基质效应的影响,从而提高检测的选择性和灵敏度。
信号扩增方法能进一步增强检测的灵敏度,已成为检测痕量目标物的一种有效手段。
发明内容
解决的技术问题:为了克服现有技术的不足,本发明借助DSN剪切过程,循环放大了来自生物胺的信号,并结合剪切的长短核酸探针实现了多种生物胺在HPLC上的信号分离,有效进行了目标信号源的置换工作,实现了在一次运行中对多种生物胺进行快速识别和检测。并将其应用于抗生素和肉类中多种生物胺的识别和检测。
技术方案:基于核酸适配体置换结合检测多种生物胺的色谱分析法,包括步骤:
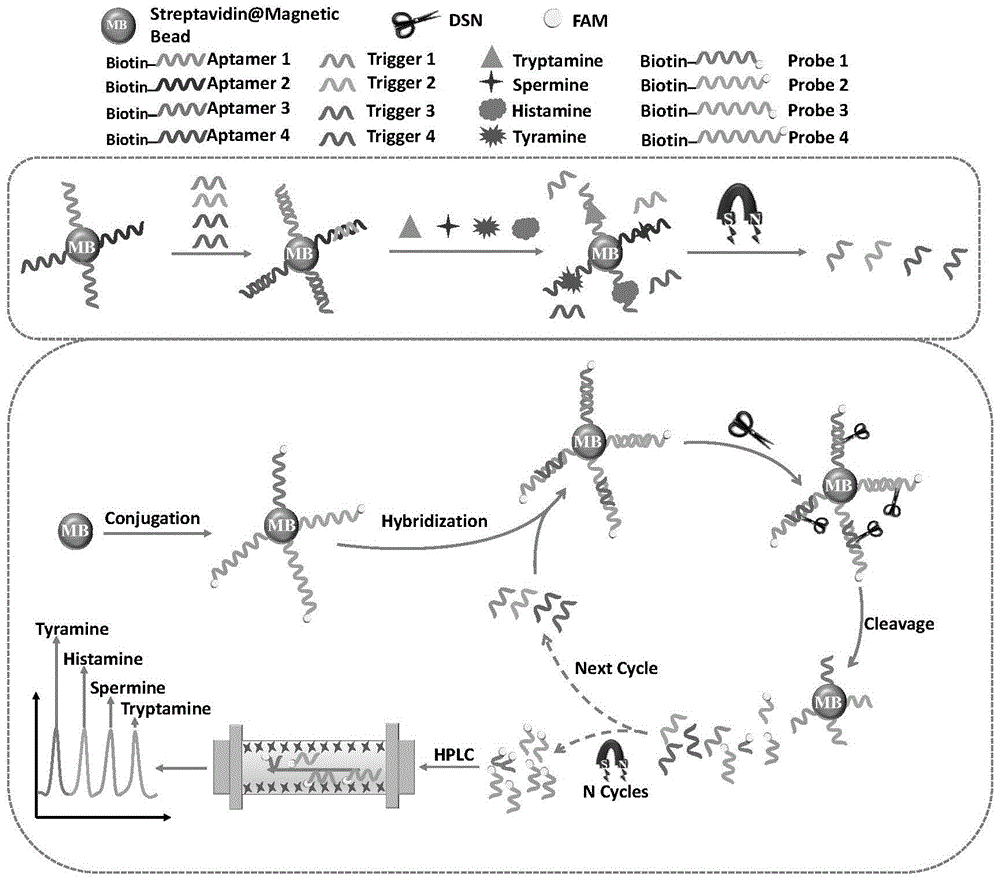
S1、将被生物素标记的适配体Aptamer 1、Aptamer 2、Aptamer 3和Aptamer 4偶联至链霉亲和素涂层的磁珠表面,得到4种适配体-磁珠偶联物,适配体序列为SEQ ID NO:1-4,如表1所示;将被生物素标记的探针Probe 1、Probe 2、Probe 3和Probe 4偶联至链霉亲和素涂层的磁珠表面,得到4种探针-磁珠偶联物,探针序列为SEQ ID NO:9-12,如表1所示;
S2、将4种适配体-磁珠偶联物加入离心管中,然后依次加入Trigger 1、Trigger2、Trigger 3、Trigger 4,序列为SEQ ID NO:5-8(如表1所示)和反应缓冲液,37℃反应1小时后依次加入酪胺、组胺、精胺和色胺,37℃继续反应2小时;反应结束后置于磁力架上,取上清液加入到含有4种探针-磁珠偶联物的棕色离心管中,然后加入DSN和反应缓冲液,反应混合物混合均匀后40℃孵育,加入2×DSN终止反应,反应液置于磁力架上,取上清液注入HPLC中进行检测;
S3、采用5%的乙腈和100mM的醋酸三乙胺溶液作为流动相A,甲醇作为流动相B,柱温设置为35℃,流速为1.0mL/min,在梯度洗脱模式下,20min内甲醇的比例由10%增加到20%,荧光检测器的激发波长和发射波长分别设置为488nm和520nm,对目标物进行荧光检测。
表1核酸序列
优选的,适配体-磁珠偶联物的具体制备方法为:取磁珠加入到离心管中,离心后放置在磁力架上,弃去溶剂并将磁珠保留在离心管中,然后使用1×B&W缓冲液低档震荡清洗后置于磁力架上,弃去溶剂保留磁珠;将磁珠重悬于2×B&W缓冲液中,同时加入4种适配体,在室温下涡旋得到适配体-磁珠偶联物。
优选的,探针-磁珠偶联物的具体制备方法为:取磁珠加入到离心管中,离心后放置在磁力架上,弃去溶剂并将磁珠保留在离心管中,然后使用1×B&W缓冲液低档震荡清洗后置于磁力架上,弃去溶剂保留磁珠;将磁珠重悬于2×B&W缓冲液中,同时加入4种探针,在室温下涡旋得到探针-磁珠偶联物。
优选的,判断S2中4种探针与磁珠偶联物的最佳偶联时间和偶联效率是通过检测上清液的荧光值确定,上清液的荧光值越低,说明探针在磁珠上的偶联效率越高。
优选的,所述反应缓冲液是由50Mm Tris-Hcl,30mM Mgcl
优选的,所述DSN能够特异性地裂解异源双链中的DNA,Trigger链为RNA,探针链为DNA,经过DSN剪切后,释放的Trigger链重新参与下一轮的循环,实现信号的累积放大,释放的携带有荧光标记的长短核酸探针,进入HPLC进行检测。
优选的,HPLC采用全多孔杂化硅胶柱Phenomenex
优选的,所述方法对酪胺、组胺、精胺和色胺的检测限降低至0.25pM、0.21pM、0.27pM和0.19pM,线性范围为1pM-1μM。
以上任一所述方法在食品、药品检测中的应用。
优选的,所述方法能够同时检测硫酸大庆霉素、鱼肉和猪肉样品中的生物胺含量。
有益效果:(1)所述方法可忽略的背景信号与累积信号放大将四种目标生物胺检测限分别降低至0.25pM、0.21pM、0.27pM和0.19pM,线性范围为1pM-1μM。(2)所建立的方法应用在食品药品检测中,同时测定实际样品如硫酸大庆霉素、鱼肉和猪肉样品中的生物胺含量以证明其实用性。(3)本发明具有高通量、高灵敏度、高选择性,高检测效率等优点。
附图说明
图1不同碱基序列的长短探针在HPLC中的保留。
图2正交试验优化后四种DNA探针的色谱图。
图3可行性分析。峰面积:(a)空白,(b)0.9U DSN,(c)1μM的酪胺、组胺、精胺、色胺,(d)1μM的酪胺+0.9U DSN,(e)1μM的组胺+0.9U DSN,(f)1μM的精胺+0.9U DSN,(g)1μM的色胺+0.9U DSN,(h)1μM酪胺、组胺、精胺、色胺+0.9U DSN。实验条件:1μM的适配体和启动子,以及100μM的探针,30mM的Mg
图4(A)不同浓度下的目标物的色谱图;(B)HPLC中四个信号峰的分离度。
图5是核酸适配体置换信号结合循环扩增对多种生物胺检测的色谱法的示意图。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改和替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1
基于核酸适配体置换结合检测多种生物胺的色谱分析法,包括步骤:
首先,将被生物素标记的适配体(Aptamer 1、Aptamer 2、Aptamer 3和Aptamer 4)偶联至链霉亲和素涂层的磁珠表面,得到适配体-磁珠偶联物在4℃下保存备用。随后,采用与适配体偶联至磁珠相同的步骤,将被生物素标记的探针(Probe 1、Probe 2、Probe 3和Probe 4),偶联至链霉亲和素涂层的磁珠表面在4℃下保存备用。
将60μL的Aptamer 1、Aptamer 2、Aptamer 3、Aptamer 4与磁珠的偶联物加入到离心管中,然后依次加入15μL 1μM的Trigger 1、Trigger 2、Trigger 3、Trigger 4和80μL反应缓冲液,在37℃下反应1小时。然后依次将15μL 1μM的酪胺、组胺、精胺和色胺,在37℃下反应2小时。反应结束后,将其置于磁力架上90秒,取上清液加入到含有60μL的Probe 1、Probe 2、Probe 3、Probe 4与磁珠的偶联物的棕色离心管中。然后加入0.9U DSN和60μL反应缓冲液。将反应混合物涡旋振荡10秒以充分混合。在40℃下孵育210分钟后,用5μL2×DSN终止液停止DSN对DNA链的裂解。将其置于磁力架上90秒,取上清液注入HPLC中进行检测。
采用5%的乙腈和100mM的醋酸三乙胺(TEAA,pH=7.0)溶液作为流动相(A),甲醇作为流动相(B)。柱温设置为35℃,流速为1.0mL/min。在梯度洗脱模式下,20min内甲醇的比例由10%增加到20%。荧光检测器的激发波长和发射波长分别设置为488nm和520nm,对目标物进行荧光检测。
所述将生物胺适配体修饰在磁珠上的方法具体是,先取30μL磁珠加入到2mL的离心管中,离心90秒后,放置在磁力架上90秒。随后弃去溶剂并将磁珠保留在离心管中。然后使用1×B&W缓冲液低档震荡清洗3次后,同样放置在磁力架上90秒,弃去溶剂保留磁珠。将磁珠重新悬浮于2×B&W缓冲液中,同时加入四种不同的适配体,在室温下轻轻涡旋一段时间。涡旋结束后,将得到的适配体-磁珠偶联物在4℃下保存备用。
所述修饰在磁珠上的生物胺适配体最佳偶联时间和偶联效率,是通过将3’端被荧光素标记的适配体加入到经过上述同样洗涤磁珠的步骤后的离心管中,在室温下轻轻涡旋不同的时间,并将其置于磁力架上90秒,取上清液测荧光值,上清液的荧光值越低,说明被偶联上的探针越多。在30分钟后,上清液的荧光值没有明显的下降,说明30分钟是最佳的偶联时间。随后将四种被荧光标记的适配体分别加入四个离心管中,然后加入其余三个未被荧光标记的适配体,涡旋30分钟后,去上清液测荧光值。利用上清液和对照组荧光强度的比值就可以估算DNA探针在磁珠上的偶联效率(IE)和百分含量(IP)。
所述缓冲液是由50Mm Tris-Hcl,30mM Mgcl
所述DSN可以特异性地裂解异源双链中的DNA,在该方法中的所有Trigger链为RNA,所有探针链为DNA,经过DSN剪切后,释放的Trigger链重新参与下一轮的循环,实现信号的累积放大。释放的携带有荧光标记的长短核酸探针,进入HPLC进行检测。
如图1所示,当核酸链中的碱基个数相同时,C、A和T的保留顺序为C
通过正交试验优化后,选择在0-20min内甲醇的比例从10%增加到20%,柱温为35℃,流速为1.0mL/min作为本实验的HPLC分析方法。如图2所示,在优化后的色谱条件下,将C
为了验证这种方法的可行性,在相同的反应条件下,对不同样品进行有/无生物胺或DSN的检测,结果如图3所示。只有当目标生物胺和DSN同时存在时,才会有相对应的信号出现。当四种生物胺和DSN都存在时,可以观察到这四种目标物对应的色谱峰的峰面积显著增加(图3h)。以上结果表明,该方法可以在一次进样中实现对酪胺、组胺、精胺和色胺的高灵敏检测。
为了评价该方法对生物胺的检测性能,在最佳的反应条件下,我们对不同浓度的生物胺所产生的信号响应进行了研究(图4A)。酪胺、组胺、精胺和色胺对应的DNA裂解探针的保留时间分别为5.69min、9.26min、13.40min和16.10min。如图4B所示,为了评估这四种峰的分离度,计算了生物胺在1μM时所对应的色谱峰的分离度。其中R1为3.06,R2为3.62,R3为2.19。分离度均大于1.5,说明四个峰已完全分离。在1pM的浓度下,四种目标物所对应的色谱峰仍然可以被明显地分离。
实施例2
本实施例对硫酸庆大霉素、猪肉、鱼肉中四种生物胺(酪胺、组胺、精胺、色胺)的检测:
将从超市买来的新鲜草鱼和猪肉进行了检测,结果如表2所示。在鱼肉中检测到了12.321nM的酪胺和14.676nM的组胺;在猪肉中检测到了16.982nM的组胺、17.756nM的精胺和13.172nM的色胺。由于肉类样品在贮藏过程中,体内生物胺的含量会急剧上升,三天后即可达到较高水平。因此,这里选择放置三天的鱼肉进行检测。为了评估基质效应,向预处理得到的鱼肉和猪肉的溶液中分别加入了1nM和10nM的酪胺、组胺、精胺和色胺的标准溶液,得到的相对回收率在101.2%-104.5%之间。本方法的相对标准偏差(RSD)在1.5%-4.3%之间。采用同样的方法检测硫酸庆大霉素中的生物胺,从表3的结果中可以看出在硫酸庆大霉素中可以检测到精胺的存在。表4列出了一些常见的检测生物胺的方法,并比较了它们之间的检测性能。从表3可以看出,我们的方法具有更低的LOD和更宽的线性范围,充分表明了该方法优越的检测性能。
表2检测新鲜猪肉和鱼肉中的生物胺
a
表3检测硫酸大庆霉素中的生物胺
a
表4多种生物胺检测策略的比较
/>
